7. equilibrios de fases en sustancias puras
Anuncio

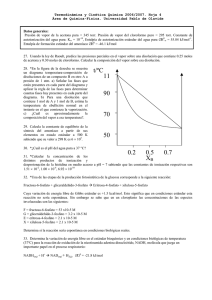
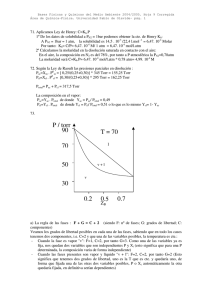
7. EQUILIBRIOS DE FASES EN SUSTANCIAS PURAS 1.- A partir de las entalpías de formación estándar y de las entropías molares estándar del sólido y del líquido, a 25 ºC, estimar la temperatura de ebullición normal del: (a) Br2; (b) C6H6; (c) CH3OH. 2.- A partir de las entalpías de formación estándar y de las entropías molares estándar del agua líquida y del vapor, calcular la presión de vapor del agua a 25 y a 40 ºC. 23.7 y 56.0 torr 3.- La presión de vapor del agua a 22.0 ºC es de 19.83 torr y a 30.0 ºC es de 31.82 torr. Calcular: (a) La entalpía de vaporización del agua; (b) La presión de vapor del agua a 0 ºC (el valor experimental es 4.58 torr). (c) La presión de vapor del agua a 50 ºC? (el valor experimental es 92.5 torr). (a) 44.0 kJ/mol 4.- La presión de vapor de la acetona es 421.5 torr a 40 ºC y 612.6 torr a 50 ºC. Calcular su entalpía de vaporización y su temperatura de ebullición normal. 31.5 kJ/mol y 56 ºC 5.- La temperatura de ebullición normal del benceno es 80.1 ºC y su entalpía de vaporización es 30.8 kJ/mol. Calcular la presión de vapor del benceno a 20 ºC. 88.6 torr 6.- Una sustancia X tiene el siguiente diagrama de fases: (a) ¿X es un sólido, un líquido o un gas a temperatura ambiente? (b) ¿Cuál es, aproximadamente, el punto de fusión normal de X? ¿Y el de ebullición? (c) ¿Cuá es la presión de vapor del líquido a 0 ºC? (d) ¿Cuál es la presión de vapor del sólido a -100 ºC? 7.- Se tienen los siguientes datos del NH3: Punto triple: Tt = 195 K, Pt = 44 torr. Teº = 240 K; ∆Hvap = 23 kJ/mol. Tc = 405 K; Pc = 111 atm. (a) Hacer un esquema del diagrama de fases del amoniaco, señalando las zonas, líneas y puntos característicos del diagrama. (b) ¿A qué presión debe comprimirse el NH3(g) a 27 ºC para que empiece a licuar? ¿Y a 200 ºC? 14 atm 8.- El punto triple del dióxido de carbono es P3 = 5.1 atm y T3 = - 57 ºC, y sus constantes críticas Pc = 73 atm y Tc = 31 ºC. Un cilindro, provisto de un pistón, contiene dióxido de carbono a 45 ºC y 1 atm. Indicar cómo debe procederse experimentalmente para: (a) Licuar el CO2. (b) Obtener “hielo seco” (CO2 sólido) a 1 atm. (c) Fundir el hielo seco obtenido en (b).