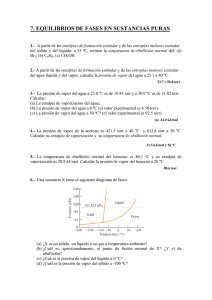
PT = PA + PB + PC …….
Anuncio

Tomado del Módulo: Estequiometría de Reacciones y Estado Gaseoso del Prof. Anel Adames 6. Ley de Dalton: La ley de Dalton establece que en una mezcla de gases cada gas ejerce su presión como si los restantes gases no estuvieran presentes. La presión específica de un determinado gas en una mezcla se llama presión parcial, p. La presión total de la mezcla se calcula simplemente sumando las presiones parciales de todos los gases que la componen. PT = PA + PB + PC ……. Por ejemplo, la presión atmosférica es 760 mm Hg debido a la suma de las presiones parciales de todos los gases presentes en ella: Presión atmosférica (760 mm de Hg) = pO2 (160 mm Hg) + pN2 (593 mm Hg) + pCO2 (0.3 mm Hg) + pH2O (alrededor de 8 mm de Hg) Figura 7. Recolección de un gas empleando una cubeta y un vaso de precipitados En la figura anterior se ilustra el procedimiento empleado para recoger los gases producidos en una reacción. En este procedimiento se aplica la ley de Dalton para determinar la presión del gas seco (restando la presión del vapor de agua a la presión total). Ejemplo: Una muestra de KClO3 se descompone parcialmente, produciendo O2 el cual se recolecta de agua. El volumen recolectado es de 0,25 L a 25 °C y la presión total es de 765 torr. ¿Cuantas moles de O2 se recolectaron? Pt = 765 torr = PO2 + PH2O = PO2 + 23,76 torr PO2 = 765 – 23,76 = 741,2 torr PO2 = 741,2 torr (1 atm/760 torr) = 0,975 atm PV = nRT (0,975 atm)(0,25 L) = n(0,0821 L atm/mol K)(273 + 25) K n = 9,96 x 10-3 mol O2 Tomado del Módulo: Estequiometría de Reacciones y Estado Gaseoso del Prof. Anel Adames ¿Cuantos gramos de KClO3 se utilizaron? 9,96 x 10-3 mol O2 (2KClO3 / 3 O2) = 6,64 x 10-3 mol KClO3 6,64 x 10-3 mol KClO3 (122,6 g/mol) = 0,814 g KClO3 Si el O2 estuviese seco, que volumen ocuparía a la misma T y P? PO2 = (Pt)(XO2) = 765 torr (1.0) = 765 torr (1 atm/760 torr) = 1,007 atm (1,007 atm)(V) = (9,96 x 10-3 mol)(0,0821 L atm/mol K)(273 + 25) K V = 0,242 L O también si conocemos n, y la temperatura, T, se mantiene constante podemos usar la ley de Boyle: P1V1 = P2V2 V2 = (P1V1)/ P2 V2 = (741,2 torr * 0,25 L)/(765 torr) V2 = 0,242 L Tabla 1. Presiones de Vapor del Agua a distintas Temperaturas: T (°C) mm Hg T (°C) mm Hg T (°C) mm Hg 0 4,6 21 18,7 30 31,8 5 6,5 22 19,8 35 42,2 10 9,2 23 21,1 40 55,3 15 12,8 24 22,4 50 92,5 16 13,6 25 23,8 60 149,4 17 14,5 26 25,2 70 233,7 18 15,5 27 26,7 80 355,1 19 16,5 28 28,3 90 525,8 20 17,5 29 30,0 100 760,0 7. Ley De Graham o de Difusión de Los Gases: La Ley de Graham, formulada en 1829 por Thomas Graham, establece que las velocidades de difusión de los gases son inversamente proporcionales a las raíces cuadradas de sus respectivas densidades. Siendo v las velocidades y δ las densidades. Tomado del Módulo: Estequiometría de Reacciones y Estado Gaseoso del Prof. Anel Adames Las densidades se pueden relacionar con las masas y el volumen (d =masa /Volumen), si tomamos las masas molares y los volúmenes molares de determinados gases y recordamos que los volúmenes de los gases en iguales condiciones de temperatura y de presión son iguales nos queda: V 1= (M1) –1/2 y V 2 =(M2) – 1/2, donde se expresa la velocidad de un gas en función del inverso de la raíz cuadrada de su masa molar. Si relacionamos ambas velocidades nos queda: V 1= (M2) V 2 = (M1) 1/2 1/2 Otra forma de relacionar la difusión de dos gases es midiendo los tiempos que tardan en escapar a través de un orificio: t 1= (M1) 1/2 t 2 = (M2) 1/2 En la ecuación anterior se pude ver que el tiempo que tarde un gas en escaparse es directamente proporcional a su masa molar, es decir el gas de menor masa molar sale en un tiempo menor y el gas de mayor masa molar tarda más en salir. El fenómeno de difusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia, se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se difunden de una región de mayor concentración a una región de menor concentración. De los 4 estados de la materia, los gases presentan la mayor facilidad de difusión de sus respectivas moléculas, como ocurre en el aire, ya que sus moléculas tienen velocidades superiores. Las moléculas de diferentes clases tienen velocidades diferentes, a temperatura constante, dependiendo únicamente de la densidad. Problemas para Práctica sobre ley de Dalton y ley de Graham: 1) Cierta mezcla gaseosa contiene helio (He), neón (Ne) y argón (Ar), todos a la misma presión parcial. La presión total de la mezcla es 746 mm Hg. ¿Cuál es la presión de cada gas? R: 249 mm Hg Tomado del Módulo: Estequiometría de Reacciones y Estado Gaseoso del Prof. Anel Adames 2) Cierta mezcla gaseosa contiene 0,60 moles de nitrógeno (N 2) y 0,25 moles de neón (Ne), la presión total de la mezcla es 790 mm Hg. ¿Cuál es la presión parcial de cada gas? 3) ¿Cuál será la presión parcial del N2, colectado sobre agua a 20 °C y presión de 720 torr? 4) Una mezcla contiene H2 a 600 torr de presión, N2 a 200 torr de presión y O2 a 300 torr de presión. ¿Cuál es la presión total de los gases en la mezcla? 5) Se tiene 0,695 g de nitrógeno a 742 mm Hg encerrados en un recipiente de 1,20 L; también se tienen 1,10 g de argón a 383 mm Hg encerrados en un recipiente de 2,63 L. Los gases están a la misma temperatura. Ambos gases se pasan a un recipiente vacío de 3,05 L. La temperatura permanece constante. ¿Qué presión se tendrá en este último recipiente? Suponga comportamiento ideal. R: 622 mm Hg 6) Se recogió una muestra de nitrógeno por desplazamiento de agua a 18 °C. La presión total fue de 742 mm Hg. ¿Cuál es la presión verdadera de la muestra de nitrógeno? R: 727 mm Hg 7) Se recogió gas nitrógeno por desplazamiento de agua a 27 °C y 807 mm Hg. El volumen de gas recogido fue de 124 mL. Calcule: a) El volumen que ocuparía el nitrógeno seco en CNTP b)¿Cuántos mg pesa el nitrógeno recogido? R: 116 mL y 196 mg 8) ¿Cuál es la presión total de una mezcla que contiene 7 g de nitrógeno (N 2) y 7 g de helio (He) encerrada en un matraz de 30 L y a una temperatura de 27 °C? R: 1,64 Atm 9) Calcule las presiones parciales del oxígeno y del nitrógeno del aire, cuando la presión es de 760 mm Hg. La composición del aire es de 20,8 % en masa de O 2 y de 79,2 % en masa de N2. 10) Se recoge hidrógeno gaseoso sobre vapor de agua. Si la muestra de 50,0 mL de gas tiene una temperatura de 22 °C y una presión de 744 mm Hg. ¿Cuál es la presión parcial del hidrógeno? ¿Cuántos gramos de H2 se recogieron? Tomado del Módulo: Estequiometría de Reacciones y Estado Gaseoso del Prof. Anel Adames 11) ¿Cuál será la presión parcial del gas N2 colectado sobre agua a 25 °C y 705 torr? ¿Qué volumen ocupará el gas seco? ¿Qué masa de N2 se recogió? 12) Se colectó una muestra de gas metano (CH4) sobre agua a 25 °C y 720 torr. El volumen del gas seco es de 2,50 L. ¿Cuál será el volumen del metano seco a presión normal? 13) Se colectó una muestra de gas propano (C3H8) sobre agua a 25 °C y 760 torr. El volumen del gas seco es de 1,25 L. ¿Cuál será el volumen del propano seco a presión normal? 14) Un trozo de sodio metálico se hace reaccionar con agua. El hidrógeno generado en la reacción se recoge sobre agua a 25 °C. El volumen del gas es de 246 mL medido a 1,0 Atm. Calcule la masa del trozo de sodio usado en la reacción (PvH2O a 25 °C es 0,031 Atm). 15) Se añadieron tres gases en el mismo recipiente de 2,0 L. La presión total de los gases en la mezcla es de 790 torr a temperatura ambiente (25 °C). Si la mezcla contiene 0,65 g de oxígeno gaseoso, 0,58 g de dióxido de carbono y una cantidad desconocida de gas nitrógeno, determine: a) El numero total de moles de gases presentes en el recipiente b) El número de gramos de nitrógeno presente en la mezcla c) La presión parcial de cada gas en la mezcla 16) Dos recipientes iguales se llenaron con H2 y O2, respectivamente y en iguales condiciones de T y P. Se abren las válvulas de los recipientes al mismo tiempo. Al cabo de una hora se habían escapado 880 mL de hidrógeno. ¿Cuánto oxígeno se escapó en ese mismo tiempo? R: 220 mL 17) Dos recipientes iguales se llenaron con He y Xe, respectivamente y en iguales condiciones de T y P. Se abren las válvulas de los recipientes al mismo tiempo. Al cabo de 30 min se habían escapado 250 mL de helio. ¿Cuánto xenón se escapó en ese mismo tiempo? 18) Una muestra de H2 sale completamente a través de un orifico en 12 minutos. Suponiendo que se tienen otras dos muestras de N2 y de UF6 en recipientes iguales y en las mismas condiciones de T y P, calcule el tiempo que tarda cada gas en salir con respecto al hidrógeno. Tomado del Módulo: Estequiometría de Reacciones y Estado Gaseoso del Prof. Anel Adames 19) Una muestra de He efluye completamente a través de un orifico en 55 segundos. Suponiendo que se tienen otras dos muestras de monóxido de dinitrógeno y de monóxido de carbono en recipientes iguales y en las mismas condiciones de T y P, calcule el tiempo que tarda cada gas en salir con respecto al helio. 20) El tiempo de difusión de una muestra de CH4 por un tubo capilar es de 22,0 s. Una misma cantidad de otro gas, a la misma temperatura y presión necesita 44,0 s. un estudiante dice que el gas puede ser SO2 y otro dice que es SO3. ¿Cuál tiene la razón? 21) Una muestra de helio fluye a través de una barrera porosa a razón de 60 mL/min. ¿Cuál será el flujo de una muestra de gas PCl5 de igual cantidad y a las mismas condiciones de temperatura y de presión? 22) Una muestra de argón fluye a través de una barrera porosa a razón de 32 mL/min. ¿Cuál será el flujo de una muestra de ozono de igual cantidad y a las mismas condiciones de temperatura y de presión? 23) Compare las velocidades de efusión relativas de los gases Cl2O, Cl2O3, Cl2O5 y Cl2O7 con respecto al de menor masa molar. 24) Compare las velocidades de efusión relativas de los gases contaminantesN2O, SO3, NO y NO2 con respecto al oxígeno. 25) ¿Cuáles son las velocidades de efusión relativas del CH4 y del H2S? Si se introducen estos dos gases simultáneamente por los extremos opuestos de un tubo de 100 cm y se dejan difundir entre ellos, ¿a qué distancia del extremo del helio se encontrarán las moléculas de los dos gases?