Práctico Equilibrio de solubilidad File
Anuncio

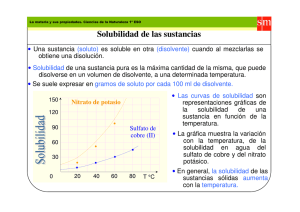
Curso: Química I PRÁCTICO DE TEMA 10 Equilibrio de Solubilidad 1. Escriba la expresión de la constante del producto de solubilidad de los siguientes compuestos: a) AgI b) Fe(OH)2 c) BaSO4 d) PbCl2 e) Ag2SO4 f) Cr(OH)3 2. Si la solubilidad molar del CaF2 a 35ºC es de 1,24x10-3 mol/L , ¿Cúal es la Kps a esa temperatura? 3. La Kps del LaF3 es 2x10-19, ¿Cuál es a solubilidad, expresada en moles por litro, del LaF3 en agua pura? 4. Calcule la solubilidad del Mn(OH)2 en gramos por litro, sabiendo que la Kps es 1.6 x10-13 5. Un volumen de 1L de solución saturada a 25ºC de oxalato de calcio (CaC2O4) se obtuvo a partir de 0,0061 g de CaC2O4. Calcule la constante del producto de solubilidad de esa sal. 6. Calcule la concentración de los iones de las siguientes soluciones saturadas: a- [I-] en una solución de AgI con [Ag+] = 9.1x10-9 M b- [Al3+] en una solución de Al(OH)3 con [OH-] = 2.9x10-9M 7. La solubilidad de un compuesto iónico M2X3 (masa molar = 288 g/mol) es 3.6 x1017 g/L ¿Cuál es el valor de Kps del compuesto? 8. El valor de Kps del hidróxido de manganeso (II) Mn(OH)2 es de 1,6x10-13. Calcule la solubilidad molar del Mn(OH)2 en una solución 0,020 M de NaOH. Compare este resultado con la solubilidad obtenida en el ejercicio nº4. Explique en cuál de los dos casos es más soluble el hidróxido de manganeso. Justifique su respuesta. 9. ¿Cuáles de las siguientes sales serán considerablemente más solubles en una solución ácida que en agua pura? a) ZnCO3 b) AgCl c) AgCN 1 10. Indique si las siguientes sustancias son más solubles en solución ácida o básica a) Ni(OH)2 (s) b) CaCO3 (s) c) BaF2 (s) 11. Calcule la solubilidad molar del CaF2 a 25º C en una solución de NaF 0.010M. Sabiendo que la Kps del CaF2 es 3,9 x 10-11 12. Calcule la solubilidad molar del AgBr en: a) agua pura b) una solución de AgNO3 3x10-2M c) una solución de NaBr 0,1 M ¿Dónde es más soluble? Dato: Kps (AgBr)=5x10-13 13. Una de las causas principales de los hundimientos del suelo, es la disolución de la piedra caliza (que es carbonato de calcio) por la acción de aguas subterráneas. El CaCO3 tiene una Kps relativamente pequeña, pero se sabe que en presencia de un ácido es muy soluble. CaCO3 (s) ↔Ca+2 + CO3 -2 Kps = 4,5 x 10-9 Sabiendo que el agua de la lluvia tiene un pH entre 5 y 6, explique si con la lluvia serán más probables los. 14. Calcule la solubilidad molar del Fe(OH)2 (Kps = 1.0x10-15) en una solución amortiguadora con: a- pH = 8.00 b- pH = 10.00 2