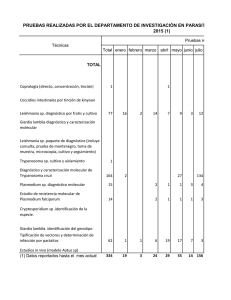
titulación por tesis angélica herrera sepúlveda
Anuncio

INSTITUTO TECNOLÓGICO DE SONORA DETERMINACIÓN DE ENTEROPARÁSITOS Giardia lamblia Y Cryptosporidium parvum EN AGUA RESIDUAL TRATADA DE PLANTA DE TRATAMIENTO SUR, CANAL PRINCIPAL BAJO Y SUS MEZCLAS TITULACIÓN POR TESIS QUE PARA OBTENER EL TÍTULO DE INGENIERA BIOTECNÓLOGA PRESENTA ANGÉLICA HERRERA SEPÚLVEDA CD. OBREGÓN, SONORA JULIO DE 2006 AGRADECIMIENTOS Al laboratorio de Biotecnología ambiental por brindarme la oportunidad de incorporarme a un excelente equipo de trabajo. A mi tutor M. C Luciano Castro Espinoza, por dirigir el rumbo de mi proyecto, por su ayuda, paciencia y comprensión. A mis revisores Dra Hermelinda Herrera, M. C Lorenia Reyes y Norma P. Silva por sus observaciones y correcciones que enriquecieron mi trabajo. Luis, Ciria, Trinidad, Carlos, Rosario y Alma por su valiosa ayuda en el desarrollo experimental y por hacer amenas las horas de trabajo. DEDICATORIAS A mis padres, por su incondicional apoyo, cariño, comprensión y ayuda durante el trayecto de mi carrera. A mis hermanos por ser un ejemplo de superación a seguir, y por fin poder compartir con orgullo el ser “Ingenieros”. A mi tía Mely por sus atinados consejos y recomendaciones que me ayudaron a no temer al momento de adentrarme en el mundo de la ciencia. Y a todas aquellas personas que creyeron en mí. Gracias ÍNDICE páginas AGRADECIMIENTOS i DEDICATORIA ii ÍNDICE iii Lista de tablas v Lista de figuras vi RESUMEN vii I INTRODUCCIÓN 1 1.1 Introducción 1 1.2 Antecedentes 2 1.3Planteamiento del problema 4 1.4 Justificación 5 1.5 Objetivo 7 1.5.1 Objetivo general 7 1.5.2 Objetivos específicos 7 1.6 Hipótesis 8 II REVISIÓN BIBLIOGRÁFICA 2.1 Enfermedades transmitidas vía hídrica 2.2. Protozoarios 2.2.1. Giardia Lamblia 2.2.1.1 Clasificación Taxonómica de Giardia 9 9 13 13 14 lamblia 2.2.1.2 Ciclo de vida 15 2.2.1.3 Sintomatología 17 2.2.2 Cryptosporidium parvum 17 2.2.2.1Taxonomia de Cryptosporidium parvum 18 2.2.2.2 Ciclo de vida 18 2.2.2.3 sintomatología 20 iv 2.3 Técnicas empleadas para la detección de Giardia 22 lamblia y Cryptosporidium parvum 2.3.1 Técnicas inmunológicas. 22 2.3.1.2 Inmunofluorescencia 24 III MATERIALES Y MÉTODOS 25 3.1 Descripción de la zona de muestreo 25 3.2 Preparación de reactivos 26 3.3 Prueba de recuperación 28 3.3.1Determinación de la concentración del control 28 positivo. 3.3.2 Evaluación de elución del filtro 29 3.4 Análisis de la muestra 29 3.4.1 Recolección de la muestra 30 3.4.2 Elución del filtro 31 3.4.3 Flotación y purificación del sedimento 32 3.4.4 Prueba de inmunoflorescencia 33 IV RESULTADOS Y DISCUSIÓN 36 4.1 Eficiencia de técnica inmunofluorescencia 4.2 Concentración de quistes y ooquistes 36 de Giardia 36 lamblia y Cryptosporidium parvum, en el periodo enero-abril 2006 4.3 Fuentes de variación durante el muestreo y 41 procesamiento de la muestra VI CONCLUSIÓN Y RECOMENDACIONES 42 VII BIBLIOGRAFÍA 43 INDICE DE TABLAS Tabla Descripción Página No. 1 Principales enfermedades de transmisión hídrica y 10 agentes responsables 2 Proporción utilizada para la preparación de las series de 27 etanol - glicerol. 3 Monitoreo sin involucrar mezcla de agua residual 4 Monitoreo involucrando mezcla de agua residual tratada 35 con agua de canal principal bajo 34 ÍNDICE DE FIGURAS Figura Descripción Página No. 1 Probabilidad de infección por ingestión de diferentes 13 células patógenas en diferentes dosis de respuesta 2 Imagen de Giardia lamblia vista en microscopio 14 electrónico 3 Ciclo de vida Giardia Lamblia 15 4 Vista al microscopio de Cryptosporidium parvum saliendo de su ooquiste 18 5 Ciclo de vida Cryptosporidium parvum 19 6 Ubicación de los puntos de muestreo en el recorrido del 25 canal principal bajo 7 Equipo necesario para la toma de muestra 30 8 Elución de filtro 31 9 Flotación y purificación del sedimento 33 10 Prueba de inmunofluorescencia 34 11 Quistes de G. lamblia y Ooquistes de C. parvum visto a 38 través de microscopio de epifluorescencia. RESUMEN Los entero parásitos Giardia lamblia y Cryptosporidium parvum son reconocidos entre los principales causantes de enfermedades emergentes transmitidas por el agua, siendo los niños y pacientes inmunocomprometidos los mas vulnerables. Debido a que estos parásitos poseen la característica de enquistar y les permite prevalecer a pesar de condiciones climatológicas y procesos habituales de tratamiento de agua. Por esta razón durante el periodo enero – abril 2006 se realizó monitoreo para determinar la concentración de quistes de Giardia lamblia y ooquistes de Cryptosporidium parvum en el efluente de la planta de tratamiento sur, canal principal bajo y sus mezclas; utilizando la técnica de inmunofluorescencia. Además se realizó una prueba de eficiencia de recuperación de la técnica utilizando el kit A 100 FL AquaGlo GIC. El porcentaje de recuperación de la técnica fue de 36% para quistes de giardia y 33% para ooquistes de Cryptosporidium. Se detectaron quistes de giardia en un 100% y un 76 % para ooquistes de criptosporidium dentro de las 17 muestras analizadas. Los resultados obtenidos permitirán establecer bases para estimar el riesgo de reutilizar las aguas residuales tratadas como alternativa para el riego de la región del valle del Yaqui. I INTRODUCCIÓN 1.1 Introducción La demanda creciente de agua para la agricultura, el consumo doméstico (municipal) y la industria están imponiendo una dura competencia por la distribución de los recursos hídricos. Una de las principales actividades económicas que demanda un mayor suministro de agua es la agricultura, ya que esta actividad utiliza casi el 70% del agua extraída en todo el mundo. Una alternativa para lograr una plena satisfacción de este recurso en torno a la agricultura, es la utilización de agua residual tratada. Sin embargo, es de vital importancia que el agua a emplearse cumpla con los parámetros de calidad necesarios para su reutilización. Dentro de estos parámetros se encuentran químicos, físicos y microbiológicos. Los parámetros químicos involucran oxígeno disuelto, demanda química de oxígeno (DQO), demanda bioquímica de oxígeno (DBO), los físicos olor turbiedad y sólidos. En los parámetros microbiológicos destacan las determinaciones de huevos de helminto, coliformes totales y coliformes fecales. A este grupo de microorganismos se les conoce como indicadores microbiológicos. Los microorganismos indicadores son aquellos que tienen un comportamiento similar a los patógenos (concentración y reacción frente a factores ambientales y barreras artificiales), pero son más fáciles de identificar, a costos más bajos y a 2 menor tiempo. Una vez que se ha evidenciado la presencia de grupos indicadores, se puede inferir que los patógenos se encuentran presentes en la misma concentración y que su comportamiento frente a diferentes factores como pH, temperatura, presencia de nutrientes, tiempo de retención hidráulica o sistemas de desinfección es similar a la del indicador (Campos, 1999). Es importante anotar que además de los patógenos que tradicionalmente se encuentran en el agua, también están presentes aquellos que son causantes de enfermedades emergentes. Este tipo de enfermedades comprende aquellas cuya incidencia en los seres humanos ha aumentado en las dos últimas décadas (Salvatella y Hortal 1998). El aumento de este tipo de microorganismos esta relacionado con cambios dramáticos en el ambiente y en la población. Frente a este fenómeno, surge la necesidad de incluir nuevos indicadores microbiológicos debido a que se ha encontrado que algunos microorganismos patógenos pueden ser más resistentes a cloracion y otros factores de estrés ambiental. Algunos de estos son los siguientes: virus entericos, quistes de Giardia, ooquistes de Criptosporidium, y esporas de Clostridium perfringens. En México, los enteroparásitos Giardia lamblia y Cryptosporidium parvum, afectan aproximadamente a 9 millones de personas. Se considera que la población infantil es la más vulnerable. Específicamente en el estado de Sonora, diversos estudios han informado de la presencia de infecciones por Giardia, tanto en población urbana como rural (Díaz et al., 2003). 1.2 Antecedentes 3 En las últimas décadas, G. lamblia y C. parvum se ha reconocido como agente causal de parasitosis intestinal en el hombre, con intervalos de prevalencia entre 1 y 5 % en países desarrollados y mayores a 10 % en países en vías de desarrollo; se estima que en México 2.3 % de los niños mayores de tres años sufren criptosporidiosis (Casemore 1990).). Ambos organismos pueden causar severas gastroenteritis, tanto para el hombre como para los animales si son ingeridos (Paulino, et al., 2001,). La ingestión de estos parásitos puede ocurrir vía fecal oral, ya que una de las características que presentan es que poseen la capacidad de formar quistes u ooquistes los cuales son eliminados en las heces fecales del hospedero. G. lamblia fue el primero de estos organismos en ser ampliamente asociado con enfermedades en los humanos, y han habido varios casos documentados de Giardiasis transmitida por el agua desde 1970 (Rose et al., 1989). C. parvum emergió como una amenaza de las reservas de agua en 1980, particularmente en Estados Unidos y en el Reino Unido, y desde entonces otros países han reconocido brotes de crisporidiosis transmitidos por el agua. C. parvum causó probablemente el brote documentado mas grande de enfermedades gastrointestinales en un país desarrollado, ocurrido en Milwaukee, Wisconsin, USA, en 1993 y en el que se estimaron alrededor de 403,000 casos de la enfermedad, de los cuales 70 resultaron fatales. Este brote fue el resultado de una contaminación del suministro de agua (Lecheveliar 1994). Sin embargo la transmisión de C. parvum se encuentra asociada frecuentemente a guarderías y alimentos. En el Instituto Tecnológico de Sonora se han realizado diversas investigaciones al agua municipal tratada, al agua residual sin tratar y al agua para irrigación de cultivos. Además, se realizaron estudios del impacto microbiológico que presentaron los vegetales al irrigarse con las aguas mencionadas anteriormente. En un estudio realizado por Gortárez et al., (2003), se analizó la calidad 4 microbiológica y fisicoquímica del efluente de la planta tratadora Sur, encontraron que el nivel de C. parvum (18 ooquistes / 100 ml) y G. lamblia (1200 quistes / 100 ml) es ligeramente superior a la dosis infectiva. A partir de 1999, en el Instituto Tecnológico de Sonora, se llevan a cabo monitoreos para determinar la prevalencia de los enteroparásitos Giardia lamblia y Cryptosporidium parvum en el agua del canal principal bajo. El procedimiento empleado para hacer este tipo de análisis es mediante la técnica de inmunofluorescencia. Sin embargo, aun no ha sido determinado el porcentaje de recuperación que presenta la técnica, por lo cual se requiere conocer el factor de conversión para lograr determinar el número exacto de quistes de Giardia lamblia y ooquistes de Cryptosporidium parvum. Así como minimizar las interferencias presentadas durante el procesamiento y análisis de la muestra. En este aspecto, se han realizado investigaciones alrededor del mundo para determinar la sensibilidad que presenta estas técnicas en comparación con las demás. Estos ensayos se han realizado inoculando una cantidad conocida de quistes de G. lamblia y ooquiste de C. parvum en un volumen determinado de agua, se les ha dado el mismo tratamiento que a una muestra ambiental y se ha determinado el porcentaje de recuperación (Rose et al., 1990). 1.3 Planteamiento del problema El agua es el principal recurso para lograr el desarrollo de la agricultura en la región del Valle del Yaqui; sin embargo existe una gran problemática debido a la escasez provocada por la falta de lluvias. Es de primordial importancia que el abastecimiento sea lo mas eficiente posible. En lugar de propiciar el antagonismo entre las diferentes actividades, es necesario generar información para el reuso del agua en ciertas actividades, después de un uso primario. Cualquiera que sea 5 la actividad en la que se plantee el reuso, el agua deberá contar con la calidad adecuada. En los estudios previos se ha detectado la presencia de las formas resistentes de los parásitos (quistes, ooquistes, etc.) por lo que con este trabajo pretendemos contestar la pregunta ¿Cuáles son las concentraciones de quistes de Giardia lamblia y ooquistes de Cryptosporidium parvum en el agua residual tratada de la planta de tratamiento sur de Cd. Obregón y el canal principal bajo?. Con estos datos se podrá hacer una mejor estimación del riesgo de reutilizar las aguas residuales tratadas. 1.4 Justificación En gran parte del mundo, el agua contaminada, la disposición inadecuada de desechos y la deficiente ordenación de las aguas, causan serios problemas de salud pública. Enfermedades relacionadas con el agua afectan a más de dos mil millones de personas en el mundo. La Organización Mundial de la Salud (OMS) estima que más de 2 millones de niños mueren cada año por enfermedades relacionadas con la ingesta de agua que no reúne condiciones adecuadas de higiene. En el agua residual de las ciudades potencialmente más de 100 diferentes tipos de virus patógenos, bacterias y parásitos pueden estar presentes y causar enfermedades como diarrea, meningitis, miocarditis y hepatitis, estas aguas generalmente son tratadas en plantas de tratamiento municipal. En América Latina según estimaciones del Third World Center for Water Management, solo 6% de las aguas residuales son tratadas y depuradas. (Aguiar et al., s.f.) Con el crecimiento de la población mundial y el aumento del uso de agua por persona, es necesario conservar el agua, regular su suministro, reducir el uso y 6 reutilizar el agua. Para lograr que se lleve a cabo la reutilización del agua, se requiere que ésta cumpla con los requerimientos específicos para la minimización de los riesgos para la salud humana. La Norma Oficial Mexicana NOM 001 SEMARNAT 1996 establece los límites máximos permisibles de contaminantes en las descargas de aguas residuales en aguas y bienes nacionales, incluye en uno de sus apartados la posibilidad de su reuso, en caso de que sea agrícola esta no involucra parámetros microbiológicos. No obstante, La Norma Oficial Mexicana NOM–003–SEMARNAT 1997 establece los límites máximos permisibles de contaminantes para las aguas residuales tratadas que se reusen en servicios al público y, adicionalmente los microorganismos tales como coliformes fecales y huevos de helminto, han sido los principales indicadores para determinar la calidad microbiológica del agua (SEMARNAT 2006). Sin embargo existen microorganismos como Giardia lamblia y Cryptosporidium parvum, que pueden formar parte del grupo de microorganismos indicadores, debido a que han sido reconocidos por tener un alto potencial como causantes de enfermedades trasmitidas por el agua y comida. En este trabajo, se monitoreó el efluente de la planta de tratamientos Sur de Ciudad obregón Son (punto 1), así como del Punto 2 y 7, ubicado en el Canal principal bajo, block 1610 Valle del Yaqui aproximadamente 4 kilómetros rumbo a Quetchehueca, en el periodo enero-abril del año 2006. Gracias a esta información será posible estimar la concentración de quistes Giardia lamblia y ooquistes de Cryptosporidium parvum; adicionalmente, se llevaron a cabo pruebas para determinar el porcentaje de recuperación de esta técnica generando así, generando así información que permitirá establecer bases para sustentar la factibilidad de emplear el agua residual tratada como alternativa para el riego de la región del Valle del Yaqui. 7 El presente trabajo formó parte del proyecto “Determinación del posible reuso con fines agrícolas de aguas residuales municipales tratadas” con clave SON-2003CO1-008 , financiado en el año 2006 por fondos mixtos de CONACYT y el gobierno del Estado de Sonora, a quien se agradece el apoyo económico y las facilidades otorgadas para la realización del mismo. El trabajo experimental que aquí se reporta se realizó en el Laboratorio de Ecodesarrollo, adscrito a la Dirección Académica de Recursos Naturales del Instituto Tecnológico de Sonora y fue dirigido por el M. C Luciano Castro Espinoza. 1.5 Objetivos 1.5.1Objetivo general • Cuantificar la presencia de quistes de Giardia lamblia y ooquistes de Cryptosporidium parvum en agua residual tratada de planta de tratamiento sur, canal principal bajo y las mezclas derivadas; por medio de pruebas de inmunofluorescencia para contribuir al establecimiento de un modelo de riesgo del reuso de agua residual tratada. 1.5.2 Objetivos específicos • Determinar eficiencia de la técnica de inmunofluorescencia empleada para detección de quistes de Giardia lamblia y Ooquistes de Cryptosporidium parvum en agua residual tratada y canal principal bajo, por medio de ensayo de rendimiento, para su correcta cuantificación. 8 • Determinar la concentración de quistes de Giardia lamblia y ooquistes Cryptosporidium parvum, mediante monitoreo ambiental en el periodo enero-abril 2006. • Establecer fuentes de variación durante el muestreo y procesamiento de la muestra, como herramienta para la eliminación de los principales factores que dificultan el procesamiento de la misma. 1.6 Hipótesis Los enteroparásitos Giardia lamblia y Cryptosporidium parvum poseen la capacidad de enquistar; dicha característica les confiere la propiedad de prevalecer a pesar de las adversidades climatológicas así como los procesos de desinfección en plantas de tratamiento convencionales. Por esta razón estos enteroparásitos estarán presentes en el agua de la planta de tratamientos sur y agua de canal principal bajo, en cantidades que representan un riesgo para su uso. II REVISIÓN BIBLIOGRÁFICA 2.1 Enfermedades transmitidas vía hídrica. El agua es uno de los elementos esenciales para la vida, pero puede ser vehículo de enfermedades cuando no reúne las condiciones de calidad necesarias que aseguren su inocuidad. Las enfermedades de transmisión hídrica son las que se transmiten por la ingestión de agua que ha sido contaminada por microorganismos patógenos, principalmente a través de heces humana. La ingestión puede ser directa, por agua potable, o indirecta, con alimentos o bebida que han sido preparados con agua contaminada; también puede ser accidental y producirse durante la natación u otras actividades recreativas. En la tabla 1 se puede observar las principales enfermedades transmitidas por el agua así como el agente patógeno responsable. 10 Tabla 1. Principales enfermedades de transmisión hídrica y agentes responsables Enfermedad Agentes Origen bacteriano Salmonella typhi, Salmonella Fiebres tifoideas y paratifoideas, Disentería bacilar,Cólera,Gastroenteritis aguda y diarrea paratyphi A y B,Shigella sp, Escherichia coli enterotoxi-génica, Campylobacter, Yersinia enterocolítica, Salmonella sp, Shigella Origen vírico Hepatitis A y E, Poliomielitis, Virus de la Hepatitis A y E , Virus de la Gastroenteritis aguda y diarrea polio. Rotavirus, Enterovirus, Adenovirus, etc. Origen parasitario Disentería amebiana, Gastroenteritis Entamoeba histolítica , Giardia lamblia Cryptosporidium Fuente: Red Iberoamericana de Potabilización y Depuración del Agua (2003) El control de enfermedades bacterianas y parasitarias transmitidas por el agua es prioritario. Se calcula que: a) el 80% de las enfermedades y más de un tercio de las deficiencias de los países en desarrollo están asociadas con el agua; b) el 35% de los casos de diarrea que ocurren en el mundo se asocian a la ingesta de agua, aun cuando se haya ingerido agua tratada y controlada biológicamente. (Vilanova 2003) Las enfermedades relacionadas con las aguas contaminadas son uno de los problemas más graves de salud pública de gran parte de la población mundial. La Organización Mundial de la Salud (OMS), por ejemplo, calcula que 1100 millones de persona actualmente no tienen acceso a fuentes de abasto de agua segura, más de 2400 millones carecen de saneamiento adecuado; las enfermedades 11 diarreicas matan a unos dos millones de personas al año, de las cuales la mayoría son niños menores de cinco años de edad (OMS citado por Vilanova. 2003). Desde 1980, se han incrementado las enfermedades transmitidas por el agua destacando aquellas causadas por los parásitos Giardia lamblia y Cryptosporidium parvum. Ambos microorganismos pueden causar gastroenteritis severas si son ingeridos. Su capacidad para generar este tipo de brotes se asocia con su resistencia a los procesos habituales de tratamiento de las aguas (Santos et al., 2004). En los sistemas habituales de tratamiento de agua residual, después de una filtración, el agua se trata con un desinfectante. Este paso suele consistir en cloración. La desinfección con cloro ha sido el método más común. Cuando se emplea la cloración, las dosis de cloro deben de ser lo suficientemente elevada para que quede cloro libre residual, en una concentración de 0.2 a 2.0 mg/Litro. La depuración anteriormente descrita elimina o inactiva eficazmente las bacterias patógenas y organismos indicadores (coliformes). Sin embargo, a menudo no elimina de forma constante y segura los quistes de Giardia lamblia y ooquistes de Cryptosporidium parvum ya que pueden permanecer viables en el agua durante largos periodos de tiempo (Prescott et al., 2000). Estos requieren como mínimo una concentración mayor de 80 mg/L de cloro libre para su destrucción (Lechevallier et al., 1991), esta concentración es 400 veces la máxima permitida en agua para consumo humano. Estos organismos son altamente infecciosos, una ingestión de 10 quistes (Adam, 1991) y 30 ooquistes (DuPont, 1995) pueden resultar una infección en el ser humano. Sin embargo un modelo exponencial de dosis de respuesta ha sido desarrollado (Ottoson 2005). Este modelo describe la probabilidad de infección de acuerdo a la exposición. Y se describe en términos de probabilidad de infección (Pi): 12 El valor r representa la fracción de ooquistes ingeridos, los cuales pueden sobrevivir y causar infección y N la exposición diaria asumiendo un consumo de 2 litros de agua respectivamente. Para G. lamblia el valor de r =0.0198 mientras que para C. parvum se ha establecido un valor de r =0.0047 (Haas, 1994, Rose et all., 1991). Con estos datos se ha construido la siguiente gráfica que se muestra en la figura 1, esta esquematiza la probabilidad de infección por ingestión de células patógenas. Probabilidad de ingestión Número de células ingeridas *a Giardia lamblia, b Cryptosporidium parvum Figura. 1 Probabilidad de infección por ingestión de diferentes células patógenas en diferentes dosis de respuesta. 13 2.2 Protozoarios Se puede definir a un protozoario como un protista unicelular eucariota habitualmente móvil. Los Protozoarios se encuentran tanto en hábitat de aguas dulces como marinas; un gran número de ellos son parásitos del hombre y otros animales y otros son saprofitos en otros hábitats como el suelo, el aire o la superficie de los árboles. Los protozoarios se dividen en 4 grandes grupos basados en su forma de locomoción: Rizópodos (Rhizopoda), Ciliados (Ciliophora), Flagelados (Mastigophora) y Esporozoos (Sporozoa). Los cuatro grupos pueden habitar en el tracto intestinal, por lo cual varios son zoonóticos, es decir, estos pueden transmitirse directamente de un animal al humano. Este es el caso de G. lamblia y C. parvum. Muchos protozoarios son capaces de enquistarse. Evolucionan a una etapa llamada quiste, forma de reposo característico por la presencia de una pared y por una actividad metabólica muy reducida. Los quistes tienen tres funciones principales: 1) protegen frente a las alteraciones adversas del medio, 2) son lugares para reorganización nuclear y la división celular; y sirven como medio de transferencia de un huésped a otro en las especies parásitas (Prescott et al., 2000). 2.2.1 Giardia lamblia. Es uno de los parásitos patógenos intestinales causantes de diarrea endémica y epidémica, y el de mayor prevalencia en la mayoría de los países industrializados; su distribución es endémica a nivel mundial con una mayor incidencia en niños de menor edad. 14 Giardia lamblia es un protozoario intestinal, flagelado, que coloniza el intestino delgado, donde puede ocasionar infección aguda o crónica. Es considerado como el parasito intestinal más común a nivel mundial (Marshall et al., 1997). De acuerdo al Centro de Control de Enfermedades (CDC) Giardia lamblia es el parasito intestinal mas comúnmente diagnosticado y causa aproximadamente dos millones de casos de diarrea en EEUU por año (CDC, 2000). 2.2.1.1 Clasificación taxonómica de Giardia lamblia Phylum: Protozoa Subphylum: Sarcomastigospora Superclase: Mastigospora Clase: Zoomastigospora Orden: Diplomonadida Familia: Hexamitidae Figura 2. Imagen de Giardia lamblia vista en microscopio electrónico Fuente: Cavalier y Smith (2003) 15 2.2.1.2 Ciclo de vida. El ciclo de vida está compuesto por dos fases un trofozoíto activo y un quiste resistente, este se puede apreciar en la figura 3. Figura. 3. Ciclo de vida de Giardia lamblia Fuente: DPDx 2003 16 El trofozoito. Este tiene forma de pera, posee dos núcleos y cuatro pares de flagelos, un disco suctorio cóncavo oval (órgano de fijación) en la mitad anterior de la superficie ventral. Es la forma patógena. Con una longitud de de 9–21 Am y un ancho de 5–15 Am. Los trofozoitos originados se fijan a la mucosa del duodeno o del yeyuno proximal, probablemente vía de la contracción del disco ventral del protozoario. Los trofozoitos normalmente se fijan a la superficie del intestino delgado, en donde se cree se alimentan de las secreciones de la mucosa. Es durante el estado de trofozoito en el cual los síntomas clínicos se presentan, como resultado del daño de la mucosa. Después de la separación, el trofozoito binuclear forma el quiste a nivel del colon (enquista) y se divide dentro del quiste. El quiste tiene un largo de 10-12 µm y de 5-8 µm de ancho, con una forma oval y una alta resistencia en este estado, por lo cual su ciclo de vida es muy alargado, ya que puede sobrevivir y mantenerse infeccioso por varios meses. Un quiste ingerido pasa a través del duodeno en donde el desenquistamiento ocurre, liberando así dos trofozoitos, después se multiplicarán rápidamente vía asexual y colonizan el intestino delgado. Los quistes de Giardia lamblia pueden sobrevivir mas de 77 días en agua de grifo a 8° C (Robertson et all., 1995). Los quistes pueden ser desechados en las heces, así como los trofozoitos, sin embargo no son infectivos. La dosis infectiva para Giardia lamblia es entre 10 y 100 quistes (Rentdorff, 1954). Los quistes sobreviven en los alimentos y en el agua; cuando se ingieren, los quistes pasan a través del estómago, donde el ambiente ácido ocasiona un fenómeno de desenquistamiento, el cual finaliza generalmente a nivel del duodeno. El periodo de prepatente (tiempo entre la ingestión de los quistes y la excreción de los nuevos quistes) para Giardiasis es de 6–16 días. 17 2.2.1.3 Sintomatología. La manifestación de giardiasis en humanos puede ser variable; debido a que puede ser tanto asintomático como diarreas crónicas. En su mayoría esto dependerá del estado inmunológico del hospedero. El periodo de incubación en humanos es generalmente alrededor de 5 a 15 días semanas; el inicio de las manifestaciones clínicas generalmente es con molestias abdominales vagas seguidas por estado nauseoso y anorexia, fiebre de baja intensidad en niños, seguidos de fuertes diarreas; las deposiciones son acuosas, con moco y en raras ocasiones con sangre, que pueden prolongarse durante semanas o años. En niños la giardiasis puede ser causa de diarrea crónica, con afección del estado nutricional, (Marshall et al., 1997). 2.2.2 Cryptosporidium parvum Son protozoarios que invaden y se replican en el interior de las vellosidades que recubren el tubo digestivo y respiratorio de los animales vertebrados. Cryptosporidium es dividido en 24 especies, de las cuales se ha demostrado que 4 son capaces de infectar al humano. Sin embargo únicamente C. parvum y C. hominis se han relacionado significativamente con problemas de la salud humana (Dawson et al., 2004). Cryptosporidium parvum se reconoció por primera vez como un patógeno potencial para el humano en 1976. Subsecuentemente, la enfermedad llego a ser mejor conocida en individuos inminosuprimidos presentando síntomas ahora referidos al síndrome de inmuno deficiencia adquirida o SIDA. 18 2.2.2.1. Clasificación taxonómica de Cryptosporidium parvum Phylum: Apicomplexa Clase: Esporozoasida Subclase: Coccodiasina, Orden: Eucoccidiorida Suborden: Eimeriorina Familia: Cryptosporidiidae Figura 4: Vista al microscopio de Cryptosporidium parvum saliendo de su ooquiste Fuente: Cavalier y Smith (2003) El reconocimiento de C. parvum como un patógeno humano, a incrementado investigaciones en lo que se refiere al ciclo del vida del parasito y así como su vinculación como posible vector de transmisión. 2.2.2.2 Ciclo de vida. El ciclo de vida de Criptosporidium es completo en un solo hospedero y culmina con la eliminación de ooquistes maduros en las heces (Santos et al., 2004) los cuales inmediatamente son infectivos en otro hospedero susceptible. Dentro del organismo hospedero, los esporozitos son liberados por el ooquiste en las células epiteliales del tracto gastrointestinal u otros tejidos como el tracto respiratorio; posteriormente los parásitos sufren multiplicación asexual y sexual produciendo microgametos varón y hembra. Posteriormente se produce la fertilización, produciendo un zigoto que desarrollan esporulación en el hospedero 19 infectado (Dawson 2004). Se producen dos tipos diferentes de ooquistes uno de membrana gruesa (varón) que normalmente se excreta por el hospedero y el ooquiste de membrana delgada (hembra) que esta automáticamente envuelto en autoinfección. Finalmente los ooquistes infectivos son excretados y permiten transmisión fecal-oral directa e inmediata. El ciclo de vida de C. parvum puede observarse en la figura 5. Figura 5: ciclo de vida Cryptosporidium parvum Fuente: DPDx 2003 20 Como un patógeno de enfermedades transmitidas por el agua, la etapa más importante del ciclo de vida de Cryptosporidium es el ooquiste, este tiene una forma esférica, con un diámetro 4.5 - 6 µm, el ooquiste esporulado contiene 4 esporocitos. Los ooquistes de C. parvum frecuentemente se encuentran en la superficie del agua. Debido a la característica que les confiere la forma de ooquiste, tienen la capacidad de sobrevivir al estrés sometido por el medio ambiente así como una tolerancia a altas dosis de desinfectantes. Se estudió la sobrevivencia de dos aislados de C. parvum en contenedores semipermeables en diferentes ambientes (agua de río y heces de vaca,) y se encontró viabilidad de ambos ooquistes después de un periodo de 6 meses En solución acuosa, el ooquiste permanece infeccioso por encima de 6 meses y permanece viable durante 9 meses (Robertson et al., 1992). La transmisión de Cryptosporidium parvum ocurre principalmente a través del contacto con agua contaminada y en algunas ocasiones de las fuentes de los alimentos. La transmisión zoonótica de C. parvum ocurre a través de la exposición a animales infectados o exposición a agua contaminada por excremento de animales infectados. 2.2.2.3 Sintomatología. C. parvum puede causar síntomas severos y suaves dependiendo de la dosis de ooquistes ingeridos, la virulencia de la cadena de C. parvum, y la immunocompetencia del individuo afectado. La inmunocompetencia es la capacidad de las células linfoides para producir una respuesta inmune humoral o celular cuando son estimuladas por antígeno esta se puede dividir en 3 categorías: (1) inmunocompetentes son aquellos individuos con una clara 21 infección en 7–14 días, (2) pacientes con SIDA o alguna otra alteración del sistema inmune (i.e., individuos con conteo celular CD4 <180 cel/mm) quienes en la mayoría de los casos nunca completan una clara infección(3) y los individuos inmunosuprimidos este grupo comprende a individuos que recibieron tratamiento de quimioterapia así como enfermedades como varicela o malnutrición; en este caso la infección usualmente es clara dentro de 10–15 días tiempo en el cual el sistema inmune vuelve a la normalidad, sin embargo se han reportado casos de niños en donde la infección persiste por mas de 30 días. Los síntomas más frecuentes en niños inmunocompetentes son gastroenteritis autolimitadas, con deposiciones acuosas, dolor abdominal, y a veces nauseas, vómitos y fiebre. Las heces no suelen tener leucocitos ni hematíes, correlacionándose síntomas, estado inmunológico y carga parasitaria. En personas inmunodeprimidos, suele consistir en hepatitis, colecistitis, artritis reactivas y síntomas respiratorios. La clínica oscila entre la de los casos de SIDA, con diarrea acuosa, prolongada, y persistente excreción de quistes, llegando a producir la muerte tras semanas o meses de malnutrición, infecciones oportunistas o neoplasias, y la que presentan pacientes inmunocompetentes con diarrea acuosa con espasmos, náuseas y febrícula, autolimitada de 2 semanas de duración. Los síntomas reportados de brotes ocasionados por transmisión vía hídrica son diarrea, calambres abdominales, nausea, vomito, fiebre, dolor de cabeza, y dolor muscular (Santos et al., 2004). 22 2.3 Técnicas empleadas para detección de Giardia lamblia y Cryptosporidium parvum. Para detectar a este tipo de parásitos, se han desarrollado técnicas inmunológicas, en las cuales se pueden presentar variaciones para la concentración de la muestra por medio de floculación con carbonato de calcio, disolución de filtros de membrana; otra técnica empleada es técnicas moleculares, como es la reacción en cadena de la polimerasa, mejor conocidas por sus siglas en ingles como PCR (Mahbubani et al., 1992) 2.3.1 Técnicas inmunológicas La inmunología es el estudio de la estructura y función del sistema inmunológico en relación a la respuesta del sistema hacia las enfermedades. Los métodos inmunológicos son métodos usados para la detección o cuantificación de la interacción antígeno-anticuerpo, varios análisis inmunológicos son utilizados en microbiología ambiental como la inmunofluorecencia, ELISA, separación magnética, inmunoprecipitación, inmunoafinidad cromatográfica. A) Inmunofluoresencia: Es una técnica utilizada para la detección de un anticuerpo ó un antígeno en células, tejidos y microorganismos mediante la utilización de compuestos fluorescentes. B) Radioinmunoensayo: se basa en el marcaje con un radioisótopo de un antígeno determinado (toxina producida por una bacteria patógena) y su posterior detección por anticuerpos específicos fijados sobre un soporte sólido. 23 C) ELISA: El método es similar al radioinmunoensayo: el antígeno se fija en un soporte sólido, se trata con el antisuero correspondiente y la interacción se detecta mediante una actividad marcadora (peroxidasa) unida al anticuerpo en cuestión o a un segundo anticuerpo de revelado. D) Separación magnética: La inmunoseparación magnética es una técnica que utiliza un anticuerpo conjugado con una partícula magnética para unir al antígeno y después se extraen mediante un imán las partículas magnéticas junto con la interacción antígeno-anticuerpo. E) Inmunoafinidad cromatográfica: La afinidad cromatográfica es un poderoso método para concentrar y purificar antígenos, el anticuerpo es químicamente unido a una columna cromatográfica, la muestra que contiene el antígeno es eluida a través de la columna y el antígeno es selectivamente retenido en la columna. F) Inmunoprecipitación: Es normalmente una serie de tubos los cuales poseen una concentración constante de anticuerpos. El antígeno se agrega entonces en una concentración creciente de los tubos consecutivos. En los tubos iniciales donde la concentración más baja de antígeno se ha agregado, no hay ninguna precipitación obvia. Cuando la concentración del antígeno se aumenta, se comienza a observar la formación de complejos de antígeno-anticuerpo. Por ser inmunofluorescencia la técnica empleada para realizar este estudio se ampliará más sobre el mismo 24 2.3.1.2 Inmunofluorescencia. El método de la American Society for Testing and Materials (ASTM) involucra, filtrar 100L (o más) de agua a través de un filtro de cartucho de fibras polipropileno con un poro de 1.0µm, extrayendo las partículas del cartucho cortando en partes y lavando las fibras y concentrando las partículas extritas por centrifugación. Estas partículas son procesadas para concentrar selectivamente los quistes y ooquistes por medio de filtración en tubos cónicos de 50 mL con un gradiente de percoll-sacarosa. Las partículas son recuperadas de la interfase del gradiente de percoll-sacarosa. Estas posteriormente son marcadas con anticuerpos fluorescentes en filtros de celulosa acetato con un diámetro de 25 mm. y un poro de 0.2 mm. Después de montar el filtro en el portaobjetos, este es explorado en un microscopio de epifluorescencia UV en búsqueda del tamaño, forma y fluorescencia característica de quistes de G. lamblia y ooquistes de C. parvum. Las ventajas que presenta esta técnica es su habilidad para confirmar quistes y ooquistes presuntos. Este método es considerado esencial para el análisis de muestras ambientales. Dentro de las limitaciones que presenta se encuentran: una pobre recuperación de quistes y ooquistes ya que se ve influenciada por la calidad del agua, problemática para exploración del filtro debido a interferencia con partículas de arcilla y algas, inhabilidad de identificar la viabilidad, y el alto tiempo requerido para realizar el análisis (Rose et al.,1989). III MATERIALES Y MÉTODOS 3.1 Descripción de la zona de muestreo La selección de los puntos de muestreo fueron determinados en base a investigaciones anteriores realizadas por Ortega y Airola (2005). De estos se seleccionó el punto número 1 correspondiente a la planta tratadora de agua residual, punto 2 al primer punto de muestreo del canal principal bajo y el punto número 7 que se encuentra al final de la zona delimitada. En la figura 6 se muestran los lugares seleccionados. Figura 6. Ubicación de los puntos de muestreo en el recorrido del canal principal bajo Fuente: Ortega y Airola (2005). 26 3.2 Preparación de reactivos Para la técnica se requirió preparar una serie de soluciones que se mencionan a continuación: • Solución buffer de Formalina al 10%. Se disolvieron 0.762 g. de fosfato dibásico de sodio (Na2HP04), 0.019 g. de fosfato monobásico de sodio (Na2HP04)en 100 ml. de la solución de formalina en agua a un volumen final de 1 litro. • Buffer salino de fosfatos (PBS). Se preparó una solución patrón a una concentración de 10X, disolviendo 80 g. de NaCI, 2 g. de fosfato dibásico de potasio (KH2P04), 29 g. de fosfato monobásico de sodio duodecahidratado (Na2HP04.12 H20) y 2 g. de cloruro de potasio (KCI) en agua y aforo a un volumen final de 1L. La solución de 10X se utilizó para preparar PBS de concentración 1X, diluyendo 1 volumen de la solución de 10X con 9 volúmenes de agua y ajustando el pH a 7.4 ± 0.2. • Solución Patrón de dodecil sulfato de sodio al 1 % (SDS). Para la solución patrón se requirió disolver 1 g. de dodecil sulfato de sodio en agua a un volumen final de 100 mL. • Solución Patrón de Tween 80 al 1 %. Para la solución de Tween se mezcló 1 mL de monoelato de polioxietilensorbitan 80 (Tween 80) con 99 mL de agua destilada. 27 • Solución de elusión (Solución buffer detergente). La solución se preparó mezclando 100 mL de SOS aI 1%, 100 mL de Tween 80, 100 mL de PBS10X y 1 mL de antiespumante con 500 mL de agua destilada. Se ajustó el pH a 7.4 ± 0.2.usando un potenciómetro, la solución se aforo a un volumen final de 1 litro. • Solución de flotación Percoll - sacarosa. Con una densidad de 1.1 ± 0.2 Q. Se mezclaron 45 mL de Percoll (densidad 1.13) en 45 mL de agua y 10 mL de solución de sacarosa al 2.5 M. • Serie de etanol- glicerol. Las series de etanol - glicerol se prepararon de acuerdo a la tabla 2. Tabla 2. Proporción utilizada para la preparación de las series de etanol glicerol. SERIES DE ETANOL- GLlCEROL 95% etanol Glicerol Agua Volumen % final destilada final de (mL) (mL) (mL) (mL) Etanol 10 5 80 95 10% 20 5 70 95 20% 40 5 50 95 40% 80 5 10 95 80% 95 5 0 100 90.2% Fuente Shay et al., 1990 • Kit A 100 FL AquaGlo GIC para la detección simultanea de inmunoflorescencia de quistes de Giardia y ooquistes de Cryptosporidium en muestras de agua. La muestra se colocó a una 28 concentración de 1X, ya que normalmente viene a una concentración de 20X. El kit se almacenó de 2 - 8° C y este se guardaba después de su uso. 3.3 Prueba de recuperación Esta prueba consta de 3 etapas, determinación de la concentración de quistes y ooquistes de G. lamblia y C. parvum del control positivo, evaluación de porcentaje de recuperación que se obtiene después de la elución del filtro y la evaluación de la concentración de quistes y ooquistes en influentes y efluentes. Estas pruebas se realizaron por triplicado. 3.3.1 Determinación de la concentración del control positivo. Para determinar la concentración del control positivo fue necesario tomar 3 controles positivos adquiridos en diferente fecha y se hizo una mezcla compuesta tomando 10 µL de cada uno de los controles hasta obtener un volumen 30 µL. Este fue aforado con PBS 1 X hasta un volumen final de 1 mL. Después se procedió a realizar la prueba de inmunofluorescencia descrita en el ICR Microbial Laboratory Manual. El filtro fue analizado en microscopio de epifluorescencia haciendo un barrido completo para determinar la concentración de quistes de Giardia lamblia y ooquistes de Cryptosporidium parvum. El resultado obtenido se tomó como patrón para realizar las pruebas de recuperación después de haber procesado el filtro 29 3.3.2 Evaluación de elución del filtro. En una hielera previamente lavada, se llenó hasta un volumen de aproximadamente 112.666 L de agua de grifo, eliminando el cloro por medio de adición de tiosulfato de sodio Na2S2O3, este se dejo actuar por un tiempo aproximado de 15 minutos. Después de este paso el agua fue inoculada con 1.36 mL de control positivo del kit de inmunoflorescencia. Una vez preparada la muestra de agua inoculada, esta fue procesada de acuerdo con el procedimiento de anticuerpos fluorescentes descrita en el ICR Microbial Laboratory Manual (Shay et al., 1990). Se tomaron de 3 litros del efluente, 1 litro del influente y 3 litros del sobrenadante obtenido después de la etapa de concentración de la muestra. A estas muestras se les da el mismo tratamiento. Este procedimiento se llevó a cabo por triplicado 3.4 Análisis de la muestra Las muestras fueron procesadas de acuerdo con el procedimiento de anticuerpos fluorescentes descrita en el ICR Microbial Laboratory Manual (Shay et al., 1990). Esta metodología consta de 4 fases: recolección de la muestra, elución de filtro, flotación y purificación del sedimento, prueba de inmunofluorescencia. 30 3.4.1 Recolección de la muestra Para la recolección de muestras de agua que no presenten señales evidentes de contaminación (por ejemplo: agua potable, lago, laguna, río, canal, entre otras) fue necesario concentrar (filtrar) un volumen considerable de agua, según sea el caso, este puede ser entre 100 y 500 litros. Para este fin fue necesario emplear un equipo de bombeo que consta de mangueras, conectores, portafiltro, medidor de agua y una bomba. Además de un filtro especial para parásitos. En la figura 7 se observa el equipo empleado para la toma de muestra. Figura 7. Equipo necesario para la toma de muestra El procedimiento a seguir fue el siguiente: Se conectó el equipo de bombeo, se colocó el filtro para parásitos en el portafiltros y revisó el medidor de agua, se encendió la bomba y se filtraron entre 100 y 121 litros de agua. Una vez terminada la etapa de filtrado se desconectó el equipo de bombeo y se abrió el portafiltro, asépticamente se remueve el filtro y transfiere a una bolsa Ziploc (incluida el agua que quedó en el portafiltro). Se etiqueta la bolsa con la fecha, lugar y volumen de agua filtrado, se refrigeró a una temperatura entre los 2 y 5 ºC. El filtro se eluyó antes de 96 horas después de la recolección de la muestra. Es importante que durante este procedimiento se utilice bata y guantes de látex 31 Para la recolección de muestras de agua que presenten signos de contaminación evidente (por ejemplo: aguas residuales, aguas residuales tratadas, y de dren, entre otras) no fue necesario concentrar o filtrar la muestra. Se tomó una cantidad de 1litro en un recipiente estéril y se enjuagó por fuera con agua potable, se etiquetó con la fecha lugar y el volumen muestreado, se refrigeró a una temperatura entre los 2 y 5 º C y se analizó en las primeras 8 horas después de su recolección. 3.4.2 Elución del filtro El procedimiento que se siguió para eluir, o lavar, el filtro es el siguiente: se extrajo asépticamente el filtro de la bolsa ziploc y fue colocado en una charola de plástico limpia (se incluyó el agua que haya quedado en la bolsa y los residuos que hayan podido quedar el ella se enjuagaron con solución de elusión). Se le realizó un corte longitudinal con la ayuda de una navaja y se separaron las hebras en tres partes iguales, separando de acuerdo a su limpieza. Esta etapa se observa en la figura numero 8 Figura 8. Elución de filtro 32 Se tomaron 4 litros de solución de elución y se dividieron en tres recipientes de 4 litros. Se lavó a mano y se tallaron las hebras del filtro haciéndolas pasar por cada uno de los tres recipientes que contienen solución de elución (durar 5 min. en cada uno) hasta que las hebras estén totalmente limpias. Iniciando a lavar las fibras que estén menos sucias y terminar con las que estén más sucias. Se depositan de nuevo las fibras, una vez limpias, en la bolsa Ziploc y se descartaron. La charola en la cual se corta el filtro se lavó con solución de elución y se incorporó al líquido de los lavados. El líquido de lavado se centrifugó en recipientes de 750 mL a 3500 rpm durante 10 minutos. Fue absorbido y descartado el sobrenadante, para combinar los sedimentos y posteriormente concentrarlos en un tubo de centrífuga limpio de 50 mL, usando para esto solución de elución. Se tomó nota del volumen de sedimento (pellet) y se resuspendió en un volumen igual con solución de formalina al 10% anotando el nuevo del pellet. En caso de ser una muestra directa se le da el mismo tratamiento omitiendo la etapa de corte y lavado del filtro. 3.4.3 Flotación y purificación del sedimento El pellet obtenido, se sometió a la flotación, se recomienda que este no deberá exceder de 0.5 mL /1mL formalina 10%.El procedimiento a seguir es el siguiente: Resuspender el pellet y transferirlo a un tubo de centrifuga limpio de 50 mL usando para ello 5 mL de solución de elución. Se adicionó solución de elución hasta un volumen final de 20 mL y agitar en vortex por 1 minuto. A la mezcla se le agregaron 30 ml de percoll – sacarosa (sp. gr. 1.10) esta solución deberá depositarse en el fondo del tubo con una pipeta de 50 mL previamente enjuagada con solución de elución. Después de agregarle la solución se centrifugó la 33 muestra a 2800 rpm por 10 min. Se colectaron los primeros 20 mL de la parte superior del tubo y 5 mL de la interfase con una pipeta previamente enjuagada con solución de elución. La muestra se colocó en un tubo de centrifuga limpio de 50 mL y ajustar hasta la marca de 50 mL con solución de elución. Nuevamente es centrifugado a 2800 rpm por 10 minutos, se aspiró el sobrenadante hasta dejar 5 mL de solución por encima del nuevo pellet y por último se etiquetó la muestra anotando el volumen del nuevo pellet y volumen final en el que fue resuspendido. En la figura 9 se observa el producto de la flotación y purificación del sedimento. La muestra se conserva en refrigeración a una temperatura entre los 2 y 5º C. Fue necesario llevar a cabo la prueba de inmunofluorescencia dentro de los siguientes 5 días después de la flotación. Figura 9. Flotación y purificación del sedimento 3.4.4 Prueba de inmunoflorescencia Antes de iniciar con esta prueba es necesario poner los reactivos a temperatura ambiente (PBS 1X, BSA 1%, Kit de inmunoflorescencia, DABCO-glicerol y las series de etanol-glicerol). Se desinfectaron con cloro al 10% los soportes y los pesos del manifold y se trataron posteriormente con una solución diluida de tiosulfato de sodio Na2S2O3, se enjuagaron con agua destilada y se secaron. 34 Se conectó el manifold a la bomba de vacío y fue necesario enjuagar cada depósito con 2 mL de PBS 1X y se colocaron los filtros en los depósitos, posteriormente poner los pesos sobre los filtros. Fue necesario ajustar la presión de vacío, evitando que excediera de 2-4 In Hg., cada membrana se lavo con 2 mL de PBS 1X drenando y seguido de 2 mL de BSA 1% y se drenó. Se homogenizaron las muestras flotadas (en vortex) y fueron filtradas de 30 a 40 µL sobre las membranas. Control positivo = 1mL PBS 1X y 100 µL del control positivo del kit. Control negativo = 1mL PBS 1 X. Se Lavó cada membrana con 2 mL de BSA 1% y se drenó. Las llaves de paso del manifold se cerraron y la bomba de vacío se apago. Se adicionaron 0.5 mL del anticuerpo a cada muestra y estas se cubrieron y pusieron a incubar por 25 min. Se puso 1 gota de DABCO-glicerol sobre un portaobjetos y se e incubaron por 20 minutos a 37º C. Una vez pasado el tiempo de incubación se drenó el exceso de anticuerpo y se lavo cada membrana con 10 mL de PBS 1 X. Posteriormente se enjuagaron con 1 mL. de las series de etanol-glicerol. Empezando con la de 10% y terminando con la de 95% de etanol teniendo cuidado de drenar el etanol completamente entre diluciones. Esta etapa se observa en la figura 10. Figura 10. Prueba de inmunofluorescencia 35 Se removieron manualmente los pesos y fueron colocados los filtros sobre los portaobjetos correspondientes previamente etiquetados e incubados usando para esto diferentes pinzas estériles. Una vez colocado el filtro sobre el portaobjeto se adicionó 1 gota de DABCO-glicerol sobre las membranas. Una vez que las membranas se observaron claras se cubren con un cubreobjetos limpio y se sellan por las orillas con esmalte para uñas, de preferencia transparente. Las muestras se colocaron en refrigeración y se leyó en el microscopio de epifluorescencia dentro de los siguientes 5 días. IV RESULTADOS Y DISCUSIÓN 4.1 Eficiencia de la técnica de inmunofluorescencia La eficiencia obtenida de la técnica de inmunofluorescencia fue de 36% de recuperación para quistes de Giardia lamblia y 32% para ooquistes de Cryptosporidium parvum. Los cuales resultaron ser más elevados que las reportadas comparadas con las reportadas por Hansen y Ongerth (1991) con eficiencia de 26.2 %, y los encontrados por Rose et al. (1991) fueron de 29 a 58 % y fueron iguales que los porcentajes de recuperación presentados por Hutton et al. (1995) que señalan una eficiencia promedio de 33%. Mientras que para quistes de Giardia lamblia este valor fue mas bajo que el presentado por LeChevallier (1991) el cual obtuvo un 68.6% de recuperación. Este porcentaje de eficiencia no se tomó en cuenta en el análisis de los resultados y se utilizaron los datos obtenidos sólo como una referencia. 4.2 Concentración de quistes y ooquistes de Giardia lamblia y Cryptosporidium parvum, en el periodo enero-abril 2006. A continuación se presentan los resultados de los monitoreos realizados durante el periodo enero mayo 2006, correspondientes a Punto 1, 2, 3 y 7 respectivamente, la ubicación de estos puntos ha sido señalados en la figura No. 6. 37 La tabla 4 corresponde a los resultados obtenidos durante el monitoreo en los cuales no se involucró mezcla de agua, y la tabla 5 corresponde aquellos en los cuales se involucró la mezcla de agua residual tratada con agua del canal principal bajo. En la figura número 10 se observan los quistes de G. lamblia y ooquistes de C. parvum visto a traes de microscopio de epifluorescencia Tabla 4. Monitoreo sin mezcla de agua residual tratada PUNTO 1 Fecha [ ] quistes Considerando [ ] Ooquistes C. Considerando muestreo G. lamblia/l parvum/l recuperación de 36% recuperación de 33% 11-Ene-06 8586 23849 239 724 25-Ene-06 621 1725 71 215 PUNTO 2 Fecha [ ] quistes Considerando [ ] Ooquistes de Considerando muestreo G lamblia /l recuperación C. parvum /l recuperación de 36% de 33% 11 Ene 06 287 797 72 218 13Feb 06 22,875 63542 1125 3409 28 Feb 06 174 483 70 212 PUNTO 7 Fecha [ ] Quistes Considerando [ ]Ooquistes de Considerando muestreo G lamblia/ l recuperación C parvum / l recuperación de 36% de 33% 25 Ene 06 49 139 <2500 <7576 13 Feb 06 188 522 113 342 28 Feb 06 192 533 48 145 38 Tabla 5. Monitoreo mezcla agua residual tratada con agua de canal principal bajo PUNTO 1 Fecha [ ] Quistes Considerando [ ] Ooquistes Considerando muestreo G lamblia/ l C parvum / l recuperación recuperación de 36% de 33% 14 mar 06 12,500 12,500 <1389 <1389 29 mar 06 12, 500 12,500 6,250 6250 18 abril 06 26,666 74072 4444 4444 PUNTO 3 Fecha [ ] Quistes Considerando [ ]Ooquistes de Considerando muestreo G lamblia/ l C parvum / l recuperación recuperación de 36% de 33% 14 mar 06 122 339 17 52 29 mar 06 88 244 <22 <67 18 abril 06 28 78 6 18 PUNTO 7 Fecha [ ] Quistes Considerando [ ]Ooquistes de Considerando muestreo G lamblia/ l C parvum / l recuperación de recuperación de 36% 33% 14 mar 06 117 325 <39 <118 29 mar 06 25 69 8 24 a b Figura 11. A) Quistes de G. lamblia y B) Ooquistes de C. parvum visto a través de microscopio de epifluorescencia. Fuente: Río Grande Basin Initiative (2005) 39 En los tratamientos tradicionales de agua residual, en la etapa de desinfección un medio eficiente para la prevención de enfermedades transmitidas vía hídrica es el cloro, este es el agente más utilizado, presentando eficiencia para la inactivación de organismos coliformes, sin embargo no lo es para los parásitos protozoarios Giardia lamblia y Cryptosporidium parvum. Aunado a esto, se presentan la dificultad de remoción por filtración de estos parásitos, ya que los ooquistes de Criptosporidium poseen la habilidad de cambiar de forma y pueden pasar a través de poros más pequeños que su tamaño (5µm). Esta propiedad también es atribuida a quistes de Giardia (Mayer 1996). Una instalación de tratamiento de agua adecuadamente operada debería de ser capaz de remocionar e inactivación del 99.9% de quistes y 99.99 % de ooquistes (Enviroment Protection Agency (EPA) 2002). En los resultados obtenidos se puede constatar que el efluente de la planta de tratamientos (punto 1) presenta concentraciones de aproximadamente de 1.2175E+03 quistes de giardia/100 Criptosporidium/100 mL, estos datos mL y 2.908E+02 ooquistes de concuerdan con los expresados según Gortares et al. (2003) en donde la concentración para quistes de giardia es de 1.2E+03/100 mL y 3.9E+01. Los resultados obtenidos en los muestreos en donde no se involucró la mezcla de agua, la media para punto 2 fue de 2.3E+01/100 mL para quistes de G. lamblia 7.1/100 mL para Ooquistes de C. parvum. Para el punto 7 fue de 1.43E+01 para quistes de giardia y de 8.1/100 mL para ooquistes de criptosporidium. Por otra parte aquellos resultados en donde se involucra la mezcla de agua en el punto 3 los resultados fueron 7.9/100 mL para quistes de G. lamlia y 1.2/100 ml para ooquistes de C. parvum, 8.1/100 ml para quistes de giardia y 0.8/100 ml para ooquistes de criptosporidium, estos últimos corresponden al punto 7. Estos resultados reflejan que la concentración tanto para quistes de giardia y ooquistes de criptosporodium no aumentó al involucrarse la mezcla de agua residual con agua del canal principal bajo. 40 En la tabla 4 y 5 los resultados correspondientes a las fechas 13 de febrero 2006 punto 2 y 29 de marzo 2006 punto 7, presentaron variación tanto en forma como tamaño, así como una deficiente tinción del anticuerpo, por lo cual se la prueba inmunológica se realizó por duplicado, sin embargo los resultados obtenidos fueron los mismos. Estos datos no se tomaron en cuenta para determinar las medias tanto quistes como para ooquistes. Este problema se considera que fue causado por interferencia con partículas como son: arcilla, arena, algas y restos de microorganismos, algunos de estos objetos exhiben una fluorescencia verde similar a la fluorescencia para G. lamblia y C. parvum después de ser marcadas por los reactivos de la prueba de inmunofluorescencia. En estudios realizados por Rodgers et al. (1995) se analizaron 54 especies de algas, y se encontró que 24 de ellas exhiben fluorescencia verde no específica. Los protozoarios Giardia y Criptosporidium son de preocupación específica en la reutilización de las aguas residuales, ya que el riesgo de la infección puede ser 10 a 1000 mayor que para las bacterias en un nivel similar de la exposición (Rose et al., 1991). Estos organismos son altamente infecciosos, una ingestión de 10 quistes de Giardia (Adam 1991) y 30 ooquistes de Criptosporidium (DuPont 1995) pueden resultar una infección en el ser humano. Las concentraciones anteriormente mencionadas sobrepasan esta dosis infectiva. No obstante, es necesario hacer énfasis en que para que la infección se lleve a cabo, es necesario que los quistes y ooquistes ingeridos sean viables, es decir se encuentren en un estado infeccioso. En las pruebas realizadas únicamente se determinó la presencia de estos microorganismos. Por lo que no se puede dictaminar cual es el riesgo de infección que estos parásitos presentan. 41 4.3 Fuentes de variación durante el muestro y procesamiento de la muestra La fuentes de variación que se presentaron durante el análisis fue la elevada turbidez del agua; esta tiene una repercusión que se ve reflejada directamente en el tiempo empleado para la elución del filtro así como en el volumen total del pellet obtenido. Debido a que se recomienda que el volumen del pellet no exceda de 0.5 mL, sin embargo, los volúmenes obtenidos fluctuaron entre los 5 – 20 mL, por lo cual fue necesario dividir el volumen del pellet en varias muestras para facilitar la flotación. Otro problema que se presentó fue la dificultad de leer estas muestras bajo el microscopio de epifluoresencia, debido a la interferencia ocasionada por las partículas algas, arcilla, arena, etc. Por lo tanto, durante la prueba de inmunofluorescencia, fue necesario distribuir homogéneamente la muestra en el filtro de nitrocelulosa. Para aquellas muestras en donde la turbidez del pellet obtenido era elevada, en la etapa de los lavados con la serie de etanol glicerol, se optó por disgregar las partículas succionando parte del la solución y volviéndola a depositar aplicando una mayor fuerza de expulsión. Esto dio como resultado muestras homogéneas eliminando así dificultad para la lectura del filtro. VI CONCLUSIÓN Y RECOMENDACIONES • Se detectaron quistes de giardia en un 100% de las 17 muestras analizadas y un 76 % para ooquistes de Cryptosporidium parvum. • El porcentaje de recuperación de la técnica fue de 36% para quistes de Giardia lamblia y 33% para ooquistes de Cryptosporidium parvum. • Las fuentes de variaciones presentadas durante el muestreo y procesamiento de la muestra son atribuidas a la turbidez que presentaron las muestras de agua, lo cual dificultó el análisis de las mismas. • En base a los resultados obtenidos no se puede hacer una afirmación sobre el reuso del agua residual tratada para riego agrícola, ya que solo se aportaron datos para establecer un modelo que mida el riesgo que implica su reutilización. • Se recomiendan estudios posteriores en donde se determine la viabilidad de quistes de G. lamblia y ooquistes de C. parvum. VII BIBLIOGRAFÍA Adam, R. D. 1991. The biology of Giardia spp. Microbiol. Rev. 55:706–732. Aguiar P. P., Rodríguez F., Cepero M. y José A. Agua y Salud (sd, s.f) (Ver www.bvs.sld.cu/uats/rtv_files/rtv0298.htm) Campos. C. (1999). “Indicadores de contaminación fecal en la reutilización de aguas residuales para riego agrícola”. Tesis doctoral. Facultad de Biología. Universidad de Barcelona. 250 pp. (Ver http://tierra.rediris.es/hidrored/ebooks/ripda/pdfs/Capitulo_20.pdf) Casemore D. (1990). Epidemiological aspects of human cryptosporidiosis. Epidemiol. Infect. 104 1-28. Cavalier and Smith(2000) Achten Sie bitte auf kleinste Symptome. (ver www.zooundco.de/zooundco3/ artikel.php?id=artikel6) Center Disease Control (CDC) (2002) Parasite disease information (Ver http://www.cdc.gov/Ncidod/dpd/parasites/giardiasis/factsht_giardia.htm) Dawson D. T., Campden y Chorleywood. 2004. Foodborne protozoan parasites. 2004. International Journal of Food Microbiology 103 (2005) 207– 227. DPDx (2003) Parasite Image Library (ver http://pathmicro.med.sc.edu/parasitology/intest-protozoa.htm) 44 Díaz C. M. Leyva E., Mata V. y Gonzáles R. 2003. Incidencia y viabilidad de Cryptosporidium parvum en el agua potable de Ciudad Obregón, Sonora, México. Revista internacional de contaminación ambiental. 19(002):67-72 DuPont, H. L., Chappell C. Sterling C, Okhuysen P, Rose J, and Jakubowski W (1995). The infectivity of Cryptosporidium parvum in healthy volunteers. N. Engl. J. Med. 332:855–859 EPA (2002) List of Contaminants & their MCLs Ver(http://www.epa.gov/safewater/mcl.html#mcls) Gortares- Moroyoqui P., L. Castro-Espinoza, J.E. Naranjo, F. Manshadi, C. P. Gerba; M.M. Karpiscak y R.J. Freitas. Recycling Municipal Treated Wastewater for Crop Irrigation 4th International Symposium on wastewater reclamation and reuse, Nov 12-14 2003. Haas, C.N., Hornberger, J., Ammangandla, U., Heath, M., and Jacangelo, J.G. 1994. A volumetric method for assessing Giardia inactivation. J. AWWA, 86:2:115120. Hansen J. y Ongerth J. (1991). Effects of time and watershed characteristics on the concentration of Cryptosporidium oocysts in river water. Appl. Environ. Microbiol. 57, 2790-2795. Hutton P., Ashbolt N., Vesey G., Walker J. y Ongerth J. (1995). Cryptosporidium and Giardia in the aquatic environment of Sydney Australia. En: Protozoan parasites and water (W. B. Betts, D. Casemore, C. Fricker, H. Smith, J. Watkins EdS.). The Royal Society of Chemistry. Cambridge, Inglaterra. pp.71-75. LeChevallier M. W., Norton W., and Lee R. (1991). Occurrence of Giardia and Cryptosporidium spp. in surface water supplies. Appl. Environ.Microbiol. 57:2610–2616. 45 LeChevallier M. W., Norton W., and Lee R. (1991). Evaluation of a method to detect Giardia and Cryptosporidium in water, p. 483–498. In J. R. Hall and G. D. Glysson (ed.), Monitoring water in the 1990s: meeting new challenges. American Society for Testing and Materials, Philadelphia, Pa. Lechevallier M. W. Norton W., Siegel J y Abbaszadegan M. 1994. Evaluation of the Immunofluorescence procedure for detection of Giardia Cysts and Cryptosporidium oocysts in water. Applied and environmental microbiology. 61(2): 690–697 Marshall M. M, Naumovitz D, Ortega Y and Sterling C. (1997). Waterborne protozoan pathogens. Clinical MicrobiologyReviews, 10:67–85. Ver (http://cmr.asm.org/cgi/reprint/10/1/67) Mayer C. L. y Palmer C. 1996. Evaluation of PCR, Nested PCR, and Fluorescent antibodies for detection of Giardia and Cryptosporidium Species in wastewater. Applied and environmental microbiology. 62(6): 2081–2085 Ottoson J (2005). Comparative analysis of pathogen occurrence in wastewater : management strategies for barrier function and microbial control. (Ver http://urn.kb.se/resolve?urn=urn:nbn:se:kth:diva-233 ) Ortega y Airola 20005. Calidad microbiológica del agua del canal bajo al mezclarse con el efluente de la planta sur de tratamiento de aguas. Tesis de ingeniero Biotecnólogo. Instituto Tecnológico de Sonora México. pp 3, 32 Prescott L. M. Harley J. y Klein D., (2000).Microbiología.Agud A. J., Gomez J. Nuñez O. y Terán E. Cuarta edición MC GRAW HILL INTERAMERICANA. España. pp 910 y 911 Rentdorff, R.C., 1954. The experimental transmission of human intestinal protozoan parasites: II. Giardia lamblia cysts given in capsules. American Journal of Hygiene 59, 209–220. 46 Rio Grande Basin Initiative (2005). Cooperative State Research, Education, and Extension Service, U.S. Department of Agriculture (Ver: http://riogrande.tamu.edu/photos_task6.php) Robertson, L.J., Campbell, A.T., Smith, H.V., 1992. Survival of Cryptosporidium parvum oocysts under various environmental pressures. Applied and Environmental Microbiology 58, 3494–3500. Rodgers M. R., Flanigan D. y Jakubowski W. (1995) Identification of Algae Which Interfere with the Detection of Giardia Cysts and Cryptosporidium Oocysts and a Method for Alleviating This Interference. Applied and environmental microbiology. 61(10): 3759–3763 Rose J.B., Haas C., and Regli S. (1991). Risk assessment and control of waterborne giardiasis. Am. J. Public Health, 81(6): 709-13. Rose J. B., Landeen L, Riley K., y Gerba C. (1989) Evaluation of Immunofluorescence techniques for Detection of Cryptosporidium Oocysts and Giardia Cysts from Environmental Samples. Applied and environmental microbiology. 55(12):3189-3196 Salvatella R y Hortal M. 1998. El desafío de las enfermedades emergentes y reemergentes. Rev Med Uruguay; 14: 34-48. Santos U. L, Bonarri T., Cantusio N. y FRANCO R .2004. Occurrence of Giardia cysts and Cryptosporidium oocysts in activated sludge samples in Campinas, sp, Brazil. Rev. Inst. Med. trop. 46(6):309-313, (Ver: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S003646652004000600003) Secretaria de Medio ambiente, y Recursos naturales (SEMARNAT). 2006. NOM 003-SEMARNAT-1997. Que establece los límites máximos permisibles de 47 contaminantes para las aguas residuales tratadas qie se reusen en el servicio público. Ver (http://portal.semarnat.gob.mx/semarnat/portal/!ut/p/kcxml/) Vilanova Silvia 2003. Evaluación de las aguas comercializadas y consumidas en la Ciudad de Buenos Aires. Revista de la Maestría en Salud Pública de la UBA N °2, (ver http://maestria.rec.uba.ar/Dos/Eval.aguas.pdf)