descargar documento
Anuncio

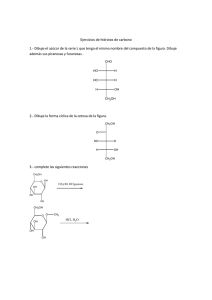
TEMA 5: CARBOHIDRATOS PARTE 2 Las estructuras piranósicas de los azúcares pueden ser ancladas mediante la formación de acetales Síntesis de Fisher (1893) mayoritario Reacciones sobre monosacáridos 1. Reducción Obtención de alditoles Reacciones sobre monosacáridos 2. Oxidación 2.1 Obtención de ácidos aldáricos COOH CHO H H OH HO H H OH H OH CH2OH D-glucosa HNO3 dil 55-60 ºC HO OH H H OH H OH COOH ácido D-glucárico Reacciones sobre monosacáridos 2. Oxidación 2.2 Obtención de ácidos aldónicos: Oxidación con agua de bromo CHO COOH HO H HO H Br2, H2 O OH CaCO3 H HO H HO H H OH H OH pH 5-6 H OH CH2 OH D-manosa CH2OH D-manónico 75% Reacciones sobre monosacáridos Interpretación mecanística: Oxidación con agua de bromo Observaciones empíricas: •El anómero ecuatorial oxida más rápido que el axial •La velocidad relativa depende del pH y la concentración de bromo •Las 2-desoxialdopiranosas se oxidan más rápidamente OH OH O OH HO HO OH H Br:Br Ordenamiento antiperiplanar del par n con respecto al enlace C1-H O H HO HO OH OH Br:Br Reacciones sobre monosacáridos Interpretación mecanística: Oxidación con agua de bromo OH OH OH O OH HO HO O HO HO OH H O HO HO OH OH OH Br:Br OH OH O HO HO O H Br OH HBr OH HO HO O D-glucono-1 5-lactona O OH Una aldonolactona Reacciones sobre monosacáridos Interpretación mecanística 2: Oxidación con agua de bromo OH OH Br Br : Br O O HO HO O HO HO H OH H O H OH H lenta Br OH Br O O HO HO OH H OH HO HO O O OH Reacciones sobre monosacáridos 2. Oxidación 2.3 Ruptura oxidativa de dioles vecinales: Reacción de Malaprade Agente oxidante: Metaperiodato de sodio IO4- H5IO6 +H+ -H+ + 2 H2O H4IO 6- H3IO6= + H+ Reacciones sobre monosacáridos Ruptura oxidativa de dioles vecinales: Reacción de Malaprade Ejemplos de reacción R H 1 OH H IO4 + - OH O HC + H2O O HC + R H3IO4 + R' R' R 2 H OH IO4- + O O H2O HC + HO O C + R H3IO 4 + R' R' R 3 H OH O + IO4- O H2O + HC R H + HO C H O + H3 IO4 Reacciones sobre monosacáridos Ruptura oxidativa de dioles vecinales: Reacción de Malaprade Interpretación mecanística R R OH H H OH H OH + H5IO6 2 H2O + O OH I H O OH O R R O HC + R O HC R H3IO4 Reacciones sobre monosacáridos Ruptura oxidativa de dioles vecinales: Reacción de Malaprade OH OH OH MeOH/ H+ O OH HO HO O OH HO HO HO HO OH O OH H OH H H O CH3 OH O H O O + O H C HO O CH3 Reacciones sobre monosacáridos Ruptura oxidativa de dioles vecinales: Reacción de Malaprade OH OH OH HO OH MeOH/ H+ HO O OH O OCH 3 OH OH O O O OCH3 + O H C H O Reacciones sobre monosacáridos 2. Oxidación 2.3 Obtención de ácidos aldónicos: Reacción de Tollens Reacciones sobre monosacáridos 2. Oxidación 2.3 Obtención de ácidos aldónicos: Reacción de Fehling CHO H HO COOH OH H H Cu++ H OH HO- , H2O H OH CH2OH HO OH H + Cu2O H OH H OH CH2OH Reacciones sobre monosacáridos 3. Condensación del carbonilo con derivados de aminas: Obtención osazonas CHO HO HC H2N H 3 HO HN H H OH H OH CH2OH D-Glucosa HO N NH Ph N NH Ph H AcONa H2N NH3 H OH H OH CH2OH Reacciones sobre monosacáridos 3. Condensación del carbonilo con derivados de aminas: Obtención osazonas HN NH2 O H HN HN C H N H C H OH H H HO NH CH O H O HO H OH H OH H Reoardenamiento de Amadoris HO H R CH2OH R Glucosa fenilhidrazona Reacciones sobre monosacáridos 3. Condensación del carbonilo con derivados de aminas: Obtención osazonas HN H HN HN H H NH NH NH CH CH CH O N N H2N HO N H H HO HO H H R R R HN HN H H H H N N H H R R HN H N H C NH NH C C HO HO N N H H H NH CH N N N H H HO H ó N H NH HO H R R Reacciones sobre monosacáridos 3. Condensación del carbonilo con derivados de aminas: Obtención osazonas H N H C H2N N + N H N H HO H R NH3 HN H N C N HO H R N H Osazona Reacciones sobre monosacáridos 3. Condensación del carbonilo con derivados de aminas: Obtención osazonas La reacción se detiene al llegar al C-2 Evidencia experimental: Ph Ph CHO H HO N N N H H OH H H OH H OH Ph + H2N N CH3 α−metilfenilhidrazina CH2 OH C1 H N N C C22 H Ph Ph H H C C33 H H HC O O R R H H Se estabiliza por formación de puente de H con el C3-OH HC Ph CH3 Ph CH3 N N N N N N N N N N N CH3 Ph CH3 Ph CH3 Ph N Ph CH3 Reacciones sobre monosacáridos 3. Condensación del carbonilo con derivados de aminas: Obtención osazonas CHO H HO HC OH Ph N NH Ph CHO HO H HO H H OH H H NH H HO H N H OH H OH OH OH H OH CH2 OH CH2OH CH2OH D-Glucosa D-Manosa CH2 OH O HO H H OH H OH CH2 OH D-Fructosa Reacciones sobre monosacáridos 4. Formación de esteres Acetilación Condiciones: Ac2O/py 20ºC, 12h. CH3COCl/py 25ºC, 16h. Reacciones sobre monosacáridos 4. Formación de esteres Acetilación Remoción: Transesterificación por disolución del acetato en metanol con Naº, reacción rápida y cuantitativa. KHCO3/ MeOH/H2O, 20ºC, 1d. 50%NH3/MeOH, 20ºC, 2,5h. El acetato sobre el C-anomérico es más fácil de remover. Se pueden emplear condiciones más suaves para su desprotección selectiva en medio básico Acilación y desacilación selectiva con lipasas Reacciones sobre monosacáridos 4. Formación de esteres Benzolilación Los benzoatos son grupos protectores interesantes: •Dan derivados que cristalizan (muy útiles para realizar determinaciones cristalográficas por RX (Se usan los 4-bromobenzoatos) Preparación: Cloruro de benzoílo en piridina (18ºC 2d) Remoción: 1%NaOH/MeOH (más estable que los acetatos 20ºC, 50 min.) Reacciones sobre monosacáridos 4. Formación de eteres Permetilación Métodos de permetilación •Sulfato de metilo/NaOH •Ioduro de metilo /Ag2O o Ioduro de metilo/N,N-DMF •Método de Hakamori (NaH/DMSO/MeI) OH HO HO HO HO O OCH3 OCH 3 O OH H3C O S O CH3 , NaOH CH3 I, Ag O 2O, MeOH O OH OH H33CO CO H H33CO CO OO OCH 3 OCH OH OH CH 3OSO3 Na, H2 O 3 OCH3 OCH 3 1,2,3,4,6-penta-O-metil-D-glucopiranosa Reacciones sobre monosacáridos 4. Formación de eteres Permetilación O O Método de Hakamori (NaH/DMSO/MeI) H3 C S NaH CH3 O H3 C S O O CH2 O H2 O OH H3 C O HO HO OH - OO S O O CH2 OO -- OO -- - OO OO - OO OH H3C I OCH3 H3 CO H 3CO O OCH3 OCH3 Na Reacciones sobre monosacáridos 4. Formación de eteres Trimetilsililéteres Los reactivos utilizados como dadores del grupo TMS, responden a la formulación general (CH3)3Si-X, por ejemplo: trimetilclorosilano (TMCS) (CH3)3SiCl, hexametildisilazano (HMDS) (CH3)3SiNHSi(CH3)3, C2H5-OH + (CH3)3SiCl C2H5OSi(CH3)3 + HCl Mecanismo de la reacción de sililación En solventes no polares o poco polares, el mecanismo corresponde a una SN2 δ+ H-Y + Me3Si-X Me Me δ− X Y Si H Me Y-SiMe 3 + H-X Reacciones sobre monosacáridos 4. Formación de eteres Trimetilsililéteres Catálisis básica Puede interpretarse como la remoción de un protón según el esquema δ+ B Me Me δ− X Y Si H Me o en el caso extremo que H-Y sea un fenol o ácido carboxílico: H-Y + B - Y- + Me 3Si-X X- + H-B Y - + H-B δ− Me Me δ− X Y Si Me Y-SiMe 3 + X- H-X + B - Reacciones sobre monosacáridos 4. Formación de eteres Trimetilsililéteres Catálisis ácida Para dadores de TMS como es el caso del HMDS, se observa un efecto catalítico producido por ácidos según: Me3Si-X + H + H-Y + + Me 3SiXH + Y-SiMe 3 H + Me-Si-XH δ+ Me Me δ+ XH Y Si H Me H+ + Y-SiMe 3 + Y-SiMe 3 + HX H Reacciones sobre monosacáridos 4. Formación de eteres Trimetilsililéteres OSi(CH3)3 OH HO HO TMCS/HMDS/py O OH OH 20ºC, 5 min (H3C)3SiO (H3C)3SiO O OSi(CH3) 3 OSi(CH3)3 Para el caso del HMDS la reacción es catalizada por ácidos y para TMCS por bases, existiendo la posibilidad del sistema HMDS + TMCS, que es de tipo autocatalítico. El uso de piridina en reacciones de sililación cumple un rol de solvente más que de catalizador, aceptándose para ella una función de solvatación de Me3SiX con la consiguiente debilitación del enlace Si-X. Reacciones sobre monosacáridos 4. Formación de eteres Tritiléteres N C Cl C Un ión carbonio buen agente alquilante Selectivo por su tamaño Cl Catión tritilo H C O O C H R R En condiciones suaves se puede lograr tritilación selectiva de alcoholes primarios CH2OC(PH)3 OH Ph3CCl/4 -N,N-DMAPy/DMF O HO HO OH 25ºC, 12h. O HO HO OH Los tritiléteres son estables a las bases pero sensibles a los ácidos: Remoción: AcOH, 56ºC, 7h OH OH Reacciones sobre monosacáridos 4. Formación de eteres Tritiléteres C Cl N C Un ión carbonio buen agente alquilante Selectivo por su tamaño Cl Catión tritilo H C O O C H R R En condiciones suaves se puede lograr tritilación selectiva de alcoholes primarios CH2OC(PH)3 OH Ph3CCl/4 -N,N-DMAPy/DMF O HO HO OH OH 25ºC, 12h. O HO HO OH OH Reacciones sobre monosacáridos 4. Formación de eteres Benziléteres OBn OH O HO C6H6CH2Cl/NaOH BnO BnO HO 20ºC, 1-3h. OH OCH3 Remoción: H/Pd, EtOH O OCH3 OBn Reacciones sobre monosacáridos 5. Formación de acetales cíclicos H R H R H C R O + O C O H H R' C C C R' O C R' OH O C O H +H 2O O R C H+ O R R O C C C C R' C O C C O R' -H 2O C R' O H H Condiciones para la formación de acetales cíclicos: Estereoquímica estructura anular estabilidad conformacional naturaleza de los compuestos carbonílicos Condiciones de reacción Reacciones sobre monosacáridos 5. Formación de acetales cíclicos Acetales isopropilidénicos o acetónidos: Dioles vecinales cis con acetona en medioácido O HO H3C CH3 + H C +H2 O O H3 C CH3 O HO Desprotección: 1N HCl/THF (1:1) 10ºC OH OH O OH O OH O C H3C CH3 O HO OH OCH3 O OCH3 Reacciones sobre monosacáridos 5. Formación de acetales cíclicos Acetales isopropilidénicos o acetónidos: Dioles vecinales cis con acetona en medioácido HO O O OH HO C OH O H3 C CH3 O HO HO OH OH O OH O +H2O ZnCl2, H3PO 4 OH OH O O 91%rend 1,2,5,6-di-O-isopropiliden-D-glucofuranosa Reacciones sobre monosacáridos Uso de acetales cíclicos O O OH O O OH O H3O+ OCH3 O CH3I/Ag2O O O H HO H3C OH O O O O O O O O OH O O NaBH4 oxidación O O O O O O O O 1,2,5,6-di-O-isopropilides-3ceto-α-D-ribohexofuranosa O OH O D-allo-derivado Reacciones sobre monosacáridos 5. Formación de acetales cíclicos Acetales cíclicos de seis miembros: Reacción de azúcares con benzaldehído H OH C Cl O HO HO O OH ZnCl2 O O O HO OH OH OH 4,6-O-benziliden-D-glucopiranosa 42% rend Esta reacción requiere una unidad 1,3-diol en el azúcar teniendo el -CH2OH libre rotación de modo que puede dar una conformación silla OH O OH O OH C H Ph Esta también es una relación 1,3-diol pero al tener los grupos un ordenamiento 1,3diecuatorial no puede formarse el acetal puenteándose con un carbono Reacciones sobre monosacáridos Cambiando la longitud de cadena Degradación de Ruff Reacciones sobre monosacáridos Síntesis de Killiani-Fischer Cambiando la longitud de cadena Reacciones sobre monosacáridos Isomerización catalizada por bases En medio básico cetosas y aldosas se equilibran para dar mezclas de azúcares CHO H CHO OH HO H H Ca(OH)2 0.035N HO CHO CH2OH OH HO H H HO H O HO H H OH H OH H OH H OH H OH H OH H OH H OH CH2OH D-glucosa CH2OH CH2OH CH2OH D-glucosa 63-67% D-manosa 0,8-2,4% D-fructosa 29-31% Reacciones sobre monosacáridos Isomerización catalizada por bases En medio básico cetosas y aldosas se equilibran para dar mezclas de azúcares H HO- CHO H OH HO H H H OH OH CH2OH O C OH HO CHO H C OH H OH HO H HO H OH H2O H H O HO H HOH H H OH H OH OH OH CH2OH CH2 OH CH2OH D-glucosa HO- H2O CH 2OH O HO H H OH H OH CH 2OH D-fructosa D-manosa Reacciones sobre monosacáridos Formación de derivados de furano en medio ácido En medio furtemente ácido los azúcares deshidratan CHO H OH O HCl 12% HO H O H OH CH2OH H Furfural BIBLIOGRAFÍA -ORGANIC CHEMISTRY. 2da. Edition.G.Marc LOUDON. Editorial Benjamin -ORGANIC CHEMISTRY. J. Mc MURRY. 3ra Edición 1994. Ed Interamericana -QUIMICA ORGANICA. Francis Carey ·3 Edicion 1999. Ed. Mc Graw Hill. -ORGANIC CHEMISTRY J. Clayden, N. Greeves, S. Warren, and P. Wothers, 2000.Oxford University Press. -BIOCHEMISTRY. Lubert STRYER 3 Edition 1998. Ed. Freemon -BIOORGANIC CHEMISTRY Hermann Dugas. 3rd Edition 1996. Springer Verlang -BIOQUÍMICA. D.y J. Voet 1992. Ed. Omega -BIOQUIMICA. Albert L. LEHNINGER. 2da. Ed. Ediciones Omega -PRINCIPIOS DE BIOQUIMICA. Albert L. LEHNINGER. Ediciones Omega -BIOQUIMICA. Mathews, C and Van Holde, K E. Ed. McGraw- Hill Interamericana. Segunda edición. 1998. -QUIMICA ORGANICA. ESTRUCTURA Y FUNCION. Vollhardt, P and Schore, N. Ed. Omega. 3ra Edición, 2000. -CARBOHYDRATES The Sweet Molecules of Life. Robert Stick Academic Press. 2001 Ed.