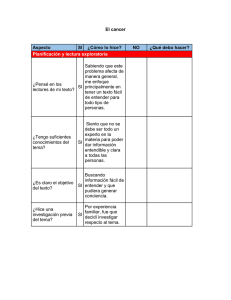
Pautas de Oncología Médica. Diciembre 2009
Anuncio

PAUTAS DE ONCOLOGIA MEDICA PARA EL DIAGNOSTICO, TRATAMIENTO SISTEMICO Y SEGUIMIENTO Cátedra de Oncología Clínica Servicio de Oncología Clínica Hospital de Clínicas Facultad de Medicina Universidad de la República Diciembre 2009 PAUTAS DE ONCOLOGIA MEDICA PARA EL DIAGNOSTICO, TRATAMIENTO SISTEMICO Y SEGUIMIENTO – Incluye actualizaciones 2009- INDICE Página CANCER DE MAMA PRECOZ* 4 CANCER DE MAMA LOCORREGIONALMENTE AVANZADO* CANCER DE MAMA METASTASICO* CANCER DE MAMA: QUIMIOPREVENCION* 12 CANCER DE PULMON CELULAS NO PEQUEÑAS* 34 CANCER DE A PULMON A CELULAS PEQUEÑAS* 46 CANCER DE LARINGE* 51 CANCER DE CAVUM 63 TUMORES NEUROENDOCRINOS* 66 CANCER DE ESOFAGO 83 CANCER GASTRICO 89 CANCER DE COLON Y RECTO* 96 CANCER DE REGION ANAL 107 CARCINOMA DE VIA BILIAR* 110 CANCER DE PANCREAS* 117 CANCER DE ENDOMETRIO 122 CANCER DE CUELLO DE UTERO 130 CANCER DE OVARIO 144 ENFERMEDADES DEL TROFOBLASTO 156 CANCER DE RIÑON* 160 CÁNCER DE PRÓSTATA* 171 TUMORES GERMINALES DE TESTICULO* 180 15 30 1 CANCER DE VEJIGA 191 MELANOMA CUTANEO* 201 SARCOMAS DE PARTES BLANDAS DEL ADULTO 214 SARCOMA DE EWING 221 OSTEOSARCOMA 224 TUMORES PRIMITIVOS DEL SNC Y METASTASIS ENCEFALICAS 230 CANCER DE TIROIDES 236 CUIDADOS PALIATIVOS EN EL PACIENTE ONCOLOGICO 242 ALGORITMO DE MANEJO DE LA NEUTROPENIA FEBRIL 262 * Actualizaciones 2009 2 INTRODUCCION Estas pautas son el resultado del análisis de la evidencia disponible sobre las diferentes opciones de diagnostico, tratamiento y seguimiento del cáncer en sus diferentes localizaciones. Son realizadas por el equipo docente del Servicio de Oncología Clínica de la Facultad de Medicina en conjunto con representantes de equipos oncológicos centros asistenciales públicos y privados de diferentes así como oncólogos residentes en el interior del País. Se trata de recomendaciones para el diagnóstico, tratamiento sistémico y seguimiento basadas en la evidencia disponible y acordes a los estándares internacionales así como a la realidad asistencial nacional. 3 2009 CANCER DE MAMA CÁNCER DE MAMA PRECOZ I) DIAGNÓSTICO Y ESTADIFICACIÓN Diagnóstico positivo Se basa en el examen clínico mamario, la mamografía+/-ecografía mamaria y la certificación cito/histológica. Diagnóstico de extensión lesional y de riesgo de recaída - Anamnesis y examen físico. Anatomía patológica con Hematoxilina y Eosina: tamaño, tipo histológico, grado histológico, márgenes de resección, estado de los ganglios linfáticos axilares. - Determinación del Receptor de Estrógenos (RE) y del Receptor de Progesterona (preferentemente mediante IHQ) - Determinación del estado de HER2/neu mediante IHQ y/o FISH En pacientes con axila negativa, podría considerarse el estudio del perfil de expresión génica mediante OncotypeDx® (puede realizarse en muestra parafinada) o MammaPrint® (requiere tejido fresco), si bien aún no se dispone de los resultados de los estudios clínicos randomizados en curso. - Enzimograma hepático, calcemia, hemograma. Imagenología de tórax y abdomen (RxTx y Ecografía abdominal o TAC de tórax y abdomen). En pacientes con enfermedad estadío I solamente frente a manifestaciones clínicas o alteraciones de laboratorio sugestivas de secundarismo. - Centellograma óseo: en pacientes de alto riesgo (T4 o N2 o dolores óseos o alteraciones de laboratorio sugestivas de metástasis óseas) - Otros estudios: en base a las manifestaciones clínicas y los signos de laboratorio. Estadificación TNM, 7ma ed. 2010 (www.cancerstaging.net). 4 Categorías de riesgo de recaída (St. Gallen 2007). 1- Bajo Riesgo 1.1- Axila Negativa y todos los siguientes factores: pT 2cm (tamaño del tumor invasivo), grado histológico y/o grado nuclear 1, ausencia de invasión vascular extensiva (ausencia de émbolos neoplásicos o presencia en un solo bloque tumoral), edad 35 años, RE y/o RP positivos, ausencia de sobre-expresión o amplificación del gen HER2/neu ). 2- Riesgo Intermedio Axila negativa y al menos uno de los siguientes: pT > 2cm, grado 2.1 histológico y/o nuclear 2-3, presencia de invasión vascular extensiva, edad < 35 años, RE y RP negativos, sobreexpresión o amplificación del gen HER2/neu. 2.2- Axila positiva con 1-3 ganglios comprometidos y todos los siguientes factores: RE y/o RP positivos, ausencia de sobreexpresión o amplificación del gen HER2/neu. 3- Alto Riesgo: 3.1- Axila positiva con 1 a 3 ganglios comprometidos y con RE y RP ausentes o sobreexpresión/amplificación del gen HER2/neu. 3.2- Axila positiva con 4 o mas ganglios comprometidos. Estimación del pronóstico y del beneficio de la quimioterapia y la endocrinoterapia adyuvantes. o Adjuvant! Online (www.adjuvantonline.com) Modelo computarizado, entre cuyas limitaciones cabe destacar que aún no toma en cuenta el estado de HER2 y tampoco el estado del Receptor de Progesterona. o Guía St Gallen 2009. Propone las siguientes indicaciones: Hormonoterapia: enfermedad receptor hormonal positiva Trastuzumab: enfermedad HER2 positiva (>30% de células 5 con tinción completa e intensa) o FISH positiva (>2.2). La evidencia de los estudios clínicos avala su uso en los pacientes que reciben quimioterapia adyuvante (aún no se ha demostrado su utilidad combinado con hormonoterapia sin quimioterapia en pacientes con receptores hormonales positivos). Quimioterapia: - Enfermedad HER2 positiva (combinada con Trastuzumab) - Enfermedad triple negativa - En enfermedad receptor hormonal positiva y HER2 negativa su indicación depende del nivel de riesgo. Indicaciones relativas para asociar quimioterapia a hormonoterapia: niveles bajos de receptores hormonales, grado 3, alta tasa de proliferación (Ki67, frecuencia de mitosis), axila positiva ( 4 ganglios linfáticos comprometidos), presencia de invasión vascular peritumoral, pT>5cm. En aquellos casos en los cuales luego de considerar los marcadores convencionales la indicación de quimioterapia es incierta, puede ser útil la realización de tests multigénicos en caso de estar validados y disponibles. Evaluación del riesgo genético - En pacientes menores de 35 años o con historia familiar de cáncer de mama y/o de ovario evaluar la posibilidad de asesoramiento genético. II) TRATAMIENTO - Tratamiento Adyuvante Sistémico Selección del tratamiento sistémico adyuvante Los principales factores a tomar en cuenta para la selección del tratamiento sistémico adyuvante son los siguientes: 1.- probabilidad de respuesta a la endocrinoterapia 2.- estado menopáusico 3.- riesgo de recaída En cada caso, la selección del tratamiento sistémico adyuvante debe tomar en cuenta los potenciales beneficios, los posibles efectos adversos tomando en cuenta la edad y comorbilidades y la preferencia del paciente adecuadamente informado. 6 Consideraciones generales sobre la adyuvancia sistémica - Cuando deben usarse QT y HT, su uso debe ser secuencial (QT-----HT). - Cuando deben usarse QT y RT, su uso debe ser secuencial (QT-----RT), salvo con CMF y docetaxel cuya administración puede ser simultáneo con RT. - En pacientes de riesgo bajo o intermedio con niveles elevados de RE y RP en la mayoría de las células tumorales y HER2 negativo se puede considerar la hormonoterapia exclusiva. Si bien no hay evidencia concluyente sobre su utilidad, en el subgrupo de pacientes con axila negativa, el estudio del perfil de expresión génica (oncotype DX®, MammaPrint®) podría contribuir a una mejor selección del tratamiento adyuvante. - Endocrinoterapia en pacientes postmenopáusicas: La estrategia preferida (salvo contraindicaciones específicas) es la utilización secuencial de tamoxifeno y un Inhibidor no esteroideo de la aromatasa (anastrazole, letrozole o exemestano). Por ejemplo: tamoxifeno por 2-3 años y luego anastrazole o exemestano hasta completar 5 años; tamoxifeno por 5 años y luego letrozole por 5 años adicionales. En pacientes con contraindicaciones o intolerancia al tamoxifeno: Inhibidor de aromatasa por 5 años. En pacientes que no toleran o tienen contraindicaciones para un inhibidor de aromatasa: tamoxifeno por 5 años. - Endocrinoterapia en pacientes premenopáusicas: La estrategia estándar es tamoxifeno +/- ablación ovárica (agonista LHRH). Si luego de 2-3 años es postmenopáusica rotar a un inhibidor de aromatasa o seguir con tamoxifeno hasta completar 5 años y luego rotar al inhibidor de aromatasa. Si persiste premenopáusica se suspende la hormonoterapia adyuvante luego de completar 5 años de tamoxifeno. En pacientes que cambian su estatus menopáusico y se rota a un inhibidor de aromatasa se recomienda determinar en forma seriada estradiol y FSH. Si la paciente retoma la función ovárica se rota nuevamente a tamoxifeno. En premenopáusicas RE +, el beneficio de la supresión ovárica (agonistas LHRH tipo goserelina) es similar al del CMF. Los agonistas LHRH deberían administrarse por 2 años pero la duración óptima no ha sido establecida. 7 Aún no se conocen los resultados de la asociación de un agonista LHRH y un inhibidor de aromatasa por lo que esta asociación solamente puede plantearse en el contexto de un estudio clínico. Cuando se administra Tamoxifeno, recordar que algunos inhibidores selectivos de la recaptación de serotonina (SIRS) tales como sertralina, paroxetina y fluoxetina, disminuyen la eficacia del tamoxifeno por lo que no deben ser administrados en forma simultánea. - Quimioterapia Para pacientes con axila positiva (N+), la PQT con antraciclinas y taxanos permite obtener mejores resultados. Los esquemas secuenciales son mejor tolerados. Los regímenes AC y CMF serían subóptimos en pacientes N+ de alto riesgo y no deberían utilizarse en dicho contexto. En las pacientes cuyos tumores exhiben sobreexpresión o amplificación de HER2, los regímenes con antraciclinas son superiores al CMF. En las pacientes con tumores HER2 negativos el beneficio de las antraciclinas es dudoso. Un meta-análisis reciente, muestra que el beneficio de las antraciclinas estaría limitado a las pacientes HER2 positivas. Se requieren estudios adicionales para determinar si existe un subgrupo de pacientes con tumores HER2-negativos (ej: N3, sobreexpresión de topoisomerasa II) que se beneficie con la adición de antraciclinas a la quimioterapia adyuvante. Pacientes con tumores triples negativos: no existe información suficiente para establecer recomendaciones en este subgrupo. El regimen TC (docetaxel 75/ciclofosfamida 600) es superior al regimen AC (60/600) tanto en sobrevida libre de enfermedad como en sobrevida. Además, no presenta cardiotoxicidad No hay datos suficientes para hacer recomendaciones de quimioterapia adyuvante en > 70 años (tratamiento individualizado). - Trastuzumab 8 En pacientes con tumores HER2 positivos (Resultado de IHQ 3 cruces y/o FISH+) debe considerarse el uso de trastuzumab adyuvante cuando la axila es positiva o cuando la axila es negativa y el tumor es >1 cm. Puede administrarse concurrente con un taxano (por ejemplo con paclitaxel luego de la administración de AC) o luego de completada la quimioterapia adyuvante. La insuficiencia cardíaca congestiva severa es un potencial efecto adverso -sobre todo cuando el trastuzumab se administra junto con la quimioterapia adyuvante. Debido a la cardiotoxicidad no se recomienda, su administración en forma concurrente con doxorrubicina. Durante el tratamiento debe controlarse la función cardíaca (con determinación de la fracción de eyección del ventrículo izquierdo) en forma periódica. La duración óptima del tratamiento no ha sido establecida. Se recomienda su administración durante 1 año, según el esquema semanal o cada 3 semanas. Selección del tratamiento adyuvante sistémico. Pautas específicas. 1. Grupo de Bajo Riesgo: Endócrinoterapia adyuvante salvo la existencia de contraindicaciones médicas o negativa de la paciente. El estudio del perfil de expresión génica podría identificar un subgrupo que se beneficiaría con la adición de quimioterapia adyuvante (ver página 3) 2. Grupo de Riesgo Intermedio - Niveles elevados de ambos receptores en la mayoría de las células tumorales: hormonoterapia exclusiva o quimioterapia* (según el nivel de HER2, estado menopáusico, comorbilidades) +/- trastuzumab (según HER2) + hormonoterapia - Niveles no elevados de ambos receptores o negatividad de uno de los receptores: quimioterapia* +/- trastuzumab (según HER2) + hormonoterapia. 9 - Ambos receptores negativos: quimioterapia* +/- trastuzumab (según HER2) * Quimioterapia: AC x4, TC x 4, CMF x 6 (salvo en ptes con enfermedad HER2 positiva) , FAC x 6, FEC x 6 3. Grupo de alto riesgo - Con RE y/o RP positivos: Quimioterapia (con antraciclinas y taxanos: Ej: AC x 4 seguido de Paclitaxel x 4, FEC* seguido de Docetaxel x 3, TAC x 6, AC x 4 seguido de Paclitaxel con esquema de densidad de dosis y factores estimulantes de colonias granulocitarias) seguida de hormonoterapia. - Con RE y RP negativos: Quimioterapia con antraciclinas y taxanos. Ej: AC x 4 seguido de Paclitaxel x 4, FEC* seguido de Docetaxel x 3, TAC x 6, AC x 4 seguido de Paclitaxel con esquema de densidad de dosis y factores estimulantes de colonias granulocitarias * La equivalencia de FAC con FEC demostrada en estudios previos lo que permitiría la utilización de adriamicina en caso de no estar disponible la epirubicina Seguimiento luego de finalizado el tratamiento. - Anamnesis y examen clínico cada 3-6 meses durante los primeros tres años, cada 6-12 meses durante los siguientes dos años y luego anual. - Controles paraclínicos: en pacientes asintomáticas y con examen clínico normal solo ha demostrado beneficio la realización de mamografía ipsilateral (luego de cirugía conservadora) y contralateral cada 1-2 años. - Tratamiento Neoadyuvante Sistémico Esta indicado en las pacientes con tumores locorregionalmente avanzados y constituye una opción válida en aquellas con tumores operables que no son candidatas a cirugía conservadora al momento del diagnostico. Son requisitos previos a la indicación de tratamiento sistémico neoadyuvante : 10 - core biopsia con determinación de RRHH y HER2/neu - marcado del lecho tumoral La evaluación de la respuesta es clínica y paraclínica con Mamografía o Ecografía y de ser posible con RNM mamaria, que es el estudio con mayor precisión para determinar el tamaño tumoral y el tipo de respuesta. La quimioterapia más efectiva es aquella que incluye antraciclinas y taxanos administrados en forma secuencial, con 20-30% de respuestas completas patológicas (RCp). En la mayoría de los estudios las RCp se asocian a una mayor sobrevida libre de enfermedad y sobrevida global. En las pacientes respondedoras se recomienda administrar al menos 4 ciclos de quimioterapia, ya que con 4 o más ciclos la posibilidad de alcanzar una RCp es mayor. Asimismo, se ha demostrado que la administración secuencial de 4 ciclos de AC seguidos de 4 ciclos de docetaxel es superior a la administración neoadyuvante de 4 ciclos de AC y docetaxel adyuvante (estudio NSABP B27). La adición de trastuzumab a la quimioterapia aumenta el porcentaje de RCp en tumores HER2 positivos, lo que se asocia en la mayoría de los estudios a mayor sobrevida libre de enfermedad. Puede administrase en forma concurrente con planes sin antraciclinas o que incluyen epirrubicina y un taxano en forma secuencial. Son válidos, entre otros, los planes TCH, Paclitaxel-FEC y AC-T. En pacientes posmenopáusicas, con enfermedad endocrino respondedora, que por edad o por sus comorbilidades no tolerarían un tratamiento de quimioterapia neoayduvante la hormonoterapia primaria es una opción, recomendándose la administración de inhibidor de aromatasa durante al menos 4 meses, en pacientes respondedoras. 1. Cáncer de mama EII- EIIIA por T3, N1: La quimioterapia neoadyuvante constituye una opción para las pacientes que desean un tratamiento conservador de la mama, pero no son candidatas al mismo debido al tamaño tumoral (en general tumores > de 3 cm). En efecto, permite un mayor número de cirugías conservadoras, con sobrevida libre de enfermedad y sobrevida global equivalentes a la de pacientes tratadas con la 11 misma quimioterapia pero en forma adyuvante. Además, puede ser mejor tolerada. No son buenas candidatas a la neoadyuvancia las pacientes con tumores multicéntricos o microcalcificaciones difusas en la mamografía. Los factores de riesgo para la obtención de márgenes positivos y una mayor probabilidad de recaída local luego de una cirugía conservadora son: presencia de CDI extensivo, respuesta dendrítica, margen menor o igual a 2 mm, tumor clínico mayor a 2 cm. Luego de la cirugía, el tratamiento adyuvante (quimioterapia, trastuzumab, hormonoterapia) será administrado de acuerdo a las guías terapéuticas para las pacientes con cáncer de mama operable. El tratamiento adyuvante con quimioterapia podría no realizarse en pacientes que recibieron el tratamiento neoadyuvante con los regímenes estandares durante al menos 6 ciclos y que obtuvieron una buena respuesta. Debería tomarse en cuenta el resultado patológico final y, en caso de indicarse, excluir las drogas que fueron inefectivas en la neoadyvuancia. Aún no hay datos disponibles para realizar recomendaciones en relación a la administración de trastuzumab adyuvante, luego de su utilización en la neoadyuvancia. La indicación de radioterapia adyuvante estará supeditada a las características tumorales pre-neoadyvuancia. CÁNCER DE MAMA LOCORREGIONALMENTE AVANZADO NO INFLAMATORIO La combinación de quimioterapia neoadyuvante, cirugía y radioterapia ha demostrado aumentar significativamente las tasas de sobrevida en el cáncer de mama localmente avanzado inoperable El cáncer de mama localmente avanzado inoperable (no inflamatorio) incluye los estadios clínicos IIIA : T0-3 N2 M0 ; IIIB : T4a-c N0-2 M0 y IIIC: cualquier T N3 M0 Se realizara tratamiento neoadyuvante utilizando los planes mencionados anteriormente. En pacientes con respuesta parcial mayor o respuesta clínica completa podrá 12 plantearse un tratamiento quirúrgico que consistirá en una MRM o eventualmente una cirugía conservadora (CC), según la magnitud de la respuesta al tratamiento sistémico. La CC no estará indicada en caso de no resolución clínica y mamográfica del edema mamario, con tumor residual mayor a 5 cm , tumores mulitcéntricos o tumor fijo a la pared o a la piel Luego de la cirugía se completará el tratamiento locorregional con radioterapia (RT), que ha demostrado mejorar el control locorregional , aún si se alcanza una RCp con el tratamiento neodayuvante. En pacientes con respuesta pobre o estabilidad lesional luego de al menos 4 ciclos de quimioterapia ha incluido antraciclinas y taxanos, una opción de tratamiento es la RT a dosis radicales. Si responde al tratamiento radiante y fuera eventualmente operable luego del mismo podrá plantearse una MRM. En pacientes neoadyuvante con progresión lesional bajo el tratamiento sistémico que ha incluido antraclinas y taxanos, una opción de tratamiento es la RT paliativa u otro esquema de quimioterapia. Con respecto a la quimioterapia adyuvante es desconocido su beneficio, aún con enfermedad residual luego de la cirugía. La mayoría de los centros administra ciclos adicionales de quimioterapia sobretodo en quienes alcanzan la máxima respuesta con menos de 6 ciclos, excluyendo drogas ineficaces en la neoadyuvancia. Se tomará en cuenta el resultado patológico final y se balancearán riesgos y beneficios en forma individualizada. Si el tumor es HER2/neu positivo se asociará tratamiento adyuvante con Trastuzumab según las guías de tratamiento con trastuzumab adyuvante. Si los RRHH son positivos, la hormonoterapia adyuvante luego de la quimioterapia ha demostrado aumentar la sobrevida global. CÁNCER DE MAMA INFLAMATORIO El cáncer de mama inflamatorio suele incluirse en el grupo de carcinomas locorregionalmente avanzados, si bien tiene características clínicas, biológicas y terapéuticas que lo distinguen. Es una entidad tumoral muy agresiva y tiene peor pronóstico que el cáncer de mama locorregionalmente avanzado no inflamatorio. El diagnóstico es clínico, radiológico y de confirmación anátomo patológica. La 13 biopsia de piel negativa no invalida el diagnóstico. Debe distinguirse de los cánceres localmente avanzados que cursan con algún componente inflamatorio. Una vez descartada la presencia de metástasis a distancia, el cáncer de mama inflamatorio puede corresponder según el compromiso ganglionar regional al estadio IIIB: T4d N0-2 M0 o estadio IIIC: T4d N3 M0. La combinación de los tratamientos con quimioterapia neoadyuvante, seguido de tratamiento locorregional (cirugía y/o radioterapia) y quimioterapia adicional ha demostrado aumentar significativamente las tasas de sobrevida en el cáncer de mama inflamatorio, con sobrevidas globales del 30% a 10 años. Son requisitos previos a la indicación de tratamiento sistémico neoadyuvante la realización de una core biopsia con determinación de RRHH y HER2/neu. El cáncer de mama inflamatorio es más frecuentemente una enfermedad de alto grado histológico, receptor de estrógeno negativa y HER-2/neu positiva. Con respecto al tratamiento sistémico neoadyuvante se recomienda administrar planes de quimioterapia que incluyan antraciclinas y taxanos , en forma secuencial, que son los que han demostrado un mayor porcentaje de respuestas. En la mayoría de los estudios las RCp se asocian a una mayor sobrevida libre de enfermedad y sobrevida global. Si existe respuesta al tratamiento sistémico, se recomienda administrar de 6 a 8 ciclos o bien el número de ciclos necesario para alcanzar la máxima respuesta. El trastuzumab en la neoadyuvancia aumentaría el número de RCp en tumores HER2/neu positivos, pero aún es investigacional. La evaluación de la respuesta será clínica y paraclínica con Mamografía o Ecografía y de ser posible con una RNM mamaria. En pacientes posmenopáusicas, con enfermedad endocrino respondedora, que por edad o por sus comobilidades no tolerarían un tratamiento de quimioterapia neoayduvante la hormonoterapia primaria es una opción, recomendándose administrar un inhibidor de aromatasa. En pacientes que presentan al menos respuesta parcial mayor a la quimioterapia podrá plantearse un tratamiento quirúrgico que consistirá en 14 una MRM. La CC está contraindicada en el cáncer de mama inflamatorio por asociarse a mayor tasa de recaída locorregional .El tratamiento locorregional será complementado con RT, que ha demostrado mejorar el control a ese nivel. En pacientes con pobre respuesta o enfermedad estable con quimioterapia neodyuvante que ha incluido antraciclinas y taxanos, una opción de tratamiento es la RT a dosis radicales y si responde al tratamiento radiante y fuera eventualmente operable luego del mismo podrá indicarse una MRM. Una vez completado el tratamiento local se valorará e individualizará de acuerdo a los hallazgos patológicos y a los factores predicitivos de respuesta a los tratamientos, el agregado de quimioterapia adicional, trastuzumab adyuvante y/u hormonoterapia adyuvante al igual que en los otros tumores locorregionalmente avanzados. En pacientes de mal pronóstico con progresión lesional bajo el tratamiento sistémico neoadyuvante que ha incluido antraclinas y taxanos, una opción de tratamiento es la RT paliativa u otro esquema de quimioterapia (por ej basado en capecitabine o sales de platino). CÁNCER DE MAMA METASTÁSICO I) DIAGNÓSTICO Diagnóstico positivo. Estudio imagenológico del o de los sitios clínicamente sospechosos Siempre que sea posible –en especial si se trata de una lesión única- debería obtenerse la confirmación citopatológica. Evaluación de la extensión lesional y de factores predictivos de respuesta al tratamiento sistémico Anamnesis y exámen físico completos. Estado funcional (Performance status) Si se trata de una recaída: Intervalo libre de enfermedad Estado menopáusico Hemograma completo, calcemia, bilirrubinas y enzimograma hepático 15 RxTx y ecografía abdominal o TAC. Otros estudios imagenológicos (Centellograma óseo, TAC o RNM de cráneo o de columna) en función de las manifestaciones clínicas y los signos de laboratorio. En pacientes con enfermedad no medible (ej: secundarismo óseo exclusivo sin lesiones medibles por radiología) puede ser útil la determinación de CA15.3 para evaluar la respuesta al tratamiento. Determinación de RE y RP en lesión metastásica si no se dispone de su determinación en el tumor primario Determinación de HER2 en lesión metastásica si no se dispone de su determinación en el tumor primario (salvo en pacienes añosas o con comorbilidades que contraindican tratamientos sistémicos diferentes a la hormonoterapia). Puede realizarse mediante IHQ o FISH. Si se realiza mediante IHQ y el resultado es HER2 ++ es necesario realizar FISH. PET CT – cuando los marcadores tumorales aumentan progresivamente y no se detecta sitio metastático por estudios habituales (TAC, centellograma óseo); podría sustituir al centellograma óseo dada su mayor sensibilidad en detectar metástasis a dicho nivel. II) TRATAMIENTO SISTÉMICO La selección del tratamiento sistémico debe tomar en cuenta los siguientes factores: - Sitios metastásicos y agresividad de la enfermedad - Estado menopáusico - Factores moleculares predictivos de respuesta: RE, RP, HER2/neu - Edad, comorbilidades y “performance status” En los casos de recaída de un cáncer de mama diagnosticado previamente, es necesario considerar además los tratamientos previos y el intervalo libre de enfermedad o de progresión. En caso de existir una lesión metastática accesible a la biopsia puede consideraras la misma ya que casi un 20% de los tumores de mama pueden experimentar cambios tanto en HER2 como en RE/RP entre el tumor inicial y su metástasis. Dado que se trata de un tratamiento paliativo, de ser posible se comenzará con el tratamiento menos agresivo, de preferencia hormonoterapia (HT). 16 En caso de emplearse quimioterapia y no existir localizaciones de riesgo que determinen la necesidad de lograr una respuesta rápida puede optarse por monoquimioterapia ya que si bien la PQT ha demostrado ser superior a la monoquimioterapia en términos de sobrevida, el beneficio es pequeño y se asocia con mayores efectos adversos. Se ha reportado ventaja en la sobrevida para dos combinaciones en base a taxanos (docetaxel-capecitabine y gemcitabina-paclitaxel) con respecto al taxano monodroga. El meta-análisis mostró beneficio de PQT sobre MQT (El metanálisis con 1986 pacientes randomizados entre PQT/MQT muestra una ventaja en SV para la PQT con HR de 0.82 ( rango 0.75-0.90 ). Pacientes con enfermedad HER2-positiva: considerar la asociación de una terapia anti-HER2 (valorar tratamientos previos y la relación temporal entre su administración y la recaída de la enfermedad) La duración óptima de la quimioterapia en las pacientes que exhiben respuesta objetiva o enfermedad estable no ha sido determinada. En las pacientes con RE-positivo o RP-positivo que exhiben tolerancia pobre a la quimioterapia puede considerarse la continuación del tratamiento con hormonoterapia. No se recomienda la quimio-hormonoterapia concurrente. Indicaciones de quimioterapia como tratamiento inicial - RE-negativo/RP-negativo o progresión bajo hormonoterapia - Enfermedad biológicamente agresiva (ILE menor de un año, metástasis viscerales, varios sitios metastásicos, enfermedad voluminosa) con necesidad de una respuesta rápida La selección del esquema de quimioterapia debería basarse en características del paciente (edad, comorbilidades, quimioterapia previa), de la enfermedad (sitios metastásicos, agresividad biológica) y en las preferencias del paciente y el médico tratante. Pacientes con enfermedad biológicamente agresiva La PQT permite obtener mayor porcentaje de respuestas objetivas que la monoquimioterapia por lo que debería considerarse su indicación. 17 En las pacientes que no han recibido antraciclinas, que no tienen contraindicaciones para las mismas y que no recibirán trastuzumab asociado puede considerarse el tratamiento con quimioterapia en base a doxorrubicina asociada o no a un taxano: FAC, AC, AT (Adriamicina-taxano). En las pacientes que recibieron antraciclinas en adyuvancia o para la enfermedad metastásica los regímenes basados en un taxano son de elección, por ejemplo: capecitabina-docetaxel, gemcitabina-paclitaxel. En las pacientes con sobreexpresión de HER2/neu (IHQ+++ o FISH-positivo), sin metástasis cerebrales y con buen “performance status” (0-1) puede considerarse la asociación del trastuzumab con el docetaxel u otro agente no antraciclina, salvo en pacientes muy añosas o con comorbilidades que contraindiquen el tratamiento. En pacientes añosas sin comorbilidades que contraindiquen la quimioterapia y enfermedad agresiva considerar: CMF (salvo en pacientes con enfermedad HER2 positiva), capecitabina. En las pacientes que progresan luego de un régimen basado en taxanos o doxorrubicina y un taxano los agentes más frecuentemente utilizados son la capecitabina, la vinorelbina y la gemcitabina. En las pacientes con tumores que sobre-expresan el HER2/neu con IHQ+++ o FISH-positivo, sin metástasis cerebrales y con “performance status” 0-1 y que no son candidatas a quimioterapia adicional puede considerarse el trastuzumab monodroga. En caso de progresión bajo trastuzumab puede utilizarse el lapatinib asociado a capecitabine. Pacientes con RE y RP-negativos y sin enfermedad biológicamente agresiva Puede considerarse la monoquimioterapia. El docetaxel parece ser el agente más efectivo. Su administración semanal exhibe la misma eficacia con mejor tolerancia. Otros agentes frecuentemente utilizados incluyen: paclitaxel, capecitabina, la vinorrelbina y la gemcitabina. La capecitabina ha demostrado actividad en pacientes previamente expuestas a taxanos. Indicaciones de hormonoterapia como tratamiento inicial - RE-positivo o RP-positivo 18 - Sin enfermedad biológicamente agresiva: metástasis óseas y otras no viscerales con período libre de enfermedad prolongado y baja carga tumoral. Para la selección de la hormonoterapia considerar el estado menopáusico, los tratamientos previos y las comorbilidades. Factores predictivos de respuesta/resistencia a la hormonoterapia. Estudios del SWOG mostraron claramente que el beneficio del TMX en enfermedad avanzada RE positivo era mayor cuanto mayor era el tenor de RP (receptores de progesterona), variando entre 43 y 70% con valores de RP <10 fmol/mg a valores >100 fmol/mg. De cualquier modo aún con RP negativos la respuesta al tamoxifeno se ve en > 40% de los casos por lo que nunca debe descartarse la hormonoterapia en estas circunstancias. En cuanto al tenor de HER2, la positividad del mismo generalmente se asocia con un efecto negativo en respuesta al tamoxifeno. Aún no se disponen marcadores que permitan predecir diferente respuesta al tamoxifeno vs inhibidores de la aromatasa, si bien están apareciendo los primeros reportes de respuesta diferencial en neoadyuvancia. Hormonoterapia de primera línea Pacientes premenopáusicas: Sin tamoxifeno adyuvante previo o discontinuado hace más de 1 año: Tamoxifeno. Si existen contraindicaciones para el tamoxifeno considerar la ablación ovárica: agonistas LHRH (Ej: goserelina) u ooforectomía quirúrgica). Cuando se realiza la ablación ovárica se pueden asociar los inhibidores de la aromatasa (IA). Un estudio aleatorizado con 119 pacientes pre y perimenopáusicas con enfermedad metastásica positiva para RH mostró que la combinación de goserelina y anastrozol resultó en tasas mayores de RG (80 vs 53%) y aumento en SV media (18.9 vs 14.3 meses) en comparación con goserelina y tamoxifeno. 19 Si bien los trabajos no son aún concluyentes, el que presentó mejor diseño fue el que comparó tamoxifeno, buserelina o la combinación de ambos, mostrando un aumento en SV mediana para la combinación de 3.7 años vs 2.9 para TMX y 2.5 para buserelina sola (p=0.01). Pacientes postmenopáusicas: Inhibidores no esteroideos de la aromatasa (anastrazole, letrozole) o tamoxifeno (si no lo recibieron previamente o el intervalo libre de progresión es mayor de 1 año y no existen contraindicaciones). Los IA son superiores al tamoxifeno en términos de probabilidad de respuesta, intervalo libre de progresión y sobrevida global. - ILBCG – 916 p con CMM o locoregionalmente avanzado postmenopáusicas, mostró aumento del ILP con Letrozole vs TMX ( 9.4 vs 6 m ) sin diferencias significativas en SV. - North American Multicenter Randomized Trial – 353 p con CMM o locoregionalmente avanzado postmenopáusicas, mostró aumento del ILP con Anastrozole vs TMX ( 11.1 vs 5.6 m ). - EORTC 10951 – 382 p con CMM o locoregionalmente avanzado postmenopáusicas, mostró un aumento en ILP con Exemestane vs TMX ( 9.9 vs 5.7 m ). - Lo reafirma metaanálisis (con HR para muerte de 0.87, 95% CI de 0.820.93) que compara anastrozole/letrozole/exemestane/vorozole tamoxifeno (aumento de vs SV para cualquiera de los IA vs tamoxifeno). Hormonoterapia de segunda línea: Exemestano (IA esteroideo efectivo luego de IA no esteroideos), fulvestrant, acetato de megestrol Exemestane Resultados de los trabajos publicados sugieren que el cáncer de mama es sensible a IA esteroideos aún post falla de IA no esteroideos. Exemestane ha mostrado un 24.3% de respuesta en 240 pacientes con CMM 20 post falla al tamoxifeno y a IA no esteroideos. Puede existir respuesta a un IA no esteroideo post falla al exemestane Los resultados de 2 estudios randomizados que compararon fulvestrant vs anastrozole en 851 pacientes postmenopáusicas con ca mama avanzado que progresaron post TMX, demostraron que el fulvestrant 250 mg/mes fue al menos igualmente efectivo que el anastrozole con perfil de toxicidad aceptable. El estudio fase III (EFECT) con 693 pacientes comparó exemestane vs fulvestrant en pacientes que progresaron bajo IA no esteroideos (anastrozol y letrozol); no mostró diferencia en la RG (7.4 vs 6.7%), beneficio clínico (23.3 vs 18.5%) o tiempo libre de progresión (3.7 meses en ambos brazos). Tampoco hubo diferencias en términos de SV global. Por lo tanto las 2 opciones de hormonoterapia son apropiadas postprogresión a inhibidores de la aromatasa. Fulvestrant Datos recientemente reportados en ASCO 2008, lo posicionan como una terapéutica altamente efectiva como hormonoterapia de segunda línea en mujeres postmenopáusicas, receptor hormonal positivo; su mecanismo de acción y su perfil de toxicidad permiten su incorporación precoz en el manejo del cáncer de mama metastático hormonodependiente. MECANISMOS DE RESISTENCIA A LA HORMONOTERAPIA La eficacia de un tratamiento hormonal puede variar ampliamente por factores relacionados con el huésped; las concentraciones plasmáticas del endoxifeno (metabolito activo del tamoxifeno) se asocian con el genotipo de la citocromo p450 y sus variantes polimórficas. Asimismo hay varias drogas (antidepresivos, anticonvulsivantes,etc) que pueden modificar las concentraciones plasmáticas del endoxifeno y por ende afectar la sensibilidad al tamoxifeno. BIFOSFONATOS Los bifosfonatos son efectivos en la hipercalcemia y en el tratamiento paliativo 21 de las metástasis óseas líticas. Tanto el pamidronato como el zoledronato pueden ser utilizados a tales efectos; no obstante un estudio fase III con 1.130 pacientes mostró que el zoledronato era más efectivo que el pamidronato en reducción de los efectos esqueléticos QUIMIOTERAPIA Monoquimioterapia El cáncer de mama es quimiosensible siendo la mayoría de las respuestas parciales. Solo un pequeño grupo de los que alcanzan RC llegan a tener largas sobrevidas. Varios agentes han mostrado respuestas favorables como MQT siendo los más efectivos: docetaxel, paclitaxel, vinorelbine, doxorubicina, epirubicina, doxorubicina liposomal, capecitabine y gemcitabine. Docetaxel Desde 1999 es el agente de elección para el cáncer metastásico de mama (post paclitaxel adyuvante, ej USA ). Docetaxel 100mg/m2 c/3s superior a Doxorubicina 75mg/m2 c/3s ( RR 48 vs 33%, p= 0.008 ). Docetaxel 100mg/m2 c/3s superior a Paclitaxel 175mg/m2 c/3s ( SV 15.4 vs 12.7m, p= 0.003 ). Sin diferencias en respuesta con planes semanales o c/3s ( 34 vs 33 % ) con toxicidades diferentes Neutropenia,neurotoxicidad y estomatitis > c/3s. Onicolisis, astenia, conjuntivitis > plan semanal. Paclitaxel Ha sido menos utilizado en este contexto en los últimos 5 años por su mayor uso en adyuvancia y los mejores resultados comparativos del docetaxel. 22 Paclitaxel 200mg/m2 c/3s inferior a Doxorubicina 75mg/m2 c3/s ( RR 25 vs 41%, p= 0.003 ). Mayor tasa de respuesta con planes semanales ( 80mg/m2 en 1h) que c/3s ( 175mg/m2 en 3h ) ( 40 vs 28 %, p= 0.017 ) , ILP ( 9 vs 5m, p= 0.008 ) y SV ( 24 vs 16m, p=0.17 ). Capecitabina 20% RR en cáncer de mama refractario al paclitaxel. Gemcitabina En estudios de fase II demostró un 14 – 37% de respuestas (1200 mg/m2 D1, 8 y 15 c/4s ) en primera línea metastásica . No mostró respuesta en pacientes refractarios a antracíclicos y/o a taxanos. Ixabepilona Esta aprobado su uso como monodroga en cáncer de mama metastásico o locoregionalmente avanzado resistente o refractario a antracíclicos, taxanos y capecitabine Ixabepilona-capecitabina Esta aprobado su uso como combinación en cáncer de mama metastásico o locoregionalmente avanzado resistente o refractario a antracíclicos y taxanos, o en aquellos tumores resistentes a taxanos donde el uso de antracíclicos esté contraindicado. La resistencia a las antraciclinas se define como progresión bajo tratamiento o post 6 meses de terminada la adyuvancia o 3 meses de terminado el tratamiento de la enfermedad avanzada La resistencia a taxanos se define como progresión bajo tratamiento o post 12 meses de adyuvancia o 4 meses de tratamiento sistémico. Esta combinación aumenta la SLP vs capecitabine solo (5.8 vs 4.2 meses) con una reducción del riesgo de progresión de un 25% (HR 0.75; 95% CI 0.64-0.88, p=0.003); la tasa de respuestas objetivas fue también mayor (35 vs 14%, 23 p<0.001). La combinación mostró mayor toxicidad grado ¾ (neuropatía sensorial 21 vs 0%), fatiga (9 vs 3%) y neutropenia (68 vs 11%). Dosis: 40mg/m2 a pasar en BIC por 3 horas iv c/3 semanas + Capecitabine 2g/m2/d por 14 días. Doxorrubicina liposomal Puede utilizarse ya sea como monodroga o asociada a paclitaxel, docetaxel, ciclofosfamida o gemcitabina. Ofrece resultados similares a la doxorrubicina no liposomal pero con menor cardiotoxicidad. La dosis como monodroga es de 35 a 45 mg/m2 iv cada 4 semanas. Poliquimioterapia es mejor que monoquimioterapia ? Varios trabajos y un meta-análisis muestran mayor sobrevida con PQT que con la MQT , si bien el incremento es discreto y la toxicidad es mayor. El metanálisis de 1998 con 1986 pacientes randomizados entre PQT/MQT muestra una ventaja en SV para la PQT con HR de 0.82 ( rango 0.75-0.90 ). ¿Quimioterapia con altas dosis? Después de 2 décadas de investigación con “ High Dose Therapy “ con soporte autólogo de stem-cells no hay resultados favorables que la avalen. ¿Quimioterapia con densidad de dosis? Según la hipótesis de Norton y Simon, los regímenes de densidad de dosis pueden ser mejores que los planes convencionales. Varios ensayos tanto en adyuvancia como en enfermedad avanzada están testeando esta hipótesis con resultados promisorios. ¿Cuál debe ser la duración de la PQT? Una revisión sistemática de los trabajos randomizados sobre duración de la QT ( 1966-1996 ) encontró 4 ensayos ( 766 p ). El metanálisis de los mismos favorece la mayor duración de la QT ( 23% mayor SV en QT prolongadas con p= 0.01 ). 24 A pesar que el beneficio en SV es modesto tiene un gran impacto ( por la alta tasa de incidencia del cáncer de mama ). Hay que sopesar la toxicidad del tratamiento prolongado ( QOL ). Poliquimioterapia con Taxanos Docetaxel – Capecitabine Sinergismo preclínico. Mayor tasa de respuesta ( 42 vs 30%, p=0.006 ). Mayor intervalo libre de progresión ( 6.1 vs 4.2 m, p=0.0001 ). Mayor sobrevida ( 14.5 vs 11.5 m, p=0.0126 ). CRITICAS Mayor toxicidad ( 65% en brazo combinado vs 36% en monodroga, tuvieron reducción de dosis ). Falta de cross-over en brazo con Docetaxel. Paclitaxel - Gemcitabine Mayor tasa de respuesta (41 vs 22%, p=0.001). Mayor intervalo libre de progresión (5.2 vs 2.9 m, p=0.0001). Mayor sobrevida (18.5 vs 15.8 m, p=0.018). CRITICAS Mayor toxicidad ( fatiga y mielosupresión en brazo combinado). Falta de cross-over en brazo con Paclitaxel. No hay evidencia de sinergismo preclínico. Terapias dirigidas contra blancos moleculares ANTI-Her2/neu ( trastuzumab) ANTI-EGFR – ANTI-Her2/neu ( lapatinib ) AGENTES ANTIANGIOGÉNICOS ( bevacizumab ) Trastuzumab Anticuerpo monoclonal humanizado Alta afinidad y especificidad por dominio extracelular de HER2 Setiembre 1998: aprobado por FDA para cáncer de mama E IV, HER2+ Grado sobreexpresión de HER2 predice % respuesta (tumores FISH + o IHC 3+) Junio 2006: aprobado por EMEA para cáncer de mama precoz que sobreexpresa el Her2 ( IHQ 3+ e IHQ 2+ con FISH + ). 25 Es activo en monoterapia y en combinación con varias drogas (combinaciones dobles y triples); las combinaciones más efectivas son trastuzumab-docetaxel, trastuzumab-paclitaxel, trastuzumab-capecitabine, trastuzumab-vinorelbine y trastuzumab-gemcitabine. Tanto en monoterapia como en combinación con taxanos tienen una relación riesgo beneficio muy favorable. Generalmente es bien tolerado y no se asocia con los efectos colaterales típicos de la QT. Se puede usar tanto en forma semanal como cada 3 semanas (con dosis carga y de mantenimiento respectivas). En pacientes que progresan bajo trastuzumab y quimioterapia, es una opción válida rotar el citostático manteniendo el trastuzumab (aumenta la tasa de respuestas y el tiempo a la progresión) Inhibidores de Tirosin-Quinasa Lapatinib Acción dual ( inhibidor de Erb B1 y Erb B2/HER2 ) No tiene resistencia cruzada con trastuzumab. Respuestas promisorias en pacientes refractarios a trastuzumab, especialmente en sistema nervioso central. Administración oral. Bloquea la transmisión de señales celulares por medio de homodímeros y heterodímeros de EGFR (ErbB-1) y HER2 (ErbB-2). Tendría indicación en pacientes resistentes al trastuzumab. Atraviesa la BHE por lo que sería de utilidad en metástasis mamarias en SNC. En el estudio pivotal se asoció al capecitabine obteniendo un impacto significativo en SLP. Lapatinib 1250 mg/d v/o continuo + Capecitabine 2000 mg/m2/d v/o D1-14 c/3 sem. Mejoría en tiempo a la progresión (8.4 vs 4.4 meses) con la combinación de lapatinib-capecitabine vs capecitabine (p< 0.001). No hubo mayor toxicidad grado 3-4 con el agregado de lapatinib. Agentes Antiangiogénicos Bevacizumab 26 Existen 4 estudios randomizados que evalúan el papel del Bevacizumab asociado a la quimioterapia en cáncer de mama metastásico HER 2 negativo. En primera línea se constató beneficio significativo en tasa de respuestas y en SVLP a favor de la combinación de Bevacizumab con quimioterapia aunque sin aumento de la SVG. Los mejores resultados en SVLP se observan en el estudio E2100 con la asociación de Bevacizumab y Paclitaxel semanal (11.8 m vs 5.9 m; HR 0.60 p <0.001 ). El estudio AVADO que lo asoció a Docetaxel cada 3 semanas mostró beneficio en SVLP menor a 1 mes y en el estudio RIBBON hubo un aumento estadísticamente significativo de la SVLP, de 3 meses para el grupo que lo recibió combinado con Capecitabine y de 1.2 meses para el grupo que recibió antraciclinas o taxanos. En segunda o tercera línea sólo demostró un aumento significativo en tasa de respuestas sin beneficio en SVLP o SVG. La respuesta al bevacizumab es independiente del Her2/RE/RP pero la mayoría de los pacientes incluidos eran Her 2 negativos. Evaluación de la respuesta al tratamiento sistémico Se recomienda evaluar la respuesta al tratamiento luego de 2-3 ciclos de quimioterapia o 3 meses de hormonoterapia mediante evaluación de la sintomatología, y mediante la repetición de los estudios paraclínicos positivos (con excepción del centellograma óseo ya que no es útil para evaluar respuesta durante el tratamiento) cada 4-6 meses. SUGERENCIAS DEL PAUTADO HT o QT SEGÚN FACTORES YA MENCIONADOS PREMENOPAUSICA HORMONOTERAPIA 1. Primera Línea Tamoxifeno Tamoxifeno + Agonistas LhRh/ooforectomía 2. Segunda Línea Agonistas LhRh + Inhibidores de la aromatasa (anastrozole) 27 POSTMENOPUSICA HORMONOTERAPIA Primera Línea Anastrozole o Letrozole o Exemestano Tamoxifeno( si hay contraindicaciones para el uso de inhibidores de la aromatasa) Segunda Línea Exemestano o Fulvestrant Anastrazole o Letrozole si no fueron utilizados en primera línea Tamoxifeno si no fue utilizado en primera línea Tercera Línea En caso de no haber sido utilizados en primera o segunda línea, puede considerarse: Tamoxifeno IA esteroideo o no esteroideo Fulvestrant También puede considerarse el acetato de megestrol QUIMIOTERAPIA en HER 2 positivo Primera Línea Herceptin combinado con algún citostático (docetaxel, paclitaxel, capecitabine, vinorelbine, gemcitabine) Segunda Línea Lapatinib + Capecitabine Quimioterapia no utilizada previamente ( en caso de contraindicación al esquema anterior o no estar disponible) Discutible Herceptin combinado (rotando el citostático a utilizar) 28 QUIMIOTERAPIA en HER 2 negativo Primera Línea Poliquimioterapia (Docetaxel-Capecitabine o Paclitaxel-Gemcitabine o combinaciones con Antracíclicos cuando no hayan sido previamente utilizados en adyuvancia ) Monoquimioterapia en caso de metástasis de bajo poder evolutivo o pacientes que por su terreno no son candidatas a poliquimioterapia. Puede considerarse combinaciones con Bevacizumab (Paclitaxel semanal de preferencia) si bien el nivel de evidencia del beneficio es inferior al de las recomendaciones anteriores. Líneas siguientes: Opciones no utilizadas en Primera Línea (ver texto) 29 CANCER DE MAMA: 2009 QUIMIOPREVENCION QUIMIPREVENCION DEL CANCER DE MAMA En el cáncer de mama las únicas intervenciones dirigidas a la prevención primaria que han sido evaluadas en estudios fase III son terapias hormonales que antagonizan el efecto del estrógeno endógeno, siendo el tamoxifeno y el raloxifeno los agentes que han probado su utilidad en la quimioprevención del cáncer mamario. Estos agentes se recomiendan para mujeres de alto riesgo con edad 35 años. Se destaca que solo reducen el riesgo de cáncer de mama receptor de estrógeno (RE) positivo, no previniendo el desarrollo de cáncer mamario REnegativo, responsable de aproximadamente el 30% de los cánceres mamarios en nuestra población. Tamoxifeno Existen 4 estudios fase III de quimioprevención con Tamoxifeno (20 mg/día v/o) comparado con placeo realizados en mujeres pre y posmenopáusicas. Estos estudios muestran que el Tamoxifeno disminuye el riesgo de desarrollar cáncer de mama invasivo RE-positivo y no invasivo en mujeres con un riesgo significativo y que el beneficio se extiende por al menos 10 años. El efecto sobre la mortalidad por cáncer de mama es desconocido. De acuerdo al metanálisis publicado en el 2003, la reducción del riesgo relativo de desarrollar cáncer de mama con Tamoxifeno es del 38%, de desarrollar cáncer de mama invasivo RE-positivo del 42 % y no reduce el riesgo de cáncer de mama RE negativo. En mujeres mayores de 50 años el Tamoxifeno se asocia a un riesgo aumentado de presentar cáncer de endometrio (RR 2.4), eventos tromboembólicos (RR 1.9), stroke (RR 1.82) y cataratas (RR 1.57) Existe al momento poca información para mujeres con riesgo genético, si bien la estrategia podría beneficiar a mujeres portadoras de mutaciones BRCA2. Raloxifeno El Raloxifeno a la dosis de 60 mg/dia ha demostrado reducir el riesgo de cáncer de mama invasivo RE positivo en mujeres postmenopausicas en igual proporción que el Tamoxifeno ( RR:1.02; IC 95% 0.82-1.28). El tamoxifeno se 30 asoció a un menor número de casos de carcinoma ductal in situ que el raloxifeno, no siendo la diferencia no fue estadísticamente significativa. Por otra parte, el Raloxifeno ha mostrado un mejor perfil de efectos adversos que el Tamoxifeno, con menor riesgo de eventos tromboembólicos, patología uterina benigna (incluyendo hiperplasia con atipías), histerectomías y cataratas. Si bien el cáncer de endometrio se observó menos frecuentemente en las pacientes tratadas con raloxifeno, la diferencia no resultó estadísticamente significativa. El beneficio observado en el riesgo de fracturas fue equivalente al observado en las pacientes bajo tratamiento con Tamoxifeno. Se desconoce el efecto de la quimioprevención con Raloxifeno sobre la mortalidad global o especifica por cáncer de mama. Lasofoxifeno El Lasofoxifeno, un SERM de 3ra generación, ha sido evaluado vs placebo en mujeres posmenopáusicas con osteoporosis en un estudio que incluyó 8237 pacientes. Los resultados preliminares de este estudio, presentados recientemente durante el encuentro de St. Gallen 2009, muestran que el Lasofoxifeno a la dosis de 0.5 mg/día por 5 años reduce el riesgo de desarrollar cáncer de mama RE+ en un 81% (HR: 0.19 IC 0.07-0.56) sin aumento del riesgo de cáncer de endometrio y con una incidencia de eventos tromboembólicas similar al Tamoxifeno. Inhibidores de aromatasa Hay varios estudios en curso de quimioprevención con inhibidores de aromatasa ( ej MAP.3, STELLAR, IBIS II) en mujeres posmenopáusicas. Se aguardan los primeros resultados para el año 2012. Recomendaciones : Considerar la quimioprevención en pacientes con riesgo aumentado de cáncer de mama, en especial en las portadoras de los siguientes factores de alto riesgo: - Hiperplasia con atipía - Carcinoma lobulillar in situ - Portadoras de genes de susceptibilidad o historia familar compatible con riesgo genético 31 A las pacientes con riesgo familiar se debería ofrecer asesoramiento genético. El mismo incluye considerar el riesgo de ser portadoras de un gen de susceptibilidad, los estudios genéticos disponibles, los potenciales beneficios, riesgos y limitaciones del estudio genético y las alternativas de prevención primaria, incluyendo la cirugía y la quimioprevención. En todos los casos, es fundamental discutir con la paciente todas las estrategias de prevención primaria disponibles, los riesgos y beneficios de la intervención propuesta y tener en cuenta si la expectativa de vida o los riesgos asociados a la presencia de comorbilidades justifican o no la intervención. Opciones de quimioprevención En la elección del tipo de agente a utilizar debe considerarse es estado menopáusico, las comorbilidades y en el caso de las pacientes postmenopáusicas si han sido histerectomizadas o no. La duración óptima del tratamiento se desconoce. Las recomendaciones se basan en la duración del mismo en los estudios que demostraron beneficio. 1.- Pre y postmenopáusicas: Tamoxifeno (20 mg/d for 5 years). Se asocia a riesgo aumentado de cáncer de endometrio, eventos tromboembólicas, stroke y cataratas. Reduce el riego de fracturas osteoporóticas 2.- Postmenopáusicas: también puede considerarse el Raloxifeno (60 mg/d for 5 years). Se asocia a menor riesgo de cáncer de endometrio, eventos tromboembólicos, stroke y cataratas, comparado con Tamoxifeno. Reduce el riego de fracturas osteoporóticas Se desaconseja la administración de tamoxifeno o raloxifeno a pacientes con antecedentes personales de accidente isquémico transitorio (AIT), stroke, trombosis venosas profundas (TVP) o tromboembolismo pulmonar (TEP) y a las pocientes premenopáusicas que no utilizan un método efectivo de anticoncepción no hormonal. 32 La utilización de otros SERMs o de inhibidores de aromatasa no se recomienda fuera de estudios clínicos. Controles a realizar En las pacientes no histerectomizadas se recomienda la realización de un control ginecológico previo al inicio del tratamiento y luego con una frecuencia anual o frente a la aparición de genitorragia. No hay evidencia suficiente para recomendar la ecografía ginecológica o la biopsia endometrial en mujeres que se encuentran asintomáticas. Si desarrollan síntomas visuales debe solicitarse valoración oftalmológica. 33 CANCER DE PULMON 2009 CANCER DE PULMON CELULAS NO PEQUEÑAS I) INTRODUCCION El cáncer de pulmón de células no pequeñas (a partir de ahora CPCNP) está integrado por tres tipos anatomopatológicos principales, a saber: carcinoma epidermoide, adenocarcinoma y el carcinoma de células grandes. Estas histologías se clasifican juntas porque cuando están localizadas, todas tienen potencial de curación con resección quirúrgica. La quimioterapia (QT) puede producir respuestas parciales objetivas y alivio de síntomas durante períodos cortos de tiempo en pacientes con enfermedad avanzada. Puede lograrse un control local con radioterapia (RT) en un gran número de pacientes con enfermedad no resecable, pero la curación se ve sólo en una pequeña minoría de pacientes. En el momento del diagnóstico, los pacientes con CPCNP pueden dividirse en tres grupos que reflejan el grado de la enfermedad y el enfoque del tratamiento. El primer grupo de pacientes tiene tumores que son quirúrgicamente resecables, en general estadios I y II. Este es el grupo con el mejor pronóstico dependiendo de una variedad de factores del tumor y del huésped. Los pacientes con enfermedad resecable que tienen contraindicaciones médicas a la cirugía pueden ser considerados para RT curativa. El segundo grupo incluye a los pacientes con cáncer de pulmón avanzado Localmente (T3-T4) o regionalmente (N2-N3) que tienen una historia natural diversa. Este grupo se trata con RT o con RT en combinación con QT. El último grupo de pacientes presenta metástasis distantes (M1) descubiertas en el momento del diagnóstico. Este grupo puede tratarse con RT para aliviar los síntomas del tumor primario, pero la QT es el tratamiento central. Los pacientes con buen performance status, las mujeres y los pacientes con metástasis distantes confinadas a un solo sitio parecen vivir más que otros. La QT a base de cisplatino ha sido asociada con el alivio de los síntomas y una pequeña pero significativa ventaja en la sobrevida contra los tratamientos paliativos no oncoespecíficos. 34 Actualmente existe más de un tipo de QT disponible para este subgrupo de pacientes. Dado que el tratamiento quirúrgico con criterio curativo, solo es posible en un bajo porcentaje, aquellos pacientes que reúnan las condiciones exigidas para estudios de investigación clínica, deberían formar parte de los mismos. SCREENING/DIAGNOSTICO PRECOZ No existe evidencia que ningún estudio paraclínico de screening o de diagnóstico precoz en pacientes de riesgo, tenga un impacto favorable en la reducción de la mortalidad por CPCNP. 1. DIAGNOSTICO El objetivo fundamental de la estadificación previa al tratamiento es evaluar la extensión de la enfermedad para poder determinar el pronóstico y la planificación del tratamiento. 1.1. Diagnóstico cito/histológico Previo al tratamiento, es IMPERATIVO la obtención de una muestra cito o histológica adecuada que permita el diagnóstico de cáncer de pulmón y de su variedad histológica, lo cual puede tener implicancias diagnósticas, pronósticas y terapéuticas. Las técnicas más frecuentes para la obtención de las muestras cito/histológicas son: Fibrobroncoscopía Punción transparietal bajo técnica de imagen (Ecografía, Tomografía Axial computada) Punción espirativa con aguja fina de lesiones palpables (p. ej. adenomegalias supraclaviculares, nódulos subcutáneos) Citología del esputo Punción para obtención de líquidos en serosas (p. ej. toracocentesis, paracentesis, etc) Estudios endoscópicos (mediastinoscopía, toracoscopía, etc) Toracotomía, mediastinotomía 1.2. Clasificación patológica Actualmente la clasificación histológica del cáncer de pulmón de células no pequeñas es: 35 Carcinoma de células escamosas (epidermoide) - Variante de células fusiformes Adenocarcinoma - Acinar - Papilar - Broncoalveolar - Tumor sólido mucinoso Carcinoma de células grandes - Célula gigante - Célula clara Carcinoma adenoescamoso Carcinoma indiferenciado ESTADIFICACION Puesto que la determinación del estadio tiene implicaciones terapéuticas y pronósticas importantes, es fundamental llevar a cabo una cuidadosa evaluación diagnóstica inicial para definir la ubicación y el grado de compromiso primario del tumor primario y sus metástasis, a fin de ofrecer el tratamiento más adecuado. La estadificación de la enfermedad se basa en una combinación de clasificación clínica (examen físico, estudios radiológicos y de laboratorio) y patológica (biopsia de ganglios linfáticos, fibrobroncoscopía, mediastinoscopía, o mediastinotomía anterior). La estadificación del mediastino es fundamental, cuando se necesita una evaluación exacta del estado ganglionar para determinar la terapia a utilizar. 1.3. Sistema TNM de estadificación del Cáncer de Pulmón El Sistema de Estadificación del cáncer de pulmón a células no pequeñas está basado en el sistema TNM, cuya útima edición (6ª) fue publicada en el año 2002. T: tumor primario Tx: no se puede evaluar el tumor primario o tumor demostrado por citología pero sin demostración radiológica o fibrobroncoscópica T0: sin evidencias de tumor primario Tis: carcinoma in situ T1: tumor de diámetro máximo 3 cm rodeado de pulmón o pleura visceral, sin evidencia de invasión proximal al bronquio lobar (es decir sin invasión del bronquio principal) 36 T2: tumor con alguna de las siguientes características: diámetro mayor a 3cm afecta bronquio principal a más de 2 cm de la carina invade pleura visceral se asocia a atelectasia o neumonitis obstructiva que no afectan todo el pulmón T3: tumor de cualquier tamaño que invade alguna de las siguientes estructuras potencialmente resecables: pared torácica (se incluyen los tumores de la cisura superior), diafragma, pleura mediastínica, pericardio; o tumor en el bronquio principal a menos de 2 cm de la carina pero sin alcanzarla; o atelectasia o nemonitis obstructiva de todo el pulmón T4: tumor de cualquier tamaño que invade estructuras irresecables: corazón, grandes vasos, tráquea, esófago, cuerpo vertebral, carina; o nódulo tumoral separado en el mismo lóbulo; o presencia de derrame pleural o pericárdico malignos (Nota: el CBP es el único cáncer en el cual el derrame pleural maligno no es considerado enfermedad M1. En la práctica clínica, pequeños derrames en general detectados por TAC son a veces difíciles de evaluar. Se asume que estos derrames son malignos a menos que el líquido sea un trasudado, no hemorrágico y citológicamente negativo en repetidas ocasiones, en cuyo caso el T debe clasificarse como T1-T3.). N: ganglios linfáticos regionales Nx: no se pueden evaluar N0: no se evidencian metástasis en ganglios regionales N1: metástasis en ganglios intrapulmonares homolaterales y/o peribronquiales homolaterales y/o hiliares homolaterales N2: metástasis en ganglios mediastinales homolaterales y/o subcarinales N3: en ganglios mediastinales y/o hiliares contralaterales, escalenos o supraclaviculares M: metástasis a distancia Mx: no se pueden evaluar M0: no hay metástasis a distancia M1: metástasis a distancia incluyendo nódulos tumorales separados situados en lóbulos diferentes En base a esta clasificación, se propone la siguiente agrupación en estadios: 37 Estadio 0: Tis,N0,M0 Estadio IA: T1,N0,M0 Estadio IB: T2,N0,M0 Estadio IIIA: T3,N1,M0 T1-3,N2,M0 Estadio IIIB: T,N3,M0 Estadio IIA: T1,N1,M0 T4,N,M0 Estadio IIB: T2,N1,M0 Estadio IV: T,N,M1 T3,N0,M0 1.4. Valoración clínica y paraclínica con fines estadificadores Anamnesis y examen físico Rx Tx (F y P) Fibrobroncoscopía Mediastinoscopía: indicada en pacientes candidatos a cirugía en quienes la valoración imagenológica revela ganglios mediastinales. TAC de Tórax y Abdomen superior. Funcional y Enzimograma Hepático con LDH Calcemia. Centellograma óseo: si calcemia elevada y/o dolores óseos. de rutina en pacientes quirúrgicos. TAC Encefálica: si sintomatología y/o signología neurológica. de rutina en pacientes quirúrgicos, tipo adenocarcinoma PET-Scan: aún no disponible en nuestro medio. De fundamental importancia para sensibilidad y la estadificación especificidad en el del cáncer diagnóstico de pulmón. de Su metastasis ganglionares mediastinales y metastasis extratorácicas es del 79% y 91% respectivamente, mientras que las de la TAC son de 60% y 77% respectivamente. 2. TRATAMIENTO 2.1. TRATAMIENTO DE LOS ESTADIOS I Y II 2.1.1. Cirugía La cirugía es el tratamiento de elección para los pacientes con CPCNP en estadio I y II, siendo la única modalidad terapéutica que alcanza sobrevidas prolongadas aceptables que fluctúan entre el 35% y 70% según la extensión de la enfermedad (estadio I vs. Estadio IIB) La posibilidad de la misma, depende de la resecabilidad del tumor y de la operabilidad del paciente. La lobectomía es el procedimiento 38 quirúrgico de elección, siendo igualmente efectiva que la neumontectomía, pero con menor morbimortalidad operatoria. En los pacientes con tumores estadios I y II, técnicamente resecables pero inoperables por causas médicas o negativa del paciente, la radioterapia radical es una alternativa razonable y en algunos casos potencialmente curativa. El valor de la quimioterapia en esta situación es discutido y probablemente sea de escaso beneficio. 2.1.2. Quimioterapia adyuvante Considerarla en pacientes con buen performance status, sin comorbilidades importantes, con tumores estadio IB, II, III. El beneficio absoluto en términos de sobrevida global es de 4% a 5 años. El beneficio en el estadio IB no fue constatado en todos los estudios y además constituyó un subgrupo pequeño dentro de la mayoría de los estudios. Por lo tanto, el nivel de evidencia para la recomendación de QT adyuvante en estos casos es menor que en los estadios II-III. Los planes a emplear en esta situación son: Cisplatino 100 mg/m2 i/v D 1 Etopósido: 100 mg/ m2 i/v D 1-3 Cisplatino: 80-100 mg/m2 i/v D 1 Vinorelbina: 25-30 mg/m2 D1, D8 y D15 Cada 3 semanas x 3-4 series No se ha demostrado en los estudios randomizados publicados, que otros esquemas útiles en esnfermedad avanzada, generen beneficios en este grupo de pacientes. 2.1.3. Radioterapia postoperatoria De indicación indiscutida en pacientes operados con márgenes positivos (en estos casos la RT precede a la QT adyuvante). En los pacientes con ganglios positivos, la RT postoperatoria es de indicación habitual y mejora las tasas de control local, pero no tendría impacto en la sobrevida global (en estos casos debe realizarse posteriormente a la QT). 2.2. TRATAMIENTO DEL ESTADIO IIIA El manejo terapéutico de los tumores T1-3, N2 constituye uno de los 39 puntos más controversiales en el tratamiento del CPCNP. Este grupo presenta una considerable heterogeneidad en su presentación clínica, tratamiento y pronóstico. En los pacientes con tumores IIIA por N1 (T3, N1, M0) la cirugía es el tratamiento de elección. El valor de la quimioterapia neoadyuvante en estos pacientes es controversial. En los pacientes con tumores IIIA por N2, la modalidad de tratamiento a emplear dependerá de la extensión del compromiso mediastinal. En vistas a su manejo, los pacientes con tumores IIIA por N2 pueden dividirse en 4 subgrupos: a) aquellos en los que el compromiso N2 es encontrado en el estudio anatomopatológico de la pieza, b) aquellos en que se reconoce en el intraoperatorio c) aquellos en que se reconoce en la evaluación preoperatoria una enfermedad N2 potencialmente resecable d) aquellos con un compromiso N2 bulky irresecable. En los pacientes con tumores en la categoría (a) está indicada la realización de QT adyuvante. En quienes el compromiso N2 se encuentra en el intraoperatorio (subgrupo b), la conducta quirúrgica dependerá del grado de afectación N2 (resección o no resección). En los que se realiza la resección está indicada la QT adyuvante. En aquellos con enfermedad bulky (d), su manejo es similar al de los pacientes con tumores estadio IIIB (ver sección 5.3). En los pacientes con tumores en la categoría (c), su manejo es controvertido y depende en gran medida de la experiencia del equipo tratante y el grado de compromiso tumoral. Las posibilidades de tratamiento son: a) Cirugía seguida de QT adyuvante b) QT neoadyuvante seguida de cirugía El valor de la quimioterapia neoadyuvante x 2-3 series no está definitivamente aclarado. En más del 90% de los pacientes que reciben este tratamiento, es posible la resección quirúrgica. Sin embargo, el beneficio en términos de sobrevida de esta estrategia es discutido, existiendo resultados contradictorios en los distintos estudios randomizados. En los pacientes con tumores estadios III técnicamente resecables pero inoperables por causas médicas o negativa del paciente, la radioterapia radical asociada a quimioterapia es el tratamiento de elección (ver sección 5.3). Los pacientes con tumores del vértice (tumor de Pancoast) constituyen un 40 subgrupo con ciertas características particulares, como ser su tendencia a la invasividad local y menor tendencia a dar metástasis a distancia. En los pacientes con tumores de vértice estadificados como T3, N0-1,M0, potencialmente resecables, la radioterapia o preferentemente radioquimioterapia preoperatorios facilitan la resección y mejoran el control local. En los tumores de Pancoast irresecables, la conducta es similar que en el estadio IIIB. 2.2.1. Quimioterapia adyuvante Ver sección 5.1.2 2.3. TRATAMIENTO DEL ESTADIO IIIB En este estadio, así como en el estadio IIIA irresecable, la cirugía no es una opción de tratamiento. La principal modalidad es la radioterapia, generalmente asociada a quimioterapia. En los pacientes con derrame pleural o pericárdico malignos, está contraindicada la radioterapia con criterio radical, siendo su manejo similar a la de los pacientes con tumores estadio IV. 2.3.1. Radioterapia exclusiva Este tratamiento debe reservarse para los pacientes que por alguna razón (estado general, performance status, comorbilidades, etc.) no puedan recibir quimioterapia asociada. La RT primaria deberá consistir en aproximadamente 6000 cGy aplicados con equipo de megavoltaje al plano medio del volumen conocido del tumor empleando fraccionamiento convencional. Frecuentemente se emplea un boost de sobreimpresión, llegando a los 6800-7000 cGy. 2.3.2. Radioterapia combinada con Quimioterapia La combinación de radioterapia con poliquimioterapia es el tratamiento de elección para los pacientes con tumores estadio IIIB y IIIA irresecables. La asociación de cisplatino monodroga a la quimioterapia no ha demostrado impacto en las tasas de respuesta, control local ni sobrevida, aumentando la toxicidad del tratamiento, por lo que no se recomienda. 41 Los esquemas de poliquimioterapia secuencial (2-3 series previas a la radioterapia) o concurrente (2-3 series exclusivamente durante la radioterapia) son los que han demostrado un mayor impacto en la sobrevida, aumentando la sobrevida mediana en 3-4 meses y la sobrevida a 2 años en un 4%, en comparación con la radioterapia exclusiva. A su vez, los esquemas concurrentes han demostrado ser superiores que los secuenciales. Estas estrategias combinadas, y particularmente la concurrente, se asocian a un incremento significativo en la toxicidad hematológica y no hematológica (principalmente esofagitis), y en las muertes por el tratamiento. Por este motivo, deben reservarse para pacientes con buen estado general y performance status y que no presenten comorbilidades importantes. En caso de no poder realizarse RT-PQT concurrente, puede emplearse la estrategia secuencial QT RT. Un estudio reciente demostró que no existe beneficio con el uso de docetaxel como mantenimiento o consolidación. En suma, las posibles formas de combinar la PQT con la RT son: Tratamiento secuencial Evaluado en ensayos F. III Tratamiento concurrente Los esquemas de PQT que pueden emplearse en el tratamiento de los pacientes con tumores estadio III irresecables son: Cisplatino-Etopósido: Cisplatino: 80-100 mg/m2 i/v D 1 Etopósido: 100 mg/ m2 i/v D 1-3 Cada 21 días X 2-3 series Paclitaxel-Carboplatino (secuencial): Paclitaxel: 175 mg/ m2 i/v D1 Carboplatino AUC 6 D1 Cada 21 días Paclitaxel-Carboplatino (concurrente con RT): Paclitaxel: 50 mg/ m2 i/v semanal Carboplatino AUC 2 semanal Durante la RT 42 2.4. CESACION DEL TABAQUISMO Debe procurarse en todo paciente. Adicionalmente, en el CPCNP tratado con RT +/- QT, existen estudios que sugieren que el abandono del hábito tabáquico mejoraría la sobrevida de los pacientes tratados. 2.5. TRATAMIENTO DEL ESTADIO IV 2.5.1. Cirugía De indicación infrecuente en el CPCNP metastático. Puede indicarse en pacientes con metástasis en SNC o suprarrenales únicas con tumor primitivo resecable o previamente resecado. 2.5.2. Quimioterapia Debe reservarse exclusivamente para pacientes con PS 0-1 (y pacientes seleccionados con PS 2), en quienes ha demostrado mejorar la sobrevida en comparación con el tratamiento paliativo. Los posibles planes de quimioterapia en pacientes con PS 0-1 son: Cisplatino-Etopósido: Cisplatino: 100 mg/m2 i/v D 1 Etopósido: 100 mg/ m2 i/v D 1-3 Cada 21 días Paclitaxel-Carboplatino: Paclitaxel: 175-225 mg/ m2 i/v D1 x no más de 6 series Carboplatino AUC 6 D1 Cada 21 días Cisplatino-Docetaxel: Cisplatino: 75 mg/m2 i/v D 1 Docetaxel: 75 mg/ m2 i/v D 1-3 Cada 21 días Otras combinaciones con platino (Cisplatino-Gemcitabina, CisplatinoVinorelbine) tienen similares resultados. El agregado de Bevacizumab al plan Carboplatino-Paclitaxel en pacientes con histología no-epidermoide, sin hempoptisis ni metástasis encefálica y menores de 70 años, se asocia a mejoría significativa en la 43 sobrevida libre de enfermedad y global. Otro estudio mostró también un aumento en la sobrevida libre de progresión en combinación con Cisplatino-Gemcitabine. Por otra parte pueden incluirse entre los esquemas de primera línea otras dos drogas. Un estudio mostró que la asociación de CisplatinoPemetrexed presentó una sobrevida global superior y una menor mielotoxicidad que la combinación Cisplatino-Gemcitabine, en la histología no-epidermoide. Por otra parte en un estudio reciente el agregado de Cetuximab a la combinación Cisplatino-Vinorelbine mostró un aumento de la sobrevida global al compararlo con CisplatinoVinorelbine, pero con una diferencia estadística significativa pero marginal (HR:0.871 0,762-0,996, p: 0,04) En los pacientes añosos o con PS 2 pueden realizarse esquemas de monoquimioterapia (Docetaxel 100 mg/m2 i/v D1 c/3 sem; Vinorelbine 30 mg/m2 i/v D1,D8,D15 c/28 días), Gemcitabine 1.000 a 1.250 mg/m2 D1, 8 y 15 cada 28 días o recibir Carboplatino-Paclitaxel. La duración de la QT debe ser de 4-6 series, incluso en pacientes respondedores. Los tratamientos más prolongados se asocian a mayor toxicidad sin mejorar los resultados a corto y largo plazo. Los pacientes que no responden no deben recibir más de 2-3 series de tratamiento. Los dobletes de 3ª generación, es decir aquellos que contienen sal de platino + taxano, vinorelbine o gemcitabine, se asocian a un incremento en la tasa de respuestas y una mejoría discreta en la tasa de sobrevida, en comparación con los dobletes de 2ª generación (platino + etopósido o vinblastina). Además, su perfil de toxicidad es más favorable. Los dobletes sin platino deben reservarse exclusivamente para pacientes con contraindicación para recibir sales de platino (Vinorelbina 2530mg/M2- Gemcitabine 1.000-1250 mg/M2 Dia 1 y 8 cada 21 dias) 2.5.3. Radioterapia Puede emplearse para la paliación de ciertos cuadros clínicos como por ejemplo: hemoptisis, síndrome mediastinal, atelectasia, compresión medular, metástasis óseas, metástasis SNC, entre otros. 44 2.5.4. Tratamiento de 2ª línea Existen 3 opciones estándar: o Docetaxel o Erlotinib o Pemetrexed En la selección deben considerarse el performance status, tratamiento recibido en 1ª línea, su tolerancia y respuesta, así como otras características de la enfermedad y el paciente. El Docetaxel 75 mg/m2 i/v cada 21 días, presenta una tasa de respuestas objetivas del 7-9% y una sobrevida mediana de 6-7 meses. La exposición previa al Paclitaxel no modifica la probabilidad de respuesta al Docetaxel en segunda línea. En los pacientes que no responden a la QT de primera línea, las probabilidades de respuesta al Docetaxel en segunda línea son mínimas, por lo que debería reservarse para pacientes que progresan luego de haber respondido previamente a un tratamiento de primera línea. Otras drogas utilizadas en esta situación, con similares resultados que el Docetaxel pero distinto perfil de toxicidad, son las pequeñas moléculas inhibidoras del EGFR (de preferencia Erlotinib y Gefitinib) y el Pemetrexed 3. CONTROL Y SEGUIMIENTO La escasez de opciones de tratamiento con criterio curativo en el caso del cáncer de pulmón de células no pequeñas ha empobrecido la relación costo/efectividad del seguimiento radiológico intensivo después de la resección quirúrgica. Sin embargo, hay un aumento en la incidencia de segundos tumores primarios de pulmón (3 % anual), y la Rx o TAC de tórax anual o semianual puede ser útil para detectar estos tumores. Ningún otro estudio se recomienda en forma rutinaria; los mismos se solicitarán de acuerdo a la existencia de síntomas y signos. Cualquier paciente que muestra síntomas después del tratamiento primario debe ser evaluado intensamente para detectar precozmente la falla local o a distancia, así como posibles segundos tumores primarios. 45 CANCER DE A PULMON A CELULAS PEQUEÑAS I) DIAGNOSTICO Y ESTADIFICACIÓN El objetivo fundamental de la estadificación previa al tratamiento es evaluar la extensión de la enfermedad para poder determinar el pronóstico y la planificación del tratamiento. a. Diagnóstico cito/histológico Previo al tratamiento, es IMPERATIVO la obtención de una muestra cito o histológica adecuada que permita el diagnóstico de cáncer de pulmón y de su variedad histológica, lo cual puede tener implicancias diagnósticas, pronósticas y terapéuticas. Las técnicas más frecuentes para la obtención de las muestras cito/histológicas son: Fibrobroncoscopía Punción transparietal bajo técnica de imagen (Ecografía, Tomografía Axial computada) Punción espirativa con aguja fina de lesiones palpables (p. ej. adenomegalias supraclaviculares, nódulos subcutáneos) Citología del esputo Punción para obtención de líquidos en serosas (p. ej. toracocentesis, paracentesis, etc) Estudios endoscópicos (mediastinoscopía, toracoscopía, etc) Toracotomía, mediastinotomía b. Clasificación patológica Actualmente la clasificación histológica del cáncer de pulmón a células pequeñas es: carcinoma de células pequeñas carcinoma mixto de células pequeñas y grandes carcinoma combinado de células pequeñas (células pequeñas de cáncer de pulmón combinadas con componentes neoplásicos escamosos, glandulares o ambos). II) ESTADIFICACION Para la estadificación del CPCP no se emplea el sistema TNM. El sistema más usado es uno sencillo de 2 etapas desarrollado por el Grupo de Estudio del Cáncer de pulmón de la Administración de Veteranos de EE.UU. 46 Estadio limitado Significa que el tumor está limitado al hemitórax de orígen, el mediastino y los ganglios supraclaviculares homolaterales, es decir que pueda ser abarcado en un campo amplio de radioterapia. No existe una definición universalmente aceptada de este término y los pacientes con derrame pleural homolaeral al tumor y ganglios supraclaviculares contralaterales han sido incluídos en la etapa limitada y también excluídos de ella por diferentes autores. Estadio extendido Implica la existencia de enfermedad más allá de la limitada. Los pacientes con metástasis a distancia siempre son incluidos en la etapa extendida. a. Valoración clínica y paraclínica con fines estadificadores Anamnesis y examen físico Rx Tx (F y P) Fibrobroncoscopía Funcional y Enzimograma Hepático con LDH Hemograma LDH: de valor pronóstico TAC de Tórax y Abdomen superior. Si no revela metástasis a distancia se realiza: Centellograma óseo. Si no revela metástasis a distancia se realiza: TAC cráneo. Si no revela metástasis a distancia se realiza: Mielograma +/- BMO En un paciente asintomático no se recomienda realizar nuevos estudios de estadificación una vez que se constata un CPCP extendido. Si una vez realizados todos loss estudios no se encuentran metástasis, entonces se está definitivamente ante un tumor en etapa limitada. En presencia de síntomas orientadores a metástasis deben realizarse los estudios pertinentes, independientemente que ya se haya realizado el diagnóstico de etapa extendida. III) TRATAMIENTO 3.1. ENFERMEDAD LIMITADA 3.1.1. Cirugía 47 La única excepción a la no operabilidad de los pacientes con CPCP, serían aquellos que según la clasificación TNM correspondieran a un T1,N0,M0. Estos pacientes pueden ser candidatos a cirugía, previa estadificación invasiva con mediastinoscopía (la cual debe ser negativa). Este tratamiento debe seguirse en todos los casos de quimioterapia+/radioterapia. 3.1.2. Quimioterapia-Radioterapia En todos los demás pacientes, el tratamiento actual del CPCP en estadio limitado consiste en la combinación de quimioterapia en base a etopósido y sal de platino, junto con radioterapia torácica, la cual necesariamente debe iniciarse con los primeros ciclos de la quimioterapia. Los posibles planes de quimioterapia son: Cisplatino-Etopósido: Cisplatino: 80 mg/m2 i/v D 1 Etopósido: 100 mg/ m2 i/v D 1-3 Cada 21 días x 4-6 series Carboplatino-Etopósido: Carbolatino: AUC 5-6 i/v D 1 Etopósido: 100 mg/ m2 i/v D 1-3 Cada 21-28 días La quimioterapia sola (sin radioterapia) es una alternativa válida en pacientes con contraindicaciones para recibir radioterapia (p. ej. radioterapia previa, mala función pulmonar, etc.) Otros esquemas posibles incluyen al VAC, el cual se asocia resultados similares que el Cisplatino-Etopósido, pero con una toxicidad considerablemente superior. VAC: Vincristina 1,4 mg/m2 i/v D1 (máximo 2 mg) Adriamicina 50 mg/m2 i/v D1 Ciclofosfamida 750 mg/m2 i/v D1 Cada 21 días 3.1.3. RT holocraneal profiláctica 48 Debe considerarse en pacientes tratados con quimioterapia +/radioterapia y que alcanzan una respuesta completa, pues existe una probabilidad del 60% de desarrollar metástasis encefálicas en los 2-3 años siguientes al tratamiento. 3.2. ENFERMEDAD EXTENDIDA 3.2.1. Quimioterapia Se emplean los mismos esquemas que se comentaron en la sección anterior. No se ha definido claramente la duración óptima de la quimioterapia, pero no hay evidencia de un aumento de la sobrevida con más de 6 ciclos de QT. 3.2.2. Radioterapia El agregado de radioterapia en pacientes con enfermedad diseminada no mejora la tasa de respuestas ni la sobrevida. Por lo tanto no existe indicación para la radioterapia torácica más allá de pacientes con enfermedad intratorácica progresiva luego de la quimioterapia, o la paliación de la enfermedad metastásica, especialmente metástasis cerebrales, epidurales y óseas. 3.2.3. Radioterapia holocraneana profiláctica Debe considerarse en pacientes tratados con quimioterapia y que alcanzan una respuesta completa. 3.3. TRATAMIENTO DE SEGUNDA LINEA El pronóstico para el carcinoma de células pequeñas que ha progresado a pesar de la QT es muy malo independientemente de la etapa de la enfermedad. La supervivencia esperada es de 2 a 3 meses. 3.3.1. Recaída antes de 3 meses En los pacientes que recaen antes de los 3 meses de culminado el tratamiento de primera línea, la monoquimioterapia tendría similares resultados que la poliquimioterapia, con menor toxicidad. Las tasas de respuesta esperadas son del orden del 10%. Las posibles drogas a emplear son: 49 Paclitaxel 175-250 mg/m2 i/v D1 Docetaxel 75 mg/m2 i/v D1 Ifosfamida 2.000 mg/m2 D1-D5 Gemcitabine 1000 mg/m2 D1, D8, D15 3.3.2. Recaída entre 3 y 6 meses En los pacientes que recaen entre los 3 y 6 meses de culminado el tratamiento de primera línea, la monoquimioterapia con topotecán es el tratamiento de elección (1,5 mg/m2 D1 a D5 cada 21 días). Las tasas de respuesta esperadas son del orden del 25%. Otros posibles esquemas de tratamiento son los mismos que en la sección anterior y el VAC (similar eficacia que el topotecán con mayor toxicidad). 3.3.3. Recaída después de los 6 meses Los pacientes que han respondido en un principio y han recaído más de 6 meses del tratamiento inicial, son los que tienen más probabilidad de responder a la QT de segunda línea. En estos pacientes se puede emplear el mismo plan terapéutico que en la primera línea. Si el plan de primera línea utilizado es el VAC, debe iniciarse con platino-etopósido. 3.4. CESACION DEL TABAQUISMO Debe procurarse en todo paciente, tanto previo, durante como luego del tratamiento. Adicionalmente, en el CPCP, existen estudios que sugieren que el abandono del hábito tabáquico mejoraría la sobrevida de los pacientes tratados. IV) CONTROL Y SEGUIMIENTO Una vez finalizado el tratamiento, se realizarán controles clínicos cada 3 meses durante el primer año, y posteriormente cada 4-6 meses los años siguientes. Luego de los 5 años se recomienda control clínico anual. Adicionalmente se sugiere realizar valoración imagenológica del tórax cada 6-12 meses. Ningún otro estudio se recomienda en forma rutinaria; los mismos se solicitarán de acuerdo a la existencia de síntomas y signos. 50 2009 CANCER DE LARINGE 1. INTRODUCCIÓN Las neoplasias de la esfera otorrinolaringológica (ORL) constituyen un grupo heterogéneo y complejo de entidades, dentro de las cuales se encuentra el cáncer de laringe. Si bien no constituye un tumor de alta incidencia/mortalidad su importancia radica en la incapacidad y morbilidad que produce y la presencia de factores de riesgo prevenibles como son el tabaquismo y alcoholismo entre otros. La distribución por regiones está representada en primer lugar por los cánceres de glotis 60-65 %, seguido de la supraglotis 30-35 % y por último la subglotis 5 %; teniendo a su vez cada topografía diferentes características clínico-biológicas que determinan un tratamiento y pronóstico particular. 2. DIAGNÓSTICO Diagnóstico de tumor primario: - Anamnesis y examen físico (ORL). - Endoscopía de vía aérea. - Biopsia. - TAC de cuello para valorar compromiso locorregional. - RMN en casos seleccionados. - Estudios de valoración general. Diagnóstico de extensión a distancia: - Rx Tx o TAC Tx para evaluar diseminación pulmonar y/o ganglionar. - Otros estudios según sospecha clínica de diseminación. - PET scan, útil en caso de masas residuales y para valoración de respuesta al tratamiento. 51 Si bien la evaluación odontológica no forma parte del diagnóstico, se recomienda realizar la misma previo inicio del tratamiento con el fin de erradicar todo posible foco infeccioso que pueda en la evolución aumentar el porcentaje de complicaciones infecciosas por el tratamiento. 3. ESTADIFICACIÓN 3.1. Sistema TNM de estadificación del cáncer de laringe El Sistema de Estadificación del cáncer de laringe está basado en el sistema TNM, en el cual el T del tumor primario es específico, según sea un tumor de supraglotis, glotis o subglotis. La misma está basada en la extensión del tumor hacia tejidos adyacentes, la movilidad de la CV, extensión ganglionar y presencia o ausencia de metástasis. Supraglotis T1. Tumor limitado al lugar de origen con movilidad normal de las cuerdas vocales. T2. Tumor que invade estructuras adyacentes de la supraglotis o glotis sin fijación de la laringe. T3. Tumor limitado a la laringe con fijación de la cuerda vocal o que invade área postcricoidea, pared medial del seno piriforme o tejidos preepiglóticos, espacio paraglótico o erosión menor del cartílago tiroideo. T4a. Tumor invade a través de los cartílagos tiroideos o invade los tejidos más allá de la laringe. T4b. El tumor invade el espacio prevertebral, envuelve la arteria carótida o invade las estructuras del mediastino Glotis T1. Tumor limitado a una (T1a) o ambas (T1b) cuerda(s) vocal(es) que puede afectar la comisura anterior o posterior con movilidad normal. T2. Tumor se extiende a la supraglotis o a la subglotis o hay deterioro de la movilidad de la cuerda vocal T3. Tumor limitado a la laringe con fijación de la cuerda vocal o invade el 52 espacio paraglótico, o hay erosión menor del cartílago tiroideo. T4a. Tumor invade a través de los cartílagos tiroideos o invade los tejidos más allá de la laringe. T4b. El tumor invade el espacio prevertebral, envuelve la arteria carótida o invade las estructuras del mediastino Subglotis T1. Tumor limitado a la subglotis, con movilidad normal de la cuerda vocal. T2. Tumor se extiende a la(s) cuerda(s) vocal(es) con movilidad normal o deteriorada. T3. Tumor limitado a la laringe con fijación de la cuerda vocal. T4. Invasión o destrucción del cartílago tiroideo. Ganglios linfáticos regionales (N) NX. No pueden evaluarse los ganglios linfáticos regionales N0. No hay metástasis a los ganglios linfáticos regionales N1. Metástasis en un solo ganglio linfático ipsilateral, < o = a 3 cm. N2. N2a. Metástasis en un solo ganglio linfático ipsilateral > de 3 cm pero < o = a 6 cm. N2b. Metástasis en múltiples ganglios linfáticos ipsilaterales, < o = a 6 cm. N2c. Metástasis en ganglios linfáticos bilaterales o contralaterales, < o = a 6 cm. N3. Metástasis en un ganglio linfático > de 6 cm. Estadio 0: Tis, N0, M0 Estadío I: T1, N0, M0. Estadío II: T2, N0, M0. Estadío III : T3, N0, M0, T1-3, N1, M0. Estadío IVA : T4a, N0-1, M0, T1-4a, N2, M0. Estadío IVB: T4b, cualquier N, M0 Cualquier T, N3, M0. 53 Estadío IVC: Cualquier T, cualquier N, M1. 4. TRATAMIENTO 4.1. TRATAMIENTO DE LOS ESTADIOS LIMITADOS, I Y II T1 Y T2 se corresponden con estadios I y II. Corresponden a un amplio espectro de situaciones. Deberían tratarse inicialmente con intento conservador de la función del órgano, resecando el tumor. 4.1.1. Cirugía La cirugía es uno de los tratamientos de elección para los pacientes con cáncer de laringe en estadio I y II, la magnitud de la misma estará determinada por la extensión y topografía del tumor en el órgano. Opciones: 1- Cirugía láser 2-Laringectomía parcial. La cirugía conservadora debe tener como objetivo márgenes libres, el concepto de margen estrecho seguido de RT post-operatoria, no es satisfactorio dado que la suma de ambos tratamientos puede afectar la funcionalidad del órgano. La recurrencia local luego de tratamiento conservador puede rescatarse con: 1-Cirugía conservadora 2-Cirugía radical, especialmente en T2. 4.1.2. Radioterapia Representa una opción terapéutica para pacientes con cáncer de laringe en estadíos I y II al igual que la cirugía, teniendo resultados en control y sobrevida comparables. No existen estudios randomizados que comparen cirugía vs. Radioterapia, teniendo ambos tratamientos cifras de control local y sobrevida comparables. 54 4.2. TRATAMIENTO DEL ESTADIO III–IVA.TUMORES RESECABLES. 4.2.1Tratamiento quirúrgico: 1-Cirugía conservadora del órgano: Sólo un pequeño porcentaje de éstos es pasible de cirugía conservadora del órgano. No se recomienda en estos casos RT posterior ni QT de inducción. Si se considera la Laringectomía total como salvataje, la sobrevida es igual al tratamiento radical. 2- Laringectomía total (LT), más vaciamiento ganglionar de cuello, siempre que el paciente sea operable, seguido de tratamiento adyuvante para aquellos que presenten factores de riesgo de recaída. 4.2.2Tratamientos de Preservación del órgano. El tratamiento de preservación del órgano es una opción terapéutica válida para aquellos pacientes que presenten un cáncer de laringe E IIIIVA curable con tratamiento quirúrgico. Indicaciones: -Cuando la LT es la única opción terapéutica quirúrgica. -Cuando el resultado funcional luego de una cirugía conservadora se considera insatisfactorio. -Cuando la experiencia en el medio en ese tipo de cirugía conservadora es escasa. -Cuando no existe compromiso del cartílago ni de partes blandas. a) Radioquimioterapia concurrente (RT-QT) La RT-QT concurrente es considerada el tratamiento estándar del cáncer de laringe resecable en el que se desea conservar el órgano. A partir de un estudio randomizado publicado en el año 2003 (RTOG 91-11, Forastiere et al.) la RT-QT con Cisplatino concurrente pasó a ser el tratamiento de preservación estándar del cáncer de laringe, al demostrar mayor porcentaje de preservación de la laringe y mayor control locorregional, que la RT exclusiva o la Poliquimioterapia seguida de RT. Un análisis del estudio a 5 años muestra que sobrevida libre de laringectomía es superior en los brazos que usaron QT , es decir tanto para la RT+QT como para la PQT seguida de RT. 55 La progresión lesional y el control locorregional sigue siendo superior para la RT+QT, sin beneficio en la QT de inducción. No existen diferencias significativas en la SVG entre los 3 brazos del estudio. CDDP 100 g/m2 D1, D22, D 43 de la RT. La dosis de RT es de 70 Gy. b) Quimioterapia de inducción seguida de RT Esta opción de tratamiento que se considera desde el estudio RTOG 9111 de Forastiere et al. Como una alternativa conservadora al cáncer de laringe resecable, tiene una sobrevida libre de laringectomía superior a la del brazo que utilizó RT exclusiva. Sin embargo, la SV libre de progresión y el control locorregional siguen siendo superiores para la RT+QT, sin beneficio en el agregado de la QT de inducción al tratamiento radiante. No existen diferencias significativas en la SVG entre los 3 brazos del estudio: RT+QT, QTde inducción seguida de RT y RT. Durante los ultimos años se han realizado ensayos clínicos que incorporan tanto en los tumores de laringe resecables como en los irresecables, nuevas drogas en el tratamiento de inducción así como RT+QT en el tratamiento posterior con resultados muy alentadores. Sin embargo faltan estudios randomizados que comparen estos planes con el estándar actual, la RT+QT. 4.2.3 Tratamiento Adyuvante. El tratamiento adyuvante está indicado en aquellos pacientes en los cuales se optó por el tratamiento quirúrgico y que presenten factores de riesgo de recaída. La recaída locorregional de estos tumores luego del tratamiento quirúrgico es aproximadamente de un 30 %, existiendo factores de riesgo de recaída identificados: FR patológicos. Extensión extracapsular. Márgenes positivos. Invasión perineural. Angiolinfoinvasión. Compromiso ganglionar de múltiples niveles 56 FR clínicos. T, N (niveles de compromiso y tamaño) El tratamiento adyuvante con RT-QT comparado con RT exclusiva, mostró beneficios en sobrevida libre de recaída y también en cifras menores de recaída local. A 5 años un solo estudio randomizado mostró mayor SVG en el brazo de RT-QT. La Radio-quimioterapia concurrente consiste en la administración de Cisplatino 100 mg/m2 D1, D22, D43 de la radioterapia. 4.3. MANEJO DE LOS GANGLIOS EN EL TRATAMIENTO CONSERVADOR DE LA LARINGE No existen estudios randomizados que focalicen el manejo de los ganglios regionales en estadios limitados y tampoco en estadios avanzados luego de un tratamiento conservador. -Los pacientes con N1 Si tienen respuesta completa a la QT+RT, no se realiza intervención. Si la respuesta es parcial se realiza disección ganglionar. -Los pacientes con N2-N3 Disección ganglionar independiente de la respuesta. Puede ser discutible la disección ganglionar cuando existe respuesta completa clínica y existe alta probabilidad de respuesta patológica completa; vs la morbilidad de la cirugía. 4.4. TRATAMIENTO DE LOS ESTADIOS III y IV IRRESECABLES. La modalidad de tratamiento oncoespecífico estándar es la radioterapia combinada con quimioterapia. El tratamiento combinado es superior a la radioterapia como modalidad única habiéndose demostrado el beneficio en sobrevida global en un Metaanálisis (MACH-NC, 2000) y posteriormente corroborado en sus actualizaciones del año 2004 y 2009, donde se constata un beneficio absoluto en sobrevida de 6,5% a 5 años. La superioridad de la radioquimioterapia es independiente al esquema 57 de radioterapia utilizado. 4.4.1. RADIOQUIMIOTERAPIA CONCURRENTE (RT-QT) La asociación de cisplatino con radioterapia ha demostrado superioridad comparada con esquemas sin cisplatino. No se han diseñado estudios que comparen regímenes de monoquimioterapia vs poliquimioterapia. El regimen de QT más ampliamente utilizado es el de cisplatino 100mg/m2 cada 3 semanas concurrente con RT (Dosis de RT 66-70 Gy). Dado la toxicidad del esquema combinado se prefiere su utilización en pacientes con un buen estado general, buen performance status y sin comorbilidades que limiten la realización del tratamiento. La administración de esquemas semanales de cisplatino con el objetivo de limitar la toxicidad del tratamiento es una alternativa al regimen de cisplatino cada 3 semanas, si bien no se han diseñado estudios que establezcan la equivalencia en la eficacia entre estos esquemas de QT concurrente con RT. Cisplatino semanal 40mg/m2 4.4.2 RADIOTERAPIA EXCLUSIVA Este tratamiento debe reservarse para los pacientes que por alguna razón (estado general, performance status, comorbilidades, edad, intolerancia al cisplatino) no puedan recibir tratamiento concurrente de QT-RT. La actualización de MACH-NC 2004 no evidenció beneficio en sobrevida en relación al tratamiento de QT-RT concurrente en el análisis del subgrupo de pacientes mayores o iguales a 70 años 4.4.3 QUMIOTERAPIA DE INDUCCION De acuerdo a estudios randomizados realizados en pacientes con cáncer de laringe locorregionalmente avanzado la quimioterapia de inducción seguida de RT o de RT+QT, podría ser una opción de tratamiento para aquellos pacientes jóvenes, con buen Performance status, portadores de tumores con compromiso ganglionar y local extenso. La Poliquimioterapia de inducción con tres drogas que incluya taxanos, demostró mayor porcentaje de respuestas, mayor control locorregional 58 y mayor sobrevida global que los planes de PQT sin taxanos, a expensas de una mayor toxicidad hematológica. Por lo tanto debe ser considerada una alternativa para pacientes seleccionados con tumores estadios III y IV irresecables no metastásicos , con buen performance status. El resultado de estudios que comparan la QT de inducción con 3 drogas seguida de RT+QT vs el estándar actual de RT+QT, están pendientes. Por ese motivo y hasta tener resultados de dichos estudios, no sería considerada aún una modalidad de tratamiento estándar para el cáncer de laringe locorregionalmente avanzado. El plan utilzado en el estudio del EORTC 24971/TAX 323 es: Docetaxel 75mg/m2 D1 Cisplatino 75mg/m2 D1 cada 21 días x 4 ciclos seguido de RT 5FU 750mg/m2 D1-5 Premedicación con dexametasona 8mg (total 6 dosis). Ciprofloxacina 500mg cada 12 hs, D5-D15 Otras opciones de QT de inducción que incluyan taxanos, seguida de RT+QT , pueden tenerse en cuenta con las mismas consideraciones que para el plan anterior. 4.4.4 TRATAMIENTO CON TERAPIAS DIRIGIDAS EN E III y IV NO METASTÁSICOS La administración de RT-Cetuximab (Ac anti EGFR) concurrente podría ser considerada una alternativa en pacientes con contraindicación de recibir quimioterapia dado el beneficio en control locorregional, sobrevida libre de progresión y sobrevida global obtenido en un único ensayo Fase III que compara RT-Cetuximab vs RT. No se han diseñado aún estudios que comparen RT-Cetuximab vs QTRT. Cetuximab 400mg/m2 dosis carga (1 semana previa a RT) 59 RT-Cetuximab 250 mg/m2 semanal 5.1 MANEJO DE LOS GANGLIOS EN EL TRATAMIENTO NO CONSERVADOR DE LA LARINGE No existen estudios randomizados que focalicen el manejo de los ganglios regionales en estadios avanzados. -Los pacientes con T1-T2 de glotis N0 no requieren disección electiva del cuello. -Los pacientes con T3-T4 de glotis -Todo T de supraglotis, Requieren disección ganglionar independiente de la respuesta, incluso si son N0 clínicos. 6.1 TRATAMIENTO DEL CANCER DE LARINGE METASTASICO Y RECURRENTE Los pacientes en estadio metastásico o recurrente deben ser valorados a nivel locorregional en vistas a un eventual rescate quirúrgico o reirradiación. Las otras opciones de tratamiento son el tratamiento sistémico y el mejor soporte paliativo. Se han identificado factores asociados con un peor pronóstico en la evolución de estos pacientes: -Relacionados con la enfermedad: enfermedad locorregional voluminosa o metastásica, enfermedad agresiva. -Relacionados con el tratamiento: tratamiento previo, ausencia o respuesta mínima al tratamiento -Relacionado con el paciente: pobre PS, comorbilidades, ausencia de soporte social, tabaquismo, alcoholismo 6.1.2 TRATAMIENTO SISTÉMICO (QT) 60 No existe un plan de tratamiento estándar. La elección del tratamiento sistémico deberá ser individualizada valorando el beneficio y la toxicidad del mismo. En la elección del tratamiento a implementar deberá tenerse en cuenta los regímenes previamente utilizados y las comorbilidades del paciente. Entre los agentes activos se encuentran -Cisplatino, -Carboplatino, -Paclitaxel, -Docetaxel, -Metrotexate, -5-Fluoracilo. La administración de PQT ha mostrado mayor tasa de respuesta comparada con monoquimioterapia sin obtener beneficios en sobrevida. 6.1.3 TERAPIAS DIRIGIDAS EN EL TRATAMIENTO DE ESTADIOS DISEMINADOS Y RECURRENCIAS El cetuximab asociado a platino y 5FU es una opción para pacientes con tumores de la esfera ORL en recurrencia o diseminados. Un único ensayo en fase III (EXTREME; Cetuximab-Platino-5FU vs Platino 5FU) mostró beneficio en sobrevida libre de progresión, tasa de respuestas y sobrevida global (SVG 10.1 meses vs 7.4 meses, p = 0.04) Cetuximab 400mg/m2 (dosis carga) Cetuximab 250mg/m2 semanal cada 21 días Cisplatino 100mg/m2 ó Carboplatino AUC 5 D1 máx. 6 ciclos 5FU 1000mg/m2 BIC D1-4 Continuar con Cetuximab monodroga hasta progresión o toxicidad 7.1 CONTROL Y SEGUIMIENTO La valoración de la respuesta al tratamiento comprende la evaluación clínica por el especialista e imagenológica. 61 El seguimiento tiene como objetivo la detección precoz de recidiva y el diagnóstico de segundos tumores. Se recomienda la valoración de la función tiroidea en aquellos pacientes que han recibido tratamiento radiante. Se debe recomendar el abandono del hábito tabáquico en vistas a reducir la toxicidad del tratamiento y el desarrollo de segundos tumores. 62 CANCER DE CAVUM 1. INTRODUCCION Los tumores del cavum comparten generalidades con el resto de los tumores de la esfera otorrinolaringológica y tienen características clínico-biológicas que determinan un tratamiento y pronóstico particular. Dentro de las que destacamos: la epidemiología, histología, así como la quimio y radiosensibilidad. Las tasas de incidencia más altas se encuentran en China, Hong- Kong y Singapore. La gran mayoría corresponden a carcinomas indiferenciados que no presentan síntomas tempranos lo que conlleva a que habitualmente los pacientes se presenten con enfermedad avanzada. Dentro de los factores de riesgo para desarrollar la enfermedad se conocen: - - La ascendencia Asiática, - - Infección por el virus de Epstein- Barr (EBV) - - Tabaquismo – alcoholismo 2. DIAGNÓSTICO Los síntomas más frecuentes son: dolor, ganglios cervicales, hipoacusia, otitis recurrente, epixtasis y disfunción de pares craneanos (II- IV- IX-XII). Diagnóstico de tumor primario: - Anamnesis y examen físico (ORL). - Endoscopía de vía aérea. - Biopsia. - TAC de cuello para valorar compromiso locorregional. - RMN en casos seleccionados. - Estudios de valoración general. Diagnóstico de extensión a distancia: La invasión loco-regional puede comprometer los nervios craneales y la base de cráneo. El compromiso linfático es frecuente y de ser así el riesgo de 63 presentar metástasis a distancia es alto. En función de resultados retrospectivos que evaluaron la SVG y SLE en función de la extensión tumoral y el tratamiento recibido, se ha demostrado que la extensión tumoral debe utilizarse para la elección del tratamiento. - TAC Tx para evaluar diseminación ganglionar y/o pulmonar. -Centellograma óseo para evaluar diseminación ósea. - Otros estudios según sospecha clínica de diseminación. - PET scan, ha sido reportado en algunos estudios de carcinoma no queratinizante de cavum como superior en el diagnóstico de metástasis óseas en comparación con el C.O, superior en las metástasis de tórax en comparación Con la RX de TX y por lo menos igual que la ecografía en la detección de metástasis hepáticas. 3. ESTADIFICACIÓN Según criterios del TNM 4. TRATAMIENTO 4.1 Dada la topografía de esta entidad la resección quirúrgica la cirugía no constituye una opción terapéutica. 4.2 La sensibilidad del carcinoma nasofaringeo a la radioterapia hace de elección esta terapéutica para los estadíos I y II. La dosis a emplear es de 65 a 70 Gy. Para los estadios III y IV sin metástasis a distancia la asociación de RT y QT es el tratamiento estándar. La quimioterapia con sales de platino (cisplatino) concurrente con la radioterapia ha mostrado un aumento en la sobrevida libre de progresión y en la sobrevida global estadísticamente superior a la RT exclusiva. Con un beneficio absoluto de la SV del 6 % a 5 años. 64 RT: DT de 70 Gy concurrente QT: CDDP (cisplatino) 100 mg/m2 i/v, días 1 - 22 - 43 seguido de tres ciclos adicionales de : CDDP 80 mg/m2 D1 5 FU 1000 mg/m2 i/v D1-2-3-4. Cada 21 días. Este plan de tratamiento que incluye la QT posterior, debe seleccionar muy bien a pacientes con excelente estado general dado la morbilidad del mismo. La neoadyuvancia puede considerarse una opción , en tumores bulky T4, con extensión a quiasma o cerebelo con el fin de realizar posteriormente una RT más limitada sin incluir estructuras cuya irradiación puede dejar secuelas severas. En el estadio IV metastásico y la recidiva la indicación es realizar tratamiento sistémico, para el cual no existe un plan estándar. Se sugieren planes que incluyan sales platinos y taxanos con una respuesta global de aproximadamente 25 %. 65 TUMORES NEUROENDOCRINOS 2009 GASTROENTEROPANCREATICOS 1. INTRODUCCIÓN Los Tumores Neuroendocrinos Gastro-Entero-Pancreáticos (TNE GEP) son un grupo heterogéneo de tumores, que derivan de células neuroendocrinas del tracto gastrointestinal y del páncreas. Los tumores primarios se localizan a nivel de la mucosa gástrica, páncreas, intestino delgado y grueso. Los síndromes clínicos son secundarios a la secreción de hormonas y péptidos. Hubo un aumento en la incidencia en las últimas décadas, probablemente relacionado al mejor conocimiento y técnicas diagnósticas. Con respecto a su origen embriológico: los TNE bronquiales, gástricos, duodenales, pancreáticos y de vesícula biliar derivan del intestino proximal. Mientras que del intestino medio derivan los tumores del intestino delgado, apéndice y colon ascendente; y del intestino distal derivan los tumores de colon transverso, descendente, sigmoides y recto. Los TNE GEP aparecen en todas las edades, con un pico de incidencia en la quinta década. Una excepción es el carcinoide del apéndice, con una incidencia máxima por debajo de los 30 años. Estos tumores pueden formar parte de los MEN-1 y enfermedad de Von Hipple-Lindau (VHL), presentándose clínicamente 15 años antes que los casos esporádicos. 2. ESTADIFICACION y EVALUACION DE RIESGO No existe una estadificación TNM específica para los TNE GEP y deben ser estadificados en función del órgano de origen. Recientemente la Sociedad Europea de TNE propuso un modelo para los tumores gástricos, duodenoyeyunales, pancreáticos y yeyunoileales. TNM para tumores endócrinos gástricos (Sociedad Europea de TNE) T Tumor Primario TX No es posible evaluar el tumor primario T0 Sin evidencia de tumor primario Tis Tumor In situ /displasia (<0.5 mm) T1 Tumor invade la lámina propia o submucosa y ≤ 1 cm T2 Tumor invade muscularis propia o subserosa o >1 cm T3 Tumor penetra la serosa 66 T4 Tumor invade estructuras adyacentes Para cualquier T, agregar (m) para tumores múltiples N Ganglios linfáticos regionales NX No es posible evaluar los ganglios linfáticos regionales N0 Ausencia de metástasis en ganglios linfáticos regionales N1 Metástasis en ganglios linfáticos regionales M Metástasis a distancia MX No es posible evaluar metástasis a distancia M0 Ausencia de Metástasis a distancia M1 Metástasis a distancia TNM para TNE de duodeno/ampolla/yeyuno proximal (Sociedad Europea de TNE) T Tumor Primario TX No es posible evaluar el tumor primario T0 Sin evidencia de tumor primario T1 Tumor invade lámina propia o submucosa y tamaño ≤ 1 cm T2 Tumor invade muscularis propia o tamaño >1 cm T3 Tumor invade páncreas o retroperitoneo T4 Tumor invade peritoneo u otros órganos Para cualquier T, agregar (m) para tumores múltiples N Ganglios linfáticos regionales NX No es posible evaluar los ganglios linfáticos regionales N0 Ausencia de metástasis en ganglios linfáticos regionales N1 Metástasis en ganglios linfáticos regionales M Metástasis a distancia MX No es posible evaluar metástasis a distancia M0 Ausencia de metástasis a distancia M1 Metástasis a distancia TNM para tumores endócrinos del páncreas (Sociedad Europea de TNE) T Tumor Primario TX No es posible evaluar el tumor primario T0 Sin evidencia de tumor primario T1 Tumor limitado al páncreas y tamaño < 2 cm T2 Tumor limitado al páncreas y tamaño 2–4 cm T3 Tumor limitado al páncreas y tamaño >4 cm o invade duodeno o conducto biliar T4 Tumor invade órganos adyacentes (estómago, bazo, colon, glándula suprarrenal) o la pared de grandes vasos (tronco celíaco o arteria mesentérica superior) 67 Para cualquier T, agregar (m) para tumores múltiples N Ganglios linfáticos regionales NX No es posible evaluar los ganglios linfáticos regionales N0 Ausencia de metástasis en ganglios linfáticos regionales N1 Metástasis en ganglios linfáticos regionales M Metástasis a distancia MX No es posible evaluar metástasis a distancia M0 Ausencia de metástasis a distancia M1 Metástasis a distancia TNM tumores endócrinos de yeyuno distal e íleon (Sociedad Europea de TNE) T Tumor Primario TX No es posible evaluar el tumor primario T0 Sin evidencia de tumor primario T1 Tumor invade mucosa o submucosa y tamaño ≤ 1 cm T2 Tumor invade muscularis propia o tamaño >1 cm T3 Tumor invade subserosa T4 Tumor invade peritoneo/otros órganos Para cualquier T, agregar (m) para tumores múltiples N Ganglios linfáticos regionales NX No es posible evaluar los ganglios linfáticos regionales N0 Ausencia de metástasis en ganglios linfáticos regionales N1 Metástasis en ganglios linfáticos regionales M Metástasis a distancia MX No es posible evaluar metástasis a distancia M0 Ausencia de metástasis a distancia M1 Metástasis a distancia A su vez, de acuerdo al índice de proliferación celular, medido a través del Ki67, se dividen en Grado I, II o III. G I Ki-67 en menos del 2 % ; G II Ki-67 del 2-20%; y G III > 20% de las células tumorales. 3. CLASIFICACION DE ACUERDO A LAS CARACTERISTICAS CELULARES Bajo potencial maligno: tumor carcinoide (TC), TNE o TNE bien diferenciado Potencial maligno intermedio: tumor pancreático endócrino (TPE), carcinoma neuroendocrino o carcinoma neuroendocrino bien diferenciado (carcinoide maligno) 68 Alto potencial maligno: carcinoma neuroendocrino pobremente diferenciado (carcinoide maligno de alto grado). (TNEPD) 4. ANATOMIA PATOLOGICA Tumores carcinoides/malignos: 50% de TNE; 1/200-300 apendicectomías. Gastrinoma: 25% Insulinomas: 15% Glucagonomas: 5% VIPomas: 6% Carcinomas de células pequeñas. Tumores carcinoides (TC): Son tumores que se presentan con una incidencia similar en ambos géneros, con una edad mediana 50 años. Suelen localizarse a nivel gastrointestinal con mayor frecuencia (74 %) y luego a nivel respiratorio (25 %). Con la resección quirúrgica se alcanzan niveles de sobrevida a 5 años del 82%. Gastrinomas: Aproximadamente el 66 % son esporádicos, estando un 30% asociados a síndromes NEM – 1. La mayoría están localizados en el duodeno, pero pueden presentarse a nivel gástrico, pancreático y yeyuno. Frecuentemente son únicos y 60-85 % malignos. La cirugía cura un 50% de estos tumores. Insulinomas: Son tumores con un pico de incidencia entre los 40 y 60 años. 80-85% son benignos y entre un 10-15% son malignos. 5-10% son multifocales y el 80% son funcionales. Su manifestación clínica suele ser como lo describe la tríada de Whipple: síntomas de hipoglucemia, glicemia < 40 mg/dL y resolución del cuadro con la administración de glucosa. Glucagonomas: Suelen ser tumores únicos y malignos, diseminados en un 50-80% de los casos al debut. Son pacientes con hiperglicemias usualmente leves y asintomáticas, y se caracterizan por la presencia de un nivel de un glucagón plasmático en ayunas > 1000 pg/ml. 5. SINDROMES CLINICOS 69 CLINICA TIPO TUMOR Rubor, diarrea, carcinoide broncoespasmo, hipotensión Úlcera péptica, diarrea gastrinoma Hipoglicemia Insulinoma TIPO CELULAR Enterocromafin PRODUCTO Serotonina, histamina Insular noInsular no- Dermatitis, demencia Diabetes, trombosis venosa profunda (TVP) Diabetes, esteatorrea, Litiasis biliar Eritema necrolítico acromegalia glucagonoma Insular A Gastrina Insulina, factor de crecimiento similar a la insulina Glucagón somatostatinoma Insular D Somatostatina PPoma GHRHoma Insular PP Insular no- Cushing Diarrea, hipopotasemia, aclorhidria Hiperpigmentación CRHoma VIPoma, Insular noInsular D Polipéptido pancreático Somatotropina, hormona del crecimiento Corticotropina Péptido intestinal vasoactivo GHRHoma Insular no- MALIGNIDAD 100 % 60 – 90 % < 10 % 50 – 80 % > 70 % > 30 % Hormona estimulante de los melanocitos. 6. PARACLINICA: En sangre: La familia de TNE GEP presenta positividad para Cromogranina A, Sinaptofisina, Enolasa Neuronal Específica (ENE) y Serotonina. Estos son útiles tanto como marcadores tempranos como también para evaluar respuesta al tratamiento y seguimiento. Mientras que existen marcadores específicos que, deben solicitarse en función de la sintomatología del paciente (gastrina, insulina, glucagón y péptido vasoactivo intestinal). En orina (de 24 horas), un marcador recomendado de síndrome carcinoide es la dosificación del ácido 5 hidroxi-indol acético (5-HIAA). Imagenología La evaluación preoperatoria debería siempre incluir un OCTREOSCAN (estudio importante de estadificación y a su vez, evalúa la expresión de receptores de somatostatina de tipo 2). Fibroendoscopía: búsqueda del tumor primario a través de esofagogastroduodenoscopía, colonoscopía y videocápsula de endoscopia para estudio de intestino delgado . TAC de tórax, abdomen y pelvis; en busca del tumor primario y de enfermedad metastásica. RNM en casos seleccionados. PET-CT scan (no es útil en TC) 70 7. TRATAMIENTO La cirugía es una opción terapéutica en los tumores localizados resecables, metástasis hepáticas resecables y como criterio paliativo. 1) TUMORES LOCALIZADOS RESECABLES La resección quirúrgica es el único método curativo. Presenta una tasa de SV a 5 años de entre 80 a 100 %. Los tumores mayores a 2 cm, multifocales y con presencia de atipía se deben resecar incluyendo la disección ganglionar. NO EXISTE EVIDENCIA CIENTIFICA QUE JUSTIFIQUE TRATAMIENTO ADYUVANTE. 2) METASTASIS HEPATICAS RESECABLES En estos casos la cirugía se realiza con intención curativa. Está indicada en pacientes con tumores primitivos resecables y que presenten una buena reserva hepática. Tras la cirugía la SV a 5 años es de aproximadamente 70 %. NO EXISTE EVIDENCIA CIENTIFICA QUE JUSTIFIQUE TRATAMIENTO ADYUVANTE EN ESTOS CASOS TAMPOCO. 3) METASTASIS HEPATICAS IRRESECABLES En pacientes asintomáticos se debe tomar una conducta expectante, con control y seguimiento exclusivo, ya que permanecen sin síntomas por un largo período de tiempo. En pacientes sintomáticos, existen 4 opciones de tratamiento quirúrgico con criterio paliativo: Citorreducción quirúrgica Embolización hepática con o sin QT Radiofrecuencia Transplante hepático I) CITORREDUCCION Se realiza con criterio paliativo. Aumenta la SV mediana en 3-4 veces. 71 En el 80 % de los casos se logra el control sintomático, y a su vez disminuye la necesidad de tratamiento con Octreotida. II) EMBOLIZACION CON O SIN QUIMIOTERAPIA Indicaciones: Reducción del tamaño tumoral Disminución de síntomas tumorales y endócrinos Prolongar la SV mediana Los agentes citostáticos más utilizados cuando se realiza Quimioembolización son: 5-Fu, cisplatino, mitomicina-c y adriamicina. Hasta el momento no existen estudios aleatorizados que sugieran superioridad de respuesta de la quimioembolización sobre la embolización. El control sintomático se logra en el 90 % de los casos. Con una SV a 5 años del 40 %, y una SV mediana de hasta 32 meses. La experiencia en diferentes centros sugiere que la embolización es mejor en metástasis de tumores carcinoides; y la quimioembolización en metástasis de tumores pancreáticos neuroendócrinos. III) RADIOFRECUENCIA Con esta técnica se logra un control sintomático entre el 70-90 % de los casos. Presenta ciertas limitaciones como ser el número de metástasis hepáticas, cuando su número supera las 8-10 metástasis; su tamaño, cuando son mayores a 5-6 cm; y por último, cuando las metástasis se encuentran próximas a grandes vasos. El efecto de la radiofrecuencia sobre la SV mediana aún no está establecido. IV) TRANSPLANTE HEPATICO Esta opción terapéutica queda reservada para pacientes jóvenes, sin enfermedad extrahepática y para tumores bien diferenciados. Presenta una alta mortalidad de entre 10-15 %, y una SV a 5 años 30-70 %. Por el momento no existen ensayos clínicos randomizados que comparen las diferentes estrategias quirúrgicas de tratamiento en pacientes con tumores neuroendócrinos gastro-entero-pancreáticos. TRATAMIENTO MEDICO SINTOMATICO. ANALOGOS DE SOMATOSTATINA (AS): Octreotida: Es un análogo sintético de la somatostatina. Produce la inhibición de la secreción exocrina del aparato digestivo (gastrina, serotonina), la inhibición de 72 la secreción endocrina de hormonas (factor de crecimiento, insulina y glucagón). Es además un modulador de la motilidad GI y biliar. Si bien no está finalmente demostrado, existen muchos trabajos que sugieren un efecto proapoptótico en las células tumorales. Su mecanismo de acción es sobre los receptores 2 y 5 de la somatostatina inhibiendo la producción de neurohormonas. Esta indicado para el tratamiento sintomático, no está claro el impacto en la reducción de la tasa de crecimiento del tumor. El control sintomático se logra con una mejor calidad de vida en un 80% de los pacientes, observándose respuestas bioquímicas en un 70%. Produce también la estabilización del tumor en un 20%. La administración de la octreotida de acción rápida y la de acción prolongada (LAR) mostraron una eficacia similar en el control de episodios de diarrea (p 0,72) con un mayor control de bochornos para la última. Los efectos adversos más frecuentes son; cólicos, nauseas, esteatorrea, flatulencia y litiasis biliar en un 50%. Dosis: Comenzar 100 mg s/c 3 veces por día aumentando según síntomas (máx. 1500 mg). A las 2 semanas comenzar con LAR i.m. 20 mg / mes manteniendo acción corta por 2 semanas (tiempo en el que se alcanza el nivel terapéutico). De persistir síntomas se puede escalonar dosis de LAR a 30-40 mg i.m. La Lanreotida tiene un perfil de eficacia y tolerancia similar, con respuestas sintomáticas en tumores funcionantes del 70-80%, respuestas humorales en tumores funcionantes del 70-80%; y respuestas objetivas en tumores funcionantes o no del 5-20%. Tiene como ventaja su acción prolongada que permite su administración mensual. Dosis: 60, 90 o 120 mg i.m. cada 4 semanas INTERFERON ALFA (INF α): Actúa mediante la estimulación de células T, aumento de expresión de MHC I, inhibición directa del ciclo celular y tiene efecto antiangiogénico. Presenta una tasa de respuestas: objetivas 8-18%, sintomáticas 40-70%, bioquímicas del 40-50%. Produce la reducción significativa del tumor en un 10-15% y una estabilización lesional en un 65%. Los efectos adversos más frecuentes son: síntomas de tipo gripal, fatiga 50% y depresión mental. Dosis: Interferón recombinante IFNα2a e IFNα2b 3 a 9 millones de unidades s/c 3 a 7 veces por semana. Interferón pegilado 50 a 100 µg semanal Combinación de Octreotida e INF α Si bien existen estudios que informan un menor riesgo de enfermedad progresiva, inhibición de crecimiento tumoral 67% y una tasa de respuestas bioquímicas del 69%, no hay aún ensayos concluyentes que demuestren claramente su indicación ya que ninguno logro demostrar un impacto en la 73 sobrevida. De todas formas puede ser una opción válida frente a la progresión de la enfermedad. PAPEL DE LA QUIMIOTERAPIA EN TNE GEP Quimioterapia en Tumores pancreático endócrino (TPE) Múltiples quimioterapias han sido evaluadas en monoterapia (tabla 1). En estudio fase II con doxorrubicina (DOX) mostró una tasa de respuesta (TR) de 20% en 20 pacientes previamente tratados (Moertel et al.(1982). Otro estudio fase II conducido por ECOG ensaya con dacarbacina (DTIC), con TR del 34 % en 50 pacientes con sobrevida global media (SVGm) de 19.3 meses (Ramanathan et al.2001). Altas dosis de paclitaxel con G-CSF se analizo en estudio de fase II (Ansell et al. 2001). Se incluyeron nueve pacientes con TPE avanzado de los cuales ninguno mostró respuesta radiológica y uno sólo mostró respuesta bioquímica. Asimismo, la gemcitabina no mostró respuestas radiológicas o bioquímicas entre los siete pacientes con TPE avanzado incluidos por Kulke et al. 2004b. No hay estudios prospectivos aleatorizados bien diseñados y de tamaño adecuado que analicen el papel de la poliquimioterapia en estos tumores (tabla 1). Un total de 103 pacientes fueron aleatorizados para recibir estreptozocina (STZ) más 5-fluoruracilo (5-FU) o STZ solo en ensayo de fase III llevado a cabo por Moertel et al., 1980. El tratamiento de combinación fue mejor que el brazo de un solo agente en términos de respuesta, 63 y 36% respectivamente, y también produjo una mejor SVG pero no estadísticamente significativa. Estos resultados llevaron a que la ECOG diseñara un nuevo estudio de fase III para comparar STZ más DOX vs STZ mas 5-FU vs clorozotocina (CLZ) en monoterapia (Moertel et al. 1992). El grupo de combinación DOX mostró un aumento significativo en la TR (69 vs 45 vs 30% respectivamente). Además, este beneficio se tradujo también en un aumento estadísticamente significativo en la sobrevida libre de progresión (SLP), 18 vs 14 vs 17 meses y la sobrevida global (SVG), 26,4 vs 16,8 vs 18 meses. El grupo SWOG ha publicado su experiencia en 47 pacientes tratados con CLZ y 5-FU (Bukowski et al. 1992). Esta combinación mostró un TR de 36% y una SVGm de 25 meses. Trece pacientes desarrollaron toxicidad renal secundaria a CLZ, lo que explica el escaso uso de este agente en los estudios posteriores. Posteriormente se han publicado dos estudios en diferentes instituciones, que utilizaron STZ más DOX. Tanto el Dana Farber Cancer Institute (McCollum et al. 2004) y el 74 Memorial Sloan Kettering Cancer Center (Cheng & Saltz, 1999) han informado su experiencia, con una TR del 6%, mucho menor que los resultados publicados anteriormente. Esta disparidad de resultados puede explicarse por la metodología utilizada para evaluar respuesta. También se puede explicar parcialmente por la heterogeneidad del tumor en términos de comportamiento biológico y la capacidad de respuesta a la quimioterapia. Otro posible explicación es el hecho de que en la última década, los tratamientos biológicos han sido progresivamente introducido como tratamiento de primera o de segunda línea, iniciando la quimioterapia sólo después del fracaso tras la terapia biológica (Vilar et al. 2005). En un intento de mejorar los resultados logrados con dobletes, se han hecho estudios evaluando tripletes con 5-FU, DOX, y STZ. Se reviso de forma retrospectiva en 84 pacientes tratados por MD Anderson Cancer Center (Kouvaraki et al. 2004). La mayoría de los pacientes son tumores nofuncionantes (n=64) y tumores metastásicos (n=76), aunque también se incluyeron pacientes con enfermedad localmente avanzada (n=8). La TR fue del 39% y 50% alcanzó estabilidad lesional (EL). En términos de respuesta, no hubo diferencias observada entre localmente avanzado y enfermedad metastásica. La mediana de SLP fue de 18 meses y la SVGm fue de 37 meses. Tabla 1. Autor Quimioterapia N TR(%) SGM(m) Moertel et STZ + 5-FU 42 63 26 STZ 42 36 16.5 STZ + DOX 36 69 26.4 STZ + 5-FU 33 45 16.8 CLZ 33 30 18 DOX 20 20 DTIC 50 34 al.(1980) Moertel et al.(1992) Moertel et al.(1986). Ramanathan et 19 75 al.(2001) Ansell et al.(2001) Paclitaxel 10 10 13 Kulke et al. Gemcitabine 7 0 11.5 CLZ + 5-FU 44 36 25 STZ + DOX 16 6 20.2 STZ + DOX 16 6 NR 5-FU + STZ + DOX 84 39 37 5-FU + DTIC + epirubicin 28 28.5 NA Kulke et al. Temozolomide + 11 45 NA (2006a) thalidomide Kulke et al. Temozolomide + 18 24 NA (2006b) bevacizumab Strosberg et al. Temozolamida + 17 71 NA (2008) capecitabine (2004b) Bukowski et al.(1992) McCollum et al.(2004) Cheng & Saltz (1999) Kouvaraki et al.(2004) Bajetta et al.(2002) Quimioterapia en Tumores Carcinoides (TC). Varios agentes citostáticos se han evaluado como monoquimioterapia (tabla 2). Un ensayo de fase II (Moertel et al.1986) ensayo la eficacia de cisplatino (CDDP).Quince pacientes fueron tratados mostrando sólo una respuesta parcial. STZ ha mostrado muy poca actividad en monoterapia (Oberg et al. 1987). DTIC (Bukowski et al. 1994) fue evaluada en un ensayo de fase II con 63 pacientes, mostrando un TR de 16%. 76 Dos estudios evaluaron la eficacia de gemcitabina (Kulke et al. 2004b) y docetaxel (Kulke et al. 2004a) como monoterapia, no mostrando respuesta en ninguno de los dos ensayos. Se incluyeron 14 pacientes, en un ensayo con paclitaxel a dosis altas (Ansell et al. 2001) en la Clínica Mayo, que mostró actividad clínica mínima con importantes toxicidades, principalmente hematológicas. En resumen, la monoquimioterapia no mostró aún resultados positivos. A pesar de los malos resultados de los ensayos anteriores, se han realizado varios ensayos de fase II explorando el papel de la poliquimioterapia (tabla 2). La combinación mayormente evaluada es STZ más 5-FU. Moertel & Hanley (1979) randomizó 118 pacientes para recibir STZ más 5 FU o STZ más ciclofosfamida. Se informó de una TR de 33 y 26% respectivamente. En el estudio Engstrom et al. 1984, los pacientes aleatorizados con TC para recibir STZ más 5-FU o DOX como agente único, mostrando un TR de 22% para el tratamiento combinado y el 21% para DOX. Oberg et al. (1987) observaron tres respuestas objetivas (10%) en 31 de los pacientes tratados con esta combinación. Debido a los resultados de estos estudios se realizo un ensayo de fase III (E1281 estudio, Sun et al. 2005) que randomizó 163 pacientes para recibir 5FU más DOX o STZ más 5-FU. Los resultados en términos de TR (15,9 vs 16%, P=0.82) o SLP (4,5 vs 5,3 meses, P= 0,17) no mostró diferencias estadísticamente significativas, sin embargo, STZ más 5-FU era superior a 5FU más DOX en SVG (24,3 vs 15,7 meses, P=0.02). Los autores concluyeron que para pacientes seleccionados, la combinación de STZ y la fluoropirimidinas sería una opción adecuada, si la quimioterapia sistémica se considera. En Cleveland Clinic Foundation (Bukowski et al. 1987), se randomizó a 65 pacientes a 5-FU más ciclofosfamida más STZ con o sin DOX mostrando un TR de 31 y 22% respectivamente. Otra combinación ensayada fue 5-FU más DTIC más epirrubicina (Bajetta et al. 1998) por un grupo de colaboración de Italia. En este ensayo, sólo dos respuestas (10%) de los 20 pacientes fueron observadas. En estudio más reciente por el mismo grupo, el mismo régimen con intensificación de dosis logro un poco mayor de respuesta (17%), con un notable aumento de la toxicidad (Bajetta et al. 2002). Un reciente ensayo de fase II ha evaluado la combinación de temozolomida y la talidomida (Kulke et al. 2006a) en pacientes con tumores neuroendocrinos avanzados de diferentes orígenes, donde de 15 pacientes con TC, sólo había una respuesta. Por lo tanto, esta combinación no parece ser activo para los pacientes con TC. 77 Tabla 2. Autor Quimioterapia N TR(%) SGM(m) Engstrom et al.(1984) 5-FU + STZ 86 22 16 DOX 86 21 12 Moertel & Hanley (1979) 5-FU 19 26 Moertel et al.(1986) CDDP 15 7 NA Moertel & Hanley (1979) 5-FU + STZ 42 33 ND CICLOP + STZ 47 26 STZ 7 3.2 7.5 STZ + 5-FU 24 6.4 18 Bukowski et al.(1994) DTIC 63 16 20 Bukowski et al.(1987) 5-FU + STZ + CICLOP + DOX 56 31 ND 5-FU + STZ + CICLOP 9 22 Kulke et al. (2006a) Temozolomide + thalidomide 15 7 NA Kulke et al. (2004b) Gemcitabine 9 0 ND Kulke et al. (2004a) Docetaxel 21 0 24 Ansell et al.(2001) Paclitaxel 14 7 ND Bajetta et al.(2002) 5-FU + DTIC + epirubicin 6 17 NA Ollivier et al.(1998) 5-FU + leucovorin + DTIC 9 11 NA Sun et al.(2005) 5-FU + STZ 249 16 24.3 15.9 15.7 Oberg et al.(1987) 5-FU + DOX Moertel et al. (1991) CDDP + VP16 27 7 19 Miltry et al. (1999) CDDP + VP16 11 10 17 Fjallskog (2001) CDDP + VP16 27 54 NA Los principales factores pronósticos que se han correlacionado con una mejor respuesta a la quimioterapia son un buen PS y la edad menor de 60 años. 78 Ninguno de los regímenes analizados ha demostrado eficacia suficiente para considerar la quimioterapia como 1era línea en el tratamiento sistémico en pacientes con TC avanzada. Por lo que, se han explorando otras formas de tratamiento antitumoral sistémico basado en la presencia de receptores de somatostatina y otras características moleculares como la expresión de factor de crecimiento vascular endotelial. Una de las opciones que se ha explorado es la combinación de agentes biológicos con terapias blanco. También el uso de agentes radiofármacos análogos de la somatostatina como a continuación analizaremos. Por último el uso de técnicas locorregionales han mostrado en algunos casos mejores resultados que los tratamientos sistémicos siendo una estrategia a considerar en casos seleccionados como ya se analizo. TNE pobremente diferenciado gastroenteropancreáticos o tumores gastroenteropancreáticos anaplásicos. (TNEPD) El pronóstico de los TNE pobremente diferenciado gastroenteropancreáticos o tumores anaplásicos (también referido como tumores de células pequeñas) es similar al cáncer de pulmón de células pequeñas, con una mediana de SVG, de 7 meses sin tratamiento. Moertel et al inicialmente reportaron TR de 67% (RC 17%, RP 50%, y EL 33%) con la combinación de CDDP y etopósido (VP-16) en 18 pacientes con tumores pobremente diferenciados gastrointestinales y pancreáticos. La TR para los pacientes con tumores bien diferenciados fue de 7% (n=27, RP 7%), subrayando el hecho de que este régimen es menos eficaz para este grupo de tumores (Moertel et al. 1991). Mitry et al. (1999) observaron una TR en tumores pobremente diferenciados con n=41 de 41.5% y en tumores bien diferenciados con n=11 de 9%, lo que confirma los resultados obtenidos por el grupo de la Clínica Mayo. En contraste, otro estudio con este régimen en tratamientos de segunda o tercera línea no confirma la relación entre el grado de diferenciación y la TR. Una posible explicación es que los pacientes con tumores bien diferenciados incluidos en estos ensayos tuvieron una rápida progresión clínica y algunos de ellos eran tumores carcinoides atípicos de pulmón, que son más sensible a la quimioterapia basada en cisplatino (Fjallskog et al. 2001). Un reciente ensayo de fase II se combino paclitaxel, carboplatino y VP-16 por Hainsworth et al. (2006). Setenta y ocho pacientes con tumores neuroendocrino pobremente diferenciado histológicamente confirmado fueron incluidos. 79 Cincuenta y tres por ciento mostraron respuestas importantes con una TR completa del 15% y SVG media de 14,5 meses. La toxicidad fue importante, neutropenia grado 3 / 4 presente en 82% de los pacientes y tres pacientes murieron como consecuencia de la sepsis neutropénica. Kulke y col. (2006b) han informado de la eficacia del régimen de CDDP más irinotecán entre los 18 pacientes con TNE avanzado. Sólo una respuesta radiológica se observó de los cuatro de los pacientes con TNE poco diferenciadas y no hubo respuestas radiológicas en los 14 pacientes con tumores bien diferenciados. La eficacia del tratamiento con quimioterapia basada en oxaliplatino (régimen FOLFOX-4) fue evaluada en 16 pacientes (8 TNE de bajo grado y 8 TNE de alto grado) y reportado en la Reunión de 2006 de ASCO por Wiedenmann et al. Se observó estabilidad lesional en el 62,5% de los pacientes, a pesar del hecho de que en la mayoría de los pacientes (n=13) tenía un valor Ki-67% =>10% (Pape et al. 2006), lo que sugiere que este régimen puede ser una opción en los tumores con un potencial altamente agresivos. Conclusiones del Tratamiento con Quimioterapía en TNE: La quimioterapia es una opción con moderada actividad en TNE bien diferenciados y con una alta actividad en los pobremente diferenciados. La monoquimioterapia (MQT) mas activa son STZ, adriamicina, 5fu y DTIC con TR del 15-35% para TPE y 5-15% para TC. La poliquimioterapia (PQT) obtiene mayor TR y mayor SV en TPE que MQT. STZ + ADM o 5Fu se considera el tratamiento estándar para los TPE, como opción 5Fu + DTIC + Epirrubicina, otros. No se considera de primera línea QT para TC y la combinación con STZ, 5Fu, DTIC, adriamicina, temozolamida debe considerarse solo tras el fallo de los otros tratamientos. El plan CDDP-VP16 debe ser de elección para los tumores indiferenciados. Se debe considerar combinar los tratamientos locorregionales agresivos y los tratamientos sistémicos. 80 Necesarios fase III para determinar el papel de la quimioterapia en los diferentes subgrupos de pacientes. RADIOFARMACOS ANALOGOS DE LA SOMATOSTATINA El Ocreoscan (+) indica presencia de receptores de somatostatina. El agente terapéutico consiste en la unión de una molécula radioactiva a una Análogo de Somatostatina. Las moléculas más utilizadas son: 111-In-ocreotida, 90-Y-ocreotida o 177Lu-ocreotato. El Ocreotato tiene afinidad por el receptor del subtipo 2 de la somatostatina 9 veces mayor que la Ocreotida. A su vez el 177-Lu provoca radioactividad 3 veces mayor que el 111-In-ocreotida por el tipo de irradiación emitida con menor captación en riñón, bazo e hígado. Uno de los centros con mayor experiencia en el uso de radioactivos análogos de la somatostatina es Eramus Medical Center de Holanda. En el mismo, Kwekkeboom et al., en el 2005, realizo ensayo con 177-Lu-ocreotato en pacientes con TNE GEP con metástasis hepática. Se incluyeron 131 pacientes. Los resultados publicados son: 2% respuesta completa, 28% respuesta parcial, 16% respuesta mínima, SLPm 40 m, SVGm 46 m. el tratamiento fue bien tolerado presentando toxicidad hematológica grado 3 y 4 en un 3.6 %. NUEVOS TRATAMIENTOS. A la luz de los resultados obtenidos con el actual enfoques de tratamiento, la terapéutica lógica y el enfoque de la investigación debe incluir tratamientos secuenciales con estrategias agresivas locales y tratamiento sistémico, con una mejor selección de candidatos basado en factores predictivos clínicos, patológicos, y moleculares, el desarrollo de nuevas terapias dirigidas, y la combinación de estos con la quimioterapia o con otras terapias dirigidas. La siguiente tabla (tabla 3) refiere a los últimos estudios con terapias moleculares y combinaciones con quimioterapia. 81 Tabla 3. Droga N RP TPE TC TPE Gefitinib EL TC TPE EP TC TPE SLP TC TPE TC 6m 39 57 10% 5% 14% 32% 6m 27 63% 24 s 75% 93% 43 s 42s 6m 6m (Hobday Tj, 2006) Imatinib (Carr 4% K, 2004) Sunitinib (Kulke 66 43 13% 2% MH, 2005) Everolimus + 13 18 18% 13% 55% 81% 15% 40 80% 20% 70% 92% 6% 68% 7% 6% Ocreotide (Yao J,2006) Endostatin 0% 5.8 m 7.6m (Kulke MH, 2006) Bevacizumab + 18 16 24% 0% 8% Temozolamida (Kulke MH, 2006) Talidomida + 11 15 45% 7% Temozolamida (Kulke MH, 2006) 8. Seguimiento (ESMO Clinical recommendation, 2009) Cada 3 meses bajo tratamiento con AS y/o INF α. Cada 3-6 meses tras cirugía, para diagnosticar recaídas quirúrgicas. Se debe incluir marcadores BQ cada 3 meses y TC cada 6 meses en los primeros 5 años y después en forma anual. 82 CANCER DE ESOFAGO I) DIAGNOSTICO Y ESTADIFICACIÓN Diagnóstico - Anamnesis y exámen fisico. Esofagogastroduodeno. Fibroesofagoscopía. Biopsia. Ecografía Endoluminal (opcional). Rx Tx (F y P). TAC de Tórax y Abdómen Fibrobroncoscopía: sobre todo en pacientes con tumores del tercio medio o en aquellos con sintomatología respiratoria. - Funcional y Enzimograma Hepático. Hemograma, VES. Albuminemia. Clasificación anatómica y TNM La particular constitución anatómica del esófago, muy distensible y carente de serosa, su largo recorrido cérvico-mediastinal en estrecho contacto con estructuras vitales, así como su compleja red de drenaje linfático hacen que estos tumores tengan su debut clínico bajo formas locorregionalmente avanzadas en casi el 75% de los casos. Habitualmente del punto de vista anatómico se divide al esófago en tres partes, a saber: esófago cervical, torácico y abdominal. Esófago cervical: Se extiende desde un plano que pasa por el borde inferior del cricoides hasta el agujero superior del tórax. Mide 5 cm. Esófago torácico: Se extiende desde la entrada al tórax hasta el diafragma. Mide 18 cm. Esófago abdominal: Se extiende desde el diafragma hasta el estómago. Mide 2 cm. Con fines terapéuticos se divide al esófago en : 83 1/3 superior: Que no es pasible de cirugía (presencia de grandes vasos, imposible disecar ganglios, etc.). Representa 15 % de los tumores esofágicos. 1/3 medio: Aproximadamente el 40 % a 50 % de los tumores de esófago se originan en este sector. Son potencialmente quirúrgicos. 1/3 inferior: Corresponde al 35 % a 45 % de los tumores esofágicos. Estadificación El estadio determina si la intención de la estrategia terapéutica será curativa o paliativa. El Comité Estadounidense Conjunto sobre el Cáncer (AJCC, por sus siglas en inglés) ha designado los estadios mediante la clasificación TNM (T= tumor, N= ganglios, M= metástasis). Tumor Primario (T) TX: No puede establecerse un tumor primario. TO: No hay evidencia de tumor primario. Tis: Carcinoma in situ. T1: Tumor invade la lámina propia o la submucosa. T2: Tumor invade la muscularis propia. T3: Tumor invade la túnica adventicia. T4: Tumor invade las estructuras adyacentes. Ganglios linfáticos regionales (N) NX: No pueden establecerse ganglios linfáticos regionales. NO: No hay metástasis en los ganglios linfáticos regionales. N1: Metástasis en los ganglios linfáticos regionales. Metástasis a distancia (M) MX: No puede establecerse metástasis a distancia. MO: No hay metástasis a distancia. M1: Metástasis a distancia. Para tumores del esófago torácico medio, usar solamente M1b, ya que estos tumores con metástasis en ganglios linfáticos no regionales tienen un 84 pronóstico tan precario como aquellos con metástasis en otros lugares distantes. Estadios Estadio O: Tis No Mo Estadio I: T1 No Mo Estadio IIA: T2 No Mo T3 No Mo T1 N1 Mo T2 N1 Mo T3 N1 Mo T4 Cualquier N Mo Estadio IV: Cualquier T Cualquier N M1 Estadio IVA: Cualquier T Cualquier N M1a Estadio IVB: Cualquier T Cualquier N M1b Estadio IIB: Estadio III: El sistema de clasificación actual para el cáncer esofágico se basa mayormente en los datos retrospectivos del Comité Japonés para el Registro del Carcinoma Esofágico. Este aplica generalmente a los pacientes con carcinoma escamosos del tercio superior y mediano del esófago, al contrario del frecuentemente común cáncer adenocarcinoma de acoplamiento esofágico y gastroesofágico distal. En particular, la clasificación de los ganglios linfáticos abdominales comprometidos como enfermedad M1 ha sido objeto de crítica. La presencia de ganglios linfáticos abdominales positivos no parece acarrear un pronóstico tan grave como el de la metástasis a los órganos distantes. Los pacientes que presentan linfadenopatía regional o del eje celíaco, no deben ser necesariamente considerados como que tienen enfermedad no resecable debido a la metástasis. La exéresis completa del tumor primario así como una linfadenectomía apropiada debe llevarse a cabo siempre que sea posible. II) TRATAMIENTO ENFERMEDAD LOCALIZADA (T is- T1-2 N0) 85 La cirugía es potencialmente curativa en tumores pequeños limitados al órgano, sin compromiso ganglionar, en donde es posible un R0. 1. Cirugía Contraindicaciones: - fístula tráqueo-brónquica constituida. - tumores cervicales Si no es R0 la mayoría tienen RL y a distancia Si post cirugía es: - R1-2 QTRT en base a CDDP/5Fu o cirugía dependiendo de la extensión - N(+) QTRT en base a CDDP /5Fu 2. QTRT definitiva QT/RT es superior a RT exclusiva. QT/RT tiene porcentajes de SV y control local comparables a la cirugía sola. Es una alternativa válida a la cirugía en pacientes inoperables o que rechazan la misma. Plan: CDDP 75 mg/m2 i/v D1 + 5Fu 1g/m2 i/c D1-4 c/28 d, durante la primera y última semana de la RT (50.4Gy) Luego de la RT realizar 2 ciclos más de CDDP/5Fu a iguales dosis. 3. Tratamiento de soporte: (en pacientes con PS 3, o que no toleran tratamiento oncoespecífico) - Paliación de la disfagia RT Tubo endoluminal Láser Terapia fotodinámica Dilataciones - Soporte Nutricional (enteral) - Manejo del dolor: farmacológico, RT La selección del tratamiento se debe realizar en forma individual. ENFERMEDAD LOCALMENTE AVANZADA (T1-2 N1 T3-4 N0-1) 86 1. QTRT (reestadificar con FGC, TAC, PET) a) si hay respuesta completa Observación b) si hay respuesta parcial Cirugía de salvataje. c) si progresa QT paliativa en base a CDDP o tratamiento sintomático 2. Neoadyuvancia RT: no demostró beneficio. QT: sin rol fuera de trabajos clínicos. QTRT: mejora la mayor % de R0 y control resecabilidad con locorregional, sin claro beneficio en la SV. No hay datos suficientes como para considerarla estándar. 3. Adyuvancia Con Rt+QT demostró beneficio en término de sobrevida libre de recurrencia y sobrevida de un 9% en adenocarcinomas de la unión esofagogástrica. Indicado en: T3-4 N0-1 posquirúrgico Alto riesgo: T2 N0: con adenocarcinoma pobremente diferenciado, invasión linfovascular o neurovascular < de 40 años. Plan: Primera serie pre RT: 5 Fu 425 mg D1-D5 en bolo y Leucovorin 20 mg D1-D5 en bolo. RT: dosis de 4500 cGY 1ª serie de QT concurrente con inicio de RT: 5Fu y leucovorin a iguales dosis que plan anterior por 4 días. 2ª serie de QT concurrente con final de RT: 5Fu y leucovorin a iguales dosis que plan anterior por 3 días. Finalizada la QT-RT concurrentes se continúa con 2 series más de QT con el mismo esquema de la primera serie. 87 ENFERMEDAD METASTASICA 1. Tratamiento soporte Paliación de la disfagia - RT - Tubo endoluminal - Láser - Terapia fotodinámica - Dilataciones Soporte Nutricional (enteral) Manejo del dolor: farmacológico, RT 2. Quimioterapia Ofrece beneficios: - Calidad de vida - control disfagia (60-80%) Sin beneficio en SV SVM 8 meses PQT vs MQT: superior en porcentaje de respuestas y SVM. Planes: MQT: CDDP, 5-Fu, Vinorelbine, Taxanos, Mitomicina C. PQT: CDDP/5Fu CDDP/taxanos 3. Cirugía (paliativa) 88 CANCER GASTRICO I) DIAGNOSTICO Y ESTADIFICACIÓN Diagnóstico - Búsqueda de sangrado oculto en materias fecales. - Rx de gastro-duodeno con doble contraste. Pueden diagnosticarse lesiones de 5 a 10 mm en el 75% de los casos. Ulcus con márgenes irregulares y pliegues rugosos que no tienen disposición radiada desde la úlcera, son frecuentes. - Endoscopía con biopsia /biopsias múltiples. El mayor número de biopsias eleva el % de certeza en el diagnóstico. Cuatro a siete biopsias es recomendable. - Tomografía computada. Es el procedimiento de elección para detectar metástasis. No permite establecer el grado de penetración del tumor en el espesor de la pared gástrica ni el compromiso de los ganglios linfáticos. Cerca del 50% de los pacientes tienen enfermedad más extendida, en el momento de la laparotomía, que lo detectado por la TAC. - Ecografía endoscópica. Permite establecer con mayor precisión la profundidad de la invasión tumoral (T) y es más precisa para detectar la presencia de metástasis ganglionares (83% de correcta estadificación y 66% de detección de los ganglios metastasiados). - Laparotomía. Es el principal método para establecer el estadio y el grado de resecabilidad. Su realización no aumenta la tasa de mortalidad. - CEA. El 40% - 50% de los pacientes con cáncer gástrico tiene una elevación de este marcador en la etapa de diseminación metastásica. Es más importante para el seguimiento que para el diagnóstico. Clasificación TNM UICC 1997 La clasificación se aplica solamente a los carcinomas. Debe existir confirmación histológica de la enfermedad. Los siguientes son los procedimientos para evaluar las categorías T, N y M. 89 Categoría T: examen físico, imágenes, endoscopía y/o exploración quirúrgica. Categoría N: examen físico, imágenes, y/o exploración quirúrgica. Categoría M: examen físico, imágenes y/o exploración quirúrgica. Subsitios anatómicos: - Cardias - Fundus - Cuerpo - Antro y píloro Ganglios linfáticos regionales Los ganglios linfáticos regionales son los ganglios perigástricos a lo largo de la curvatura menor y mayor, los ganglios a lo largo de los vasos gástricos izquierdos, vasos hepáticos comunes, vasos esplénicos, y arteria celíaca así como los ganglios hepatoduodenales. La invasión de otros ganglios linfáticos intra-abdominales como los retropancreáticos, mesentéricos y para-aórticos los clasifica como matástasis a distancia. TNM clasificación clínica T Tumor primario Tx Tumor primario no puede ser evaluado To Sin evidencia de tumor primario Tis Carcinoma in situ: tumor intraepitelial sin invasión de la lámina propia. T1 Tumor que invade la lámina propia o submucosa. T2 Tumor que invade la muscularis propia de la subserosa.1 T3 Tumor que penetra la serosa (peritoneo visceral) sin invasión de estructuras adyacentes. T4 1 2 3 Tumor que invade estructuras adyacentes. 123 1 Un tumor puede penetrar la muscularis propia con extensión a los ligamentos gastrocólico o gastrohepático o al epiplón menor y mayor sin perforación del peritoneo visceral que cubre estas estructuras. En estos casos el tumor es clasificado como T2. Si existiera perforación del peritoneo visceral que cubre los ligamentos gástricos o epiplón, el tumor es clasificado como T3. 2 Las estructuras adyacentes al estómago son el bazo, colon transverso, hígado, diafragma, páncreas, pared abdominal, suprarrenal, riñón, intestino delgado y retroperitoneo. 3 La extensión intramural al duodeno o al esófago es clasificada por la profundidad de mayor invasión en cualquiera de esos sitios incluyendo al estómago. 90 N Ganglios linfáticos regionales Nx Los ganglios linfáticos regionales no pueden ser evaluados. No Ganglios regionales sin metástasis. N1 Metástasis en 1 a 6 ganglios linfáticos regionales. N2 Metástasis en 7 a 15 ganglios linfáticos regionales. N3 Metástasis en más de 15 ganglios linfáticos regionales. M Metástasis a distancia Mx Metástasis a distancia no pueden ser evaluadas. Mo Sin metástasis a distancia. M1 Metástasis a distancia. pTNM clasificación patológica Las categorías pT, pN y pM corresponden a las categorías T, N y M. pNO. El examen histopatológico de un espécimen de linfadenectomía regional debe incluir habitualmente 15 ó más ganglios linfáticos. G Grado Histopatologico Gx Grado de diferenciación no puede ser evaluado G1 Bien diferenciado. G2 Moderadamente diferenciado. G3 Pobremente diferenciado. G4 Indiferenciado. Estadificación Estadio O Tis No Mo Estadio IA T1 No Mo T1 N1 Mo T2 No Mo T1 N2 Mo T2 N1 Mo T3 No Mo T2 N2 Mo T3 N1 Mo T4 No Mo T3 N2 Mo Estadio IB Estadio II Estadio IIIA Estadio IIIB 91 Estadio IV T4 N1,N2,N3 Mo T1, T2, T3 N3 Mo Cualquier T Cualquier N M1 Resumen T1 Lámina propia, submucosa. T2 Muscularis propia, subserosa. T3 Penetra la serosa. T4 Estructuras adyacentes. N1 1 a 6 ganglios N2 7 a 15 ganglios N3 más de 15 ganglios. II) TRATAMIENTO DEL CÁNCER GÁSTRICO LOCALIZADO La cirugía es el único tratamiento potencialmente curativo. Es recomendable en estadios Tis-T3; N0-N2 M0 o T4N0M0. 1. CIRUGÍA Gastrectomía total Debe realizarse en los tumores que se topografían en el sector proximal del estómago, en el tercio medio y en caso de tumores difusos. Gastrectomía subtotal Se realiza en lesiones limitadas al antro - Mismos resultados que gastrectomía total - Margen: 2 cm tu localizados 5 cm infiltrantes - Menores complicaciones y mortalidad Linfadenectomía No existe consenso acerca del tipo de vaciamiento ganglionar a realizar. La linfadenectomía tipo D2 no habia demostrado ser superior a D1. Sin embargo varios trabajos randomizados muestran mayor sobrevida a 5 años cuando la cirugía es D2 comparada con D1 en manos especializadas. Un reciente trabajo publicado en 2006 muestra que la sobrevida global con D3 es superior a D1. 92 El vaciamiento ganglionar debería incluir un mínimo de 14-16 ganglios. 2. TRATAMIENTO ADYUVANTE E IB- EIV MO Quimio-radioterapia concurrentes Está demostrado su beneficio en términos de sobrevida libre de enfermedad y sobrevida global. Plan: Primera serie pre RT: 5 Fu 425 mg en bolo D1-D5 y Leucovorin 20 mg en bolo D1-D5 RT: dosis de 4500 cGY a partir del D28 1ª serie de QT concurrente con inicio de RT: 5Fu 400mg/m2 en bolo y leucovorin 20 mg/m2 en bolo por 4 días. 2ª serie de QT concurrente con final de RT: 5Fu 400mg/m2 en bolo y leucovorin 20 mg/m2 en bolo por 3 días en la 5ª semana de RT. 1 mes después de Finalizada la QT-RT concurrentes se continúa con 2 series más de QT con el mismo esquema de la primera serie. Quimioterapia exclusiva No existe consenso sobre su beneficio. 3. TRATAMIENTO NEOADYUVANTE E II A IV MO El estudio MAGIC que utiliza ECF como QT peroperatoria, (neoadyuvante y adyuvante) ha demostrado beneficios en sobrevida con respecto a la cirugía sola en estadios localizados, resecables. La QT mejora la SVLE y SVG en este subgrupo de pacientes. Otros índices también mejoran con este plan, como el tamaño tumoral, y la extensión del compromiso nodal. Este plan ofrece dificultades para su implementación en el medio ya que requiere de infusión continua por 21 días e incluye epirrubicina. Sin embargo podría ser una opción válida en casos de tumores gástricos resecables, cuando el paciente sea enviado a consulta oncológica en el preoperatorio. TRATAMIENTO DEL CÁNCER GÁSTRICO AVANZADO 93 Cáncer gástrico localmente avanzado El cáncer gástrico localmente avanzado se define como irresecable inicialmente. La sobrevida promedio para los pacientes no tratados es de 11 meses. El objetivo primario es la resecabilidad. Estadios III: T3-T4, N+, M0 La quimioterapia neoadyuvante podría ser una opción para el tratamiento del cáncer gástrico en esta etapa. Existen numerosos estudios fase 2 con distintos planes de QT que demuestran la posibilidad de aumentar la resecabilidad de los tumores localmente avanzados. No existe un régimen óptimo. Sin embargo este aumento de la resecabilidad hasta ahora no ha demostrado beneficio en términos de sobrevida en comparación con la quimioterapia exclusiva. Cáncer gástrico diseminado El cáncer gástrico diseminado es el estadio IV. La sobrevida promedio estimada sin tratamiento de 3 meses y los objetivos del tratamiento son: paliación de síntomas, mejorar la calidad de vida y sobrevida. La revisión de 4 trabajos randomizados utilizando los planes de QT más frecuentes vs. el mejor tratamiento de soporte (MTS) mostró que la sobrevida mediana con QT es superior al MTS. La QT mejoro la calidad de vida de los pacientes diseminados en los estudios diseñados exclusivamente para evaluar esta variable. La evaluación de monoterapia vs. PQT mostró que existen ventajas estadísticamente significativas en sobrevida global con PQT sobre monoterapia. La diferencia neta es de 1 mes. Los planes recomendados asocian 3 drogas que incluyan el cisplatino y la epirrubicina. El ECF (epirrubuicina, cisplatino, 5 fluouracilo) es el que ha mostrado mejores resultados. El DCF (Docetaxel+5 Fu+CDDP) tiene resultados superiores en tiempo a la progresión, en respuestas globales y una modesta ventaja en sobrevida con respecto a los planes clásicos pero con elevada toxicidad. Por ello debería reservarse para individuos jóvenes con buen performance status. El CDDP+5 Fu (cisplatino, 5 fluouracilo) continúa siendo un plan estándar. 94 - El 5 Fu+Irinotecan (con infusión continua de 5 Fu) es una alternativa válida para los pacientes con contraindicaciones para recibir cisplatino. - La asociación de 5 Fu+antraciclinas son alternativas válidas y el 5 Fu monodroga para los pacientes que no pueden recibir los planes de elección. Planes de Quimioterapia - ECF (c/ 3 semanas) Epirrubicina: 50 mg/m2 D1 Cisplatino: 60 mg/m2 D1 5-Fu: 200 mg/m2 D1 al 21 - DCF (cada 21 dias ) Docetaxel: 75 mg/m2 D1 5 Fu: 750 mg/m2 en Infusión contínua D1-D5 CDDP: 75 mg/m2 D1 - CDDP+5 Fu (cada 28 dias ) Cisplatino: 100 mg/m2 D1 5 fluouracilo: 1000 mg/m2 en Infusión contínua D1-D5 - 5 Fu+ Lv + Irinotecan (semanal por 6 sem) Irinotecan 80 mg/m2 D1 Leucovorin 500mg/m2 en 2 horas 5 Fluouracilo 2000 mg/m2 I/c de 22 hs - 5 Fu (cada 28 dias) 5 Fluouracilo 1000 mg/m2 I/c D1 – D5 cada 28 días. 95 2009 CANCER DE COLON Y RECTO I) DIAGNOSTICO Y ESTADIFICACION Diagnóstico COLON Tumor primario - Endoscopía con biopsia Estudio endoscópico completo del colon en el pre o postoperatorio si no es posible al momento del diagnostico Estadificación - Ecografía de abdomen Par Radiológico de tórax De valoración general - Hemograma Función hepática Función renal No rutinarios de acuerdo a extensión loco-regional y sospecha de siembra a distancia: - TAC Tórax-abdomen-pelvis Cistoscopia Centellograma óseo TAC del SNC PET no esta indicado de rutina, se puede considerar : en la estadificación y en la recaída. - Considerar en pacientes con metástasis única resecable y en la recaída bioquímica en pacientes sin evidencia de recaida local o sistémica por otros métodos. CEA: es un marcador inespecífico, que se eleva en diversas patologías benignas y malignas (pulmón, colon, mama etc). No tiene valor en tamizaje para cáncer de colon. Es útil como elemento de valor pronóstico y en el seguimiento de la enfermedad, si bien no en todos los casos. El Ca 19-9 puede elevarse en tumores 96 mucosecretantes y ser de utilidad cuando el CEA no presenta alteraciones. RECTO Tumor primario Rectosigmoidoscopía con biopsia - FCC en busca de un tumor sincronico ECO transrectal de gran utilidad para evaluar compromiso parietal y ganglionar, especialmente en la selección de pacientes con tumores superficiales para resección local. De utilidad también en la evaluación de la respuesta al tratamiento neoadyuvante. RNM De utilidad para predecir el compromiso del margen - circunferencial y de los ganglios regionales. Estadificación - TAC abdómino-pélvica Cistoscopía en caso de sospecha de compromiso vesical RxTx PET no esta indicado de rutina, se puede considerar : en pacientes con metástasis única resecable y en la recaída bioquímica en pacientes sin evidencia de recaida local o sistémica por otros métodos. De valoración general - Hemograma Función hepática y renal CEA: Iguales consideraciones que en colon. Estadificación Sistema TNM II) TRATAMIENTO COLON E I y II: solo cirugía E III: cirugía seguida de adyuvancia E IV: Tratamiento sistémico Metastasectomía en situaciones puntuales 97 E II de riesgo: adyuvancia discutible dado que el beneficio es del orden del 5% en sobrevida libre de enfermedad y sin beneficios en SVG. QUIMIOTERAPIA ADYUVANTE: Indicaciones: Estadio III y II de riesgo: E II de riesgo: Definición - Oclusión Intestinal - Perforación de colon - T4 - Invasión vasculolinfática y perineural -Otros de menor importancia ( valoración ganglionar insuficiente, tumor pobremente diferenciado, CEA preop >5, bordes +, estabilidad de microsatélite, etc.) Nota: La adyuvancia en el cáncer de colon estadio II podrá ser indicada valorando con el paciente el magro beneficio de su aplicación. Planes de quimioterapia: FOLFOX4: 5Fu: 400 mg/m² bolo y luego 600 mg/m² en 22 hs D 1-2 LV: 200 mg/m² en 2hs D 1-2 Oxaliplatino: 85 mg/m² en 2hs D1 c/ 15 d x 12 c FLOX: 5 Fu: 500mg/m2 i/v en bolo semanal x 6 Lv: 500 mg/m2 semanal x 6 cada 8 sem por 3 ciclos Oxaliplatino: 85 mg/m2 semanas 1, 3 y 5 m FOLFOX 6 Oxaliplatino: 85mg/m2 I/V D1 LV: 400 mg/m2 i/v D1 c/15d 5Fu: 400 mg/m2 i/v seguido de 1200 mg/m2/d x 2 días i/c x 12 c 98 5 FU/leucovorin: 5FU: 425 mg/m2 i/v D 1-5 cada 28 días x 6 ciclos. LV: 20 mg/m2 i/v, 30’ previos al 5Fu. Capecitabine: 2500mg/m2 v/o día, en 2 tomas diarias D 1-14 cada 21-28 días por 8 ciclos. PLAN INDICACIONES E II alto riesgo – E III PS 0-2 FOLFOX 4 - PS 0-2 FLOX - No recomendable mayores 70 años cuando NO es posible implementar infusión continua 5 Fu-LV - PS 0-2 < 70 años con PS hasta 3 Capecitabine - Intolerancia o contraindicación al oxaliplatino > 70 años con PS 0-1 Intolerancia o contraindicación al oxaliplatino PS: Performance status ENFERMEDAD DISEMINADA: Estadios IV Metastasectomía: - SV 5a 35-58% post-metastasectomía. -Valorar: localización, ubicación en el tiempo: sincrónica vs metacrónica; operabilidad y resecabilidad -Objetivos: RO -En forma esquemática se representan las conductas más frecuentes en estas situaciones. 99 METASTASIS SINCRONICAS CIRUGIA → METACRONICAS PQT (Colectomía + Metastasectomía) RESECABLES METASTASECT → PQT NEOADYUVANCIA → CIRUGIA +/- PQT PSEUDO-NEOADYUVANCIA → COLECTOMIA → NEOADYUVANCIA → METASTASECTOMIA → PQT METASTASECT +/- PQT PS: 0-2 NEOADYUVANCIA → CIRUGIA +/- PQT NEOADYUVANCIA → METASTASECTOMIA → PQT IRRESECABLES COLECTOMIA → PS ≥ 3 PQT TRATAMIENTO DE SOPORTE * Planes de quimioterapia utilizados en estadios IV Esquemas: FOLFOX 4 (igual al adyuvante) FLOX (igual al adyuvante) XELOX es al menos equivalente a FOLFOX4 Capecitabine: 1700 – 2000 mg/m2 x 14 días Oxaliplatino: 130 mg/m2 v/o c/ 21 días x 8 ciclos i/v en 2 hs D1 FOLFIRI: 5Fu: 400 mg/m² bolo y luego 600 mg/m² en 22 hs D 1-2 c/ 15 d LV: 200 mg/m² en 2hs D 1-2 x12 c Irinotecán: 180 mg/m2 D1 IFL: 5FU: 500 mg/m2 i/v Leucovorina: 20 mg/m2 i/v semanales durante 4 a 6 semanas Irinotecan: 125 mg/m2 5 FU/leucovorin: (igual al adyuvante) 100 Capecitabine: (igual al adyuvante) Bevacizumab 5 mg/Kg i/v cada 15 días + Planes con oxaliplatino o irinotecan y fluopirimidinas. 7.5 mg/Kg i/v cada 21 días + Planes con oxaliplatino o irinotecan y fluopirimidinas. Irinotecan - 125 mg/m2 i/v D1-8-15-22 cada 6 semanas - 300-350 mg/m2 i/v D1 cada 21 días Cetuximab/Irinotecan - Irinotecan 300-350 mg/m2 i/v D1 cada 21 día - Cetuximab1º dosis 400 mg/m2 i/v, luego 250 mg/m2 i/v semanal Cetuximab/FOLFIRI - Cetuximab1º vez 400 mg/m2 i/v, luego 250 mg/m2 i/v semanal + FOLFIRI Bevacizumab: Indicado en el tratamiento del cáncer de colon metastático con criterio paliativo en 1º y/o 2º línea, en asociación con los planes de quimioterapia más efectivos. Dado que su incorporación incluye además otro plan de QT el grupo recomendado debería cumplir los siguientes requisitos: -Estadio IV -Edad menor o igual a 70 años -PS 0, I -Tener una sobrevida estimada mayor o igual a 6 meses. -En el caso de utilizarse en segunda línea haber demostrado respuesta en la primera. La dosis recomendada es de 5 mg/kg peso cada 14 días asociado a quimioterapia. Puede administrarse 7.5 mg/kg cada 21 días + QT. 101 La implementación de 2º líneas en cáncer de colon y recto va a depender de los planes utilizados previamente y de la existencia o no de respuesta a las líneas anteriores. - Cetuximab: La determinación del K ras como factor predictivo de respuesta al Cetuximab es una etapa incorporada en el estudio y tratamiento del cáncer de colon. Las mutaciones del Kras se asocian con menor respuesta y/o peor sobrevida en pacientes quimio-refractarios. En primera línea, es una opción a tener en cuenta, combinado con Irinotecan(FOLFIRI) en pacientes con K-ras salvaje y que tengan contraindicaciones para recibir Bevacizumab. El beneficio de la combinación FOLFIRI+Cetuximab (Estudio Crystal) fue estadísticamente significativo en SVLP, Respuestas globales y también en sobrevida global, para el subgrupo de pacientes con Kras salvaje. Las 2º líneas van a depender de los planes utilizados previamente 1º línea Planes con oxaliplatino y fluopirimidinas + Bevacizumab 2º línea Planes con irinotecan y fluopirimidinas +Bevacizumab FOLFIRI o Irinotecan + Cetuximab Planes con irinotecan y fluopirimidinas Planes con oxaliplatino y fluopirimidinas + Bevacizumab + Bevacizumab FOLFIRI + Cetuximab * FOLFOX o XELOX + Cetuximab 5 Fu/LV o Capecitabine +/Bevacizumab Alguno de los planes anteriores Cetuximab + Irinotecan * En pacientes con K-ras salvaje y que tengan contraindicaciones para recibir Bevacizumab. La progresión luego de la utilización de planes con fluopirimidinas asociadas con sales de platino en primera línea permite sugerir la utilización del irinotecan en segunda línea asociado o no a las fluopirimidinas. 102 La combinación con Bevacizumab en primera línea, puede mantenerse en segunda línea cambiando la QT asociada. El uso del Cetuximab en segunda línea puede realizarse ante la progresión de planes con sales de platino y bevacizumab o incluso con planes que utilizaron irinotecan. La combinación cetuximab+irinotecan luego de progresión con irinotecan, ha mostrado beneficios en respuestas globales y mayor tiempo a la progresión estadísticamente significativos. La implementación de 3º líneas en cáncer de colon metastásico es cada vez mas frecuente y dependerá de los tratamientos recibidos previamente y de las respuestas observadas. Se pueden utilizar entre otros Irinotecan, Mitomicina C, Taxanos y Gemcitabine; solos o combinados como terapia de salvataje Tratamiento sistémico contínuo, (QT de Mantenimiento) La utilización de tratamiento sistémico continuo en cáncer de colon avanzado ha sido explorada desde hace algunos años. Si bien existe tendencia creciente a mantener la QT luego del tratamiento inicial hasta la progresión tumoral, con el mismo o con planes de QT diferentes y con menor toxicidad; la significación estadística de esta modalidad de tratamiento continuo en SVG ha sido marginal en los estudios que no incluían los Ac monoclonales. Hay estudios en curso que exploran esta modalidad de tratamiento continuo vs intermitente incluyendo Ac monoclonales con resultados definitivos aún pendientes. IV) SEGUIMIENTO - Luego de Cirugía con/sin tratamiento adyuvante. Clínico: cada 3 meses por 3 años, y cada 6 meses el 4º y 5º año. CEA: cada 3 meses por 3 años, en E II-III . Aumento asintomático del CEA: - Repetir el estudio - Valorar función renal y hepática - Evaluación imagenológica y endoscópica. Considerar PET si está disponible Si la evaluación completa es negativa: observación 103 TAC Tx-abd: anual en pacientes de alto riesgo de recaída que son candidatos a cirugía pretendidamente curativa de rescate. FCC: pre y/o postoperatoria, al año de la intervención, a los 3 años y si es normal, cada 5 años. B) RECTO E I: T1N0MO, Sm1, Topografía distal sin elementos de riesgo histológico (menores de 3 cm, grado histológico I o II sin invasión vascular o linfática y con margen negativo todas las características presentes), la resección transanal es una opción. Con margen negativo tratamiento suficiente. EI: T1-T2N0M0, Sm2 o con elementos de riesgo histológico en topografía distal, la indicación es cirugía radical. Si no fuese pasible de cirugía, puede realizarse tratamiento local + adyuvancia con RT +/- QT. EI: T1-T2 N0M0 recto medio y alto, cirugía sin tratamiento adyuvante si el estadio Patológico se mantiene. E II y III: T3-T4 N0MO, o cualquier T N+, QT-RT neoadyuvante seguida de cirugía es la mejor opción. En presencia de N+ se indica adyuvancia sistémica posterior a la cirugía. Otra opción es la cirugía seguida de adyuvancia. E II y III: T3-T4 N0MO, o cualquier T N+ topografía en recto alto, cirugía seguida de adyuvancia sistémica si es N+. -Tumor irresecable o próximo a margen anal: - Tto neoadyuvante….. resecable: tto quirúrgico + adyuvancia no resecable: RT radical E IV: tratamiento sistémico igual que en colon. La metastasectomía tiene iguales consideraciones que en cáncer de colon. -Es fundamental considerar, antes de tomar conducta terapéutica, el concepto patológico de Mesorrecto. Solicitar información al patólogo sobre la condición del mismo en la resección, si está indemne o incompleto y también información sobre el margen circunferencial. -Es de destacar que la escisión total del mesorrecto (ETM) es un factor 104 pronostico fundamental en la cirugía de recto: Cuando está indemne, disminuye la recurrencia y aumenta la SVLE. -La evaluación del margen circunferencial también es un factor pronostico y debe considerarse como ideal, si es mayor a 2 mm. Potenciales indicaciones de la neoadyuvancia Tumores distales o que comprometen el esfínter. T1-2 N1 T3 N0-1 T4 para aumentar la resecabilidad Beneficios de la QT-RT neoadyuvante Permite la conservación esfinteriana hasta en un 39 %, con reducción de la recaída local, menor toxicidad y sobrevida global similar al tratamiento adyuvante. Evaluar la posibilidad de resección quirúrgica entre 4 y 6 semanas de finalizado dicho tratamiento De ser posible la cirugía se procederá a la misma y una vez recuperado el paciente de la intervención, se continuará con tratamiento quimioterápico adyuvante como en colon hasta completar 6 ciclos de QT. En caso de no ser posible la cirugía se completará la RT hasta llegar a dosis radicales en combinación con 5FU. Esquemas de tratamiento Neoadyuvancia RT-QT (5Fu i/v o i/c) + Cirugía El 5 Fu concurrente a la RT puede administrarse de diferentes formas: * 225 mg/m2 dia durante toda la RT. * 350 mg/m2 en bolo D1-D5 + Leucovorin 20 mg/m2 en bolo D1-D5 en la semana 1 y 5 de la RT. *5 Fu 425 mg/m2 i/v en bolo D1-5 al comienzo y al final de la RT *1000 mg/m2 dia en infusión contínua D1-D4 al inicio y al final de la RT. Otras opciones: 105 * Capecitabine 1650 mg/m2 dia, dividido en 2 tomas durante toda la RT. * Capecitabine 1650 mg/m2 dia, dividido en 2 tomas de lunes a viernes durante la RT asociado a Oxaliplatino 50 mg/m2 semanal. La incorporación del capecitabine concurrente con RT asociado o no a oxaliplatino esta sustentado en estudios clínicos Fase II, estando los estudios fase III con resultados definitivos pendientes. Adyuvancia La mejor opción para el cáncer de recto es la neoadyuvancia seguida de cirugía. Cuando los pacientes son intervenidos de inicio, y existen factores de riesgo para recaída local y/o sistémica; se considerará la adyuvancia con RT+QT que podrá estar seguida de QT exclusiva cuando el estado ganglionar sea positivo. Luego de finalizada la RT + QT concurrente, los planes de adyuvancia sistémica son los utilizados en colon incluyendo el oxaliplatino. La QT concurrente con RT, se hará con 5FU a la dosis de 1000 mg/m2 D 1-4 al comienzo y al final de la RT. 3. ENFERMEDAD AVANZADA En los estadios diseminados son útiles los planes utilizados para el cáncer de colon diseminado. Dado que la sintomatología loco-regional compromete la calidad de vida, se considerará el tratamiento local multimodal según el caso, a pesar de tratarse de un estadio diseminado. IV) SEGUIMIENTO Clínico: cada 3 meses por 3 años, y cada 6 meses el 4º y 5º año. CEA: cada 3-4 meses por 2- 3 años. ECO/TAC abdomen: según clínica y/o laboratorio RxTx: anual por 2-3 años FCC: a los 6-12 meses de la cirugía, luego cada 1-2 años hasta los 5 años. 106 CANCER DE REGION ANAL I) INTRODUCCIÓN El subtipo histológico más frecuente es carcinoma epidermoide y tiene predominancia por el sexo femenino con estrecha relación con el virus de HPV y sus sero-tipos 16 y 18. El adenocarcinoma es excepcional 1-2% y cuando se presenta tiene tratamiento diferente. Cuando la histología es mixta, el comportamiento es similar al escamoso. Hasta un 30 % de los casos se presenta con adenopatías regionales y cuando la histología es epidermoide, frecuentemente muestran necrosis. La curación en pacientes con ganglios positivos puede alcanzar al 50%. En esta localización la cirugía sólo juega un rol en estadios precoces y en aquellos casos que la RT+QT no ha logrado la respuesta completa. II) DIAGNOSTICO Y ESTADIFICACION Anamnesis y examen físico. Tacto Rectal. Examen genital. Ecografía endo-anal especialmente útil en la valoración del esfínter, ganglios regionales y órganos vecinos. Estudio endoscópico con biopsia. Puede requerirse punción citológica de adenopatías inguinales. TAC de Abdómen y Pelvis. Rx Tx (F Y P) o TAC cuando la situación lo amerite. Func. y Enz. Hepático. Hemograma. III) TRATAMIENTO Radio-Quimioterapia concurrentes Es el tratamiento estándar para pacientes con: T1 mayor a 10 mm T2-4 N0 Cualquier T con N+ 107 El plan estándar de QT es la combinación de MITOMICINA C y 5 Fu. Este plan es superior al de CDDP+5 Fu concurrente con RT en términos de sobrevida libre de enfermedad y sobrevida libre de colostomía. La sobrevida global es similar para ambos planes. El plan con CDDP tiene mayor mortalidad por toxicidad intrínseca mientras que la toxicidad hematológica es mayor para el plan estándar. Plan estándar: MIT C 10 mg/m2 i/v D1y D29 5FU 1 gr/m2/día en I.C D1-D4 y a los 28 días se repite el plan. En los casos de toxicidad desmedida luego de la primera serie concurrente, se puede realizar 5FU solo a igual dosis al final de la RT. El plan con CDDP no sustituye a la Mit C pero puede considerarse una alternativa válida en algunas situaciones: Intolerancia o contraindicaciones para la Mit C. En pacientes en que se prevea severa toxicidad hematológica del plan estándar. Con respecto a la RT, la mayoría de los ensayos clínicos, manejan 40-50 Gy hasta T2 y 50-60 Gy para T3-T4. La RT exclusiva podrá considerarse en estadios avanzados cuando se estime excesivamente tóxico el plan estándar o los alternativos. Estadios precoces: -Tis: el tratamiento es discutido, lo más aceptado es realizar cirugía endoanal, seguida de RT para disminuir el riesgo de recaída local. Otra opción es la RT exclusiva. -T1 menor 1cm invasor: RT local, pudiendo incluir últimos 2-3 cm del recto para involucrar ganglios peri-rectales. Los adenocarcinomas de canal anal, se deben tratar como tumores de recto bajo. Estadios diseminados: La estrategia fundamental es la quimioterapia. Los planes más utilizados incluyen: -5 Fu+ CDDP 108 -Mit C -Carboplatino -Irinotecan IV) EVALUACIÓN A las 8 semanas de finalizado el tratamiento se evaluará respuesta, pudiendo darse por terminado el tratamiento en caso de respuesta completa. En aquellos casos que no se alcanza la respuesta completa y no es posible la preservación de órgano la cirugía de rescate es la amputación abdómino- perineal. V) SEGUIMIENTO Fundamentalmente clínico, para descartar una recidiva loco-regional. S e recomienda: -Evaluación cada 6 -8 semanas durante los primeros 3 a 6 meses de tratamiento con: Examen físico y anoscopía . -Luego cada 3 meses por 2 años, cada 6 meses por 3 años y anual después de los 5 años. -No tiene indicación el CEA, a menos que se trate de un adenocarcinoma . 109 2009 CARCINOMA DE VIA BILIAR Los tumores de vía biliar pueden asentar en la vesícula biliar y en el conducto cístico o en los conductos biliares (colangiocarcinoma ) II) VESICULA BILIAR INTRODUCCION Se trata de un tumor poco frecuente, representa el 1% de todos los cánceres. Si bien la etiopatogenia es desconocida dentro de los factores de riesgo se destacan: 1) Presencia de cálculos, particularmente asociado a colecistitis crónica. El riesgo se relaciona con el tamaño de los cálculos. 2) Vesícula biliar calcificada 3) Pólipos en vesícula biliar mayores de 10 mm En cuanto a la anatomía patológica el mayor porcentaje son adenocarcinomas. DIAGNOSTICO El 80% se diagnostican en etapas avanzadas cuando el tumor es irresecable, dado que se presentan con síntomas inespecíficos como ser: dolor abdominal, disminución de peso, anorexia, nauseas, colecistitis aguda por obstrucción neoplásica. Solo el 10% se diagnostican en el preoperatorio, el 50% en el intraoperatorio y el 40% en el postoperatorio. Diagnostico del tumor primario Anamnesis y examen físico. Ecografía abdominal, ecografía doppler opcional. Punción con aguja fina guiada por ecografía. Valoración de extensión loco- regional y a distancia: TAC de abdomen Rx Tx (F Y P). Func. y Enz. Hepático. Hemograma. Otros según situación clínica ESTADIFICACION según TNM T1a: tumor invade lámina propia. 110 T1b: tumor invade la capa muscular. T2: tumor invade tejido conjuntivo perimuscular, no más allá de la serosa. T3: tumor perfora la serosa, o invade el hígado y/o órgano adyacente. T4: tumor invade vena VPP o arteria hepática o múltiples órganos o extructuras extrahepáticas. N0: sin compromiso ganglionar. N1: compromiso ganglionar regional. M0: sin metástasis a distancia. M1: metástasis a distancia. E IA: T1 N0 M0 E IB: T2 N0 M0 E IIA: T3 N0 M0 E IIB: T1-3 N1 M0 E IIII: T4 N cualquiera M0 E IV: cualqier T cualquier N M1 TRATAMIENTO El tratamiento quirúrgico es el único tratamiento curativo para estadios tempranos. 1) Tumores resecables Los pacientes con tumores pT1a y márgenes negativos son candidatos a observación luego de colecistectomía simple. Los pacientes con tumores pT2-4 N0-1 MO deben ser estadificados y en caso de que se trate de tumores M0, debe realizarse colecistectomía radical y se aconseja tratamiento adyuvante. Los que más se benefician del tratamiento adyuvante son aquellos pacientes con tumores N + o margen positivo ya que presentan mayor riesgo de recaída. Opciones a considerar según extensión lesional, comorbilidades y PS: Radio/Quimioterapia Quimioterapia Radioterapia Estas tres opciones se pueden considerar indistintamente, pero en pacientes con GL (+) o márgenes positivo, se aconseja realizar Radio/Quimioterapia si el PS y las comorbilidades lo permiten. 2) Tumores irresecables Opciones a considerar según extensión lesional, comorbilidades y PS: Quimioterapia Radio/Quimioterapia 111 Radioterapia Esquemas de tratamiento: Quimioterapia: múltiples estudios fase II demuestran el beneficio del tratamiento sistémico adyuvante. Un estudio reciente fase III muestra un beneficio en SVLP y SVG en pacientes con carcinoma de vía biliar PS 0-2 con la utilización CDDP/Gemcitabine, de acuerdo al siguiente esquema: CDDP 25 mg/m2 D1 y 8 / Gemcitabine .1000mg/m2 D1,8 y15 Otros regímenes de PQT a considerar: Gemcitabine 1000 mg/m2 en infusión de 100 min D1y 8 / Oxaliplatino 100 mg/m2 D2 cada 15 días Gemcitabine 1000 mg/m2 D1,8 y15 / 5FU 600 mg/m2 / LV 25 mg/m2 D1,8 y15 cada 28 días Gemcitabine 1000 mg/m2 D1 y 8/ Capecitabine 1300 mg/m2 en dos tomas diarias D1-14 cada 21 días Capecitabine 2000 mg/m2 en dos tomas diarias D1-D14/ Oxaliplatino 130 mg/m2 D1 cada 21 dias De tratarse de un paciente no candidato a PQT considerar: Gemcitabine 1000 mg/m2 D1,8 y 15 cada 28 días Capecitabine, 2500 mg/m2 día D1-D14 en dos tomas diarias cada 21 días. 5 FU 425 mg/m2/ LV 20 mg/m2 cada 21 días. RT/QT con 5 FU a considerar en pacientes con buen PS, con GL (+) o márgenes positivo. 5FU 500 mg/m2 en bolo 3 días consecutivos al inicio y final de RT Capecitabine 1600 mg/m2 de lunes a viernes en 2 tomas diarias durante la RT RT (54 Gy sobre lecho tumoral y región ganglionar.) SEGUIMIENTO En aquellos pacientes tratados con criterio radical: 112 Control clínico cada 3 meses durante los 2 primeros años. Ecografía de abdomen cada 6 meses durante los 3 primeros años y Rx de Torax anual Luego del tercer año se podrán espaciar los controles clínicos cada 6 meses e imagenológicos cada 12 meses. III) COLANGIOCARCINOMA INTRODUCCION Son tumores menos frecuentes que los de vesícula biliar. Se dividen en: - intrahepáticos (constituyen por frecuencia el segundo tumor hepático) - extrahepáticos (son los mas frecuentes de los conductos biliares). Los tumores extrahepáticos se subdividen en: - tumores del tercio superior o de Klatskin' s (50%) - tumores del tercio medio (25%) - tumores del tercio inferior (19 %) La distribución mundial es similar a la del carcinoma de vesícula. La etiopatogenia es desconocida, se asocia a múltiples factores de riesgo: 1) CUC 2) Colangitis esclerosante primaria 3) Hepatolitiasis En cuanto a la AP se trata en la gran mayoría de los casos de adenocarcinomas. DIAGNOSTICO En la gran mayoría de los casos el diagnostico es tardío. Los síntomas son inespecíficos: disminución de peso, anorexia, dolor abdominal. La ictericia obstructiva es permanente y progresiva y es más frecuente cuanto mas abajo se origine el tumor (así los tumores del extrahepáticos topografiádos en el tercio superior pueden obstruir el 70 % del flujo biliar sin causar ictericia) Diagnostico del tumor primario: Anamnesis y examen físico Ecografía de abdomen, la ecografía doppler es opcional. Ecoendoscopía permite realizar PAAF de los tumores distales. 113 RNM con colangioresonancia de mayor utilidad en vía biliar intrahepática y extrahepática superior CPER (colangiopancreatografia endoscopica retrograda) de mayor utilidad en tumores de vía biliar inferior. Si bien es un método invasivo con riesgo de infección permite obtener diagnostico histológico y en algunos casos puede ser terapéutico CEA y CA 19-9 Valoración de extensión locorregional y a distancia: TAC de abdomen Rx Tx (F Y P). Func. y Enz. Hepático. Hemograma. Otros según situación clínica ESTADIFICACION según criterios del TNM INTRAHEPATICOS EXTRAHEPATICOS T1: tumor solitario sin invasión vascular. T1: tumor confinado al conducto biliar. T2: tumor solitario con invasión vascular o T2: tu. invade más allá de la pared del múltiples tumores < 5 cm. conducto biliar. T3: múltiples tumores > 5 cm, o compromiso T3: invasión del higado, vía biliar, páncreas de vena porta o hepática. T4: invasión de órg. adyacentes (< via biliar) divisiones o de vena porta o hepática T4: invade VP principal o sus bilat. o perforación de peritoneo visceral. art. hepática u órg. adyacentes. N0: sin compromiso ganglionar. N0: sin compromiso ganglionar. N1: compromiso ganglionar regional. N1: compromiso ganglionar regional. M0: sin metástasis a distancia. M1: metástasis a distancia. M0: sin metástasis a distancia. M1: metástasis a distancia. 114 E I: T1 N0 M0 E IA: T1 N0 M0 E II: T2 N0 M0 E IB: T2 N0 M0 E IIIIA: T3 N0 M0 EIIA: T3 N0 M0 E IIIB: T4 N0 M0 E IIB: T1-3 N1 M0 E IIIC: cualquier T N1 M0 E III: T4 cualquier N M0 E IV: cualquier T cualquier N M1 E IV: cualquier T cualquier N M1 TRATAMIENTO El tratamiento quirúrgico es el único tratamiento curativo para estadios tempranos 1) Tumores resecables En pacientes con buen PS y tumores resecados R1-R2 o N+ considerar: Quimioterapia. Radio/Quimioterapia. Radioterapia. Estas tres opciones se pueden considerar indistintamente, pero en pacientes con GL (+) o márgenes positivo, se aconseja realizar Radio/Quimioterapia si el PS y las comorbilidades lo permiten. 2) Tumores irrecables Opciones a considerar según extensión lesional, comorbilidades y PS: Quimioterapia. Radio/Quimioterapia. Radioterapia. Esquemas de tratamiento: ver aquellos incluidos en cáncer de vesícula biliar. SEGUIMIENTO 115 En aquellos pacientes tratados con criterio radical: Control clínico cada 3 meses durante los 2 primeros años. Ecografía de abdomen cada 6 meses durante los 3 primeros años y Rx de Tórax anual Luego del tercer año se podrán realizar los controles clínicos cada 6 meses e imagenológicos cada 12 meses. 116 2009 I) CANCER DE PANCREAS DIAGNOSTICO Anamnesis y exámen físico. TAC de Abdómen y Pelvis. Ecografía Abdominal (opcional). BIOPSIA Rx Tx (F Y P). CA 19-9 Func. y Enz. Hepático. Hemograma. Otros según situación clínica Pacientes en que existen dudas de lograr una resección potencialmente curativa: - ECO endoscopía - RNM - PET TC El rol del PET aún no está definido, sin embargo cuando existan dudas sobre la resecabilidad del tumor sería la indicación mas frecuente. II) TRATAMIENTO Enfermedad Resecable T1-3 N0 M0 T1-2 N1 M0 Cirugía La cirugía es el único tratamiento curativo del cáncer de páncreas, sin embargo, solo un 20 % de los casos son susceptibles a la misma. Los pacientes con R0 tienen una SVM 15-19 meses y SV 5a 20%. Las recaídas locales son tan altas como 70% y las metástasis ganglionares son precoces y ocurren tanto en los ganglios peri-pancreáticos como en los para-aórticos. Las técnicas quirúrgicas han progresado y eso ha aumentado la SV del cáncer de páncreas resecado de 24 a 41% en estadios con ganglios negativos. El compromiso ganglionar y la infiltración venosa son factores de pronóstico adverso pero no constituyen una contraindicación para la cirugía; sin embargo la infiltración arterial si lo es. Las cirugías con linfadenectomía ampliada no han demostrado beneficios en SV. 20-25 ganglios es un número óptimo en una pancreatectomía. 117 La metastasectomía es una opción en pacientes con M1 detectada en la cirugía en un cáncer resecable, sin embargo, el beneficio de la resección de metástasis y de recurrencias debe aclarase con estudios randomizados. Opciones Quirúrgicas: Procedimiento de Whipple: (resección pancreato-duodenal) Pancreatectomía distal: en tumores de cuerpo o cola. Pancreatectomía total: para lograr márgenes negativos. Tratamiento adyuvante Se ha intentado mejorar los magros resultados en sobrevida de la cirugía exclusiva desde hace 2 décadas, realizando estudios randomizados y prospectivos para valorar el beneficio de los tratamientos adyuvantes de radioterapia y quimioterapia luego de obtenida la resección completa de la lesión pancreática. La mayoría de los estudios randomizados muestran que la adyuvancia con quimioterapia es superior en sobrevida libre de recaída y sobrevida global a la cirugía sola. El 5 Fu con leucovorin por 6 ciclos es uno de los planes considerados para el tratamiento adyuvante de los estadios resecables. El Gemcitabine tiene iguales resultados en sobrevida que el 5 Fu con mejor tolerancia por lo que el plan semanal por 6 ciclos es el estándar en adyuvancia. Se recomienda adyuvancia en pacientes resecados, R0-1 y con buen PS. Si bien existen razones lógicas para emplear la RT+QT en adyuvancia del cáncer de páncreas el nivel de evidencia aún, es insuficiente para su uso sistemático. Sin embargo la RT+QT puede ser considerada en pacientes con alto riesgo de recaída local como son los que presentan compromiso ganglionar o resecciones R1. Planes de Tratamiento adyuvante QT: Gemcitabine 1000 mg/m2 D1, 8 y 15 c/28 días x 6 ciclos. (otra opción) 1250 mg/m2 D1 y 8 c/21 días x 6 ciclos. Se recomienda comenzar la adyuvancia a partir del 10º día de la cirugía y antes de los 40 días de la misma. RT/QT: en pacientes de alto riesgo (compromiso ganglionar o de márgenes) 118 1. 5Fu 200-225 mg/m2 i/c durante la RT (50,4 Gy) 350 mg /m2 D1-5 i/v en la 1º y 5º sem. de la RT. 500 mg/m2 i/v en bolo D1-3 en la 1ª y 5ª sem de la RT 2. Capecitabine 1600 mg/m2/d de L a V durante la RT. Tratamiento Neoadyuvante Dado el alto porcentaje de pacientes con enfermedad no quirúrgica o con márgenes estrechos o positivos luego en la cirugía, la neoadyuvancia sigue siendo una modalidad de investigación permanente en el cáncer de páncreas. Se argumenta a su favor con respecto al post-operatorio, que evitaría el tiempo perdido en la recuperación posquirúrgica, que existiría una menor tasa de fallos a nivel de la anastomosis, complicación mayor postoperatoria, y que disminuiría la incidencia de márgenes estrechos o positivos. Puede evitar la cirugía en un 25% de los pacientes, que cuando se realiza la reestadificación post-tratamiento neoadyuvante, presentan metástasis especialmente a nivel hepático. No existe un plan estándar pero la mayoría de los estudios que muestran beneficio se han realizado con RT+QT, tampoco existen estudios que comparen neoadyuvancia vs. adyuvancia. Hay en curso un estudio clínico fase III que podría dilucidar el real beneficio de la neo vs adyuvancia en cáncer de páncreas. Potenciales indicaciones: Pacientes con enfermedad localizada y resecabilidad marginal Pacientes con enfermedad rápidamente progresiva, Pacientes con invasión vascular venosa y/o arterial, con el objetivo de tener cirugías R0. Planes de Neoadyuvancia 1. RT/QT (5Fu i/c o i/v en la 1ª y última semana de la RT) - 5Fu 200-225 mg/m2 i/c durante la RT o 350 mg /m2 D1-5 i/v la 1º y 5º sem. de la RT - Capecitabine 1600 mg/m2/d de L a V durante la RT. 2. Existen planes combinados que utilizan Gemcitabine, Paclitaxel o combinaciones de ellos con RT 119 Enfermedad Irresecable T3-T4, N0-1 M0 La conducta en pacientes con enfermedad irresecable no metastásica, no es estándar. La QT es considerada por algunos grupos como el tratamiento de elección al igual que en los estadios metastásicos. Sin embargo para otros grupos, la RT es considerada una opción particularmente útil en estos pacientes. La asociación de radio-quimioterapia es superior a la RT exclusiva siendo la combinación con fluopirimidinas el plan de referencia. La comparación del tratamiento combinado de RT+QT con QT exclusiva (Gemcitabine), no ha mostrado beneficio a favor de ninguna de las opciones siendo necesarios mayor número de estudios clínicos. El consenso alcanzado a través de estudios retrospectivos, no randomizados, es que los pacientes que se beneficiarían de la RT+QT serían aquellos previamente tratados con QT que no han tenido progresión después de 3-4 meses de tratamiento sistémico. Los pacientes que progresan bajo el tratamiento de QT pueden recibir una segunda línea de QT o tratamiento de soporte. Enfermedad Diseminada El tratamiento sistémico constituye un pilar en el manejo de los pacientes portadores de cáncer metastásico. En relación al cáncer pancreático, los resultados son poco alentadores. La QT es mejor al tratamiento de soporte, la PQT es superior a la mono-quimioterapia y el régimen de elección debe incluír el Gemcitabine. Entre los planes de QT que combinan gemcitabine con otras drogas, sólo 2 de ellos han mostrado beneficio en SVM, Gemcitabine combinado con Fluopirimidinas y con Sales de Platino. Dado que los estudios tienen bajo n de pacientes y la mayoría no muestran ventajas en SVG , se ha recurrido a los metanálisis con los estudios mencionados. Las combinaciones de Gemcitabine +Platinos y Gemcitabine+fluopirimidinas aumentan la SVM con respecto al Gemcitabine monodroga, siendo observado este beneficio solo en pacientes con buen PS. Es recomendable dado la alta incidencia de complicaciones tromboembólicas la anticoagulación profiláctica salvo que existan contraindicaciones. . Primera línea Opciones terapéuticas: 120 Buen PS: PQT: Gemcitabine/Capecitabine Gemcitabine/Sales de platino Gemcitabine/Erlotinib: si bien tiene un beneficio estadísticamente significativo, éste es mínimo y con una mayor toxicidad Gemcitabine. 1000 mg/m2 D1 y 8 + Capecitabine 1300 mg/m2/d D1-14 c/21 días. Gemcitabine 1000 mg/m2 D1 y 8 + Cisplatino 25 mg/m2 D 1 y 8 c/21 días. Gemcitabine 1000 mg/m2 D1 + Oxaliplatino 100 mg/m2 D2 c/15 días. Regular PS: MQT: Gemcitabine: 5Fu Capecitabine Mal PS: Tratamiento de Soporte (opiáceos, derivación biliar, alcoholización percutánea del plexo celíaco, etc) Segundas líneas: 5 Fu 1000 mg/m2 D1-5 i/c + CDDP 100 mg/m2 D2 c/28 días Xelox o Folfox Gemcitabine en pacientes que no lo han recibido 5Fu monodroga o Capecitabine Seguimiento Historia clínica y examen físico cada 3-6 meses por 2 años. CA 19.9 y TAC (no hay consenso) cada 3-6 meses por 2 años. 121 CANCER DE ENDOMETRIO I) DIAGNÓSTICO Y ESTADIFICACIÓN La forma de presentación habitual es la metrorragia de la post-menopausia e implica realizar un legrado fraccionado y sistematizado completo o una histeroscopia. En ambos métodos lo fundamental es la obtención de material para el diagnóstico histopatológico. El mismo método diagnóstico es válido para estudiar metrorragias de la paramenopausia. Si existe sospecha de diseminación extrauterina puede solicitarse una tomografía computada. En la post-menopausia mediante un control con ecografía trans-vaginal la línea endometrial mayor a 6 mm, obliga a realizar al menos una histeroscopia diagnóstica. De no contar con ella debe realizarse un legrado endometrial. Desde el año 1988 la estadificación FIGO es quirúrgica, siendo fundamental determinar la citología peritoneal, la invasión miometrial y los sitios de diseminación loco-regional y ganglionar. Si la paciente no está en condiciones de ser intervenida se debe utilizar la estadificación clínica FIGO de 1971 y plantearse tratamiento radioterápico u hormonal. Para una correcta estadificación, de ser posible, estará presente durante la cirugía un anátomo-patólogo para el estudio intraoperatorio de la pieza quirúrgica. En caso contrario el cirujano procederá a la sección longitudinal del útero observando si existe compromiso cervical y el grado de invasión miometrial. De acuerdo a FIGO se realizará: Incisión mediana infraumbilical (y de ser necesario supraumbilical), toma de ascitis o lavado peritoneal para estudio citológico y completa exploración de toda la pelvis y el abdomen. El procedimiento será la histerectomía total extrafascial, anexectomía bilateral y en casos especiales: linfadenectomía pelviana y lumboaórtica y omentectomía. Otros estudios de estadificación 122 - Radiografía de tórax - Tomografía axial computada o resonancia nuclear magnética de abdomen y pelvis en caso de sospecha de compromiso extrauterino. - Hemograma - Funcional con enzimograma hepático. - Azoemia, creatininemia. Estadios FIGO I II Tumor limitado al cuerpo uterino Ia Tumor limitado a endometrio Ib Tumor invade menos de la mitad del miometrio Ic Tumor invade más de la mitad del miometrio Tumor se extiende a cuello uterino IIa Compromete sólo glándulas endocervicales IIb Invade estroma III Diseminación loco-regional IIIa Tumor compromete serosa y/o anexos y/o citología peritoneal (positiva por ascitis o lavado) IIIb Compromiso vaginal IIIc Metástasis ganglionar pelviana y/o lumboaórtica IV Extensión a otros órganos IVa Tumor invade mucosa vesical y/o rectal IVb Metástasis a distancia incluyendo ganglios intra-abdominales diferentes a los pelvianos y lumboaórticos Tipos histológicos 1- Endometrioide: Adenocarcinoma Adenoacantoma Adenoescamoso 2- Adenocarcinoma mucinoso 3- Adenocarcinoma papilar seroso 4- Adenocarcinoma de células claras 5- Carcinoma indiferenciado Grados de diferenciación 1- G 1 Bien diferenciado 2- G 2 Moderadamente diferenciado 123 3- G 3 Poco diferenciado/indiferenciado Factores de riesgo para recidiva 1- Uterinos: tipo histológico, grado de diferenciación, invasión miometrial y/o linfovascular y la invasión a cuello. 2- Extrauterinos: metástasis en los anexos, citología peritoneal maligna, diseminación peritoneal, ganglios metastáticos. II) TRATAMIENTO Estadio I Cirugía: Toma de ascitis o de lavado peritoneal para citología. Exploración minuciosa de toda la pelvis y abdomen. Histerectomía total extrafascial y anexectomía bilateral. Diagnóstico intraoperatorio de invasión miometrial, de preferencia con patólogo en sala de operaciones. Opciones Si se trata de un tumor G 1 sin invasión miometrial o con invasión de la mitad interna puede no realizarse la linfadenectomía (en este caso el riesgo de metástasis ganglionares es menor al 5 %). Si se trata de un tumor G 2 con invasión menor a la mitad del miometrio, o un tumor G 3 o cualquier tumor con invasión más allá de la mitad del miometrio, se justifica la realización de la linfadenectomía. La evidencia actual justifica la linfadenectomía en función de que si no existe enfermedad extrauterina se podría evitar la adyuvancia con radioterapia. Inclusive la linfadenectomía tendría potencial valor terapéutico al evitar la progresión retroperitoneal de la enfermedad. Tratamiento adyuvante La radioterapia no ha mejorado la sobrevida global, pero si ha logrado una disminución de la recidiva local pelviana. Se acepta que las pacientes en estadio I (limitadas al cuerpo uterino) no deben recibir radioterapia complementaria a excepción de los G 2-3 o cuando existe un compromiso igual o mayor al 50% del miometrio. La radioterapia también es un tratamiento útil en la recidiva pelviana. La indicación del tratamiento radiante es generalmente, postoperatoria aunque puede ser el tratamiento de elección en aquellas pacientes que 124 son inoperables por causas médicas, técnicas, o negativa del paciente. En aquellas pacientes con invasión de más de la mitad del miometrio, o cuando es un adenocarcinoma grado 2-3, o hay invasión linfovascular, se plantea tratamiento adyuvante con radioterapia externa y sobreimpresión a nivel de cúpula vaginal. Radioterapia externa Para la realización de los tratamientos de radioterapia externa se recomiendo el empleo de equipo de megavoltage (igual o mayor de 1.25 Mev), en especial Acelerador Lineal. De contar con energías mayores (de 6 MeV se podrá optar por ellas.) Si se dispone de energías altas por encima de 15Mev se podrá optar por técnica de dos campos antero posteriores. Si se opta por energía de menos de 15 Mev se podrán realizar campos anteroposteriores si el diámetro del paciente lo permite o se realizara la técnica de la caja, o sea 4 campos, uno anterior y otro posterior y dos laterales La técnica a realizar siempre debe ser iso céntrica, salvo que el equipo de tratamiento no lo permita, movilizando el equipo manteniendo fijo el iso centro del paciente. Se debe asegurar la reproducibilidad del tratamiento, asegurando la realización del mismo para dar fiel cumplimiento a lo que surge del sistema de planeamiento. Se recomienda, que las pacientes deben ser localizadas previamente a través de un sistema de simulación virtual tomográfico. En el caso de no contar con un sistema de simulación virtual, se debe realizar a través de un sistema coplanar. 125 Deben realizarse todas las radiografías de verificación necesarias, en general 4 , si no se usara técnica iso céntrica y de 2 radiografías de control si se usa esta técnica. Luego de realizar la localización, realizar el marcado y luego la verificación de cada campo en el equipo de terapia, manteniendo el mismo criterio de la inmovilidad del paciente durante todo el tratamiento y rotando el equipo de acuerdo a lo planificado.. Se entregan 1.8 a 2 Gy día y se completarán entre 45 y 50.4 Gy a nivel de pelvis. No se consideran otras formas de fraccionamiento por considerarlas experimentales. En aquellas pacientes en que el tratamiento radiante es exclusivo, y hay extensión del tumor mas halla de útero, se puede hacer una sobreimpresión sobre la zona pélvica de 10 a 15 Gy al centro del campo previamente diseñado de acuerdo a la planificación y el criterio de tratamiento. Los límites de los campos anterior y posterior son los siguientes: Límite inferior. Si no hay invasión de la vagina (estadio I y II) el límite se coloca a nivel del borde inferior de los agujeros obturadores. En caso de invasión vaginal se colocará 2 cm por debajo del borde inferior del tumor. Recordemos que los tumores que comprometen el cuello uterino se comportarán como aquellos originados en este órgano. Límite superior: Estará a nivel de L4-L5, para cubrir las cadenas hilíacas comunes. 126 Límites laterales: Estarán 2 cm por fuera del estrecho superior de la pelvis, o pasarán por la mitad de la cabeza del fémur. Los límites de los campos laterales: Los limites superior e inferior son los mismos que los de los campos posterior y anterior. Límite anterior: A nivel del borde posterior de la sínfisis pubiana. Límite posterior: Pasará por la unión de S2 –S3. Braquiterapia Se puede emplear braquiterapia de baja tasa de dosis con Cesio 137 que es el gold estándar en el mundo o de alta tasa de dosis. La braquiterapia de media tasa de dosis se considera como tratamiento no estándar y/o experimental. Nuestro protocolo se referirá únicamente a la técnica con baja tasa de dosis pues es la de utilización en el INCA y en el Hospital Universitario. Si se introdujera la alta tasa de Dosis se adoptarían las técnicas y protocolos recomendados por la Asociación de Físicos Norteamericana, ASTRO, y ESTRO. El implante se realiza, en general, en el block quirúrgico, y se utiliza anestesia local o general dependiendo de la colaboración de la paciente. Para la colocación exclusiva de colpóstatos o cilindros vaginales, puede realizarse sin anestesia en casos seleccionados. Se coloca un par de colpostatos vaginales del diámetro adecuado a cada paciente. Habitualmente se incluye la mitad superior de la vagina salvo en aquellos casos de compromiso vaginal donde se irradia hasta el introito. La dosis a entregar a la mucosa vaginal seguirá las recomendaciones de la ABS y de la FIGO En los casos en que el tratamiento es un tratamiento radiante exclusivo, y 127 la paciente no fue histerectomizada, se hará braquiterapia intracavitaria útero vaginal. En esta situación se debe colocar tandems intrauterinos y se debe entregar una dosis que sigue las recomendaciones las mismas recomendaciones.. Las guías para la realización de la técnica de braquiterapia útero-vaginal se desarrolla con mas detalle en el capitulo de cáncer de cuello uterino. Estadio II Debe valorarse correctamente el riesgo quirurgico por patologías asociadas y/o edad Segun dicha valoración se puede plantear tratar como un tumor de cuello uterino, realizándose operación de Wertheim-Meigs: histerectomía radical (Piver 2 o 3), colpectomía de tercio superior, parametrectomía y linfadenectomía. En esta etapa siempre se recomienda tratamiento radiante postoperatorio con radioterapia externa y braquiterapia. Puede plantearse tratamiento radiante preoperatorio, (braquiterapia y radioterapia externa) seguida de la histerectomía Estadio III Tratamiento convencional del cáncer de endometrio (muestra de ascitis o de lavado peritoneal, histerectomía total extrafascial y anexectomía bilateral) sumando el concepto de cito-reducción: agregar omentectomía, biopsia peritoneal y linfadenectomía. Estas pacientes son tratadas con radioterapia exclusiva, (radioterapia externa y braquiterapia). En tumores extensos y según el terreno podrá plantearse quimioterapia. Estadio IV Puede plantearse la cirugía paliativa o iniciar de entrada radioterapia y/o quimioterapia. La elección del tratamiento sistémico dependerá del performance-status y la extensión lesional. El tratamiento es con criterio paliativo, el cual dependerá de la diseminación. El empleo de radioterapia, cirugía, quimioterapia y hormonoterapia dependen del tipo de diseminación y del trabajo conjunto en la modalidad de comité de tumores del equipo médico tratante. Las drogas citostáticas son la adriamicina, el cisplatino, el carboplatino y los 128 taxanos entre otras y sus tasas de respuestas como monodrogas se encuentran de en el entorno del 26 al 36%. Los esquemas poliquimioterapia más usados son: adriamicina 60 mg/m2 + cisplatino 50-60 mg/m2 cada 21 días o carboplatino AUC 5-7 + paclitaxel 175 mg/m2 cada 21 días; en ambos casos con respuestas que oscilan entre 40 y 60 %. En las pacientes de edad avanzada o en aquellas que han recibido quimioterapia se puede considerar el tratamiento hormonal con progesterona (60-320 mg/dia). Carcinoma seroso papilar y células claras Tratar como Cáncer de ovario: Operación de Taylor agregando linfadenectomía y biopsias peritoneales. Seguimiento El valor del seguimiento es detectar precozmente las recidivas pelvianas, sobre todo aquellas que ocurren en pacientes no tratadas con radioterapia adyuvante. Los controles serán cada 3-6 meses por 2 años y luego cada 6-12 meses y consistirán en examen clínico, colpocitología oncológica y colposcopía. Rx de tórax y tomografía computarizada de abdomen y pelvis anual. Recidivas a. Sin radioterapia previa i. Vaginal: braquiterapia ii. Pelviana: radioterapia pelviana y braquiterapia b. Con braquiterapia previa i. Vaginal o pelviana: considerar cirugía de resección y/o radioterapia pelviana c. Con radioterapia pelviana previa, en abdomen superior y/o metástasis a distancia: considerar radioterapia, quimioterapia u hormonoterapia como tratamiento paliativo. 129 CANCER DE CUELLO DE UTERO I) DIAGNÓSTICO Y ESTADIFICACIÓN Diagnóstico - Examen clínico y ginecológico. - Citología cervical. - Colposcopía: PAP anormal sin clínica. - Biopsia: a. en área anormal de la colposcopía; b. en la lesión; c. en la periferia de la lesión; d. en los 4 cuadrantes del cuello. - Legrado de endocérvix y de endometrio (cuando corresponda) - Conización quirúrgica: a. cuando no se vea la lesión y se plantea lesión de endocervix; b. cuando no se ve toda la lesión en la colposcopía; c. cuando se diagnosticó carcinoma microinvasor en la biopsia: para valorar profundidad de la lesión. d. cuando hay discrepancia entre el aspecto citológico e histológico de la lesión; e. colposcopía inadecuada. - Rutinas hematológicas: Hemograma, azoemia, funcional enzimograma y creatininemia, hepático, ionograma. - Estudios radiológicos: Rx. de tórax; TAC de abdomen y pelvis (eventual, hecho con contraste sustituye a la UIV). - Otros (eventuales): Ecografía y/o RMN de abdomen y pelvis - Endoscopía: cistoscopía, rectoscopía para descartar invasión vesical y rectal; según Estadio clínico (eventuales). 130 Estadificación Mantiene vigencia la estadificación de la FIGO 0 Cáncer preinvasivo. (carcinoma in situ) I Limitado al cuello (no se toma en cuenta la invasión al cuerpo) Ia Preclínico, diagnosticado por microscopía Ia1* Invasión hasta 3 mm Ia2* Invasión en profundidad de 3 a 5 mm y la extensión horizontal hasta 7 mm Ib Lesiones invasivas mayores de 5mm. Ib1 Menores de 4cm Ib2 Mayores de 4cm II Extendido más allá del cuello sin llegar a la pared pélvica, infiltra vagina sin llegar al tercio inferior. IIa Sin infltración visible de los parametrios IIb Con infiltración visible de los parametrios III Llega a la pared pélvica, y/o infiltra el tercio inferior de la vagina IIIa No infiltra la pared de la pelvis IIIb Infiltra la pared de la pelvis y/o hidronefrosis o insuficiencia renal. IV Extendido más allá de la pelvis verdadera o que infiltra mucosa vesical y /o Rectal IVa Extensión a los órganos adyacentes IVb A los órganos distantes * En los estadios Ia1 y Ia2 se debe registrar la infiltración del espacio vascular venoso o linfático 131 Clasificacioón T N M FIGO T: TUMOR PRIMARIO TNM FIGO TX Tumor primario no puede ser evaluado. To Sin evidencia de tumor primario. Tis 0 Carcinoma in situ.(Carcinoma preinvasor) T14 I Cancer cervical limitado al útero (extensión al cuerpo debe ser despreciada) Cancer invasor preclínico, diagnosticado sólo por miscroscopía. Todas T1a Ia las lesiones visibles macroscópicamente, aún con in-vasión superficial, son T1b/estadio Ib. T1a1 Ia1 T1a2 Ia2 T1b Invasión del estroma no mayor a 3.0 mm., en profundidad y 7.0 mm. o menos en di-seminación horizontal. Invasión estromal mayor a 3.0 mm y no más de 5.0 mm con una diseminación ho-rizontal de 7.0 mm o menos. Lesión clínicamente visible confinada al cuello o lesión microscópica más Ib grande que T1a2/IA2. T1b1 Ib1 Lesión clínicamente visible de 4.0 cm o menos en su dimensión mayor. T1b2 Ib2 Lesión clínicamente visible mayor a 4 cm. en su dimensión mayor. T2 Tumor invade más allá del útero, pero no a la pared pélvica ni al 1/3 II inferior de la vagina. T2a IIa Sin invasión parametrial T2b IIb Con invasión parametrial. T3 III Tumor se extiende a pared pélvica y/o invade el 1/3 inferior de vagina y/o causa hidronefrosis ó riñón no funcionante. T3a T3b IIIa Tumor invade el 1/3 inferior de la vagina, sin extensión a pared pélvica. IIIb Tumor se extiende a pared pélvica y/o causa hidronefrosis ó riñón no funcionante T45 Tumor invade la mucosa de la vejiga o del recto y/o se extiende más allá de la pelvis menor. M1 IVB Metástasis a distancia N GANGLIOS LINFATICOS REGIONALES Son ganglios linfáticos regionales: los paracervicales; parametrio; hipogástrico, ilíacos internos (obturador); ilíacos común y externo; presacro 4 La profundidad de la invasión no debe ser mayor a 5 mm tomados de la base del epitelio, ya fuera el superficial o glandular, del cual se origina. La profundidad de la invasión es definida como la medida del tumor desde la unión estroma-epitelio de la papila epitelial adyacente más superficial al punto más profundo de la invasión. La invasión del espacio vascular, venoso o linfático, no afecta la clasificación. 5 El edema bulloso no es suficiente evidencia para clasificar al tumor como T4 132 y sacros laterales. Nx: ganglios linfáticos regionales no pueden ser evaluados. No: sin metástasis en ganglios linfáticos regionales. N1: metástasis en ganglios linfáticos regionales. M METASTASIS A DISTANCIA Mx: metástasis a distancia no pueden ser evaluadas. Mo: sin metástasis a distancia. M1: metástasis a distancia. pTNM CLASIFICACION PATOLOGICA Las categorías pT, pN y pM se correspondan a las categorías T, N y M. pNo: El examen histológico del espécimen de la linfadenectomía pélvica debe incluir 10 ó más ganglios linfáticos. Grado histopatologico Gx: grado de diferenciación no puede ser evaluado. G1: bien diferenciado. G2: moderadamente diferenciado. G3: pobremente diferenciado. Agrupamiento EO 0 Tis No Mo EI A T 1a No Mo A1 T1a1 No Mo A2 T1a2 No Mo B T1b No Mo B1 T1b1 No Mo B2 T1b2 No Mo E II A T2a No Mo E II B T2b No Mo E III A T3a No Mo E III B T1 N1 Mo T2 N1 Mo T3a N1 Mo T3b Cualquier N Mo EI E IV A T4 Cualquier N Mo E IV B Cualquier T Cualquier N M1 133 Factores pronósticos desfavorables Estadío Tumor primario grande Ganglios linfáticos positivos (pélvicos y para aórticos) Adenocarcinomas Para los E I B y IIa: (además de la comprobación de ganglios metastasiados.) - Tumores mayores a 4 cm. de diámetro. - Cancer pobremente diferenciado - Invasión de los espacios linfáticos y vasculares. - Tumor con infiltración profunda. II) TRATAMIENTO Debe ser realizado por un equipo multidiciplinario especializado en el tratamiento de esta patología. En el planteo terapéutico se tendrá en cuenta el estadio clínico, patologías asociadas que contraindiquen tratamientos, disponibilidades terapéuticas (discutible). 1) Carcinoma in situ – CIN 3 (displasia severa – ca. in situ) - Conización del cervix para diagnóstico. Puede ser: quirúrgica LEEP si la lesión se ve en su totalidad, si no se introduce en canal o no hay sospecha de invasión. Debe ser suficiente en extensión (bordes negativos y por lesión) - Como tratamiento complementario la histerectomía se efectúa eventualmente en mujeres mayores, si no se desean más hijos. También en los casos en que exista otra afección ginecológica concomitante que requiera la extirpación del útero - Si la paciente no puede ser intervenida: radioterapia intracavitaria 2) Estadío IA 134 En el Estadio IA se recomienda en primer lugar la cirugía. La RT es la segunda opción. El tratamiento inicial es la conización quirúrgica para evaluación de la invasión estromal E IA1 a) en mujeres sanas que no desean nuevos embarazos: Histerectomía abdominal o por vía vaginal con manguito vaginal. Wertheim simple Indicaciones variables según el caso. b) en mujeres que no tengan hijos Conización y seguimiento estricto, si los bordes del cono están libres de tumor con el consentimiento de la paciente. En aquellos casos en los que hay invasión de los espacios vasculares, deben ser tratados como un estadio IA2 E IA2 - Histerectomía radical abdominal con extirpación de sector superior de vagina, parametrios y ganglios pelvianos, con o sin extirpación de ovarios según edad y estado hormonal de la paciente. - Histerectomía radical por vía vaginal con histerectomía radical con linfadenectomía laparoscópica. 3) Estadío Ib - IIa a) Cirugía exclusiva: extirpación o conservación de los ovarios, extirpación de sector superior de vagina, parametrios y ganglios pelvianos, b) Radioterapia exclusiva. La radioterapia externa es fundamental para el tratamiento de las pacientes con cáncer de cuello uterino estadío IB2 a IIIB.También es fundamental en aquellas pacientes con una enfermedad más precoz, pero que no pueden ser tratadas con cirugía; aunque en estas pacientes lo más importante es el tratamiento de braquiterapia. (Las características de la radioterapia se exponen en el tratamiento del cáncer de cuello uterino estadio IIB y III) c) IB2 bulky: se recomienda RT y Cisplatino (CDDP) semanal. En casos seleccionados puede plantearse la cirugía radical 135 Tanto en el estadio Ib como en el IIA tratados quirurgicamente, en caso de presentar cualquiera de los factores de riesgo siguientes: márgenes positivos, ganglios positivos, parametrios positivos, tumor mayor a 4 cm, invasión miocervical, invasión linfovascular, se agregará tratamiento adyuvante con RT y QT con Cisplatino semanal a dosis habituales. 4) Estadio IIB, III (A y B) y IV A: Cinco estudios prospectivos demostraron, desde el año 1998, que el tratamiento quimio-radioterápico combinando Cisplatino concurrente con RT, obtendría una mejoría estadísticamente significativa en el resultado terapéutico de esos pacientes en relación a los alcanzados con RT sola, con un beneficio absoluto en la sobrevida del 12 %. De acuerdo a dichos estudios actualmente se recomienda RT asociada a QT concurrente con CDDP a la dosis de Cisplatino 40 mg/m2 i/v (sin pasar de 70 mg) por semana por un total de 6 semanas seguidas. Las 6 semanas de CDDP coinciden con las 6 semanas iniciales de la radioterapia. Se hará hemograma y creatininemia previo y luego en forma semanal durante el tratamiento. Estadio IIB Se recomienda la utilización de Radioterapia asociada al uso de Cisplatino, cuando las condiciones del paciente lo permiten. Habitualmente se emplea la radioterapia externa primero y luego la braquiterapia, para que el primer tratamiento, a través de la reducción tumoral, permita una mejor geometría para la braquiterapia. Una excepción a dicha secuencia es aquella paciente que se encuentra sangrando donde la braquiterapia se puede emplear con criterio hemostático. Se debe elegir equipos de megavoltaje, 1.25 Mev o mayor, siendo preferible rayos x de 6 Mev. De contar con energías mayores de 6 MeV se podrá optar por ellas. Si se dispone de energías altas por encima de 15Mev se podrá optar por 136 técnica de dos campos antero-posteriores. Si se opta por energía de menos de 15 Mev se podrán realizar campos anteroposteriores si el diámetro del paciente lo permite o se realizara la técnica de la caja, o sea 4 campos, uno anterior y otro posterior y dos laterales. Puede optarse por realizar el tratamiento por campos anteroposteriores con energías en el orden del megavoltaje, menores de 15 Mev en situaciones determinadas que el médico justifique. La técnica a realizar siempre debe ser iso céntrica, salvo que el equipo de tratamiento no lo permita, movilizando el equipo manteniendo fijo el iso centro del paciente. Se debe asegurar la reproducibilidad del tratamiento, asegurando la realización del mismo para dar fiel cumplimiento a lo que surge del sistema de planeamiento. Se recomienda que las pacientes deban ser localizadas previamente a través de un sistema de simulación virtual tomográfico. En el caso de no contar con un sistema de simulación virtual, se debe realizar a través de un sistema coplanar. Deben realizarse todas las radiografías de verificación necesarias, en general 4, si no se usara técnica iso céntrica y de 2 radiografias de control si se usa esta técnica. Luego de realizar la localización, realizar el marcado y luego la verificación de cada campo en el equipo de terapia, manteniendo el mismo criterio de la inmovilidad del paciente durante todo el tratamiento y rotando el equipo de acuerdo a lo planificado.. Se entregan 1.8 a 2 Gy día y se completarán entre 45 y 50.4 Gy a nivel de pelvis. No se consideran otras formas de fraccionamiento por considerarlas experimentales. Siempre proceder a la simulación, verificación radiológica para cada campo de tratamiento dependiendo de la disponibilidades técnicas 137 que de el equipo de tratamiento que se disponga optimizando sus características al máximo. Habitualmente se emplea la técnica de la caja para el tratamiento de estas pacientes, 4 campos dos laterales derecho e izquierdo y uno anterior y otro posterior. La paciente se irradia en decúbito dorsal y todos los campos se realizan diariamente. Se deberá emplear la técnica de isocentro obligatoriamente siempre que el equipamiento lo permita. Los pacientes posicionamiento deben e tener la inmovilidad máxima para la garantía de su realizacion de los tratamientos. Límites de los campos: Los límites de los campos de tratamientos que se recomiendan son los siguientes, siempre se deben de adaptar a la situación en particular de cada paciente. Campos anterior y posterior (Figura 1): Límite inferior: Cuando no hay compromiso de la vagina, el mismo se encuentra a nivel del borde inferior de los agujeros obturadores; cuando hay invasión de la vagina, este debe colocarse 2 cm por debajo del Figura 1. Campos anterior y posterior borde inferior, y cuando la lesión llega a la mitad inferior de la vagina debe llegar al introito vaginal. Límite superior: Se coloca a nivel de L4-L5, cuando la lesión es IB2 o mayor, para las lesiones IA2 y IB1 el límite esta en L5-S1. Límites laterales: estarán 1,5-2 cm por fuera del estrecho superior de la pelvis Figura 2. Campos laterales Campos laterales: (Figura 2) Limite superior e inferior: son similares a los de los campos anterior y posterior. Límite anterior: Se coloca a nivel del borde anterior de la sínfisis pubiana. Límite posterior: Cuando no hay compromiso parametrial se coloca a nivel de la unión de S2 y S3. Cuando hay 138 compromiso de los paramétrios, existe una gran frecuencia de compromiso de los ligamentos útero sacros por lo que el borde posterior se coloca en el borde anterior del sacro. La dosis diaria es entre 1,8 y 2 Gy cuando no se emplea quimioterapia concomitante y de 1,6 a 1,8 Gy cuando se emplea cisplatino. La dosis total es de no menos de 45 Gy hasta 50.4 Gy. en 22 a 28 aplicaciones. En las pacientes con una enfermedad con compromiso parametrial (estadio IIB-IIIB) se realiza tratamiento de sobreimpresión en los mismos para llegar a una dosis de 60 Gy a ese nivel. Campos parametriales: en aquellas pacientes con una enfermedad que compromete los paramétrios, Figura 3. Campos parametriales debe hacerse una sobreimpresión en los mismos, con campos anteriores y posteriores como se ven en la figura 3. BRAQUITERAPIA La braquiterapia es fundamental para el tratamiento de cáncer de cuello uterino, incluso para aquellas pacientes con una enfermedad avanzada, donde el empleo de la misma aumenta la probabilidad de control de la enfermedad. Se incluyen las mismas consideraciones generales y técnicas que en el tratamiento de las lesiones malignas de endometrio Se emplea braquiterapia de baja tasa de dosis, que continua siendo el estandar de oro contra la cual se camparan otras formas de tratamiento, se podría utilizar la alta tasa de dosis ya consolidada como tratamiento estándar en otros países, de aplicarse se deben seguir todas las indicaciones y fraccionamientos determinados en el ICRU 38. La Braquiterapia de media tasa de dosis se considera como tratamiento no estándar o experimental. El procedimiento de Braquiterapia utero-vaginal se debe realizar siempre con anestesia general y en bloc quirúrgico cuando se haga implante intrauterino de baja tasa. 139 Técnica Esta técnica debe ser siempre realizada por un médico radioterapeuta. 1. La paciente con sonda vesical y en posición ginecológica. 2. Examen clínico bajo anestesia, fundamental para analizar el compromiso parametrial y la respuesta al tratamiento de radioterapia externa realizado con anterioridad. 3. Desinfección del campo con desinfectante adecuado 4. Histerometría 5. Dilatación del cuello con bujía de tipo Hegar.. 6. Colocación de tandem intrauterino. La elección del mismo debe ser adecuada a la antevesoflección del útero, pero se recomienda la elección de aquel tandem, que se mantenga mas cerca del eje de la pelvis, equidistante del promontorio, del pubis y de ambas paredes laterales de la pelvis 7. Colocación de dos colpostatos en cada fondo lateral de la vagina. 8. En aquellas pacientes con una vagina estrecha, o en aquellas que tienen una infiltración de la vagina, se puede colocar un cilindro vaginal debajo del tandem en lugar de los colpostatos 9. Los colpóstatos deben quedar posicionados de tal manera de permitir el mechado o “paking”, con mecha embebida en jalea urológica o xilocaina viscosa, o con material contrastado 10. Luego de colocado el sistema porta fuentes es obligatorio que se hagan las placas localizadoras de frente y perfil 11. No deben de cargarse con las fuentes radiactivas hasta no completar todos los pasos de verificación y de planificación terapéutica 12. Estas radiografías es recomendable se hagan con contraste en el recto y en el balón de la sonda Foley , ya que serán enviadas al sistema de planificación 13. El tratamiento deberá ser autorizado por el medico radioterapeuta antes de su ejecución. 14. La colocación del sistema, debe siempre ser realizado bajo la supervisión directa y/o por el medico especialista. 15. La especificación de la dosis se hace de acuerdo al protocolo de lCRU 38. 16. Deben de seguirse las recomendaciones de la ABS y FIGO. 17. La dosis al punto A debe ser definida de acuerdo de los estándar aceptados por el ICRU 38 y las recomendaciones de la ABS y FIGO 18. Pueden contemplarse los valores de Dosis Biológicamente Efectiva. Estadio III (A y B) Radioterapia (con similares consideraciones que en el estadío IIB) combinada con Cisplatino. 140 Estadio IV IV A a) Radioterapia que se adaptará a la situación del paciente, siguiendo los lineamientos de lo indicado en el tratamiento del estadío IIB, combinada con Cisplatino b) Exenteración pelviana, puede ser analizada para casos muy bien seleccionados IV B Poliquimioterapia como tratamiento de enfermedad avanzada. RT paliativa en masas residuales ó sobre áreas sintomáticas o que causen alteraciones mecánicas. RT de los pacientes con ganglios linfáticos metastásicos luego de histerectomía radical Su utilización es controversial.En USA un panel especialmente comisionado para delinear el tema (Morrow) no encontró un claro beneficio con el agregado de la RT. MSKCC: encontraron beneficio con RT postoperatoria + QT. Kinney et al: la sobrevida fue mayor en grupo con Cirugía que en el grupo con RT. Las recidivas fueron mayores en el grupo Cirugía que en el RT. Las pacientes con márgenes positivos o tumor presente cerca del borde de resección requieren RT postoperatoria para alcanzar el control local. Tienen mayor riesgo de metástasis ganglionares y de recurrencia pélvica luego de histerectomía radical aquéllas que presentan una afectación cervical extensa (>10 mm. de invasión; 70% de penetración; > 4 cm de diámetro cervical). Los ganglios metastasiados, la invasión de los espacios linfovasculares y el tipo histológico adenocarcinoma (en particular si es de Grado 3) están asociados con una alta tasa de recurrencia pélvica. La recidivas siguen siendo un problema aún con RT postoperatoria, probablemente porque la dosis de RT que puede suministrarse sin inconvenientes a la pelvis luego de la histerectomía radical es frecuentemente insuficiente para controlar la enfermedad en un campo distorsionado por la cirugía efectuada. 141 Esto constituye un argumento para plantear la indicación de RT radical como tratamiento primario. Ganglios linfáticos para-aórticos metastásicos - Son indicadores de frecuente diseminación a distancia. - Se los comprueba clínicamente en < 20% de los pacientes con recidivas. - Habitualmente se los detecta cuando se hace una laparatomía exploradora con biopsia de los ganglios. - Sobrevida actuarial a 4-5 años es muy baja. - En tales situaciones puede utilizarse RT a dosis entre 45 y 60 Gy que dependerá del protocolo de irradiación del Servicio de Radioterapia. - Otros autores recomiendan la asociación RT + QT. Quimioterapia En el cáncer de cuello de utero avanzado o en recaída, el citostático más efectivo es el cisplatino. Pacientes tratadas previamente con RT y cisplatino, logran menores respuestas objetivas en el momento de la progresión lesional Esquemas de QT: Cisplatino: 50-100 mg/m2 i/v cada 21 días. Cisplatino: 75-100 mg/m2 i/v cada 21-28 días Paclitaxel: 175 mg/m2 Carboplatino: AUC 5-6 i/v cada 28 días. Paclitaxel: 175 mg/m2 Cisplatino: 80 mg/m2 i/v cada 21-28 días. Vinorelbina: 25 mg/m2 i/v días 1 y 8 Otros esquemas podrán plantearse dependiendo del performance status de la paciente y el tratamiento recibido previamente. Quimioterapia concurrente a la RT Cisplatino 40 mg/m2 i/v por semana durante 5-6 semanas, coincidiendo con la RT. 142 QT neoadyuvante a la RT No se recomienda, dado que la mayoría de los estudios no mostraron beneficio en la sobrevida. QT neoadyuvante a la cirugía Los metaanálisis mostraron un beneficio absoluto en la sobrevida del 14 % a 5 años, por lo cual podría ser una estrategia válida, fundamentalmente cuando se retarda el inicio de la RT. En estadios IB, II y enfermedad voluminosa, los resultados son promisorios. Se espera que los estudios fase III en curso permitan definir su utilidad. QT adyuvante No hay resultados que actualmente demuestren un beneficio terapéutico. Seguimiento - Control clínico con examen recto-vaginal y citología vaginal cada 3-4 meses los primeros 2 años. Cada 6 meses del 3º al 5º año y luego anual. - Radiografía de torax anual. - Hemograma, función hepática y renal cada 6 meses por 5 años. En estadíos avanzados tomografía o resonancia de abdomen y pelvis anual. 143 CANCER DE OVARIO I) DIAGNÓSTICO Y ESTADIFICACIÓN Anamnesis y exámen físico. Tacto Genital. Tacto Rectal. Ecografía abdominal y Transvaginal. TAC de Abdomen - Pelvis. (según caso clínico, fundamentalmente en aquellos en los cuales existe una fuerte sospecha de irresecabilidad). Laparoscopía: sólo para aquellos casos de duda diagnóstica. No es un método aceptado de estadificación. Permite biopsia en casos inoperables de inicio. Laparotomía: Biopsia, estadificación, citorreducción. Radiografía de Tórax (frente y perfil). Funcional y enzimograma hepático. CA 125. Hemograma. Creatininemia y azoemia. Estadificación La Federación Internacional de Ginecología y Obstetricia (FIGO) y el Comité Americano Conjunto en Cáncer (AJCC) ha adoptado el siguiente sistema de clasificación: Estadio I: tumor limitado al ovario (15 %). Ia: un solo ovario comprometido Ib: los dos ovarios comprometidos Ic: Ia o Ib pero con tumor en superficie, cápsula rota o citología peritoneal +. 144 Aunque comprende solo el 15 % del total, los tumores en EI comprenden el 50 % a 75 % de los casos que se curan. Estadio II: extensión pélvica (15%) IIa: extensión( o metástasis) a útero o trompa. IIb: extensión a resto de la pelvis. IIc: como IIa o IIb con tumor en la superficie, cápsula rota o citología peritoneal +. Estadío III: metástasis peritoneales (65 %) IIIa: metástasis peritoneales microscópicas. IIIb: metástasis macroscópicas <2 cm; ganglios negativos. IIIc: metástasis peritoneales macroscópicas >2 cm o ganglios positivos. Estadío IV: metástasis a distancia ( 5 % a 15 %) (Metástais en cápsula hepática es estadío III). El estadio de presentación es el principal factor pronóstico independiente, útil para determinar las tasas de curación y pronóstico a largo plazo. III) TRATAMIENTO La cirugía cumple un papel como procedimiento diagnóstico, estadificador y citorreductor. En estadios precoces puede ser curativa como único tratamiento. La estadificación del cáncer de ovario es quirúrgica. Sin cirugía hasta un 30% (E I) y 40 % (E II) corresponden a estadíos más avanzados. Esto tiene impacto en el pronóstico, pues la sobrevida a 5 años del del estadío I clínico es del 60 % y del 90-100 % con estadidificación quirúrgica. El volumen tumoral residual luego de la cirugía es un factor pronóstico independiente (masa < de 0,5 cm diámetro vs >0,5cm), aunque lo más aceptado es enfermedad residual < 1 cm (cirugía óptima) y cirugía subóptima (enfermedad residual > 1 cm). 145 Cuando el paciente es operable el procedimiento inicial es la cirugía con un equipo quirúrgico entrenado. La estadificación quirúrgica se hace por laparotomía. Conceptualmente es la histerectomía total, salpingooforectomía bilateral, omentectomía, apendicectomía y biopsias múltiples normatizadas (BMN) Incluye: -incisión mediana supra e infraumbilical. -toma de muestra de ascitis o cualquier otro exudado. -si no hay exudados: lavado y estudio citológico del líquido - biopsias peritoneo *goteras parietocólicas *FDS Douglas *base hemidiafragma derecho -biopsias de cualquier zona sospechosa -biopsias de ganglios pélvicos y para aórticos. -histerectomía total -salpingooforectomía bilateral. Cuidar de no romper el tumor (puede afectar el pronóstico al producirse la siembra peritoneal). Puede hacerse biopsia extemporánea si no hubo diagnóstico histológico anterior. -omentectomía (hasta el nacimiento en la curvatura mayor). -apendicectomía. La estadificación laparoscópica no es equivalente. Cuando el tumor está evadido del ovario la operación tiene fin citorreductor (CR) buscando mejorar la respuesta a la quimioterapia. Estadio I: - En estadios IA y IB sin factores de riesgo y con la estadificación quirúrgica adecuada la cirugía puede ser suficiente como tratamiento. Los factores de valor pronóstico que definen la enfermedad con bajo riesgo de recaída son: grado histológico I o II. histología no células claras. ausencia de invasión capsular. citología de lavado peritoneal negativo. 146 ausencia de ascitis. estadificación correcta. En pacientes jóvenes que desean conservar fertilidad, puede realizarse una cirugía conservadora que solo incluya anexectomía unilateral, siempre que se trate de una estadificación quirúrgica completa, tumor borderline o invasor estadio IA . La paciente debe aceptar controlarse estrechamente. - Si el tumor es de histología a células claras, grado histológico III, densamente adherente o estadio IC, las chances de recaída y consiguiente muerte por cáncer oscila entre un 25 y 30% y requieren tratamiento complementario a la cirugía. En la enfermedad con alto riesgo de recaída estadios IC o IA-IB con factores pronósticos desfavorables (es suficiente con la presencia de un solo factor o estadificación quirúrgica incompleta) dos grandes estudios randomizados (ICON 1 y ACTION) y un metanálisis que los incluye demuestran que la quimioterapia adyuvante mejora tanto la sobrevida libre de enfermedad como la sobrevida global (beneficio absoluto en sobrevida global a 5 años del 8% y del 11% en sobrevida libre de enfermedad a 5 años) Las distintas opciones propuestas son: En estadio IA o IB con factores de riesgo favorables y estadificación quirúrgica completa: observación cuidadosa sin tratamiento inmediato. En estadio IC o IA-IB con factores pronósticos adversos o estadificación quirúrgica insuficiente: quimioterapia adyuvante basada en una sal de platino +/- un taxano por 3 o 4 series: *Carboplatino monodroga x 6 ciclos *Carboplatino-Paclitaxel x 3 ciclos Estadio II: - Cirugía completa como para el estadio I. -Tratamiento adyuvante con quimioterapia idéntico a los planteados para los estadios I con alto riesgo de recaída. Enfermedad avanzada (estadios III-IV): 147 La sobrevida a 5 años de las pacientes con estadío III y IV es 35 y 5% respectivamente. El tratamiento estándar es una cirugía que incluya histerectomía total + salpingooforectomía bilateral + apendicectomía + omentectomía seguida de quimioterapa. Se debe intentar resecar todas las lesiones macroscópicas que sea posible. Las resecciones viscerales pueden estar indicadas cuando ello signifique una citorreducción completa u óptima. El mejor resultado puede observarse en las pacientes con enfermedad residual mínima. La extensión lesional, la localización de las metástasis y el terreno pueden condicionar esta secuencia, la cirugía o ambas herramientas terapéuticas, por lo que en algunas circunstancias el gesto inicial es la quimioterapia seguida o no de cirugía de intervalo. La revisión de la literatura muestra que las pacientes tratadas con cirugía óptima comparadas con las que presentan enfermedad subóptima, la mediana de sobrevida es de 39 contra 17 meses, respectivamente. En una revisión retrospectiva, aquellas pacientes con enfermedad residual > 2 cm presentaron una peor evolución que las que tenán < 2 cm. Actualmente el concepto de enfermedad residual mínima o cirugía óptima ha cambiado, considerándose como tal aquella cuya enfermedad residual es menor de 1 cm. Quimioterapia. Desde los años 80 varios agentes han mostrado su utilidad en cáncer de ovario, siendo uno de los más efectivos el cisplatino, con respuestas objetivas del 40 %. Otras drogas útiles han sido la ciclofosfamida, la adriamicina y más recientemente el paclitaxel y la gemcitabine. En tanto la combinación de agentes ha demostrado ser más eficaz que la monoquimioterapia se han ensayado secuencialmente diferentes esquemas de quimioterapia. En la enfermedad avanzada, los regímenes sin cisplatino obtienen 40 % de respuestas objetivas con sobrevida media de 15 meses y los planes con cisplatino respuestas objetivas del 70 a 80 % con 20 a 50 % de respuestas completas, con una sobrevida a 5 años de 10 a 20 %. El clásico esquema PAC (cisplatino-adriamicina-ciclofosfamida) comparado a cisplatino-ciclofosfamida solo mostró mayor toxicidad, pero sin aumento en las tasas de sobreviva por lo que el esquema más usado hasta mediados de los noventa ha sido el cisplatino a la dosis de 75 mg/m2 junto a ciclofosfamida a la dosis de 1000 mg/m2 o cisplatino 100 mg/m2 junto a ciclofosfamida a la dosis de 600 mg/m2 cada 21-28 días de acuerdo a la tolerancia hematológica 148 y una correcta función renal. Cuando se demostró que con carboplatino se obtenían resultados similares, este sustituyó al cisplatino, aunque con mayor mielotoxicidad, pero sin la nefrotoxicidad y neurotoxicidd de éste. En estudios randomizados tanto para estadio III como IV, la combinación de paclitaxel/cisplatino o carboplatino comparado a cisplatino/ciclofosfamida demostró ser superior en términos de sobrevida libre de enfermedad y global por lo que se constituyó en el esquema de primera línea desde la segunda mitad de los años 90. De manera que actualmente el estándar para cáncer de ovario estadio III-IV, es la combinación de paclitaxel 175 mg/m2 i/v en tres horas junto a carboplatino (AUC 5-7). Un estudio reciente no encontró diferencia en la sobrevida entre el esquema carboplatino/paclitaxel y carboplatino monodroga. Dado que este último grupo de pacientes recibió paclitaxel en la recaída, no es posible afirmar una efectividad equivalente. No obstante lo cual, el carbolplatino monodroga puede ser considerado como una alternativa válida en pacientes condicionados por su terreno. De acuerdo a las consideraciones previas, las opciones de quimioterapia postcirugía son: 1. Paclitaxel/Carboplatino. 2. Paclitaxel/Cisplatino 3. Carboplatino. El aumento del número de ciclos por encima de seis es más tóxico y no ha demostrado ningún beneficio adicional Estudios randomizados mostraron una ventaja en la mediana de sobrevida de ocho meses en los pacientes con resección óptima tratados con cisplatino intraperitoneal contra cisplatino intravenoso en combinación con ciclofosfamida. Un estudio reciente, tambien mostró beneficios para los pacientes que recibieron docetaxel intraperitoneal, pero asociado a una significativa mayor toxicidad. No obstante estos resultados, actualmente este método de tratamiento es poco empleado, ya que no está claro cual es el rol de la quimioterapia intraperitoneal en este grupo de pacientes. 149 Cuando en la cirugia inicial no pudo realizarse, la citorreducción secundaria está condicionada a la respuesta a la quimioterapia. En esos casos se realizará el procedimiento estandarizado para los estadios I y II. *Histología Borderline: Estadios I Y II: CIRUGIA. Estadios III Y IV: no hay estudios randomizados que demuestren el beneficio de la quimioterapia adyuvante en la sobrevida. Sin embargo, puede considerarse esta opción de tratamiento sistémico con los mismos esquemas que para la enfermedad invasiva en caso de estadio avanzado o presencia de enfermedad residual. CANCER DE OVARIO RECURRENTE El cáncer de ovario recurrente tiene mal pronóstico. Estos pacientes frecuentemente fallecen por enfermedad locoregional, siendo las complicaciones más importantes la obstrucción intestinal, así como la insuficiencia renal, caquexia, etc. Para el encare del tratamiento de la recaída del cáncer de ovario es fundamental conocer el intervalo entre la finalización de la quimioterapia inicial con cisplatino o carboplatino y la recidiva. Aquellas pacientes que respondieron a estos citostáticos y recaen a más de seis meses de la finalización de la dicha quimioterapa, pueden volver a responder a los mismos y por lo tanto considerarse nuevamente el uso del mismo esquema. Aquellas pacientes refractarias a las sales de platino (enfermedad estable como mejor respuesta, recidiva o progresión durante la quimioterapia o que recaen tempranamente) deben ser considerados para tratamiento con monoquimioterapia. -Diversos factores deben ser tenidos en cuenta en la selección de un tratamiento de segunda línea: 150 - Respuesta al tratamiento previo y tiempo transcurrido. - Respuesta y efectos secundarios de las drogas de segunda línea disponibles. -Comodidad de administración. -Toxicidad experimentada por la paciente con el o los esquemas previos. -Situación clínica de la paciente. -Co-morbilidad. -Preferencia de la paciente. -Se reconocen tambien algunos factores predictivos de respuesta en la recaída. -Las recaidas que se presentan luego de los 18 meses de haber finalizado el tratamiento con sales de platino presentan tasas de respuestas semejantes al tratamiento inicial. -Histología seroso. -Tamaño tumoral <5cm. -Número de localizaciones tumorales <2. En casos seleccionados de recaídas tardías mayores de un año y enfermedad macroscópica resecable, la cirugía exclusiva puede constituir una opción terapéutica. Opciones terapéuticas en cáncer de ovario recurrente Estándar 1. Para pacientes sensibles a las sales de platino (recaída > 6 meses del tratamiento previo) se puede considerar nuevamente tratamiento sistémico con alguna sal de platino. -Carboplatino/paclitaxel si no existe neuropatía residual. -Carboplatino. 2. Para pacientes resistentes a las sales de platino, el paclitaxel 60-80 mg/M2 semanal es la droga de elección si no fue empleada previamente. 3. Segundas cirugías de citorreducción no han demostrado una real prolongación de la sobrevida, de todas maneras puede ser considerada ante alguna complicación como la oclusión intestinal u otra situación en la que la cirugía pueda mejorar la calidad de vida de la paciente . 151 4. Quimioterapia de salvataje. Diferentes combinaciones de quimioterapia no han demostrado mejorar las tasas de respuestas ni de sobreviva cuando se comparan a la monoquimioterapia. Distintos citostáticos pueden ser útiles en el tratamiento del cáncer de ovario recurrente, a saber: Gemcitabine: es un antimetabolito piriimídinico que se emplea a la dosis de habiéndose 800-1000 mg/m2 i/v días 1, 8 y 15 cada 28 días, comunicado respuestas objetivas entre 13 % y 19 %, tanto en tumores resistentes al CDDP como al Paclitaxel y en enfermedad “bulky”. Los efectos tóxicos son anemia, neutropenia y plaquetopenia. En algunos casos se han observado sindrome flu-like siguiendo a la administración del citostático. Ifosfamida: respuestas globales del 20 %. Dosis: 1-1,2 gr/m2 x 5 días. Los efectos tóxicos incluyen mielotoxicidad, nefrotoxicidad, cistitis hemorágica (que puede evitarse con uroprotección con Mesna) y encefalopatía. Etopósido oral: se han observado con esta droga v/o respuestas objetivas entre 6 y 26% y baja toxicidad. Dosis 50 mg/m2 día x 21 días cada 28 días. Doxorubicina liposomal: diversos estudios han mostrado una tasa aproximada de respuestas objetivas del 25 % tanto en pacientes resistentes al cisplatino como al paclitaxel. Los efectos tóxicos incluyen neutropenia, mucositis y sindrome mano-pie. Las naúseas son mínimas y la alopecia es rara. Dosis: 40-50 mg/m2 cada 28 días. Topotecan: es un inhibidor de la topoisomerasa I y en estudios de fase II, administrado a la dosis entre 1-1,5 mg/m2 i/v días 1-5 cada 21 días, se han comunicado respuestas del 13 % al 16 %, aún en pacientes resistentes al cisplatino. Los efectos tóxicos son fundamentalmente mielosupresión, naúseas, vómitos, alopecia y raramente astenia. 152 Docetaxel: se han visto resultados alentadores con dosis de 75-100 mg/M2 cada 21 días. Oxaliplatino: 130 mg/M2 cada 3 semanas. Irinotecan: 250-300 mg/M2 cada 21 dias. Vinorelbine: 25-30 mg/M2 semanal. Tamoxifeno: se han visto RO del 18 % con la dosis de 20 mg v/o cada 12 horas. Los que más se benefician son aquellos con receptores de estrógeno positivos. Diferentes citostáticos se han empleado por vía intraperitoneal, incluyendo al cisplatino. Actualmente los estudios en curso incluyen también al paclitaxel, etopósido, etc. Para dichas estrategias se requiere enfermedad mínima y personal técnico entrenado. Altas dosis de quimioterapia y rescate hematológico: se han visto resultados alentadores como tratamiento de segunda línea y también se ha comparado dicha estrategia contra un tratamiento estándar en enfermedad estadio III, pero por el momento continúa en fase de investigación y no es empleada en la asistencia corriente. ESQUEMAS DE QUIMIOTERAPIA Carboplatino/Paclitaxel: Carboplatino: AUC (5-7) i/v Paclitaxel: 175 mg/m2 i/v en perfusión de 3 horas Cada 21 días Cisplatino/Paclitaxel: Cisplatino: 100 mg/m2 i/v Paclitaxel: 175 mg/m2 i/v en perfusión de 3 horas Cada 21 días 153 Carboplatino monodroga: AUC (6) cada 21 días. Carboplatino/Docetaxel Carboplatino: AUC(5) Docetaxel: 75 mg/m2 Docetaxel monodroga: 100 mg/m2 i/v cada 21 días Cisplatino/Docetaxel: Cisplatino: 75 mg/m2 i/v Docetaxel: 75 mg/m2 i/v Cada 21 días REESTADIFICACION: - Rx Tx (F y P). - CA 125/ CEA. - Ecografía ó TAC Abdominal y Pelviana. - Fibrolaparoscopía optativa. En general no existe acuerdo dado que las regiones exploradas son alrededor del 40% - Laparotomía ó second Look: no constituye un procedimiento de rutina. . Ausencia de poliquimioterapia de rescate efectiva. . 60 % de “Second Look” negativo, recaen . SEGUIMIENTO 1er. año: Controles clínicos cada 3 meses Dosificación de CA 125 cada 3 meses TAC abdómen y pelvis (Opcional) 154 2do. año: Controles clínicos cada 4 meses Dosificación de CA 125 cada 4 meses TAC abdómen y pelvis (Opcional) 3er. año y 4to. año: Controles clínicos cada 6 meses Dosificación de CA 125 cada 6 meses TAC de abdómen y pelvis (Opcional) 5to. año: Control clínico anual Dosificación de CA 125 anual TAC de abdómen y pelvis (Opcional) 155 ENFERMEDADES DEL TROFOBLASTO MOLA HIDATIFORME - MOLA INVASORA - CORIOCARCINOMA I) DIAGNOSTICO Y ESTADIFICACIÓN Diagnóstico Anamnesis y Exámen Físico. Ecografía de abdomen y pelvis. B HCG. TSH, T3, T4 Hemograma, FH y EH Estudio anatomopatológico y genético. Rx Tx (F y P). En CORIOCARCINOMA: TAC Encefálica. TAC de Abdomen (hígado). Factores de riesgo Edades reproductivas extremas alteración genética Antecedente de embarazo molar o anormal coriocarcinoma: 1/160.000 embarazos normales 1/15.000 abortos 1/40 embarazo molar Lejano Oriente (RR x 5-10) Grupo sanguíneo (OxA, AxO, B, AB) discutido Estadificacion Clasificación FIGO6 I Confinado al útero II Extensión a vagina o anexos limitado a estructuras genitales III Metástasis pulmonares con o sin compromiso de estructuras genitales IV Todos los demás sitios metastásicos 6 Mola se registra para seguimiento, NO es estadío 0. Benedit JL et al. Int. J. Gynecol Obstet 2000; 70: 209-262. 156 Clasificación de riesgo FIGO/OMS PUNTAJE 0 1 Edad <40 >/= 40 Embarazo previo Mola Aborto Término <4 4-6 7-12 >12 <1000 1000-10.000 >10.000-100.000 >100.000 3-4 >/=5 Bazo, Riñón T. digestivo SNC, Hígado 1-4 5-8 >8 Una droga Dos o más Intervalo desde emba previo (meses) HCG pre tto Tamaño de masa tumoral mayor (incl útero) Sitio de metástasis Nº de metástasis identificadas 2 QT previa fallida 4 ≤ 6: Bajo riesgo - ≥ 7: Alto riesgo. Kohorn EI, et al Int J Gynecol Obstet 2000, 10: 84-88 II) TRATAMIENTO (ver cuadros 1 y 2) Mola hidatiforme Succión de Mola con ocitocina, dilatadores y Curetaje. Luego control de B HCG semanal hasta que 3 dosificaciones seguidas sean negativas. Continuar con B HCG: 1 por mes x 6 meses y finalmente 1 cada 2 meses x 6 meses más. Otras enfermedades del trofoblasto Quimioterapia MQT: Actinomicina D 750 ug/m2 semanal ó Metrotexate 25/35 mg/m2 2 veces por semana ó Metrotexate mg/Kg/día, días alternos por 7 días con Leucovorin. PQT: CDDP 100 mg/m2, 1 día cada 3 semanas. VP16 150 mg/m2, 1 día todas las semanas. Actinomicina D 750 ug/m2, 1 día todas las semanas. *QMT: * PQT: EST. I, II y ENF. METASTASICA DE BAJO RIESGO (pulmonar). ENF. METASTASICA DE ALTO (encefálica o hepática). Contraindicado: 1) Embarazo por un año, puede disminuir a 6 meses en caso de Mola de Remisión Espontánea. 2) Dispositivos intrauterinos. * 157 Tratamiento7 Bajo Riesgo - Metotrexate 1 mg/kg IM D1-3-5-7 RC > 95% SV 5a 100% - Leucovorin 0,1 mg/kg VO D2-4-6-8 Alto Riesgo EMACO: - Etopósido 100mg/m2 IV D1-2 - Metotrexate 100 mg/m2 IV D1 200 mg/m2 IC 12 h - Leucovorin 15 mg/m2 VO-M c/12 h D2 4 dosis RG 70 % SV 5a 86 % - Actinomicina 0,5 mg IV D1-2 - Ciclofosfamida 600 mg/m2 IV D8 - Vincristina 1 mg/m2 IV D8 Tratamiento de segunda línea8 Cuando hay progresión lesional en pacientes que recibieron Actinomicina D, se sustituye ésta por MTX 300 mg/m2 y Acido Folínico. Regímenes con cisplatino , etopósido, bleomicina, ifosfamida Respuesta es menor tras falla de un plan combinado: progresión bajo EMA-CO en 2ª tras MTX-LV: 11 % tras PQT: 34 % III) CONTROL y SEGUIMIENTO B HCG puede permanecer elevada hasta 6 – 8 semanas. Se han descripto situaciones de hasta 14 semanas. Durante el tratamiento se solicita 1 vez por semana. Se considera Remisión Completa (RC) cuando 3 controles seguidos son negativos. 7 Schorge O et al J Reprod Med 2003, oct (48) 10-780-4; Chan KK Am J Obstet Gynecol 2006, May 22 (epub); Bower M, J Clin Oncol 15:2636-2643, 1997 8 Bower M, J Clin Oncol 15:2636-2643, 1997 158 Una vez alcanzado el valor cero: 1 vez por meses x 6 meses. Luego 1 vez cada 2 meses hasta el año. Puede utilizar anovulatorios orales. Fecundidad luego de MTX ó ACT. D es posible en un 56 %. Riesgo de Recidiva de Mola: 3 – 4 %. Riesgo de Malformación fetal: 3 a 4.5 % (igual a población general) Más embarazos patológicos luego de embarazo molar. Cuadro 1. Tratamiento I ETG Historia clínica Examen físico Rx de torax HCG Examen de valoración No metástasis MOLA PARCIAL Coriocarcinoma en la anatomía patológica Metástasis MOLA COMPLETA Resolución espontánea Persistencia de HCG Ascenso luego de 2 semanas Plateau luego de 3 semanas Seguimiento de 6 a 12 meses NTG Cuadro 2. Tratamiento II NTG Etapa IV Factor de riesgo ≥7 Etapas I, II, III Factor de riesgo ≤ 6 Quimioterapia Agente múltiple (EMA CO) Quimioterapia Agente único Resolución No responde Seguimiento clínico Cambie el esquema o el propio agente y HCG por 12 meses No responde No responde Responde Considerar resección de las lesiones aisladas, poliquimioterapia de segunda línea Seguimiento clínico y HCG por159 12 meses CANCER DE RIÑON 2009 I) DIAGNOSTICO Y ESTADIFICACION La incidencia del cáncer renal ha ido en aumento en forma global, en parte debido al diagnóstico más oportuno en el marco de estudios imagenológicos realizados por otras causas. Representa el 2 a 3 % de todos los tumores. La incidencia en el Uruguay en el período 2002-2005, fue de aproximadamente 400 casos, con una mortalidad anual, promedio, de 200 casos. Se ha asociado a varios factores de riesgo, tales como tabaquismo, obesidad, hipertensión arterial, diabetes mellitus, diálisis renal, dieta y factores ambientales. Dentro de las causas hereditarias, la más conocida es la asociada al sindrome de Von Hippel-Lindau. En cuanto a la forma de presentación, la clásica tríada de tumor, dolor y hematuria, solo se ve en el 10 % de los casos. Otros síntomas o signos están relacionados con la invasión del sistema venoso por trombos tumorales, invasión y compresión de órganos vecinos por el tumor o la presencia de metástasis a distancia. Síndromes paraneoplásicos pueden verse en aproximadamente el 30 % de tumores sintomáticos, siendo los síndromes paraneoplásicos más frecuentes, hipertensión arterial, caquexia y pérdida de peso. El diagnóstico imagenológico durante el estudio de otras patologías y/o síntomas se ve en aproximadamente el 50 %. SV a 5 años: EI 96%, EII 82%, EIII 64% y EIV 23%. En la tabla siguiente se muestra la incidencia de los sintomas, asi como de los síndromes paraneoplásicos asociados al carcinoma de células renales. Tabla 1. Síntomas y síndromes paraneoplásicos asociados 160 al carcinoma renal. Síntomas o signos Incidencia Síndrome Incidencia (%) paraneoplásico (%) Hematuria 30-50 Anemia 20-40 Masa lumbar 20-40 Fiebre 15-30 Dolor 20-40 Hipertensión arterial 15-30 Pérdida de peso 10-30 Disfunción hepática 3-6 Amiloidosis 3-5 Síntomas relacionados a 10-30 metástasis Tríada clásica 8-10 Eritrocitosis 3-5 Varicocele agudo 1-3 Enteropatía 3 Neuromiopatía 3 ESTUDIOS PARACLINICOS - Hemograma completo - Creatininemia - Azoemia - Ionograma con calcemia - Funcional y enzimograma hepático con LDH - TAC de abdomen y pelvis con contraste si la función renal lo permite: evalúa el tumor, su relación con órganos vecinos, el riñón contralateral, glándula suprarenal, así como adenopatías profundas. - Ecografia de aparato urinario, permite diferenciar entre una lesion quística y una sólida. - Radiografia de tórax para descartar metástasis pulmonares y eventualmente TAC de tórax. - Imagen por resonancia magnética, es el estudio de elección ante la sospecha de compromiso venoso, insuficiencia renal o alergia al contraste. - Otros estudios como centellograma óseo, TAC de cráneo, se pedirán ante sospecha clinica o alteración de otros estudios. - PET scan: estudios recientes demuestran que el PET scan tiene una sensibilidad del 60 a 70%, pero con alta especificidad, pudiendo ser útil en la estadificación y en la definición de lesiones sospechosas de metástasis. 161 - La confirmación anatomopatológica se podrá obtener a partir de la pieza quirúrgica de la nefrectomía, biopsia percutanea ante duda diagnóstica, o biopsia de una lesión metastásica en la enfermedad avanzada. Para la estadificación del cáncer de células renales se encuentra en vigencia el sistema TNM de la American Joint Committee on Cancer del 2002: Tumor primario TX el tumor primario no puede ser evaluado T0 sin evidencia de tumor primario T1a tumor menor o igual a 4 cm, confinado al órgano T1b tumor mayor a 4 cm y menor a 7 cm, confinado al órgano T2 tumor mayor a 7 cm, confinado al órgano T3a invasión directa de la glándula suprarrenal, grasa perirenal, tumor confinado a la fascia de Gerota T3b invasión por el tumor de la vena renal o de la vena cava inferior por debajo del diafragma T3c invasión de la vena cava inferior por arriba del diafragma o invasión de la pared de la vena cava T4 invasión por el tumor más allá de la fascia de Gerota Compromiso ganglionar regional NX ganglios regionales no pueden ser evaluados N0 ganglios regionales sin metástasis N1 metástasis en un ganglio regional N2 metátastasis a más de un ganglio regional Metástasis a distancia MX metástasis a distancia no pueden ser evaluadas M0 sin metástasis a distancia M1 metástasis a distancia presentes. Incluye metástasis a ganglios no regionales y/o a otros órganos Estadios 162 I T1a T1b, N0, M0 II T2, N0, M0 III T1a T3b, N1, M0 o T3a T3c, No, M0 IV T4, N0 N1, M0 o cualquier T, N2, M0 o cualquier T, cualquier N, M1 Clasificación patológica El carcinoma de células renales es una enfermedad heterogénea, describiéndose múltiples subtipos,fundamentalmente por la morfología,sin embargo se han ido describiendo e incorporando entidades por las caracteristicas citogenéticas y moleculares. El carcinoma renal a celulas claras es el subtipo histológico más frecuente, representando entre el 60 % y el 70 % y tiene su mayor incidencia en la sexta y séptima década de la vida. Afecta al hombre en una relacion 2:1 con respecto a la mujer. Si bien la mayoria corresponde a cáncer esporádico, un 5 % puede presentarse en un contexto hereditario, siendo más frecuente el sindrome de Von HippelLindau. A continuación se describe la clasificación patológica de la OMS 2004: Carcinoma a células renales Carcinoma renal a células claras Carcinoma renal a células claras quistico multilocular Carcinoma a células renales papilar Carcinoma a células renales cromófobo Carcinoma de los ductos colectores de Bellini Carcinoma renal medular Carcinoma traslocación Xp11 Carcinoma asociado con neuroblastoma Carcinoma mucinoso tubular y a células en aguja Carcinoma renal no clasificado Adenoma papilar/adenoma renal cortical 163 Oncocitoma Factores pronósticos patológicos no incluidos en el TNM Grado tumoral de Fuhrman Histologia Necrosis tumoral Factores pronósticos no patológicos Performance Status Trombocitosis mayor a 450.000 x mm3 Neutrofilia mayor a 6.500 cel./uL Modelos predictivos de sobrevida (enfermedad diseminada) Para la enfermedad avanzada se han desarrollado difererentes modelos pronósticos basados en diferentes factores. El más conocido y que actualmente se emplean para homogeneizar los pacientes en el marco de ensayos clinicos es el desarrollado por Motzer y colaboradores, a partir de un estudio retrospectivo de 670 pacientes incluidos en 24 ensayos clinicos en el Memorial Sloan-Kettering Cancer Center (MSKCC). Un análisis de múltiples variables identificó 5 factores pronósticos adversos para la sobrevida. De acuerdo a lo anterior se han elaborado 3 grupos de riesgo, con sobrevida bien diferente. Los factores de mal pronóstico en esta clasificación son: performance status menor a 80 %, intervalo entre diagnóstico de la enfermedad avanzada y tratamiento menor al año, hemoglobina menor a 10 gr/dl., LDH mayor a 1.5 del límite superior normal, calcemia mayor a 10 mg/dl. Grupo Nº factores adversos Favorable Intermedio Pobre II) Sobrevida 0 30 meses 1-2 14 meses 3 o más 6 meses TRATAMIENTO DE LA ENFERMEDAD LOCALIZADA 164 La probabilidad de curación está en relación directa con el estadio de la enfermedad. Frecuentemente el cáncer de riñón es curable cuando está localizado al riñón y al tejido circundante inmediato. Incluso cuando hay afectación de los vasos sanguíneos o ganglios linfáticos en un número significativo de pacientes se puede lograr largas sobrevidas. Considerando todos los estadios la SVG a 5 años es de aproximadamente un 40 %, lo cual se debe a que un porcentaje importante de pacientes (40-45%) es diagnosticado cuando la enfermedad está relativamente localizada. La cirugía es el tratamiento estandar para el cáncer renal localizado con criterio potencialmente curativo. El tratamiento de elección es la nefrectomía radical que abarca la exéresis del tumor primario, la glándula suprarenal con sus envolturas, asegurando un adecuado margen libre de tumor y vaciamiento ganglionar locoregional. El vaciamiento ganglionar extensivo es hoy día discutido, aunque tiene implicancias pronósticas, dado que el compromiso ganglionar traduce un peor pronóstico. Actualmente no hay evidencia que apoye la indicación de tratamiento adyuvante. En situaciones particulares, el paciente puede ser candidato a un estudio clínico. TRATAMIENTO DE LA ENFERMEDAD AVANZADA El cáncer de riñón se encuentra entre los tumores considerados resistentes a la quimioterapia citotóxica y al tratamiento hormonal. Las citoquinas fueron el tratamiento de referencia por muchos años. En lo últimos años nuevos fármacos, dirigidos para inhibir especificamente factores conocidos involucrados en el desarrollo de crecimiento y metástasis del cáncer renal han sido estudiados. La FDA (Administración de Drogas y Medicamentos de USA) aprobó tres nuevos fármacos para el tratamiento del cáncer renal avanzado sobre la base de resultados de estudios aleatorizados de fase III: Sorafenib (Nexavar ) en diciembre de 2005, Sunitinib (Sutent ) en febrero de 2006, Temsirolimus (Torisel ) en mayo de 2007. En diciembre de 2007 se aprobó en Europa la combinación de Bevacizumab e interferón y recientemente en setiembre de 2009 se aprueba el Everolimus 165 (Afinitor ) en 2ª línea. Los mecanismos de acción de estos compuestos son similares, siendo las consecuencias finales de su acción el bloqueo de señales que impulsan el ciclo celular de las células malignas, la generación de metástasis y de la producción de nuevos vasos. El Bevacizumab es un anticuerpo monoclonal que inhibe el factor de crecimiento endotelial vascular (VEGF), un mediador escencial de la angiogénesis y la progresión tumoral en el cáncer renal. El Sorafenib y el Sunitinib son inhibidores de la tirosina quinasa (TKI) multidirigidos que inhiben la señalización del receptor del VEGF, junto con la señalización de otras vías celulares a través de varios otros receptores de tirosina kinasa. El Temsirolimus y el Everolimus son inhibidores del blanco de rapamicina (mTOR), los cuales están impicados en la inhibición del crecimiento y la angiogénesis tumoral. El Sunitinib, a partir de 2 estudios de Fase II fue aprobado en segunda línea para el cáncer renal, pero en un estudio Fase III donde se comparó a Interferon en primera línea, demostró una respuesta objetiva del 31 % versus 6 % del interferón, con una sobrevida libre de progresión de 11 meses contra 5 meses. Dichas diferencias fueron estadísticamente significativas para todos los grupos de riesgo, aunque mucho mayor en los grupos de riesgo bueno e intermedio, por lo cual pasó a ser el nuevo estándar para el cáncer renal avanzado en primera línea, especialmente en los grupos de pronóstico bueno e intermedio. Un analisis reciente de este mismo trabajo que evalua la SVG realizado con 26 meses de seguimiento, no evidenció una diferencia significativa entre ambos brazos, con medianas de SV de 26.4 para el sunitinib y 21.8 para el INF manteniéndose una diferencia significativa en SLP. El Sorafenib fue estudiado tanto en Fase II como en Fase III, como segunda línea luego de progresión a modificadores de respuesta biológica, encontrándose un beneficio en la mediana de sobrevida comparada a placebo, de 5,5 meses contra 2.8 meses (estudio TARGET). Un analisis de subgrupo para comparar la toxicidad en pacientes mayores o menores de 70 años, se demostró una toxicidad similar en ambos grupos etarios. Respecto a su papel en primera línea, en un estudio de Fase II se comparó con Interferón, no observándose diferencias en la SLP (5,7 vs. 5,6 meses), aunque hubo mayor respuestas con el sorafenib y mejor calidad de vida. Basado en los ensayos previos fue aprobado el uso de sorafenib para el tratamiento del cáncer renal avanzado en segunda línea o en primera línea en 166 pacientes con mala tolerancia a sunitibib o en condiciones especiales. El Temsirolimus fue estudiado también en estudios fase II y III. En un ensayo fase III para paciente de pobre riesgo, donde se comparó a interferón y a un tercer brazo con la combinación de ambos fármacos, se encontró una mejoría significativa de la sobrevida global de 10.9 meses contra 7.3 meses con interferón y y 8.4 con la combinación de ambas. La sobrevida fue mayor en los pacientes menores de 65 años. Este estudio llevó a la aprobación por la FDA de temsirolimus en primera línea para el cáncer renal avanzado de alto riesgo. El Bevacizumab fue evaluado en un estudio fase III en primera línea. En dicho ensayo clínico (AVOREN) se comparó Bevacizumab 10 mg/kg más Interferon 2 a 9 MU 3 v/semana vs. Interferon 2 a 9 MU 3 v/semana más placebo, mostrando la combinación un beneficio en la sobrevida libre de progresión de 10.2 meses contra 5.4 meses. Otro estudio fase III más reciente (CALGB 90206) con diseño similar comparando Bevacizumab más Interferon realiza una estratificación por 2a versus Interferon grupos de riesgo y status 2a que quirúrgico reafirmando el beneficio del Bevacizumab con sobrevida libre de progresión de 8.5 meses contra 5.2 meses. Todos estas drogas demostraron eficacia significativa en pacientes que no responden al tratamiento con citoquinas y por lo tanto ofrecen un tratamiento de segunda línea efectivo en este contexto. Desde el advenimiento de los trabajos que han permitido el reemplazo de la primera línea por éstas terapias dirigidas, la eficacia de segundas líneas y la estrategia general del tratamiento del cáncer renal no está definida aún. Las opciones de tratamiento de segunda línea son basicamente las mismas: tratamiento con otra citoquina; tratamiento con un fármaco dirigido que inhiba una vía ya inhibida; tratamiento con fármaco dirigido que tenga como blanco otra vía, una combinación de estos abordajes; o tratamiento con un fármaco en investigación en un estudio clínico, o incluso quimioterapia (ver abajo). Los datos más consistentes respecto al uso de fármacos dirigidos en pacientes que recibieron otros tratamientos dirigidos previos fueron otorgados por un estudio fase III que evaluo el valor del Everolimus. Pacientes que no habían respondido a múltiples TKI, incluidos Sunitinib, Sorafenib, INF más Bevacizumab, reciben Everolimus o placebo. La administración de Everolimus produjo una prolongación significativa de la SLP 4,9 versus 1,9 meses. La ausencia de comparación, con otras opciones de tratamiento potencialmente activo, hace dificil llegar a una correcta conclusión beneficio 167 Rol de la nefrectomía citoreductora Previo al advenimiento de las nuevas moléculas, 2 ensayos clínicos mostraron el beneficio de la nefrectomía en pacientes con enfermedad avanzada, previo al inicio de la terapéutica sistémica, comparado al tratamiento con Interferon sin la nefrectomía. Los pacientes canditados a dicha estrategia son aquellos pacientes con PS 0-1, sin metástasis encefálicas, hepáticas u óseas, histología sin diferenciación sarcomatoide, donde el tumor primario represente la mayor carga tumoral y sin enfermedades comórbidas asociadas. Un estudio retrospectivo del MDACC presentado en el ASCO 2009 incluye un análisis de 566 pacientes que recibieron cirugía de citoreducción y terapias dirigidas evidencia un beneficio significativo en sobrevida global, comparado con respecto a 110 pacientes que recibieron solamente terapias dirigidas. Dicho beneficio se pierde en pacientes con más de 3 de estos factores de riesgo preoperatorios: albúmina sérica 3,5 mgdl, LDH 595 UIl, metástasis hepáticas, debút con metástasis sintomáticas, compromiso de ganglios retroperitoneales, compromiso de ganglios supradiafragmáticos, T3 o T4. Rol de las citoquinas Durante últimas décadas la inmunoterapia fue el tratamiento estándar en el cáncer de riñón. Los agentes más extensamente utilizados son el interferón alfa y la interleukina-2 (IL-2), solos o combinados ya sea entre sí o con otros modificadores de la respuesta biológica, así como con drogas citotóxicas. La IL-2 en altas dosis (según el régimen a altas dosis del NCI) ha demostrado obtener un 9% de respuestas completas, siendo un alto porcentaje de éstas respuestas prolongadas. El esquema de IL-2 en altas dosis (NCI original), consiste en 720.000 U/kg diluida en 100 mL de SG 5%, agregando 10 mL de albúmina 20% IV, a pasar en 15 minutos cada/8 h durante el máximo de 14 dosis seguidas. Luego de 9 a 14 días, usar nuevo ciclo con las mismas dosis. Reevaluar la respuesta después de 6 a 8 semanas. Si hay respuesta, repetir dos veces más el mismo 168 tratamiento. Este esquema tiene una alta toxicidad, por lo que se debe seleccionar criteriosamente a los potenciales candidatos a recibirlo. En cuanto al INF, se debe iniciar con 3 MU s/c 3 veces por semana y aumentar hasta 9-10 MU. Hoy en día las citoquinas tienen lugar en dos situaciones específicas: aquellos pacientes en quienes el objetivo es obtener una respuesta completa y aquellos pacientes con secundarismo ganglionar y pulmonar exclusivo. En los pacientes portadores de tumores con histología a células claras y que reciben IL-2, la variante alveolar se relaciona con un mejor pronóstico. La presencia de características histológicas alveolares en más del 50% y la ausencia de componentes papilíferos y granulares se asocia con mayores probabilidades de obtener respuestas objetivas. La alta expresión de la enzima anhidrasa carbónica IX (definida como > 85% de marcación por inmunohistoquímica, utilizando el anticuerpo MN-75), se asocia a mayores probabilidades de obtener respuestas objetivas en los pacientes que recibieron tratamiento con IL-2 a altas dosis. Por otro lado, las respuestas completas solo se evidenciaron en el grupo con alta expresión de esta enzima. Rol de la quimioterapia Si bien el cáncer renal es considerado un tumor quimioresistente, en casos seleccionados puede emplearse la QT. Los regímenes con gemcitabine y capecitabine, gemcitabine y 5FU o gemcitabine y oxaliplatino logran entre 520% de RO con resultados variables en SVLP y SVM. La monoquimioterapia logra menores porcentajes de RO. Régimen de Atzpodien: Semana 1 y 4: IL-2, 20 MU/m2 sc L, M,V. IFN, 6 MU/m2 SC los V Semana 2 y 3: IL-2, 5 MU/m2 sc M, J y S y IFN, 6 MU/m2 SC a las L, M y V Semana 5 a 8: IFN, 9 MU/m2 sc L, M y V y 5-FU, 750 mg/m2 IV los V Abreviaciones: MU, millones de unidades; LMMJVS, lunes, martes, miércoles, jueves, viernes y sábados. Aunque el régimen de Atzpodien produjo RG del 48,6% (RC del 11,4%) en el estudio original, la experiencia subsiguiente de los propios autores mostró RG del 28,5 %. 169 Estudios posteriores con el mismo régimen por parte de otros autores no reprodujeron los mismos resultados que en los trabajos originales. Rol de la radioterapia La misma puede jugar un papel como tratamiento paliativo, en especial en el tratamiento del secundarismo óseo, compromiso medular y secundarismo encefálico. No existen estudios clínicos randomizados que apoyen la indicación de RT adyuvante. 170 CANCER DE PROSTATA 2009 I) DIAGNÓSTICO Y ESTADIFICACIÓN Diagnóstico positivo: Se basa en el Tacto Rectal, PSA, Ecografía transrectal y certificación histológica en muestra obtenida por PBP ecoguiada con determinación del grado histológico (score de Gleason). Diagnóstico de extensión lesional - Tacto rectal - Ecografía transrectal (RNM endorectal) (tamaño, compromiso capsular, compromiso ganglionar) - Estado de los ganglios linfáticos regionales: en pieza de linfadenectomía o biopsia laparoscópica (Imagenología: no permite descartar con certeza el compromiso). - Centellograma óseo: en pacientes con PSA > 10 ug/l y/o Gleason ≥7 y/o ≥T3 o dolores óseos. - TAC de abdomen y pelvis: en pacientes con: PSA > 10 ug/l y/o Gleason ≥7 y/o ≥T3 o síntomas - RxTx - Estudios biológicos: PSA, Hemograma, Fosfatasa Alcalina, Creatininemia - Otros estudios: según las manifestaciones clínicas o los hallazgos de laboratorio. Estadificación según sistema TNM (2002) Tumor primario (T) TX: No es posible evaluar el tumor primario T0: Sin evidencia de tumor primario T1: Tumor subclínico, no palpable ni visible mediante imágenes T1a: Hallazgo histológico incidental en ≤5% del tejido resecado T1b: Hallazgo histológico incidental en >5% del tejido resecado T1c: Tumor identificado mediante PBP (ej: debido a PSA elevado) T2: Tumor confinado a la próstata* T2a: Tumor que compromete el 50% o menos de un lóbulo 171 T2b: Tumor que compromete >50% de un lóbulo T2c: Tumor que compromete ambos lóbulos T3: Tumor que se extiende a través de la cápsula prostática9 T3a: Extensión extracapsular (unilateral o bilateral) T3b: Tumor invade la(s) vesícula(s) seminal(es) T4: Tumor que esta fijo o invade estructuras adyacentes diferentes a las vesículas seminales: cuello vesical, esfínter externo, recto, músculos elevadores y/o la pared pélvica Ganglios linfáticos regionales (N) (ganglios de la pelvis por debajo de la bifurcación de las arterias ilíacas comunes) NX: No es posible su evaluación N0: No hay metástasis en ganglios linfáticos regionales N1: Metástasis en ganglios linfáticos regionales Metástasis a distancia (M) MX: Metástasis a distancia no son evaluables M0: No hay metástasis a distancia M1: Metástasis a distancia M1a: Ganglios linfáticos noregionales M1b: Óseas M1c: Otros sitios con o sin metástasis óseas Grado Histopatologico (G) GX: El grado no puede ser determinado G1: Bien diferenciado (Gleason 2–4) G2: Moderadamente diferenciado (Gleason 5–6) G3-4: Pobremente diferenciado o indiferenciado (Gleason 7–10) Agrupación estadios Estadio I T1a, N0, M0, G1 Estadio II T1b, N0, M0, any G T1c, N0, M0, any G T1, N0, M0, any G 9 La Invasión del ápex prostático o de la cápsula pero no más allá de la misma es clasificada como T2. 172 T2, N0, M0, any G T1a, N0, M0, G2-4 Estadio III T3, N0, M0, any G Estadio IV T4, N0, M0, any G T, N1, M0, any G Any T, any N, M1, any G Categorías de riesgo de en pacientes con cáncer de próstata localizado Los sistemas más comúnmente empleados para estratificación del riesgo son la clasificación en grupos de riesgo de D´Amico 10 y los nomogramas. Grupos de riesgo de D´Amico Riesgo bajo: T1-T2a y Gleason 2-6 y PSA <10 Riesgo intermedio: T2b y/o Gleason 7 y/o PSA 10-20 Riesgo alto: T2c y/o Gleason ≥ 8 y/o PSA >20 Nomogramas11 Predicen con mayor certeza que la agrupación de riesgos la probabilidad de recaída post-tratamiento. La mayoría predice el riesgo de progresión de la enfermedad a 5-7 años post-tratamiento radical. Los más comúnmente empleados, validados en estudios clínicos, están disponibles en los siguientes artículos: Nomograma pre prostatectomía radical.12 Nomograma post prostetectomía radical.13 D’Amico et al. JAMA 280:969, 1998. Disponible online y gratuito en : www.nomogorams.org 12 Kattan et al. J Natl Cancer Inst 90:766-771, 1998 10 11 173 Nomograma pre radioterapia tridimensional conformada.14 Nomograma pre braquiterapia. 15 Recaída Bioquímica. Definiciones y Diagnóstico. DEFINICIONES Recaída bioquímica post-prostatectomía radica Existen múltiples definiciones. La que se asocia en mejor medida a mortalidad por cáncer de próstata y aumento subsiguiente del PSA es: ascenso del PSA por encima de 0,4 ng/ml en algún momento de la evolución post prostatectomía radical. Recaída bioquímica post-radioterapia radical: Se aplica la definición de ASTRO de 2006. Elevación por encima de 2 ng/ml por encima del nadir. PREDICCIÓN DE LA EVOLUCÍÓN Y DEL SITIO DE RECIDIVA La recaída bioquímica no es sinónimo de recaída clínicamente relevante ni de muerte por cáncer de próstata. Sólo un 30-40% de los pacientes con recaída bioquímica presentarán una recaída clínica. En vistas a la definición del pronóstico y tratamiento es importante predecir que pacientes pueden presentar una recaída clínica así como el sitio de recidiva. Para ello se deben considerar: - Características de la enfermedad al diagnóstico: PSA pretratamiento radical, score de Gleason, estadio TNM, estado de los márgenes quirúrgicos en pacientes prostatectomízados - Características de la recaída: tiempo a la recaída, valor absoluto de PSA, tiempo de duplicación del PSA. Este último es el principal factor predictivo de recurrencia clínica y mortalidad por cáncer de próstata. En www.nomograms.org está disponible un calculador del tiempo de duplicación del PSA. VALORACIÓN PARACLÍNICA 13 14 15 Kattan et al. J Clin Oncol ;17:1499-1507, 1999 Kattan et al. J Clin Oncol 18:3352-3359, 2000 Kattan et al. Urology 58: 393-399, 2001 174 Es excepcional la positividad de los estudios paraclínicos en pacientes con PSA menor de 20-40 ng/ml. Su solicitud debería limitarse a pacientes con PSA mayor de 20 y/o tiempo de duplicación del PSA menor a 6 meses. En estos pacientes se recomienda solicitar: - TAC de abdomen y pelvis Centellograma óseo III. TRATAMIENTO III.1 Cáncer de Próstata Localizado/Locorregional (T1-4/NX O N1/M0) Tratamiento sistémico Hormonoterapia neoadyuvante - PRE PROSTATECTOMÍA RADICAL: no se recomienda (sin ventaja en la SV libre de recaída bioquímica ni la SV global. - PRE RADIOTERAPIA RADICAL + CONCURRENTE CON LA RT: Un curso corto de entre 4 y 6 meses de hormonoterapia (HT) neoadyuvante y concurrente con la radioterapia externa convencional se asocia a mejorías en las tasas de control local, a distancia y en algunos casos sobrevida global en comparación con la radioterapia exclusiva en pacientes con cáncer de próstata localizado de alto riesgo y localmente avanzado. - Tipo y duración de la HT: Goserelina 3,6 mg s/c cada 28 días asociada a Flutamida 250 mg v/o c/8 h a comenzar entre 2 y 4 meses previo al comienzo de la radioterapia y manteniéndola durante la misma. - Es importante destacar que la HT neoadyuvante y concurrente con Goserelina y Flutamida x 4 meses seguida del mismo tratamiento en forma adyuvante x 2 años se asocia a mejorías en las tasas de control local, a distancia y sobrevida libre de enfermedad a 5 años en comparación con la hormonoterapia neoadyuvante exclusiva. - Se desconoce el beneficio agregado de la HT neoadyuvante en pacientes que reciben hormonoterapia adyuvante. Hormonoterapia adyuvante Beneficio demostrado en términos de sobrevida libre de progresión (SLP) y sobreviva global (SVG) en las siguientes situaciones: 175 - Luego de RADIOTERAPIA: en pacientes con enfermedad localizada de alto riesgo (y eventualmente riesgo intermedio) o localmente avanzada (T3/4) o N1 (+/- hormonoterapia neoadyuvante y/o concurrente) - Luego de PROSTATECTOMIA RADICAL: en pacientes con compromiso ganglionar regional (N1) Tipo y duración de la HT: - Goserelina 3.6 mg sc (o leuprolide 3.6 mg im) cada 28 días +/flutamida o ciproterona por 6 meses a 3 años o hasta progresión lesional. El esquema de 6 meses se reserva para pacientes con tumores T1-T2 de riesgo intermedio o alto. - Bicalutamida 150 mg vo por 2 años o hasta progresión lesional (alternativa en pts que desean conservar la actividad física y sexual) No existe evidencia suficiente para hacer mayores recomendaciones sobre el esquema de tratamiento (adyuvancia exclusiva o asociada a neoadyuvancia y/o a HT concurrente), el tipo de HT y su duración. Hormonoterapia exclusiva En pacientes con enfermedad localmente avanzada (T3-4) o con compromiso ganglionar regional (N1) en los que no recibirán tratamiento local ya sea por negativa del paciente o en función de su edad y comorbilidades. Beneficio en la SLP y posible beneficio en la SVG. Prevención de la ginecomastia dolorosa Considerar Radioterapia previa a la hormonoterapia Seguimiento 1- En pacientes sometidos a manejo expectante: - PSA cada 3-6 meses - TR cada 6-12 meses - Considerar la eventual repetición de la biopsia prostática para descartar aumento del grado histológico (la primera rebiopsia aproximadamente al año de la inicial) 2- Luego de prostatectomía radical +/- HT - PSA16 a los 2-3 meses y luego cada 6-12 m - TR cada 6-12 meses 3- Luego de radioterapia +/- HT 16 El PSA debe ser indetectable pasados los 2 meses de la prostatectomía radical. 176 - PSA17 cada 6-12 m - TR cada 6-12 meses III.2 Recaída Bioquímica Las opciones terapéuticas son: Tratamiento local de rescate Radioterapia radical: de rescate en pacientes previamente prostatectomizados o Prostatectomía de rescate en pacientes previamente irradiados. Su indicación debe limitarse a pacientes en los cuales las características de la enfermedad al diagnóstico y las características de la recidiva sugieren una recaída exclusivamente local. Los candidatos ideales serían aquellos con: (1) Características de la enfermedad al debut: PSA pretratamiento radical menor a 10 ng/ml, T1-2ª, Gleason ≤ 7, márgenes quirúrgicos positivos, ganglios e invasión vesículas seminales negativos; (2) Características de la recidiva: tiempo a la recidiva mayor a 2 años, tiempo de duplicación del PSA mayor de 12 meses; y (3) expectativa de vida mayor a 10 años. Hormonoterapia: De elección en pacientes en los cuales las características de la enfermedad al diagnóstico y las características de la recidiva predicen un riesgo elevado de recaída clínicamente relevante y mortalidad por cáncer de próstata (p.ej. (1) Características de la enfermedad al debut: T3, Gleason 8-10, PSA pre-tratamiento radical mayor de 20, ganglios positivos, invasión vesículas seminales; (2) tiempo a al recidiva menor de 12-24 meses, tiempo de duplicación del PSA menor a 12 meses.). Opción también en todo pacientes no candidato a tratamiento local de rescate. Observación Opción en pacientes con bajo riesgo de recaída clínica y muerte por cáncer de próstata, especialmente en aquellos con expectativa de vida corta. III.3 Cáncer Prostático Metastásico Hormonosensible 17 El PSA debe alcanzar el nadir (ideal menor a 1 µg/l) dentro de los 18-24 meses que siguen a la radioterapia radical. 177 Opciones Terapéuticas La hormonoterapia antiandrogénica es el tratamiento inicial de elección en todo paciente con diagnóstico de cáncer de próstata metastático. Las siguientes opciones terapeúticas tienen similar eficacia pero diferente perfil de toxicidad/efectos adversos/ complicaciones: - Orquiectomía bilateral Superagonistas LHRH (Goserelina, Leuprolide, Buserelina, Triptorelina) - Antiandrógenos no esteroideos (Flutamida, Bicalutamida, Nilutamida) - Antiandrógenos esteroideos (Ciproterona) En pacientes sintomáticos que comienzan un tratamiento con superagonistas LHRH debe administrarse antiandrógenos en forma concomitante por un período de aproximadamente un mes para evitar el fenómeno de flare. El bloqueo androgénico total se asocia a un beneficio marginal en sobrevida con un incremento significativo de los efectos adversos por lo que no se recomienda rutinariamente. La terapia hormonal intermitente aún se considera una estrategia experimental por lo que no debe aplicarse en la práctica clínica estándar en forma rutinaria. Sin embargo, podría tener indicación en situaciones específicas como por ejemplo pacientes con indicación de tratamiento con superagonistas LHRH que deseen mantener una vida sexual activa. En caso de falla de la terapia hormonal de primera línea, las maniobras hormonales de segunda línea logran respuestas en un 20-30% de los pacientes. III.4 Cáncer Prostático Metastásico Hormonorefractario Definición Enfermedad progresiva con niveles de testosterona de castración y hormono refractariedad (2 manipulaciones hormonales y retiro de antiandrógenos). Tratamiento Sistémico Se sugiere no iniciar el tratamiento quimioterápico hasta aparición de síntomas. La progresión humoral per se no es una indicación formal de quimioterapia. 178 La quimioterapia basada en docetaxel es la única que ha mostrado prolongar la sobreviva por lo que constituye el tratamiento de primera línea: Docetaxel 75 mg/m2 i/v cada 3 semanas + Prednisona 10 mg v/o día (Opción: docetaxel semanal) Progresión post-quimioterapia basada en Docetaxel: No hay un tratamiento estándar. Puede emplearse: - Mitoxantrona 12 mg/ m2 i/v D1 cada 3 semanas + Prednisona 10 mg v/o día. - Ketoconazol 200 mg/m2: opción en pacientes asintomáticos con progresión humoral - Otros regímenes de quimioterapia potencialmente útiles (mejoría subjetiva, reducción del PSA) incluyen la ciclofosfamida, vinorelbine y combinaciones de estramustina con agentes antimicrotúbulo (paclitaxel, vinblastina) y con etopósido. - Considerar tratamiento analgésico con radiisótopos (radioterapia sistémica). Bifosfonatos El bifosfonato indicado en el cáncer de próstata metastático hormonorefractario con metástasis óseas es el Àcido Zoledrónico. Los estudios que compararon Pamidronato vs. Placebo no demostraron beneficio significativo en aquellos pacientes que recibieron Pamidronato. No existen a la fecha estudios que demuestren el beneficio de los bifosfonatos en el cáncer de próstata hormonosensible. 179 TUMORES GERMINALES DE 2009 TESTICULO I) DIAGNÓSTICO Diagnóstico positivo El diagnóstico presuntivo se basa en la anamnesis y examen clínico, la ecografía testicular y la determinación de marcadores tumorales (AFP, ßHCG y AFP). El diagnóstico definitivo se obtiene a través de la orquiectomía radical por vía inguinal, la cual constituye una maniobra diagnóstica, terapéutica y estadificadora. En pacientes con un diagnóstico presuntivo de tumor germinal en base a los estudios mencionados, y con una enfermedad metastásica que amenace la vida a corto plazo, debe considerarse la realización de poliquimioterapia en forma urgente, aún en ausencia de confirmación a través de la orquiectomía. Diagnóstico de extensión lesional - Anamnesis y examen físico Estudio anátomo-patológico de la pieza de orquiectomía: permite la definición del pT. - Marcadores tumorales pre y postorquiectomía: en caso de elevación de la AFP el manejo terapéutico postorquiectomía y el seguimiento debe ser el de un tumor germinal no seminomatoso (TGNS) aún ante la ausencia de elementos no seminomatosos en la pieza de orquiectomía. Recordar vida media de los MT: AFP 57 días, ßHCG 18-36 horas. - TAC tórax-abdomen-pelvis y Rx tórax Otros estudios (TAC/RMN cráneo, centellograma óseo, etc): en base a las manifestaciones clínicas o los signos de laboratorio. Exámenes de valoración general - Hemograma, creatininemia, azoemia, inograma, funcional y enzimograma hepático. Otras consideraciones Discutir con el paciente acerca de la posibilidad de esterilidad post-QT y 180 en consecuencia de la opción de la criopreservación de semen. II) ESTADIFICACIÓN Y DETERMINACIÓN DE RIESGO Estadificación TNM En base a la clínica, los exámenes mencionados y el estudio de la pieza de orquiectomía se realiza la estadificación basándose en el sistema TNM: T: tumor primario (se clasifica luego del estudio de la pieza de orquiectomía radical) pTx: no se puede evaluar el tumor primario (si no se realizó orquiectomía radical se asigna esta categoría) pT0: no hay evidencias de tumor primario pTis: carcinoma in situ pT1: tumor limitado al testículo y epidídimo sin invasión vascular o linfática ni de la vaginal pT2: tumor limitado al testículo y epidídimo con invasión vascular o linfática o de la vaginal. pT3: tumor que invade el cordón espermático pT4: tumor que invade el escroto N: ganglios linfáticos regionales (paraaórticos, preaórticos, interaortocava, precavos, paracavos, retrocavos, retroaórticos y los localizados a la largo de la vena espermática. Los ganglios ilíacos comunes, ilíacos externos e internos e inguinales se consideran regionales sólo después de una cirugía escrotal o inguinal) Nx: no se pueden evaluar N0: no hay metástasis en ganglios linfáticos regionales N1: metástasis en uno o más ganglios 2 cm N2: metástasis en uno o más ganglios > 2 cm pero 5 cm N3: metástasis en uno o más ganglios >5 cm M: metástasis a distancia M0: sin evidencias M1a: metástasis en ganglios no regionales o pulmonares M1b: metástasis viscerales no pulmonares S: marcadores tumorales séricos (determinados inmediatamente antes de la quimioterapia) S0: marcadores tumorales normales 181 S1: MT elevados pero AFP<1.000, HCG<5.000, LDH<1,5x límite superior normal S2: AFP 1.000-10.000, HCG 5.000-50.000, LDH 1,5-10 xN S3: AFP>10.000, HCG>50.000, LDH>10 xN En base a esta clasificación se propone la siguiente agrupación en estadios: Estadio I: tumor limitado al testículo. Se subdivide en IA (T1,N0,M0,S0), IB (T2-4,N0,M0,S0), IS (T1-4,N0,M0,S1-3). Estadio II: enfermedad con compromiso ganglionar retroperitoneal pero no más allá de éste. El estadio II se subdivide en IIA (T,N1,M0,S0-1), IIB (T,N2,M0,S0-1), IIC (T,N3,M0,S0-1). Los pacientes con compromiso retroperitoneal exclusivo pero un nivel de marcadores S2 o S3 se clasifican como estadio III. Estadio III: enfermedad diseminada a ganglios no regionales, o metástasis parenquimatosas, o metástasis retroperitoneales exclusivas con marcadores S2 o S3. Se subdivide en: IIIA (T,N,M1a,S0-1), IIIB (T,N13,M0,S2 – T,N,M1a,S2), IIIC (T,N1-3,M0,S3 – T,N,M1a,S3 – T,N,M1b,S) Determinación del riesgo Debe asignarse en todo paciente con enfermedad metastásica. Para ello se tienen en cuenta: topografía tumor primitivo, topografía metástasis, nivel de marcadores tumorales. La clasificación internacional de riesgo del International Germ Cell Cancer Collaborative Group (IGCCCG) es la siguiente: TGNS SEMINOMA RIESGO BUENO Primario testicular o Cualquier valor HCG (todos presentes) retroperitoneal No met. viscerales No met. viscerales extrapulmonares extrapulmonares AFP<1.000 Cualquier topografía primario ng/ml HCG<5.000 mU/ml LDH<1,5 lim. sup. normal RIESGO INTERMEDIO Primario testicular o Cualquier valor HCG retroperitoneal Si met. viscerales No met. viscerales extrapulmonares extrapulmonares AFP1.000- Cualquier topografía primario 10.000 ng/ml 182 HCG 5.000-50.000 mU/ml LDH1,5-10 lim. sup. normal RIESGO POBRE AFP>10.000 ng/ml No aplicable (al menos 1 HCG > 50.000 mU/ml presente) LDH >10 lim. sup. normal Si met. viscerales extrapulmonares Primario mediastinal RIESGO BUENO RIESGO INTERMEDIO RIESGO POBRE % pac. al diag/SV a 5 a. % pac. al diag/SV a 5 a. % pac. al diag/SV a 5 a. TGNS 60% / 90-95% 26 % / 80% 14 % / 48% SEMINOMA 90% / 90-95% 10% / 70-80% No aplicable III) TRATAMIENTO DEL SEMINOMA SEMINOMA ESTADIO I Existen 3 opciones de manejo postorquiectomía para el seminoma estadio I: 1. Radioterapia paraaórtica ilíaca 2. Quimioterapia con Carboplatino AUC 7 x l serie 3. Seguimiento exclusivo sin tratamiento Para la decisión terapéutica deben considerarse fundamentalmente: Preferencias del médico tratante y del paciente Morbilidad aguda y tardía de los tratamientos Posibilidades institucionales y compromiso del paciente con el seguimiento clínico-imagenológico y humoral a largo plazo. Tener en cuenta que los pacientes que reciben RT son los que requieren un seguimiento menos intensivo mientras que en los que se elige el Seguimiento exclusivo se requiere un seguimiento clínico-imagenológico más intenso. Adicionalmente puede considerarse: Riesgo recidiva sin tratamiento. Este riesgo es globalmente de un 15-20%. Los factores de riesgo de riesgo recidiva retroperitoneal en el seminoma estadio I son: tamaño tumor 4cm e invasión rete testis. En ausencia de estos factores, el riesgo de recidiva es aprox. 15%, en presencia 183 de ambos es aprox. 30%. En caso de seguimiento, el esquema de seguimiento sugerido es: Años 1-3 Años 4-7 Años ≥8 HC y EF 3-4 m 6m Anual AFP, βHCG, LDH 3-4 m 6m Anual TAC abd-pelvis 3-4 m 6m Anual Rx tórax 3-4 m 6m Anual En los pacientes con seminoma estadio I que recaen luego del tratamiento o durante el seguimiento, el tratamiento de la recidiva es en función de la extensión de la misma. Pueden recibir RT (en caso de recidiva retroperitoneal exclusiva) o PQT (PEBx3 o EPx4 o PEBx4 según el riesgo) SEMINOMA ESTADIO IIA-B (no bulky) El tratamiento estándar postorquiectomía es la RT a nivel lumboaórtica e ilíaca. Puede considerarse la quimioterapia (EPx4 o PEBx3) en pacientes seleccionados con contraindicaciones para la RT o que no deseen recibirla. SEMINOMA ESTADIOS IIC y III Pacientes de riesgo bajo: PEB x 3 o EP x 4 Pacientes de riesgo intermedio: PEB x 4 IV) TRATAMIENTO DE LOS TUMORES GERMINALES NO SEMINOMATOSOS (TGNS) TGNS ESTADIO I A-B Existen 3 opciones de manejo postorquiectomía para los TGNS estadio I A-B: 1. Poliquimioterapia (PEB x 2) 2. Seguimiento exclusivo sin tratamiento 3. Linfadenectomía retroperitoneal 184 Las opciones 1 y 2 son las más empleadas en nuestro medio. Para la decisión terapéutica deben considerarse: Riesgo recidiva sin tratamiento. Este riesgo es globalmente de un 30%. Los factores de riesgo de riesgo recidiva retroperitoneal en los TGNS estadio I son: invasión vásculo-linfática (el factor de mayor impacto), carcinoma embrionario 50%, ausencia de tumor saco vitelino, ausencia de teratoma. En ausencia de estos factores, la tasa de recidiva a 2 años es del 0%, con 1 factor 10%, 2 factores 25% y 3-4 factores 60%. el riesgo de recidiva es aprox. 15%, en presencia de ambos es aprox. 30%. Posibilidades institucionales y compromiso del paciente con el seguimiento clínico-imagenológico y humoral a largo plazo. Morbilidad aguda y tardía de los tratamientos En ausencia de factores de riesgo recidiva, considerar firmemente la posibilidad de seguimiento en pacientes comprometidos. En presencia de factores de riesgo recidiva, cualquiera de las opciones son viables, prefiriéndose la PQT o el seguimiento. En caso de realizarse linfadenectomía retroperitoneal, se recomienda PQT (PEBx2) en caso pN2-3. En caso de seguimiento, el esquema de seguimiento sugerido es: Año 1 Año 2 Año 3 Año 4 Año 5 Año 6 HC y EF 1-2 m 2m 3m 4m 6m Anual AFP, βHCG, 1-2 m 2m 3m 4m 6m Anual 2-3 m 3-4 m 4m 6m Anual Anual 1-2 m 2m 3m 4m 6m Anual LDH TAC abd- pelvis Rx tórax TGNS ESTADIO IS PQT: EP x 4 o PEB x 3 TGNS ESTADIO IIA-B (no bulky) En caso de: 185 MT postorquiectomía elevados: PQT (PEB x 3-4 o EP x 4; elección en función del riesgo determinado por el nivel de elevación MT). MT postorquiectomía normales: PQT (PEB x 3 o EP x 4). En casos seleccionados puede considerarse la linfadenectomía retroperitoneal seguida o no de PQT en función del estadio pN. TGNS ESTADIO IIC y III Pacientes de riesgo bajo: PEB x 3 o EP x 4 Pacientes de riesgo intermedio/alto: PEB x 4 Consideraciones: ‐ La eficacia del carboplatino es inferior a la del cisplatino ‐ El plan PEB estándar es el de administración en 5 días. Puede considerarse la utilización de PEB en 3 días (ver esquema al final del capítulo); su eficacia es similar a la del plan en 5 días pero la toxicidad aguda es mayor La eficacia el plan VeIP es similar a la del PEB pero tiene ‐ mayor mielotoxicidad. Puede considerarse en casos que desee evitarse la toxicidad pulmonar de la bleomicina. No se recomienda administrar más de 4 series de PQT. En ‐ caso de persistencia MT elevados post-4ª serie línea. En caso de MT normales post-4ª serie PQT 2ª cirugía (ver abajo) V) MANEJO DE LAS MASAS RESIDUALES POST-QUIMIOTERAPIA SEMINOMA La histología de las masas residuales en el seminoma es: fibrosis/necrosis en 70-85% de los casos, tumor residual en 15-30% de los casos. El manejo sugerido es: Masa residual menor de 3 cm: seguimiento imagenológico Masa residual mayor o igual a 3 cm: cirugía de resección de masa residual. Si se dispone de la posibilidad de realizar PET scan debe realizarse a las 6 semanas de culminada la QT: en caso de positividad se sugiere la 186 cirugía de resección; de ser negativo se sugiere el seguimiento imagenológico. TGNS La histología de las masas residuales en los TGNS es: fibrosis/necrosis en 50% de los casos, teratoma en 35% y tumor residual en 15% de los casos. El manejo de las masas residuales depende del nivel de MT postquimioterapia: MT elevados: QT segunda línea (VeIP, TIP, QT altas dosis) MT normales: cirugía de resección de todas las masas residuales. No existe característica clínica, patológica o paraclínica que prediga con certeza la histología de las masas residuales post-QT por lo que el seguimiento imagenológico no es una conducta estándar. En caso de masas residuales abdominales y torácicas, la discordancia histológica entre una y otra se ve en el 3060% de los casos. La conducta estándar es la resección de todas las masas residuales pero los hallazgos del retroperitoneo podrían guiar la conducta respecto al tórax; es decir que en caso de hallazgo de necrosis en retroperitoneo podría considerarse el seguimiento imagenológico de las masas torácicas. Por el contrario, la histología de las masas torácicas no es predictora de la del retroperitoneo. En caso de hallazgo de tumor viable a nivel de las masas residuales: QT consolidación (EP x 2 series). VI) QUIMIOTERAPIA DE RESCATE Las opciones de QT de rescate incluyen: QT a dosis estándar QT a altas dosis (QTAD) 187 Los factores asociados a una baja probabilidad de respuesta a la QT a dosis estándar son: ‐ respuesta incompleta o enfermedad progresiva con la QT 1ª línea ‐ tumor primario mediastinal ‐ elevación significativa AFP y HCG (si bien no existe una definición precisa puede considerarse como cutt-off 100 U/L) En los pacientes con estos factores de riesgo debe considerarse fuertemente la QTAD en la 2ª línea de tratamiento, la cual se asociaría a mayor probabilidad de cura que la QT a dosis estándar. En pacientes sin estos factores de riesgo las opciones incluyen la QT a dosis estándar (de elección) o la QTAD. Los planes de QT de rescate a dosis estándar sugeridos son: VeIP (Vinblastina, Ifosfamida, Cisplatino) TIP (Paclitaxel, Ifosfamida, Cisplatino) La QTAD es también la opción preferida en pacientes con respuesta incompleta o que recaen luego de la QT de segunda línea a dosis estándar. Uno de los planes de QTAD de elección es: Carboplatino 700 mg/m2 Días -5 a -3 + Etopósido 750 mg/m2 Días -5 a -3 x 2 series. Las opciones de QT a dosis estándar para la 3ª o sucesivas líneas son: Gemcitabina monodroga o en combinación con Paclitaxel Oxaliplatino monodroga o en combinación con Gemcitabina o Irinotecán Otras combinaciones 188 VII) SEGUIMIENTO POST-TRATAMIENTO SEMINOMA Estadios I-II tratados con RT Año 1 Año 2 Año 3 HC y EF 3-4 m 6m Anual AFP, βHCG, LDH 3-4 m 6m Anual TAC abdomen Anual Anual Anual 3-4 m 6m Anual (+ pelvis en pacientes que no recibieron RT ilíaca) Rx tórax Estadios II-III tratados con PQT Año 1 Año 2 Año 3 Año 4 Año HC y EF 2m 3m 4m 6m Anual AFP, βHCG, 2m 3m 4m 6m Anual 2-3 m 3-4 m 4m 6m Anual 2m 3m 4m 6m Anual 5 LDH TAC abd- pelvis Rx tórax TGNS (post-quimioterapia o linfadenectomía RP) Años 1-2 Año 3-4 Año 5 Año 6 HC y EF 2-3 m 4m 6m Anual AFP, βHCG, 2-3 m 4m 6m Anual 6m 12 m 12 m Anual 2-3 m 4m 6m Anual LDH TAC abd- pelvis Rx tórax VIII) PLANES DE QUIMIOTERAPIA EP: ETOPÓSIDO-CISPLATINO Etopósido 100 mg/m2 IV D1 al D5 189 Cisplatino 20 mg/m2 IV D1 al D5 Cada 21 días PEB: CISPLATINO-ETOPÓSIDO-BLEOMICINA Etopósido 100 mg/m2 IV D1 al D5 Cisplatino 20 mg/m2 IV D1 al D5 Bleomicina 30 U D1, D8 y D15 Cada 21 días VeIP: VINBLASTINA-IFOSFAMIDA-CISPLATINO Vinblastina 0,11 mg/kg IV D1 y D2 Ifosfamida 1200 mg/m2 IV D1 al D5 Cisplatino 20 mg/m2 IV D1 al D5 Cada 21 días TIP: PALCITAXEL-IFOSFAMIDA-CISPLATINO Paclitaxel 250 mg/m2 IV D1 Ifosfamida 1500 mg/m2 IV D2 al D5 (+ Mesna) Cisplatino 25 mg/m2 IV D2 al D5 Cada 21 días 190 CANCER DE VEJIGA I) DIAGNOSTICO Y ESTADIFICACION Diagnóstico Anamnesis y exámen físico. Cistoscopía con biopsia - de zona sospechosa - a cada lado de orificios ureterales - de línea media posterior - del domo - de la uretra prostática Urografía de Excreción. TAC de abdómen y pelvis. Exámen de orina completa con PAP. Urocultivo con antibiograma. Rx Tx (F y P). Func. y Enz. Hepático. Centello Oseo: si sintomatología osteoarticular, hipercalcemia, ó Fosfatasa Alcalina elevada. Hemograma. VES. Creatininemia, Azoemia. Clearence de creatinina. Calcemia. Estadificación por estadios Se ha usado la clasificación TNM y otras TNM: Marshall-Jewet T0 no hay tumor Tx no se puede encontrar Tu Ta tumor papilar, no invasivo Tis Ca in situ T1 Tu que invade submucosa 0 A T2 Tu que llega a capa muscular 191 T2a capa interna B1 T2b capa externa B2 T3 Tu que invade grasa perivesical T3a microscópica C T3b macroscópica C T4 evadido a otros órganos T4a próstata, utero, vagina D1 T4b evadido a pelvis (pared peviana y abdominal) D1 N0 no ganglios Nx no se conoce status ganglionar N1 1 ganglio menor de 2 cm N2 + de 1 ganglio menor de 2 cm o ganglios 2-5cm N3 ganglios mayores de 5cm Para Jewett ganglios= D1 (metastásico) M0 no metástasis Mx no se puede evaluar met M1 metástasis D2 ESTADÍOS E0a: TaNOMO E0is: Tis NOMO E I: T1N0 M0 E II T2N0 M0 E III T3 N0 MO T4a NOMO E IV T4b Cualquier N + M+ La distinción más importante: superficial (E 0,I) o invasivo (II,III). Importancia pronóstica. Sobrevida a 5 años de: Estadio 0-I 80 %, Estadio II 70 %, Estadio III 35-50% y Estadio IV 10-20 %. La clasificación omite la importancia del GH para los Tu superficiales: Alto grado (AG) tienen peor pronóstico que Bajo Grado (BG). 192 II) TRATAMIENTO CARCINOMA SUPERFICIAL La RTU es la base del tratamiento de los tumores superficiales y debe valorarse en su indicación el tamaño, número, presencia de CIS, grado histológico, variedad papilar o sólido de estas lesiones. En el estadío Ta único, de bajo grado, sin áreas de Cis en los alrededores, una RTU sola consigue la resección total de 70 % de las lesiones, con 90 % de sobrevida a 5 años. Presentan recaídas en el 20 % de los casos y solo 4% con progresión a carcinoma invasor por lo que se plantea control con cistoscopía a los 3 meses y anual hasta los 5 años. En los casos de Ta de alto grado histológico, Ta múltiples, lesiones endoscópicamente irresecables, Tis, estadio I (tienen recaídas de 30-80 % con RTU sola) y los pacientes tratados con RTU que presentan: 3 o más recurrencias, una recurrencia antes del año de la RTU, se benefician de un tratamiento intravesical, se plantea tratamiento intravesical con BCG. En estos casos el seguimiento inclurá una cistoscopía cada 3 meses en los primeros 2 años, cada 4 meses durante el tercer año, cada 6 meses por 2 años y luego anualmente. Se debe esperar 7-14 días después de la RTU para disminuir complicaciones. El tratamiento intravesical penetra unas pocas capas de células y por esto solo es adecuado para los tumores superficiales. Para el Tis esta modalidad combinada de tratamiento muestra un 70% de sobrevida libre de enfermadad a 1 año, y 40% a los 10 años (aumenta el intervalo entre recurrencia en 50 % y baja la tasa de progresión en 5-10 %). El BCG intravesical produce un 70 % de remisiones completas en el carcinoma in situ y con ello disminuye las cistectomías de rescate. Asimismo, en el estadio I presenta un 80 % de sobrevida a los 5 años y reduce 40 % el riesgo de progresión a estadíos avanzados. Los pacientes que presenten un tumor T1 en la evaluación a los 3 meses después de un curso de 6 semanas de BCG inravesical y los pacientes con Tis persistente después de un segundo curso de 6 semanas de BCG, tienen alto riesgo de desarrollar enfermedad muscular invasiva y deben ser considerados para cistectomía. 193 Un estudio aleatorio que comparó BCG i/v y s/c con Doxorubicina i/v mostró mejores tasas de respuesta y SLE con el regimen de BCG para tumores papilares recurrentes así como también para el Tis. Un estudio aleatorio sueco-noruego comparó MMC y BCG i/v durante 2 años, no encontrando diferencias en la progresión de la enfermedad, así como de la sobrevida general a 5 años. Otros fármacos (Adriamicina, Tiothepa) han sido ensayados en instilación intravesical no mostrando mejores resultados que el BCG. El tratamiento con BCG intravesical puede presentar los siguientes efectos secundarios: cistitis, disuria y en un complicacines sistémicas como fiebre, sepsis, tuberculosis, coagulación intravascular diseminada e hipertensión arterial. La hipersensibilidad podría explicar parte de las complicaciones. Contraindicaciones para su uso: Inmunodepresión, antacedetes personales de tuberculosis. En suma, opciones de tratamiento para Ca no invasor: Estándar RTU con fulguración. RTU con fulguración después de BCG i/v. BCG es el tratamiento de elección para Tis. RTU con fulguración después de QT i/v. Cistectomía por segmentos (rara vez indicada). Cistectomía radical en pacientes seleccionados con tumor superficial extenso o refractario. Implante intersticial de radioisótopos con o sin irradiación de haz externo (sólo para T1). Luego de RTU Grupo A: Tumor Papilar único. Recidiva tardía (luego de 1-2 años) 194 Grupo B: Tumor Papilar grado III. Tu. múltiple. Ca. in situ. Recidiva precoz (12 meses ó menos). Respuesta previa exitosa a la QT por ca. de vejiga. - QT Intravesical: 1° 1ínea: BCG. 2° línea: Adriamicina. 3° línea: Mitomicina C. BCG: presentación: frasco ampolla 0.25 mg/ml (contiene 0.8 ml) 0.50 mg/ml (contiene 1.6 ml) 30 Frasco ampolla mg/ml (contiene 1.6 ml) Vol. c/amp. Unidades formadoras de colonias 0.25 mg/ml 0.8 ml 3.5 x 10 6 ml 0.50 mg/ml 1.6 ml 8.0 x 10 6 ml 30 1.6 ml 500 x 10 6 ml mg/ml Equivalentes del BCG: Instituto Pasteur Laboratorio Calmette 30 mg/ml 30 mg/ml 3 - 5 x 10 6 mg/ml 30 x 10 6 ml Precauciones: - Duración un mes a partir de la fecha de producción. - Proteger de la luz solar. - Agitar suavemente antes de usar. Formas de administración BCG Un frasco de 30 mg/m2 diluído en 60 cc de suero fisiológico intravesical. Permanencia: 60 minutos. Rotando decúbitos cada 15 minutos. 195 Este tratamiento se realiza: 1 vez x semana x 6 semanas y luego mensualmente x 6 meses. Adriamicina 60 mg en 60 cc de suero fisiológico a retener, intravesical. Permanencia: 60 minutos. Tratamiento: 1 vez x semana x 6 semanas y luego mensualmente x 6 meses. CARCINOMA INVASOR Estos tumores no pueden tratarse con tratamiento intravesical, y las opciones de tratamiento local oncológicamente adecuadas son la cistectomía radical y la RT radical. Con tratamientos locales la sobrevida a 5 años es de 30 % en Estadio IIIII. Por ser la causa de muerte la enfermedad diseminada oculta al momento de la operación se puede administrar tratamiento quimioterápico complementario. La cistectomía radical es el tratamiento estándar para el Carcinoma invasor estadio II-III. En algunos informes la RTU+RT+QT obtiene 50 % de ILE a 3-4 años. La cistectomía radical fue reservada para los pacientes que no obtuvieron una RC. Algunos autores piensan que el pronóstico es peor para los pacientes con hidronefrosis en el pielograma i/v inicial, no siendo candidatos para el tratamiento conservador. El tratamiento con QT y RT concurrente ha sido asociado con mejores tasas de control local comparado con series históricas de pacientes tratados con RT exclusiva. La única comparación aleatoria prospectiva entre RT y QT reportó una mejor tasa de control local cuando se administró CDDP concurrente a la RT. Cirugía 196 La cistectomía radical incluye: vejiga, próstata, vesículas seminales. En mujer: vejiga, útero, trompas, ovarios, pared anterior de vagina y uretra. Se acompaña de biopsia extemporánea de los ganglios de drenaje, pues en al caso de confirmar metástasis se suspende la operación en tanto el mal pronóstico del compromiso gnglionar no justifica la morbilidad de la cixtectomía. Se construye una neovejiga con asa de Intestino delgado (ID) o colon y se abocan de forma ortotópica (uretra o a esfínter anal) o heterotópica (pared abdominal o periné). Presenta un 5% de mortalidad. Además de ñas potenciales complicaciones de la anestesia, operatorias y de la neovejiga, pueden observarse otras como: incontinencia (> de 75 % la supera luego), impotencia (75% recupera la potencia antes del año), alteraciones metabólicas (acidosis hiperclorémica), IUA, más frecuente que la población general por el reflujo. A veces precisan cobertura ATB. La cistectomía parcial es un procedimiento que intenta conservar la vejiga. Puede realizarse ante: -tumor único -bajo grado histológico -no asocia Cis -resección permite margen de 2 cm -ubicación en trígono y cuello son CI relativas por lo anterior En estos casos seleccionados algunos estudios muestran resultados comparables a la cirugía radical. Radioterapia La Rt radical puede ser alternativa a la cistectomía. En algunos centros es el procedimiento estándar. Efectos secundarios de la RT: cistitis, proctitis. Como único tratamiento la radioterapia puede presentar hasta un 45% de remisiones completas, pero alta chance de recurrencia con progresión (30 %). La RTU+RT+QT sería el mejor tratamiento conservador de vejiga (Cisplatino 70 mg/m2 cada 21 dias 0 30.40mg/m2 semanal concomitante a la radioterapia de hasta 45 Gy). En los que no responden y puede plantearse la cistectomía radical no se observa disminución sobrsvida global. 197 Recaen con tumores superficiales en un 20-30 %. No esta indicda en pacientes con hidronefrosis. La sobrevida a 5 años es de 50 %; 40 % con vejiga funcionando mas probable en T2 y T3a. En suma, opciones de tratamiento para cáncer invasor (estadio II y III). Estándar Cistectomía radical con o sin disección de los ganglios linfáticos pelvianos. Irradiación de haz externo (candidatos no quirúrgicos y casos seleccionados). Implantación instersticial de radioisótopos antes o después de RT externa. RTU con fulguración (en ptes. seleccionados de E II). Cistectomía segmentaria (en ptes. seleccionados). RT externa concurrente con CDDP. En evaluación clínica Ensayos clínicos múltiples están evaluando el potencial de la QT administrada previa a la cistectomía, después de la cistectomía o concurrente a la RT externa para mejorar el control local de los tumores, prevenir metástasis a distancia o permitir la preservación de la vejiga. El régimen M-VAC produjo un 20 % de RCp en pacientes tratados previo a la cirugía. Sin embargo no hay evidencia que la QT neoadyuvante con CDDP o basada en CDDP prolongue la sobrevida de los pacientes con cáncer localmente avanzado de la vejiga. En un ensayo clínico con preservación de la vejiga con RT externa y QT, dos ciclos de QT tipo CMV no mejoran el control local, porcentaje de metástasis y sobrevida general con respecto a la RT externa y CDDP concurrente. Quimioterapia En el caso de pacientes operados y con esadios patológicos II con invasión linfovascular hasta IV (T3a y/o N+ y M0) puede cosiderarse el uso de quimioterapia adyuvante en base a M-VAC. Algunos centros aconsejan Cisplatino-Gemcitabine aunque no existen trabajos que este plan de elección en enfermedad diseminada sea mejor que la referencia en el set de adyuvancia. 198 La quimioterapia neoadyuvante puede plantearse en pacientes que con diagnóstico confiramado por RTU se presenten en estadios T2-4 y/o N+ con M0. Dos estudios con un número importante de pacientes incluidos en cada uno, demostraron la utilidad en términos de sobrevida de planes de quimioterapia como M-VAC y CMV respectivamente utilizados previo a la cistectomía. En uno de ellos se demostró también el valor pronóstico de contar con un cirujano especializado y entrenado en cistectomías por lo que sin duda es aconsejable el manejo de esos pacientes en el marco de comité de tumores desde el diagnóstico. La quimoterapia neoadyuvante puede generar los siguientes beneficios al reducir tumor: Facilitar la resección completa patológica. Favorecer el tratamiento conservador de vejiga (cistectomía parcial o Rt) en est II, con tumres pequeños (hasta en 58 % se puede conservar la vejiga). Luego de tratamiento Qt estándar, 45 % muestra disminución de tamaño tumoral y aproximadamente el 23 % está libre de tumor en la cirugía. No debe plantearse quimioterapia neoadyuvancia en las variedades histológicas adenocarcinoma y epidermoide. CANCER METASTASICO (estadio IV) (T4b, N0, M0, cualquier T, N1-N3, M0, o cualquier T, cualqier N, M1) Actualmente sólo puede curarse una fracción pequeña de pacientes con cáncer de la vejiga en estadio IV. El potencial curativo se limita a pacientes con enfermedad en etapa IV con complicación de órganos pelvianos mediante extensión directa o metástasis de poco volumen a los ganglios linfáticos regionales. Puede indicarse desviación urinaria, no sólo para fines paliativos de los síntomas urinarios, sino también para la preservación de la función renal en los candidatos a QT. M-VAC y CMV constituyen dos esquemas clásicos de quimioterapia en enfermedad diseminada performance-status. La en pacientes combinación seleccionados con Cisplatino-Gemcitabine buen ha 199 mostrado en un estudio randomizado igual beneficio que M-VAC en términos de sobrevida pero con una mejor tolerancia y calidad de vida por lo que resulta el plan de elección en el momento actual. El M-VAC si bien no fue comparado a CMV, los resultados serían similares tanto en respuesta como en sobrevida. El régimen de paclitaxel y carboplatino ha demostrado ser activo y bien tolerado, con respuestas objetivas del 50 % en estudios de Fase II. Esquemas de quimioterapia CDDP: 40 mg/m2 semanal asociado a RT CDDP: 70-100 mg/m2 cada 14-21 días asociado a RT M-VAC: MTX: 30 mg/m2 D1, 15 y 22 VBT: 3 mg/m2 D2, 15 y 22 ADR: 30 mg/m2 D2. CDDP: 70 mg/m2 D2. Cada 28 días CMV: CDDP: 100 mg/m2 MTX: 30 mg/m2 VBT: 3 mg/m2 Cada 21-28 días Gemcitabine/CDDP: GCTBINE: CDDP: 1250 mg/m2 i/v días 1 y 8 75 mg/m2 i/v día 1 Cada 21 días Paclitaxel/Carboplatino PAC: 175 mg/m2 i/v CBP: (AUC: 5-7) i/v Cada 21-28 días 200 2009 I. MELANOMA CUTANEO DIAGNOSTICO Y ESTADIFICACION Diagnóstico positivo. Frente a una lesión pigmentada sospechosa se debe realizar la biopsia quirúrgica excisional con margen de 1-3 mm (el margen quirúrgico definitivo depende del espesor tumoral por lo que se recomienda la exéresis quirúrgica en dos tiempos). Cuando se trata de lesiones muy grandes o en ciertas localizaciones como la cara, la biopsia incisional puede ser aceptable. Diagnóstico de extensión lesional - Anamnesis y examen físico - Estudio anátomo-patológico de la biopsia: además de confirmar el diagnóstico positivo permite determinar el espesor tumoral de Breslow que junto con la ulceración son las principales características pronósticas del tumor primario en pacientes con melanoma localizado (estadios I y II). El nivel de Clark tiene valor pronóstico en los pacientes con lesiones de espesor menor a 1 mm. El índice mitótico parece tener valor pronóstico independiente. - El resto de los estudios dependerá de la estadificación clínica (American Joint Committe on Cancer, AJC, 2002). Estadios I y II RxTx (opcional) Si no esta indicada la biopsia del ganglio linfático centinela (BGC) no se recomiendan estudios adicionales, salvo los indicados para evaluar síntomas y signos específicos. En caso de indicarse la BGC y ser positiva se recomiendan los mismos estudios que para los pacientes con estadio clínico III. Estadio III: compromiso ganglionar (clínico o por BGC positiva) o metástasis en tránsito Punción citológica confirmatoria del compromiso regional. TAC Tórax y Abdomen y TAC de cuello o pelvis en caso de primario en cabeza y cuello o MMII respectivamente (+/- RNM, +/- PET CT). Funcional y enzimograma hepático con LDH 201 Estadio IV y recaídas En caso de lesión única o lesiones dudosas: punción citológica o biopsia quirúrgica confirmatoria de enfermedad metastásica. TAC de abdómen y pelvis +/- RNM de cráneo +/- Centellograma óseo y BMO en caso de síntomas o signos que lo justifiquen Funcional y enzimograma hepático con LDH PET/CT: Puede detectar lesiones subclínicas, caracterizar lesiones dudosas por otros estudios imagenológicos y permite evaluar áreas del cuerpo no estudiadas específicamente por la tomografía de tórax, abdomen, pelvis y cráneo. No se recomienda para el diagnostico inicial de metástasis ganglionares ya que tiene menor sensibilidad que la biopsia del ganglio centinela. Tampoco se recomienda para el estudio de los pacientes con enfermedad localizada (estadios I-IIB) por su baja sensibilidad para la detección de metástasis. Se recomienda en pacientes con estadio IIC-III en caso de lesiones indetermindadas por TAC o en pacientes con enfermedad avanzada cuando la detección de enfermedad metastásica cambie la conducta quirúrgica (ej: previo al vaciamiento ganglionar en recaídas locorregionales o a la resección de enfermedad metastásica limitada). Biopsia del ganglio centinela El estado de los ganglios linfáticos regionales constituye el factor pronóstico más importante en lo que hace a la sobrevida melanoma-especifica. En pacientes sin evidencia clínica de compromiso ganglionar regional ni a distancia y con una probabilidad significativa de compromiso ganglionar subclínico debe realizarse la biopsia del ganglio centinela (BGC). La misma está formalmente indicada cuando el espesor de Breslow es entre 1 y 4mm y previo a la ampliación de márgenes ya que luego de la misma la validez de la BGC se desconoce. No se dispone de datos concluyentes sobre el valor de la biopsia del ganglio 202 centinela en pacientes con melanomas de espesor menor a 1 mm o mayor a 4 mm. Cuando el espesor de Breslow es menor a 1 mm se toman en cuenta los factores que predicen una mayor probabilidad de compromiso ganglionar, En función de estos se recomienda: 1.- su realización cuando se trata de tumores ulcerados (Tb) o con índice de Clark de IV o V. 2.- considerar su realización cuando se asocian los siguientes factores de pronóstico adverso: - Breslow > 0.75mm - índice mitótico mayor a 5 por mm2 - invasión linfovascular - márgen profundo positivo - paciente joven Aproximadamente en el 30-40% de los pacientes que presentan melanomas localizados con espesor de Breslow superior a 4 mm la BGC resulta positiva. En este grupo de pacientes el resultado de la BGC constituye un importante factor pronóstico por lo que podría considerarse su realización. Si el ganglio centinela es negativo por técnica de hematoxilina y eosina debe realizarse inmunohistoquímica. ESTADIFICACION CLINICA Y PATOLOGICA: según la American Joint Committe on Cancer, AJC, 2002. Estadificación TNM (ver al final) II. TRATAMIENTO DEL MELANOMA ESTADIO I-III Exéresis quirúrgica de la lesión primaria con márgenes apropiados En general, luego de la biopsia exéresis y en función del espesor de Breslow, se requiere la ampliación de márgenes. En caso de indicarse la BGC, la misma puede realizarse en el mismo acto quirúrgico precediendo a la ampliación de los márgenes. Márgenes quirúrgicos recomendados Tumor in situ : 5 mm Tumor invasivo; - espesor < 1 mm : 1 cm 203 - espesor 1-4 mm: 2 cm (1-2 cm puede ser aceptable en zonas - anatómicamente o funcionalmente difíciles) >4 mm: 2cm (1-2 cm puede ser aceptable en zonas anatómicamente o funcionalmente difíciles) Si no es posible establecer espesor (ulceración franca o signos de involución): 2 cm de margen De ser necesario recurrir a un injerto de piel o colgajo para no sacrificar margen. El márgen profundo debe incluir tejido subcutáneo hasta la fascia subyacente. Vaciamiento ganglionar de la región ganglionar comprometida Está formalmente indicado en los pacientes con compromiso clínico de los ganglios linfáticos regionales (estadio III clínico). Se recomienda en los pacientes con BGC positiva, sabiendo que el impacto sobre la sobrevida observado en un estudio reciente no ha sido confirmado en estudios clínicos randomizados diseñados para dar respuesta a esta interrogante. Tratamiento sistémico adyuvante El tratamiento adyuvante ha sido evaluado fundamentalmente en los pacientes con melanoma estadio IIB /C y III debido al alto riesgo de recaída y muerte luego de la cirugía. (Mortalidad a 5 años del estadio IIB/C : 30-50% y 40-70% para el estadio III ) Al menos 25 estudios randomizados han investigado terapias adyuvantes con quimioterapia, inmunoestimulantes no específicos ,(Bacilo Calmette Guérin y el Levamisol), vacunas e interferón gamma sin resultados favorables. El interferón alfa es la única estrategia de tratamiento que en forma consistente ha demostrado al menos un beneficio en sobrevida libre de enfermedad, modesto en magnitud (~ 5-10%) aunque sin beneficio significativo en la sobrevida global. Este escaso beneficio sumado a la toxicidad asociada a muchos de los planes evaluados, hacen que el interferón alfa constituya más que un tratamiento estándar una opción a la observación 204 exclusiva. Otra opción es incluir a estos pacientes en estudios clínicos de investigación. El interferón alfa ha sido evaluado en pacientes con alto riesgo de recaída (estadios IIB – III ) a dosis altas, intermedias , bajas y muy bajas mientras que en el estadio II han sido evaluadas las dosis bajas. El interferón alfa2b a altas dosis administrado por el plazo de un año ha demostrado aumentar la sobrevida libre de enfermedad en el estadio III (aproximadamente 10% de beneficio absoluto) sin beneficio en la sobrevida global a expensas de una toxicidad elevada. Altas dosis de Interferón alfa2b : 20 MUI/ m2 intravenoso durante 5 días por 4 semanas seguidos de 10 MUI /m2, 3 veces x semana, durante 11 meses. Las dosis intermedias de interferón alfa2b administradas por el plazo de 2 años han demostrado otorgar beneficio en sobrevida libre de enfermedad para el estadio IIB, sin beneficio en la sobrevida global, y a expensas de una toxicidad aceptable. En este estudio de dosis intermedias se comparó el tratamiento administrado por un año (10 MU s/c 5 x/sem seguido de 10 MU s/c 3x/sem x 1 año ) con el tratamiento por dos años (10MU s/c 5 x sem x 1 mes seguido de 5 MU s/c 3 x sem x 2 años) vs observación para el estadio IIB y III demostrándose el beneficio en sobrevida libre de enfermedad con la administración más prolongada. Basados en la hipótesis de que un tratamiento más prolongado pudiera ser más efectivo el mismo grupo de investigación evaluó el beneficio de administrar Interferón alfa2b pegilado por 5 años vs observación en pacientes con melanoma maligno resecado estadio III. El beneficio en sobrevida libre de enfermedad es similar al obtenido en otros estudios con interferon alfa adyuvante (con dosis altas e intermedias), sin beneficio en la sobrevida global. El tratamiento tuvo un impacto negativo en la calidad de vida de los pacientes que recibieron el interferón pegilado como lo muestra un estudio de calidad de vida fase III recientemente publicado. Dosis de IFN pegilado: 6 ug/kg/sem s/c x 8 sem seguido de 3 ug/kg/sem x 5 años Existen al menos 4 estudios randomizados publicados hasta el 2004 que evalúan las dosis bajas (alfa2b y alfa2a) en pacientes con tumores estadios IIB y III (mayoritariamente estadio III) y uno con dosis muy bajas (interferón alfa2b 205 e interferón gamma) que no muestran resultados favorables. Sin embargo en el 2008 un grupo alemán publica los resultados de un estudio con 444 pacientes que compara el Interferon alfa2a a dosis bajas (3 MU s/c 3 x sem x 2 años) con o sin Dacarbazina vs observación que muestra con un seguimiento de 4 años un beneficio significativo en la sobrevida global (HR 0.62 IC 0.42-0.89) y sobrevida libre de enfermedad (HR 0.69 IC 0.49-0.96) con el interferon a dosis bajas. En este estudio el brazo de tratamiento de interferon concurrente con quimioterapia no mostró diferencias con la observación y plantearía la hipótesis, según los autores, de que la Dacarbazina revertiría el beneficio del interferón. El mismo grupo de investigación previamente había publicado un estudio fase III con 252 pacientes evaluando 2 ciclos de Dacarbazina (850mg/m2) seguido de Interferon humanizado alfa a dosis bajas por 6 meses (3 MU/m2 s/c 3 x sem). Si bien se reporta para estadios IIb y III un beneficio en la sobrevida global (RRR de muerte del 40%), un análisis detallado del mismo muestra que estos resultados favorables est en un análisis retrospectivo de un subgrupo no planeado. Se plantea como hipótesis que este beneficio estaría dado por el uso del interferon humanizado y que la Dacarbazina utlizada no en forma concurrente con el interferon pudiera aportar algún beneficio adicional. Son necesarios estudios fase III prospectivos para confirmar estos resultados. Con respecto al estadio II (IIA/IIB) existen dos estudios, uno francés y otro austríaco, publicados en 1998 que muestran que las dosis bajas de interferón alfa2a (3 MU s/c 3 x sem x 2 años) aumentan la sobrevida libre de enfermedad con baja toxicidad , sin beneficio en la sobrevida global. Las dosis bajas de interferón alfa2a constituyen una opción de tratamiento en algunos países europeos para el estadio II. Conclusiones: No existe un tratamiento adyuvante estándar para el melanoma maligno estadios II y III .Las opciones son: observación, incluir al paciente en un estudio clínico u ofrecer un tratamiento con interferón alfa, sabiendo que el beneficio demostrado en forma consistente es en sobrevida libre de enfermedad (5-10%) No hay consenso en cuanto a la dosis de interferón y el tiempo de administración más apropiado. Planes de Interferón alfa que han demostrado algún benefico en sobrevida libre de enfermedad: 206 Estadio IIA/B: Dosis bajas: INF alfa2a 3 MU 3 x sem x 12-18 meses. Estadio IIB: Dosis intermedias: INF alfa2b 10MU s/c 5 x sem x 1 mes seguido de 5 MU s/c 3 x/sem x 2 años Estadio III Altas dosis : INF alfa2b 20 MUI/ m2 intravenoso durante 5 días por 4 semanas seguidos de 10 MUI /m2, 3 veces x semana, durante 11 meses INF pegilado alfa2b: 6 ug/kg/sem s/c x 8 sem seguido de 3 ug/kg/sem x 5 años Dosis bajas: INF alfa2a 3 MU s/c 3 x sem x 2 años Planes de Interferon alfa que han demostrado algún benefico en sobrevida : Estadio III Bajas dosis: INF alfa2a 3 MU s/c 3 x sem x 2 años III. RADIOTERAPIA SOBRE TUMOR PRIMARIO Y REGIONES GANGLIONARES Se debe considerar la indicación de radioterapia (RT) sobre tumor primario cuando la resección adecuada no es posible. Por otra parte, se debe considerar la RT sobre regiones ganglionares post vaciamiento ganglionar inadecuado con masa residual. Luego de un vaciamiento ganglionar adecuado podría considerarse la RT cuando existen 4 o más ganglios positivos , uno de los ganglios comprometidos mide 3 cm o más o presenta extensión extracapsular Seguimiento Deberá ser interdisciplinario y tomar en cuenta el riesgo de recaída y la factores de riesgo como la historia familiar de melanoma. 207 Las características, frecuencia y duración óptima del seguimiento no han sido claramente establecidasRecomendamos: Dermatológico: de preferencia semestral Oncológico: Estadios 0- IIA: clínico (estudios paraclínicos de acuerdo a las manifestaciones clínicas), cada 3- 6 meses por 5 años y luego anual. Estadios IIB a III: - Clínico, cada 3 a 4 meses por 5 años y luego anual. - Paraclínico: en ausencia de manifestaciones clínicas el valor de los estudios paraclínicos en el seguimiento no ha sido bien determinado. Puede considerarse la realización de RxTx, LDH, TAC +/- PET-CT +/- RNM cráneo, en especial los primeros 5 años. IV. TRATAMIENTO DEL MELANOMA METASTASICO En pacientes con enfermedad metastásica limitada y resecable en forma completa, se recomienda considerar la metastasectomía seguida de tratamiento sistémico “adyuvante”. En el resto de los casos el tratamiento primario es el sistémico. La radioterapia y en casos seleccionados la radiocirugía, tiene un papel importante en el tratamiento de las metástasis encefálicas. Otras indicaciones incluyen el tratamiento de la compresión medular y la radioterapia analgésica. Tratamiento sistémico Los tratamientos sistémicos producen respuestas completas duraderas en un pequeño porcentaje de pacientes, sin demostración del aumento de la sobrevida global. La Dacarbazina (DTIC) es la droga estándar con respuestas objetivas de un 20% y respuestas completas en menos del 5%. La duración mediana de la respuesta es de 5 a 6 meses. 208 La poliquimioterapia (regimen de Dartmouth modificado: BCNU, CDDP, DTIC) ha demostrado mayor tasa de respuestas objetivas con aumento de la toxicidad, pero sin impacto en la sobrevida cuando se compara con DTIC. Se sugiere su indicación para pacientes sintomáticos en los cuales se necesitan mejores respuestas. La Temozolamida de administración v/o, es mejor tolerada y atraviesa la BHE, a diferencia de la Dacarbazina. En un estudio Fase III demostró resultados equivalentes con similar tasa de respuestas, sobrevida libre de progresión y sobrevida global. Dado que atraviesa la BHE es una alternativa para pacientes con metástasis encefálicas o aquellos que progresan bajo DTIC o presentan mala tolerancia a la misma. Los otros agentes (sales de platino, nitrosoureas, alcaloides de la vinca y taxanos) presentan respuestas objetivas menores al DTIC, por lo cual no se recomienda su administración como monodroga. Una opción de poliquimioterapia en segunda línea la constituye la combinación Carboplatino-Paclitaxel cada 21 días, la cual es segura y ampliamente utilizada en esta enfermedad. Bioquimioterapia El agregado de INFalfa2b a DTIC no muestra impacto en la sobrevida vs DTIC, aunque se asocia a mayor tasa de respuestas y mayor toxicidad. La IL2-DTIC no aumenta la sobrevida global ni las respuestas comparado con DTIC monodroga. La combinación de ambas citoquinas (IFN e IL2) + DTIC vs DTIC, si bien muestra aumento de las respuestas objetivas, no ha demostrado impactar la sobrevida global. Terapias dirigidas contra blancos moleculares Aún sin utilidad en melanoma cutáneo; sólo en etapa experimental. Su interés surge de la resistencia caracterísitica a la terapia convencional. El mas estudiado ha sido el Sorafenib, no habiendo demostrado ventajas respecto a la quimioterapia con Carboplatino –Paclitaxel en pacientes que progresaron bajo DTIC o Temozolamida. 209 Radioterapia - Secundarismo encefálico: RT holocraneana con o sin cirugía previa. Radiocirugia en casos seleccionados. - Secundarismo óseo: RT sobre lesiones dolorosas, sobre lesiones líticas sin riesgo cercano de fractura y luego de la cirugía traumatológica . - Compresión medular (dosis no inferiores a 30 Gy) Cirugía - Enfermedad metastasica limitada resecable (por ejemplo: metástasis pulmonar única o varias en un lóbulo). - Resección de metástasis intestinales frente a oclusión intestinal o sangrado incoercible. V. TRATAMIENTO DE LAS RECURRENCIAS LOCORREGIONALES Siempre que sea posible deberá confirmarse la recidiva con punción citológica o biopsia histológica y reestadificar a los pacientes con estudios de imagen (RxTx , TAC , / o PET , / RNM) Recidiva local en la cicatriz Es importante diferenciar la recidiva local a nivel de la cicatriz luego de una excéresis inicial inadecuada de aquella que ocurre luego de una excéresis inicial con márgenes adecuados (de peor pronóstico) En caso de recidiva luego de un tratamiento inicial inadecuado se recomienda la re-exéresis con márgenes según el espesor tumoral y considerar la BGC en función del espesor de Breslow. Si la recidiva aparece post-excéresis inicial adecuada y en ausencia de enfermedad extraganglionar regional se recomienda la re-exéresis con márgenes negativos y según el caso podrá o no considerarse la BGC. Luego de una exéresis completa podrá optarse por la observación, la administración de un tratamiento sistémico según las guías de tratamiento adyuvante explicadas anteriormente o la inclusión del paciente en un ensayo clínico. 210 Recidiva con lesiones en tránsito o satelitosis Siempre que sea posible realizar la exéresis quirúrgica completa. Si esta no es posible, las opciones de tratamiento que clásicamente se describen son la inyección intralesional de BCG o interferon alfa, la terapia tópica con imiquimod y en caso de lesiones localizadas en los miembros, la quimioterapia regional mediante perfusión del miembro aislado. Otros tratamientos a considerar en esta situación incluyen la radioterapia y/o el tratamiento sistémico para la enfermedad avanzada. Si se logra el status libre de enfermedad podrá considerarse un tratamiento adyuvante según las guías anteriores, la observación exclusiva o la inclusión del paciente en un ensayo clínico. Recidiva ganglionar regional Si previamente no se realizó una linfadenectomía o se realizó en forma parcial se recomienda el vaciamiento ganglionar completo de la región comprometida Posteriormente podrá considerarse un tratamiento según las guías de tratamiento adyuvante explicadas anteriormente, siendo también otras opciones la observación o la inclusión del paciente en un ensayo clínico. Si previamente se realizó un vaciamiento regional completo se recomienda la resección con márgenes negativos. Podría considerarse la RT postoperatoria en pacientes con recidiva ganglionar completamente resecada con factores de riesgo como la presencia de múltiples ganglios comprometidos o la extensión extracapsular. Otras potenciales indicaciones de la RT podrían ser la enfermedad ganglionar irresecable o una resección incompleta. En estas dos últimas situaciones también podría indicarse un tratamiento sistémico como en la enfermedad avanzada. VI. CONCLUSIONES PREVENCION: Educación poblacional orientada y fotoprotección adecuada (incluya UVA) con control del tiempo de exposición. CIRUGIA DEL TUMOR: Márgenes adecuados (según recomendaciones 211 internacionales) en superficie y profundidad (fascia); de preferencia cirugía en 2 tiempos. BIOPSIA DEL GANGLIO CENTINELA: Siempre que este indicado y contando con equipo entrenado en esta técnica. ANATOMIA PATOLOGICA: Debe incluir los parámetros ya mencionados (Breslow, ulceración, Clark, márgenes). ESTADIFICACION: Los estudios habituales (Rx tórax, eco abdomen, TAC y centellograma óseo cuando corresponda; PET-CT si está disponible para Breslow >4mm y cuando se sospeche recurrencia). TRATAMIENTO SISTEMICO ADYUVANTE: no existe demostración concluyente de beneficio en términos de sobrevida. El tratamiento con interferón alfa, utilizando alguno de los planes que han mostrado beneficio en estudios randomizados, constituye una opción a la observación, a considerar especialmente en los pacientes con alto riesgo de recaída. ENFERMEDAD DISEMINADA: DTIC en primera línea. Opcional en 2da linea temozolamida o Carboplatino-Paclitaxel. RADIOTERAPIA: como parte del tratamiento de la enfermedad avanzada (ej: paliativa ósea, SNC, compresión medular). CIRUGIA DE LAS METASTASIS: Siempre que sea posible una resección completa se deberá intentar la cirugía. 212 ESTADIFICACION CLINICA (American Joint Committe on Cancer, AJC, 2002. Estadificación TNM) A: no ulcerado, T1 < 1.0mm Clark II y III IA B:ulcerado o IB Clark IV y V T2 1.01-2.0mm T3 2.01-4.0mm T4 >4.0 mm N1 1 ganglio A: no ulcerado IB B: ulcerado IIA A: no ulcerado IIA B: ulcerado IIB A: no ulcerado IIB B: ulcerado A: micromet. B: Macromet. IIC III A: micromet. N2 2-3 ganglios B: Macromet C: satelitosis, III les. en tránsito N3 M1a M1b M1c >4 ganglios ------- III LDH normal IV Pulmón LDH normal IV Otras vísceras LDH normal Culaquier M LDH alto Piel, subcut o ganglionar. IV 213 SARCOMAS DE PARTES BLANDAS DEL ADULTO I. DIAGNÓSTICO Diagnóstico positivo El diagnóstico presuntivo se basa en la anamnesis, el examen clínico e imagenología. El diagnóstico definitivo se obtiene a través de una biopsia, cuyo objetivo será la confirmación histopatológica de la lesión, así como la evaluación del grado histológico y de los factores pronóstico. El tipo de biopsia dependerá del sitio de lesión y tamaño tumoral. Si bien es posible realizar punción espirativa con aguja fina, se prefiere la realización de biopsia incisional o excisional para permitir un mejor diagnóstico, eventualmente complementado mediante inmunohistoquímica. Se prefiere reservar la punción citológica para la confirmación de las recidivas. Diagnóstico de extensión lesional - Anamnesis y examen físico - TAC/RMN de sitio de lesión con especial énfasis en la relación del tumor con los tejidos adyacentes, paquetes vásculo-nerviosos, etc. - TAC de tórax principalmente en lesiones de miembros inferiores y tronco, ya que el 70% se disemina a nivel pulmonar. - En lesiones superficiales, de bajo grado histológico y menores de 5cm se podrá optar por RxTx, debido al menor riesgo metastático. - Otros estudios deberán considerarse según subtipo histológico, dada la existencia de un patrón de diseminación diferente en alguno de ellos. (ejemplo de diseminación ósea por liposarcoma mixoide, imagenología hepática en sarcomas intraabdominales/retroperitoneales) Exámenes de valoración general 214 II. ESTADIFICACIÓN Y FACTORES PRONÓSTICO Estadificación TNM En base a la clínica, la imagenología y el estudio anátomo patológico se realiza la estadificación basándose en el sistema TNM. Como particularidad de los sarcomas de partes blandas, la estadificación TNM incluye el grado histológico. T: tumor primario pTx: no se puede evaluar el tumor primario pT0: no hay evidencias de tumor primario pT1: T ≤ 5cm a: tumor superficial b: Tumor profundo pT2: T >5 cm a: tumor superficial b: Tumor profundo Tumor superficial está localizado sobre la fascia superficial sin invadir la fascia. Tumor profundo está localizado está localizado ya sea exclusivamente debajo de la fascia superficial, superficialmente sobre la fascia con invasión de la fascia o a través de ella, o de manera superficial sobre la fascia y debajo de ella. Los sarcomas retroperitoneales, mediastínicos y pélvicos se clasifican como tumores profundos. N: ganglios linfáticos regionales Nx: no se pueden evaluar N0: no hay metástasis en ganglios linfáticos regionales N1: metástasis en ganglio linfático regional La presencia de N1 positivo, se considera estadio IV M: metástasis a distancia Mx: No puede evaluarse la presencia de metástasis a distancia M0: sin evidencias 215 M1: metástasis en ganglios no regionales o pulmonares M1b: metástasis viscerales no pulmonares G: Grado del tumor GX: El grado no puede determinarse G1: Bien diferenciado G2: Moderadamente diferenciado G3: pobremente difrenciado G4: Indiferenciado En base a esta clasificación se propone la siguiente agrupación en estadios: Estadio T N M G I 1 a,b 2 a,b 0 0 1y2 II 1 a,b 2a 0 0 3y4 III 2b 0 0 3y4 IV Culaquier T Postitivo Presente Cualquier G Factores pronóstico de recurrencia: Se han establecido primariamente para los SPB de miembros pero pueden ser eventualmente aplicables para los sarcomas de otras localizaciones. Grado histológico T > 5 cm. Localización profunda al momento del diagnóstico Márgenes positivos 216 TRATAMIENTO III. En los SPB del adulto la elección del tratamiento depende del tamaño tumoral, grado histológico, localización y relaciones, presencia de metástasis, características del paciente. Salvo excepciones, en general no depende del tipo histológico del tumor. a. Tratamiento de la enfermedad localizada y localmente avanzada: tratamiento sistémico adyuvante y neoadyuvante. La resección completa del tumor con márgenes negativos y satisfactorios es el mínimo requisito para un adecuado control de la enfermedad. Esto puede ser más sencillo de lograr en los SPB de miembros pero más dificultoso en topografías como cabeza y cuello, retroperitoneo, pelvis. El racional para la eventual realización de tratamientos sistémicos neo/adyuvantes sería la alta tasa de recidivas en pacientes operados por un SPB mayor de 5 cm y/o de alto grado (50%) y que la mayor parte de estas recidivas son sistémicas. Los principales factores de riesgo de recidiva incluyen: tamaño mayor de 5-10 cm, GH alto, topografía profunda. II) Quimioterapia neoadyuvante La tasa de respuestas a la QT neoadyuvante es del entorno del 30%. Por otra parte, las chances de progresión bajo este tratamiento también están en el entorno del 30%. No se ha demostrado una mejoría en las tasas de sobrevida libre de enfermedad o sobrevida global con el empleo de esta estrategia. Podría considerarse en aquellos con tumores de alto grado irresecables de inicio o cuya resecabilidad implique un mal resultado funcional/estético. Los esquemas de elección son aquellos de empleo en la enfermedad metastásica. III) Quimioterapia adyuvante Existen varios estudios F. III y 4 meta-análisis que han evaluado el impacto de la QT adyuvante en pacientes con SPB. El metaanálisis más reciente sugiere un beneficio marginal en 217 términos de SLP y SG. Sin embargo, los datos al respecto son contradictorios y no existe una demostración absoluta del beneficio de la QT adyuvante. Por lo tanto, la QT adyuvante no puede considerarse estándar en el manejo de los SPB del adulto. Su indicación podría tener lugar en pacientes con tumores con alto riesgo de recidiva (p.ej. tumores mayores de 5 cm, de GH 2-3) Los esquemas que combinan adriamicina e ifosfamida serían los de elección. b. Tratamiento de la enfermedad metastásica resecable La cirugía es el único tratamiento curativo de los SPB. Por lo tanto, aún en caso de metástasis debe procurarse la cirugía con intención curativa en aquellos casos que tengan una enfermedad metastásica limitada, siendo condición necesaria la exéresis completa del tumor primario y las metástasis. Esto se da principalmente en caso de metástasis pulmonares, lográndose en pacientes operados tasas de SV a 5 años de un 40%. El papel de la exéresis de metástasis hepáticas no está claro y debe discutirse en cada caso particular. No hay evidencia definitiva del beneficio del uso de PQT luego de la cirugía de las metástasis, debiendo valorarse individualmente en cada caso. c. Tratamiento de la enfermedad metastásica irresecable En los casos donde la enfermedad diseminada es irresecable, el pilar de tratamiento es el sistémico. No existe un esquema de quimioterapia estándar para el tratamiento de los SPB diseminados. La monoquimioterapia logra tasas de respuestas en un 15-28% y una SV mediana de aproximadamente 18 meses. Por su parte, la poliquimioterapia logra tasas de respuestas del 30-38% y SV medianas de 18 meses al igual que la MQT, con 4550% de sobrevivientes al año. Los estudios que han comparado monoquimioterapia vs. poliquimioterapia han demostrado mayor tasa de respuestas y mayor toxicidad para la PQT y similar sobrevida global. En consecuencia, la elección de MQT o PQT dependerá de las características del paciente, la tolerabilidad esperada a la QT, las características de la 218 enfermedad, así como de las preferencias del médico tratante y del paciente. En aquellos casos donde se desee priorizar las chances de alcanzar una respuesta objetiva (p.ej.. pacientes sintomáticos, enfermedad visceral extensa, potencial resecabilidad post-QT) puede ser de elección la PQT. La adriamicina es la droga de elección en los casos que se realice monoquimioterapia. Otras opciones en el tratamiento de primera línea: ifosfamida, dacarbacina. No existe un esquema de poliquimioterapia de elección y la selección del mismo dependerá de las preferencias del médico tratante, comorbilidades del paciente, toxicidad del plan. Los estudios que compararon esquemas de QT entre sí no demostraron diferencias en la sobrevida global ni tasas de respuesta. El esquema MAID (MesnaAdriamicina-Ifosfamida-Dacarbazina) el de mejor perfil de toxicidad. La combinación de Adriamicina e ifosfamida es otro de los esquemas de elección. No existe evidencia concluyente que permita recomendar un esquema específico según el tipo histológico. Sin embargo, existe evidencia creciente acerca de la sensibilidad específica de algunos tipos histológicos Particularmente, la a determinados combinación planes de de quimioterapia. gemcitabina-docetaxel ha demostrado tasas de respuesta superiores a los esquemas basados en adriamcina e ifosfamida en pacientes portadores de leiomiosarcomas. Adicionalmente, varios estudios retrospectivos sugieren que el paclitaxel monodroga o en combinación con vinorelbina puede ser un esquema especialmente útil en pacientes con angiosarcomas. Dada la falta de evidencia derivada de estudios F. III, los planes convencionales continúan siendo una opción válida en estos pacientes. d. Tratamiento de segunda línea Aún existe menor evidencia que en el caso de los tratamiento de primera línea. Las opciones son múltiples no existiendo ningún esquema preferido. Dada la baja probabilidad de respuesta y el criterio eminentemente paliativo de estos tratamientos, se prefiere en general planes de monoquimioterapia. Opciones: Docetaxel Paclitaxel 219 Gemcitabina Dacarbacina Ifosfamida Adriamicina e. Esquemas de quimioterapia II) Monoquimioterapia Adriamicina 75 mg/m² IV cada 21 días Dacarbazina 1.2 g/m² IV cada 21 días Ifosfamida 3000 mg/m² i/v D1 al D3 cada 21 días (+ Mesna) III) Poliquimioterapia Adriamicina-Ifosfamida Ifosfamida Adriamicina 2000 mg/m2 i/v D1 al D3 25 mg/m2 i/v D1 al D3 Mesna i/v 60% de la dosis de ifosfamida cada día que se administra la Ifosfamida dvidido en 3 dosis diarias Cada 21 días MAID Adriamicina: 15 mg/m2/día, i/v en IC días 1-4 Dacarbazina: 250 mg/m2/día, i/v en IC días 1-4 Ifosfamida: 2000 - 2500 mg/m2/día, i/v en IC días 1-3 Mesna i/v 60% de la dosis de ifosfamida cada día que se administra la Ifosfamida dvidido en 3 dosis diarias Cada 21 días Gemcitabina-Docetaxel Docetaxel 100mg/m² D8 Gemcitabine 900mg/m² D1y8 Cada 21 días 220 SARCOMA DE EWING I. DIAGNOSTICO Y ESTADIFICACION Debe tenerse presente siempre otros Tumores a células redondas del joven: Rabdomiosarcoma. Neuroblastoma. L.N.H. Tumor de Askin (Neuroepitelioma). Osteosarcoma a células redondas. Paraclinica Rx del sector óseo afectado. TAC del sector óseo afectado. Biopsia. Centello óseo. B.M.O. Rx Tx (F y P). TAC Tórax si Rx Tx es normal. L.D.H. Estadios En realidad se distinguen dos situaciones: EWING LOCALIZADO. EWING METASTASICO al inicio: - 20 % metástasis pulmonares. - 40 % compromiso de M.O. - 50 % lesiones óseas múltiples. Evolutivamente pueden presentar: 2° Tumor SNC, Meningosis. II) TRATAMIENTO Se basa en Poliquimioterapia y Radioterapia, y ocasionalmente en la Cirugía. Sarcoma de ewing localizado 221 Después de la biopsia diagnóstica: 1) 2 series de 9 semanas c/u en base a VACA. 2) RT ó Cirugía + RT, Cirugía Radical. 3) 2 series de 9 semanas c/u en base a VACA. POLIQUIMIOTERAPIA: Series: 1° 2° 3° I CTX 1,2 gr/m² I I CTX 1,2 gr/m² I II ADR 30 mg/m2 III ACT.D 0.5 mg/m2 II ADR 30 mg/m2 I CTX 400 mg/m² I I I I I I VCN 1.5 mg/m2 I I I I I I I I I I 1 2 3 4 5 6 7 8 9 1° Total 18 semanas __________________________________________________________________ TRATAMIENTO LOCAL __________________________________________________________________ REPITE PQT 18 SEMANAS En la recidiva o en pacientes con factores pronósticos adversos (hombre, edad, LDH elevada, anemia, fiebre, localización axial, porcentaje de necrosis tumoral luego de la QT, imposibilidad de cirugía) se puede combinar el esquema VAC con Ifosfamida-etopósido, secuencial o alternado. Sarcoma de Ewing metastasico 20 % de los pacientes tendrán 2° desde el inicio. Tratamiento combinado de Poliquimioterapia y Radioterapia sobre: metástasis pulmonares (ACT.D), metástasis óseas. Indicaciones de radioterapia 222 Primitivo de hueso largo. Si la cirugía no es posible por deformidad inaceptable. Si la resección ósea y de partes blandas no es posible. Sobre las metástasis. Resecciones parciales. Márgenes microscópicos inadecuados. Indicaciones quirurgicas Hueso plano totalmente resecable. Hueso distal de mano ó pie. Fractura patológica. Localización en miembro inferior en niño pequeño. 223 OSTEOSARCOMA I) DIAGNÓSTICO Y ESTADIFICACIÓN CLASIFICACION A) ANATOMO - PATOLOGICA TUMORES DEL TEJIDO OSEO Benignos: - Osteoma. Osteoma Osteoide. Osteoblastoma. Malignos - Osteosarcoma: fibroblástico condroblástico osteoblástico telangiectásico - Osteosarcoma Periostal. Osteosarcoma Parostal. TUMORES DEL TEJIDO CARTILAGINOSO Benignos - Condroma. Condroma Perióstico Osteocondroma. Condroblastoma. Inciertos: Encondromatosis Múltiple. Malignos - Condrosarcoma. Condrosarcoma Perióstico. Condrosarcoma Mesenquimal. TUMORES DE HISTOGENESIS INCIERTA De malignidad incierta: Tumor Giganto Celular. 224 Malignos - Tumor Giganto Celular Maligno. Ameloblastoma. Sarcoma de Ewing. TUMORES DEL TEJIDO HEMATOPOYETICO Malignos - Reticulosarcoma de Hueso (Histiocítico). Otros L. N. H. Plasmocitoma. TUMORES VASCULARES Benignos ó Malignos - Hemangioendotelioma/Hemangiosarcoma Hemangiopericitoma/Hemangiopericitomá M. TUMORES FIBROSOS Benignos - Fibroma no Osificante. Histiocitoma Fibroso Benigno. Intermedios - Fibroma Desmoplásico. Malignos - Histiocitoma Fibroso Maligno. Fibrosarcoma. TUMORES DEL TEJIDO NERVIOSO Benignos - Schwannoma Benigno Neurofibroma Perióstico Malignos - Schwannoma Maligno TUMORES DEL TEJIDO MUSCULAR TUMORES DE INCLUSIONES TUMORES INCLASIFICABLES 225 LESIONES SEUDOTUMORALES B) ANATOMO - CLINICA TUMORES A CELULAS FUSIFORMES - Osteosarcoma. - Condrosarcoma. - Fibrosarcoma. - Histiosarcoma Fibroso Maligno. __________________________ | | Bajo Grado Alto Grado ---------Cirugía solo. ---------Cirugía. Radioresist. Relat. Quimiosensibles. TUMORES A CELULAS REDONDAS - Sarcoma de Ewing. - Osteogénico a Cels. Redondas. - L.N.H. - Condrosarcoma Mesenquimático. _____________________________ | Alto Grado -----------Radiosensibles. Quimiosensibles. II) EVALUACION CLINICA Y PARACLINICA 226 Para: Confirmación Diagnóstica y Estadificación. Estadificación: Localizado ó Metastásico. Tres Situaciones: A) Tu. Primitivo sin Metástasis. B) Tu. Primitivo con Metástasis. C) Recidiva Local y/o a Distancia. a) Tumor Primitivo sin Metástasis: Historia y exámenes diarios. Rx. ósea. Rx. Tórax. TAC ósea. RM: es el estudio de elección para evaluar tumor y su relación con el tejido vecino y en particular con las estructuras neurovasculares. Es el estudio que mejor evalúa la extensión intramedular, así como las “skip” metástasis. TAC Tórax. Centellograma óseo Fosfatasa Alcalina: si está aumentada: tiene valor de marcador. Biopsia quirúrgica. b) Tratamiento Quirúrgico: Control Local: amputación. cirugía conservadora. III) TRATAMIENTO NEOADYUVANTE. A efectos de mejorar el control sistémico del osteosarcoma y función siguiendo a la cirugía, se han desarrollado esquemas de quimioterapia, metotrexate a altas dosis como monodroga o en asociación con otros fármacos. El grado de necrosis posquimioterapia permite elegir el esquema de tratamiento para adyuvancia. a) EXAMENES PRETRATAMIENTO: 227 Hemograma. Clearence de creatinina (más de 79 ml/min.). Func. Hepático. Rx. Tórax, obligatoria antes de cada serie. Eventualmente audiograma y F. de Eyección pretratamiento. b) QUIMIOTERAPIA - DOSIS: Metotrexate monodroga: 8-12 g/m2 i/v semanal x 4 Leucovorina (como rescate): 10-15 mg v/o cada 6 horas x 10 dosis comenzando 20 horas de finalizado el metotrexate de cada ciclo. Metotrexate en combinación: Metotrexate: 8-12 g/m2 i/v día 1 (semana 0), día 8 (semana 1), día 29 (semana 4) y día 36 (semana 5). Leucovorina: idem arriba. BCD regimen Bleomicina: 15 U/m2 i/v x 2 días (días 15 y 16 de semana 2) Ciclofosfamida: 600 mg/m2 i/v x 2 días (días 15 y 16 de semana 2) Dactinomicina: 600 ug)m2 i/v x 2 días (días 15 y 16 de semana 2) Este esquema combinado de QT finaliza en 6 semanas y entre el día 43 de la semana 6 y el 50 de la semana 7 se realiza la cirugía. IV) TRATAMIENTO ADYUVANTE El esquema de tratamiento adyuvante dependerá del grado de necrosis tumoral posquimioterapia (grado 1-2: poca necrosis; grado 3-4: mucha necrosis). Adyuvancia poca necrosis (mal pronóstico): Adriamicina: 25 mg/m2 i/c días 1-3 x 5 ciclos (días: 57-59, 106-108, 155-157, 190-192, 225-227) 228 Cisplatino: 120 mg/m2 i/v x 5 ciclos (días: 57, 106, 155, 190, 225) Metotrexate: como arriba los días: 78, 99, 127, 148 BCD como arriba los días: 85, 134, 176, 211 Adyuvancia mucha necrosis (buen pronóstico): Adriamicina: como arriba los días: 57-59, 106-108, 155-157, 204-206 Metotrexate: como arriba los días: 78, 99, 127, 148, 176, 197, 225, 246 BCD: como arriba los días: 85-86, 134-135, 183-184, 232-233 Otras alternativas terapéuticas sistémicas: Ifosfamida en asociación o como monodroga en la recaída. c) TOXICIDAD - MONITOREO: Si Glob. Blancos < 3000 i/v, PMN 1500 i/v, Plaq.< 100.000 se pospone QT. Si Glob. Blancos < 1000 i/v, Plaq. < 25.000 ó Infección ó Sangrado, reducir la dosis de ADR. en un 20 % en las series siguientes. Si mucositis severa, reducir ADR. 20 % en las series siguientes (impide la alimentación). Recalcular la dosis si hay marcado adelgazamiento durante la PQT. V) SEGUIMIENTO Finalizada la PQT: Cada 6 sem, por 1 año: Hemograma, F.Alcalina y Rx Tx. Cada 8 sem, por 1.5 año: Hemograma, F.Alcalina y Rx Tx. Cada 12 sem, en adelante: Hemograma, F.Alcalina y Rx Tx. TAC Tórax y Centello Oseo si están indicados. 229 TUMORES PRIMITIVOS DEL SNC Y METASTASIS ENCEFALICAS I) DIAGNÓSTICO TAC de cráneo en todo paciente que se sospeche un tumor primitivo de SNC, que se repetirá en el postoperatorio inmediato. IRM de cráneo en aquellos casos dudosos y en aquellos tumores donde esté formalmente indicada una IRM. IRM espinal en pacientes con tumores de fosa posterior o de otros sectores del SNC pero con riesgo de diseminación, a saber: tumores PNET, en especial el meduloblastoma, ependimoma, tumores germinales, etc. Otros estudios: Aquellos tumores con riesgo de diseminación sistémica, especialmente los PNET (meduloblastoma, neuroblastoma, pineoblastoma, ependimoblastoma) deberán ser estudiados además con: TAC de tórax-abdomen-pelvis. Centellograma óseo. Mielograma y BMO. LDH Ante la sospecha o confirmación de un tumor germinal deberá determinarse los marcadores tumorales biológicos AFP y BetaHCG en sangre y LCR. Eventualmente otros estudios dependerán de cada paciente y del tumor en cuestión, así como eventuales complicaciones. II) TRATAMIENTO Gliomas Malignos: Gliomas G III y IV (Astrocitoma Anaplasico y Glioblastoma Heteromorfo O Multiforme) Cirugía: Exéresis quirúrgica lo más radical posible, compatible con menores secuelas funcionales. Su limitación surge por su localización En estos profunda ó en áreas altamente expresivas. casos algunos recomiendan la biopsia estereotáctica por tomografía computada. 230 Este esquema se aplica a todas las demás variedades de tumores primitivos del SNC. Radioterapia: Postoperatoria cuando las condiciones generales y neuroquirúrgicas lo permitan. Debe ser radical con DT del orden de los 60 Gys equivalente biológico, en 5 a 6 semanas ó y en campos su lo suficientemente amplios como para incluir el lecho tumoral y 2 cm más allá del edema. Quimioterapia adyuvante: Todo paciente menor de 70 años y sin contraindicaciones generales puede ser sometido a este tratamiento. Drogas recomendadas NITROSUREAS Fundamentalmente la Carmustina (BCNU). Esta droga presenta una toxicidad acumulativa fundamentalmente hematológica y pulmonar. BCNU: 200 mg/m2 en 500 cc SF i/v en 90’ día 1 c/6 semanas (dosis máxima acumulativa 1200 mg/m2). Nadir de la depresión hematológica y pulmonar a la 4 a 5 semanas de finalizado el tratamiento. Tanto el CCNU como el MeCCNU tienen menor efectividad que la anterior. PROCARBAZINA (PCZ) (NATULAN) 100 mg/m² D1-14 c/4 semanas, de acuerdo a toxicidad hematológica, fundamentalmente sobre la serie blanca, que alcanza su nadir entre la primera y segunda semana de finalización del tratamiento. TENIPOSIDO (VM 26)VUMON 30 mg/m2 i/v D1 a D5 c/4 semanas. Otras drogas útiles TEMOZOLAMIDA es el fármaco de elección como segunda línea. Dosis: 200 mg/m2 v/o día 1-5 cada 28 días. Carboplatino: (AUC 5-6) i/v día 1 Etopósido: 100 mg/m2 i/v día 1-3 Cada 21-28 días Gliomas Benignos: Astrocitoma G I y II: 231 Cirugia: Similar a lo indicado en A). Puede ser curativa en algunas variedades de astrocitoma cerebeloso en el niño cuando se logra exéresis completa. En pacientes menores de 35 años, con exéresis completa puede plantearse cirugía exclusiva si es factible el seguimiento imagenológico adecuado (de preferencia IRM). Radioterapia radical local postoperatoria con las dosis indicadas en A). Se recomienda en los gliomas grado 2, donde es dudosa la exéresis macroscopicamente completa, así como en pacientes mayores de 35-40 años. Quimioterapia adyuvante: No se ha demostrado que la QT adyuvante prolongue la sobrevida de estos pacientes, por lo cual no se recomienda. Frente a la RECIDIVA TUMORAL Se recomienda la reintervención quirúrgica, siempre que sea posible con una adecuada preservación de las funciones neurológicas. Se hará radioterapia si no fue previamente empleada. Así mismo dependiendo del tiempo transcurrido, puede haber lugar para la reirradiación. En estos casos podrá plantearse quimioterapia con cualquiera de las drogas mencionadas anteriormente. Su principal indicación es cuando se confirma una mayor agresividad de estos tumores. Gliomas de tronco cerebral: Cirugía: Habitualmente inabordable. una derivación Puede haber lugar ventrículoperitoneal frente para a una hidrocefalia sintomática que puede complicar la evolución. Radioterapia radical local en los rangos de dosis ya indicados. Quimioterapia asociada a RT: Se continúa con series mensuales de las drogas planteadas durante 6 –12 meses, según respuesta. Oligodendrogliomas: En general, seguir lo indicado en los astrocitomas benignos. Oligodendroglioma anaplásico: asociar RT con drogas especificadas previamente en los gliomas malignos. Este es un tumor que en los últimos años se ha demostrado su quimiosensibilidad, por lo cual se recomienda en los 232 oligodendrogliomas agresivos, ya sea como adyuvancia, luego de la RT, o en el momento de la recidiva. Dada la quimiosensibilidad de estos tumores es válido el tratamiento con quimioterapia y reservar la RT para la progresión lesional que no es controlada ni con cirugía ni con QT. Estos tumores en la recidiva también por lo general lo hacen con un mayor grado de agresividad, pudiendo transformarse en un glioblastoma multiforme. Ependimomas benigno y anaplásico Cirugía: Igual a lo indicado previamente. Radioterapia: Trata de tumores que especialmente en sus variedades de cuarto ventrículo se diseminan por vía LCR y pueden dar metástasis. Por esta razón se recomienda RT profiláctica de todo el eje cerebroespinal con un refuerzo campo reducido en la localización inicial. En los benignos ubicados en los hemisferios cerebrales podrá evitarse la RT, si es pasible de un seguimiento imagenológico. Quimioterapia: Se utiliza fundamentalmente para las formas más indiferenciadas, con mayor probabilidad de recidiva. Pueden utilizarse cualquiera de las drogas ya mencionadas. Ependimoblastoma Es una entidad diferente considerada entre los tumores tipo PNET (Tumores Neuroectodérmicos primitivos) y debe seguir el tratamiento de estos, donde su principal representante es el meduloblastoma. Neuroblastoma de cerebelo (meduloblastoma) Cirugía: Igual que en variedades anteriores. Se recomienda la DVP preoperatoria. Radioterapia radical: Craneoespinal Profiláctica por ser tumores diseminantes con refuerzo en la localización primaria. Quimioterapia adyuvante: Se ha logrado demostrar su efectividad, en tumores avanzados y se utiliza dado el carácter maligno y recidivante de la afección en aquellos casos de mal pronóstico. 233 Recidiva tumoral ó aparición de metastasis: De ser posible la reintervención se hará la misma, seguida de QT. En estos tumores es posible la diseminación extraencefálica, estando indicado el tratamiento con QT, siendo hoy día las drogas de primera elección las sales de platino y el etopósido. Tumores pineales primitivos y germinomas Cuando se logra su diagnóstico mediante Marcadores Biológicos (AFP y Beta HCG en sangre y LCR) ó por Citología, puede no estar indicado el abordaje quirurgico. Se recomienda la DVP para tratamiento de la Hidrocefalia. Pueden abordarse quirúrgicamente con baja morbimortalidad. Radioterapia radical craneoespinal seguido de refuerzo en la región primaria. Dan metástasis vía LCR. Pueden curarse en alto porcentaje con la RT sola los Germinomas (símil seminoma de testículo). Quimioterapia: No se recomienda en primera línea, pudiendo emplearse en las raras formas recidivantes. En los pacientes portadores de tumores germinales no seminomatosos se recomiendan esquemas de QT similares a los utilizados en los tumores no seminomatosos de testículo, pero sabiendo que en general los tumores no seminomatosos extratesticular tienen un peor pronóstico. Otros tumores Se discutirán puntualmente de acuerdo a cada caso clínico, así como aquellas situaciones no consideradas aquí. Metastasis encefálicas Es más frecuente que los tumores primitivos del SNC. Pueden ser sincrónicas, metacrónicas o preceder al diagnóstico del tumor primario, pudiendo en este caso la exéresis de la misma ser terapeútica y diagnóstica. Frecuentemente son hemisféricas y múltiples. Algunos casos como los tumores digestivos, se caracterizan por metástasis únicas y a nivel de la fosa posterior. La TAC de cráneo es el primer estudio a solicitar. En caso de observarse 1 o 2 metástasis pasibles de exéresis, se pedirá una IRM de cráneo para descartar otras metástasis, fundamentalmente a 234 nivel de la fosa posterior, lugar donde frecuentemente la TAC tiene menor resolución. Recomendaciones terapéuticas: Cirugía de la metástasis, cuando exista 1 o 2, dado que se prolonga la sobrevida, siempre y cuando exista un tumor primario controlable y sin evidencia de diseminación fuera del SNC. Luego de la cirugía se hará RT holocraneal hasta 50 GY. En pacientes no quirúrgicos, la RT es el tratamiento paliativo de elección. Se podrá asociar QT en tumores quimiosensibles como el carcinoma a células pequeñas de pulmón, tumor germinal, cáncer de mama, etc. En pacientes con más de dos metástasis, la cirugía podrá resecar una metástasis mayor que esté determinando una complicación no controlable por la RT a corto plazo. III) SEGUIMIENTO Control semanal durante el tiempo que dure la RT, fundamentalmente si se hace QT y RT concurrente. En pacientes sometidos a QT se hará un hemograma antes de cada ciclo y creatininemia en aquellos planes que incluyan sales de platino. En aquellos pacientes tratados con nitrosureas y en especial con BCNU se hará un FEH cada dos ciclos. Se hará una TAC de cráneo antes del boost de sobreimpresión, así como al finalizar el tratamiento. Se controlará con una TAC de cráneo cada 4 meses durante el primer año y luego en forma más espaciada ante la ausencia de sospecha de recidiva. Otros estudios dependerán de cada tumor, así como de los resultados previos. 235 CANCER DE TIROIDES I) DIAGNOSTICO Y ESTADIFICACION Anamnesis y exámen físico. Signos y síntomas sospechosos de Neoplasia en un Nódulo Tiroideo: Edad menor a 20 ó mayor de 60 años. Sexo: masculino. Aparición reciente. Crecimiento rápido. Nódulo único. Dureza del nódulo. Presencia de adenopatías cervicales. Antecedentes de Radioterapia. Síntomas y signos de compresión. Invasión de estructuras cervicales vecinas. Exámenes complementarios Gamagrafía tiroidea. Ecografía tiroidea. Punción aspiración con aguja fina (PAAF) y estudio citológico. Dosificación de hormonas tiroideas (T3, T4, TSH). Dosificación de tiroglobulina (optativo). Dosificación de tirocalcitonina y CEA (para el C.M.T.). Rx Tx (F y P). Funcional y enzimograma hepático. Hemograma completo. VES. Estadios Cancer diferenciado (papilar y folicular) Se considerará: - Menor de 45 años: Estadio I: sin metástasis a distancia. Estadio II: con metástasis a distancia. - Mayor ó igual a 45 años: Estadio I: T1 N0 Mo Estadio II: T2 No Mo 236 T3 No Mo Estadio III: T4 No Mo Cualq.T, N1, Mo Estadio IV: Cualq.T, Cualq.N, M1 Cáncer medular Se considera como Ca. Diferenciado Tiroideo, en pacientes mayor ó igual a 45 a. Cáncer indiferenciado Todos se consideran Estadio IV. Clasificación TNM: T1: Tumor menor 1 cm. T2: Tumor entre 1 y 4 cm. T3: Tumor mayor de 4 cm. T4: Extensión de la logia glandular. N1: Gl. Regionales: cervical. mediastinal alto. M1: Metástasis a distancia. Clasificacion anatomo-clinica Carcinomas ADENOCARCINOMA PAPILAR (60 -80 %). Microcarcinoma (menor a 1 - 1.5 cm). Encapsulado (antes Adenoma Papilar). Folicular. Formas raras. CARCINOMA FOLICULAR (15 - 20 %). Encapsulado (el más frecuente, se diferencia del adenoma por la invasión capsular más del tercio interno y/o invasión vascular intracápsular ó más allá) Invasivo (patrón sólido ó trabecular peor que folicular). De células oxifílas (Hurthle). De células claras. CARCINOMA INDIFERENCIADO (10 %) Ca. de células pequeñas (Dc. Dif.: Linfomas y cáncer medular de tiroides). Cáncer de células gigantes. CARCINOMA MEDULAR (6 %). 237 Otros tumores malignos Linfoma. Sarcoma. Tumor Metastásico. II) TRATAMIENTO Carcinoma Diferenciado (Papilar Y Folicular). Cirugía - Se hará Tiroidectomía casi total. Más vaciamiento ganglionar si están clínicamente comprometidos. - No hacer vaciamiento ganglionar profiláctico. Ablación Tiroidea con Iodo 131: - - Se hará ante estos factores adversos: Edad: mayor de 40 años. Sexo: masculino. Tumor: mayor a 1.5 cm. Invasión capsular/local. Invasión vascular. Ganglios reg. positivos ó metástasicos a distancia. Menor diferenciación histológica. Antecedentes de irradiación de cuello. En los demás casos será optativo. Previamente deberá hacerse un Perfilograma Tiroideo con dosis trazadoras de I 131. Entre las 3 y 6 semanas posteriores a la cirugía, momento en que existe la máxima estimulación del remanente tiroideo con dosif. hormonales de T3 y T4 que tienden a cero y TSH elevada, mayor a 40 - 60 mU/ml. Hormonoterapia: Se hará Levotiroxina a dosis supresoras de TSH. 238 Controles de los C.D.T.: - Clínico: cada 3 - 4 meses. Paraclínico: cada 3 - 4 meses. Determinación de hormonas T3 - T4 y TSH. Determinación de Tiroglobulina. Una vez comprobada la supresión de TSH, puede determinarse la Tiroglobulina en forma anual. Rastreo Corporal total (RCT) con I 131 en forma anual (si es de alto riesgo) (optativo) Rx Tx. Carcinoma medular Cirugía - Se hará Tiroidectomía Total. Reoperar si no se hizo la TT. Está formalmente indicado compartimiento central la disección profiláctica del del cuello, desde la tiroides hasta los vasos innominados y lateralmente hasta la vena yugular, ya que en un 50 %, dichos ganglios son positivos y habitualmente este carcinoma no capta el I 131. - Biopsia extemporánea de ganglios del compartimiento lateral y de ser positivos hacer linfadenectomía. - No hacer disección radical del cuello en forma rutinaria (no mejora el pronós tico), salvo con vena yugular ó músculo ECM afectado. - Revisar glándulas paratiroides. Radioterapia Externa Ante un alto número de ganglios positivos y cuando la Tirocalcitonina permanece elevada luego de la cirugía. Hormonoterapia: Se hará Levotiroxina a dosis supresoras de TSH. Controles de los C.D.T. - Clínico: cada 3 - 4 meses. Paraclínico: Determinación de hormonas tiroideas. 239 Dosificación basal y estimulada de Tirocalcitonina con calcio y pentagastrina en el postoperatorio y luego en forma periódica. Búsqueda de tumores asociados: Feocromocitoma. Rx Tx. Func. y Enz. Hepático. Ecografítica Hepática. (eventual). Se hará estudio familiar ante C.M.T. bilateral ó Hiperplasia Parafolicular Contralateral, con determinación de Tirocalcitonina basal y estimulada. Carcinoma indiferenciado - Dado su agresividad se harán tratamientos combinados. De ser pasible de Cirugía se comenzará con este tratamiento. Si es inoperable de entrada (forma más frecuente de presentación) se comenzará con tratamieto combinado de Quimioterapia y Radioterapia, pasando luego a la Cirugía de ser posible. Planes de QT y RT combinadas: - Adriamicina y RT. - Adriamicina, Cisplatino y RT. ================================================ =========== - ADR: 20 mg i/v sem. x 3 y RT EXT: 3000 cGy en 3 sem. 4° sem.: Cirugía 6° y 7° sem: ADR. 20 mg i/v sem y RT 1600 cGy. Seguir con ADR: 20 mg i/v sem. x 4 meses. - ADR: 60 mg/m2 i/v. - CDDP: 90 mg/m2 i/v. cada 4 sem. RT EXT: del día 10 al 20: 1750 cGy durante los 4 primeros ciclos. ================================================ =========== Indicaciones de radioterapia externa en cancer diferenciado de tiroides - Cuando el tumor es inoperable, especialmente si no concentra I 131. 240 - Tumor voluminoso a localización mediastinal incontrolable por la cirugía. - Persistencia el tumor residual. Metástasis óseas, ya que concentra débilmente el I 131. Metástasis cerebrales, hepáticas y/o cutáneas. Síndrome de Compresión Medular y Sindrome de VCS. En fractura aunque capte I 131. Indicaciones de quimioterapia en carcinoma de tiroides Su indicación estaría reservada para aquellos casos de progresión de la enfermedad, después de agotados los tratamientos convencionales. - Respuestas: 20 - 40 % (Parcial + Estabilización). Se recomienda: ADR.: 65 mg/m2 i/v cada 3 - 4 sem. c/s CDDP. 241 CUIDADOS PALIATIVOS EN EL PACIENTE ONCOLOGICO “Porque me queda mucho por andar y promesas que cumplir, antes de dormir” (Oxford Textbook of Palliative Medicine, 1998) “El único dolor tolerable es el dolor del otro” (Dr. Enrique Bzuroski) Estas pautas terapéuticas se basan en los trabajos de la Dra. Mary Baines del Saint Christopher´s Hospice y del Dr. Henry Rapin del Centre de Soins Continus de Ginebra, Suiza. Nosotros hemos ampliado y adaptado estas pautas a nuestro medio y hemos modificado algunos aspectos de acuerdo a nuestra propia experiencia. CONTENIDO Introducción Algunas consideraciones generales Tratamiento del dolor Control de los trastornos digestivos Control de los trastornos respiratorios Cuidados de la piel Control de los trastornos neuro-psiquiátricos I. INTRODUCCION El cáncer es la 2ª causa de muerte en nuestro país. El 25% de nuestra población fallece por cáncer y se calcula que aproximadamente el 60-70% de los pacientes oncológicos pasarán por una fase de enfermedad terminal; es evidente que estamos ante un verdadero problema de salud pública. Se entiende por enfermo terminal el paciente oncológico con un pronóstico de vida estimado en 3 a 6 meses y al que no se le puede ofrecer tratamientos oncológicos pretendidamente curativos. 242 La mayoría de estos pacientes presentan múltiples síntomas que son multifactoriales, cambiantes y progresivos y de gran impacto sobre el propio paciente, su familia y el equipo asistencial. Ello se debe al deterioro progresivo del paciente, a la alteración de la relación familiar y en gran parte a la angustia generada por el enfrentamiento a la muerte. La constante demanda de mejorar la calidad de vida del paciente oncológico obliga a optimizar la calidad profesional y humana sobre todo en la fase final de la enfermedad ya que es la situación más difícil de manejar y de mayor conflicto para el paciente, su familia y el personal de salud. Actualmente la Medicina Paliativa ofrece los recursos técnicos y humanos capaces de resolver de la mejor manera posible estas situaciones. La OMS define Medicina Paliativa de la siguiente manera: son los cuidados apropiados para el paciente con una enfermedad avanzada y progresiva que ya no responde a un tratamiento curativo y donde el control del dolor y otros síntomas, así como los aspectos psico-sociales y espirituales cobran la mayor importancia. El objetivo de los Cuidados Paliativos es lograr la mejor calidad de vida posible para el paciente y su familia. La Medicina Paliativa afirma la vida y considera el morir como un proceso normal. Los Cuidados Paliativos no adelantan ni retrasan la muerte. Los Cuidados Paliativos constituyen un verdadero sistema de apoyo y soporte para el paciente y su familia. Basados en la filosofía de los Cuidados Paliativos y ante las carencias en la atención de estos pacientes y sus familias es que se crea a fines de 1994 la Unidad de Cuidados Paliativos del Servicio de Oncología Clínica de la Facultad de Medicina. Los objetivos de la Unidad de Cuidados Paliativos son: La puesta en funcionamiento de un equipo interdisciplinario que asegure un abordaje eficaz e integral para cubrir las múltiples necesidades de estos pacientes y sus familias. Es así que la Unidad de Cuidados Paliativos se integra por médicos, psicólogo, asistente social y enfermería. En el área asistencial, tratar el “dolor total” del paciente y su familia como lo propone la OMS. En el área docente: docencia en pre-grado mediante la participación en los cursos curriculares, y en seminarios y talleres en la clínica. docencia de post-grado: mediante la participación en cursos, jornadas, congresos, simposios, etc. Hoy se encuentra en marcha un programa de formación de Unidades de Cuidados Paliativos en el Interior de la República. 243 Actividades de extensión a la comunidad mediante un programa de formación de voluntarios en Cuidados Paliativos junto al Servicio de Voluntarias del Hospital de Clínicas. En el área de investigación, la realización y participación en ensayos clínicos. Con la presentación y difusión de estas pautas terapéuticas nuestro objetivo es el de contribuir al mejor manejo de los pacientes oncológicos en las etapas finales de la vida. La presente publicación abarca solamente el tratamiento médico-sintomático, en una segunda instancia se abarcarán los temas concernientes a la comunicación y a los aspectos psico-sociales y éticos que se deben considerar en relación a estos pacientes y sus familias. II. ALGUNAS CONSIDERACIONES GENERALES En las próximas líneas intentaremos encuadrar a grandes rasgos la situación clínica así como algunos aspectos particulares referentes a la atención del paciente oncológico en las fases finales de la vida. Se deberá poner especial énfasis en la situación clínica particular de cada paciente, en cuáles son los objetivos razonables de cada tratamiento y establecer qué hacer y qué no hacer en cada momento. Debemos recordar que se trata de pacientes que no tienen posibilidades de un tratamiento curativo y que no obstante su breve expectativa de vida (semanas o meses), siempre será posible ofrecerles un buen tratamiento sintomático. En esta situación se le exige al equipo de salud una valoración muy precisa de un equilibrio muy delicado: por un lado, no someter al paciente a exámenes inútiles y costosos, no agregar tratamientos agresivos o inoportunos, y por el otro lado, no descuidar un examen clínico atento y riguroso capaz de develar y prevenir situaciones puntuales que podrían afectar gravemente la calidad de vida del paciente. Es decir, no sobre-tratar, ni sub-tratar al enfermo, sino saber guardar el equilibrio y valorar en cada circunstancia cuánto beneficio y cuánto perjuicio obtendremos con determinado tratamiento o con determinada abstención terapéutica. De manera general queremos señalar que estos pacientes excepcionalmente necesitan una vía venosa, la gran mayoría de los medicamentos pueden administrarse por vía oral y si ello no fuera posible se utilizará la vía sub244 cutánea (s/c). Hemos obtenido muy buenos resultados entrenando a la familia y al enfermo en el manejo de la vía s/c. Antes de indicar una vía venosa deberá valorarse si la deshidratación es un fenómeno puntual y reversible, o si por el contrario, forma parte del cuadro de la enfermedad terminal del paciente. En la situación de terminalidad no siempre la rehidratación es un objetivo deseable ni beneficioso. Antes de indicar una pielostomía en un paciente con una insuficiencia renal de causa obstructiva baja, por una pelvis enyesada y con una infiltración del plexo sacro, deberá discutirse con la familia, y si es posible con el paciente, las potenciales ventajas y desventajas de esta maniobra. Así también en vez de recurrir a una consulta quirúrgica sonda naso-gástrica (SNG) y a una frente a un paciente con una carcinomatosis peritoneal que cursa un cuadro oclusivo o sub-oclusivo, debe tenerse presente que la gran mayoría de estos pacientes se pueden controlar en domicilio con un tratamiento médico adecuado. Muy frecuentemente estos pacientes están en alto riesgo de instalar una trombosis venosa profunda, deberá considerarse siempre la posibilidad de indicar una anticoagulación profiláctica con heparinas de bajo peso molecular, que el mismo enfermo o la familia pueden manejar. Deberá tenerse bien presente que no se trata de dispensar cuidados compasivos, bien por el contrario, la actitud clínica será la de indicar un tratamiento rápido y eficaz de todos aquellos síntomas potencialmente reversibles y que apunten a mejorar la calidad de vida de nuestro enfermo. Se trata, en fin, de tomar las mejores decisiones en la situación de un paciente terminal sin prolongar su agonía ni acelerar su muerte. Huelga decir que para cumplir con estos objetivos no sólo se debe lograr un control de síntomas eficaz, sino que, y tal vez sea lo más difícil, debe irse tejiendo un verdadero consenso entre el paciente, su familia y el equipo de salud. Ello sólo será posible mediante un trabajo intenso, en el marco de una excelente comunicación y con el más estricto respeto por la autonomía y la libertad del enfermo. III. TRATAMIENTO DEL DOLOR El control del dolor deberá basarse en lo posible, sobre un diagnóstico preciso de la causa que lo provoca. Esto requiere un examen clínico atento y un 245 mínimo de exámenes paraclínicos, los que pueden ser realizados después de instalado un tratamiento eficaz. Se proponen las siguientes etapas: identificar la causa del dolor: extensión local del cáncer compromiso de otra víscera compromiso de un tronco nervioso metástasis óseas infección constipación, etc. evaluar la intensidad, el ritmo y la repercusión del dolor sobre la vida del paciente. definir en función de la importancia del dolor, los siguientes objetivos: obtener de entrada una sobrevida de buena calidad suprimir el dolor de reposo atenuar el dolor durante la higiene o la realización de maniobras permitir la deambulación con el menor dolor posible evaluar el estado psicológico del paciente la ansiedad el síndrome depresivo utilizar de manera racional los analgésicos: conocer la acción, dosificación y vida media de los analgésicos nunca calmar a demanda, sino en horarios regulares LOS PRINCIPIOS El dolor y los otros síntomas del cáncer avanzado son crónicos y constantes. El dolor crónico se diferencia del dolor agudo en que es una situación permanente y no un fenómeno puntual. Su tendencia es a empeorar y progresar por lo que toma tal importancia que ocupa toda la atención del paciente aislándolo de su entorno. La depresión, la ansiedad y los otros síntomas si no son adecuadamente tratados, tenderán a exacerbar la percepción global del dolor. 246 El dolor constante exige ser calmado de manera permanente. La analgesia deberá ser empleada de forma regular, el objetivo será el de determinar la dosis adecuada del analgésico necesaria para cada enfermo y aumentarla hasta que éste no sufra más. La dosis siguiente deberá ser administrada antes de que el efecto de la precedente haya cesado y por lo tanto antes de que el enfermo la solicite. Es la única manera de suprimir el recuerdo y el temor al dolor. Nunca calmar a demanda. Los mismos principios se aplican para el control de otros síntomas tales como las náuseas, la disnea y la constipación, etc. Estos exigen un tratamiento continuo para estar aliviados permanentemente. LOS TRATAMIENTOS ESPECIFICOS El correcto control del dolor en un paciente oncológico pasa por determinar la causa del dolor. Existen numerosos tratamientos específicos que si son correctamente aplicados hacen prescindible el uso de analgésicos. Frecuentemente se pueden asociar haciendo posible indicar una dosis más baja de un analgésico. Un momento particularmente favorable para estimar la intensidad del dolor, sobretodo en los pacientes hospitalizados, es cuando se realiza la higiene y durante los cambios de posición necesarios para los cuidados. El Dolor Oseo Hay evidencias que indican que las metástasis óseas producen la activación de los osteoclastos que generan prostaglandinas que sensibilizan las terminaciones nerviosas. Los anti-inflamatorios no esteroideos (AINE) inhiben la síntesis de prostaglandinas y son los medicamentos de elección para el tratamiento del dolor óseo. Nosotros utilizamos: Aspirina: 500 mg v/o c/4 horas Paracetamol: 500 mg v/oc/4 horas (Cuidado con la toxicidad hepática) Ketoprofeno: 100 mg v/o c/12 horas Frecuentemente, asociamos el Pamidronato, 90 mg i/v a pasar en 2 horas cada 21 días (en el 2° óseo del cáncer de mama y en el mieloma múltiple). 247 Ensayamos durante 1 a 2 días alguno de estos fármacos y si no hay buena analgesia agregamos un analgésico inespecífico, Propoxifeno o Tramadol, antes de pasar a la Morfina. Siempre se deberá considerar la posibilidad de realizar radioterapia analgésica en el caso de metástasis óseas. LAS INFECCIONES SECUNDARIAS: profundas: antibióticos en forma sistémica y si la infección es debida a gérmenes anaerobios Metronidazol 500 mg. cada 8 o 12 hs. superficiales: aplicaciones locales. LOS CÓLICOS POR OBSTRUCCIÓN INTESTINAL: El objetivo es lograr una atonía intestinal con un escurrimiento pasivo de la materia fecal a lo largo del tracto intestinal. Se puede utilizar un antiperistáltico como la Loperamida 2 mg, 4 veces por día asociando Lactulon y Normacol . En caso de que la vía oral no se pueda utilizar (vómitos), se indicará Hioscina simple, 1 ampolla s/c cada cuatro horas, o bien, Sulfato de Atropina, media ampolla, 0.5 mg s/c cada 8 horas. LAS CEFALEAS POR HIPERTENSIÓN ENDOCRANEANA: Se indicarán corticoides a dosis relativamente altas, Dexametasona 8 mg cada 8 hs. ya sea por vía oral o por vía s/c. Si se trata de pacientes añosos, con mayores probabilidades de instalar un delirio corticoideo se utilizará la mitad de la dosis. A veces es difícil en los pacientes neoplásicos añosos realizar un diagnóstico diferencial entre metástasis cerebrales y un accidente vascular. En ese caso, se realizará un tratamiento de prueba con Dexametasona, si se trata de metástasis obtendremos una respuesta clínica favorable, en 24 hs. Deberá recordarse siempre indicar protección gástrica con el uso de corticoides. TRATAMIENTO NO ESPECÍFICO Los Analgésicos 248 El objetivo es controlar el dolor las 24 horas preferentemente con un tratamiento oral, manteniendo al enfermo lúcido y con los menores efectos secundarios posibles. Dolor leve Paracetamol: 500 mg v/o c/4 horas Aspirina: 500 mg v/o c/4 horas con protección gástrica Ibuprofeno: 400 mg/ v/o c/6 - 8 horas Dolor moderado Ketorolac 20 mg v/o c/ 4 horas con protección gástrica Dipirona + Propoxifeno: 400 mg + 70 mg c/4 a 6 hs. v/o. Tramadol: 50 - 100 mg c/4 a 6 hs v/o Dolor Severo LA MORFINA Y LOS FALSOS MITOS Dependencia física versus adicción. La confusión entre estos términos, tanto para los médicos como para los pacientes, constituye uno de los principales obstáculos para el uso de la morfina. Todos los pacientes que requieren un medicamento específico para el control de un síntoma o de una enfermedad dependen de una droga, el paciente asmático depende de los broncodilatadores y el diabético de la insulina. Así también el paciente con dolor crónico e intenso dependerá de la morfina. Debe distinguirse además la dependencia física, término que se utiliza para describir el fenómeno del síndrome de abstinencia de la Morfina de la adicción, término que describe la alteración de una conducta y traduce la dependencia sicológica de una droga. Se debe recordar que la morfina v/o o s/c no suele producir adicción en el enfermo con dolor, la morfinomanía se desarrolla, en personalidades predispuestas, por el abuso de Morfina por vía i/v. LA MORFINA NO TIENE TECHO No existe una dosis máxima limitante de la morfina. Un paciente que ha recibido altas dosis de morfina durante un largo período puede y debe recibir la dosis necesaria para mantenerse sin dolor. Ello no afectará su estado de conciencia, no provocará depresión respiratoria, ni afectará sus habilidades para desarrollar sus tareas habituales. 249 LA TOLERANCIA Se puede desarrollar cierta tolerancia en las primeras semanas del tratamiento. Ello puede controlarse fácilmente aumentando ligeramente las dosis para mantener al paciente sin dolor. Es una falsa creencia, sin ningún fundamento empírico, manifiestan médicos y pacientes de que será el temor que necesario aumentar permanentemente la dosis de morfina a lo largo de la enfermedad. Probablemente la situación inversa es la que vemos con mayor frecuencia, una vez que se titula la dosis necesaria para mantener a un paciente sin dolor, es raro tener que aumentarla. LA DEPRESIÓN RESPIRATORIA En nuestra experiencia jamás hemos visto casos de depresión respiratoria provocados por morfina. Antes bien, hemos tratado casos de disnea severa con morfina. En esta situación, como se verá más adelante, se titula la dosis de morfina a la frecuencia respiratoria . EL USO DE LA MORFINA Continúa siendo el medicamento más útil de los analgésicos mayores. Se absorbe bien por vía oral, se obtiene el pico máximo de concentración sanguínea aproximadamente a las dos horas y su vida media plasmática no excede las 4 horas por lo cual deberá indicarse siempre con esa frecuencia. La Morfina se presenta en forma oral como Licor de Brompton 300 o 600. El Licor de Brompton 300 contiene 3 mg de sulfato de Morfina en cada ml., en cambio el Licor de 600 contiene 6 mg en cada ml. Conviene indicarle al paciente que dosifique en cc. utilizando para ello una jeringa. Por ejemplo: si un paciente ya no controla más el dolor con Dextropropoxifeno o Tramadol a dosis máximas se comenzará con Licor de Brompton 10 mg cada 4 horas, pudiéndose aumentar la dosis cada 24 - 48 horas. La progresión sugerida es la siguiente: 10 mg 120, 150 mg son 20 mg 30 mg 45 mg 60 mg (90, raramente necesarios). Se debe prevenir al enfermo que 250 podrá estar somnoliento al inicio del tratamiento pero que rápidamente este efecto desaparecerá; puede también padecer náuseas y ocasionalmente alucinaciones pero se debe insistir en que no abandone el tratamiento ya que en 48 – 72 horas se desarrolla la tolerancia a los efectos secundarios de la morfina permaneciendo sólo la analgesia. MORFINA SUBCUTÁNEA Si el paciente presenta intolerancia digestiva alta se deberá usar morfina por vía s/c. El clorhidrato de morfina es al menos 2 veces más activo en inyección que por boca. Se dividirá por lo tanto la dosis diaria total entre dos y se administrará en inyecciones subcutáneas cada 4 horas. Recordar que una ampolla al 1% contiene 10 mg de morfina. En algunas circunstancias se comenzará con Morfina s/c de entrada, 10 mg cada 4 hs. es la dosis de comienzo. En esta situación se colocará una mariposa 23 que se abandona en el tejido subcutáneo y se fija correctamente. De esta manera, se evitan las punciones a repetición y se puede utilizar toda la medicación necesaria por esta vía. Generalmente, la duración de una vía s/c en estas condiciones es de 7 a 10 días. TRATAMIENTO DE LOS EFECTOS SECUNDARIOS DE LA MORFINA LAS NÁUSEAS Y LOS VÓMITOS Cerca del 50% de los pacientes presentan náuseas al inicio del tratamiento con morfina, las Fenotiacinas y las Butirofenonas son los antieméticos específicos de elección. Por ejemplo: Clorpromacina (Largactil®) 25 mg, medio comprimido o media ampolla, (12,5 mg) v/o o s/c, cada 8 horas, comenzando con la primera dosis media hora antes de la morfina. Alternativamente se podrá usar Haloperidol, 1 a 3 mg v/o o s/c cada 8 hs. Esta indicación se aplicará para el uso de la morfina en cualquiera de sus presentaciones: licor de Brompton, ampollas o comprimidos de liberación lenta. Dado que se desarrolla tolerancia a estos síntomas aproximadamente en una semana se podrá discontinuar la indicación de los antieméticos. CONSTIPACIÓN 251 Este es uno de los efectos secundarios de más difícil manejo. Es importante prevenir al paciente. Se recomendará una dieta rica en residuos y se indicará Lactulon, una cucharada sopera media hora antes de las comidas, más Orvilax 15 a 30 gotas en la noche. SOMNOLENCIA Los ancianos son particularmente propensos a desarrollar somnolencia cuando reciben morfina, por lo que se recomienda en este grupo de pacientes comenzar con dosis menores. De cualquier forma este efecto se resuelve en 48 - 72 horas dado que se desarrolla tolerancia al mismo. MIOCLONIAS Ocasionalmente, las dosis elevadas de morfina pueden producir mioclonias que se controlan fácilmente con Diazepam 5mg v/o cada 8hs. o si fuera necesario Midazolám media ampolla s/c cada 8hs. Precauciones La ictericia no es una contraindicación al uso de la morfina pero es una seria limitante para su dosificación. Si la bilirrubina total es superior a 2 mg comenzamos con morfina 5 mg cada 8 hs. aumentando la frecuencia y la dosis cada 24 hs. con estrecha vigilancia del estado de conciencia del paciente. Procedemos de la misma manera en caso de insuficiencia renal con más de 3 mg de creatininemia. ALTERNATIVAS A LA MORFINA DE ACCIÓN INMEDIATA MORFINA ORAL DE ACCIÓN RETARDADA Una vez titulada la dosis con la morfina de acción inmediata (Licor de Brompton o ampollas) es más práctico pasar a una presentación de acción retardada. La equivalencia es mg a mg. Por ejemplo, si la dosis diaria total es de 120 mg se indicarán 60 mg v/o cada 12 horas. Sulfato de Morfina (SM Retard®): Cápsulas de 30, 60, 100 mg y se indican cada 12 horas. 252 Clorhidrato de Morfina (Vendal®): Cápsulas de 30, 60, 100 y 200 mg También se administra cada 12 horas. Dosis de rescate Una vez que se instaura un tratamiento con una forma de liberación lenta de morfina debe advertirse al paciente que pueden producirse “escapes” de dolor y que para manejarlo deberá suplementar morfina de acción rápida (licor de Brompton o ampollas s/c). Cada dosis de rescate será de 1/6 de la dosis total de morfina diaria y puede repetirse según necesidad sin alterar por ello el horario de administración de la morfina de liberación lenta. Por ejemplo, si un paciente recibe SM Retard 100 mg v/o cada 12hs., la dosis diaria será de 200 mg y por ende cada dosis de rescate será de aproximadamente 30 mg. Si las dosis de rescate son muy frecuentes ello es indicación de aumentar la dosis del preparado de liberación lenta. VÍA TRANSDÉRMICA Una vez titulada la dosis de morfina una alternativa puede ser pasar a la vía transdérmica: Parches de Fentanilo (Durogesic®). Existen parches que liberan 25, 50, 75 y 100.µg/hora. La equivalencia con la morfina oral es la siguiente: Dosis total de Fentanilo Dosis total de morfina v/o en mg. por 24 hs . 25 µg/hora: ‹ 120 50 µg/hora: 150 - 250 75 µg/hora: 250 - 320 100 µg/hora: 320 - 400 CADA PARCHE TIENE UNA VIDA ÚTIL DE 48 A 72 HS. SE DEBE SEGUIR AL PACIENTE CADA 48 HS. HASTA TITULAR LAS DOSIS ADECUADAS DE MORFINA V/O POR FENTANILO. SE DEBE CONTINUAR CON LA 12 HS. MÁS, YA QUE EL PICO MÁXIMO DE FENTANILO SE OBTIENE A LAS 18 HS. EL PROCEDIMIENTO ES ENGORROSO Y LOS PARCHES SON CAROS. FRECUENTEMENTE SE PRODUCEN LESIONES EN LA PIEL SOBRE LA ZONA EN QUE SE PEGA EL PARCHE. TIENE LA VENTAJA DE QUE UNA VEZ DETERMINADA LA DOSIS NECESARIA EL PACIENTE PERMANECE CON UNA ANALGESIA DE 48 A 72 HS. DE DURACIÓN SIN DEPENDER DE OTRA 253 MEDICACIÓN, SALVO EVENTUALES ESCAPES DE DOLOR PARA LOS CUALES DEBERÁ PROVEERSE AL PACIENTE DE DOSIS DE MORFINA DE RESCATE. COADYUVANTES DE LOS ANALGESICOS En algunas situaciones se debe complementar la analgesia lograda con Morfina con otros fármacos, que pueden potenciar su acción analgésica permitiendo, a veces, no seguir aumentando las dosis de Morfina. Un ejemplo es el dolor neuropático: la neuralgia post-herpética, el dolor por plexopatías o por polineuropatías. Los analgésicos coadyuvantes en estos casos son: Amitriptilina, 25 mg v/o en la noche aumentando hasta llegar a los 75 mg. Gabapentín, 300 mg v/o por día hasta llegar a 1.200 mg por día Dexametasona, 4 a 8 mg v/o o s/c, cada 8 hs. Carbamazepina, 100 mg c/ 12 hs. hasta llegar a 1.200 mg día IV. TRATAMIENTO DE LOS TRATORNOS DIGESTIVOS TRATAMIENTO ETIOLÓGICO DE LAS NÁUSEAS Y LOS VÓMITOS Deberán descartarse algunas etiologías que tienen tratamiento específico. HIPERCALCEMIA Debe recordarse que una presentación clínica frecuente de la hipercalcemia son los vómitos sin causa clínica aparente. Se debe sospechar además en los pacientes que presentan un estado confusional sin signos focales neurológicos, tengan o no un secundarismo óseo extenso. La hipercalcemia leve (hasta 13 mg/dl) puede ser tratada con rehidratación i/v (suero fisiológico 3 a 4 litros por día) y glucocorticoides: prednisona 60 mg/día reduciendo luego la dosis progresivamente. La hipercalcemia severa requiere además del uso de los bifosfonatos. Recomendamos Pamidronato 90 mg i/v a pasar en 2-3 horas. HIPERTENSION ENDOCRANEANA Dexametasona 8mg. c/8 horas v/o, s/c o i/v, reduciendo lentamente si es posible. La radioterapia se discutirá según la situación clínica del paciente. 254 LOS VÓMITOS POR OBSTRUCCIÓN Son muy frecuentes en los últimos estadios del cáncer abdominal y/o pelviano. Se instalan progresivamente y son intermitentes al inicio. La vaselina líquida se utiliza precozmente acompañada de un antiperistáltico como la loperamida en caso de cólicos dolorosos. A medida que el estado del paciente evoluciona los analgésicos y los antieméticos serán necesarios de inicio por vía oral, más tarde en inyectable: Metil bromuro de hioscina (Buscapina simple®), 1 amp. s/c cada 4 hs.; Atropina, 0,5 mg. cada 8 hs., además de la Morfina. De esta manera se logra evitar la colocación de una sonda nasogástrica en la mayoría de los casos. TRATAMIENTO SINTOMÁTICO DE LAS NÁUSEAS Y LOS VÓMITOS En algunos casos, cuando no existe un tratamiento específico se recurrirá a los antieméticos: las Fenotiacinas y las Butirofenonas son los medicamentos más útiles. En los vómitos incoercibles, una asociación de medicamentos de diferentes grupos es más eficaz que el uso de un solo fármaco. Haloperidol Clorpromacina 1 a 3 mg s/c cada 8 hs. (Largactil®): Metoclopramida (Primperán®): 12,5 c/8 hs. v/o o s/c Es particularmente útil cuando los vómitos se deben a un retardo de la evacuación gástrica. Cualquiera sea la presentación la dosis es 10 mg 3-6 veces al día v/o o s/c . En Ondansentrón 8 mg s/c cada 6 hs. Dexametasona 4 mg s/c cada 8 hs. adultos mayores se prefiere la Domperidona dado que con la Metoclopramida pueden presentarse efectos extrapiramidales. LA ANOREXIA Es muy común en los enfermos con una afección maligna diseminada. Según la experiencia del equipo del St. Christopher los esteroides constituyen el único tratamiento eficaz: prednisona 15-30 mg por día. El alcohol antes o durante la comida puede ser un estimulante del apetito. 255 Nosotros usamos la prednisona a razón de 10 mg. por día, durante 10 días, generalmente a la semana se manifiesta el efecto estimulante del apetito. No es útil mantener el tratamiento por más de 10 días. Una alternativa que ha mostrado cierta eficacia es el uso de los progestágenos como el acetato de megestrol (Megace®) a dosis de 160 mg/día. Debe recordarse a la familia que no es conveniente insistir ni alimentar a la fuerza y que los suplementos alimentarios no son útiles. Finalmente debe recordarse que la desnutrición y la deshidratación son parte de la enfermedad crónica y por tanto su manejo y significación son diferentes con respecto a las situaciones agudas. LA BOCA SECA Y DOLOROSA Este síntoma puede deberse a la sobre-infección por Cándida, deshidratación, o por la medicación anticolinérgica. La higiene de la boca es importante así como la identificación precoz del muguet: tratamiento de la boca y dientes con nistatina (Micostatina®) en suspensión a la dosis de 100.000 unidades por ml, 4 veces por día. Enjuagues bucales cada 2-4 horas con soluciones antisépticas. Ante la presencia de Herpes: Aciclovir suspensión: 200mg/5ml 4 veces al día. En caso de dolor son útiles los enjuagues bucales con una solución de Mylanta® 1/3, Benadryl® 1/3 y Xilocaína viscosa 1/3. No utilizamos nunca la vía intravenosa ni la sonda nasogástrica. Es perfectamente posible corregir la sequedad de boca con medidas locales: líquidos frecuentes en pequeñas cantidades, realizando un cuidado meticuloso de la boca. HIPO La clorpromazina (Largactil®) 12,5 mg cada 8 hs., vía oral o subcutánea y la metoclopramida (Primperán®) 10 mg cada 8 hs., vía oral o subcutánea pueden ser eficaces. CONSTIPACIÓN 256 La mayoría de los pacientes oncológicos, ancianos y en estadíos terminales de la enfermedad son constipados, debido a múltiples factores: inmovilidad, anorexia, régimen con pocos residuos, medicamentos analgésicos. La mejor forma de tratarlos es con una asociación de laxantes y un estimulante del peristaltismo (Lactulón, Normacol y Orvilax). Es importante ser regular en la prescripción y la toma de esta asociación. En caso de ser ineficaz el laxante puede ser necesario recurrir a un enema evacuador. DIARREA Puede ser secundaria al tratamiento de la constipación o a una obstrucción funcional. Puede deberse también a malabsorción, en general, por insuficiencia pancreática, pudiendo ser útil la indicación de extractos pancreáticos. En nuestra experiencia hemos verificado la importancia del uso de estos extractos, sobre todo en los casos de carcinomatosis peritoneal o de masa abdominal adherida al páncreas. En el carcinoma rectal la diarrea acompaña a los signos rectales, puede ser mejorada con el uso de prednisona y con enemas a retener con Rectogel® agregando Hioscina s/c. V. EL CONTROL DE LOS TRASTORNOS RESPIRATORIOS DISNEA En primer lugar se trata de determinar la causa de la disnea para instituir un tratamiento específico: derrame pleural, TEP, anemia, insuficiencia cardíaca, neumonia, tumor, linfangitis carcinomatosa. Desde el punto de vista sintomático algunos medicamentos tienen un interés particular: GLUCOCORTICOIDES: La obstrucción de la vena cava superior puede ser tratada con dexametasona 8-12 mg por día, sea previo a la radioterapia o sola si esta no está indicada. La mismas dosis también son eficaces en la disnea por linfangitis carcinomatosa. La dexametasona 4-8 mg. por día o la prednisona 30-40 mg día son igualmente eficaces para el broncoespasmo. 257 MORFINA Reduce la sensación de disnea. Se comienza con una dosis de 5 mg. s/c cada 4 hs. Se puede suplementar con 2, 5 mg. s/c según necesidad Se aumentará la dosis fija cada 24 hs. ANTIBIÓTICOS: Siempre deberá plantearse eliminar una posible infección sobreagregada. Se utilizará antibioticoterapia empírica. ATROPINA: Su uso evita la acumulación de secreciones respiratorias y evita la necesidad de realizar broncoaspiraciones. Debe indicarse precozmente, antes de que se acumulen las secreciones. Se administra la dosis de 0,5 mg. s/c cada 8 hs. Una alternativa puede ser la Hioscina una amp. s/c c/4 hs. OXÍGENO: No suele ser de utilidad en estos casos salvo la presencia de hipoxemia y por su efecto placebo. TOS Se debe suprimir la tos improductiva para permitir el reposo. Se utilizará la Dihidrocodeinona (Tussionex, comprimidos de 5 mg) 3 a 6 comprimidos por día. Aunque clínicamente inaparente, el broncoespasmo siempre es un componente de la disnea y la tos crónica. Deben agregarse siempre los beta 2 inhaladores junto a los corticoides y a los antitusígenos. VI. EL CONTROL DE LOS TRASTORNOS CUTÁNEOS LAS LESIONES NEOPLÁSICAS CUTÁNEAS El cáncer de mama es el que más se acompaña de lesiones neoplásicas proliferativas y ulceradas. La limpieza regular es esencial. Aconsejamos el lavado con suero fisiológico dos veces al día. 258 Para las lesiones vulvares, el gluconato de clorexidina en solución de 1/2000 de principio activo se utiliza para irrigaciones frecuentes. Una gasa impregnada de una solución de adrenalina al 1/1000, controla eficazmente las hemorragias capilares. El tratamiento con antibióticos apropiados por vía sistémica puede ayudar a reducir las infecciones con secreciones. Se deberá usa metronidazol si se sospecha de infección anaeróbica. EL PRURITO En caso de irritación provocada por estasis biliar, la colestiramina es el medicamento de elección: 1 a 4 veces al día, nosotros obtuvimos buenos resultados con Prednisona 5 a 20 mg/día. Un antihistamínico, por ejemplo Prometacina (Fenergan) 25 mg por la noche. Los esteroides tópicos son un tratamiento antipruriginoso útil. VII. EL CONTROL DE LOS TRASTORNOS NEUROPSIQUIÁTRICOS INSOMNIO Es preferible evitar los barbitúricos y las benzodiacepinas de acción prolongada. Las benzodiacepinas de acción corta (Ativan) son las mejores ya que no poseen sedación por acumulación. Preferiblemente nosotros utilizamos el Midazolam (Dormicum) que se puede repetir a las 4 hrs. La sudoración nocturna, con o sin fiebre (síndrome paraneoplásico muy frecuente) puede ser una de las causas de insomnio y responde la mayoría de las veces a la Indometacina: 25mg. v/o cada 8hs. Ansiedad y depresión Dos clases de medicamentos pueden ser útiles: las benzodiacepinas y las fenotiacinas. Lorazepám 2 mg. v/o, cada 6 a 8 hs. Clorpromacina (Largactil) 10-25 mg. tres veces al día. Frente a la depresión son de elección los antidepresivos tricíclicos, especialmente en aquellos pacientes con una enfermedad prolongada. Por 259 ejemplo: Imipramina 25 mg v/o a la noche con aumentos progresivos hasta 75 mg . En ancianos se aconseja el uso de las ISRS (por ejemplo sertralina) SÍNDROME CONFUSIONAL La confusión en la fase terminal es frecuente y se acompaña de dificultades diagnósticas. Es necesario esforzarse en hacer un diagnóstico etiológico de la confusión ya que se dispone de tratamientos específicos: antibióticos en caso de infecciones pulmonares o urinarias, reducción de la dosis de sedantes, empleo de corticoides en caso de metástasis cerebrales; siempre deberá descartarse el sindrome confusional de causa metabólica. Para el tratamiento sintomático de la confusión y/o agitación con o sin delirio nosotros utilizamos preferentemente: Haloperidol: 5 - 10 mg s/c, útil en caso de urgencia, por su acción rápida. Se puede administrar seguidamente 5 - 10 mg por día, en dosis fraccionadas por v/o o s/c. Thioridazina (Meleril): 25 mg 3 veces al día, conveniente para los enfermos añosos porque no provoca una sedación importante. Clorpromazina (Largactil) 50mg de inicio, seguido de 25 mg tres veces por día, es útil si se busca una buena sedación. Levomepromazina (Nozinam) ½ amp., 12,5 mg. s/c, cada 8 – 12 hs. Corofodin C 10 gotas, cada 8hs. (contiene fenobarbital cloropromacina y codeína). CONVULSIONES No es habitual dar anticonvulsivantes preventivamente, pero si sobreviene una crisis convulsiva, se puede utilizar el valproato de sodio 200 mg tres veces por día o comitoína simple un comprimido tres veces por día. En caso de que el paciente no pueda tomar anticonvulsivantes por vía oral, utilizamos Midazolam 1 amp. s/c a repetir cada 4 hs., o bien, el Fenobarbital 60 mg. s/c dos veces al día. AGITACIÓN TERMINAL Ella puede ser debida al dolor, a una distensión del recto o de vesícula, pero lo más frecuente es que no haya una causa evidente. El mejor medicamento en este caso es la levomepromacina (Nozinam) por sus propiedades sedantes: 25 mg inyectable s/c a repetir cada 8 o 12 hs. Se podrá asociar Morfina s/c si es necesario. 260 En nuestra práctica jamás abandonamos la medicación antes de la muerte del paciente. Medicación que puede usarse por vía s/c. Haloperidol Clorpromazina Fenobarbital Midazolam Levomepromacina Metoclopramida Ondansentrón Hioscina Dexametasona Morfina Atropina Furosemide Ranitidina 261 ALGORITMO DIAGNOSTICO - TERAPEUTICO DE LAS NEUTROPENIAS FEBRILES DEFINICIONES Fiebre: se establece con una temperatura oral mayor o igual a 38.3° Centígrados (101 °F) o una temperatura igual o mayor de 38° Centígrados (100.4°F) durante al menos una hora. Neutropenia: se define como un recuento absoluto de neutrófilos inferior a 1500. Según las cifras, se establecen grados de severidad considerándose leve entre 1500 y 1000, moderada cuando es menor de 1000 y mayor de 500, y severa cuando es menor de 500 neutrófilos. Según el N.C.I.(National Cancer Institute) los grados de toxicidad sobre la cifra de neutrófilos se definen en el siguiente orden: Figura 1. Grado 1 1500 a 1799 Grado 2 1000 a 1499 Grado 3 500 a 999 Grado 4 <500. ESTRATIFICACION DEL RIESGO PARA INFECCIONES Se establecen diferentes riesgos de padecer infecciones bacterianas en función de: Recuento absoluto de neutrófilos. Estado de la médula ósea. Duración de la neutropenia. 1-figura 1 262 2-La relación entre grado de neutropenia y riesgo de infección se ajusta bien a situaciones donde la producción de neutrófilos está afectada; ya sea en la maduración de stem cells o mieloblastos , o cuando la médula es hipocelular. 3-La duración de la neutropenia también tiene su importancia en el riesgo para infecciones y establece un grupo de bajo riesgo si la neutropenia es menor a 7 días y un grupo de alto riesgo cuando dura más de 7 días. EVALUACION CLINICA -Historia clínica exhaustiva. -Investigar exposición inusual a gérmenes y factores de riesgo adicionales. -Establecer el 1er día de fiebre y su relación con el 1er día de la Quimioterapia. -Consignar si recibió derivados sanguíneos o CSF en las 6 hs previas a la fiebre. OTROS FACTORES QUE PREDISPONEN A LA INFECCION: -Presencia de accesos venosos a permanencia (Port-a cath). -Lesiones mucocutáneas por los tratamientos o por invasión tumoral. -Realización de maniobras invasivas (punciones venosas o de médula ósea). -Inmunodepresión debido a la enfermedad de base. -Otros tratamientos que deprimen la función granulocitaria y macrofágica (corticoesteroides). -Esplenectomía. -Malnutrición. -Adquisición de flora bacteriana intrahospitalaria durante la internación. EVALUACION PARACLINICA 263 ENCUESTA MICROBIOLOGICA -Hongos -Bacterias - 2 Hemocultivos Si existe vía central, 2 muestras de ésta y 2 de la vía periférica. - Orina con sedimento - Urocultivo - Exudado, - Faríngeo* Directo con gram - Nasal* - Toda lesión o acceso venoso con supuración o inflamación - Coprocultivo En presencia de diarrea - Par radiológico de tórax Basal siempre, en la evolución si existen síntomas o signo respiratorios - Fibrobroncoscopía con lavado bronquioloalveolar y biopsia, Si no existe riesgo de sangrado y se sospecha infección no aislada aún. - Estudios imagenológicos: TAC, ecografía, RMN, radioisótopos, De utilidad cuando no se puede determinar foco infeccioso. - Determinación por técnicas de PCR: agentes infectantes de lento crecimiento, exigentes en los medios de cultivo y determinación de carga viral. * Pueden ser de utilidad para prevenir transmisión nosocomial y conocer el perfil microbiológico local. - Examen de líquido cefalorraquídeo. Sólo si se sospecha infección del SNC 264 CONTROL DE TRATAMIENTO Y SOPORTE - Hemograma diario Descartar al inicio seudoneutropenia por paraproteína, anticoagulantes o error de técnica - Ionograma* - Función renal* - Funcional y Enzimograma hepático* -Monitoreo de drogas ATB *Con una frecuencia al menos cada 48 horas. TECNICAS DE AMPLIFICACION DE CULTIVOS DE MICROORGANISMOS POR PCR 1- Detección de organismos altamente infectantes o peligrosos de cultivar HIV, Coxiella Burnetti, Coccidioides 2- Detección de organismos de lento crecimiento micosis profundas M. Tuberculosis, Histoplasmosis 3- Detección de agentes involucrados en encefalitis, donde el diagnóstico precoz evita morbilidad y puede obviar la biopsia cerebral. Herpes virus simple 4- Detección de virus de LCR, sangre, aspirados de médula ósea de pacientes trasplantados Parvovirus, Enterovirus, CMV 5- Detección de gérmenes cuyos medios de cultivos no se disponen fácilmente Toxoplasma Gondii, Pneumocistis carinii, T.Pallidum. 265 6- Determinación de carga viral u otros patógenos para emitir pronóstico o para monitorizar el efecto terapéutico de una droga. Cuantificación de HIV TRATAMIENTO DE LA NEUTROPENIA FEBRIL - Medidas generales. - Medidas específicas. MEDIDAS GENERALES - Limitar los contactos interhumanos múltiples. - Lavado de manos del personal de asistencia antes y después de asistir a cada paciente. - No tomar temperatura rectal. - Adecuado manejo de los catéteres. - Higiene corporal cuidadosa. - Higiene bucofaríngea con cepillo blando y gargarismos boratados más un antiséptico y un antifúngico luego de cada comida. - Alimentación cocida. - Descontaminación intestinal selectiva sólo en NTF largas o en curso de un protocolo. -La administración de vitamina K oral es opcional. TRATAMIENTO ANTIBIÓTICO REQUISITOS BASICOS 266 * ALCANZAR RÁPIDAMENTE CONCENTRACIONES BACTERICIDAS * COBERTURA DE AMPLIO ESPECTRO PARA GÉRMENES DE - flora intestinal - piel - infecciones por catéteres intra-venosos. Se deberán cubrir principalmente: - Gérmenes gram negativos * Escherichia coli * Pseudomona aeruginosa * Especies de klebsiella - Gérmenes gram positivos * Estafilococo dorado * Especies de Estreptococos TRATAMIENTO ANTIBIOTICO 1- ANTIBIOTICOTERAPIA COMBINADA A)DUOTERAPIA SIN VANCOMICINA Aminoglucósido + Cefalosporina 3° con efecto antipseudomona (Ceftazidime) Aminoglucósido + Carboxipenicilina con efecto antipseudomona (Ticarcilina c/s Ac. Clavulánico) 267 Amikacina + Ceftriaxona * * En dosis únicas este plan, tendría igual eficacia que los planes anteriores. Sin embargo no cubre la pseudomona aeruginosa, estafilococo coagulasa negativo y el MRSA. B) VANCOMICINA MAS UNO O DOS ANTIBIOTICOS La vancomicina no es necesaria en el régimen antibiótico empírico inicial de una neutropenia febril, se justifica desde el inicio en situación de alto riesgo. POBLACION DE ALTO RIESGO - Enfermedad grave por infecciones de catéteres. - Pacientes que reciben quimioterapia intensa con serio daño mucoso (altas dosis de citarabina). - Pacientes que reciben quinolonas como profilaxis de los episodios febriles. - Colonización conocida por neumococo resistente a penicilina o estafilococo dorado resistente a cefalosporinas o a meticilina. - Hemocultivos positivos para bacterias gram positivas antes de su identificación, y Los que presenten hipotensión u otra evidencia de falla cardiovascular. Vancomicina + Vancomicina + Ceftazidime Doble Plan (A) 2- MONOTERAPIA ANTIBIOTICA Ceftazidime 268 Imipenem / Cilastatin Meropenem DESVENTAJAS DE LA MONOTERAPIA Inadecuada cobertura para gram + Resistencia de gram - QUINOLONAS* * No se recomienda el uso de quinolonas como monodroga, dado la limitada acción contra estreptococos y la falta de actividad contra los gérmenes anaerobios. TRATAMIENTO ANTIBIOTICO BASADO EN EL RIESGO CRITERIOS DE TALCOTT. GRUPO 1: Pacientes hospitalizados en el momento de la fiebre, recibiendo quimioterapia a altas dosis con TAMO, o con enfermedades hematológicas. Alto riesgo, con una morbilidad de 35% y una mortalidad de 13%. GRUPO 2: Pacientes ambulatorios en el momento de la fiebre, con comorbilidad. Alto riesgo de complicaciones, con una morbilidad de 40% y una mortalidad de 12%. GRUPO 3: Pacientes ambulatorios sin comorbilidad, pero con enfermedad oncológica no controlada. Riesgo moderado a alto, con una morbilidad de 25% y una mortalidad de 18%. 269 GRUPO 4: Pacientes ambulatorios sin comorbilidad, con enfermedad oncológica respondedora. Bajo riesgo, con una tasa de morbilidad inferior a 3% y una mortalidad cercana a 0. GRUPO 4 DE TALCOTT CONCLUSION Con una cuidadosa selección de los pacientes, basada en la determinación del riesgo y un seguimiento frecuente, el tratamiento ambulatorio parenteral u oral puede ser exitoso en los pacientes con neutropenias febriles de bajo riesgo. VENTAJAS - Aumento del índice costo/beneficio - Apropiada utilización de los recursos - Mejora en la calidad de vida - Reducción de las infecciones nosocomiales DESVENTAJAS - Riesgo de complicaciones graves: shock o hemorragia - No cumplimiento del tratamiento oral - Problemas de accesos venosos TRATAMIENTO ANTIBIOTICO EN LOS PACIENTES DE BAJO RIESGO Para el tratamiento ambulatorio de las neutropenias febriles en pacientes con bajo riesgo de complicaciones (grupo 4 de Talcott), en función de: - la cobertura que proporciona, - la buena tolerancia, - la fácil administración y - el costo aceptable; la combinación antibiótica mas razonable sería: 270 quinolona + B lactámico+inhibidor de la b lactamasa OTRAS MEDIDAS TERAPEUTICAS EN LAS NEUTROPENIAS FEBRILES - Uso de factores estimulantes de colonias (CSF) El uso de CSF desde el inicio del tratamiento de una neutropenia febril, se debe limitar a los pacientes de alto riesgo de complicaciones. Se incluyen en este grupo pacientes con neumonías, hipotensión arterial, celulitis y sinusitis severas, infecciones micóticas sistémicas y falla multiorgánica secundaria a sepsis. Se recomienda su utilización en pacientes con neutropenias persistentes con infecciones que no responden al tratamiento antibiótico o cuando la neutropenia puede retrasar una quimioterapia. - Uso de antivirales No existe indicación de uso empírico cuando no hay evidencia de enfermedad viral. En presencia de lesiones cutáneas y/o mucosas por herpes simple o varicela zoster, estaría indicado para evitar que las lesiones sean puerta de entrada para bacterias y hongos. Tiene indicación cuando se documenta infección viral respiratoria. - Uso de antimicóticos Se recomienda la administración empírica de anfotericina B a las neutropenias febriles que no responden al tratamiento antibiótico en 7 días. Luego de 2 semanas si no se demuestra infección micótica debe suspenderse. DURACION DEL TRATAMIENTO ANTIBIOTICO 271 - Mínimo 7 días. - Hasta la negativización de los cultivos. - Hasta la resolución de los sitios de infección y los síntomas. - Al suspender los antibióticos, la cifra de neutrófilos debería ser mayor a 500/mm3. - Sin documentación de foco infeccioso y con recuperación medular; no hay suficiente evidencia para suspender antibióticos antes de los plazos mencionados. - Si el paciente persiste febril, se establecen a los 3 y 7 días dos puntos de atención , para reconsideraciones clínico-paraclínicas. Quedan exceptuados de este plazo de espera para observar respuesta antibiótica (promedio 5 días) ,aquellos pacientes que instalen elementos de falla cardiovascular o multisistémica. RELACION DEL RECUENTO ABSOLUTO DE NEUTRÓFILOS Y EL RIESGO DE INFECCION. >1500 ninguno 1000 – 1500 no hay riesgo significativo, la fiebre puede manejarse en régimen externo 500 – 1000 algún riesgo de infección, la fiebre ocasionalmente se maneja en régimen externo. <500 riesgo significativo de infección, la fiebre debe ser manejada con internación, antibióticoterapia parenteral; pocos signos clínicos de infección. < 200 muy alto riesgo de infección, la fiebre debería siempre manejarse con 272 internación, antibióticoterapia parenteral, pocos o ningún signo clínico de infección. 273