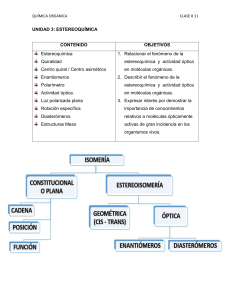
UNIDAD 3: ESTEREOQUÍMICA CONTENIDO OBJETIVOS
Anuncio
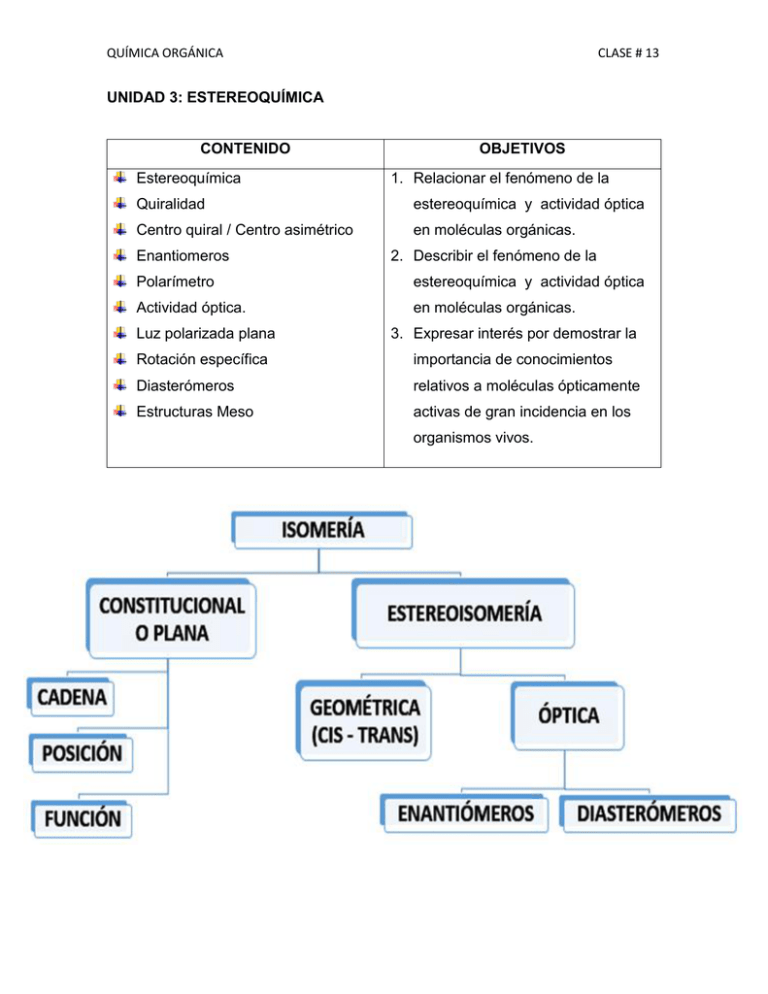
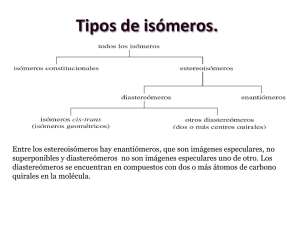
QUÍMICA ORGÁNICA CLASE # 13 UNIDAD 3: ESTEREOQUÍMICA CONTENIDO Estereoquímica OBJETIVOS 1. Relacionar el fenómeno de la Quiralidad estereoquímica y actividad óptica Centro quiral / Centro asimétrico en moléculas orgánicas. Enantiomeros 2. Describir el fenómeno de la Polarímetro estereoquímica y actividad óptica Actividad óptica. en moléculas orgánicas. Luz polarizada plana 3. Expresar interés por demostrar la Rotación específica importancia de conocimientos Diasterómeros relativos a moléculas ópticamente Estructuras Meso activas de gran incidencia en los organismos vivos. QUÍMICA ORGÁNICA CLASE # 13 1. Estereoquímica La estereoquímica es el estudio de los compuestos orgánicos en el espacio. Para comprender las propiedades de los compuestos orgánicos es necesario considerar las tres dimensiones espaciales. Las bases de la estereoquímica fueron puestas por Jacobus van’t Hoff y Le Bel, en el año 1874. De forma independiente propusieron que los cuatro sustituyentes de un carbono se dirigen hacia los vértices de un tetraedro, con el carbono en el centro del mismo. En general a las moléculas que se diferencian por la disposición espacial de sus átomos, se les denomina estereoisómeros. 2. Estereoisómeros Es un isómero que tiene la misma fórmula molecular, también la misma secuencia de átomos enlazados, con los mismos enlaces entre sus átomos, pero difieren en la orientación tridimensional de sus átomos en el espacio. Se diferencian, por tanto, de los isómeros estructurales, en los cuales los átomos están enlazados en un orden diferente dentro de la molécula. Por ejemplo los isómeros cis y trans son estereoisómeros. Son isómeros debido a que tienen la misma fórmula molecular, no son isómeros estructurales debido a que tienen unidos los átomos en el mismo orden. Estos isómeros difieren únicamente en el arreglo de sus átomos en el espacio. cis trans. QUÍMICA ORGÁNICA CLASE # 13 3. Quiralidad El término quiralidad (del griego kéir: mano) fue acuñado por el físico Irlandés William Thomson, alias Lord Kelvin. “Cualquier figura geométrica, o conjunto de puntos, diré que es quiral y que presenta quiralidad, si su imagen en un espejo plano, idealmente realizada, no puede ser superpuesta con ella misma”. QUÍMICA ORGÁNICA CLASE # 13 La quiralidad está a menudo asociada a la presencia de carbonos asimétricos. Un carbono asimétrico es aquel que se une a cuatro sustituyentes diferentes. Un ejemplo de carbono asimétrico lo tenemos en la molécula de Bromocloroyodometano. El carbono está unido a bromo, cloro, yodo e hidrógeno, cuatro sustituyentes diferentes que lo convierten en quiral o asimétrico. La molécula y su imagen en un espejo son diferentes, ningún giro permite superponerlas. 4. Centro quiral / Centro asimétrico Un carbono asimétrico o carbono quiral es un átomo de carbono que está enlazado con cuatro sustituyentes o elementos diferentes. Puede presentarse en algunos compuestos orgánicos, es decir, en aquellos que están presentes en los seres vivos, como los glúcidos. Glucosa 5. Enantiómeros La presencia de uno o varios átomos de carbono asimétrico en un compuesto químico es responsable de la existencia de isomería óptica. Cada una de las dos estructuras diferentes que pueden formarse tiene los mismos átomos y los mismos enlaces pero no pueden superponerse una sobre otra, como ocurre con las dos manos de una persona. Se llaman enantiómeros y se diferencian en la dirección en la que desvían la luz polarizada por lo que se llaman formas ópticamente activas. En la práctica para para identificar a una molécula estereoquímica se utiliza: A. El polarímetro B. Se estudia su reacción frente a otras sustancias. QUÍMICA ORGÁNICA CLASE # 13 A. Polarímetro Instrumento mediante el cual se puede determinar el valor de la desviación de la luz polarizada por un estereoisómero ópticamente activo (enantiómero). A partir de un rayo de luz, a través de un filtro polarizador se obtiene un rayo de luz polarizada plana, que al pasar por una porta muestras que contiene un enantiómero en disolución, se desvía. Según la orientación relativa entre los ejes de los dos filtros polarizantes, la luz polarizada pasará por el segundo filtro o no. a. Polarización de la luz La luz polarizada se puede definir como un conjunto de ondas luminosas que vibran todas ellas en un solo plano, mientras que en la luz no polarizada el plano de vibración varía rápidamente, a razón de cien millones de veces por segundo. En comparación con algunos animales, el ojo humano no es capaz de distinguir entre la luz polarizada y la no polarizada. Esta es utilizada para distinguir la estereoquímica de los compuestos orgánicos, mediante el instrumento denominado polarímetro. En el polarímetro cuando un haz de luz polarizada en un plano pasa por una solución de ciertas moléculas orgánicas el plano de polarización QUÍMICA ORGÁNICA CLASE # 13 gira, (no todas las sustancias orgánicas presentan dicha propiedad, pero las que si lo presentan se les denomina, moléculas óptimamente activas), en sí, se determina el valor de la desviación de la luz polarizada por un estéreo isómero óptimamente activo (enantiómero). El rayo de luz, pasa través de un filtro polarizador, con eso obtenemos un rayo de luz polarizada plana, que al pasar por un tubo de muestra que contiene un enantiómero en disolución, esta se desvía y (se origina la rotación del plano de polarización), posteriormente la luz pasa por un segundo polarizador llamado analizador según la orientación relativa entre los ejes de los dos filtros polarizantes, la luz polarizada pasará ya sea por el segundo filtro o no, si logra pasar, se hace girar el analizador hasta que lo atraviesa la luz, así se podrá determinar el nuevo plano de polarización y se podrá decir hasta qué grado de ha producido la rotación, esta rotación se expresa con una alfa griega y se expresan los grados]. b. Actividad óptica La luz polarizada se caracteriza porque vibra en un solo plano, pero hay algunas sustancias que hacen que este plano gire, en ese caso decimos que la sustancia es ópticamente activa. Los enantiómeros presentan propiedades físicas idénticas, con la excepción de su comportamiento frente a la luz polarizada. Un enantiómero gira el plano de la luz polarizada en el sentido de las agujas del reloj, es dextrógiro (+). El otro enantiómero provoca rotación en el sentido contrario al de las agujas del reloj, es levógiro (-). Este fenómeno asociado a sustancias quirales se conoce como actividad óptica. B. En cómo reaccionan frente a otras sustancias Los enantiómeros se comportan por igual frente a un reactivo químico aquiral (simétrico) o frente a las mediciones escalares (simétricas). Cada enantiómero reacciona con la misma velocidad frente a un reactivo aquiral. Ambos enantiómeros presenta iguales propiedades físicas escalares, tales como: punto de fusión, punto de ebullición, presión de vapor, índice de refracción, densidad espectro UV, etc. Sin embargo, cada enantiómero reacciona a velocidad diferente frente a los reactivos QUÍMICA ORGÁNICA CLASE # 13 quirales, de la misma manera que un guante derecho se relaciona en forma distinta con una mano derecha que con una izquierda. Los enantiómeros también muestran comportamiento diferente frente a las mediciones físicas quirales, tales como rotación óptica, dispersión rotatoria óptica. Un caso muy marcado de diferenciación de enantiómeros frente a reactivos quirales es el que se presenta en las reacciones bioquímicas entre reactivos quirales (sustratos) y las enzimas; usualmente la diferencia de reactividad de dos enantiómeros frente a una enzima es tan grande que solamente uno de ellos reacciona. Esto nos explica, por ejemplo, la diferencia previamente mencionada entre las propiedades antibióticas de dos enantiómeros, o entre sus respectivos sabores. CASO DE LA TALIDOMIDA La talidomida, que fue desarrollada por la compañía farmacéutica alemana Grünenthal Gmb H, es un fármaco que fue comercializado entre los años 1957 y 1963 como sedante y como calmante de las náuseas durante los tres primeros meses de embarazo (hiperémesis gravídica). Como sedante tuvo un gran éxito popular ya que, en un principio, se creyó que no causaba casi ningún efecto secundario y, en caso de ingestión masiva, no resultaba letal. Este medicamento, producido por Grünenthal GmbH en Alemania, provocó miles de nacimientos de bebés afectados de focomelia, anomalía congénita que se caracterizaba por la carencia o excesiva cortedad de las extremidades. La talidomida afectaba a los fetos de dos maneras: bien que la madre tomara el medicamento directamente como sedante o calmante de náuseas o bien que fuera el padre quien lo tomase, ya que la talidomida afectaba al esperma transmitiendo los efectos nocivos desde el momento de la concepción. Una vez comprobados los efectos teratogénicos nocivos del medicamento (que provocaban malformaciones congénitas) descubiertos inicialmente por el doctor Widukind Lenz y su compañero de la Clínica Universitaria de Hamburgo, el español Claus Knapp, este fue retirado con más o menos prisa en los países donde había QUÍMICA ORGÁNICA CLASE # 13 sido comercializado bajo diferentes nombres. España fue de los últimos, pues lo retiró en 1963. Investigando se descubrió que había dos talidomidas distintas, aunque de igual fórmula molecular, en las cuales cambiaba la disposición de los grupos en un carbono, cosa que hasta entonces no se tenía en cuenta. Se trataba, por tanto, de una sola molécula con dos enantiómeros. Están pues (según la nomenclatura actual) la forma R (que producía el efecto sedante que se buscaba) y la S (que producía efectos teratogénicos y la que causaba focomelia). Este descubrimiento produjo que a partir de ese momento se tuviese en cuenta la estereoisomería en moléculas, utilizando el sistema R/S actual. La talidomida fue comercializada bajo estos nombres (entre otros): Imidan, Varian, Contergan, Gluto Naftil, Softenon, Noctosediv, Entero-sediv, Entero-SedivSuspenso… 6. Diasterómeros Estereoisómeros que no son imágenes especulares entre sí. Los diasterómeros tienen propiedades químicas similares puesto que son miembros de la misma familia; sin embargo, no son idénticas. En la relación de dos diasterómeros con una sustancia determinada, ninguno de los dos conjuntos de reaccionantes ni de los estados de transición son imágenes especulares, por lo que –salvo por pura coincidencia- no serán de energías iguales. QUÍMICA ORGÁNICA CLASE # 13 Los diasterómeros tienen diferentes propiedades físicas: distintos puntos de fusión y de ebullición, solubilidades en un solvente determinado, índices de refracción, etcétera. También difieren en la rotación específica: pueden tener igual o diferente signo de rotación y algunos pueden ser inactivos. Como consecuencia de sus diferencias en puntos de ebullición y solubilidades, al menos en principio, pueden separarse por destilación o cristalización fraccionadas; igualmente, debido a diferencias en forma molecular y polaridad, difieren en adsorción, por lo que pueden separarse por cromatografía. 7. Compuesto Meso Se llaman compuestos meso a aquellos que tienen átomos de carbonos asimétricos pero son aquirales. En estos casos, la imagen especular de estos, es en sí, el mismo compuesto. Este tipo de compuestos no presenta actividad óptica y presentan un plano de simetría que divide en dos la molécula. Uno de los requisitos de los compuestos meso es tener por lo menos dos sustituyentes en común. Aunque este es un requisito, hay compuestos que presentan esta característica y no son compuestos meso. Por ejemplo, en el 2,4-pentanodiol, tanto el segundo y cuarto átomos de carbono, que tienen estereocentros, tienen los cuatros sustituyentes en común. Dado que un isómero meso tiene una imagen especular superponible, un compuesto con un total de n estereocentros no puede tener 2 n estereoisómeros, dado que uno de ellos es meso. Los compuestos meso se basan en el número de centros estereogénicos representado por la fórmula de 2 a la n, n siendo el número de centros quirales para determinar la cantidad de estereoisómeros que tiene la molécula. 8. Proyecciones de Fischer ¿Cómo hacer una proyección de Fischer? Proyectar consiste en dibujar en dos dimensiones (plano) una molécula. En la proyección de Fischer la molécula se dibuja en forma de cruz con los sustituyentes QUÍMICA ORGÁNICA CLASE # 13 con los sustituyentes que van al fondo del plano en la vertical y los grupos que salen hacia nosotros en la horizontal, el punto intersección de ambas líneas representa el carbono proyectado. La proyección de Fischer puede hacerse para varios carbonos de la molécula. El primer paso consiste en dibujar la molécula eclipsada y en segundo lugar girarla dejando unos grupos hacia nosotros y otros al fondo del papel. QUÍMICA ORGÁNICA CLASE # 13 El número de isómeros puede calcularse a partir de la fórmula 2n , donde n es el número de centro quirales, aunque en algunos casos el número es menor debido a los meso. Ejemplo1: Un compuesto con n átomos de carbono asimétricos, en teoría deberá tener 2n estereoisómeros. 1. Identificar los carbonos quirales (que tengan cuatro grupos distintos alrededor del carbono) y se marcan con un asterisco ( ). 2. Determinar mediante la fórmula 2n el número de estereoisómeros existentes. n=2; porque tiene dos carbonos quirales. 22=4, tiene cuatro estereoisómeros. 3. Hacer las proyecciones de Fischer. 3.1. Dibujar una proyección de Fischer para la molécula. QUÍMICA ORGÁNICA 3.2. CLASE # 13 Buscar la imagen de espejo de la estructura anterior son imágenes de espejos y al girar una 180° y ver que no se superponen, se denominan ENANTIÓMEROS 3.3. Cambiar de posición los sustituyentes de uno de los carbonos quirales (los que se encuentran en la línea horizontal), de tal manera que se genere otra estructura diferente a las anteriores. El Br del primer carbono quiral se ubicó a la izquierda de la estructura. Ver inciso 3.1. Puede cambiar la posición de los átomos (hacia la izquierda o hacia la derecha) pero manteniéndolos en el mismo carbono. 3.4. Buscar la imagen de espejo de la estructura anterior. son imágenes de espejos y al girar una 180° y ver que no se superponen, se denominan ENANTIÓMEROS 3.5. Identificar los diasterómeros. Todas aquellas que no son imágenes de espejo. (1) y (3), (1) y (4), (2) y (3), (2) y (4) QUÍMICA ORGÁNICA Ejemplo 2: 2,3 – dibromo butano CLASE # 13 QUÍMICA ORGÁNICA CLASE # 13 Ejercicios ¿Cuántos estereoisómeros tienen las siguientes moléculas? Clasifíquelos en: enantiómeros, Diasterómeros o Compuesto meso. a. b.