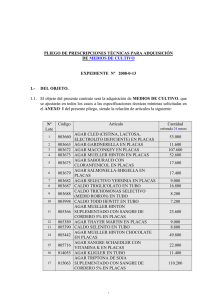
Manual de Procedimientos 2008
Anuncio

Manual de Procedimientos Sensibilidad a los antimicrobianos en Salmonella, Shigella y E. coli 2008 AUTORES Bioq. Fernando Pasterán Bioq. Marcelo Galas Dto. Bacteriología Instituto Nacional de Enfermedades Infecciosas A.N.L.I.S. “Dr. Carlos G. Malbrán” Centro Regional de Referencia WHO-Global Salm Surv para América del Sur. Sensibilidad a los antimicrobianos Las pruebas de sensibilidad deben realizarse sobre microorganismos asociados a infecciones cuando su sensibilidad no se pueda predecir a partir de su identificación. La determinación de la sensibilidad está indicada en los casos en que el microorganismo causal de la infección pertenezca a una especie 2 capaz de exhibir resistencia a los antibióticos de uso clínico. Los mecanismos de resistencia a los agentes antimicrobianos incluyen: producción de enzimas inactivantes, alteraciones en el sitio de acción y modificaciones en el ingreso o el eflujo de las drogas. Para los microorganismos que posean sensibilidad antibiótica predecible se recomienda la aplicación de la terapia empírica adecuada. Las pruebas de sensibilidad también son importantes en estudios de epidemiología de la resistencia y de nuevos agentes antimicrobianos. Para realizar pruebas de sensibilidad e identificación se debe partir de un cultivo primario en medio sólido y se debe procesar colonias aisladas de cada tipo de microorganismo que pueda tener rol patógeno. No se deben realizar pruebas de sensibilidad sobre mezclas de diferentes tipos de microorganismos, ni sobre el material clínico sin procesar, excepto para emergencias clínicas donde la coloración de Gram sugiera la presencia de un sólo patógeno. Cuando la prueba de sensibilidad haya sido realizada a partir del material clínico, se debe informar como resultado preliminar y se debe repetir utilizando la metodología estandarizada. No es aconsejable la realización de pruebas de sensibilidad cuando no es clara la naturaleza de la infección y la muestra contiene flora normal o polimicrobiana, en la cual el o los microorganismos aislados probablemente tengan poca relación con el proceso infeccioso. En estos casos los resultados obtenidos pueden conducir a errores en el tratamiento. 1. Difusión por discos INTRODUCCION La metodología empleada en la actualidad para la determinación de la sensibilidad a los antimicrobianos es el producto de importantes esfuerzos internacionales que, desde hace más de tres décadas, están enfocados a estandarizar la técnica. Un comité de expertos de la OMS y grupos colaborativos internacionales dirigidos por Ericsson y Sherris sugirieron recomendaciones que fueron seguidas por la mayor parte de los países europeos. Sin embargo, la falta de un acuerdo general sobre los puntos de corte para la interpretación de estas pruebas continúa siendo un tema de discusión a nivel internacional. Europa está dividida en varias regiones de influencia con diferentes recomendaciones para la determinación de sensibilidad antimicrobiana: Grupo Sueco de Referencia en Antimicrobianos, el Sistema DIN, el de los países bajos, la Sociedad Británica de Antimicrobianos, la Sociedad Francesa de Microbiología y el Comité de Estandarización de Laboratorios Clínicos (ex NCCLS, hoy denominado CLSI). En la mayoría de los países de Latinoamérica se siguen las pautas del CLSI, en algunos casos, con pocas modificaciones. El siguiente es un resumen de la metodología referida habitualmente como "Método de la OMS", que no difiere substancialmente del conocido "Kirby-Bauer". El documento que se ha tomado como base es el M2 – A9 del Clinical and Laboratory Standards Institute, CLSI, del año 2006 y las Tablas de interpretación corresponden al suplemento M100 – S17 del año 2007. El método recomendado por el Subcomittee on Antimicrobial Susceptibility Testing del CLSI se basa en los estudios de Bauer y colaboradores (1). Esta metodología está descrita detalladamente y cuenta con Tablas de interpretación que están respaldadas por una gran cantidad de datos clínicos y de laboratorio. La modificación de doble capa de Barry, García y Thrupp (2) es un método alternativo que demostró datos comparables de los diámetros de las zonas de inhibición, con precisión similar al del CLSI y con una correlación satisfactoria con la CIM. Este método es una alternativa aceptable para la estandarización del inóculo en las pruebas de sensibilidad de bacterias de rápido crecimiento, como S. aureus, Enterobacterias y P. aeruginosa. El método de doble capa en agar no es aplicable a las pruebas de sensibilidad a los antimicrobianos de microorganismos con requerimientos nutricionales especiales como Streptococcus spp., Haemophilus spp., etc. Las Tablas para la interpretación de los diámetros de inhibición recomendadas por el CLSI (M100S17) se pueden utilizar para cualquiera de las dos metodologías descritas. La difusión con discos es una metodología muy sencilla pero requiere un estricto control de calidad interno de cada uno de los pasos y los insumos que intervienen en su realización. El control de calidad interno de las pruebas de sensibilidad por difusión es un requisito indispensable para validar los resultados de los aislamientos clínicos. En muchos casos, variaciones pequeñas en la calidad de los reactivos o en algunos detalles metodológicos, se traducen en resultados totalmente distintos a los reales. El American Type Culture Collection (ATCC, USA) dispone de todas las cepas patrones necesarias para llevar a cabo este proceso. Indicaciones para la realizacion de las pruebas de sensibilidad a los antimicrobianos 3 Las pruebas de sensibilidad contribuyen a orientar el tratamiento antimicrobiano de los procesos infecciosos. No es necesario realizar pruebas de sensibilidad en aquellos casos en los que la identificación del microorganismo es suficiente para predecir la sensibilidad a los antimicrobianos (por ejemplo S. pyogenes vs penicilina). Las pruebas de sensibilidad pueden ser necesarias cuando, a pesar de conocerse la sensibilidad del germen a drogas altamente efectivas, el paciente no puede recibir dicha medicación. El antibiograma también puede ser indicado con fines epidemiológicos y en el estudio de nuevos antibióticos. Las pruebas de sensibilidad se deben realizar a partir de una cepa aislada. No se debería realizar el antibiograma en forma directa a partir del material clínico, excepto en las emergencias clínicas donde la coloración directa de Gram sugiere cultivo monobacteriano. En este caso, debe repetirse luego usando la metodología estandarizada. En el caso particular de Salmonella sp., Shigella spp y Escherichia coli aisladas de materia fecal se ha descrito resistencia a todos los antibióticos útiles para su tratamiento. Este hecho determina la necesidad de realizar pruebas de sensibilidad en todos los casos. Estos patogenos producen fundamentalmente diarreas pero su capacidad invasiva le confiere la posibilidad de hacer infecciones sistémicas. El tratamiento antimicrobiano en cada una de estas situaciones clínicas es muy distinto y por lo tanto también lo es la elección de los antibióticos a ensayar en el antibiograma. Principios del método El principio del método involucra la aplicación de una cantidad determinada de antimicrobiano en un reservorio (disco de papel, pastillas con drogas en estado cristalino, etc.) en la superficie del agar sobre la cual se ha distribuido un inóculo del microorganismo en cuestión; se formará así, por difusión, un gradiente de concentración de antimicrobiano alrededor del reservorio y la sensibilidad del microorganismo estará indicada por el tamaño de la zona de inhibición del crecimiento bacteriano. El diámetro obtenido dependerá no sólo de la sensibilidad del microorganismo y la carga del disco, sino también del espesor de la capa de agar Mueller Hinton, su pH y composición, de la capacidad de difusión de la droga en ese medio, de la temperatura y atmósfera de incubación, de la velocidad de duplicación bacteriana, del tamaño del inóculo y la fase de crecimiento de la bacteria, etc. Todas estas son las variables más importantes que afectan el resultado del antibiograma. Una vez colocado el disco en la superficie del agar, la difusión del antibiótico que contiene comienza instantáneamente y sigue hasta alcanzarse un gradiente continuo de concentraciones alrededor del reservorio. Este gradiente se alcanza aproximadamente a las 6 hs. El tamaño de la zona de inhibición dependerá del equilibrio entre la difusión del antibiótico y la velocidad de crecimiento del microorganismo. Las recomendaciones del CLSI son: colocar los discos dentro de los 15 minutos de inoculada la placa y proceder a la incubación de la misma dentro de los 15 minutos posteriores a la colocación de los discos. Cualquier variación en estos tiempos ocasionará un desplazamiento del equilibrio antes mencionado que se traduce en errores en el tamaño de la zona de inhibición. Como la difusión del disco comienza instantáneamente después de apoyado sobre el agar, estos nunca deben levantarse para cambiarlos de lugar en el antibiograma porque seguramente ya no tendrán la carga de antibiótico original. Para que los resultados sean confiables los procedimientos deberán ser controlados cuidadosamente y las Tablas de interpretación tendrán validez únicamente cuando la metodología utilizada en el laboratorio sea estrictamente comparable con la aplicada en la elaboración de dichas Tablas. Fundamentos para la interpretacion de las pruebas de sensibilidad a los antimicrobianos por el metodo de difusion Para cada antimicrobiano se establecen "concentraciones críticas" o "puntos de corte" que permiten separar a los microorganismos en tres categorías, sensibles, resistentes o de sensibilidad intermedia. Estas categorías se establecen para cada bacteria frente a cada antibiótico comparando la CIM en cada caso con los puntos de corte establecidos. *Sensible: Un microorganismo se considera "sensible" a un antibiótico cuando se puede esperar que una infección causada por el mismo responda al tratamiento con dicho fármaco a la dosis recomendada. *Resistente: este término indica que no es probable que la infección causada por el microorganismo responda al antibiótico en cuestión, cualesquiera que sean la dosis y la localización de la infección. 4 *La categoría sensibilidad intermedia se aplica a dos situaciones. Por un lado, se incluyen en ella las cepas con sensibilidad disminuida a un antibiótico que puede utilizarse con éxito, para el tratamiento en dosis más altas, por ser poco tóxico o porque se concentra en el foco de infección (por ejemplo, antibióticos ß-lactámicos o quinolonas en la orina). En esta categoría se incluyen asimismo las cepas de "sensibilidad intermedia" a antibióticos que, por ser más tóxicos, no puede usarse en dosis más altas. En este caso, la categoría intermedia sirve como una zona de transición entre las cepas sensibles y las resistentes y previene pequeños errores causados por factores técnicos. Muchas veces un resultado intermedio requiere la definición de la sensibilidad mediante el uso de un método cuantitativo como la CIM. La decisión definitiva sobre el uso de un determinado antibiótico y sobre la dosificación del mismo no sólo depende de los resultados de las pruebas de sensibilidad sino también de la interpretación de las mismas por el equipo de salud. También habrá que tener en cuenta otros factores como el rol patogénico del microorganismo, los efectos secundarios y las propiedades farmacocinéticas del medicamento, su penetración a los diferentes sitios de infección y el estado inmunitario del huésped, etc. Seleccion de los agentes antimicrobianos para las pruebas de sensibilidad La selección de los agentes antimicrobianos apropiados para la prueba de difusión, es una decisión de cada laboratorio clínico en consulta con el cuerpo médico, el comité de farmacia y el comité de enfermedades infecciosas. Para la selección de los antimicrobianos a ensayar en las pruebas de sensibilidad se deben tener en cuenta las siguientes consideraciones: eficacia clínica, prevalencia de resistencia, costo, indicaciones del FDA, recomendaciones consenso para drogas de primera elección y alternativos. Se pueden obtener resultados incorrectos (sensibilidad in vitro, falla terapéutica in vivo) cuando se ensayan determinados agentes antimicrobianos con ciertos microorganismos. Algunos ejemplos de estas combinaciones incluyen: cefalosporinas de 1ra. y 2da. generación y aminoglucósidos frente a Salmonella spp. y Shigella spp. Por ello se resume las drogas con actividad frente a Salmonella y Shigella spp.: • Aminopenicilinas (Ampicilina) • Trimetoprima/sulfametoxazol • Quinolonas fluoradas (ciprofloxacina o norfloxacina) • Fosfomicina • Tetraciclinas (Tetraciclina) • Cloranfenicol (sólo para aislamientos de infección sistémica de Salmonella) • Nitrofuranos (solo para aislamientos de Shigella) • Cefalosporinas de tercera generación (cefotaxima/ceftriaxona solo para aislamientos de infección sistémica) Otras drogas inapropiadas para tratamiento de diarreas pueden ser probadas para proveer datos taxonómicos o información epidemiológica (como es el caso de la gentamicina). Sin embargo, tales resultados deberán estar disponibles sólo para el laboratorio o para el comité de control de infecciones. El ensayo de algunas drogas es muy útil como indicador de la presencia de mecanismos de resistencia de difícil detección. Son ejemplos de estos casos: ácido nalidixico para detectar sensibilidad disminuida a las fluorquinolonas y ceftacidima o el disco de amoxicilina/ ac. clavulánico a 30 mm del disco de una cefalosporina de tercera generación o disco de cefpodoxima como detectores de ß-lactamasas de espectro extendido (Famiglietti A, et al. Consensus for antimicrobial susceptibility testing for Enterobacteriaceae. Subcommittee on Antimicrobials, SADEBAC (Argentinian Society of Clinical Bacteriology), Argentinian Association of Microbiology. Rev Argent Microbiol. 2005 Jan-Mar;37(1):57-66.). Una ventaja adicional del disco de cefpodoxima es su alta sensibilidad para detectar cepas de Salmonella y/o Shigella productoras de ampC plasmidicos (Rapoport etr al, CMY-2 type ß-lactamase finally emerging in Argentina, aceptado para publicacion en Int. J. Antimicrob. Agents) Para la realización de una adecuada prueba de sensibilidad, el número de agentes probados debe ser limitado. En general, deberá incluir sólo un representante de cada grupo de drogas relacionadas que tengan muy similar actividad y para las cuales la interpretación podría ser la misma. 5 MATERIALES Equipos • • • • • Ansas para inocular tipo loop (1-10 µl) Pinzas Mechero tipo Bunsen Regla o calibre Pipetas Pasteur plásticas descartables Soluciones, reactivos y medios de cultivo • • • • • Solución fisiológica estéril, 3 ml en tubos Caldo apropiado (tripteina soja (soya) u otro) esteril ,4 ó 5 ml en tubos Placas con agar Mueller Hinton (profundidad del agar de 4 mm ) Discos de antibióticos Estándar de turbidez equivalente al 0.5 de la escala de Mc Farland 6 Preparación del Agar Mueller Hinton Comentarios teóricos (1) Prepar el agar M. Hinton a partir de la base deshidratada de acuerdo a las recomendaciones del fabricante. De los medios disponibles se considera al agar MHinton como el mejor para las pruebas de sensibilidad de rutina dado que: • Muestra buena reproducibilidad lote a lote en las pruebas de sensibilidad. • Contiene bajo nivel de inhibidores de sulfonamidas, trimetoprima y tetraciclina. • Es adecuado para el desarrollo de la mayoría de las bacterias patógenas. • Existen suficientes datos recopilados que avalan la experiencia de las pruebas de sensibilidad realizadas en este medio. (2) Inmediatamente después de esterilizar dejar enfriar en baño de agua hasta 45-50ºC. Aunque el agar M. Hinton es generalmente confiable para las pruebas de sensibilidad, los resultados obtenidos con algunos lotes pueden, en ocasiones, variar significativamente. Si un lote de medio no sustenta el adecuado crecimiento de los microorganismos probados, los halos obtenidos en las pruebas por difusión podrían ser mayores quedando fuera de los límites de control de calidad, conduciendo a resultados erróneos. (3) Dispensar el medio en las placas de Petri de fondo plano hasta un nivel aproximado de 4 mm. Esto corresponde a 60 - 70 ml de medio para placas de 150 mm. de diámetro y 25 a 30 ml. para las de 100 mm. de diámetro interno. Se ha demostrado que con volúmenes mayores o menores de agar, la prueba pierde reproducibilidad ya que pequeñas variaciones tienen efectos significativos. Placas de espesores menores a los 4 mm producirán zonas de inhibición más grandes a las esperadas pudiendo ocasionar falsa sensibilidad al momento de interpretar los halos obtenidos. El fenómeno opuesto se obtendrá con espesores mayores a los 4 mm. Controle la profundidad de entre 2 a 5 placas del total del lote preparado. Para medir la profundidad introduzca dentro del agar un elemento fino, estéril, marcado en 3 y 5 mm de uno de sus extremos. El rango de profundidad aceptado para la prueba de difusión es de 3 a 5 mm. Antes de colocar el medio en la placa de petri debe asegurarse que la mesada donde está trabajando esté perfectamente nivelada. De no ser así, el agar en las placas quedará inclinado conduciendo a errores por la heterogeneidad del espesor del mismo. (4) Las placas que no se usan en el día pueden mantenerse en refrigerador (2-8 ºC.). Las placas almacenadas en bolsas de plástico tienen un período de uso de hasta 70 días. (5) Las placas con más de 7 días de preparación no son adecuadas para las pruebas de sensibilidad salvo que sean envueltas en bolsas de plástico para evitar la desecación, de lo contrario deberán controlarse con los microorganismos de referencia (6) Debe controlarse la esterilidad de una muestra representativa de cada lote incubando 24 horas o 7 más a 30-35 ºC. Luego descar esas muestras. No deberá observarse crecimiento de colonias bacterianas o micóticas. Para verificar la esterilidad del medio, tome una muestra equivalente al 5-10% del total del lote producido. Ignorar cualquier contaminación esporádica; ej. una fracción de medio. Descartar el lote completo, si el nivel de contaminación es significativo (>10% del medio controlado). pH: El agar Mueller Hinton debe tener un pH 7,2 7,4 a temperatura ambiente y debe determinarse después de su solidificación. El pH para cada lote debe ser controlado cuando se prepara cada lote de medio. Si el pH está por debajo de 7,2, ciertas drogas (por ej. aminoglucósidos, quinolonas y macrólidos) parecerán menos activas; mientras otras (p ej. tetraciclinas) parecerán tener mayor actividad. Si el pH es demasiado alto se observarán los efectos opuestos. Ver Tabla 1 Si el pH está muy alejado del rango aceptable debe controlarse el procedimiento de la preparación del medio. Es ideal el uso de electrodos de superficie, pero también resulta satisfactoria la determinación del pH del macerado de una alícuota solidificada de agar, suficiente para que el bulbo del electrodo quede totalmente sumergido. El método a utilizar dependerá del tipo de equipo disponible en cada laboratorio Debe asegurarse que el electrodo de superficie esté adecuadamente calibrado. Las correcciones necesarias se deben realizar por el agregado de NaOH 1M o HCl 1M El agregado de grandes volúmenes de estas soluciones para correccion del pH puede alterar el contenido de sales del medio. Humedad: Si justo al momento de usar las placas hay exceso de humedad en la superficie, éstas se deben colocar a 35ºC durante 10 - 30 min hasta que desaparezcan las gotas de humedad superficiales. Las placas deberán estar húmedas pero no mostrar gotas sobre la superficie del medio ya que distorsionarán las zonas de inhibición. Efecto de la Timina o Timidina: Para evaluar cada lote de Mueller Hinton en su contenido de Timidina se debe ensayar el Enterococcus faecalis ATCC® 29212 o ATCC® 33186 frente al disco de trimetoprima / sulfametoxazol. Los medios que contienen excesiva cantidad de timina o timidina pueden revertir los efectos inhibitorios de las sulfonamidas y trimetoprima, produciendo así zonas más pequeñas, menos nítidas o sin halo lo cual puede dar como resultado un informe de falsa resistencia. Un medio satisfactorio mostrará un halo de inhibición claro y definido de 20 mm o más. En caso que se observe una zona de inhibición < 20 mm podrá procederse al agregado de timidina fosforilasa o sangre lisada de caballo. La timidina fosforilasa ya sea en su forma pura (aislada) o contenida en la sangre lisada de caballo eliminará los excesos de timidina presentes en el medio. Este procedimiento mejorará la nitidez de los halos y la confiabilidad de las pruebas de sensibilidad para sulfonamidas y trimetoprima frente a patógenos comunes. 8 Un agar Mueller Hinton con elevado contenido de timina o timidina no podrá ser utilizado para el ensayo de trimetoprima, sulfonamidas o la combinación de ambas drogas pero podrá utilizarse para ensayar la actividad de cualquier otro antimicrobiano. Efectos por variación en la composición de cationes divalentes. Las pruebas de control de cadidad interno realizadas con cada lote de agar M. Hinton deben estar de acuerdo con los rangos de diámetros sugeridos para las correspondientes cepas ATCC (ver Control de Calidad). Los resultados de las pruebas con las cepas patrones deben ser cuidadosamente observados para detectar cualquier valor aberrante debido a la composición de cationes del medio de cultivo. La variación en cationes divalentes principalmente Ca++ y Mg++ afectarán los resultados con tetraciclina, colistín y aminoglucósidos sobre todo frente a P. aeruginosa. Un excesivo contenido de cationes reducirá la zona de inhibición, mientras que bajas concentraciones de cationes resultarán en zonas de inhibición mayores que las esperadas. Un exceso de zinc podría reducir las zonas de inhibición de los carbapenems Los rangos aceptables son los siguientes (Método de absorción atómica o equivalente): Ca++ = 20 -25 mg/L; Mg++ = 10 -12.5 mg/L. Aspecto: Antes de su utilización, se debe controlar que los medios de cultivo no presenten evidencia de: - Decoloración - Deshidratación - Rotura del agar - Volumen insuficiente - Heterogeneidad del espesor de la capa de agar - Otros signos de deterioro Descartar los medios que presenten alguna de estas características Tabla1 Variación de la actividad de diferentes antimicrobianos con el cambio del pH Se incluyen también antibióticos sin actividad frente a Salmonella y Shiegella spp. AUMENTO DE LA ACTIVIDAD pH ácido pH alcalino Amoxicilina Amplicilina Carbenicilina Cloxacilina Piperacilina Tetraciclina Doxiciclina Minociclina Nitrofurantoina Amicacina Netilmicina Estreptomicina Tobramicina Claritromicina Eritromicina Ac. Nalidixico Quinolonas Fluoradas DISMINUCION DE LA ACTIVIDAD pH ácido Azitromicina Claritromicina 9 Clindamicina Metronidazol CAMBIOS EN LA ACTIVIDAD CON EL AUMENTO O DISMINUCION DEL pH Penicilina Cefalotina Cefalexina Cefoperazona Ceftazidima Ceftriaxona Cloranfenicol Polimixina B Sulfonamidas Trimetoprima Conservación de los discos Comentarios teóricos Los discos deben mantenerse refrigerados a 2 8ºC (si van a ser utilizados en los siguientes 7 días) o en congelador (freezer) a -14 ºC o menos (para conservación a largo plazo). Para mantener su potencia, todos los discos deben mantenerse en congelador (freezer) especialmente los que contienen drogas de la familia de los ßlactámicos. Sólo los discos que se estén usando diariamente pueden permanecer en el refrigerador Los discos deben guardarse en contenedores herméticos con desecante y ser sacados del refrigerador o congelador (freezer) 1 ó 2 horas antes de su uso a fin de lograr un equilibrio en la temperatura antes de ser abiertos los frascos o contenedores Este proceso evita la condensación que podría ocurrir cuando la humedad ambiente alcanza los frascos fríos. La mayoría de las drogas antibacterianas son más sensibles a la exposición a un ambiente húmedo que a temperaturas templadas. Los antimicrobianos más afectados por los problemas de conservación son, en general, los ß-lactámicos y dentro de esta familia, los carbapenemes (meropenem e imipenem), oxacilina, cefaclor, las combinaciones de ßlactámicos con inhibidores de ß-lactamasas (amoxicilina/ac. clavulánico, ampicilina/sulbactam, ticarcilina/ac. clavulánico, cefoperazona/sulbactam y piperacilina/tazobactam) son los más lábiles. Cuando el indicador del desecante usado (por ej. gel de sílice) cambia de color debe interpretarse como un exceso de humedad y reemplazarse. Patrón de turbidez Comentarios teóricos Para estandarizar la densidad del inóculo se usa una suspensión de sulfato de bario como estándar Una turbidez equivalente al 0.5 de Mc Farland representa aproximadamente 108 UFC/ml para 10 de turbidez (0.5 de la escala de Mc Farland). bacterias de rápido crecimiento. La estandarización de inóculo es esencial ya que el tamaño de la zona de inhibición es muy dependiente de la densidad del inóculo utilizado. Preparar dicho estándar agregando 0,5 ml de BaCl2 0,048M (1,175% P/V BaCl2.2H2O) a 99,5 ml de H2SO4, 0,18 M (0,36 N) (1% V/V). Verificar la densidad correcta del estándar usando un espectrofotómetro. La absorbancia a 625 nm debe ser 0,08 a 0,10, para el estándar 0,5 de Mc Farland. (Ver Tabla 2) Distribuir en 4-6 ml dentro de tubos similares a los usados para la preparación de los inóculos de las cepas clínicas y mantener guardados a temperatura ambiente y al abrigo de la luz. Inmediatamente después de su preparación, los tubos se deben sellar herméticamente para evitar la evaporación y concentración de la suspensión. Agitar vigorosamente con vortex o manualmente el estándar antes de su uso para lograr una turbidez homogénea. Reemplazar o verificar la confiabilidad de los estándares mensualmente. Descartar los estándares, que presenten alguna evidencia de evaporación. Esto pude controlarse marcando los tubos en el momento de la preparación con una marca a la altura del menisco. Si la evaporación es evidente, descartar los tubos. Recordar que los patrones de turbidez de SO4Ba tienen una vida útil de aproximadamente un año. Luego de transcurrido este tiempo deben ser reemplazados por un nuevo lote. Tabla 2 Preparación de los estándares de Mc Farland Estándar No 0.5 1 2 3 4 5 6 7 8 9 10 Volumen (ml) BaCl2 (1,175 %) H2SO4 (1 %) 0.5 99.5 1.0 99.0 2.0 98.0 3.0 97.0 4.0 96.0 5.0 95.0 6.0 94.0 7.0 93.0 8.0 92.0 9.0 91.0 10.0 90.0 Equivalente en No de bacterias/ml (x108) 1.5 3 6 9 12 15 18 21 24 27 30 PROCEDIMIENTO 11 Día 1 Comentarios teóricos a) Preparación del inoculo A partir de 4 ó 5 colonias bien aisladas y de igual morfología en un medio de aislamiento primario preparar una suspensión en 4 ó 5 ml de un caldo apropiado (tripteina soja (soya) u otro) tocando la parte superior de cada colonia. Las pruebas de sensibilidad se deben realizar a partir de una cepa aislada. Se debería evitar realizar el antibiograma en forma directa a partir del material clínico, excepto en las emergencias clínicas donde la coloración directa de Gram sugiere naturaleza monobacteriana. En este caso, debe repetirse luego usando la metodología estandarizada. Para esta operación se puede utilizar ansa o hisopo. Incubar el tubo de cultivo a 35-37 ºC hasta que se alcance o exceda la turbidez del estándar equivalente al 0,5 de Mc Farland (2 - 4 h). Alternativamente el inóculo puede ser obtenido directamente a partir de colonias seleccionadas de una placa de cultivo no selectivo, de no más de 18 a 24 horas de incubación. Proceder a ajustar directamente el inoculo (paso siguiente) sin incubación previa. Cuando se prueban discos de trimetoprimasulfametoxazol con este método de preparación del inoculo de colonia aislada sin incubacion previa en medio liquido, pueden arrastrarse sustancias antagónicas que producen un crecimiento con aspecto de niebla dentro de la zona del halo de inhibición. b) Estandarización del inóculo Ajustar la densidad de los cultivos que se encuentran en fase logarítmica, con solución salina o caldo, por comparación visual hasta turbidez equivalente al tubo 0,5 de la escala de Mc. Farland. Para facilitar este procedimiento, mire los tubos contra un fondo blanco con una línea negra como contraste. Importante: agitar muy bien el estándar de turbidez antes de proceder a la comparación Utilizar para esta operación las pipetas Pasteur descartables y transferir unas gotas a un tubo con solución fisiológica estéril. Una turbidez equivalente al 0.5 de Mc Farland representa aproximadamente 108 UFC/ml para bacterias de rápido crecimiento. La estandarización de inóculo es esencial ya que el tamaño de la zona de inhibición depende de la densidad del inóculo. Para la interpretación de las pruebas de sensibilidad con las tablas recomendadas por el CLSI se requiere un inóculo confluente. Nunca utilice inóculos no estandarizados para el hisopado de las placas. Evitar extremos en la densidad del inóculo. Los excesos o defectos en la densidad del inóculo producen cambios muy grandes en los resultados finales del ensayo c) Siembra de las placas Dentro de los 15 minutos después de ajustado el inóculo, inocular las placas de Mueller Hinton con un hisopo estéril. Para evitar el sobrecrecimiento del inóculo bacteriano no excederse de los 15 minutos Presionar el hisopo contra las paredes del tubo a fin de escurrir el exceso de inóculo. Sembrar la superficie seca del Mueller Hinton por hisopado en tres direcciones para asegurar una Resultados reproducibles y confiables requieren una distribución homogénea del inóculo en las 12 completa y homogénea distribución del inóculo. placas. Esperar de 3 a 5 minutos, pero no más de 15 min. antes de aplicar los discos para que el exceso de humedad superficial producido por la inoculación sea completamente absorbido d) Colocación de los discos Colocar los discos sobre la superficie del agar con pinza estéril aplicando una ligera presión a una distancia no menor a 24 mm desde un centro al otro. La distancia al borde de la placa al disco no debe ser menor de 14 mm Debido a que todas las drogas difunden casi instantáneamente, un disco no debe ser removido una vez que tomó contacto con la superficie del agar. Si el disco es desplazado del lugar donde tomó contacto con el agar, la carga de antibiótico del mismo será menor que la estandarizada, por lo que se observara una tendencia a la falsa resistencia. No deben colocarse más de 5 discos por placa de 90 mm o 12 en placa de 150 mm. La colocación de los discos se realizará según figura 1 e) Incubación de las placas Llevar las placas a la estufa dentro de los 15 minutos posteriores a la colocación de los discos. Estas se deben incubar invertidas, a 35oC±2 por 16 a 18 horas y en ambiente aeróbico. Figura 1 Esquema sugerido para la colocación de los discos CIP NIT TET CTX GEN Placa 1 FOS AMP CHL TMS NAL Placa 2 CIP: ciprofloxacina; NIT: nitrofurantoína; CTX: cefotaxima; GEN: gentamicina; TET: tetraciclina; FOS: fosfomicina; AMP: ampicilina; TMS: trimetoprima/sulfametoxazol; NAL: ácido nalidíxico, CHL: cloranfenicol. Este esquema tiene en cuenta el tamaño de las zonas de inhibición usuales que producen los distintos antibióticos frente a Salmonella y Shigella spp. y está diseñado de manera de evitar la superposición de las zonas de inhibición producidas. 13 Día 2 f) Lectura de las placas e interpretación de resultados Examinar y verificar la pureza del inóculo Comentarios teóricos Las pruebas de sensibilidad deben ser realizadas de cultivos puros. Si se produjera contaminación durante la realización del ensayo puede ser fácilmente detectado examinando la placa del antibiograma. Examinar y verificar que el crecimiento sea confluente. Las zonas de inhibición deberán ser uniformemente circulares y el desarrollo confluente. La presencia de colonias aisladas indica un inóculo bacteriano de densidad inferior al estandarizado. Se deberá repetir la prueba. Lo mismo si el inóculo bacteriano fuere más denso que el recomendado. Si las placas fueron satisfactoriamente hisopadas y el inóculo fue el correcto, las zonas de inhibición serán uniformemente circulares En algunas oportunidades en el antibiograma, entre discos ubicados cercanos unos de otros puede producirse alguna distorsión de las zonas de inhibición (por ejemplo antagonismo, sinergia, inducción y/o inhibición) y estas zonas de inhibición no se presentarán por ende uniformemente circulares. Esta valiosa información adicional no deberá considerarse en la lectura de la zona de inhibición pero provee importante información adicional sobre posible identidad bacteriana, mecanismos de resistencia, etc. Medir los diámetros de las zonas de inhibición. Para la lectura de los halos se deberá tener en cuenta el área que no muestre desarrollo obvio a ojo desnudo, no incluyendo velo de crecimiento o colonias muy pequeñas que puedan ser detectadas sólo con mucha dificultad en el borde de la zona de inhibición. Cuando se prueban discos de trimetoprima/sulfametoxazol no considerar en la lectura un crecimiento del 20% o menos del desarrollo total. Los tamaños de las zonas de inhibición serán interpretados con las Tabla 2A. Los organismos se informarán sensibles, intermedios o resistentes al antimicrobiano ensayado según corresponda. Colonias mayores creciendo dentro de la zona de inhibición deberán ser subcultivadas, identificadas nuevamente y reevaluadas en cuanto a su sensibilidad a los antimicrobianos. Este fenómeno ocurre por que pueden arrastrarse sustancias antagónicas de la actividad de esta combinación de drogas que determinan un crecimiento con aspecto de niebla dentro de la zona de inhibición real. Las interpretaciones de los diámetros de las zonas de inhibición son provistas por CLSI. Estas tablas de interpretación fueron obtenidas utilizando un inóculo estandarizado que da como resultado un crecimiento confluente. Los puntos de corte para la interpretación de cada droga se deducen del análisis de regresión lineal resultante de múltiples determinaciones de un amplio número de aislamientos mediante el método de referencia (CIM) y la difusión por discos. El documento del CLSI M100-S17 no incluye puntos de corte para enterobacterias frente a fosfomicina. En este caso los puntos de corte se pueden obtener de otras normas (por ej. Sociedad Francesa de Microbiología). Del mismo modo, el uso de pruebas de tamizaje para la presencia de BLEE surge de la epidemiologia de Argentina con 14 reportes de presencia de estas enzimas en estos patogenos (Andres P. et al. Int J Antimicrob Agents. 2005 Jun;25(6):501-7. Extended-spectrum ß-lactamases in Shigella flexneri from Argentina: first report of TOHO-1 outside Japan) g) Informe de los resultados Utilizar la planilla para el registro de los resultados CONTROL DE CALIDAD Propósito El objetivo de un programa de control de calidad interno es el monitoreo de: • La exactitud y precisión de los procedimientos para realizar las pruebas de sensibilidad. • La calidad de los reactivos usados en las pruebas. • El desempeño de las personas que llevan a cabo los ensayos y la lectura de los resultados. Estos objetivos son alcanzados principalmente por la utilización de cepas de referencia seleccionadas por su estabilidad genética y por su utilidad en los métodos a ser controlados. Cepas Control Para controlar la precisión y la exactitud de las pruebas de difusión, se deben obtener de una fuente confiable las siguientes cepas patrones para control de calidad: • E. coli ATCC® 25922 • P. aeruginosa ATCC® 27853 • S. aureus ATCC® 25923 • E. faecalis ATCC® 29212 • E. coli ATCC® 35218 • K. pneumoniae ATCC® 700603 E. coli ATCC® 35218 productor de ß-lactamasa se recomienda solamente para el control de calidad de los discos que contengan la combinación "ß-lactámico/Inhibidor de ß-lactamasa", entre estos inhibidores se encuentran: ácido clavulánico, sulbactam y tazobactam. Cuando se prueben rutinariamente sulfonamidas, trimetoprima ó trimetoprima-sulfametoxazol, debe controlarse, para cada lote nuevo de Mueller Hinton, los niveles de timina ó timidina. Para ello debe utilizarse E. faecalis ATCC® 29212 ó 33186. Las siguiente Tabla muestran algunas de las cepas utilizadas más comúnmente en el control de calidad interno, los factores a evaluar y algunas de sus características. Tabla 3. Microorganismos sugeridos para el control de calidad de las pruebas de sensibilidad a los antimicrobianos Cepa Pseudomonas aeruginosa ATCC 27853 - Factores a evaluar: Propiedades - Concentración de cationes: Aumento de resistencia a aminoglucósidos cuando aumenta la concentración de calcio y magnesio. 15 - pH: Aumento de resistencia a aminoglucósidos cuando el pH del medio disminuye. • No subcultivar, se seleccionan mutantes resistentes a las penicilinas activas frente a Pseudomonas spp • Frente a un doble halo alrededor del disco de imipenem, cambiar el lote de Mueller Hinton. Escherichia coli ATCC 25922 - Calidad de la prueba de sensibilidad Escherichia coli ATCC 35218 - Mide la carga de inhibidores de ß-lactamasas de los discos para antibiograma. Probar sólo frente a combinaciones de antibióticos ß-lactámicos e inhibidores de ß-lactamasas como ampicilina/sulbactama, amoxicilina/ácido clavulánico, ticarcilina/ ácido clavulánico, etc. Staphylococcus aureus ATCC 25923 Enterococcus faecalis ATCC 29212 - Calidad de la prueba de sensibilidad - Concentración de timidina: Este compuesto interfiere con la actividad de trimetoprima y de sulfametoxazol. Las cepas patrones para el control de calidad se deben probar y mantener de la siguiente manera: • Las cepas de control de calidad se deben probar por la técnica estandarizada de difusión en agar descrita anteriormente. Los antibióticos a ensayar deben ser los mismos que se utilizan para los aislamientos clínicos. • Las cepas de control de calidad de trabajo se deben conservar a 4 - 8ºC en agar tripticasa de soja (soya) (no exigentes o fastidiosas) y se deben subcultivar semanalmente. Si las quiere almacenar por tiempo prolongado, puede hacerlo de la siguiente manera: mantenga los cultivos a -20 ºC ó menos (p ej.: Nitrógeno líquido) en medios adecuados (p ej.: 10-15 % de glicerol en caldo Tripticasa - Soja (Soya), caldo al 50 % de Suero fetal bovino, en sangre de oveja defibrinada ó en leche descremada) o en estado liofilizado minimizando de esta manera el riesgo de alterar su sensibilidad a los antibióticos. • Los cultivos de trabajo deben ser reemplazados por lo menos una vez al mes a partir de cultivos congelados, liofilizados o comerciales. • Antes de su utilización, las cepas patrones se deben sembrar sobre una placa de agar con el fin de obtener colonias aisladas. • Los inóculos para realizar los ensayos de sensibilidad con las cepas de referencia se deben preparar siguiendo las mismas indicaciones que se utilizan para los aislamientos clínicos ya sea permitiendo que el cultivo alcance fase logarítmica o bien resuspender colonias provenientes de una placa de 18-24 h de incubación. • Las cepas de control de calidad pueden ser utilizadas para ensayar la precisión y la exactitud de las pruebas de sensibilidad hasta tanto no presenten un cambio significativo en los diámetros de las zonas de inhibición que no puedan ser atribuidos a fallas metodológicas o de calidad de los reactivos. Si aparecen resultados inexplicables que sugieran un cambio en la sensibilidad propia del microorganismo, se debe obtener un nuevo cultivo a partir de las cepas almacenadas. Parámetros que se evaluan con las cepas de referencia para el control de calidad A) Potencia de los antimicrobianos B) Medios de cultivo Parámetros que NO se evaluan eficientemente con las cepas de referencia para el control de calidad A) Problemas concernientes al antimicrobiano en las pruebas de sensibilidad (por ej. discos, pocillos o tubos: vacíos, secos, sobre o subcargados). 16 1. pH 2. Cationes Ca++ y Mg++ 3. Contenido de timidina 4. Factores de crecimiento, composición del medio 5. Profundidad del agar para la prueba de difusión por discos B) Contaminación esporádica de los medios de cultivo. C) Mal funcionamiento instrumental. momentáneo del C) Condiciones de incubación (temperatura y atmósfera) D) Presencia de NaCl en los caldos para la prueba de oxacilina para Staphylococcus spp. D) Inóculo y técnica de inoculación. E) Lectura subjetiva de puntos finales poco definidos (pej. halos de inhibición difusos). E) Contaminación de los medios de cultivo. F) Funcionamiento del instrumental. F) Interpretación de resultados, uso de criterios apropiados de interpretación. G) Medida del punto final G) Errores de transcripción. H) Errores técnicos individuales. Son numerosos los factores que pueden dar como resultado una alteración en el tamaño final de las zonas de inhibición. Las causas probables de algunas de ellas se indican a continuación. Efecto observado con las cepas de referencia Causas probables Agrandamiento general de las zonas de inhibición Bajo inóculo Volumen insuficiente del medio de cultivo Sobrecarga de los discos Disminución general de las zonas de inhibición Alto inóculo Volumen excesivo del medio de cultivo Inactivación de la droga de los discos Discos vencidos Trimetoprima-Sulfametoxasol, disminución del tamaño de la zona y/o aparición de colonias internas Exceso de timidina en el medio de cultivo. Se corrige con el agregado (5%V/V) de sangre lisada de caballo, rica en timidina fosforilasa. Tetraciclinas, quinolonas fluoradas, colistina o aminoglucósidos - Disminución de las zonas, especialmente frente a Pseudomonas aeruginosa -Exceso del contenido de cationes divalentes: Ca++ y Mg++ - Aumento de las zonas - Escaso contenido de cationes divalentes Aminoglucósidos, macrólidos - Disminución de las zonas pH menor a 7,2 Penicilinas y tetraciclinas - Aumento de las zonas pH menor a 7,2 17 Frecuencia de Realización de las pruebas de control de calidad con las cepas de referencia Frecuencia de las pruebas Comentario Cada vez que se introduce un nuevo lote de discos de antimicrobianos a la rutina, este se debe ensayar con las cepas patrón de control de calidad apropiadas. En general se acepta que en una serie de pruebas uno de cada veinte ensayos consecutivos de control de calidad esté fuera de los rangos establecidos. Si aparece más de un resultado fuera de dichos rangos, se deben tomar medidas correctivas. Las cepas patrón de control de calidad se deben probar semanalmente y cada vez que se cambie cualquier reactivo que intervenga en la realización de las pruebas de sensibilidad; los discos de antibiótico a ensayar deben ser los mismos que se utilizan de rutina para los aislamientos clínicos Cuando un ensayo dé como resultado halos de inhibición que estén fuera del rango aceptable, se deben tomar medidas correctivas. Si la desviación se puede atribuir a un error obvio, como por ejemplo discos o cepas de control anómalos, contaminación de la cepa control o atmósfera de incubación incorrecta, se debe repetir la prueba de control de calidad. Si dicha desviación no se puede atribuir a un error obvio, se debe continuar con los controles de calidad diariamente hasta detectar la fuente de error y documentar la solución del problema. La obtención de resultados aceptables con las cepas de control de calidad no garantiza que los resultados obtenidos con los aislamientos clínicos sean correctos. Cuando se obtienen resultados de sensibilidad atípicos en un aislamiento clínico se debe repetir la prueba y/o confirmar la tipificación del mismo. En la Tabla 4 se presentan las resistencias naturales de las enterobacterias más comunes en la clínica diaria. Estas resistencias muchas veces puede ayudar al bacteriólogo a confirmar o no la identificación bacteriana. Cabe destacar que todos estos microorganismos pueden tener además resistencias adquiridas a varios de los antimicrobianos para los cuales las cepas salvajes son sensibles. Resistencias inusuales Por otra parte se debe tener en cuenta que la resistencia a algunos antibióticos en determinados microorganismos es sumamente inusual y debe, por lo tanto, repetirse. Si dicha resistencia se confirma, el aislamiento debe derivarse a un centro de referencia para su confirmación y caracterización del mecanismo involucrado. Algunos ejemplos de estas combinaciones microorganismo-droga incluyen resistencia a: • • • • carbapenemes en cualquier enterobacteria. cefalosporinas de tercera generación en Shigella spp. cefpodoxima en Salmonella o Shigella spp. quinolonas fluoradas en Shigella spp. o Salmonella spp. La detección temprana de este tipo de cepas permitirá dar la voz de alarma y de esa manera elaborar estrategias para evitar su diseminación. Cada laboratorio debería desarrollar sus propias reglas para detectar las posibles fallas en las pruebas de sensibilidad y proceder así a su corrección. 18 Tabla 4 Resistencias naturales en el género enterobacterias Organismo Citrobacter koserib Citrobacter freundii Enterobacter aerogenes y E. cloacae Enterobacter agglomerans AMP GEN AMP/ CAR MEZ CPG FOX CTG CFP IMP TOB AKN CHL SUL TIC PIP NET TE T SXT CIP NAL NTI POL Rc S-R R S S-R S S S S S S S S S S S S S Rc S-R S S R R S S S S S S S S S S S S R c S-R S S R R S S S S S S S S S S S S S-R S-R S S S-R S-R S S S S S S S S S S S S E. coli S S S S S S S S S S S S S S S S S S Klebsiella spp. Rc S-R Rc S-R S S S S S S S S S S S S S S Morganella morganii Proteus mirabilis Proteus vulgaris y P. penneri Providencia spp. Salmonella spp. Rc S-R S S Rc S-R S S S S S S S S S S Rc Rc S S S S S S S S S S S S Rc S S S Rc Rc c S-R S S R c S S S S S S S R c S S S R R c S-R S S R c S-R S S S S S S R c S S R S S S S S S S S S S S S S S S Serratia spp. R R S S R S-R S S S S S S R S Shigella spp. S S S S S S S S S S S S S S R c c c R R c R S S S S S R R S S S S c a Abreviaturas: S, sensible; R, resistente; S-R, sensible o resistente; AMP, ampicilina; AMP/SUL, ampicilina/sulbactam; CAR, carbenicilina; TIC, ticarcilina; MEZ, mezlocilina; PIP, piperacilina; CPG, cefalosporinas de primera generación; FOX, cefoxitina; CTG, cefalosporinas de tercera generación; CFP, cefoperazona; IMP, imipenem; GEN, gentamicina; TOB, tobramicina; NET, netilmicina; AKN, amicacina; CHL, cloranfenicol; TET, tetraciclina; SXT, trimetoprima/sulfametoxazol; CIP, ciprofloxacina; NAL, ácido nalidíxico; NTI, nitrofurnatoina; POL, polimixina. b Ex C. diversus c Muy inusual encontrar aislamientos sensibles a esta droga. LIMITACIONES DEL METODO DE DIFUSION POR DISCOS Grupos de microorganismos donde se puede aplicar la prueba de difusión por discos El método de difusión descripto en este documento ha sido estandarizado para patógenos de rápido desarrollo. Resultados incorrectos Se pueden obtener resultados incorrectos cuando se ensayan determinados agentes antimicrobianos con ciertos microorganismos. Algunos ejemplos de estas combinaciones incluyen: cefalosporinas de 1ra. y 2da. generación y aminoglucósidos con Salmonella spp y Shigella spp. En estos casos si se ensaya alguna de las drogas enumeradas el resultado de éstas no deberá incluirse en el informe al médico. Esto se debe a que pueden inducir a errores en la elección del tratamiento (falsa sensibilidad) Emergencia de resistencia Algunos agentes antimicrobianos están asociados con la emergencia de resistencia durante terapias prolongadas. Más aún, aislamientos inicialmente sensibles podrían transformarse en resistentes dentro de los tres a cuatro días de haberse iniciado la terapia antimicrobiana 19 c c c Planilla - Registro de Resultados: Prueba de Difusión por discos Antimicrobiano Cepa Cepa Cepa Cepa E. coli ATCC® 25922 Diámetro S,I, Diámetro S,I, Diámetro S,I, Diámetro S,I, Diámetro Rang mm R mm R mm R Mm R mm o Ampicilina 16-22 Trimtoprimasulfametoxazol 24-32 Acido nalidixico* 22-28 Cloranfenicol 21-27 Fosfomicina - Nitrofurantoina 20-25 Cefotaxima** 29-35 Gentamicina 19-26 Tetraciclina 18-25 Ciprofloxacina* 30-40 * Resistencia a Acido nlidixico indica generalmente sensibilidad disminuida a ciprofloxacina. Es importante que esta sensibilidad disminuida sea informada al equipo medico ya que se han descrito fallas de tratamiento en infecciones por Salmonella spp. con estas características (CLSI). Si se detectara un aislamiento de Salmonella spp. o Shigella spp. con sensibilidad disminuida o resistencia, confirmar el hallazgo y enviarlo a un centro de referenci para su estudio. ** Las cefalosporinas de tercera generación se deben informar únicamente frente a aislamientos causantes de infecciones sistémicas. Descartar previamente presencia de BLEE: Cefpodoxima se puede incorporar como prueba de tamizaje de ß-lactamasas de espectro extendido y resistencia a cefalosporinas de tercera generación. En caso de presentarse resistencia a esta droga (halos < 17mm) se debe confirmar la presencia de BLEE mediante el ensayo de CTX y CAZ con el disco de AMC entre ambos o en paralelo con los discos de cefotaxima/ac. clav (CTC) y ceftazidima/ac. clav (CAC). Para la sospecha de BLEE en Salmonella spp y Shigella spp., utilizar los puntos de corte especiales recomendados por CLSI para E. coli, Klebsiella spp. y P. mirabilis frente a CTX y CAZ. Evaluar en un segundo paso también la sensibilidad a cefoxitina con el objetivo de diferenciar la resistencia a cefpodoxima mediada por BLEE de la mediada por enzimas tipo AMP-C plasmídico. 20 2. Métodos de Dilución INTRODUCCION Las técnicas de dilución en caldo o agar, se pueden utilizar para medir cuantitativamente la actividad "in vitro" de un antimicrobiano frente a un cultivo bacteriano. Estos métodos se basan en la preparación de una serie de tubos o placas con caldo o agar, respectivamente, a los cuales se les agrega el antibiótico (ATB) en distintas concentraciones. Luego se inoculan cada uno de los tubos o placas con una suspensión estandarizada del microorganismo en estudio. Las pruebas se examinan después de incubar 18 a 24 hs. a 35ºC y se determina la concentración inhibitoria mínima (CIM) del antimicrobiano frente al microorganismo ensayado. El resultado final no ende significativamente de la metodología empleada. Por ello, para obtener valores reproducibles intra e interlaboratorios, cada detalle técnico debe ser cuidadosamente controlado. Las bases para la realización de estas metodologías derivan, en gran parte, de la información generada por un estudio colaborativo internacional (1). Aunque estos métodos son referenciales, algunos son lo suficientemente prácticos para ser desarrollados tanto en los laboratorios clínicos como en los de investigación. Existen también sistemas comerciales que se basan, al menos en parte, en los mismos conceptos y dan resultados equivalentes a los obtenidos con las técnicas descriptas en este documento... El documento que se ha tomado como base es el M7 – A7 del Clinical Laboratory Standards Institute (CLSI) del año 2006. Las Tablas de interpretación corresponden al suplemento M100 – S17 del año 2007. Las técnicas que se describen en este documento fueron diseñadas para ensayar bacterias de fácil desarrollo después de 18 - 20 hs. de incubación en medio M. Hinton sin suplementos. Indicaciones para realizar la prueba sensibilidad a los antimicrobianos por el metodo de CIM La realización de una CIM esta justificada en las siguientes situaciones 1. Ausencia de metodología más sencilla por ejemplo, método de difusión 2. Falta de estandarización 3. Uso de nuevos antibióticos 4. Falla inesperada de tratamiento 5. Perfiles inusuales (confirmación) 6. Para vigilancia cuantitativa de la resistencia a los antimicrobianos 7. Infecciones severas que requieran la realización de pruebas bactericidas tales como poder bactericida del suero, velocidad bactericida del suero, curva de muerte (endocarditis no respondedoras a la terapia, uso de esquemas no convencionales, bacteriemias y meningitis en inmunocomprometidos, osteomielitis crónicas, búsqueda de actividad sinérgica) El valor de CIM obtenido por el método de dilución, orienta al medico tratante sobre que concentración de antibiótico necesita alcanzarse en el sitio de infección para inhibir el desarrollo del microorganismo infectante. La CIM, sin embargo, no representa un valor absoluto. La CIM real puede estar entre la menor concentración de antibiótico que inhibe al microorganismo y la siguiente dilución inmediatamente inferior donde se observa desarrollo del mismo. Si por ejemplo, fueran probadas diluciones al medio y se determina una CIM de 16 µg/ml, el verdadero valor podría estar entre 16 y 8 µg/ml. Debe tenerse en cuenta que a pesar de realizar las pruebas de dilución bajo condiciones cuidadosamente controladas, no siempre se obtienen los mismos resultados. Generalmente, la reproducibilidad de esta prueba es de +/- 1 dilución. La metodología más común para la determinación de La CIM es la que utiliza diluciones seriadas al medio (por ej. 1, 2, 4, 8,16 µg/ml, etc.). También existen otros esquemas de dilución, que utilizan unas pocas concentraciones (hasta dos), concentraciones "Breakpoint" o que agregan concentraciones entre las que se ensayan normalmente (por ej. 4, 6, 8, 12, 16 µg/ml) Los resultados de estos métodos alternativos pueden ser igualmente útiles; sin embargo, a veces son más difíciles de controlar. Cuando se produce inhibición del crecimiento con la menor concentración utilizada, el verdadero valor de la CIM no se puede determinar exactamente y debe informarse como igual o menor que dicha concentración. Cuando se ensayan concentraciones adicionales entre las usuales y la CIM es una de esas concentraciones intermedias, la interpretación de la prueba se debe hacer después de redondear el valor a la próxima superior dilución al medio del esquema normal (por ej. Una CIM de 6 µg/ml se debe redondear a 8 µg/ml y luego proceder a interpretar). 21 Cuando se informa al médico el resultado de la CIM, el valor debe ser acompañado por su correspondiente interpretación (por ej. SENSIBLE, INTERMEDIO o RESISTENTE) que se obtiene aplicando los criterios enumerados en las Tablas del CLSI. Cuando las CIMs se realizan con 4 o menos concentraciones consecutivas, o con concentraciones no consecutivas, se debe informar la correspondiente interpretación. Si se desea se puede informar además el rango de CIM ensayado Eleccion del numero de concentraciones a ensayar Las concentraciones a ensayar para un determinado antibiótico, en general, deberían determinarse de acuerdo a los puntos de corte que se enumeran en la Tabla 2A del documento M100-S17del CLSI, pero el número final de concentraciones deberá ser elegido por quien realiza la prueba. Se recomienda elegir el rango de concentraciones de manera tal que incluya el rango de CIM de al menos una cepa patrón de control de calidad. La elección del rango deberá considerar los siguientes puntos: 1. CIM usual de la combinación germen/droga (CIM50 y 90), 2. “Break point” de sensibilidad y resistencia y 3. Rango aceptable de al menos una de las cepas ATCC ensayadas en paralelo con la/s cepa/s incógnita/s (Tabla 3A del documento M100-S17 del CLSI) 2.1 Dilución en agar La dilución en agar es un método bien establecido para la determinación de la sensibilidad a los antimicrobianos (3,4). El agente antimicrobiano se incorpora dentro del medio con agar, de manera tal que cada placa contenga una concentración de antibiótico diferente. Los inóculos estandarizados de los distintos microorganismos se pueden aplicar rápida y simultáneamente sobre la superficie del agar utilizando un replicador de Steers (5). La mayoría de los replicadores existentes transfieren de 25 a 36 inóculos a la vez por cada placa. La preparación, propiedades y control del agar M. Hinton y los estándares de turbidez se describen en detalle para el método de difusión. Para la dilución en agar valen los mismos considerandos descripto ut supra MATERIALES Equipos • • • • • • • • • • • Estándar de turbidez equivalente al 0.5 de la escala de Mc Farland Ansas para inocular tipo loop (1-10 µl) Mechero tipo Bunsen Placas de Petri (9 cm de diámetro) Pipetas Pasteur plásticas descartables Pipetas de 0.1 ml (podrán utilizarse pipetas automáticas) Pipetas de 1 ml Pipetas de 5 ml Micropipetas hasta 1000µl Baño termostatizado (50-55 oC) Replicador tipo Stern Soluciones, reactivos y medios de cultivo • • • • • • • • Solución fisiológica estéril, 3 ml en tubos 13X100 mm (para la preparación del inóculo estandarizado) Tubos con 0.9 ml de caldo o solución fisiológica estéril (para la dilución 1/10 del inóculo) Placas de agar nutritivo (9 cm de diámetro) Gradilla de 11 tubos 13x100mm con 3 ml de agua destilada (para la dilución del ATB) 19 tubos con 19 ml de agar Mueller Hinton Placas de Petri con Agar Mueller Hinton que contengan diluciones del ATB Patrón de turbidez equivalente al 0.5 Mc Farland Antimicrobianos de potencia conocida 22 PROCEDIMIENTO Día 1 Comentarios teóricos a) Preparación de las diluciones del antibiótico Las figuras 2 a 9 muestran los pasos secuenciales para la preparación de las diluciones de los antibioticos comúnmente utilizados para Salmonella y Shigella Los antibióticos estándar o de referencia se pueden obtener directamente del laboratorio productor o de otras fuentes comerciales. No se recomienda la utilización de las preparaciones para aplicación parenteral. A modo de ejemplo se indican en la Tabla 5 columna 2 los rangos sugeridos para distintos atb con actividad frente a Samonella La elección de la rangos deberá tener en consideración la epidemiología local Para las pruebas de sensibilidad se debe conocer el lote, la potencia (generalmente expresada en µg/ml, % ó UI/mg de polvo) y la fecha de vencimiento de los antimicrobianos de referencia El almacenamiento de la droga debe hacerse según las recomendaciones del laboratorio productor, o a una temperatura igual o menor a 20ºC en un desecador (preferiblemente con vacío) provisto de algún material desecante como gel de sílice o cloruro de calcio. Cuando se saca el desecador del freezer se debe esperar que tome temperatura ambiente antes de abrirlo para evitar que el agua de condensación humedezca las drogas. Las tertraciclinas deberán protegerse al abrigo de la luz. b) Preparación de la Solución de Antibiótico de trabajo (SAT) Para preparar la solución de antibiótico de trabajo se debe tener presente el peso de droga activa y la concentración más alta del rango deseado corregido según el volumen final requerido para el ensayo (ver Tabla 5). Se debe tener en cuenta que para la dilución en agar cada solución de atb preparada debe ser 20 veces más concentrada que la deseada en la placa. En general los antimicrobianos se obtienen como sales. Esto significa que no todo el peso de la droga en polvo será activo. El dato de potencia expresa la proporción de droga activa en el total del polvo Ello es por que la solución del antibiótico se diluirá 1/20 al ser incorporada al agar (1 ml de la solución de ATB + 19 ml del agar) Por ello para considerar la pesada a efectuar deberá tenerse presente en primer lugar que la solución de antibiótico a preparar deberá ser de una concentración 20 veces superior a la del rango superior deseado (20X). (Tabla 5, columna 3) Para el caso particular de trimeptroprima/ sulfametoxazol (TMS) la solución de antibiótico a preparar deberá ser de una concentración 40 veces superior a la del rango superior deseado de cada uno de los componentes individuales (40X). (Tabla 5, columna 3) Puesto que para obtener la solucion de antibiotico de trabajo (SAT) de TMS se mezclaran volúmenes iguales de las soluciones de trimetoprima (TMP) y sulfametozaxol (SMZ). De esta manera ambas soluciones se diluirán 1:2, obteniéndose la SAT de TMS El volumen final de SAT requerido dependerá del esquema de dilución a seguir En el caso propuesto en el ejemplo de la Tabla 5 las diluciones seriadas al ½ involucran la transferencia de 3 ml de la SAT para obtener la dilución al ½ correspondiente (figuras 2-9) Puesto Esquemas alternativos de dilución de las soluciones de ATB se encuentran en la Tabla 5 del documento M100-S17 del CLSI (2002). El volumen final de SAT a preparar deberá contemplar el esquema de diluciones a realizar 23 que 1 ml de la SAT también será necesario para preparar la primera placa del rango, se requiere un volumen de SAT superior a los 4 ml. (Tabla 5, columna 4) El peso de droga activa de cada antibiótico (Tabla 5 columna 5) (deberá posteriormente corregirse con el dato de potencia) resulta de multiplicar el volumen final necesario (Tabla 5 Columna 4) por 20 veces la concentración superior del rango de SAT (Tabla 5 Columna 3) por 20 veces el valor de la concentración superior del rango Tabla 5 Ejemplo de rango sugeridos y cálculo de las pesadas Antibiótico Rango de diluciones (µg/ml) Concentración de solución a preparar (rango superior x 20) (µg/ml) Volumen final necesario de solución de ATB (ml) Peso del antibiótico activo (deberá posteriormente corregirse con el dato de potencia) (mg) Peso del antibiótico total corregido por el dato de potencia (mg) Solvente Fig. Ampicilina (AMP) 0.12-256 5120* (256X20) 5 25,6 (5 x5120) Ver formula 1 Agua 2 c Cefotaxima (CTX) 0.008-16 320 (16X20) 5a 1.6 (5 x640) Pesar 10 veces mas Ver formula 1 Agua 3 Cloranfenicol (CHL) 0.25-512 10240* (512X20) 5 51,2 (5 x10240) Ver formula 1 Metanol 4 Ver formula 1 Agua 5 c Ciprofloxacina (CIP) Trimetoprima/ sulfametoxazol (TMS) Tetraciclina (TET) Gentamicina (GEN) 0.002-4 0.03/5764/1216 0.25-512 0.06-128 80 (4X20) 5a TMP: 2560 (64X40) 3 b 4,0 (5 x800) Pesar 10 veces mas TMP: metanol 7,680 (3 x2560) 6 Ver formula 1 SMZ: 48640 (1216X40) 10240* (512X20) 2560* (128X20) b SMZ: agua 3 145,38 (3 x48640) 5 51,2 (5 x10240) Ver formula 1 Metanol 7 5 12,8 (5 x2560) Ver formula 1 Agua 8 Estos rangos se establecieron en base a la epidemiología de la resistencia de Argentina * Estas soluciones representan las soluciones de antibiótico de trabajo (SAT). a: Estas soluciones requieren un paso previo (dilución o mezcla) para convertirse en la SAT por lo que se podría prepara un volumen final menor a 5 ml (ver mas adelante). b: De esta manera ambas soluciones se diluirán 1:2, obteniéndose la SAT de TMS con un volumen final superior a los 5 ml requeridos para el ensayo del ejemplo c) Cálculo de la cantidad de droga activa. Para saber cual es exactamente la cantidad de droga activa hay que calcularla utilizando el dato de potencia. (EJEMPLO: que un antibiótico tenga una potencia de 930 µg/mg, implica que por cada miligramo de polvo pesado sólo 930 µg serán activos o tendrán actividad antimicrobiana) (FORMULA 1) En general los antimicrobianos se obtienen como sales. Esto significa que no todo el peso de la droga en polvo será activo. El resultado de esta formula estima finalmente la cantidad de droga a pesar 24 FORMULA 1 Peso del antibiótico total: _______(colunma 5 de Tabla 5) Potencia: _________ Cálculo: ________ µg de droga activa (dato de potencia) --------------- 1mg droga ____ mg droga activa calculados (Tabla 5 columna 5) -------------- X= _____ µg de droga a pesar (Tabla 5 columna 6) Para pesar el antibiótico a ensayar se debe hacer en balanza analítica bien calibrada, con una precisión igual o superior al décimo de miligramo, Se debe evitar pesar cantidades muy pequeñas de droga ya que estas acarrean alto error Se recomienda utilizar el método de doble arresto para efectuar la pesada Generalmente al realizar la pesada se obtiene un exceso o defecto de la droga activa , en tal caso se debe aplicar la fórmula 2 para conocer el exacto volumen de solvente a agregar para obtener la concentración deseada FORMULA 2 Cálculo: Cálculo del solvente necesario para obtener la concentración deseada: ______ µg de droga activa (Tabla 5 columna 3) ---------------- 1 ml (Concentración del antibiótico en la primer placa 20X) ________ µg (cantidad de droga pesada) ---------------- X=_________ ml (Dato experimental que surge de la pesada) (vol. de solvente para disolver la droga) Agregar el volumen calculado del solvente apropiado (Tabla 5 columna 7) ** Asegúrese de tomar todos los recaudos necesarios para el manejo de solventes distintos del agua según indicaciones del fabricante ** El solvente a utilizar dependerá del tipo de droga. En algunos casos el límite de solubilidad del antimicrobiano sólo permite preparar soluciones de concentraciones bajas Para las drogas que no son solubles en agua (Tabla 5, columna 7), se debe proceder de la siguiente manera: 1- Use solamente la cantidad mínima del solvente (metanol, acetona, cloroformo, etc) necesaria para solubilizar la droga. 2- Diluya hasta alcanzar el volumen final calculado, con agua estéril o con el buffer estéril adecuado como se indica en la formula 2 . La mayoría de las soluciones preparadas en el ejemplo serán directamente las SAT con excepción En general cuando se preparan soluciones de antibiótico, se busca obtener soluciones madres 25 de CTX, CIP, TMP, SMZ que deben realizar algún paso previo antes de conseguir la SAT (ver a bajo). stock concentradas que luego se deben diluir para alcanzar la concentración necesaria para preparar el rango deseado En el caso de CTX y CIP la SAT se obtiene diluyendo las soluciones preparadas (1/10 en el ejemplo para CTX de la Tabla 5) y para trimetoprima / sulfametoxazol se debe mezclar un volumen de cada droga para obtener la mezcla de la concentración deseada (3 ml de c/u en el ejemplo de la Tabla 5) En el ejemplo de la Tabla 5 se pesan diez veces mas CTX y CIP para evitar pesar cantidades muy pequeñas de droga ya que estas acarrean alto error. d) Preparación de las diluciones del antibiótico (ver figuras 2 a 8 correspondientes a cada droga) La SAT será en todos los casos la primera dilución del rango (la más concentrada). El objetivo en este paso es obtener 11 diluciones al ½ sucesivas de la SAT. Para determinar el número de concentraciones a incluir en las pruebas de sensibilidad se recomienda elegir el rango de concentraciones de manera tal que incluya: los puntos de corte que se enumeran en la Tabla 2 A de CLSI (M100-S17), el rango de CIM de al menos una cepa patrón de control de calidad (Tabla 3 de CLSI M100-S17) y la CIM 50 y 90 para bacterias de características similares a las cepas incógnitas (previamente reportadas en la literatura o basadas en la experiencia previa) Para el ejemplo de la Tabla 5, tomar una gradilla con 11 tubos conteniendo 3 ml de agua. Colocar 3 ml de la SAT en el primero de los 11 tubos y homogeneizar correctamente. Tomar 3 ml de este tubo y transferirlos al segundo tubo de la serie, homogenizar y pasar 3 ml al tercero. Repetir este procedimiento hasta el último tubo. De esta manera se deben obtener, incluida la SAT, 12 diluciones consecutivas al ½ del antibiótico Un esquema alternativo de dilución del antibiótico se puede obtener en la Tabla 5 de CLSI M100-S17 e) Colocación del antibiótico en el agar y preparación de las placas para la CIM (ver figuras 2 a 8 correspondiente a cada droga) Tomar 12 tubos con 19 ml de agar Mueller Hinton fundido y enfriado a 50-55º C (mantenerlos en el baño termostatizado hasta su utilización). De a una a la vez y empezando por la más diluida, tomar las diluciones preparadas en el punto 2.1.4 transferir 1ml de cada solución a un tubo con 19 ml de agar (dilución 1/20) Importante: no descartar el sobrante de las soluciones de antibiótico antes de finalizar el ensayo. En caso de error durante la preparación de las placas (solidificación total o parcial en el tubo, etc) podria llegar a utilizarlas nuevamente Homogeneizar correctamente cada tubo por inversión evitando la formación de burbujas y vierta La mezcla agar-antibiótico debe ser colocada rápidamente en las placas para evitar la 26 el contenido completo a una placa de Petri de 9 cm de diámetro. Si se formaran burbujas en la placa, pasar ligeramente la llama del mechero por la superficie de la placa para eliminarlas. solidificación total o parcial de la misma dentro del recipiente de mezclado Importante: rotular cada placa con el valor de la concentración final resultante (Tabla 5 columna 2). Se debe marcar además cada placa de agar para conocer la ubicación de los inóculos en la misma Si las placas no se usan de inmediato se pueden guardar a 4 - 8ºC por no mas de 3 días El almacenamiento de las placas se debe hacer en bolsas de plástico para evitar su desecación. Las placas conteniendo ácido clavulanico o carbapenemes se deben preparar el dia de realización de la CIM debido a la rápida degradación (hidrólisis) de la droga. Otros antimicrobianos particularmente lábiles son: ßlactámicos en general, y sulbactam y tazobactam No se puede asegurar que todos los antibióticos mantengan su actividad en estas condiciones, por lo tanto siempre es necesario evaluar el estado de los antibióticos mediante la prueba de cepas patrones de control de calidad. La placa de Petri debe alcanzar una profundidad de 3-4 mm con la mezcla agar-antibiótico Este control (placa sin antibiótico) permitirá conocer la viabilidad de los microorganismos a los cuales se le evaluará la sensibilidad. Preparar además una placa con 20 ml de agar sin antibiótico Esta placa sin antibiótico servirá como control de crecimiento. De esta manera se deben obtener, por atb, 12 placas con las concentraciones de antibiótico comprendidas en el rango de la segunda columna de la Tabla 2 y una placa sin antibiótico que se utilizará como control. f) Secado de las placas Antes de realizar la prueba, colocar las placas, abiertas e invertidas, en una estufa de 35º C o en un equipo de flujo laminar por al menos 30 minutos para eliminar el exceso de humedad que pudieran contener. Evite la sobre desecación de las placas g) Preparación de los inóculos (ver figura 9) El inóculo estandarizado para el método de dilución en agar, se puede preparar permitiendo el crecimiento del microorganismo hasta la turbidez 0,5 de la escala de McFarland o bien resuspendiendo colonias directamente hasta alcanzar dicha turbidez (ver Prueba de difusión por discos Para la inoculación de las placas para la dilución en agar se puede utilizar un replicador tipo Stern (que deposita simultáneamente múltiples inóculos) o también puede realizarse con pipeta o ansa calibrada. La siembra de los inóculos se realiza por “spot” en la superficie del agar (aproximadamente 2 µl de suspensión). Cada “spot” debe contener una cantidad neta de 104 bacterias. La inoculación de las placas se realizará utilizando un replicador de Stern Control de calidad Juntamente con las cepas incógnitas deberán ensayarse las cepas de referencia que se describen mas adelante para el control de calidad del ensayo. h) Ajuste del inoculo al patrón de 0.5 Mc Farland 27 A partir del tubo con crecimiento logarítmico de cada aislamiento, transferir pequeños volúmenes (gotas) a un tubo con 3 ml de solución fisiológica hasta obtener una turbidez comparable al estándar 0.5 de Mc Farland. Utilice para esta operación pipetas Pasteur descartables. Las suspensiones bacterianas contendrán 1 x 108 UFC/ml. preparadas IMPORTANTE: agitar muy bien el estándar antes de proceder a la comparación. i) Dilución 1/10 de la suspensión bacteriana (0.5 Mc Farland) Evitar extremos en la densidad del inóculo. Transferir 0.1 ml de cada inóculo ajustado en el punto h a un tubo con 0.9 ml de caldo o solución fisiológica. De esta manera se realiza una dilución 1/10 del inóculo ajustado, Se obtendrá así una suspensión de ~1 x 107 UFC/ml que será el inóculo de trabajo. Una vez ajustado, el inóculo debe utilizarse dentro de los 15 min. Para evitar sobrecrecimiento bacteriano j) Colocación de los inóculos (ver figura 9 y 10) La colocación de los inóculos obtenidos en el punto 2.1 en el pocillo del replicador.8 se realizará con pipeta automática, depositando con mucho cuidado 400 µl de cada uno de ellos en el pocillo correspondiente. IMPORTANTE: asegurarse de no salpicar y contaminar los pocillos continuos al que se está cargando. Y de anotar la posición del pocillo en el que se deposita cada inoculo (ver esquema en la Figura10) Pocillo del Replicador Recuerde agitar muy bien el inóculo de trabajo antes de proceder a colocarlo en el pocillo del replicador Se recomienda distribuir las cepas de referencia en varias posiciones de los pocillos (preferentemente distantes uno de otro) para monitorear toda la extensión de la placa Cepa Nro…. Figura 10. Esquema de distribución de los inóculos 28 k) Siembra de las placas IMPORTANTE: Se debe rotular cada placa de agar antes de comenzar con la siembra para conocer la ubicación de los inóculos en la misma Se debe comenzar con la placa control que sólo contiene agar Mueller Hinton y luego se continuará con la serie de placas con antibiótico comenzando con aquella que posea la menor concentración. Verifique que todas las placas estén secan antes de la siembra. Sembrando desde la placa con menor concentración de antibiótico se reduce la posibilidad de efecto “carry over”. De todas maneras se debe inocular una segunda placa control de viabilidad al finalizar la serie (corresponde a la placa sin antibiótico del la droga siguiente), para confirmar que no hubo contaminación ó un significativo efecto "carry over" de antibiótico durante el procedimiento IMPORTANTE: mirar periódicamente que todos los clavos estén depositando la microgota de inóculo. Cada clavo del replicador de Stern deposita aproximadamente 2 µl, como el inóculo utilizado tiene 1 x 107 UFC/ml (ver punto 2.1.9), por cada “spot” quedarán aproximadamente 2 x 104 bacterias que es el inóculo recomendado. Las placas inoculadas se deben mantener a temperatura ambiente hasta que el agar absorba el líquido que acompaña al inóculo pero no más de 15 minutos IMPORTANTE: no invertir ni inclinar las placas hasta que la microgota de inóculo se haya absorbido. l) Incubación Incubar las placas invertidas durante 16-18 hs a 35ºC en ambiente aeróbico Día 2 Comentarios teóricos m) Lectura e interpretación Para determinar el punto final, las placas se deben colocar sobre una superficie oscura y opaca. La CIM se registrará como el valor de la menor dilución que inhibe completamente el desarrollo bacteriano Si persisten dos o más colonias en concentraciones superiores al aparente punto final, o si se encuentra desarrollo a altas concentraciones y no a bajas, se debe controlar la pureza del cultivo y probablemente deba repetirse la prueba. No se debe considerar el desarrollo de una simple colonia o una tenue película causada por el depósito del inóculo. 29 Algunos antagonistas del medio de cultivo pueden permitir un leve desarrollo bacteriano cuando se ensaya trimetoprima o sulfonamidas. El punto final en estos casos corresponderá a la concentración en la que haya más del 80 % de reducción del crecimiento comparando con el control. Este fenómeno ocurre por que pueden arrastrarse sustancias antagónicas de la síntesis del ácido fólico Los resultados de CIM obtenidos serán interpretados con la Tabla 2A, y los organismos se informarán sensibles, intermedios o resistentes frente al antimicrobiano ensayado El documento de la CLSI M100-S17no incluye puntos de corte para todos los antibióticos ensayados. En estos casos los puntos de corte son asignados de acuerdo a un análisis de la distribución poblacional y según las propiedades farmacocinéticas y farmacodinamia del antibiótico n) Informe de los resultados Utilizar la planilla para el registro de los resultados 30 Figuras Figura 2 Dilución en Agar - AMPICILINA (*) caldo, agua 1. Preparación de la dilución 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml ____ml de H20 3 ml* 3 ml* 3 ml* 3 ml* 3 ml* 160 µg/ml 80 µg/ml 40 µg/ml 20 µg/ml 10 µg/ml 5 µg/ml 19ml* SAT 256 µg/ml 32 µg/ml 2 µg/ml m l 2.5 µg/ml 1 19ml* 19ml* 1 µg/ml 3 ml* 1 m l 19ml* 19ml* 4 µg/ml 1 m l 1 1 1 8 µg/ml Volcar la totalidad del contenido del tubo (20ml) 3. Colocación del ATB/ ATB/agar en la placa 19ml* 19ml* 16 µg/ml m l m l 19ml* 19ml* 64 µg/ml 1 1 19ml* 128 µg/ml 1 m l m l 19ml* m l 3 ml* 320 µg/ml m l 3 ml* 640 µg/ml m l 3 ml* 1 2. Colocacion del ATB en el agar 3 ml* 1280 µg/ml 1 1 m l AMP activa ___mg 3 ml* 2560 µg/ml m l SAT 5120 µg/ml 0.5 µg/ml 0.25 µg/ml 19ml* (*) agar MH 0.125 µg/ml Volcar la totalidad del contenido del tubo (20ml) 256 µg/ml Al volcar el contenido de los tubos en las placas evite la formación de burbujas Figura 3 Dilución en Agar - CEFOTAXIMA 1. Preparación de la dilución (*) caldo, agua 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml ____ ml de H20 3 ml* 3 ml* 3 ml* 2.5 µg/ml 1.25 µg/ml 0.625 µg/ml 0.31 µg/ml 19ml* SAT 16 µg/ml 19ml* 8 µg/ml 19ml* 19ml* 19ml* 4.0 µg/ml 2.0 µg/ml 1.0 µg/ml Volcar la totalidad del contenido del tubo (20ml) 3. Colocación del ATB/ ATB/agar en la placa 19ml* 0.5 µg/ml 0.25 µg/ml 19ml* 19ml* 0.12 µg/ml 0.06 µg/ml 19ml* 0.03 µg/ml 0.015 µg/ml 1 1 1 1 1 19ml* 1 m l m l 1 1 1 m l 1 1 1 2. Colocacion del ATB en el agar 3 ml* m l 3 ml* 5 µg/ml m l 3 ml* 10 µg/ml m l 3 ml* 20 µg/ml m l 3 ml* 40 µg/ml m l 3 ml* 80 µg/ml m l 3 ml* 160 µg/ml m l 3 ml* m l Sol Interm. Interm. 1920 µg/ml 3 ml* SAT 320 µg/ml m l CTX activa ___mg Dil 1/10 19ml* 0.016 µg/ml 19ml* (*) agar MH 0.008 µg/ml Volcar la totalidad del contenido del tubo (20ml) 16 µg/ml Al volcar el contenido de los tubos en las placas evite la formación de burbujas 31 Figura 4 Dilución en Agar - CLORANFENICOL 1. Preparación de la dilución (*) caldo, agua 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml ____ml de Metanol 3 ml* 3 ml* 3 ml* 3 ml* 160 µg/ml 80 µg/ml 40 µg/ml 20 µg/ml 10 µg/ml 19ml* SAT 512 µg/ml 256 µg/ml 19ml* 19ml* 19ml* 128 µg/ml 64 µg/ml 32 µg/ml 19ml* 16 µg/ml 8 µg/ml 19ml* 19ml* 4 µg/ml 2 µg/ml 5 µg/ml 1 1 m l 1 m l 1 1 1 19ml* Volcar la totalidad del contenido del tubo (20ml) 3. Colocación del ATB/ ATB/agar en la placa m l m l 1 1 m l 1 m l 19ml* 3 ml* m l 3 ml* 320 µg/ml m l 3 ml* 640 µg/ml m l 3 ml* 1280 µg/ml m l 3 ml* 1 1 2. Colocacion del ATB en el agar 3 ml* 2560 µg/ml 1 m l CHL activo ___mg 3 ml* 5120 µg/ml m l SAT 10240 µg/ml 19ml* 19ml* 1 µg/ml 0.5 µg/ml 19ml* (*) agar MH 0.25 µg/ml Volcar la totalidad del contenido del tubo (20ml) 512 µg/ml Al volcar el contenido de los tubos en las placas evite la formación de burbujas Figura 5 Dilución en Agar - CIPROFLOXACINA 1. Preparación de la dilución (*) caldo, agua 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml ____ ml de H20 3 ml* 40 µg/ml 20 µg/ml 10 µg/ml 5 µg/ml 2.5 µg/ml 1.25 µg/ml 0.625 µg/ml 0.31 µg/ml 0.15 µg/ml 0.08 µg/ml 19ml* SAT 4 µg/ml 19ml* 2 µg/ml 19ml* 19ml* 19ml* 1 µg/ml 0.5 µg/ml 0.25 µg/ml Volcar la totalidad del contenido del tubo (20ml) 3. Colocación del ATB/ ATB/agar en la placa 19ml* 19ml* 0.12 µg/ml 0.06 µg/ml 19ml* 19ml* 0.03 µg/ml 0.015 µg/ml 19ml* 0.008 µg/ml 0.04 µg/ml 1 1 1 1 1 1 m l 1 m l 1 1 1 1 2. Colocacion del ATB en el agar 3 ml* m l 3 ml* m l 3 ml* m l 3 ml* m l 3 ml* m l 3 ml* m l 3 ml* m l 3 ml* m l 3 ml* m l 800 µg/ml 3 ml* 1 Sol. Intermedia CIP activa ___mg 9 ml* SAT 80 µg/ml m l Dil 1/10 19ml* 0.004 µg/ml 19ml* (*) agar MH 0.002 µg/ml Volcar la totalidad del contenido del tubo (20ml) 4 µg/ml Al volcar el contenido de los tubos en las placas evite la formación de burbujas 32 Dilución en Agar – TRIMETOPRIMA (TMP) / SULFAMETOXASOL (SUL) Fig. 6 1. Preparación de la dilución ____ ml de Metanol 3 ml 3 ml (*) caldo, agua 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml TMP act._____mg Dil 1/2 3 ml* 3 ml* ____ ml de H20 3 ml 3 ml* 3 ml* 3 ml* 3 ml* 3 ml* SAT 640/12160 160/3040 40/760 1280/24320 µg/ml µg/ml µg/ml µg/ml 320/6080 80/1520 µg/ml µg/ml 3 ml* 3 ml* 10/190 µg/ml 20/380 µg/ml 3 ml* 3 ml* 2.5/47.5 µg/ml 5/95 µg/ml 0.625/11.875 µg/ml 1.25/23.75 µg/ml 19ml* 19ml* SAT 64 µg/ml 32 µg/ml 19ml* 19ml* 19ml* 16 µg/ml 8 µg/ml 4 µg/ml 19ml* 2 µg/ml 1 µg/ml 19ml* 19ml* 0.5 µg/ml 0.25 µg/ml m l m l 1 1 m l 1 m l 1 1 19ml* Volcar la totalidad del contenido del tubo (20ml) 3. Colocación del ATB/ ATB/agar en la placa m l m l 1 1 m l 1 m l 1 m l 1 m l 1 m l 1 2. Colocacion del ATB en el agar m l SUL act._____mg 19ml* 19ml* ____ µg/ml ____ µg/ml 19ml* (*) agar ____MH µg/ml Volcar la totalidad del contenido del tubo (20ml) 64 µg/ml Al volcar el contenido de los tubos en las placas evite la formación de burbujas Figura 7 Dilución en Agar - TETRACICLINA 1. Preparación de la dilución (*) caldo, agua 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml ____ml de Metanol 3 ml* 20 µg/ml 10 µg/ml 19ml* SAT 512 µg/ml 256 µg/ml 19ml* 19ml* 19ml* 128 µg/ml 64 µg/ml 32 µg/ml Volcar la totalidad del contenido del tubo (20ml) 3. Colocación del ATB/ ATB/agar en la placa 19ml* 16 µg/ml 8 µg/ml 19ml* 19ml* 4 µg/ml 2 µg/ml 19ml* 1 µg/ml 5 µg/ml 1 1 1 1 19ml* 1 m l 1 1 m l 1 1 m l 19ml* 3 ml* m l 3 ml* 40 µg/ml m l 3 ml* 80 µg/ml m l 3 ml* 160 µg/ml m l 3 ml* 320 µg/ml m l 3 ml* 640 µg/ml m l 3 ml* 1280 µg/ml m l 3 ml* 1 1 2. Colocacion del ATB en el agar 3 ml* 2560 µg/ml 1 m l TET activa ___mg 3 ml* 5120 µg/ml m l SAT 10240 µg/ml 19ml* 0.5 µg/ml 19ml* (*) agar MH 0.25 µg/ml Volcar la totalidad del contenido del tubo (20ml) 512 µg/ml Al volcar el contenido de los tubos en las placas evite la formación de burbujas 33 Figura 8 Dilución en Agar - GENTAMICINA 1. Preparación de la dilución (*) caldo, agua 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml ____ml de H20 3 ml* 3 ml* 3 ml* 3 ml* 20 µg/ml 10 µg/ml 5 µg/ml 2.5 µg/ml 1.25 µg/ml 19ml* SAT 128 µg/ml 64 µg/ml 19ml* 19ml* 19ml* 32 µg/ml 16 µg/ml 8 µg/ml Volcar la totalidad del contenido del tubo (20ml) 3. Colocación del ATB/ ATB/agar en la placa 19ml* 4 µg/ml 2 µg/ml 19ml* 19ml* 1 µg/ml 0.5 µg/ml m l 19ml* 0.25 µg/ml 1 1 1 1 1 19ml* m l m l 1 1 m l 1 1 m l 19ml* m l 3 ml* 40 µg/ml m l 3 ml* 80 µg/ml m l 3 ml* 160 µg/ml m l 3 ml* 320 µg/ml m l 3 ml* 640 µg/ml 1 1 2. Colocacion del ATB en el agar 3 ml* 1 m l GEN activa ___mg 3 ml* 1280 µg/ml m l SAT 2560 µg/ml 19ml* 0.12 µg/ml 19ml* (*) agar MH 0.06 µg/ml Volcar la totalidad del contenido del tubo (20ml) 128 µg/ml Al volcar el contenido de los tubos en las placas evite la formación de burbujas Dilución en Agar Figura 9 Preparación y colocación del inóculo 0.1 ml Gotas Dilucion 1/10 Bacteria en fase logarítmica 0.5 de McFarland Cc:1x108 UFC/ml 0.9 ml de SF o caldo Cc:1x107 400 µl UFC/ml Policubetas de inóculos del Replicador de Stenr © Servicio ANTIMICROBIANOS – INEI - Dr. Carlos G. Malbrán 34 Planilla - Registro de Resultados: Método de dilución en agar y microdilución (CIM) AISLAMIENTOS Antibiótico Método Cepa mínima CIM µg/ml Concentración inhibitoria CIM µg/ml S,I,R Cepa CIM µg/ml S,I,R Cepa CIM µg/ml S,I,R Cepa CIM µg/ml S,I,R E. coli ATCC® 25922 Rango CIM µg/ml µg/ml AMP 2-8 CTX 0.030.12 CHL 2-8 CIP 0.0040.016 TMS <0.5 /9.5 TET 0.5-2 GEN 0.25-1 35 2.2 Microdilución en caldo Este método se denomina microdilución porque se utilizan pequeños volúmenes de caldo. La prueba se realiza en policubetas de plástico estériles de fondo cónico o redondo. MATERIALES Equipos • • • • • • Mechero tipo Bunsen Pipetas Pasteur plásticas descartables 1 Reservorio con 12 compartimientos 5 Reservorios sin compartimientos Micropipeta multicanal para 12 y 8 puntas Microplacas de 96 pocillos fondo redondo esteriles Soluciones, reactivos y medios de cultivo • • • • • • Solución fisiológica estéril, 3 ml en tubos 13X100 Placas de agar Mueller Hinton (9 cm de diámetro, profundidad del agar de 4 mm ) Placas de agar nutritivo (9 cm de diámetro) 12 Tubos 13x100mm con 4,5 ml de caldo Mueller Hinton ajustado en cationes Tubo con 9,9 ml de caldo Mueller Hinton ajustado en cationes Estándar de turbidez equivalente al 0.5 de la escala de Mc Farland Preparación del caldo Mueller Hinton Comentarios teóricos (1) Preparar el caldo M. Hinton a partir de la base deshidratada de acuerdo a las recomendaciones del fabricante. Esterilizar en autoclave. De los medios disponibles se considera al caldo MHinton el mejor para las pruebas de sensibilidad de rutina dado que: • Muestra buena reproducibilidad lote a lote en las pruebas de sensibilidad. • Contiene bajo nivel de inhibidores de sulfonamidas, trimetoprima y tetraciclina. • Es adecuado para el desarrollo de la mayoría de las bacterias patógenas. • Existen suficientes datos recopilados que avalan la experiencia de las pruebas de sensibilidad realizadas en este medio. (2) El caldo que no se usa en el día puede mantenerse en refrigerador (2-8 ºC.). (3) Controlar la esterilidad de una muestra representativa de cada lote incubando 24 horas o mas a 30-35 ºC. Luego descar esas muestras. No deberá observarse crecimiento bacterianas o micótico. Para verificar la esterilidad del medio, tome una muestra equivalente al 5-10% del total del lote producido. Ignorar cualquier contaminación esporádica; ej. una fracción de medio. Descartar el lote completo, si el nivel de contaminación es significativo (>10% del medio controlado). pH: El caldo debe tener un pH 7,2 - 7,4 a temperatura ambiente. Determinar el pH después de su preparación. El pH para cada lote debe ser controlado cuando se prepara cada lote de medio. Si el pH es demasiado bajo, ciertas drogas (p ej. Aminoglucósidos, quinolonas y macrólidos) parecerán menos activas; mientras otras (p ej. tetraciclinas) parecerán tener mayor actividad. Si el pH es demasiado alto se podrían esperar los efectos opuestos. Ver Tabla 1 36 Si el pH está muy alejado del rango aceptable debe controlarse el procedimiento de la preparación del medio. El método a utilizar dependerá del tipo de equipo disponible en cada laboratorio Las correcciones necesarias serán realizadas por el agregado de NaOH 1M o HCl 1M El agregado de largos volumenes de estas soluciones para correccion del pH puede alterar el contenido de sales del medio. Efecto de la Timina o Timidina: Para evaluar cada lote de Mueller Hinton en su contenido de Timidina se debe realizar la CIM de trimetoprima / sulfametoxazol frente a Enterococcus faecalis ATCC® 29212 o ATCC® 33186. El punto final en estos casos corresponderá a la concentración en la que haya más del 80 % de reducción del crecimiento comparando con el control. Los medios que contienen excesiva cantidad de timina o timidina pueden revertir los efectos inhibitorios de las sulfonamidas y trimetoprima, produciendo así CIMes mas altas, lo cual puede dar como resultado un informe de falsa resistencia. El medio se considera adecuado si el valor de la CIM es < 0.5/9.5 µg/ml. En caso que se observe una CIM > 0.5/9.5 µg/ml podrá procederse al agregado de timidina fosforilasa o sangre lisada de caballo. Efectos por variación en la composición de cationes divalentes. Las pruebas realizadas con cada lote de caldo M. Hinton deben estar de acuerdo con los límites de control para las correspondientes cepas ATCC (ver Control de Calidad). Los resultados de las pruebas con las cepas patrones deben ser cuidadosamente observados para detectar cualquier valor aberrante debido a la composición de cationes del medio de cultivo. La timidina fosforilasa ya sea en su forma pura (aislada) o contenida en la sangre lisada de caballo inactivará los excesos de timidita presentes en el medio y la confiabilidad de las pruebas para sulfonamidas y trimetoprima frente a patógenos comunes, excepto para enterococos La variación en cationes divalentes principalmente Ca++ y Mg++ afectarán los resultados con tetraciclina, colistín y aminoglucósidos frente a P. aeruginosa. Un excesivo contenido de cationes aumentará las CIMes, mientras que bajas concentraciones de cationes resultarán en CIMes menores a las esperadas. Un exceso de zinc podría aumentar las CIMes de los carbapenems Los rangos aceptados son los siguientes (Método de absorción atómica o equivalente): Ca++ = 20 -25 mg/L; Mg++ = 10 -12.5 mg/L. 37 PROCEDIMIENTO Día 1 Comentarios teóricos a) Preparación de las soluciones de antibiótico (figura 11) Se debe tener en cuenta que para la microdilucion, cada solución de antibiótico debe ser preparada 2 veces más concentrada que la deseada en el pocillo La solución de antibiótico se debe preparar de una concentración tal que duplique la deseada (2X). De esta forma, los pocillos serán cargados con 50 µl de la solución del antibiótico y 50 µl del inoculo. Para pesar las drogas podrán utilizarse los conceptos y formulas descriptos para la dilución en agar con la salvedad que la solución de antibiótico a preparar deberá ser de una concentración 2 veces superior a la del rango superior deseado (2X). (Tabla 5) Una vez preparada las diluciones del antibiótico, homegeinicelas perfectamente y con la misma pipeta llene el correspondiente compartimiento del reservorio de la pipeta multicanal comenzando por la solución mas diluida (Se deberán utilizar reservorios con 12 divisiones). Proceda de la misma manera para las otras 11 diluciones. (ver figura 11) IMPORTANTE: Rotular los reservorios con el nombre del antibiótico que esta colocando y al menos la ubicación de la menor y mayor concentración del rango preparado. Al finalizar todos los compartimientos (12) del reservorio de la pipeta multicanal quedarán llenos. Se utilizará un reservorio de 12 compartimientos por cada antibiótico a ensayar b) Llenado de las policubetas con las diluciones del antibiótico (Figuras 11 y 12) Este procedimiento se llevará a cabo mediante la utilización de la pipeta multicanal de doce puntas y el correspondiente reservorio. De una vez se cargan las 12 diluciones del antibiótico en la línea de la policubeta correspondiente (ver figura 12). Rotular cada línea de las policubetas con el nombre del antibiótico que le colocó y las ubicaciones de la dilución menor y mayor del rango. Se deberá preparar una policubeta por cada cepa a ensayar. Cada una será idéntica con respecto a los antibióticos que contengan. c) Preparación del inóculo (ver figura 13) 38 El inóculo estandarizado para el método de microdilución, se puede preparar permitiendo el crecimiento del microorganismo hasta la turbidez 0,5 de la escala de McFarland o bien resuspendiendo colonias directamente hasta alcanzar dicha turbidez (ver Prueba de difusión por discos Importante: agitar muy bien el estándar de turbidez antes de proceder a la comparación Con pipeta de 0.1 o 0.2 ml, colocar 0.1 ml del inóculo ajustado al 0.5 de Mc Farland (1 x 108 UFC/ml) en un tubo con 9.9 ml de caldo Mueller Hinton ajustado en cationes. Con esto se logra una dilución 1/100 del inóculo 6 ajustado (1 x 10 UFC/ml). Cuando se colocan 50 µl de esta suspensión a cada pocillo se obtendrá una concentración final de bacterias de aproximadamente 5 x 105 UFC/ml (inóculo recomendado) al ser diluida al medio por el agregado de igual volumen de la dilución del antibiótico Control de calidad Juntamente con las cepas incógnitas deberán ensayarse las cepas de referencia para el control de calidad del ensayo. d) Siembra de las policubetas de la microdilución (ver figura 13) Tomar reservorios para pipetas multicanal sin compartimientos (o placas de petri) y volcar en cada uno la dilución 1/100 de cada una de las cepas preparadas en el punto 3.3 La aplicación del inóculo se debe realizar dentro de los 15 minutos posteriores a su ajuste Una vez cargados los reservorios, tomar de a uno por vez y, con pipeta multicanal de 8 puntas, colocar 50 µl del inóculo en todos los pocillos de una de las policubetas preparadas Importante: recordar que hay un pocillo control de caldo que sólo lleva 100 µl del caldo utilizado para preparar las diluciones del antibiótico Repetir esta operación con todas las ensayar en sus respectivas policubetas Cada policubeta debe incluir un pocillo de control de crecimiento (sin antibiótico), y un control negativo (caldo sin inocular): Control de caldo: contendrá 100 µl de caldo Mueller Hinton ajustado con cationes. Control de inòculo: contendrá 50 µl del inóculo de trabajo preparado en el punto 2.2.3. y 50 µl de caldo Mueller Hinton ajustado en cationes. cepas a Importante: rotular cada policubeta con el nombre de la cepa que le colocó. 39 e) Incubación Apilar las policubetas terminadas y colocar en la de arriba un film plástico. Incubar 16-20 hs a 35º C en ambiente aeróbico. Al finalizar la prueba, se debe sellar cada policubeta con tapa plástica, película plástica autoadhesiva o bolsa plástica para evitar la desecación. Esta cubierta plástica debe permitir el intercambio de temperatura Para mantener una temperatura de incubación uniforme, se recomienda no apilar más de cuatro policubetas. f) Lectura e interpretación La CIM es la menor concentración de antibiótico capaz de inhibir completamente el desarrollo bacteriano en el pocillo, el punto final queda definido a simple vista por la falta de turbidez del caldo. Cuando en una prueba de microdilución se obtiene un pocillo salteado, se debe leer la CIM más alta. Algunos antagonistas del medio de cultivo pueden permitir un leve desarrollo bacteriano cuando se ensaya trimetoprima o sulfonamidas. El punto final en estos casos corresponderá a la concentración en la que haya más del 80 % de reducción del crecimiento comparando con el control. Para determinar el punto final de desarrollo, debe compararse cada pocillo de la CIM con el pocillo control de crecimiento. El ensayo se considera válido si en el pocillo control de crecimiento se observa un botón de crecimiento o turbidez neta. Si apareciera más de un pocillo salteado con alguna droga, esta no se debería informar. Este fenómeno ocurre por que pueden arrastrarse sustancias antagónicas de la síntesis del ácido fólico Los resultados de CIM obtenidos serán interpretados con la Tabla 2A y los organismos se informarán sensibles, intermedios o resistentes frente al antimicrobiano ensayado g) Informe de los resultados Utilizar la planilla para el registro de los resultados 40 Figuras Figura 11 Microdilución: Microdilución: diluciones del ATB 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml ____ml SAT ____ µg/ml Antibiótico:_________ 3 ml* 3 ml* 3 ml* 3 ml* 3 ml* 3 ml* 3 ml* 3 ml* 3 ml* 3 ml* 3 ml* ____ µg/ml ____ µg/ml ____ µg/ml ____ µg/ml ____ µg/ml ____ µg/ml ____ µg/ml ____ µg/ml ____ µg/ml ____ µg/ml ____ µg/ml 2 ml Reservorio para pipeta multicanal (12 divisiones) (*) Caldo Mueller Hinton ajustado en cationes © Servicio ANTIMICROBIANOS – INEI - Dr. Carlos G. Malbrán Microdilución: Colocación del ATB Fig 12 AMP 256 128 64 32 16 8 CTX 16 8 4 2 1 0,5 CHL 512 256 128 64 32 16 CIP 4 2 1 0,5 TMS* 64 32 16 8 4 2 1 0,5 TET 512 256 128 64 32 16 8 4 2 GEN 128 64 32 16 8 4 2 1 0,5 Caldo Inoc. (-) (+) Controles 4 2 1 0,5 0,25 0,12 0,25 0,12 0,06 0,03 ,015 ,008 8 4 2 1 0,5 0,25 0,25 0,12 0,06 0,03 ,015 ,008 ,004 ,002 0,25 0,12 0,06 0,03 1 0,5 0,25 0,25 0,12 0,06 © Servicio ANTIMICROBIANOS – INEI - Dr. Carlos G. Malbrán 50 µl (*) Se indica rango de TMP Se deberá preparar una placa de microdilución por cada cepa a estudiar 41 Figura 13 Microdilución Preparación y Colocación del inóculo Pipeta multicanal 5 ml 0,1 ml 1/100 Reservorio 0.5 de McFarland Cc:1x108 UFC/ml 9.9 ml de Caldo Mueller Hinton ajustado en cationes Cc final del Inoculo 5x105 UFC/ml 50 µl Cc:1x106 UFC/ml Policubetas Control de caldo No agregar inóculo © Servicio ANTIMICROBIANOS – INEI - Dr. Carlos G. Malbrán 42 Planilla - Registro de Resultados: Método de dilución en agar y microdilución (CIM) AISLAMIENTOS Antibiótico Método Cepa mínima CIM µg/ml Concentración inhibitoria CIM µg/ml S,I,R Cepa CIM µg/ml S,I,R Cepa CIM µg/ml S,I,R Cepa CIM µg/ml S,I,R E. coli ATCC® 25922 Rango CIM µg/ml µg/ml AMP 2-8 CTX 0.030.12 CHL 2-8 CIP 0.0040.016 TMS <0.5 /9.5 TET 0.5-2 GEN 0.25-1 43 Referencias 1. Bauer A.W., Kirby W.M.M., Sherris J.C., Turck M. Antibiotic susceptibility testing by standardized single disk method. Am. J. Clin. Pathol. 1966, 45:493-496 2. NCCLS. Evaluating production lots of dehydrated Mueller Hinton agar; Approved standard NCCLS document M6-A. Wayne, Pennsylvania;1996. 3. Ericsson H.M., Sherris J,C,. Antibiotic susceptibility testing. Report of an international collaborative study. Acta Pathol. Microbiol. Scand., 1971, 217(suppl B):1-90 4. Woods G.L., Washington J.A., Antibacterial Susceptibility test: dilution and disk diffusion methods. In: Murray P.R., Baron E.J., Pfaller M.A. y cols. Manual of Clinical Microbiol., 6ta ed. Washington DC: American Society for Microbiology, 1995:1327-1341. 5. Steers E., Foltz E.L., Graves B.S., An inocula replicating apparatus for routine testing of bacterial susceptibility to antibiotics. Antibiotic Chemother., 1959, 9:307-311 6. Clinical and Laboratory Standards Institute. 2006. Methods for dilution antimicrobial susceptibility test for bacteria that grow aerobically; approved standard. 7th ed. M7-A7. Clinical and Laboratory Standards Institute, Wayne, PA. 7. Clinical and Laboratory Standards Institute. 2006. Performance standards for antimicrobial susceptibility testing; approved standard 9th ed. M2-A9. Clinical and Laboratory Standards Institute, Wayne, PA. 8. Clinical and Laboratory Standards Institute. 2007. Performance standards for antimicrobial susceptibility testing; 17th informational supplement. M100-S17. Clinical and Laboratory Standards Institute, Wayne, PA. 44