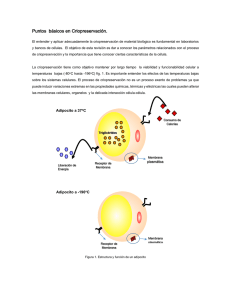
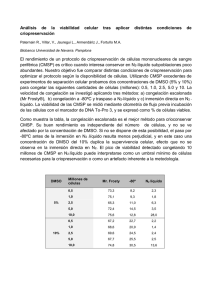
Subsistema Nacional de Recursos Genéticos Acuáticos: uso de la
Anuncio

Hidrobiológica 2011, 21 (3): 415-429 415 Conservación de los Recursos Genéticos Acuáticos Subsistema Nacional de Recursos Genéticos Acuáticos: uso de la criopreservación para la conservación de los recursos genéticos acuáticos en México National Subsystem for Aquatic Genetic Resources: The use of cryopreservation for conservation of aquatic genetic resources in Mexico Carmen Guadalupe Paniagua-Chávez,1 Silvia Margarita Ortiz-Gallarza1 y Marisela Aguilar-Juárez2 1Centro de Investigación Científica y de Educación Superior de Ensenada, B. C. (CICESE), Carretera Tijuana-Ensenada No. 3918 Zona Playitas, Ensenada B. C., 22800. México 2Universidad Autónoma de Sinaloa. Facultad de Ciencias del Mar, Laboratorio de Estudios Ambientales, Paseo Claussen S/N, Mazatlán, Sinaloa, 82000. México e-mail: maguilar@uabc.edu.mx Paniagua-Chávez C. G., S. M. Ortiz-Gallarza y M. Aguilar-Juárez. 2011. Subsistema Nacional de Recursos Genéticos Acuáticos: uso de la criopreservación para la conservación de los recursos genéticos acuáticos en México. Hidrobiológica 21(3): 415-429. RESUMEN Dada la importancia de mantener los recursos genéticos acuáticos, además de otros recursos genéticos en la soberanía alimentaria del país, la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA) y a través de la Dirección General de Vinculación y Desarrollo Tecnológico y del Instituto Nacional de Pesca (INAPESCA), han establecido el Subsistema Nacional de Recursos Genéticos Acuáticos (SUBNARGENA), el cual funciona como una red interinstitucional e interdisciplinaria para la conservación y aprovechamiento sostenible de la biodiversidad acuática de México. Los objetivos del SUBNARGENA son localizar, recolectar, conservar (de forma in situ, ex situ in vivo y ex situ in vitro), y caracterizar genéticamente el germoplasma de organismos acuáticos de interés biológico o comercial y que son declarados como una prioridad para la nación. Por tanto, el objetivo de este manuscrito es presentar el trabajo realizado por el SUBNARGENA y los avances hechos en la criopreservación de algunos de los recursos genéticos acuáticos de México. Palabras clave: Criopreservación, recursos genéticos, acuáticos. ABSTRACT Due to the relevance of mantaining genetic aquatic resources as well as other genetic resources within the alimentary sovereignty of the country, the Secretary of Agriculture, Livestock, Rural Development, Fishery and Food (SAGARPA) and through the General Direction of Technological Transfer and Development and the National Institute of Fishery (INAPESCA), had established the National Subsystem for Aquatic Genetic Resources (SUBNARGENA) which works as an inter-institutional and interdisciplinary network for the conservation and sustainable use of the aquatic biodiversity of Mexico. The objectives of the SUBNARGENA are to localize, collect, conserve (as in situ, ex situ in vivo and ex situ in vitro) and genetically characterize the germplasm of aquatic organism of biological or commercial interest and declared as a priority for the nation. Thus, the goal of this paper is to present the work performed by SUBNARGENA and the advances made in the criopreservation of select aquatic genetic resources of Mexico. Key words: Cryopreservation, genetic resources, aquatics. Vol. 21 No. 3 • 2011 416 Paniagua-Chávez C. G. et al. INTRODUCCIÓN La diversidad de los seres vivos y sus interacciones entre sí y con el ambiente físico son la base de la vida en el planeta (Mace et al. 2009). A nivel mundial, se estima que existen entre 2 y 100 millones de especies, de las cuales sólo se han descrito alrededor de 1.8 millones (May, 1992; Benítez-Díaz & Bellot-Rojas, 2003). Tales especies, en su mayoría, se ubican en una superficie que ocupa el 10% del total del planeta y México junto con otros países albergan entre el 60 y 70% de la biodiversidad total (Mittermeier et al. 1997). México ha sido señalado como el segundo país con mayor variedad de ecosistemas y especies, por ello sus recursos biológicos son de los más diversos del planeta. Además, el país cuenta con varias especies endémicas de las cuales alberga entre el 50 y 60% de las especies de plantas conocidas del mundo (CONABIOSEMARNAT, 2009). Por tanto, siendo México uno de los países más megadiversos del mundo (UICN, 2009), la república tiene el compromiso de salvaguardar la biodiversidad para las generaciones presentes y futuras (Benitez-Díaz & Bellot-Rojas, 2003). Por otro lado, el crecimiento poblacional acelerado, la falta de planeación del uso de suelo y una visión de contínuo desarrollo, han conducido a la sobreexplotación de los recursos naturales, dando como resultado impactos negativos en los ecosistemas y por ende en la biodiversidad. El resguardo de la biodiversidad, en acuerdo al Convenio sobre la Diversidad Biológica (CDB) constituye un compromiso de los gobiernos nacionales, y la regulación de los recursos genéticos (RG) está sometida a la legislación nacional. Por ello, el CDB contempla entre sus objetivos fundamentales promover medidas que conduzcan a un futuro sostenible en función de la conservación de la diversidad biológica, la utilización sostenible de sus componentes y la distribución de manera justa y equitativa de los beneficios derivados de la utilización de los RG, éste último punto de particular interés para los países en vías de desarrollo (ONU, 1992). La FAO (2007) reconoce la importancia de los recursos genéticos animales (RGAn), en la seguridad alimentaria para las generaciones presentes y futuras, pero también reconoce que no toda la biodiversidad animal es utilizada completamente para satisfacer las necesidades de seguridad alimentaria, por ello existe gran preocupación por el constante deterioro de ésta a nivel mundial. Consecuentemente, a raíz de tales declaraciones, los gobiernos del mundo establecieron como alta prioridad el mantenimiento de la biodiversidad (León et al. 2004). La importancia de conservar los RG como estrategia para la seguridad alimentaria ha sido enfatizada desde el siglo pasado, dando prioridad al sector agrícola y pecuario. No obstante, la relevancia del sector acuático no ha sido reconocida apropiadamente en el pasado y mucho menos en los últimos años (Greer & Harvey, 2004; Sánchez, 2007), a pesar de que la acuicultura es uno de los sectores del ramo alimenticio con mayor crecimiento de los últimos años. Por ejemplo, en México la producción de peces, crustáceos y moluscos de cultivo pasó de 104,354 toneladas en 2004 a 151,065 toneladas en 2008 (FAO, 2010a). En acuerdo con la FAO (2007) la conservación de los RGAn puede darse de tres formas: (1) conservación in situ, (2) conservación ex situ in vivo y (3) conservación ex situ in vitro. En ésta última, la conservación del organismo se realiza en forma de germoplasma (e.g. tejidos que originan a otro organismo tal como embriones, espermatozoides, ovocitos) fuera de su hábitat natural y bajo condiciones criogénicas. La conservación de los organismos acuáticos es relevante comparada a la de los organismos terrestres, debido a que éstos representan el mayor recurso alimentario obtenido a partir de especies silvestres (Ryman, et al. 1995). Por tanto, el mantenimiento de su diversidad es prioritario. A nivel genómico, la caracterización genética a través del uso de marcadores moleculares asociado a una aproximación estadística poderosa, provee una nueva vía para elegir la mejor toma de decisiones en la conservación y el manejo racional de los recursos genéticos animales. Los datos obtenidos de los marcadores moleculares son aplicados en la toma de decisiones para la conservación de las poblaciones. Estos incluyen la determinación de la identidad de las especies, la estructura genética de las poblaciones, la estimación del tamaño efectivo de la población y la detección de los cambios en el tamaño de la población (Primmer, 2006). A la fecha, los marcadores más comunes son aquellos utilizados para evaluar la diversidad entre y dentro de familias. Aunque en principio todos los tipos de marcadores pueden ser apropiados para este propósito (e.g. polimorfismo en las secuencias del ácido desoxirribonucleico [ADN] mitocondrial o nuclear), a nivel poblacional, los microsatélites son de los marcadores que han mostrado resolver interrogantes relacionadas con la estructura de las poblaciones. Aproximadamente, el 90% de todos los estudios de diversidad utilizan este método (Baumung et al. 2004). El comité de la FAO y la Sociedad Internacional de Genética Animal recomiendan el empleo de un conjunto de marcadores de microsatélites para la mayoría de las especies de granja. Esta recomendación fue revisada en 2004 y se extendió a un gran número de especies (Hoffman et al. 2004). Por lo que dichos marcadores fueron seleccionados para representar la variabilidad genética neutral en los genomas de animales. La mayoría de las tecnologías tienen como blanco las regiones genómicas, las cuales son selectivamente neutrales, mientras que otras se enfocan en genes específicos. Por tanto, la tecnología utilizada para la conservación y manejo de la colección del germoplasma dependerá de los objetivos del mismo. La conservación de los Recursos Genéticos Acuáticos (RGA) es un concepto nuevo y la criopreservación de germoplasma es Hidrobiológica Conservación de los Recursos Genéticos Acuáticos una de las alternativas que han sido contempladas para su conservación. En 2007, la Comisión de los Recursos Genéticos para la Alimentación y la Agricultura indicó que la conservación ex situ in vitro para las especies acuáticas aún se encuentra en un estado de desarrollo temprano (FAO, 2007), por lo que resaltaron la necesidad del desarrollo de tecnologías para la criopreservación de las diversas especies acuáticas. Hasta años recientes se ha logrado la criopreservación del germoplasma de más de 200 especies de organismos acuáticos en el mundo, siendo en su mayoría células espermáticas (Hiemstra et al. 2005; Tiersch & Green, 2011). La conservación de los RGA tiene importancia para el desarrollo del potencial social y se considera como benefactor económico que permitirá mantener la biodiversidad para un bien común (Greer & Harvey, 2004). Por todo lo anterior, el objetivo principal de esta revisión bibliográfica, es reseñar el desarrollo de la conservación ex situ in vitro de los RGA en México. La revisión contempla cuatro partes. En la primera sección se analiza el desarrollo de los bancos de germoplasma animal. En la segunda, se indica como fue creado el Subsistema Nacional de Recursos Genéticos Acuáticos (SUBNARGENA), que alberga los bancos de germoplasma para especies acuáticas del país. En la tercera parte se describen las técnicas de criopreservación que se emplean en los RGA. Finalmente, en la última sección se indican los trabajos de criopreservación realizados en México y se enlistan las especies almacenadas en el SUBNARGENA. Desarrollo de los bancos de germoplasma animal La conservación de los RGAn incluye todas aquellas actividades humanas como estrategias, planes, políticas y acciones emprendidas para asegurar la diversidad de estos recursos (FAO, 2007). La importancia de la conservación de los RGAn es relevante en la alimentación, la producción agrícola y el desarrollo de nuevos productos como reproducción asistida, mejoramiento genético entre otros, todo esto a beneficio de las generaciones actuales y futuras. Por tanto, el desarrollo de Bancos de Recursos Genéticos (BRG) o Bancos de Germoplasma (BG) juega un papel fundamental en salvaguardar el material genético de estos recursos. Los BRG o BG, son los depósitos que ayudan a mantener y conservar el material genético de especies nativas o exóticas de importancia biológica y económica de una región. Los objetivos de los BRG, estan influenciados por la forma en que los bancos se establecen y operan. Las principales categorías son (1) bancos para conservación animal, (2) bancos para conservación de especies de importancia agrícola y (3) bancos para investigación médica y de ciencia básica. De tal modo, existen diferencias primordiales en el concepto e intención entre BG, los cuales estan en buena medida influenciados por el tipo de material a resguardar (Holt, 2001). Vol. 21 No. 3 • 2011 417 Históricamente, los primeros BRG o BG iniciaron con la conservación de semillas de plantas. En el mundo se cuenta con una importante bóveda que fue construida a 130 m de profundidad en una montaña de la isla Spitsbergen, perteneciente al archipiélago Svalbard en Noruega. La bóveda de Svalbard contiene alrededor de 100 millones de semillas de plantas pertenecientes a un centenar de países (ICRISAT, 2008). A raíz de la relevancia que han adquirido los RG, la FAO ha dirigido esfuerzos importantes para su conservación en el mundo con el propósito de promover un manejo sostenible a nivel global (ONU, 1992). Bajo dicho contexto, se han desarrollado planes estratégicos de acción, bases de datos, convenios y guías para el mejor manejo de los RG. En el caso específico de los RGAn, la FAO desarrolló el sistema de información llamado Domestic Animal Diversity Information System (DAD-IS) el cual indica que ~154 países se encuentran involucrados en programas de conservación in situ o ex situ con apoyo del gobierno, academia o iniciativa privada (DAD-IS, 2011). Posterior al desarrollo del Plan Global de Acción establecido por la FAO en 2007; los países participantes iniciaron con el cumplimiento de los compromisos establecidos en este plan. Con respecto a las estrategias de conservación, a la fecha, los países participantes, organizados en redes de colaboración, se encuentran desarrollando tareas para la conservación de los RGAn in situ y ex situ. De tal manera que la conservación ex situ in vitro puede ser realizada o coordinada por el gobierno en conjunto con instituciones de investigación, universidades y asociaciones, entre otros. En dicho sentido, el procesamiento, almacenamiento de muestras y especímenes puede ser realizado por los miembros de las instituciones participantes (Day & Stacey, 2007). Para ello, los gobiernos e instituciones participantes han desarrollado, o se encuentran desarrollando BRG para resguardo del patrimonio nacional (Tabla 1). Por ejemplo, en los Estados Unidos de Norteamérica destaca el Programa Nacional de Recursos Genéticos (National Genetic Resources Program, NGRP), autorizado por el congreso estadounidense en 1990. El objetivo de este programa es caracterizar, preservar, documentar y distribuir entre todos los científicos interesados, el germoplasma de todo tipo de formas biológicas que directa o indirectamente estén relacionadas con algún aspecto de producción agrícola y alimentaria (Blackburn, 2011). Con base en los objetivos establecidos por dicho programa, se desarrollaron proyectos independientes para la preservación del germoplasma de plantas, animales, microbios e invertebrados. El Programa Nacional de Germoplasma Animal (National Animal Germplasm Program, NAGP) fue iniciado en Fort Collins, Colorado, EUA, en 1999 y tiene como objetivo principal, coordinar la disponibilidad, conservación y utilización del material genético animal a fin de proveer grupos de genes con características favorables para incrementar la producción mundial de alimentos. 418 Paniagua-Chávez C. G. et al. Tabla 1. Lista de algunos bancos de germoplasma dedicados a la criopreservación de recursos genéticos animales. País Nombre del Banco Albania Somatic Cells Gene Bank Alemania German Genebank for Domestic Animals Austria Austrian Gene Bank for AnGR. The Austrian National Cryo-preservation programme Azerbaiyán Republic Artificial Insemination Center Brasil Brazilian Animal Gen Bank Canadá Canada Animal Genetic Resources program. Agriculture and Agri-Food Canada Eslovenia The National Farm Animal Gene Bank of Slovenia Estados Unidos National Center for Genetic Resources Preservation Francia Cryobanque Nationale Grecia National Cryobank for AnGR Italia Criobanca del Germoplasma Animale “Giuseppe Rognoni”-IBBA-CNR, Banca delle Risorse Genetiche Animali Lombarde-LABank Países Bajos Dutch National Gene Bank for AnGR- Centre for Genetic Resources, the Netherlands Malasia Bancos en: The National Institute of Veterinary Biodiversity & The National Embryo Center México Centro Nacional de Recursos Genéticos Perú Instituto Nacional de Innovación Agraria Suiza National Genpool Taiwán Taiwan Animal Germplasm Center Para realizar las actividades de operación del NAGP, se formaron seis comités (especies acuáticas, ganadería para producción de carne, ganadería para producción lechera, aves, rumiantes menores y ganado porcino) que se integraron de universidades, sector público, privado y agencias gubernamentales (Blackburn, 2011). El resguardo del germoplasma se ha confinado al Centro Nacional para la Preservación de los Recursos Genéticos (National Center for Genetic Resources Preservation NCGRP), el cual pertenece al Departamento de Agricultura de los Estados Unidos (United States Department of Agriculture, USDA) y es coordinado por la Agencia de Investigación Agrícola (ARS Agricultural Research Service). Otro banco importante es el situado en Sudamérica, el banco genético animal brasileño, que contiene más de 14,000 muestras de ADN y tejidos de especies de ganado nativas y de importancia económica, de las cuales ~60 mil dosis son de semen y 500 muestras de embriones de diversas especies de ganado bajo algún grado de riesgo (FAO, 2010b). La Empresa Brasileña de Investigaciones Agropecuarias (EMBRAPA), institución vinculada al ministerio de Agricultura Pecuaria y Abastecimiento de Brasil, es la responsable de ejecutar el programa de conservación ex si­ tu in vitro. Un ejemplo de colaboración internacional es el trabajo realizado entre Canadá, Estados Unidos y Brasil para desarrollar el sistema de información y base de datos para apoyar el manejo de los RGAn entre tales países. Subsistema Nacional de Recursos Genéticos Acuáticos Al igual que en otros países, en México se estableció el Centro Nacional de Recursos Genéticos (CNRG) que pertenece al Sistema Nacional de Recursos Genéticos (SINARGEN) y tiene como objetivos: (1) preservar y proteger los RG del país, (2) contribuir y propiciar el uso ordenado y racional de los RG de México (RGM), (3) coadyuvar a las acciones realizadas por el SINARGEN y (4) difundir la importancia de la conservación de los RGM. El CNRG está constituido por cinco subsistemas (Acuático, Agrícola, Forestal, Microbiano y Pecuario) los cuales, tienen como objetivos principales desarrollar tareas de recolección, conservación, caracterización, evaluación, uso sostenible y monitoreo de recursos genéticos in situ y ex situ de México (De la Torre, com. pers. 2011). El SINARGEN nació a partir de que el Programa Sectorial de Desarrollo Agropecuario y Pesquero (2007-2010) consideró necesaria la promoción del uso racional y aprovechamiento sostenible de los recursos básicos para la producción primaria: suelo, agua, vegetación y mares; así como la conservación de los recursos fitogenéticos, zoogenéticos y forestales; ya que de ello depende la producción de alimentos inocuos y de calidad para la población de las generaciones actuales y futuras. En este entorno y con la finalidad de integrar acciones que permitan conservar, estudiar y aprovechar sosteniblemente nuestra riqueza genética, se desarrolló el SINARGEN como un esquema de coordinación en la materia, con los cinco subsistemas antes mencionados. Sin embargo, a pesar de que se ha destinado un gran esfuerzo en la conservación de los RGAn, poco ha sido dedicado a los RGA y a la fecha se tiene escasa información de la existencia de programas destinados a la conservación de RGA o a resguardos en los BRG o BG. En Estados Unidos de Nortéamerica se tienen almacenados en el NAGP ~28,500 muestras de germoplasma correspondientes a 729 organismos pertenecientes a 13 especies de peces de agua dulce, seis de peces marinos y tres de invertebrados (Blackburn, 2011). En la India, el Consejo de Investigación Agrícola estableció en 1983 el Buró Nacional de Recursos Genéticos de Peces (NaHidrobiológica Conservación de los Recursos Genéticos Acuáticos tional Bureau of Fish Genetic Resources, NBFGR) el cual, se ha vuelto un centro de excelencia en la categorización y conservación de recursos acuáticos en dicho país. En la India los RG se han valorado en términos de su potencial económico, ecológico y social, por tanto, su conservación a largo plazo se vuelve una necesidad. La creación del NBFGR nace a raíz de que en este país se detecta que sus RGA están amenazados debido al aumento de la población humana, y se sabe que estas alteraciones podrían ser severas y resultar en una pérdida de la diversidad genética o en la extinción de las poblaciones. Por tanto, el NBFGR proyecta un plan visionario hasta el 2025 en el cual, las prioridades son la caracterización, manejo y uso sostenible de los RGA con el fin de salvaguardar la diversidad genética de los peces de este país (NBFGR, 2007). A la fecha, los avances del NBFGR son: (1) el desarrollo de una base de datos de >2000 especies de peces, (2) el análisis de la estructura genética de poblaciones de diversas especies prioritarias, (3) la estandarización de tecnología para la conservación in situ y ex situ de especies en peligro y (4) el desarrollo de capacidades para el diagnóstico de patógenos en relación a la evaluación de especies de peces exóticos (NBFGR, 2010). Otro BG dirigido a la conservación de RGA es el CRIOGAM, instalado en la Facultad de Ciencias del Mar de la Universidad Católica del Norte, en Coquimbo Chile. La misión de dicho banco es conservar y generar investigación para optimizar los protocolos utilizados en la criopreservación de gametos de organismos marinos, específicamente para el abulón rojo (Haliotis rufescens Swainson, 1822) y el azul (H. fulgens Philippi, 1845), el ostión del norte (Argopecten purpuratus Lamarck, 1819) y la almeja amarilla (Mesodesma donacium Lamarck, 1818) (Dupré & Guerrero, 2011). En Moscú, Rusia, el banco genético de baja temperatura de esperma de peces (Low-Temperature Gene Bank of Fish Sperm), fue fundado en 1988 en el All-Russian Research Institute of Freshwater Fisheries, con el fin de conservar la diversidad genética de los esturiones. Para 2008, se tenían ~400 muestras de semen de diferentes especies de esturión (Mims et al. 2011), cifra que sigue en continuo aumento. En Canadá, World Fisheries Trust (WFT) en conjunto con agencias de gobierno y First Nations, han sido responsables de la criopreservación de esperma de salmones silvestres durante 1990-2006. WFT ha criopreservado mas de 4,500 muestras de 43 diferentes líneas de material genético de salmónidos (Harvey, 2011). Igualmente, WFT se ha encargado del desarrollo de métodos de criopreservación de esperma en campo para numerosas especies migratorias de Sudamérica, especialmente del Brasil (Carolsfeld et al. 2003). Finalmente, el CNRG de México contiene los Bancos Periféricos de Germoplasma de especies Acuáticas, de los cuales se hablará en la próxima sección. En México, al noroeste del país, en el Centro de Investigación Científica y de Educación Superior de Ensenada (CICESE), Vol. 21 No. 3 • 2011 419 nace en el 2005 el primer BG de especies acuáticas a nivel piloto denominado “Banco de Germoplasma de Especies Acuáticas de Baja California”. Este proyecto fue desarrollado con fondos de un proyecto mixto entre el Consejo Nacional de Ciencias y Tecnología (CONACyT) y la Secretaría del Medio Ambiente y Recursos Naturales (SEMARNAT). El objetivo del proyecto fue el de conservar los RG de especies acuáticas con importancia biológica y económica para Baja California, con el fin de ayudar a los programas de conservación y a mejorar la industria acuícola del estado. Este proyecto finalizó en 2007, pero el Banco de Germoplasma quedó como un legado y ejemplo nacional para asegurar la conservación de los recursos genéticos del país. En 2009, el Banco de Germoplasma de especies acuáticas de Baja California se integra al Sistema Nacional de Recursos Genéticos para la Alimentación y la Agricultura de la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA) a través del Instituto Nacional de Pesca (INAPESCA), siendo ahora conocido como SUBNARGENA. El SUBNARGENA pertenece al SINARGEN y tiene como objetivo conservar los recursos genéticos acuáticos del país mediante el desarrollo de núcleos genéticos para el mantenimiento de organismos in situ o ex situ in vivo y la criopreservación de material genético (conservación ex situ in vitro). El SINARGEN, se estableció como un mecanismo abierto e incluyente para resguardar, proteger, mejorar y aprovechar sosteniblemente toda la riqueza genética de los sectores acuático, agrícola, forestal y pecuario de México, que opera a través de los subsistemas y redes (especie, temática o región) y en las que participan varias instituciones de México. En este contexto y en el marco del SUBNARGENA, se constituyó la Red de RGA, como parte de los elementos que permitan orientar acciones hacia el cumplimiento de los objetivos del Programa de Uso Sostenible de Recursos Naturales para la Producción Primaria y en particular apoyar a los objetivos establecidos en el Plan Nacional de Acción para la conservación de los RGA. La red está constituida por investigadores de diferentes instituciones tales como la Universidad Nacional Autónoma de México (UNAM), la Universidad Juárez Autónoma de Tabasco (UJAT), la Universidad Autónoma de Baja California (UABC), la Unidad Multidisciplinaria de Docencia e Investigación (UMDI-UNAM), la Universidad Autónoma Metropolitana Iztapalapa (UAM-I), el Colegio de la Frontera Sur (ECOSUR), el Centro de Investigaciones Biológicas del Noroeste (CIBNOR), y se espera que otras instituciones se sumen al trabajo del SUBNARGENA. El SUBNARGENA, coordinado por el CICESE en Ensenada, B. C tiene un BG periférico, que contiene muestras de diferentes especies tales como, lenguado (Paralichthys californicus Ayres 1859), ostión del pacífico (Crassostrea gigas Thunberg 1793), abulón rojo (Haliotis rufescens), totoaba (Totoaba macdonaldi Gilbert 1890) y trucha de San Pedro Mártir (Oncorhynchus mykiss nelsoni 420 Paniagua-Chávez C. G. et al. Evermann 1908). Además y debido a la necesidad de atender las necesidades de conservación ex situ in vitro de todo el país, en febrero de 2010 se estableció un segundo BG en el sureste del país denominado Banco de Germoplasma Periférico del Sureste, el cual será coordinado por la Unidad Multidisciplinaria de Docencia e Investigación-UNAM en Sisal Yucatán y coordinará las tareas y objetivos establecidos en el Plan de Acción del SUBNARGENA. La criopreservación como una herramienta en la conservación de los recursos genéticos acuáticos La criopreservación es una técnica que permite mantener a muy bajas temperaturas (<-130° C), a cualquier conjunto biológico de células por tiempo indefinido, creando las condiciones necesarias para que conserven la capacidad de sobrevivir después de la descongelación (Day & Stacey, 2007). Tal herramienta tiene amplio potencial para los fines que se persiguen en la biología de la conservación, la ecología y la acuicultura. En especies acuáticas, la conservación de gametos y embriones es clave para el desarrollo de tecnologías de reproducción asistida (Denniston et al. 2011); porque es posible la no dependencia de los reproductores para efectuar la fertilización artificial fuera de la temporada reproductiva. Incluso, se puede diagnósticar la condición patológica de los gametos, antes que sean empleados para fertilización o se liberen al medio (Bobe & Labbe, 2009). Además, el mantenimiento de los gametos a bajas temperaturas, facilita su transporte a diferentes unidades de reproducción en donde el material puede ser utilizado en programas de selección genética o bien Figura 1. Aspectos implicados en la criopreservación. Hidrobiológica Conservación de los Recursos Genéticos Acuáticos para la conservación de especies en peligro de extinción (Cabrita et al. 2010) o de interés comercial (Chao & Liao, 2001; Tiersch & Green, 2011). El proceso de la criopreservación en organismos acuáticos se puede desglosar en los siguientes pasos: colección del germoplasma, mantenimiento de muestras en una solución fisiológica o extensora, refrigeración o almacenamiento a corto plazo, congelación, almacenamiento a -196° C, descongelación, fertilización y evaluación del desempeño (Fig. 1). La elección del tipo de material para criopreservar depende primeramente de la posibilidad de obtenerlo, los objetivos que se persiguen, la existencia de experiencias en la recolecta de gametos y protocolos de criopreservación, así como de los costos y de otras circunstancias de carácter práctico (Hiemstra et al., 2005). Por otro lado, para otorgarle valor o precio al material en resguardo, es recomendable que la recolecta del material biológico considere los siguientes supuestos: (1) pureza de la muestra (libre de organismos contaminantes), (2) autenticidad (identificación correcta a nivel morfológico y genético de cada donante u progenitor) y (3) control de calidad (determinación de la adecuada funcionalidad y capacidad de las células) (Stacey & Day, 2007). Se hace hincapié en lo anterior debido a que, durante el almacenamiento de las células gaméticas a temperaturas cercanas al punto de congelación, éstas disminuyen su metabolismo pero no lo detienen, como sucede en condiciones de almacenamiento a -196° C (Denniston et al., 2011). Por ello, se debe poner atención especial para asegurar el funcionamiento apropiado del metabolismo celular y la integridad de las estructuras de las células al retornar a la temperatura normal. Así, el medio de almacenamiento juega un papel crucial y la solución extensora (SE) más apropiada, será aquella que tenga la capacidad osmótica e iónica para mantener apropiadamente el metabolismo de las células (Scott y Baynes, 1980). A la fecha, no existe un criterio que determine el éxito de usar una solución extensora de formulación simple (uno a dos ingredientes) o una compleja (mezcla de uno o varios aditivos de alto peso molecular) (Cabrita et al., 2009). Aunque, se ha sugerido que el criterio para la elección se base en que la composición iónica y la presión osmótica de la SE, sean lo más similar a aquella en la sangre o el plasma seminal del organismo (Morisawa & Susuki, 1980), lo que hace que esta SE sea especie-específica. Sin embargo, al determinar una SE apropiada debe considerarse que esta debe prevenir la activación de gametos y permitir la homeostasis celular. Incluso, la SE puede incluir moléculas específicas para proteger a los gametos de daños por efecto de las bajas temperaturas (Gwo, 2000). Independientemente de la formulación de la SE, el material biológico está sujeto a cambios en su medio físico y químico. Por tanto, su tolerancia al almacenamiento, tiene que ser consideVol. 21 No. 3 • 2011 421 rada y su calidad monitoreada constantemente. En el caso del esperma, el porcentaje de células con movimiento después de su activación con el medio apropiado, ha sido el criterio más utilizado para determinar su calidad (Cabrita et al., 2009). Incluso, con base en lo anterior, se puede inferir si la criopreservación será viable o si se dificultará y entonces el almacenamiento en refrigeración permanecería como la única opción para manejar una fertilización posterior in vitro (Bobe & Labbe, 2009). El éxito en la conservación de semen a corto plazo depende de las características físicas y fisiológicas de las células espermáticas (Bobe & Labbe, 2009). Cuando el esperma se almacena entre 0 y 4° C, la adición de antibióticos y la tasa de suspensión (Esperma:SE) son los parámetros más relevantes para su mantenimiento (Bromage & Roberts, 2001). Los antibióticos mas empleados en este caso son penicilina y estreptomicina, que solos o en combinación han sido aplicados con éxito en la conservación a corto plazo del esperma de varias especies de peces (Bromage & Roberts, 2001). En el caso de la tasa de suspensión o proporción entre volumen de la SE y el semen, las tasas de 1:1 a 1:3 han sido eficientes en la criopreservación de gametos, por lo que estas pueden ser utilizadas como pauta para efectuar ensayos de conservación a corto plazo (Bromage & Roberts, 2001). No obstante, en especies donde el semen es extraído directamente de las gónadas, la dilución inicial recomendable es de 1:10 (Bobe & Labbe, 2009). En el caso de la criopreservación a largo plazo la congelación del material biológico se realiza en nitrógeno líquido a -196° C y su objetivo principal, es conservar la integridad genética, la funcionalidad y la estructura física de las células, mientras la actividad metabólica es detenida (Chao & Liao, 2001;Tiersch & Green, 2011). Durante este procedimiento, el tipo y concentración del crioprotectante, la tasa de congelación, la tasa de descongelación, el tiempo de almacenamiento y la acción bacteriana son factores clave (Gwo, 2000; Lahnsteiner, 2000; Li et al., 2006; Tiersch­ & Green, 2011). Durante la criopreservación con frecuencia se logra observar efectos dañinos sobre las células sometidas (Paynter & Fuller, 2007). Uno de los más letales, es el rompimiento de las células debido a la formación de cristales de hielo, los cuales ocasionan efectos deletéreos en la célula (Leibo, 2008; Tiersch & Green, 2011). Bajo este contexto, el uso de agentes crioprotectantes (ACP), tienen la función de reducir la temperatura de congelación del medio en el que se encuentran suspendidas las células para reducir o contrarrestar la formación de los cristales de hielo (Woods et al. 2004; Pegg, 2007). Los ACP se pueden dividir en dos tipos: crioprotectantes penetrantes a la membrana plasmática, tales como glicerol, dimetil sulfóxido, 1,2-propanodiol, etilenglicol y metanol entre otros, y crioprotectantes no penetrantes, como los azúcares (glucosa, trehalosa y sacarosa, entre otros), (Leslie et al. 1995; Jain & Paulson, 2006). Sin embargo, los mismos ACP 422 penetrantes que confieren protección a la célula, pueden ser extremadamente tóxicos cuando se encuentran a altas temperaturas ya que pueden inducir la desnaturalización de proteínas debido a su naturaleza (Rana, 1995; Muchlisin, 2005). Por otro lado, el daño producido por los ACP no penetrantes, es generado por la deshidratación y la consiguiente constricción de las células por debajo del volumen crítico. En ambos casos, la disolución de estos compuestos químicos genera una presión osmótica alta que provoca encogimiento o aumento del volumen de la célula, ya sea en el proceso de criopreservación o en el de descongelación (McFadzen, 1995; Özkavukcu & Erdemli, 2002). Por tanto, en la elección del ACP se debe considerar que éstos sean de bajo peso molecular, baja toxicidad y alta solubilidad en agua (Chao & Liao, 2001; Pegg, 2007; Leibo, 2008). Otro de los factores relevantes durante la criopreservación a largo plazo son las tasas de congelación, que están influenciadas por la velocidad a la que el agua se mueve a través de la membrana celular. Esta habilidad está determinada por factores como, el tipo específico de membrana, la temperatura, la proporción entre la superficie de la membrana, el volumen y la concentración de solutos (Denniston et al. 2011). Por ello, las tasas de congelación deben ser definidas en conjunto con la temperatura inicial y final del procedimiento (Tiersch & Green, 2011). Lo anterior se debe a que la congelación rápida de los gametos o embriones no permite una deshidratación apropiada y puede originar la formación de cristales letales dentro de la célula (Denniston et al., 2011) y de manera opuesta, si la congelación sucede muy lentamente, puede producir incremento de los efectos de exposición a la solución crioprotectora dentro de la célula (Rall & Polge, 1984). Así, la técnica utilizada para el enfriamiento, es determinante en la calidad final de las muestras. La congelación puede ser realizada de manera manual (utilizando una caja de hule espuma) o automática (con un congelador con tasas de congelación programable). Para bajar la temperatura utilizando un congelador manual se requiere hielo seco o vapor de nitrógeno líquido (VN2L) mientras que para el congelador programable se utiliza VN2L (Wayman & Tiersch, 2001). El enfriamiento con VN2L ofrece una distribución de la temperatura más uniforme y se puede manejar a diferentes tasas de congelación, lo que no sucede cuando se utiliza hielo seco, el cual, aunque conveniente para la aplicación en campo, puede solo generar tasas de enfriamiento de ~30-35° C/min (Bromage & Roberts, 2001; Salinas-Flores, 2003). La descongelación es otro punto importante en el proceso de criopreservación y también tiene efectos adversos, la recristalización del hielo al momento de la descongelación provoca efectos similares a los de la congelación (Woods et al., 2004). Por ello es importante establecer las tasas de descongelación más adecuadas para reducir los daños (Chao & Liao, 2001; Pegg, 2007). La influencia que tienen las tasas de descongelación sobre Paniagua-Chávez C. G. et al. el material biológico son la formación de cristales de hielo intracelular, la rehidratación y el mantenimiento de la integridad celular (Tiersch & Green, 2011). La temperatura de descongelación, depende de la tasa de congelación y de la temperatura previa de la muestra antes de haber sido introducida en el nitrógeno líquido (Denniston et al., 2011). Por otro lado, las tasas de congelación y descongelación también dependen de la especie y del tipo de célula. Por ejemplo, en el caso de embriones de mamíferos tales como terneros, ovejas, cabras y potrillos se ha determinado que el uso de tasas de descongelación lentas (menores a 25° C/min), es favorable para su sobrevivencia (Wilmut & Rowson, 1973; Willadsen et al., 1976; Bilton & Moore, 1976; Yamamoto et al., 1982; Takeda et al., 1984;). Mientras que para el esperma de anfibios, se ha observado que diferentes tasas de descongelación no afectan la recuperación celular (Hopkins & Herr, 2008; Sargent & Mohun, 2005; Browne & Figiel, 2011). En el esperma de la almeja (Mesodesma donacium) la descongelación rápida resultó en 84% de fertilización y motilidad de 12%, mientras que con la lenta, se obtuvo una tasa de fertilización del 62% y un 17% de motilidad (Dupré & Joo, 2006). La vitrificación, como una modalidad alternativa de la criopreservación (Fahy et al., 1984; Cabrera et al., 2006) consiste en la congelación ultrarápida de las células, lo cual permite que el agua se congele de una manera amorfa sin la formación de cristales de hielo (Vajta et al., 1998; Isachenko & Isachenko, 2007). Tal procedimiento reduce los tiempos en el manejo de muestras, porque estas son sumergidas directamente en el nitrógeno líquido, con lo que se evita el uso de equipo sofisticado (Denniston et al., 2011). La técnica de vitrificación ha sido aplicada con éxito en ovocitos o embriones de conejos (López-Béjar & López-Gatius, 2000), humanos (Mukaida et al., 2003), toros, caballos (Campos-Chillón et al., 2009), peces (Chen & Tian, 2005) y ratones (Manno, 2010; Mazur & Seki, 2011). La desventaja de dicha técnica es que en los casos en que se necesitan ACP, estos tienen que ser utilizados a altas concentraciones, lo que puede producir citotoxicidad a las células antes de su vitrificación (Taylor et al., 2004). Por tanto, es necesario realizar experimentos para determinar que células son factibles de vitrificar. Determinar la calidad de las muestras antes y después de la criopreservación es un elemento importante para definir el éxito de la técnica de criopreservación utilizada. Para muestras de esperma, la funcionalidad del espermatozoide es uno de los principales marcadores de calidad. La movilidad ha sido el parámetro más utilizado para determinar la calidad del esperma de mamíferos y especies acuáticas. Aunque la evaluación de la movilidad espermática puede ser un método efectivo en esperma fresco, éste no es siempre efectivo para muestras de semen descongeladas ya que no siempre puede predecir la habilidad para fertilizar (Cieresko et al., 1999; Paniagua-Chávez, et. al., 2001). Existen otros parámetros que son importantes en la determinación de la calidad del semen como lo es la concentración espermática, la cual, Hidrobiológica 423 Conservación de los Recursos Genéticos Acuáticos en muchas ocasiones no se reporta o no se tiene control de esta (Cuevas-Uribe & Tiersch, 2011). Esto implica que el desconocer la concentración espermática podría afectar los resultados de la evaluación. Por lo que es imperante reconocer la importancia de la determinación de la concentración espermática y así llevar a cabo la homogenización y estandarización de métodos que darán por resultado, la obtención de información más precisa sobre la calidad espermática (Cuevas-Uribe & Tiersch, 2011). La viabilidad celular es otro parámetro que se utiliza regularmente tanto para gametos como para embriones. La determinación de la viabilidad espermática, puede facilitarse con el uso de sondas fluorescentes (Paniagua-Chávez, et al., 2001; Cabrita et al. 2011). Las sondas fluorescentes se emplearon inicialmente para verificar la viabilidad de espermatozoides de humanos y animales de granja tales como bovinos y ovejas, y en años recientes en varias especies de organismos acuáticos (Cabrita et al., 2011). En general, las pruebas usadas más comúnmente para determinar la viabilidad espermática son la evaluación de la integridad de la membrana citoplasmática y el potencial de la membrana mitocondrial (Daly & Tiersch, 2011). Para las especies acuáticas, la prueba de viabilidad espermática utilizando las sondas fluorescentes de SYBR14 y yoduro de propidio (YP) (Live-Dead Sperm Viability kit” ®; Molecular Probes, Eugene, OR) son las más usadas. Esta prueba consiste en una tinción dual donde las células con membranas intactas adquieren un color verde debido a que la sonda fluorescente de SYBR14 penetra la membrana y se intercala en la molécula del ADN. Las células dañadas adquieren una coloración roja debido a que la sonda de YP se intercala al ADN por exclusión competitiva con el SYBR14 (Thomas et al., 1997; 1998; Paniagua-Chávez, et al., 2001). En el caso de la evaluación del potencial de membrana mitocondrial, se utiliza rodamina 123 la cual, se acumula selectivamente en la mitocondria, dependiendo del potencial de la membrana. Por tanto, cambios en el potencial de membrana resultarán en cambios en la intensidad de la tinción (Petit, 1992). Otras sondas fluorescentes tales como Mito Tracker Red (Favret & Lynn, 2010) y JC-1 (Guthrie, et al., 2008) han sido también utilizadas para evaluar el potencial de membrana mitocondrial. La criopreservación de ovocitos, huevos o embriones de especies acuáticas ha sido extremadamente difícil (Hamaratoğlu et al. 2005; Hagedorn & Kleinhans, 2011). Sin embargo, se continúa con una investigación ardua debido a la importancia de la aplicación que tiene la criopreservación de este tipo de células (Hagedorn & Kleinhans, 2011). Uno de los primeros pasos es entender la fisiología compleja de estas células con respecto al proceso de criopreservación. Para esto, la evaluación de la calidad de los ovocitos y embriones antes y después de la criopreservación es un punto importante. Por ello, también las tinciones fluorescentes han sido utilizadas para evaluar el desempeño de estas células. El diacetato de fluoresceína (DAF) ha mostrado ser un buen inVol. 21 No. 3 • 2011 dicador de la integridad estructural en ovocitos y embriones de especies acuáticas (Paniagua-Chávez, et al., 2001). Esta sonda fluorescente, es capaz de penetrar la célula donde las esterasas hidrolizan el grupo diacetato y la fluoresceína libre se acumula dentro de la célula y emite una fluorescencia verde que indica que está intacta (Boender, 1984). Finalmente, la fertilización puede ser considerada también un parámetro integrativo de evaluación de calidad de gametos, principalmente en las especies que contiene esperma con acrosoma, como los moluscos, donde el esperma con buena movilidad pero con daño en el acrosoma, pueden conducir a tasas de fertilización muy pobres (Paniagua-Chávez et al., 2001). La evaluación de la calidad de gametos y embriones es extremadamente importante pero altamente problemática, por lo que es de gran importancia seguir trabajando en estos tópicos para validar los métodos y mejorar los protocolos de evaluación. En resumen, la respuesta de las células al proceso de criopreservación, está relacionada al tipo de célula (meiotica o mitótica) y a la fase de desarrollo celular, por ello los procedimientos de criopreservación implican necesariamente la mejora de técnicas especie-específicas (Woods et al., 2004; Pegg, 2007). A la fecha, los logros en la conservación de esperma en especies acuáticas han sido muy amplios en comparación con los de ovocitos o embriones, (McFadzen, 1995; Gwo, 2000; Pentfold & Watson, 2001; Dupré & Espinoza, 2004; Di Matteo et al., 2009). Como se dijo anteriormente, la complejidad celular de los ovocitos y embriones de las especies acuáticas es uno de los principales factores que no han permitido la criopreservación de estas células. De los trabajos sobresalientes en la criopreservación de ovocitos de especies acuáticas se pueden mencionar los realizados para el erizo (Evechinus chloroticus Valenciennes 1846) (Adams et al., 2003), la estrella de mar (Asterina miniata Brandt 1835) (Ha­ maratoğlu et al., 2005) y el ostión (Crassostrea gigas) (Tervit et al., 2005). Además, de los significativos avances realizados en el pez cebra Danio rerio (F. Hamilton 1822) (Seki et al., 2007a, b; Babin et al., 2008; Zhang et al., 2008; Tsai et al., 2009; Guan et al., 2010). Criopreservación de los recursos genéticos acuáticos de México En México, la conservación de RGA ha sido supeditada a los BG del SUBNARGENA que tienen como objetivos prioritarios ubicar, recolectar, conservar y caracterizar el germoplasma de organismos acuáticos que por sus características biológicas o de interés comercial sean considerados prioritarios para la nación. El almacenamiento de recursos génicos o germoplasma en el SUBNARGENA ofrece una oportunidad excelente para facilitar la eficiencia de los programas de reproducción de especies en cautiverio. Bajo dicho argumento, las granjas acuícolas serían las más beneficiadas ya que se facilitaría la producción de larvas de un mo- 424 do más simple, se reducen los costos porque no generan gastos para el mantenimiento de reproductores y con menos riesgo para los técnicos y laboratoristas. Por ejemplo, es más sencillo transportar esperma o embriones congelados de lugares distintos que a los reproductores, ya que estos son más susceptibles al estrés causado por el transporte y confinamiento. Además, economicamente es más rentable producir organismos libres de patógenos provenientes de germoplasma de reproductores que contengan una certificación sanitaria, que de aquel material o germoplasma de procedencia dudosa (Tiersch & Green, 2011). Otra ventaja es la posibilidad de almacenar germoplasma de reproductores con líneas genéticas de interés, tanto para los productores como para las instituciones de investigación (Tiersch et al., 2007; Cabrita et al., 2010). Dependiendo de los objetivos del programa de conservación, la tecnología reproductiva y la criopreservación son dos factores ligados fuertemente que pueden dar como resultado el éxito en la producción y comercialización del germoplasma almacenado (Cabrita et al., 2010; Denniston et al., 2011). En ganaderia, la criopreservación de esperma se ha transformado en una industria billonaria en el mundo, mientras que en especies acuáticas se encuentra en un estado de desarrollo temprano desde el punto de vista tecnológico y comercial (Tiersch et al., 2007). Aunque en los últimos años, ha habido un incremento en la investigación y generación de literatura relacionada con la criopreservación de organismos acuáticos (Tiersch & Green, 2011), incluso, se ha podido observar que los protocolos generados son variables en la misma especie o entre especies diferentes (Asturiano, 2009; Tiersch & Green 2011). Esto es debido a que en las especies acuáticas, la criobiología se mantiene como una ciencia dentro de un marco teórico rudimentario y la criopreservación, como una investigación de tipo empírico con experimentos de ensayo y error (Tiersch & Green, 2011). Aunado a esto, se tiene el interés de criopreservar material celular de diversas especies que, se caracterizan por tener más diferencias que similitudes entre sí (Tiersch & Green, 2011). Consecuentemente, los protocolos de criopreservación para especies acuáticas, se han confeccionado con especificidad para el tipo de organismo y el tipo de célula a criopreservar. De esta manera, en los diferentes pasos de un protocolo de criopreservación existen puntos importantes que requieren aún investigación y desarrollo de procedimientos para su aplicación posterior (Fig. 1). En el SUBNARGENA, se han diseñado protocolos para la conservación a corto plazo y para la criopreservación, de muestras de esperma, aunque también se tienen experiencias con ovocitos de ostión (Ramírez-Torrez, 2011). En este BG, también se realiza la caracterización genética de las muestras recolectadas y se evalúa la posible transferencia de patógenos. Los trabajos de investigación realizados han sido en colaboración con instituciones como son, la UABC, UNAM y UAM, en las que se han abordado tópicos relacionados con el desarrollo y optimización de Paniagua-Chávez C. G. et al. protocolos de conservación de gametos, entre los que se pueden listar la criopreservación de esperma de lenguado (Paralichthys californicus) (Parroquín-Hernández, 2009), abulón rojo (Haliotis rufescens) (Salinas-Flores, et al., 2005), totoaba (Totoaba mac­ donaldi) (información aún no publicada) y trucha de San Pedro Mártir (Oncorhynchus mykiss nelsoni). En esta última especie se ha realizado una extensa investigación relacionada a sus RG, en donde se evalúa la capacidad de esta trucha para ser mantenida en cautiverio (conservación ex situ in vivo) (Aguilar-Juárez et al., 2011), su conservación a corto y largo plazo, y la determinación de la calidad del esperma descongelado (Aguilar-Juárez, 2010). Además, los protocolos de criopreservación de otros organismos de importancia ecológica o de cultivo, como es el caso del bacalo negro (Anoplopoma fimbria Pallas 1814), la tilapia (Oreochromis niloticus Linnaeus 1758) y el camarón blanco (Litopenaeus vanna­ mei Boone 1931) están en proceso de investigación. En adición a lo anterior, los mecanismos relacionados al criodaño son de gran interés para el desarrollo y optimización de los protocolos de criopreservación de gametos. Por tanto, en el SUBNARGENA se ha desarrollado investigación para la determinación del criodaño en ovocitos de abulón rojo y ostión del pacífico (Ramírez-Torrez, 2011). Cabe mencionar, que una parte del material resguardado en el SUBNARGENA es transferido al CNRG para cumplir con los objetivos del SINARGEN. Finalmente, la agenda de trabajo del SUBNARGENA contempla una lista de especies que por sus características ecológicas o de cultivo son prioritarias para su conservación, entre las cuales destacan las especies de truchas mexicanas reconocidas hasta ahora (Hendrickson et al., 2002; Espinosa et al., 2007) y los organismos de importancia comercial como peces, moluscos y crustáceos. Conclusiones A la fecha, la creación de bancos de germoplasma de especies acuáticas ha sido motivada principalmente por tratar de conservar especies de importancia económica y para la alimentación. Además de que estos bancos pueden ser una herramienta importante para mejorar los programas de reproducción de organismos acuáticos. De esta manera, en la última década el crecimiento en los tópicos relacionados a la criopreservación de los RGA ha aumentado dramáticamente (Cabrita et al., 2009; Tiersch & Green, 2011); por ello, se debe hacer mucho para resolver los problemas relacionados al desarrollo y estandarización de los protocolos de criopreservación, por ejemplo, la estandarización de los protocolos de congelación que permitan alcanzar tasas de fertilización cercanas a las obtenidas con semen fresco y la evaluación de sustancias crioprotectoras que disminuyan los efectos tóxicos y de criodaño sobre la célula (Medina-Robles et al., 2005). Incluso, la falta de tecnología apropiada para el desarrollo de los mismos y la verificación de la calidad de las muestras criopreservadas, son factores relevantes a considerar. Al realizar una revisión soHidrobiológica 425 Conservación de los Recursos Genéticos Acuáticos bre las colecciones de germoplasma de especies acuáticas en el mundo, podemos encontrar, que a la fecha, estas colecciones son pocas, comparadas con las colecciones del sector pecuario, diseminadas en organizaciones privadas o gubernamentales e instituciones de educación, con terminología y técnicas no estandarizadas y sin un organismo privado o gubernamental de apoyo. Sin embargo, se espera que este estado cambie en la próxima década y que los BRG evolucionen, tal y como lo han hecho los sectores pecuario y agrícola. No cabe duda del gran beneficio que tienen los BRG como apoyo a la protección de la biodiversidad, sobre todo para aquellas especies consideradas amenazadas o en proceso de extinción. Aunque tiene que ser dirigido gran esfuerzo a la conservación del hábitat, la criopreservación del germoplasma es una herramienta de apoyo importante en estos programas de conservación. La técnica de criopreservación y los BG ofrecen las ventajas de disponer de un material genético durante largos periodos sin afectar su viabilidad, aseguran la continua disponibilidad de las diferentes variedades del material genético, facilitan la transportación de éstos recursos y disminuyen los riesgos de introducción de enfermedades. Las granjas de cultivo también podrían verse beneficiadas por medio de la optimización del manejo de reproductores, obtención de líneas y mejoramiento genético; además de tener la posibilidad de disminuir el mantenimiento de organismos en las granjas, entre otros beneficios. De igual manera, la investigación básica y aplicada se verían favorecidas. Además, la posibilidad de congelar los RG, abre las perspectivas para el intercambio comercial entre países aumentando la disponibilidad de nuevos mercados internacionales (Roa et al., 1998). Comparando a la industria pecuaria, la cual es una actividad multimillonaria que ha crecido desde la primera vez que se obtuvo esperma criopreservado hace más de 50 años atrás, con el trabajo que se ha realizado en las especies acuáticas, encontramos, que a la fecha, la criopreservación del germoplasma de especies acuáticas se encuentra esencialmente como una actividad de investigación con una aplicación comercial escasa. Por tanto, la creación del SUBNARGENA junto con el plan de trabajo desarrollado para salvaguardar los RGA de México, representa una gran oportunidad para seguir avanzando en los programas de conservación a nivel nacional y mundial tratando de atender todas aquellas preguntas o problemas relacionados a mejorar las técnicas de conservación. Así mismo, se espera gran impacto en los diferentes sectores que ayuden a fortalecer las diferentes acciones del plan de desarrollo del país en materia de conservación de recursos genéticos. AGRADECIMIENTOS Este trabajo fue realizado con la iniciativa y fondos de SAGARPA, Dirección General de Vinculación y Desarrollo Tecnológico e INAPESCA. Agradecemos a G. Tinoco por la asistencia técnica. Vol. 21 No. 3 • 2011 REFERENCIAS Adams, S. L., P. Hessian & P. V. Mladenov. 2003. Flow cytometric evaluation of mitochondrial function and membrane integrity of marine invertebrate sperm. Invertebrate Reproduction and Development 44 (1): 45-51. Aguilar-Juárez, M. 2010. Inducción a la maduración y conservación del esperma de la trucha de San Pedro Mártir Oncorhynchus mykiss nelsoni (EVERMANN). Tesis de Doctorado en Ciencias (Ecología Molecular y Biotecnología), Facultad de Ciencia Marinas, UABC, México. 253 p. Aguilar-Juárez, M., G. Ruiz-Campos & C. Paniagua-Chávez. 2011. Sexual maturation and milt quality of the San Pedro Mártir trout using and artificial photoperiod. North American Journal of Aquaculture 73: 279-284. Asturiano, J. 2009. Different protocols for the cryopreservation of european eel (Anguilla Anguilla) sperm. In: Cabrita E., V. Robles & P. Herráez. (Eds). Methods in Reproductive Aquaculture. Marine and Freshwater Species. CRC Press Taylor & Francis group, pp. 415-420. Babin, P. J., M. André, J. Forgue, A. Knoll-Gellida, D.M. Rawson & T. Zhang. 2008. Development of oocyte viability molecular signature (OVMS) assays for zebrafish (Danio rerio) oocyte cryopreservation studies. Cybium 32 (2): 217. Baumung, R., H. Simianer & I. Hoffmann. 2004. Genetic diversity studies in farm animals - a survey. Journal of Animal Breeding Genetics 121 (6): 361-373. Benítez-Díaz, H. & M. Bellot-Rojas. 2003. Biodiversidad: Uso, amenazas y conservación. In: Sánchez, O., E. Vega., E. Peters & O. MonroyVilchis (Eds.). Conservación de Ecosistemas Templados de Montaña en México. Instituto Nacional de Ecología (INE-SEMARNAT). INE, México, pp. 93-106. Bilton, R. J. & N. W. Moore. 1976. In vitro culture, storage, and transfer of goat embryos. Austrian Journal of Biological Science 29 (1-2): 125129. Blackburn, H. D. 2011. The USDA National Animal Germplasm Program and the Aquatic Species Collection. In: Tiersch, T. R. & C. C. Green (Eds.). Cryopreservation in aquatic species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society, pp. 774-779. Bobe, J. & C. Labbe. 2009. Chilled storage of sperm and eggs. In: Cabrita, E., V. Robles & P. Herráez (Eds.). Methods in Reproductive Aquacul­ ture, Marine and Freshwater Species. Section IV. Chapter 6. Sperm and egg Cryopreservation. CRC Press, Taylor & Francis Group, pp. 219-235. Boender, J. 1984. Fluorescein diacetate, a fluorescent dye compound stain for rapid evaluation of the viability of mammalian oocytes prior to in vitro studies. The Veterinary Quartery 6 (4): 236-240. Bromage, N. R. & R. J. Roberts (Eds.). 2001. Broodstock management and egg and larval quality. Blackwell Science, Malden. 424 p. 426 Browne, G. G. & C. R. Figiel. 2011. Amphibian Conservation and Cryopreservation of Sperm, Cells, and Tissues. In: Tiersch, T.R. & C.C. Green (Eds.). Cryopreservation in Aquatic Species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 345-365. Cabrera, P., A. Fernández, P. Bastidas, M. Molina, A. Bethencourt & T. Díaz. 2006. Vitrificación: Una alternativa para la criopreservación de embriones. Revista de la Facultad de Ciencias Veterinarias 47 (1): 9-23. Cabrita, E., V. Robles & P. Herráez. 2009. Sperm quality assessment. In: Cabrita E., V. Robles & P. Herráez. (Eds). Methods in Reproductive Aquaculture. Marine and Freshwater Species. CRC Press Taylor & Francis group. pp. 93-147. Cabrita, E., V. Robles, C. Sarasquete & P. Herraez. 2011. New insight on sperm quality evaluation for broodstock improvement. In: Tiersch, T.R. & C.C. Green (Eds.). Cryopreservation in Aquatic Species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 146-161. Cabrita, E., C. Sarasquete, S. Martínez-Páramo, V. Robles, J. Beirão, S. Pérez-Cerezales & M. P. Herraez. 2010. Cryopreservation of fish sperm: applications and perspectives. Journal of Applied Ichthyology 26 (5): 623-635. Campos-Chillón, L. F., T. K. Suh, M. Barcelo-Fimbres, G. E. Jr. Seidel & E. M. Carnevale. 2009. Vitrification of early-stage bovine and equine embryos. Theriogenology 71 (2): 349-354. Carolsfeld, J., H. P. Godinho, E. Zaniboni Filho & B. J. Harvey. 2003. Cryo­ preservation of sperm in Brazilian migratory fish conservation. Jour­ nal of Fish Biology 63 (2): 472-489. Chao, N. H. & I. C. Liao. 2001. Cryopreservation of Finfish and Shellfish Gametes and Embryos. Aquaculture 197 (1-4): 161-189. Chen, S. L. & Y. S. Tian. 2005. Cryopreservation of flounder (Paralichthys oli­ vaceus) embryos by vitrification. Theriogenology 63 (4): 1207-1219. Ciereszko, A., K. Dabrowski, F. Lin, S. A. Christ & G. P. Toth. 1999. Effect of extenders and time of storage before freezing on motility and fertilization of cryopreserved muskellunge spermatozoa. Progressive Fisheries Culturist American Fisheries Society 128 (3): 542-548. Paniagua-Chávez C. G. et al. Day, J. G. & D. N. Stacey. 2007. Methods in molecular biology. Cryopre­ servation and freeze-drying protocols. Human Press Inc., Totowa, New Jersey. 347 p. Denniston, R. S., S. Michelet, K. R. Bondioli & R. A. Godke. 2011. Principles of Embryo Cryopreservation. III. Basics of Cryopreservation. In: Tiersch, T.R. & C.C. Green (Eds.). Cryopreservation in Aquatic Spe­ cies. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 274-290. Di Matteo, O., A. L. Langelloti, P. Masullo & G. Sansone. 2009. Cryopreservation of Mediterranean mussel (Mytilus galloprovincialis) spermatozoa. Cryobiology 58 (2): 145-150. Domestic Animal Diversity Information System (DAD-IS). 2011. Disponible en línea en: http://www.dad.fao.org/ (consultado el 5 junio 2011). Dupré, E. & C. Espinoza. 2004. Congelamiento de espermatozoides del ostión del norte Argopecten purpuratus mediante congelador mecánico. Investigaciones Marinas 32 (2): 3-9. Dupré, E. & R. Joo. 2006. Viabilidad de espermatozoides criopreservados de macha Mesodesma donacium (Mollusca Bivalvia). Investigacio­ nes Marinas 34 (2): 187-190. Dupré, E. &. A. Guerrero. 2011. Cryopreservation of macha surf-clam spermatozoa. In: Tiersch, T. R. & C. C. Green (Eds.). Cryopreservation in aquatic species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 574-580. Espinosa, H., F. J. García de León, G. Ruiz C., A. Varela, I. Barriga, J. L. Arredondo, D. Hendrickson, F. Camarena, A. B. de los Santos & Grupo Truchas Mexicanas. 2007. Las truchas mexicanas, peces enigmáticos del Noroeste. Revista sobre Conservación y Biodiversidad 16 (1): 814. Fahy, G., D. M. Farlene, C. Angell & H. Meryman. 1984. Vitrification as an approach to cryopreservation. Cryobiology 21: 407-426. Favret, K. & J. Lynn. 2010. Flow-cytometric analyses of viability biomarkers in pesticide-exposed sperm of three aquatic invertebrates. Archives of environmental contamination and toxicology 58 (4): 973-984. CONABIO-SEMARNAT. 2009. Cuarto Informe Nacional de México al Convenio sobre Diversidad Biológica (CDB). Comisión Nacional para el Conocimiento y Uso de la Biodiversidad y Secretaría de Medio Ambiente y Recursos Naturales. México D.F. 190 p. Disponible en línea en: http://www.conabio.gob.mx/institucion/cooperacion_internacional/doctos/4oInforme_CONABIO.pdf Greer, D. & B. Harvey. 2004. Blue Genes: Sharing and conserving the World´s aquatic Biodiversity. Earthscan, London, United Kingdom. 223 p. Cuevas-Uribe, R. & T. R. Tiersch. 2011. Estimation of fish sperm concentration by use of spectrophotometry: In: Tiersch, T.R. & C.C. Green (Eds.). Cryopreservation in Aquatic Species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 162-200. Guthrie, H. D., L. C. Woods, J. A. Long & G. R. Welch. 2008. Effects of osmolality on inner mitochondrial transmembrane potential and ATP content in spermatozoa recovered from the testes of striped bass (Morone saxatilis). Theriogenology 69 (8): 1007-1012. Daly, J. & T. R. Tiersch. 2011. Flowcytometry for the assessment of sperm quality in aquatic species. In: Tiersch, T.R. & C.C. Green (Eds.). Cr­ yopreservation in Aquatic Species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 201-207. Gwo, J. C. 2000. Cryopreservation of Sperm of Some Marine Fishes. In: Tiersch T.R. & P.M. Mazik (Eds.). Cryopreservation in Aquatic Spe­ cies. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 138-160. Guan, M., D. M. Rawson & T. Zhang. 2010. Cryopreservation of zebrafish (Danio rerio) oocytes by vitrification. CryoLetters 31 (3): 230-238. Hidrobiológica Conservación de los Recursos Genéticos Acuáticos Hagedorn, M. & F. W. Kleinhans. 2011. Problems and prospects in cryopreservation of fish embryos. In: Tiersch, T.R. & C.C. Green (Eds.). Cryopreservation in Aquatic Species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 483-502. Hamaratoğlu, F., A. Eroğlu, M. Toner & K. C. Sadler. 2005. Cryopreservation of starfish oocytes. Cryobiology 50 (1): 38-47. Hendrickson, D. A., H. Pérez-Espinosa, L. T. Findley, W. Forbes, J. R. Tomelleri, R. L. Mayden, J. L. Nielsen, B. Jensen, G. Ruiz-Campos, A. VarelaRomero, A. Van der Heiden, F. Camarena & F. J. García de León. 2002. Mexican native trouts: a review of their history and current systematic and conservation status. Reviews in Fish Biology and Fisheries 12 (2): 273-316. Harvey, B. 2011. The application of cryopreservation in fish genetic conservation in North and South America. In: Tiersch T.R. & C.C. Green (Eds.). Cryopreservation in Aquatic Species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 783-788. Hiemstra, S. J., T. Van der Lende & H. Woelders. 2005. The potential of cryopreservation and reproductive technologies for Animal Genetic Resources Conservation Strategies. In: The role of biotechnology for the characterization and conservation of crop, forestry, animal and fishery genetic resources: International workshop, 5-7 March 2005, Turin, Italy. pp. 25-35. Hoffmann, I., P. Ajmone Marsan, J. S. F. Barker, E. G. Cothran, O. Hanotte, J. A. Lenstra, D. Milan, D. S. Weigend, & H. Simianer. 2004. New MoDAD marker sets to be used in diversity studies for the major farm animal species: recommendations of a joint ISAG/FAO working group. Proceedings of the 29th International Conference on Animal Genetics. Tokyo, Japan, September 11-16; 123. (abstract). Holt, W. V. 2001. Aims of genetic resource bank progemmes. Chapter 2: Genetic Resource Banking and Maintaining Biodiversity. In: Watson, P.F. & W.V. Holt. (Eds.). Cryobanking the genetic resources: Wildlife conservation for the future? Taylor & Francis Inc. pp. 15-17. Hopkins, B. K. & C. Herr. 2008. Cryopreservation of frog (Rana pipiens) sperm collected by non-lethal methods. Reproduction, Fertility and Development 20 (1): 120. Internationational Crops research Institute for the semi-arid tropics (ICRISAT). 2008. Innovations for a changing. Annual Report 2008. Svalbard, Noruega; pp. 1-60. Isachenko, K. V., & E. Isachenko. 2007. Vitrification in small quenched volumes with a minimal amount of, or without vitrificants: basic biophysics and thermodynamics. In: Tucker, M.J. & J. Liebermann (Eds.). Vitrification in assisted reproduction. A user´s manual and Troubles­ hooting guide. United Kingdom. Informa Healthcare. pp. 21-32. Jain, J. K. & R. J. Paulson. 2006. Oocyte Cryopreservation. Fertility and Sterility 86 (3): 1037-1046. Lahnsteiner, F. 2000. Cryopreservation Protocols for Sperm of Salmonid Fishes. In: Tiersch T.R. & P.M. Mazik (Eds.). Cryopreservation in Aquatic Species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 91-100. Vol. 21 No. 3 • 2011 427 Leibo, S. P. 2008. Cryopreservation of oocytes and embryos: Optimization by theoretical versus empirical analysis. Theriogenology 69 (1): 3747. León, C., I. Espejel, L. C. P. Bravo, J. L. Férman, B. Graizbord, L. J. Sobrino & J. Sosa. 2004. El Ordenamiento Ecológico Territorial como un instrumento de política pública para impulsar el desarrollo sustentable, caso en el Noreste de México. In: Rivera-Arriaga E., G.J. Villalobos, I. Azuz-Adeath & F.R. May (Eds.). El Manejo Costero en México. Universidad Autónoma de Campeche, SEMARNAT, CETYS-Universidad de Quintana Roo. pp. 1-12. Leslie, S. B., E. Israeli, B. Lighthart, J. H. Crowe & L. M. Crowe. 1995. Trehalose and sucrose protect both membranes and proteins in intact bacteria during drying. Applied and Environmental Microbiology 61 (10): 3592-3597. Li, J., L. Qinghua & S. Zhang. 2006. Evaluation of the damage in fish spermatozoa cryopreservation. Chinese Journal of Oceanology and Lim­ nology. 24 (4): 370-377. López-Béjar, M. B. & F. López-Gatius. 2000. In vitro and in vivo survival of vitrified rabbit embryos. Theriogenology 53: 259. Mace, G., L. Boitani, E. Fleishman & A. D. Thornhill. 2009. Biodiversity. In: Hassan R., R. Scholes & N. Ash. (Eds.). Ecosystems and Human WellBeing: Current State and Trends: Biodiversity Volume 1. Findings of the condition and trends working group of the Millennium ecosystem assessment, Island Press. pp. 77-122. Manno, F. A. 3rd. 2010. Cryopreservation of mouse embryos by vitrification: a meta-analysis. Theriogenology 74 (2): 165-172. May, R. M. 1992: How many species inhabit the earth? Scientific Ame­ rican 267 (4): 42-48. Mazur, P. & S. Seki. 2011. Survival of mouse oocytes after being cooled in a vitrification solution to -196° C at 95° C to 70,000° C/min and warmed at 610° C to 118,000° C/min: A new paradigm for cryopreservation. Cryobiology 62 (1): 1-7. McFadzen, I. R. B. 1995. Cryopreservation of the sperm of the pacific oyster Crassostrea gigas. In: Day, J.G. & M.R. McLellan. (Eds.). Cryopre­ servation and Freeze-Drying Protocols. Human Press, Totowa. pp. 145-149. Medina-Robles, V. M., Y. M. Velasco-Santamaría & P. E. Cruz-Casallas. 2005. Aspectos generales de la criopreservación espermática en peces teleósteos. Revista Colombiana de Ciencias Pecuarias 18 (1): 34-48. Mims, S. D., L. I. Tsvetkova, W. R. Wayman, Á. Horváth, B. Urbányi & B. Golmesky. 2011. Cryopreservation of sturgeon and paddlefish sperm. In: Tiersch, T.R. & C.C. Green (Eds.). Cryopreservation in aquatic species. 2nd ed. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 366-380. Mittermeier, R., C. Goettsch & P. Robles Gil. 1997. Megadiversidad. Los paí­ ses biológicamente más ricos del Mundo. CEMEX, México. 501 p. 428 Morisawa, M. & K. Suzuki. 1980. Osmolality and potassium ion: their role in initiation of sperm motility. Science 210 (4474): 1145-1147. Muchlisin, Z. A. 2005. Review: current status of extenders and cryoprotectants on fish spermatozoa cryopreservation. Biodiversitas 6 (1): 12-15. Mukaida, T., K. Takahashi & M. Kasai. 2003. Blastocyst cryopreservation: ultrarapid vitrification using cryoloop technique. Reproductive Bio­ medicine Online 6 (2): 221-225. National Bureau of Fish Genetic Resources (NBFGR). 2007. Perspective Plan. Vision 2025. Indian Council of Agricultural Research: 1-20. National Bureau of Fish Genetic Resources (NBFGR). 2010. Annual report 2009-2010. Indian Council of Agricultural Research. 1-123. Organización de las Naciones Unidas (ONU). 1992. Convenio sobre la Diversidad Biológica. Río de Janeiro, Republica Federativa de Brasil, disponible en línea: http://www.cbd.int/convention/ (consultado el 19 de septiembre 2011). Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO). 2007. State of art in the management of animal genetic resource. Method for conservation In: Commission on Genetic Resources for Food and Agriculture Food & Agriculture Organization on the United Nations (Eds.). The State of the world’s Animal Genetic Resources for food and Agriculture. Rome Italy. pp. 443-475. Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO). 2010a. Servicio de Estadísticas y Información del Departa­ mento de Pesca y Acuicultura. FAO anuario. Estadísticas de pesca y acuicultura. 2008. Roma. 72 p. Paniagua-Chávez C. G. et al. Pentfold, L. M. & P. F. Watson. 2001. The cryopreservation of gametes and embryos of cattle, sheep, goats and pigs. In: Watson, P. F. & W. V. Holt (Eds.). Cryobanking the genetic resources, wildlife conserva­ tion for the future? Taylor and Francis, New York. pp. 279-316. Petit, P. X. 1992. Flow cytometric analysis of rhodamine 123 fluorescence during modulation of the membrane potential in plant mitochondria. Plant physiology 98 (1): 279-286. Primmer, C. 2006. Genetic characterization of populations and its use in conservation decision-making in fish. In: Ruane J. & A. Sonnino (Eds.). The role of biotechnology in exploring and protecting agricul­ tural genetic resources. Rome, Italy. FAO. pp. 97-104. Rall, W. F. & C. Polge. 1984. Effect of warming rate on mouse embryos frozen and thawed in glycerol. Journal of Reproduction and Fertility 70 (1): 292-293. Ramírez-Tórrez, J. A. 2011. Actividad de la MAPK, organización del huso mitótico y condensación de los cromosomas en ovocitos de moluscos después de la criopreservación. Tesis de Maestría (Acuicultura), CICESE, México. 68 p. Rana, K. J. 1995. Preservation of gametes. In: Bromage, N. & R. Roberts. (Eds.). Broodstock management of egg and larval quality. Blackwell Scientific Publications, Oxford. pp. 53-73. Roa, N. A., T. Linares & R. Tamasaukas. 1998. Métodos y aplicaciones de la criopreservación de oocitos y embriones en bovinos y otyros mamíferos. Una revisión. Revista Científica, FCV-LUZ 8 (1): 40-52. Ryman, N., F. Utter & l. Laikre. 1995. Protection of intraspecific biodiversity of exploited fishes. Reviews in Fish Biology and Fisheries 5: 417-446. Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO). 2010b. 6th Session of the intergovernmental technical working group on animal genetic resources for food and agriculture. Descriptive chart. Salinas-Flores, L. 2003. Criopreservación de esperma del abulón rojo Ha­ liotis rufescens. Tesis de Maestría (Acuicultura), CICESE, México. 111 p. Özkavukcu, S. & E. Erdemli. 2002. Cryopreservation: Basic knowledge and biophysical effects. Journal of Ankara Medical School 24 (4): 187196. Salinas-Flores, L., Paniagua-Chavez, C. G., J. Jenkins & T. R. Tiersch. 2005. Cryopreservation of sperm of red abalone Haliotis rufescens. Shell­ fish Research. 24 (2): 415-420. Paniagua-Chavez, C. G., & T. R. Tiersch. 2001. Laboratory studies of cryopreservation of sperm and trochophore larvae of the eastern oyster. Cryobiology 43 (3): 211-223. Sánchez, O. 2007. Ecosistemas acuáticos: diversidad, procesos, problemática y conservación. In: Sánchez, O., M. Herzig, E.P. Recagno, R. Márquez-Huitzil & L. Zambrano (Eds). Perspectivas sobre la conser­ vación de ecosistemas en México. Mexico. pp. 11-34. Parroquín Hernández, G. 2009. Conservación a corto plazo y criopreservación de esperma de lenguado de California Paralichthys californi­ cus. Tesis de Maestría (Ciencias), Ciencias Biológicas y de la Salud, UAM, Xochimilco, México. 36 p. Paynter, S. J. & B. J. Fuller. 2007. Cryopreservation of mammalian oocytes. In: Day, J. G. & G. N. Stacey. (Eds.). Methods in molecular Biology. Human Press, New Jersey. pp. 313-323. Pegg, D. E. 2007. Principles of Cryopreservation. In: Day, J.G & G.N. Stacey (Eds.). Cryopreservation and Freeze-Drying Protocols, Methods in Molecular Biology ™ 368. Human Press, New Jersey. pp. 39-57. Sargent, M. G. & T. J. Mohun. 2005. Cryopreservation of sperm of Xenopus laevis and Xenopus tropicalis. Genesis 41 (1): 41-46. Scott, A. P. & M. Baynes. 1980. A review of the biology, handling and storage of salmonid spermatozoa. Journal of Fish Biology 17: 707-739. Seki, S., T. Kouya, T. Hara, D.M. Valdez, B. Jin, M. Kasai & K. Edashige. 2007a. Exogenous expression of rat aquaporin-3 enhances permeability to water and cryoprotectans of immature oocytes in the zebrafish (Danio rerio). Journal of Reproduction and Development 53 (3): 597-604. Hidrobiológica 429 Conservación de los Recursos Genéticos Acuáticos Seki, S., T. Kouya, D. M. Valdez Jr., B. Jin, N. Saida, M. Kasai & K. Edashige. 2007b. The permeability to water and cryoprotectants of immature and mature oocytes in the zebrafish (Danio rerio). Cryobiology 54 (1): 121-124. Stacey, D. N. & Day, J. G. 2007. Long-term ex situ conservation of biological resources and the role of biological resources centers. In: Day, J.G. & G.N. Stacey (Eds.). Cryopreservation and Freeze-Drying Protocols. Human Press. pp. 1-14. Takeda, T., R. P. Elsden & E. L. Squires. 1984. In vitro and in vivo deve­ lopment of frozen-thawed equine embryos. Proceedings of the 10th International Congress on Animal Reproduction and Artificial Insemination. University of Illinois. Urbana 2: 1-246. Taylor, M. J., Y. C. Song & K. G. M. Brockbank. 2004. Vitrification in tissue preservation: new developments. In: Fuller B.J., N. Lane & E.E. Benson (Eds.). Life in the frozen state. Boca Raton, Florida. U. S. A CRC Press. pp. 603-641. Tervit, H. R., S. L. Adams, R.. Roberts, L. T. McGowan, P. A. Pugh, J. F. Smith & A. R. Janke. 2005. Successful cryopreservation of Pacific oyster (Crassostrea gigas) oocytes. Cryobiology 51 (2): 142-151. Thomas, J. M., D. L. Garner, J. M. DeJarnette & C. E. Marshal. 1997. Fluorometric assessments of acrosomal integrity and viability in cryopreserved bovine spermatozoa. Biology of Reproduction 56 (4): 991-998. Tsai, S., M. Rawson & T. Zhang. 2009. Studies on chilling sensitivity of early stage zebrafish (Danio rerio) ovarian follicles. Cryobiology 58 (3): 279-286. Unión Internacional para la Conservación de la Naturaleza (UICN). 2009. UICN Red list of threatened species. Version 2009.1. Disponible en línea: http://www.iucn.org/es/ (consultado en marzo de 2011). Vajta, G., P. Holm, M. Kuwayama, P. J. Booth, H. Jacobsen, T. Greve & H. Callensen. 1998. Open pulled straw (OPS) vitrification: a new way to reduce cryoinjuries of bovine ova and embryos. Molecular Repro­ duction and Development 51 (1): 53-58. Wayman, W. R. & T. R. Tiersch. 2001. Research methods for cryopreservation of sperm. In: Tiersch, T.R. & P.M. Mazik (Eds.). Cryopreservation in aquatic species. Baton Rouge, Louisiana, U. S. A. World Aquaculture Society. pp. 264-275. Willadsen, S. M., C. Polge, L. E. A. Rowson & R. M. Moor. 1976. Deep freezing of sheep embryos. Journal of Reproduction and Fertility 46 (1): 151-154. Wilmut, I. & L. E. A. Rowson. 1973. Experiments in the low temperature preservation of cow embryos. Veterinary Record 92 (26): 686-690. Woods, E. J., J. B. Benson, Y. Agca & J. K. Critser. 2004. Fundamental cryobiology of reproductive cells and tissues. Cryobiology 48 (2): 146156. Thomas, J. M., D. L. Garner, J. M. DeJarnette & C. E. Marshal. 1998. Effect of cryopreservation of bovine sperm organelle function and viability as determined by flow cytometry. Biology of Reproduction 58 (3): 786-793. Yamamoto, Y., N. Oguri, Y. Tsutsumi & Y. Hachimohe. 1982. Experiments in the freezing and storage of equine embryos. Journal of Reproduc­ tion and Fertility 32 (supplement): 399-403. Tiersch, T. R., & C. C. Green (Eds.). 2011. Cryopreservation in Aquatic Spe­ cies, 2nd ed. World Aquaculture Society. Baton Rouge, Louisiana. U.S.A. 423 p. Zhang, T., D. M. Rawson, L. Tosti & O. Carnevali. 2008. Cathepsin activities and membrane integrity of zebrafish (Danio rerio) oocytes after freezing to -196° C using controlled slow cooling. Cryobiology 56 (2): 138-143. Tiersch, T. R., H. Yang, J. A. Jenkins & Q. Dong. 2007. Sperm cryopreservation in fish and shellfish. In: Roldan, E.R.S. & M. Gomendio (Eds.). Spermatology. Society of Reproduction and Fertility, Nottingham, UK Universal Press, 65 (Supplement): 493-508. Recibido: 02 de junio de 2011. Vol. 21 No. 3 • 2011 Aceptado: 31 de octubre de 2011.