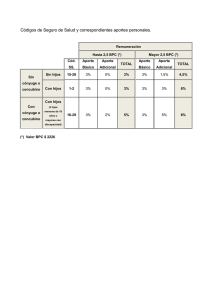
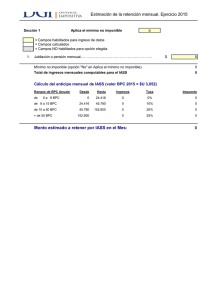
Renovación BPC
Anuncio

DRA MARIA LILIANA GUTIERREZ MD • • • • Medica U. Javeriana Especialista Bioética . U. El Bosque Aspirante Titulo Magister en Bioética Miembro Grupo Buenas Practica Clínica INVIMA PLAN DIRECTRICES PARA LA RENOVACIÓN EN BUENAS PRÁCTICAS CLÍNICAS DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLOGICOS 2015 Objetivos Dar a conocer las estadísticas del grupo de BPC Dar a conocer los diferentes aspectos a evaluar durante la auditoria de certificación o renovación en Buenas Prácticas Clínicas (BPC). Antecedentes El Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA es un establecimiento público de orden nacional adscrito al Ministerio de Salud y protección social, creado con la expedición de Ley 100 de 1993. El INVIMA es institución de referencia en materia sanitaria encargada de ejecutar las políticas en materia de vigilancia sanitaria de medicamentos, productos biológicos, alimentos, bebidas, cosméticos, dispositivos y elementos medico quirúrgicos, odontológicos, productos naturales, homeopáticos, reactivos de diagnóstico y otras que puedan tener impacto en la salud colectivo. Antecedentes Resolución 2378 de 2008 • Artículo 3 :“El Instituto Nacional de Vigilancia de Medicamentos y Alimentos Invima deberá verificar que las instituciones que desarrollen investigaciones en seres humanos con medicamentos, cumplan con las Buenas Prácticas Clínicas que se adoptan a través de la presente resolución, en desarrollo de lo cual, deberá expedir un certificado” Centros de Investigación Departamento Número DEPARTAMENTO NUMERO ANTIOQUIA 24 ATLANTICO 16 BOLIVAR 2 CALDAS 2 CASANARE 2 CORDOBA 1 CUNDINAMARCA 46 META 2 NARIÑO 2 Antioquia 16 Atlántico 4 Bogotá D.C. 28 Bolívar 2 Caldas 2 Córdoba 1 QUINDIO 5 Cundinamarca 1 RISARALDA 3 Nariño 1 SANTANDER 8 TOLIMA 1 Risaralda 1 VALLE DEL CAUCA 11 Santander 8 TOTAL 125 Tolima 1 Valle del Cauca 8 TOTAL 73 IPS CERTIFICADAS CEI Comités de Ética Solicitudes BPC conceptos NO no; 87 SI si; 125 0 20 40 60 Fuente: Bases de datos BPC 2008/2015 80 100 120 140 Solicitudes BPC negadas 4% desistidas 38% certificadas 58% negadas desistidas Fuente: Bases de datos BPC 2008/2015 certificadas Certificaciones BPC 2011 2012 2013 AÑO Fuente: Bases de datos BPC 2008/2015 4 2010 4 2 8 28 81 INSTITUCIONES CERTIFICADAS EN BUENAS PRACTICAS CLINICAS DEL AÑO 2010 AL 2015 2014 2015 Certificaciones 2010/2011 18 12 9 8 9 8 7 5 4 2 dic-10 1 marzo abril mayo junio julio Fuente: Bases de datos BPC 2008/2015 agosto septiembre octubre noviembre diciembre Control Nacional de la investigación clínica (INVIMA) TOTAL DE ESTUDIOS CLÍNICOS EVALUADOS AÑOS 2008-2015 PROTOCOLOS Estudios Registrados Fase I Fase II Fase III Fase IV Total Activo 3 118 313 7 441 No activo 2 247 211 1 461 Total 5 365 524 8 902 Fuente: Registro de Ensayos Clínicos Grupo Programas Especiales / Ensayos Clínicos INVIMA PROTOCOLOS DE INVESTIGACION ACTIVOS AL 30 DE SEPTIEMBRE 2015 78 90 81 74 80 80 70 60 50 40 30 20 10 28 24 18 8 0 1 2008 2009 2010 2011 Fuente: Bases de datos BPC 2008/2015 2012 2013 2014 2015 TOTAL DE PROTOCOLOS DE INVESTIGACION SOMETIDOS PARA EVALUACION AL INVIMA ENTRE LOS AÑOS 2013 AL 30 DE SEPTIEMBRE DE 2015 88 83 90 80 69 68 70 60 50 40 38 28 30 20 10 0 2015 TOTAL 2014 DESISTIDOS EVALUACION Fuente: Bases de datos BPC 2008/2015 DECLARACION ABANDONO 2013 APROBADOS NEGADOS Control Nacional de la investigación clínica (INVIMA) PROTOCOLOS ACTIVOS A FEB 2015 400 313 300 200 100 118 3 0 7 Fase I Fase II Fuente: Bases de datos BPC 2008/2015 Fase III Fase IV ORIGEN DE LAS MÓLECULAS EN INVESTIGACIÓN 2015 Control Nacional de la investigación clínica (INVIMA) Síntesis Química Biológicos Porcentaje Vacunas 5,4 58,7 35,87 Tipo de Molecula Fuente: Registro de Ensayos Clínicos Grupo Programas Especiales / Ensayos Clínicos INVIMA Proceso de Renovación Resolución 2378 de 2008 • Las actividades a realizar durante la auditoria de certificación o renovación en Buenas Prácticas Clínicas cumplen los lineamientos establecidos en el Anexo Técnico de la Resolución No 2378 del 27 de Junio de 2008 “Por la cual se adoptan las Buenas Prácticas Clínicas para las instituciones que conducen investigación con medicamentos en seres humanos” Componentes Comité de Ética en Investigación. Equipo Investigador. Servicio Farmacéutico Laboratorio Clínico. Sistema de Gestión de Calidad Responsabilidades del Patrocinador Guía para los comités de ética COMITÉ DE ÉTICA Resolución 1403 de 2007 Decreto 2200 de 2005 LABORATORIO CLÍNICO CENTRO DE INVESTIGACIÓN SERVICIO FARMACÉUTICO EQUIPO INVESTIGADOR Resolución 2011020764 de 2011 Resolución 1995 de 1999 Resolución 2003 de 2014 Guía para la selección del investigador RESOLUCIÓN 8430 DE 1993 RESOLUCIÓN 2378 DE 2008 COMITÉ DE ÉTICA EN INVESTIGACIÓN multidisciplinario independiente Seguimiento antes, durante y al cierre de los protocolos Procedimientos Responsabilidades Compromiso/ Tiempo Comité de ética - Acta de creación, conformación y/o resolución de constitución del Comité de Ética en Investigación. - Listado de miembros y listado de consultores externos (si aplica) - Manual operativo del Comité de Ética en Investigación que contemple entre otras cosas responsabilidades, declaración de conflictos de interés y política de confidencialidad, financiamiento, adherencia a la normatividad nacional y lineamientos internacionales. Comité de ética - Procedimientos - Cronograma de reuniones ordinarias - Procedimiento de Manejo de la documentación y de archivo - Cronograma de capacitaciones a los integrantes del Comité de Ética en Investigación. Certificaciones y/o evidencia de dichas capacitaciones Equipo investigador Experiencia en investigación Experiencia asistencial Certificado en BPC Tiempo Responsabilidad Confidencialidad y conflicto de interés Consentimiento informado Eventos adversos Equipo Investigador - Manual de Funciones - Manual operativo del centro de investigación en el que se contemplen todas las actividades relacionadas con el desarrollo de estudios clínicos con medicamentos. - Archivo - Hoja de vida de cada uno de los integrantes del equipo investigador con los respectivos soportes de formación académica y certificado de capacitación en Buenas Prácticas Clínicas. Laboratorio clínico Verificación de las condiciones para toma de muestras Consentimiento informado Confidencialidad Profesional idóneo Conservación y transporte de muestras Laboratorio clínico - Procedimientos Operativos Estandarizados para la toma, procesamiento, almacenamiento, embalaje y envío de los especímenes biológicos de los sujetos participantes en la investigación. - Sistema de Calidad y programa de auditoría interna. - Manejo de las muestras biológicas de los sujetos participantes en la investigación. - Procedimiento Operativo Estandarizado para el manejo de desviaciones. Servicio Farmacéutico Personal capacitado en BPC Área restringida Monitoreo permanente Asegurar condiciones de almacenamiento Complejidad media o alta Presencia permanente de un QF Servicio Farmacéutico - Procedimientos Operativos Estandarizados para el manejo del producto en investigación (recepción, almacenamiento, dispensación, manejo de inventario, devolución, destrucción, entre otros) junto con los formatos de registro de dichas actividades. - Procedimiento Operativo Estandarizado para el manejo de desviaciones presentadas durante el manejo del producto en investigación y plan de contingencia. - Áreas designadas para el manejo de productos en investigación - Procedimientos Operativos Estandarizados para la adecuación y ajuste de dosis de productos en investigación cuando aplique. Sistema de Gestión de Calidad - Certificado de visita de cumplimiento de las condiciones de habilitación de la institución en el que se contemplen entre otros el servicio farmacéutico (mediana o alta complejidad) y laboratorio clínico. - Certificado de Cámara y Comercio de la institución. - Listado Maestro de documentos empleados en investigación clínica. Sistema de Gestión de Calidad - Contrato(s) o convenio(s) con los prestadores de servicios tercerizados (servicio farmacéutico, laboratorio clínico, Comité de Ética en Investigación u otros) cuando aplique. - Programa de auditoria a prestadores tercerizados cuando aplique. - Programa de saneamiento básico de la institución. de servicios Sistema de Gestión de Calidad - Programa de mantenimiento y calibración de equipos tanto del laboratorio clínico como del servicio farmacéutico. - Programa de capacitación continua al personal involucrado en investigación clínica – Soportes de capacitación. Patrocinador - Procedimiento Operativo Estandarizado para realizar el estudio de factibilidad para el desarrollo de estudios clínicos (póliza, presupuesto, otros.) - Soporte de Capacitación al equipo investigador por parte del patrocinador y/o CRO previo al inicio de estudios clínicos. - Soporte de Monitorias realizadas por el patrocinador y/o CRO a la institución que conduce ensayos clínicos. Visitas de renovación ¿Cómo solicitar la visita de renovación? Someter Solicitud Copia consignacion Visita de Renovación Formato de renovación Formato de protocolos Código: ASSAYC-FM046 ¿Cuando? Antes de el vencimiento de las BPC para que dicha certificación se mantenga. Renovación de BPC Programación de acuerdo a cronograma del Grupo Tres meses antes ¿Qué metodologia? Reunión de apertura Presentación de la Institución Reunión Final Diaria Observaciones encontradas. Temas de trabajo para el día siguiente Oportunidades de mejora. Verificación de las oportunidades de mejora Recorrido General por las instalaciones de la institución Evaluación por Componentes Elaboración del Acta RESOLUCIÓN Reunión de Cierre (Notificación del concepto técnico) Evaluación Institucional Certificación en buenas practicas clínicas Cumplir con el 100% de los aspectos críticos y no críticos planteados en la normatividad nacional vigente Garantizar la seguridad de los sujetos participantes en investigación y la veracidad de los resultados obtenidos. RESOLUCIÓN ¿QUIENES? ¿QUIENES? DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLOGICOS LUZ HELENA FRANCO COORDINACIÓN GRUPO DE PROGRAMAS ESPECIALES – ENSAYOS CLÍNICOS LEDA JARAMILLO MEDICOS Nidia Turmeque Diana Lopez Suarez Maria Liliana Gutierrez QUIMICOS FARMACEUTICOS Angélica Sandoval Laura Cruz Zayra Ramírez Lina Cabanzo BACTERIOLOGOS Claudia Esperanza Martinez Maria Sildana Guerrero Zulma Valvuena Consideraciones En la reunión de apertura y cierre debe estar presente el representante legal de la Institución o su respectivo delegado. Las inquietudes y observaciones generadas durante la verificación del cumplimiento de las Buenas Practicas Clínicas deben ser canalizadas a través del auditor líder. Los requisitos no críticos ameritan una acción correctiva en el transcurso de la visita La información que se conozca por la ejecución de esta auditoria será tratada confidencialmente, por parte del equipo auditor. Al final de cada sesión diaria se realizara una reunión en la que el equipo auditor expondrá los hallazgos encontrados correspondientes a requisitos no conformes. GRACIAS Gracias www.invima.gov.co Carrera 10 No 64-28 - Bogotá, D.C. Colombia. Teléfono: (1)2948700