LA VITAMINA C COMO MATERIA INTERDISCIPLINAR EN QUÍMICA
Anuncio

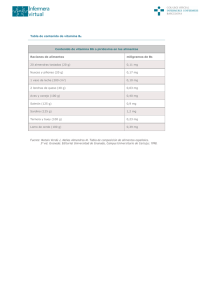
LA VITAMINA C COMO MATERIA INTERDISCIPLINAR EN QUÍMICA F. Enríquez, enriquez@uma.es Departamento de Química Física. Facultad de Ciencias. Universidad de Málaga. J.J. Quirante Departamento de Química Física. Facultad de Ciencias. Universidad de Málaga. P.L. Ramírez IES Carlinda. CEP de Málaga. J. Maldonado IES Cerro del Viento. Benalmádena. Málaga. INTRODUCCIÓN La investigación en el ámbito universitario está adaptándose a nuevas metodologías, a fin de dar respuesta a los diversos problemas científicos que se presentan. Asimismo, cada vez en mayor proporción, la investigación se efectúa con grupos interdisciplinarios lo que proporciona una nueva forma para el desarrollo de las ideas e incluso, en algunos casos, se presenta como el único medio para resolver un problema que una sola disciplina no puede resolver. Así pues, la enseñanza interdisciplinar (Brown,2002) constituye un importante aspecto de desarrollo intelectual y científico, tomando cuerpo en instituciones académicas para posibles aplicaciones de programas conjuntos donde encajan perfectamente, por ejemplo, las opciones hacia créditos de libre configuración según los nuevos planes de estudio. Insistiendo en lo anterior, más de un autor ha sugerido que la década de los años 90 se reconocerá como la década de la integración (Crosby,1997). Una integración que, fundamentalmente, se extiende a los conceptos y a las metodologías de diversas disciplinas. Diferencias de concepciones y de enfoques de conocimientos pueden generar habilidades de comunicación entre los alumnos. Quizás el desafío más significativo que se le presenta a un estudiante que se inicia en la investigación es el de agrupar todos aquellos conocimientos que va adquiriendo. Sin duda, desde el punto de vista educativo el aislamiento del estudiante en sus adquisiciones le privará de maravillosas oportunidades que le puede proporcionar el equipo de investigación interdisciplinaria. Es decir, que la práctica interdisciplinar exige a los participantes el que estén abiertos a las nuevas ideas y a las nuevas formas de comunicarse entre sí. Además, en una formación para los tiempos que vivimos necesitaremos profesores que sepan relacionar los principios y las leyes de la ciencia con el mundo de los estudiantes, profesores que sepan comunicar la ciencia como vivencia y como motivación. Del mismo modo, una formación completa en ciencias, de cara al alumno, supone un curriculum en que estén integrados rudimentos de física, química, biología, matemáticas, etc. Concretando más, una formación completa en ciencias químicas supone un conjunto interdisciplinar que comprenda todos los ámbitos de la química tanto en los campos teóricos como prácticos y experimentales, sin olvidarse, cuando sea preciso, del cálculo computacional. Este tipo de actividad está en la línea de los "Laboratorios integrados" que se plantearon con ocasión de las últimas reformas llevadas a cabo en los Planes de Estudio de la Licenciatura en Químicas y, pensamos, que pueden ser de utilidad para los alumnos siempre que lleguen a unos conocimientos básicos de las distintas materias implicadas. APLICACIÓN A LA VITAMINA C Dentro de esta consideración universalista e interdisciplinar recurrimos a una sustancia muy conocida y ampliamente utilizada que nos puede dar un enfoque globalizado de las anteriores propuestas. Hablamos en concreto de la Vitamina C, cuyo estudio puede extenderse a un amplio campo de la Química (Analítica, Química Física, Orgánica, ...) Bioquímica, Ciencias de la Salud, etc., pensando en alumnos que, en la Enseñanza Universitaria (Facultades o Escuelas) se inician en la Química. Previo al estudio de la Vitamina C, recordamos que con el nombre genérico de Vitaminas (Brown y otros, 1998) se designan varias sustancias químicas de naturaleza y estructura muy diversa, pero que se reúnen en un grupo debido a su característica común de ser necesarias en cantidades muy pequeñas para que el organismo realice sus funciones con normalidad. Las vitaminas, asimismo, se clasifican de acuerdo con su solubilidad en agua o en grasas (aceites), aunque algunas se disuelven en ambas. El grupo de las acuosolubles comprende el complejo vitamínico B y la vitamina C y entre las liposolubles figuran las A, D, E y K. Con respecto a la denominación de la sustancia que nos ocupa se emplean indistintamente el de ácido ascórbico o vitamina C (Pauling,1980), aunque se utilice, preferentemente, la "vitamina C" cuando se quiere destacar el papel del ácido ascórbico como componente nutritivo esencial, y el de "ácido ascórbico" para señalar su existencia como sustancia pura. La vitamina C en estado puro fue obtenida por Albert Szent-Györgyi en 1928, y, aunque en principio, la designó por ácido hexurónico, más tarde lo cambió por ácido ascórbico. El ácido ascórbico se describe como un polvo blanco, cristalino, muy soluble en agua, con un sabor muy similar al del zumo de naranja cuando se encuentra en solución. Asimismo, el ácido ascórbico corriente se denomina, también, ácido L-ascórbico (Pauling, 1980), existiendo otra sustancia, el ácido D-ascórbico que es imagen especular de la anterior pero que no tiene la actividad de la vitamina C. Son muchas las características y propiedades de la Vitamina C debidas, principalmente, a que es muy termosensible y lábil a la acción del oxígeno y a las radiaciones ultravioletas, potenciándose sus propiedades en presencia de bioflavonoides, calcio y magnesio. Entre los procesos en los que interviene la vitamina C (Jaramillo, 2000) destacaremos los siguientes: • Formación de estructuras tales como la dentina, cartílagos, colágeno y la matriz ósea. • Favorece la hemostasia (mecanismo de coagulación) y la cicatrización de las heridas. • Interviene en la respuesta del cuerpo al esfuerzo. • Fija el hierro en la hemoglobina de la sangre. • Ayuda a corregir la fatiga, la debilidad y el cansancio. • Tiene un efecto protector sobre las articulaciones, los tendones y los músculos. • Posee cualidades antioxidantes con las que se evita el envejecimiento y el daño celular. • Es un buen antiinflamatorio y un buen antidepresivo. Respecto a cómo se absorbe la vitamina C en el organismo diremos que ésta es absorbida por un sistema de transporte activo localizado en el intestino y se reabsorbe a través de los riñones. En cuanto a su poder antioxidante (Gaby, 1991), la vitamina C protege el ADN de las células del daño causado por los radicales libres y mutágenos, y puede ser especialmente importante porque combate los efectos de muchas toxinas, incluyendo el ozono, el monóxido de carbono, los hidrocarburos, pesticidas y los metales pesados. Al parecer la vitamina C rechaza a estos contaminantes estimulando las enzimas en el hígado que destoxifican el cuerpo. En varios estudios efectuados con la vitamina C se comprobó que ésta redujo las anormalidades del cromosoma en trabajadores expuestos a contaminantes como el alquitrán de carbón, el estireno, el metil metacrilato y éteres halogenados. Insistiendo en su cualidad de antioxidante el ácido ascórbico constituye un excelente compuesto para titulaciones yodométricas (Silva y otros, 1999; Wright, 2002) pudiendo sustituir con muy buenos resultados a productos tradicionales utilizados en la titulación como, por ejemplo, el tiosulfato sódico. Precisamente, la determinación de la vitamina C en productos farmacéuticos (redoxon, cecrisina, etc.) constituye una interesante práctica de laboratorio para alumnos de Química General. Dada su simplicidad expresamos a continuación la citada reacción: O O H OH CH- CH 2 OH (aq) + I2 (aq) HO OH Ac. ascórbico (C6H8O 6) O O H OH CH - CH2 OH + 2 H + (aq) + 2 I (aq) O O Ac.dehidroascórbico (C6H6O 6) El punto final de esta titulación se puede apreciar a partir de la aparición de un compuesto de color azul-violeta oscuro. Por último señalamos que la química computacional constituye un instrumento más que nos permite el estudio de la vitamina C desde aspectos químico físicos, y que de hecho algunos autores como O´Malley (2001) estudian con detalle y de una forma refinada, aunque, por su elevado nivel pensamos que se sale de nuestro ámbito de aplicación. Sin embargo, cálculos básicos, por ejemplo, a través de la Mecánica Molecular (MM) y orbitales moleculares (OM) están, hoy día, suficientemente definidos para que resulten utilizables por los alumnos tanto para la resolución de los problemas como para la simulación de las experiencias de laboratorio. Para nuestro propósito de aplicación computacional se hace un estudio estructural y energético de la molécula a través de métodos clásicos y métodos cuánticos, determinando su geometría así como otras propiedades físicas susceptibles de ser calculadas, lo que aparece recogido en el correspondiente poster. Inicialmente se parte de una geometría plana y se llega a la optimización de esta geometría a través del método MM2 (Allinger y Yuh, 1996) de Mecánica Molecular. Posteriormente y sirviéndonos de datos obtenidos anteriormente se vuelve a optimizar la estructura, ahora, mediante el método semiempírico AM1 (Dewar y otros, 1985). Finalmente, con el programa Gaussian 94 (Frisch y otros, 1995) haciendo uso de un modelo teórico simple como el HF/631G*, efectuamos el cálculo Ab initio que nos permite precisar y comparar los resultados, lo que se podrá apreciar a través de las respectivas tablas y figuras. CONCLUSIÓN Concluimos diciendo que lo que hemos pretendido en este estudio interdisciplinar del ácido ascórbico o vitamina C es poner de manifiesto que sustancias ampliamente conocidas y universalmente utilizadas pueden servirnos, en nuestra labor docente, para despertar el interés por la Química y aumentar la motivación y curiosidad científica de los alumnos. Al mismo tiempo se trata, también, de mostrar al alumno una más de las muchas maneras en las que la Química tiene su impacto y aplicación en la vida diaria REFERENCIAS BIBLIOGRÁFICAS ALLINGER, N. L.; YUH, Y. H. (1982). Op. Ins. For MM2 and MMP2 Programs, QCPE. BROWN, E.N.(2002). Interdisciplinary Research: A Student´s Perspective. Journal of Chemical Education. 79 (1) pp.13-14. BROWN; LeMAY; BURSTEN. (1998). QUÍMICA. Ciencia Central. Prentice Hall 7ª Edic. México, pp. 466. CROSBY, G. A. (1997): The Necessary Role of Scientists in the Education of Elementary Teachers. Journal of Chemical Education. 74 (3) pp.271-272. DEWAR, M. J. S.; ZOEBISH, E. F.; STEWART, J. J. P. (1985). J. Am. Chem. Soc. 107 pp. 3902. FRISCH, M. J.; VARIOS AUTORES y POPLE, J. A. (1995). Gaussian 94(Revisión A.1). Gaussian, Inc., Pittsburgh PA. GABY, S. K.; SINGH, V. N. (1991). "Vitamina C". Vitamin Intake and Health: A Scientific Review. Eds. Marcel Dekker, N. Y. pp. 108-109. JARAMILLO, N. (2000). Importancia de la Vitamina C. Edit. Contusalud.com. O´MALLEY, P. J. (2001). Density Functional Calculations Modelling the Spin Density Distribution, Hyperfine Couplings, and Hydrogen Bonding Environment of the Ascorbate (Vitamin C) Free Radical. J. Phys. Chem. B. 105 pp. 11290-11293 PAULING, L. (1980). Vitamina C, Resfriado común y gripe. Edit. AC, pp. 13, 32, 37. SILVA, C.R.; SIMONI, J.A.; COLLINS, C.H.; VOLPE, L.O. (1999). Ascorbic Acit as a Standard for Iodometric Titrations. Journal Of Chemical Educations.76 (10),pp.1421-1422. WRIGHT, S. W.; REEDY, P. (2002). The Vitamin C Clock Reaction. Journal of Chemical Education. 79 (1), pp. 41.