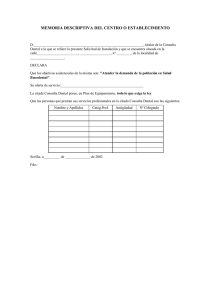
análisis in vitro de tres dentífricos con
Anuncio

UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE ODONTOLOGÍA CARRERA DE ODONTOLOGÍA “ANÁLISIS IN VITRO DE TRES DENTÍFRICOS CON AGENTES ANTIBACTERIANOS Y SU EFICACIA FRENTE A STREPTOCOCCUS MUTANS (ATCC 25175) Y LACTOBACILLUS ACIDOPHILUS (ATCC 4356)”. Trabajo teórico de titulación previo a la obtención del grado Académico de Odontóloga. Neira Osorio Karla Fernanda TUTOR: Dr. Fabricio Marcelo Cevallos González. Quito, abril 2016 DEDICATORIA Especialmente a Dios por darme las fuerzas y ponerme en los caminos correctos y por haber llegado a lograr este objetivo, al igual manera se lo dedico a mis padres Juan Carlos y Mariana que han estado conmigo en las buenas y malas, mis hermanas Adriana, Belén y Daniela que han estado junto a mi brindándome su amor en todo momento. LOS AMO. ii AGRADECIMIENTO A mi tutor Dr. Fabricio Cevallos que con dedicación y paciencia supo transmitirme sus conocimientos impartidos. A mis familiares y a mis amigas por su cariño y apoyo brindado. Karla Fernanda Neira Osorio iii AUTORIZACIÓN DE LA AUTORÍA INTELECTUAL Yo, Karla Fernanda Neira Osorio en calidad de autora del Trabajo de Investigación o Tesis realizada sobre: “ANÁLISIS IN VITRO DE TRES DENTÍFRICOS CON AGENTES ANTIBACTERIANOS STREPTOCOCCUS MUTANS Y (ATCC SU EFICACIA 25175) Y FRENTE A LACTOBACILLUS ACIDOPHILUS (ATCC 4356)”. Por la presente autorizo a la UNIVERSIDAD CENTRAL DEL ECUADOR, hacer uso de todos los contenidos que me pertenecen o de parte de los que contiene esta obra, con fines estrictamente académicos o de investigación. Los derechos que como autor me corresponden, con excepción de la presente autorización, seguirán vigentes a mi favor, de conformidad con lo establecido en los artículos 5, 6, 8, 19 y demás pertinentes en la Ley de Propiedad Intelectual y su Reglamento. Quito, 11 de abril del 2016 Karla Fernanda Neira Osorio C.I: 1313427492 Telf: 0994905739 E-mail: karlitaneira@gmail.com iv UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE ODONTOLOGÍA UNIDAD DE GRADUACIÓN, TITULACIÓN E INVESTIGACIÓN APROBACIÓN DEL TUTOR Quito, 11 de abril del 2016 Dra. Mariela Balseca COORDINADORA DE LA UNIDAD DE INVESTIGACIÓN, GRADUACIÓN Y TITULACIÓN DE LA FACULTAD DE ODONTOLOGÍA DE LA UNIVERSIDAD CENTRAL DEL ECUADOR. Presente De mi consideración: Yo, DR. FABRICIO CEVALLOS GONZÁLES, APRUEBO como Tutor la tesis titulada “ANÁLISIS IN VITRO DE TRES DENTÍFRICOS CON AGENTES ANTIBACTERIANOS Y SU EFICACIA FRENTE A STREPTOCOCCUS MUTANS (ATCC 25175) Y LACTOBACILLUS ACIDOPHILUS (ATCC 4356)”, que se desarrolló en la área del conocimiento de la especialidad de Odontología cuyo AUTOR es el estudiante Srta. KARLA FERNANDA NEIRA OSORIO. -----------------------------------------------------Dr. Fabricio Marcelo Cevallos Gonzáles C.I: 1313427492 TUTOR v UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE ODONTOLOGÍA UNIDAD DE GRADUACIÓN, TITULACIÓN E INVESTIGACIÓN HOJA DE APROBACIÓN DE TESIS “ANÁLISIS IN VITRO DE TRES DENTÍFRICOS CON AGENTES ANTIBACTERIANOS Y SU EFICACIA FRENTE A STREPTOCOCCUS MUTANS (ATCC 25175) Y LACTOBACILLUS ACIDOPHILUS (ATCC 4356)”. Quito, 11 de abril del 2016. Dra. Mariela Balseca COORDINADORA DE LA UNIDAD DE INVESTIGACIÓN, GRADUACIÓN Y TITULACIÓN DE LA FACULTAD DE ODONTOLOGÍA DE LA UNIVERSIDAD CENTRAL DEL ECUADOR. Presente De mi consideración: Los abajo firmantes miembros del Jurado Calificador APROBAMOS la tesis titulada “ANÁLISIS IN VITRO DE TRES DENTÍFRICOS CON AGENTES ANTIBACTERIANOS Y SU EFICACIA FRENTE A STREPTOCOCCUS MUTANS (ATCC 25175) Y LACTOBACILLUS ACIDOPHILUS (ATCC 4356)”, cuyo autor es la Srta. KARLA FERNANDA NEIRA OSORIO. ------------------------------------------Dra. MARIA ANTONIA DONA VIDALE PRESIDENTE DEL TRIBUNAL --------------------------------------------DRA. ALICIA DEL CARMEN FREIRE ANDRADE ---------------------------------------------------Dra. RAQUEL ESMERALDA GUILLÉN GUILLÉN MIEMBRO DEL TRIBUNAL MIEMBRO DEL TRIBUNAL vi ÍNDICE DE CONTENIDOS DEDICATORIA ............................................................................................................... ii AGRADECIMIENTO ..................................................................................................... iii ÍNDICE DE CONTENIDOS .......................................................................................... vii ÍNDICE DE ANEXOS ..................................................................................................... x ÍNDICE DE FIGURAS ................................................................................................... xi ÍNDICE DE TABLAS .................................................................................................... xii ÍNDICE DE GRÁFICOS .............................................................................................. xiii RESUMEN .................................................................................................................... xiv ABSTRACT ................................................................... ¡Error! Marcador no definido. INTRODUCCIÓN ............................................................................................................ 1 CAPÍTULO I .................................................................................................................... 3 1. EL PROBLEMA ............................................................................................ 3 1.1. Planteamiento del problema ........................................................................... 3 1.2. Formulación del problema ............................................................................. 4 1.3. Objetivos ........................................................................................................ 4 1.3.1. General ........................................................................................................... 4 1.3.2. Específicos ..................................................................................................... 4 1.4. Justificación .................................................................................................... 4 1.5. Hipótesis ......................................................................................................... 5 1.6. Hipótesis Nula ................................................................................................ 6 CAPITULO II ................................................................................................................... 7 2. MARCO TEÓRICO ....................................................................................... 7 2.1. Biofilm ........................................................................................................... 7 2.2. Caries Dental .................................................................................................. 9 2.2.1. Factores Etiológicos ..................................................................................... 10 2.2.1.1. Huésped ........................................................................................................ 11 2.2.1.2. Dieta ............................................................................................................. 13 2.2.1.3. Tiempo ......................................................................................................... 14 2.3. Bacterias Cariogénicas ................................................................................. 14 2.3.1. Género Streptococcus ................................................................................... 15 vii 2.3.1.1. Streptococcus mutans ................................................................................... 16 2.3.2. Género de Lactobacillus sp. ......................................................................... 18 2.3.2.1. Lactobacillus acidophilus ............................................................................ 19 2.4. Dentífricos .................................................................................................... 20 2.4.1. Origen ........................................................................................................... 20 2.4.2. Definición ..................................................................................................... 21 2.4.3. Características .............................................................................................. 22 2.4.4. Composición................................................................................................. 22 2.4.4.1. Abrasivos ...................................................................................................... 23 2.4.4.2. Humectantes ................................................................................................. 23 2.4.4.3. Detergentes ................................................................................................... 23 2.4.4.4. Espesantes y fijador ...................................................................................... 24 2.4.4.5. Saborizantes ................................................................................................. 24 2.4.4.6. Edulcorantes ................................................................................................. 24 2.4.4.7. Conservante .................................................................................................. 25 2.4.4.8. Agentes Terapéuticos ................................................................................... 25 2.5. Aloe vera ...................................................................................................... 26 2.5.1. Composición Química General .................................................................... 26 2.5.2. Aloe Vera en Odontología............................................................................ 27 2.6. Arginina........................................................................................................ 28 2.6.1. Arginina en Odontología .............................................................................. 28 2.7. Monofluorofosfato de Sodio ........................................................................ 30 2.7.1. Monofluorofosfato de Sodio en Odontología............................................... 30 CAPITULO III ............................................................................................................... 32 3. MARCO METODOLÓGICO ...................................................................... 32 3.1. Tipo de estudio ............................................................................................. 32 3.2. Operacionalización de las Variables ............................................................ 33 3.3. Población y Muestra ..................................................................................... 33 3.3.1. Criterios de Inclusión ................................................................................... 34 3.3.2. Criterios de Exclusión .................................................................................. 35 3.4. Materiales y Recursos .................................................................................. 35 3.4.1. Recursos ambientales ................................................................................... 35 3.4.2. Recursos humanos ........................................................................................ 35 viii 3.4.3. Equipos, materiales e instrumental para la evaluación microbiológica de los dentífricos. 35 3.5. Procedimiento............................................................................................... 37 CAPITULO IV ............................................................................................................... 47 4. ANÁLISIS DE DATOS ............................................................................... 47 4.1. Recolección de Datos ................................................................................... 47 4.2. Discusión ...................................................................................................... 55 CAPÍTULO V ................................................................................................................ 61 5. CONCLUSIONES Y RECOMENDACIONES ........................................... 61 5.1. Conclusiones ................................................................................................ 61 5.2. Recomendaciones ......................................................................................... 61 BIBLIOGRAFÍA ............................................................................................................ 63 ANEXOS ........................................................................................................................ 72 ix ÍNDICE DE ANEXOS Anexo No. 1. Certificado de autenticidad del Streptococcus mutans ATCC 25175. .. 72 Anexo No. 2. Certificado de autenticidad del Lactobacillus acidophilus ATCC 4356. 73 Anexo No. 3. Recolección de datos del Lactobacillus acidophilus. ............................ 74 Anexo No. 4. Recolección de datos del Streptococcus mutans. .................................. 75 Anexo No. 5. Certificado Traducción ......................................................................... 76 ........................................................................................................................................ 76 Anexo No. 6. Fórmulas para obtención de diluciones para las pastas dentales. ......... 77 Anexo No. 7. Certificado estadístico ........................... ¡Error! Marcador no definido. x ÍNDICE DE FIGURAS Figura No. 1. Figura 1. ............................................................................................. 11 Figura No. 2. Dentífricos utilizados. ........................................................................37 Figura No. 3. Peso del dentífrico. .............................................................................38 Figura No. 4. Colocación de agua destilada. ............................................................ 38 Figura No. 5. Obtención de todas las diluciones. ..................................................... 39 Figura No. 6. Centrífugadora .................................................................................... 39 Figura No. 7. Soluciones después del centrifugado donde se observa el sobrenante y el precipitado. ................................................................ 40 Figura No. 8. Colocación del sobrenante en los disco..............................................40 Figura No. 9. Suspensión bacteriana que contiene la cepa ATCC 25175 de Streptococcus mutans y Lactobacillus acidophilus ATCC 4356. ......41 Figura No. 10. Escala Mc. Farland ............................................................................42 Figura No. 11. Toma de muestra con hisopo del inóculo. .........................................42 Figura No. 12. Hisopado en tres direcciones. ............................................................. 43 Figura No. 13. Rotulación de las cajas Petri............................................................... 43 Figura No. 14. Discos colocados. ...............................................................................44 Figura No. 15. Jarra de anaerobiosis Gaspak, incubación. .........................................44 Figura No. 16. Regla microbiológica. ........................................................................45 Figura No. 17. Halos de inhibición de Lactobacillus acidophilus y Streptococcus mutans con las pasta dental Colgate Sensitive Pro-Alivio Arginina 8%. ...................................................................45 Figura No. 18. Halos de inhibición de Lactobacillus acidophilus y Streptococcus mutans con las pasta dental Blendax Aloe Vera – Aloe Barbadensis Leaf Extract. .......................................................... 46 Figura No. 19. Halos de inhibición de Lactobacillus acidophilus y Streptococcus mutans con las pasta dental (Kolynos súper blanco - Monoflurofosfato de Sodio 0,76%. .....................................46 xi ÍNDICE DE TABLAS Tabla No.1. Clasificación Streptococcus mutans ...................................................... 18 Tabla No.2. Composición de la pasta dental.............................................................. 22 Tabla No.3. Resultados del halo de inhibición para Streptococcus mutans. .............47 Tabla No.4. Resultados del halo de inhibición para Lactobacillus acidophilus. .......48 Tabla No.5. Halo de inhibición por tipo de pasta para Streptococcus mutans ..........49 Tabla No.6. Halo de inhibición por tipo de pasta para Lactobacillus acidophilus. ............................................................................................ 51 Tabla No.7. Resultados de la prueba de Kruskal Wallis ...........................................53 Tabla No.8. Media del halo formado por cepa, dilución y tipo de pasta. ..................53 xii ÍNDICE DE GRÁFICOS Gráfico No.1. Halo de inhibición por tipo de pasta para Streptococcus mutans. ......50 Gráfico No.2. Halo de inhibición por tipo de pasta para Lactobacillus acidophilus ......................................................................................... 52 Gráfico No.3. Media del halo formado por cepa, dilución y tipo de pasta. ..............54 xiii TEMA: “ANÁLISIS IN VITRO DE TRES DENTÍFRICOS CON AGENTES ANTIBACTERIANOS Y SU EFICACIA FRENTE A STREPTOCOCCUS MUTANS (ATCC 25175) Y LACTOBACILLUS ACIDOPHILUS (ATCC 4356)”. AUTOR: Karla Fernanda Neira Osorio TUTOR: Fabricio Marcelo Cevallos González RESUMEN El Streptococcus mutans y el Lactobacillus acidophilus son considerados las principales bacterias productoras de caries, sin embargo para contrarrestar los efectos de estos microorganismos se han desarrollado agentes dentífricos que inhiben las acción de los mismos. El objetivo de este trabajo fue evaluar la eficacia de tres dentífricos basados en (monoflurofosfato de sodio, arginina y Aloe vera) con aparentes propiedades antibacterianas frente al mutans y al Lactobacillus. Los mencionados agentes dentales fueron diluidos en agua estéril aplicando la técnica de difusión de disco, analizando 96 cepas distribuidas de forma equitativa para cada pasta, evidenciando que el agente antimicrobiano con mayor poder de inhabilitación lo tuvo la arginina, con halos de inhibición de 13.5mm en mutans y 10.8mm para Lactobacillus, seguido del Aloe vera y el monofluorofosfato de sodio. Finalmente se concluyó que la efectividad para inhibir las bacterias cariogénicas dependerá de la dilución de los componentes en cada pasta dental. PALABRAS CLAVES: pasta dental / Streptococcus / Lactobacillus. xiv TEMA: “ANÁLISIS IN VITRO DE TRES DENTÍFRICOS CON AGENTES ANTIBACTERIANOS Y SU EFICACIA FRENTE A STREPTOCOCCUS MUTANS (ATCC 25175) Y LACTOBACILLUS ACIDOPHILUS (ATCC 4356)”. AUTHOR: Karla Fernanda Neira Osorio TUTOR: Fabricio Marcelo Cevallos González ABSTRACT Streptococcus mutans and Lactobacillus acidophilus are considered the main dental cavity-producing bacteria; however, to counteract the effects of these microbes, toothpastes have been developed that inhibit their activity. The goal of this work was to assess the effectiveness of three different toothpastes with a base of sodium monofluorophosphate, arginine, and aloe vera, which have apparent antibacterial properties against S. mutans and L. acidophilus. The toothpastes were diluted in sterile water using the disc diffusion technique, analyzing 96 strains equally distributed among each toothpaste. It was evident that the most effective antimicrobial agent was arginine, with inhibition halos of up to 13.5 mm against S. mutans and 10.88 mm against L. acidophilus, followed by aloe vera and sodium monofluorophosphate. Finally, it was concluded that the effectiveness in inhibiting cariogenic bacteria depends on the dilution of the components in each toothpaste. KEYWORDS: Toothpaste / Streptococcus / Lactobacillus. xv INTRODUCCIÓN En las últimas dos décadas de investigación han ido avanzado significativamente los conocimientos acerca de la caries dental, tal es el caso de que se han identificado claramente ciertas teorías entre las que se destacan considerar a esta patología como un proceso dinámico, multifactorial que implica la interfaz del biofilm de la placa no perturbado y la superficie del diente cuando azúcares de la dienta están presentes. El proceso comienza cuando las especies productoras de ácido tales como los Streptococcus mutans y Lactobacillus acidophilus metabolizan estos azúcares de la dieta para producir ácido láctico y otros ácidos, causando la desmineralización es decir, la pérdida de iones de calcio y fosfato de la estructura hidroxiapatita del esmalte dental (Yin et al., 2013). La prevención de la caries es una de las señas de identidad de la práctica dental contemporánea, de acuerdo con el informe sobre la salud bucal mundial, la caries dental sigue siendo un importante problema de Salud Pública en la mayoría de los países, lo que afecta el 60-90% de niños escolares y una gran mayoría de los adultos, que según la OMS (2010) puede ser debido a los estilos de vida, hábitos dietéticos, aumento de consumo de azúcar y la exposición inadecuada a los fluoruros (Kiranmayi et al., 2015). El uso de los dentífricos se ha convertido en la forma más común de la higiene oral en los países más desarrollados y en desarrollo ya que su uso ha sido asociado no sólo con el propósito de limpieza de los dientes, sino también anticaries, anti-sensibilidad, sensación de frescura y la reducción del mal aliento. Hay una amplia gama de formulaciones entre ellas está el cepillado dental que aparentemente tiene alta eficacia para la reducción del biofilm. Hoy en día existen dentífricos formulados con monofluorofosfato de sodio puede mostrar beneficios en la cavidad oral para contrarrestar los efectos de la placa. En este sentido los dentífricos fluorados juegan un papel activo en la bioquímica oral a través de una acción directa sobre los procesos de desmineralización y remineralización de los tejidos dentales (Muniz et al., 2015). Cabe mencionar que también se han identificado recientemente otros componentes que potenciarían la salud oral tal es el caso de la arginina que contribuye a prevenir que la flora bacteriana se trasforme en una flora de bacterias productoras de ácido, como el 1 S. mutans, y mantener así una placa saludable después del estímulo con azúcar (Souza et al., 2013). Actualmente, extractos de plantas han sido incorporados a las fórmulas de los dentífricos, se destaca el Aloe vera por ejemplo, al cual también se lo conoce como sábila en el área comercial, que además de desempeñar funciones cosméticas, tiene el objetivo principal de mejorar la acción antimicrobiana y actuar como agente terapéutico ya que la acción terapéutica de los dentífricos no está relacionada únicamente a la presencia de flúor en su composición, sino también de otros componentes como los antes mencionados que ayudan en procesos de prevención, la reversión de lesiones cariosas incipientes , la halitosis, gingivitis, entre otras. (Barreto, 2009). Pese a lo referido anteriormente, insuficientes estudios evalúan la actividad antimicrobiana de estos agentes antimicrobianos utilizados en el medio, en especial contra los Streptococcus mutans y lactobacillus. Por lo tanto con estos antecedentes, el presente estudio pretendió evaluar mediante pruebas In vitro la actividad antimicrobiana de tres dentífricos basados arginina, monofluorofosfato de sodio, aloe vera y su acción frente a cepas de Streptococcus mutans y lactobacillus acidophilus. 2 CAPÍTULO I 1. EL PROBLEMA 1.1. Planteamiento del problema Dentro de las enfermedades crónicas más comunes que presenta el ser humano se encuentran la caries dental las cuales son causadas principalmente, por una inadecuada higiene oral, producto de la falta de conocimiento de medidas preventivas y la incorrecta utilización de técnicas e instrumentos de higiene, por lo tanto la cavidad oral está expuesta a la colonización de microorganismos de origen bacteriano y salival que forman la placa bacteriana (biofilm) y consecuentemente causan un pH ácido que a su vez produce una desmineralización a los tejidos dentales. La forma común de visibilizar este deterioro es la aparición de caries acompañada de enfermedades periodontales. Se ha llegado a concluir que uno de los factores causantes para la formación de la placa bacteriana que a su vez ocasionan la aparición de caries es la presencia de microorganismos cariogénicos principalmente el Streptococcus mutans y Lactobacillus acidophilus (Ojeda et al., 2013). Los compuestos antibacterianos que presentan los dentífricos ayudan a impedir la desmineralización y la adherencia de la placa bacteriana y a la remineralización, sin embargo, no es fácil elegir dentro de la variedad de dentífricos que se encuentran en el mercado. Generalmente los consumidores relacionan el precio del producto con la calidad, es decir, creen que entre más costosa sea la pasta dental es más eficaz, sin tener conocimiento de los componentes que ofrece el producto y cuál es la función real de cada uno de ellos. De los antecedentes señalados surge la siguiente interrogante, que será el soporte de la investigación propuesta. 3 1.2. Formulación del problema ¿Qué grado de dilución de los dentífricos produce mayor halo inhibición en el crecimiento de microorganismos cariogénicos: Lactobacillus acidophilus y Streptococcus mutans? 1.3. Objetivos 1.3.1. General Evaluar el nivel de eficacia de tres dentífricos con agentes antibacterianos frente a microorganismos cariogénicos: Streptococcus mutans (ATCC 25175) y Lactobacillus acidophilus (ATCC 4356 midiendo halos de inhibición. 1.3.2. Específicos 1. Evidenciar la capacidad de inhibición en los agentes antibacterianos frente Streptococcus mutans (ATCC 25175) y Lactobacillus acidophilus (ATCC 4356). 2. Comprobar si los dentífricos con agentes antibacterianos, Monoflurofosfato de sodio, Aloe Barbadensis leaf extract y arginina son eficaces frente a Streptococcus mutans (ATCC 25175) y Lactobacillus acidophilus (ATCC 4356). 1.4. Justificación Se ha mencionado que los agentes antimicrobianos pueden actuar directamente sobre el biofilm dental o alterar los diversos componentes de ésta para permitir un retiro más fácil y completo durante el cepillado dental y la utilización del hilo dental (Harris et al., 2005). Existen diversos agentes antibacterianos que han expuesto una potencia anticaries al ser evaluados en distintas metodologías, primordialmente In Vitro (Barrancos et al., 2006). Se Refieren que los principios activos antibacterianos han servido para completar la higiene dental diaria y han mostrado su eficacia contra los microorganismos asociados con la etiología de la caries dental (Negrori, 2009). 4 En otro ámbito cabe indicar que la arginina es un aminoácido que ha sido identificado como un ingrediente que brinda un alivio superior contra la hipersensibilidad dentinaria y el biofilm (Bravo et al., 2006). A su vez ciertas investigaciones le adjudican propiedades biológicas al Aloe vera por su acción antibacteriana, antiinflamatoria y cicatrizante se ha investigado su uso en el tratamiento de la enfermedad periodontal, en la prevención de gingivitis, caries dental y mucositis (Silva, 2013). Para Rosales et al., (2014) otro de los compuestos antibacterianos presentes en las pastas dentales lo constituye el Monoflurofosfato de Sodio, que estimula la remineralización del esmalte descalcificado, interfiriendo en el crecimiento y desarrollo de bacterias de la placa dental. Cada día se puede encontrar en el mercado más dentífricos compuestos por numerosos agentes antibacterianos, que se ofrecen como la última alternativa en el tratamiento y eliminación de problemas orales, como el caso de “libre de caries”, entre otras. Sin embargo, se desconoce la cantidad mínima necesaria de los componentes antibacterianos que alcance un halo de inhibición adecuado para atacar el problema, a pesar de que se han realizado estudios anteriores (Barreto & Maria, 2005). Con este antecedente literario la presente investigación pretenderá mediante un estudio In Vitro en dos cepas previamente definidas, determinar si el uso de agentes antibacterianos incrementados en los dentífricos inhibe la carga bacteriana de Streptococcus mutans y Lactobacillus acidophilus y en base al resultado obtenido, tomar como potencial solución el incremento de estos agentes en las pastas dentales para prevenir las enfermedades buco-dentarias más comunes caries y enfermedad periodontal. 1.5. Hipótesis Los dentífricos con agentes antibacterianos son eficaces frente a Streptococcus mutans (ATCC 25175) y Lactobacillus acidophilus (ATCC 4356). 5 1.6. Hipótesis Nula Los dentífricos con agentes antibacterianos no son eficaces frente a Streptococcus mutans (ATCC 25175) y Lactobacillus acidophilus (ATCC 4356). 6 CAPITULO II 2. MARCO TEÓRICO 2.1. Biofilm La cavidad bucal provee un ambiente cálido y húmedo adecuado para el crecimiento de muchos microorganismos. Éste es el único lugar del cuerpo humano que, en condiciones normales, posee superficies dentales, que permiten la colonización microbiana y facilitan el desarrollo de biopelícula. La placa dental fue probablemente, la primera biopelícula en ser estudiada a los agentes antimicrobianos. (Cuenca, 2013). Es por eso, que la formación del biofilm es un acontecimiento importante que tiene lugar en el inicio de la etiología de las dos enfermedades bucales más importantes: la caries dental y la enfermedad periodontal. (Freeman, 1997). Oliva (2007) mencionó: “a la placa bacteriana como una comunidad microbiana que se localiza sobre la superficie del diente, creando una biopelícula formada por una matriz de polímeros de origen bacteriano y salival en boca de individuos sanos y enfermos”. Según Henostroza (2009), considera que la cavidad bucal contiene una de las más variadas y concentradas poblaciones microbianas en el organismo, en ella habitan más de mil especies, cada una de ellas representada por una gran variedad de cepas, y que según ciertas investigaciones podrían concentrarse en 1mm3 de biofilm dental, pesando aproximadamente 1 mg, donde se encontrarían 108 microorganismos. Considerándose que en la placa bacteriana pueden encontrarse iones de calcio, fosfato, magnesio, potasio y flúor. El calcio y fosfato presentes proceden de la saliva o del esmalte y siempre se encuentran en concentraciones más elevadas en la saliva, constituyendo un reservorio en el proceso desmineralización-remineralización. La ingesta regular de carbohidratos presente en la placa dental procede del metabolismo de la sacarosa realizado por las bacterias, almacenándose intracelular o extracelular para su utilización posterior. Además, polisacáridos extracelulares como los glucanos facilitan la adhesión y agregación bacteriana favoreciendo la formación de la placa dental. (Barbería, 2014). 7 En efecto que las bacterias que se encuentran en la saliva suspendida en la fase líquida, adoptan una forma que se denominan planctónicas (forma de crecimiento de las bacterias cuando flotan suspendidas en un medio líquido. O bien las bacterias que se encuentran sobre una superficie dura (diente, reconstrucciones, prótesis e implantes) formando una película gelatinosa adherente: la placa dental (Enrile, 2009). Basconez (2009) refiere que para la formación de la placa dental sobre una superficie dentaria es precisa la formación previa de la película adquirida. Por su parte Negroni (2009) manifestó que la película adquirida es una capa orgánica acelular, delgada, amorfa y electrodensa adyacente a la superficie del esmalte, carece de bacterias y sus productos están formados por proteínas y glucoproteínas y su grosor varía de sitio en sitio, pero se ha estimado en 1 a 2 µm. Sin embargo en un periodo de 24 horas esta película es colonizada por los primeros microorganismo, suelen ser bacterias cocos grampositivos; posteriormente otras bacterias se adhieren sobre la superficie dentaria o específicamente a las células ya adheridas, co-agregacion de anaerobios facultativos y gram negativos; a los 7-14 días aparecen los últimos colonizadores que son anaerobios obligados Boj et al. (2011). De acuerdo con Marsh & Martin (2011) los factores que influyen para la colonización de diferentes microorganismos que favorecen la formación de la placa bacteriana dentro de la cavidad bucal, se considera una temperatura constante de 35-36oC y un pH medio de 6,75 y 7,25, esto puede dar lugar a la colonización de especies acidúricas como el Streptococcus mutans y Lactobacillus. Sin embargo las bacterias cariogénicas como los Estreptococos y los Lactobacilos pueden degradar por glucólisis la glucosa a valores de pH de hasta 4,5 y 3,7. Esta intolerancia diferencial a la acidez es la causa de que Streptococcus mutans estén predispuestos para iniciar la caries, mientras que los Lactobacilos posibilitan la progresión de ésta (Hubertus J. M. van de Waes, 2002). Negroni (2009) sostuvo que el equilibro fisiológico entre las piezas dentarias y la biopelícula puede alterarse dependiendo de las características del medio bucal. El pH bajo, causado por la fermentación de los carbohidratos selecciona la población de cepas acidogénicas y acidúricas, tales como los estreptococos del grupo mutans (S. mutans, Sobrinus y Lactobacilos).Para Moroni et al., (2009) el biofilm de la placa dental, está íntimamente ligado a la caries dental, siendo el Streptococcus mutans, el microorganismo más importante seguido por el Lactobacillus y el Actinomyces. Para el 8 control de los estos microorganismos relacionados con la placa dental, así como en el proceso carioso, es de vital importancia para el control de la enfermedad el uso de antimicrobianos. Debido a que la placa dental no es permeable a la saliva, los ácidos no se diluyen ni se neutralizan, desmineralizan el esmalte causando una lesión en los dientes por lo tanto es esta lesión química lo que inicia la caries dental (Prescolt & Klein, 2006). En efecto que cuando una superficie susceptible del diente es colonizada por bacterias cariogénicas y está presente una fuente de sacarosa, éstas producen ácido láctico a partir de la fermentación de los carbohidratos lo que provoca la disolución de los cristales de hidroxiapatita del esmalte del diente y ocasiona la caries dental (Alonso & Karakowsky, 2009). 2.2. Caries Dental Seif (1997) afirma: “la caries dental es una de las enfermedades infecciosas de mayor prevalencia en el hombre, manteniéndose como uno de los principales problemas de salud pública a nivel mundial” coincidiendo hoy en día con la OMS (2012). De acuerdo con Barbería (2014) la caries dental es una enfermedad infecciosa multifactorial caracterizada por la destrucción de las estructuras dentarias que origina cavitaciones y pérdidas dentarias, provocados por la acción de los ácidos producidos por los microorganismos que integran la placa dental. Así mismo Negroni (2009) sostuvo que la caries dental se define como una enfermedad compleja, trasmisible, en la que un amplio grupo de factores biológicos, socio-económicos y culturales interactúan, directa o indirectamente en el establecimiento y desarrollo de los microorganismos cariogénicos. Existen zonas que son más susceptibles para el desarrollo de esta patología, constituyéndose en aquellas con mayor grado de cariogenicidad las que se localizan en áreas de los dientes que no están protegidas por la auto limpieza, tales como fosas, fisuras y puntos de contacto, superficies bucales y linguales. (Seif, 1997). “En las zonas de fisuras, fosas y en los huecos de las superficies oclusivas los microorganismos adherentes de la placa están más protegidos de la eliminación mecánica”. (Freeman, 1997). 9 La superficie dentaria esta bañada por la saliva y, entre ambos, ocurre un continuo intercambio de iones de calcio y fosfato dando lugar a un ciclo constante de desmineralización – remineralización. Si la perdida e incorporación de iones es similar, el resultado es el equilibrio y la superficie, aparentemente, permanece intacta, por lo tanto, el equilibro puede alterarse en presencia de carbohidratos fermentables que son aprovechado por los Streptococcus mutans y los Lactobacillus quienes metabolizan ácidos orgánicos que dan lugar a una caída de pH favoreciéndose la desmineralización. Por el contrario, si están presentes iones de fluoruro, se formarán cristales de fluorapatita, más resistentes a la agresión ácida. (Barbería, 2014). Freeman (1997), mencionó que el microorganismo que inicia la caries en la superficie lisa del esmalte es el Streptococcus mutans, en presencia de sacarosa, el factor más cariogénico de la dieta. Además el S. mutans produce gran cantidad de ácido láctico a partir de la sacarosa y otros productos como los carbohidratos y los lactobacilos son invasores secundarios de la lesión cariada, produciendo más ácido láctico. 2.2.1. Factores Etiológicos “La interacción simultánea de tres factores básicos concluyentes en la formación de caries que representan la triada de Keyes: un factor “microorganismos” que en presencia de un factor “sustrato” logra afectar a un factor “diente” (también denominado hospedador)”. (Negroni, 2009). “Con el afán de hacer más preciso el modelo de Keyes, se añadió el factor tiempo en la etiología de la caries”. (Henostroza, 2007). Para Harris & García (2001) estos factores se los llamo factores principales. Por otro lado Henostroza (2007) ha resaltado los factores etiológicos moduladores, los cuales favorecen la evolución de las lesiones cariosas entre ellos se encuentra la edad, salud general, fluoruros, grado de instrucción, nivel socioeconómico experiencia pasada de caries, grupo epidemiológico y variables de comportamiento. Por su parte Cárdenas & Perona, (2013) reportan que los factores de riesgo (tiempo) no actúan aisladamente si no en conjunto, por lo que con frecuencia fortalecen en gran medida su nocivo efecto sobre la salud ya que la acción combinada de los factores riesgo muestra que a trabajar en conjunto, su acción será mejor. “Además son reconocidos como 10 factores ambientales el bajo nivel educativo, la ausencia de hábitos higiénicos y la falta de accesibilidad a los servicios de salud” Guerrero et al. (2009). HÚESPED (DIENTE-SALIVA) DIETA CARIES MICROORGANIS MOS TIEMPO Figura No. 1. Figura 1. Fuente: (Henostroza, 2007). Anillo de Keyes Autora: Karla Neira. Seif (1997) ha incluido que uno de los principios fundamentales implicados en el desarrollo de la caries dental es la teoría química parasitaria, citando a Miller (1882) quien sugiere que las bacterias cariogénicas convierten los carbohidratos de la dieta en ácidos, que son capaces de solubilizar el fosfato de calcio del esmalte y producir la lesión cariada. Alonso & Karakowsky (2009) aseveran que cuando una superficie susceptible del diente es colonizada por bacterias cariogénicas y está presente una fuente de sacarosa, éstas producen ácido láctico a partir de la fermentación de los carbohidratos lo que provoca la disolución de los cristales de hidroxiapatita desmineralizando el esmalte del diente y desarrollando caries. 2.2.1.1. Huésped De acuerdo a Boj et al., (2011) el órgano dentario en sí mismo ofrece puntos débiles que predisponen al ataque de caries, en especial en zonas del diente que favorecen la acumulación de placa o que el acceso de la saliva está limitado; fosas, fisuras, las superficies proximales, especial en la zona cervical al área de contacto y el margen 11 gingival; la constitución del esmalte, que es el resultado de la composición del fluido fisiológico que envuelve al diente durante el desarrollo, estos elementos se incorporan al esmalte por intercambio iónico y pueden hacer que el esmalte sea inicialmente más o menos resistente al ataque que acido; la edad posteruptiva del diente, la susceptibilidad a la caries es mayor inmediatamente después de la erupción del diente y disminuye con la edad. Los dientes sufren un proceso de maduración posteruptiva que implica cambios en la composición de la superficie del esmalte. Durante el proceso de ataque ácido, buena parte de los iones carbonato de la hidroxiapatita inicial que son más solubles, son sustituidos por otros iones como el flúor que confieren más resistencia a la hidroxiapatita del esmalte. De acuerdo a Shafer (1986), ha sugerido que las características morfológicas del diente tienen influencia en la iniciación de la caries, como la hipoplasia del esmalte que predispone al desarrollo de la caries dental y que entre más este afectado el diente, es más extensa la caries. Por último la posición del diente puede jugar un papel importante en el proceso de la caries dental bajo ciertas circunstancias. El investigador además menciona que los dientes que están mal alineados, fuera de la posición, volteados o situados en una forma que no es normal pueden ser difíciles de limpiar y tienden a favorecer la acumulación de comida y restos de alimentos. Otros de los factores a considerar es la saliva que constituye uno de los elementos del huésped más importantes a tener en cuenta a la hora de evaluar el riesgo de un paciente a desarrollar caries dental, debido a que intervienen en la estabilidad de la ecología microbiana influyendo en el crecimiento y adherencia de las bacterias en los tejidos orales y puede alterar el proceso de fermentación de los azúcares. (Rioboo, 2002). Entre los mecanismos que Boj et al. (2011) incluyó: la acción de limpieza mecánica y favorecedora del aclaramiento de las comidas; propiedades antibacterianas debidas a determinadas proteínas y enzimas: (lactoferrina, lisozima, peroxidasas e inmunoglobulinas, principalmente IgA secretora) producida en las glándulas salivales que inhiben la adhesión de las bacterias al esmalte; y además posee componentes que inhiben la desmineralización dentaria y favorecen la remineralización, bien sean orgánicos (determinadas proteínas), como inorgánicos (iones flúor, calcio). Otro 12 mecanismo que influye es el sistema buffer de la saliva, que incluye bicarbonato, fosfatos y proteínas. El pH salival depende de las concentraciones de bicarbonato; el incremento en la concentración de bicarbonato resulta un incremento del pH, además los niveles muy bajos del flujo salival hacen que el pH disminuya por debajo de 5-3, sin embargo, aumenta a 7-8 si se acrecienta gradualmente el flujo salival (Núñez. & García, 2010). 2.2.1.2. Dieta Sturdevant (2007) afirma: “La frecuente exposición a la sacarosa es el factor más importante para mantener un descenso de pH en la superficie dental, que con frecuencia produce desmineralización”. Debido al efecto patogénico que tienen los carbohidratos, la dieta es uno de los elementos predisponentes a la caries dental, sobre todo después de la ingestión de grandes cantidades de alimentos azucarados a intervalos irregulares durante el día, especialmente en forma de productos de alta densidad y viscosidad. (Sarabia et al., 2005). Los alimentos pegajosos se mantienen en contacto con los dientes durante mayor tiempo y por ello son más cariogénicos. Los líquidos tienen adherencia mínima en los dientes, y en consecuencia poseen menor actividad cariogénica. La ingestión de alimentos con carbohidratos durante las comidas implica una cariogenicidad menor que la ingestión de esos alimentos entre comidas (Higashida, 2009). La ingesta frecuente y en tres horas de azúcares (en especial la sacarosa) y más si la cualidad de alimentos es pegajosa o viscosa proporciona los requisitos nutricionales y energéticos para la microflora, permitiéndose colonizar, crecer y metabolizar sobre superficies dentarias selectivas (Villafranca et al., 2005). De acuerdo a Palma & Sánchez (2013) los alimentos sirven de sustrato a las bacterias es especial los hidratos de carbono y dentro de ellos los azúcares cariogénicos (sacarosa, glucosa, fructosa y lactosa) son metabolizados en el interior de las bacterias, por medio de la glucólisis, para obtener energía y como resultado del metabolismo se producen ácidos orgánicos, principalmente el láctico, que determinan una disminución del pH salival, considerándose el pH 5,5 como pH crítico, pues a partir de esta comienza la desmineralización del esmalte. Para Negroni (2009) la interacción entre la dieta y la 13 caries dental constituye un aspecto de importancia trascendental, ya que lo alimentos son la fuente de los nutrientes necesarios para el metabolismo de los microorganismos Las recomendaciones dietéticas deben ser realistas y siempre basadas en los comportamientos dietéticos de la familia, deben ser dadas por el Odontólogo al niño y a sus padres. La educación nutricional se consigue enseñando a los padres la importancia de reducir el consumo de azúcar y dulces. La educación es necesaria, pero no es suficiente para cambiar los hábitos dietéticos. (Barroso et al., 2011). 2.2.1.3. Tiempo Henostroza (2007) ha mencionado que el tiempo resulta determinante puesto que si los factores etiológicos interactúan durante más tiempo, habrá oportunidad que ocurran los fenómenos de desmineralización, mientras que si tal interactúan durante menos, dichos fenómenos no alcanzarían a producirse. Según Negroni (2009) “el tiempo de desmineralización del esmalte por la ingesta de soluciones azucaradas se estima en aproximadamente veinte minutos”. Cuando se produce ataques ácidos de forma reiterada, puede que un colapso suficiente de cristales de esmalte y de laminillas provoque la rotura de la superficie, acción que se prolonga durante meses o años, dependiendo de la intensidad o de la frecuencia del ataque acido ya que la mayoría de las bocas contienen bacterias cariogénicas, en todas ellas se puede producir la continua desmineralización y remineralización del esmalte, por lo que se deduce que un individuo jamás dejara de estar exento de poder padecer caries dental (Cameron & Widmer, 2010). 2.3. Bacterias Cariogénicas A medida que la lesión de caries progresa, se da una transición de bacterias: anaerobias facultativas Gram-positivas, que predominan en la etapas iniciales de la lesión, y las bacterias anaerobias estrictas Gram-positivas y Gram-negativas que predominan en lesiones de caries avanzadas entre las bacterias asociadas con el inicio, progresión o avance de la lesión de caries dental (Figueroa et al. 2009). Para Harris et al., (2001) “la mayor parte de las 200 a 300 especies de microorganismos habitantes de 14 la placa no están directamente involucradas en el proceso y desarrollo de caries, sin embargo tienen especial interés dos géneros bacterianos: el Streptococcus mutans y Lactobacillus acidophilus”. Las bacterias cariogénicas son acidogénicos y acidúricos como el Streptococcus del grupo mutans principalmente (Cárdenas & Aguilera, 2013). A este microorganismo se lo considera el de mayor potencial cariogénico, aunque también son importantes S. salivarius, S. milleri, S. sanguis, S. mitis, S. intermedious, Lactobacillus acidophilus, L. casei, Actinomyces viscosus y A. naeslundii, entre otros que potencia la patología (Higashida, 2009). Para Barbería (2015) el Streptococcus mutans presenta una capacidad mayor de adhesión a la superficie dentaria por su capacidad de producir glucanos, por lo que se le atribuye el papel de inductor de la caries, mientras los Lactobacilos tienen un protagonismo más intenso cuando la caries se ha iniciado, relacionándose con la velocidad progresión. Los S. mutans y los Lactobacilos se encuentran en casi todas las lesiones de caries y su proporción en placa y saliva están relacionados con la frecuencia y actividad de caries dado que representan el 50% de las bacterias de la lengua, superficies mucosas, saliva y el 30% de la flora de la placa y surco gingival. (Rioboo, 2002). Los microorganismos bucales utilizan los carbohidratos de la dieta, especialmente la sacarosa, para obtener energía y sintetizar polisacáridos complejos, se han mostrado que la exposición frecuente de azúcares refinados induce a la colonización y multiplicación de microorganismos cariogénicos, sobre todo si la exposición se produce entre comidas (Barrancos & Barrancos, 2006). 2.3.1. Género Streptococcus Jawetz et al., (2010) definió a los estreptococos como bacterias esféricas gram positivas que de manera característica forman pares o cadenas durante su multiplicación con un diámetro normal entre 0.8 y 10 µm, son anaerobios facultativos, productores de polisacáridos extracelulares a partir de la sacarosa, acidógenos y acidúricos y se adhieren al diente. Dentro de su metabolismo carecen de catalasa, cuando crecen en 15 presencia de oxígeno, su desarrollo se va a favorecer en una atmósfera del 5 – 10 % de CO2; y su tolerancia al oxígeno se debe a la presencia de peroxidasas flavínicas y pseudocatalasa; su temperatura óptima para su desarrollo es de 36±1 °C (Liébana, 1995). “La mayoría de los estreptococos de la cavidad bucal están dentro de los siguientes grupos: Streptococcus grupo salivarius, mutans, anginosus, sanguinis y mitis” (Bodoni et al., 2010). 2.3.1.1. Streptococcus mutans De acuerdo a (Silverstone et al., 1985) afirmó que el Streptococcus mutans fue descrito por primera vez en 1924 por Clarke, y ha sido extensamente estudiada en años recientes al mismo tiempo el nombre mutans se le dio debido a que cambia de manera característica de un coco a un bastón bajo ciertas condiciones de cultivo, con un pH bajo. Las células del S. mutans se especifican por ser cocos gram positivos, presentar un diámetro de 0,5 a 0,75 milimicras y disponerse en forma de cadenas. Una característica propia de esta bacteria anaerobia facultativa (es que puede usar para su metabolismo oxigeno si se encuentra presente en el medio ambiente, y puede sobrevivir cuando existe ausencia total de O2), sin embargo su crecimiento óptimo ocurre bajo condiciones de anaerobiosis (Seif, 1997). Streptococcus mutans es un microorganismo acidógeno puede fermentar los azucares de la dieta para producir principalmente ácido láctico como producto final del metabolismo y esto hace que descienda el pH y se desmineralice el esmalte dental; es acidófilo puede resistir al acidez del medio bombeando protones (H+) fuera de la célula y también acidúrico por la capacidad de producir ácido en un medio de pH bajo (Chamarro et al. 2013). “En cultivos de agar sangre, las colonias de microorganismo son fácilmente diferenciadas: altas, convexas, pulvinadas, mucoides y opacas con un aspecto que recuerda al vidrio esmerilado” (Gutiérrez, 2006). Barrancos & Barrancos (2006) reportaron que el S. mutans se relaciona con la biopelícula cariogénica, antes de la formación de la caries dental. Para Negroni (2009) el mutans está relacionado con el comienzo de la caries dental. (Valencia et al., 2009) reconocieron que este microorganismo es de mayor poder cariogénico y se considera el iniciador de la caries dental, dado que desencadena el proceso que conduce a la 16 desmineralización inicial y hace posible la penetración de bacterias en el tejido duro dental. De acuerdo a Marsh & Martin (2011), los Streptococcus mutans son regularmente aislados de la placa dental en los sitios cariados, pero su prevalencia es baja en esmalte sano. El S. mutans se encuentra en forma permanente en la cavidad oral después de la erupción dental, debido fundamentalmente a que requiere la presencia de tejido duro no descamativo para su colonización ya que la principal fuente de adquisición y transmisión de S. mutans en los niños es la saliva de sus madres; estas evidencias provienen de diferentes estudios que han mostrado un idéntico patrón de ADN cromosomal en las bacterias de los niños y de sus madres (Gutiérrez, 2006). El Streptococcus mutans produce polisacáridos extracelulares a partir de la sacarosa que es fundamental para la colonización y mantenimiento de este microorganismo en el diente, por otra parte, puede sintetizar polisacáridos intracelulares y ello le permite obtener energía y conservar la producción de ácido láctico durante largos periodos , también produce dextranasas y fructanasas, estas enzimas metabolizan los polisacáridos extracelulares, lo cual favorece la producción de ácido, independientemente de que constituyen un sustrato durante los periodos en que disminuye el aporte exógeno (Higashida, 2009). Hay un gran interés en los Streptococcus mutans debido a su papel etiológico de la caries dental, se han reconocido nueve serotipos (a-h, y k), basados en la especificidad serológica de los antígenos del carbohidrato situados en la pared celular. Marsh & Martin (2011). Considerándose que son capaces de unirse a la superficie dental por medio de dos mecanismos: 1) unión a la película adquirida por medio de proteínas extracelulares (adhesinas) localizadas en las fimbrias (cubierta peluda) de estos organismos; y 2) mecanismos dependientes de la sacarosa. (Harris & García 2005). 17 Tabla No.1. Clasificación Streptococcus mutans Grupo Mutans Especie Serotipos S. mutans Serotipo c, e, f, k S. ferus Serotipo c S. macacae Serotipo c S. downei Serotipo h S. Sobrinus Serotipo d, g S. cricetus Serotipo a S. rattus Serotipo b Tomado de Bordoni et al. (2010) y Ojeda et al. (2013) Autora: Karla Neira. 2.3.2. Género de Lactobacillus sp. Harris & García (2001) mencionaron que los lactobacilos son acidógenos (productores de ácido) y acidúricos (tolerantes al ácido). Por otro lado Silverstone et al., (1085) señalaron que son anaerobios facultativos, bastoncitos grampositivos, negativos a la catalasa y su capacidad única para sobrevivir y crecer en niveles bajos de pH de 5.0 aproximadamente, inhibe el crecimiento de la mayoría de las demás bacterias y permite el reconocimiento de las colonias. Desde el punto de vista de su morfología, los lactobacilos son pleomórficos, pero debido que se divide en un solo plano, nunca presentan ramificaciones; suele aparecer asociados en parejas, cadenas empalizadas o frecuentemente aisladas en cuanto a los cultivos, la temperatura óptima es de 36±1 °C (Liébana, 1995). Son comúnmente aislados de la cavidad oral, especialmente la placa dental y la lengua, aunque usualmente abarquen menos del 1% de la microflora cultivable total; las especies más comunes son L. casei, L. rhamnosus, L. fermentum, L. acidophilus, L. salivarius, L. plantarum, L. gasseri, L. oris (Marsh & Martin, 2011). 18 2.3.2.1. Lactobacillus acidophilus Higashida (2009), señaló que el lactobacillus acidophilus es un gran productor de ácido láctico, igual que el Streptococcus mutans, algunas cepas de lactobacilos sintetizan polisacáridos extracelulares e intracelulares a partir de la sacarosa, sin embargo, tienen poca afinidad por la superficie del diente. En consecuencia los Lactobacillus aparecen una vez que la lesión ya se ha establecido y siempre en lesiones que son progresivas también aparecen en situaciones de retención de la cavidad bucal como obturaciones desbordante, bandas ortodóncicas, prótesis y dietas con abundantes consumo de sacarosa (Rioboo, 2002). Según Negroni (2009) los lactobacilos presentan poca afinidad por las superficies dentarias y, en consecuencia, no se los implica en el comienzo de la caries de esmalte; no obstante, son los primeros relacionados con el avance de la caries de dentina; actúan principalmente como “invasores secundarios”. Además Herazo (2011) mencionó que según un estudio realizado en el 2010 “Lactobacillus acidophilus” disminuye la adhesión de los estreptococos solamente si se adiciona después de la formación de la biopelícula, siendo así se disminuía significativamente la adhesión y para disminuir el potencial cariogénico de estreptococos. Morales (2007) mencionó que según Regezi (1991) y Barrancos (1993) los microorganismos causantes de caries son Streptococcus mutans y Lactobacillus acidophilus, estos últimos se encuentra en grandes cantidades en la boca con pacientes con caries rampante y ésta aparece después del inicio de caries. Además Negroni (2009) refiere que por su metabolismo oxidativo y fermentativo se conocen como “homofermentativas” a las especies que producen ácido láctico a partir de la glucosa y “heterofermentativas” las que además de ácido láctico elaboran otros productos, como ácido acético, etanol y dióxido de carbono, en la cavidad bucal existen los “homofermentativas” se relacionan con la caries dental. 19 2.4. Dentífricos 2.4.1. Origen Contreras et al., (2014) mencionaron que a partir de los estudios de Miller en los laboratorios de Koch, cambiaron el concepto del origen de la caries dental, postulándose que los ácidos producidos en la superficie del diente son producto de la fermentación bacteriana de los azúcares de los alimentos, por lo tanto los científicos iniciaron la elaboración de pastas dentales bajo una nueva perspectiva, con el fin de neutralizar la acidez de la placa dental y los antisépticos puedan luchar contra los gérmenes. De las primeras pastas de dientes que se tienen registro son las que se utilizaban en un manuscrito de Egipto en el Siglo IV A.C. que establece una mezcla de pimienta, sal pulverizada, hojas de menta, iris y flores a las que llamaron CLISTER, además en su proceso de fabricación se utilizaba piedra pómez, uñas de buey, cáscara de huevo y mirra. La pasta de dientes de los griegos y romanos estaban basadas en orina humana, porque se consideraba que ésta contenía elementos blanqueadores (Acuña, 2008). Expósito y col. (2012) han atribuido que el primer dentífrico comercializado apareció en Gran Bretaña a finales del siglo XVII, pero fue Washington Sheffeld en 1850, quién inventó la primera pasta de diente quien llamó Creme Dentifrice. Lucius S., su hijo utilizó tubos metálicos de pinturas y colocó la pasta en este tipo de envases. Los Mayas utilizaban como pasta de dientes algunas sustancias de procedencia animal o vegetal como las raíces de la especie denominada chacmun, que aplicaban contra los dientes para tratar las caries, las molestias dentales y halitosis (Acuña, 2008). Por otro lado Expósito y col. (2012) mencionaron que tras la Segunda Guerra Mundial, aparecieron detergentes sintéticos que sustituyeron al jabón utilizado en las pastas dental, tales como Lauril sulfato de sodio. Mc Donald (1998) menciona a principios de la década de los cincuenta identificaron el primer dentífrico con flúor capaz de disminuir la incidencia de caries dental, este dentífrico contenía fluoruro de estaño junto con pirofosfato cálcico, como agente limpiador y pulidor, y tras 20 estudios clínicos fue aceptado en 1964 como el primer 20 dentífrico terapéutico por el Concil on Dental Therapeutics de la American Dental Association. Muchas de las innovaciones en la pasta de dientes fueron después del avance del fluoruro, a partir de 1980 la atención se centró en otras dos problemáticas, el sarro y la hipersensibilidad dental, alrededor de 1990 las pastas dentales fueron dirigidas a eliminar el sarro y promover unas encías saludables al introducir el bicarbonato de sodio y otros ingredientes (Expósito y col. (2012). La evidente evolución científica y tecnológica de las pastas dentales nos lleva a la actualidad a observar en el mercado una amplia gama de opciones como el color, el sabor, la textura, la presentación y el precio son algunos de los parámetros en la selección de la pasta dental (Acuña, 2008). 2.4.2. Definición Las pastas dentífricas son suspensiones homogéneas de sólidos en agua, que dan lugar a un producto de aspecto cremoso de consistencia semisólida y fácil de usar con un cepillo dental, además la limpieza la realizan por fricción, arrastrando y eliminando la placa que se encuentra sobre el diente, aparte de su acción limpiadora, las pastas dentífricas pueden tener una actividad específica de prevención o tratamiento de patologías bucales, así obtenemos: pastas dentales desensibilizantes, gingivales (Muñoz, 2012). Los dentífricos anticaries, antiplaca, son cremas o geles compuestos de diferentes sustancias químicas, con el fin de facilitar la eliminación o interrupción de la placa dental y permitir la administración de flúor en las superficies del diente (Magalhaes, 2011). Carmona, Gonzáles & Lujan (2013) el uso de pastas dentales para prevención de caries se considerada la estrategia preventiva de mayor eficacia, aunque es necesario realizar protocolos adecuados al riesgo individual, gravedad de la lesión y edad, para prevenir efectos secundarios irreversibles. Una pasta dental adecuada aumenta los beneficios del cepillado por lo tanto, una pasta dentífrica se compone de un producto abrasivo y un agente cariostático (Victoria & Grupo Infancia Adolescencia, 2011). 21 2.4.3. Características Según Contreras et al., (2014) una buena pasta dental debe reunir las siguientes características: Cuando se utiliza adecuadamente con un cepillo de dientes eficaz y una frecuencia adecuada, debe eliminar los detritos alimentarios, placa bacteriana y manchas. Debe dejar en la boca una sensación de frescura y limpieza. Su costo debe permitir su uso regular. Ser inocuo y agradable para su uso. Ser estable en las condiciones de almacenamiento y uso, y no producir irritación en la encía o cualquier otra parte de la cavidad bucal. Poseer el grado de abrasividad idóneo para poder proceder a la eliminación de la placa dentobacteriana con el mínimo daño del esmalte dentario. Nahás, (2009) ha mencionado que la eficacia de los dentífricos reside en la capacidad de interferir con la iniciación y progresión de la lesión de caries así mantener el equilibrio mineral de los dientes; también es capaz de reponer pérdidas minerales que ya ocurrieron en el tejido dentario. 2.4.4. Composición Tabla No.2. Composición de la pasta dental. Constituyentes de la pastas dentales Ingredientes Porcentajes Abrasivos 20 a 40 Agua 20 a 40 Humectantes 20 a 40 Espumantes (jabón o detergente) 1a2 Fijador hasta 2 Saborizante hasta 2 Edulcorante hasta 2 Agente terapéutico hasta 5 Colorante o conservador menos de 1 Tomado de: Harris & García, (2001). Autora: Karla Neira. 22 2.4.4.1. Abrasivos Un abrasivo puede ser definido como agentes pulidores sólidos cuya función es eliminar la biopelícula que se deposita sobre la superficie de un diente (Rioboo, 2002). Los agentes abrasivos que encontramos en los dentífricos son productos inorgánicos insolubles , se incorporan en la fórmula con el propósito de facilitar la limpieza mecánica del cepillo de dientes y reducir el tiempo necesario para la limpieza de la superficie dental , su efecto limpiador depende de su capacidad para eliminar la placa con la mínima abrasión por lo tanto es importante el tamaño de partícula del abrasivo seleccionado para evitar la sensación arenosa en el cepillo, un tamaño medio aconsejado seria 15 µm (Muñoz, 2012). Los abrasivos de uso más común son: carbonato de calcio, fosfatos de calcio, óxidos de silicio, óxidos de aluminio, bicarbonato y pizarra, siendo los abrasivos por lo general no dañan el esmalte, pero pueden opacar el brillo dental , para compensar esto, se agregan pulidores a la formulación del dentífrico (Harris & García, 2011). 2.4.4.2. Humectantes Es necesario incorporar un humectante para prevenir el secado de la pasta dental ya que en un principio, el único humectante utilizado con una solución de 50% de glicerina en agua, éste es un perfecto humectante, ya que es estable, no tóxico, tiene ciertas propiedades solubilizantes y contribuye a dar cierto dulzor a la pasta dental, actualmente ha sido reemplazado por una solución de al 70% de jarabe de sorbitol, con similares propiedades pero más económico (López, 2010). 2.4.4.3. Detergentes Los detergentes refuerzan la acción limpiadora de una pasta dentífrica y mantienen en solución a la placa ya separada del diente, además actúan como disolvente para sustancias no solubles en agua en su forma primaria, tales como los aromáticos, los detergentes también reducen la tensión superficial de la saliva, de forma que puede tener lugar un mejor humedecimiento de la superficie del diente y hacen posible, por ejemplo, 23 el trasporte de los fluoruros a zonas de muy difícil acceso (espacios interproximales, fisuras). El detergente que se emplea con mayor frecuencia es las pastas dentales es el laurilsulfato de sodio en una concentración de 0,5-2%, éste actúa sobre la encía de forma curativa, más que nociva (Zimmer et al., 1994). 2.4.4.4. Espesantes y fijador Según Muñoz, (2012) son indispensables para mantener la suspensión estable, éste componente aumenta la viscosidad del dentífrico y mantiene unidad las partículas del abrasivo. Encontramos las sílices y las gomas que influyen principalmente en la viscosidad de la pasta dental, el tamaño medio de las partículas de las sílicas espesantes es de 4µm (Contreras et al., 2014). 2.4.4.5. Saborizantes El sabor de las pasta dentales, junto a su olor, son factores que hacen grato su uso, en términos generales un dentífrico debe ser, desde el punto de vista del sentido del gusto, agradable, producir una inmediata reacción gustativa y tener una larga proporcionada y grata distribución de la sensación en el tiempo (Rioboo, 2002). Para proporcionar el sabor deseado se acostumbra mezclar aceites esenciales y sabores sintéticos, la menta verde, yerbabuena, la gaulteria, la canela y otros sabores dan al dentífrico un gusto placentario (Harris & García, 2001). 2.4.4.6. Edulcorantes Los principales edulcorantes no cariogénicos que se utiliza dentro de la composición de los dentífricos son la sacarina, el ciclamato, el sorbitol y el manitol. El sorbitol y el manitol también pueden servir como humectantes. En la actualidad se encuentra el xilitol que tiene la capacidad anticaries al facilitar la remineralización de las lesiones cariosas incipientes (Harris & García, 2001). 24 2.4.4.7. Conservante En la práctica común se utiliza la adición de conservantes a la formulación de una pasta dental para protegerla del efecto de los microorganismos, el agente gelificante, por ejemplo, puede ser particularmente vulnerable para esta finalidad se utilizan formol y benzoato y p-hidroxibenzoatos. Hoy en día es menos común el uso de conservantes por una variedad de razones. En la actualidad, el formol y el benzoato sódico los prohíben ya que no son efectivos a pH neutro y valores más altos, por lo tanto los componentes saborizantes tienen por sí mismo cierta acción antibacteriana, así como poseen algunos de los ingredientes activos que en la actualidad se utilizan (Wilkinson & Moore, 1990). 2.4.4.8. Agentes Terapéuticos En las últimas décadas se han establecido una gran variedad de cambios en la composición de los dentífricos, especialmente la utilización de las pastas dentales como un sistema de administración de agentes terapéuticos a la cavidad oral, entre las que se encuentran las empleadas para la prevención de la caries dental (Contreras et al., 2014). El principio activo indiscutible para la prevención de la caries es flúor, las sales de flúor más utilizadas son el fluoruro sódico, el monoflurofosfato de sódico y los fluoruros de aminas, ya que presentan una buena solubilidad, poca toxicidad y gran capacidad de liberar el ión flúor a un pH ligeramente ácido, las concentraciones de fluoruro en las pastas dentífricas oscila entre 1.000 y 2.500 ppm. (Muñoz, 2012). Actualmente, extractos de plantas han sido incorporados a la fórmulas de los dentífricos, que además desempeñar funciones cosméticas, tiene el objetivo principal de mejorar la acción antimicrobiana y actuar como agentes terapéuticos, la acción terapéutica de los dentífricos no está relacionada únicamente a la presencia de flúor en su composición, visando la prevención y ó la reversión de lesiones de caries incipientes, sino que también otras substancias están siendo incorporadas a las fórmulas. Basado en lo antes citado, los extractos de plantas como la salvia, han sido incorporadas a las formulas dentífricas con el intuito de reducir la halitos, combatir la gingivitis y actuarían sobre una masa de bacterias extremadamente organizadas que se adhieren 25 selectivamente a las superficies dentales y constituyente del biofilm dentario (Barreto et al., 2005). 2.5. Aloe vera Villalobos, Salazar & Ramírez (2001) citaron que la especie Aloe barbadensis, conocida como Aloe vera o Aloe de Curacao (sábila), por sus propiedades curativas ha sido utilizaba por el hombre desde la antigüedad y en 1930 se inicia la investigación de sus efectos medicinales, confirmándose su acción laxante, antiulcerosa, antituberculosa, analgésica, antiinflamatoria, cicatrizante, hetaprotector, la actividad antimicrobiana del jugo de las hojas frescas frente a Staphylococcus aureus, Streptococcus pyogenos, Corynebacterium xerosis y la efectividad del polvo de las hojas secas ante Pseudomonas aeroginosas y Proteus vulgaris. 2.5.1. Composición Química General Vitaminas: A, C, E, B1, B2, B6, B12, ácido fólico y colina. Minerales: glucosa-6-fosfato, manosa-6-fosfato, fructosa, glucomanamos como el acemanano, glicoproteína como elaprogen y el C-glucosil cromona, aloérico (manosa, glucosa, arabinosa y galactosa). Ácidos grasos (esteroides): colesterol, campesterol, β-sisosterol y lupeol. Aminoácidos: 20 de los 22 aminoácidos del ser humano y 7 de los 8 esenciales. Hormonas: auxinas y giberilinas. Metabolitos secundarios: lignina, saponinas, ácido salicílico y taninos. Enzimas: amilasa, bradiquinasa, catalasa peroxidasa y superoxido-disminutasa (Alarcón & Fernández Da Silva, 2013). 26 2.5.2. Aloe Vera en Odontología Tomando en consideración los efectos antiinflamatorios, antimicrobianos y cicatrizantes de tejidos del Aloe vera, su aplicación en Odontología es muy amplia basado en la enfermedad periodontal y la caries dental, patologías multifactoriales de alta prevalencia a nivel mundial, tienen un componente infeccioso con destrucción de tejido (Alarcón & Fernández Da Silva, 2013). Aloe vera en los dentífricos es eficaz en el control de bacterias que causan caries respecto a otras pastas de dientes de uso comercial en el medio, el gel de la Aloe vera tiene la capacidad de matar y eliminar microorganismos dañinos se debe a los compuestos llamados antraquinonas, que son antiinflamatorias (Mangaiyarkarasi et al., 2015). Calixto, (2006) señala dentro de los componentes de la Aloe vera se encuentra polisacáridos y uno de ellos es el acemanano, el cual induce la proliferación de células fibroblásticas que aumentan la proporción de la actividad metabólica y replicación celular, fundamentales en el proceso de curación. El gel de Aloe vera utilizado bajo la forma de enjuage bucal al 50% disminuye la cantidad de placa y la inflamación gingival, aloe vera contiene bradiquinasa, la cual ejercería la acción antiinflamatoria a nivel gingival, su acción enzimática reduce el dolor y disminuye la dilatación de los vasos sanguíneos actuando sobre el péptido bradiquinina a nivel de su extremo carboxiloterminal (Corrales & Reyes, 2015). La acción antimicrobiana del Aloe vera es efectiva contra L. acidophilus y S. mutans (responsable del desarrollo de caries dental y enfermedad periodontal), de la Candida albicans, y del A. aggregatibacter, P. gingivalis y B. fragilis causante de enfermedad periodontal, adicionalmente, su actividad antiviral se demostró contra el virus herpex simplex tipo II (Alarcón & Fernández Da Silva, 2013). La aplicación de Aloe vera liofilizado en dientes con exposición pulpar, produce regeneración del complejo pulpo dentinario, demostrado por estudio histopatológico, lo mismo que con la aplicación de acemanano, donde además se ha demostrado ausencia de necrosis superficial. De acuerdo a los estudios realizados, la Aloe vera podría ser un agente 27 antimicrobiano en las formulaciones de los dentífricos y para el control de bacterias causante de la caries. El uso odontológico de Aloe vera es múltiple, como antiséptico poderoso donde la limpieza normal es difícil, sus propiedades antifúngicas son de gran ayuda en el problema de la estomatitis protésica en lesiones bucales agudas se mejoran mediante la aplicación directa de la misma en lesiones como aftas, úlceras bucales y las grietas que se producen en las comisuras de los labios, además ayuda en las enfermedades orales como el liquen plano, pénfigo. Incluso en pacientes asociados con sida y leucemia en el alivio de sus síntomas (Ruchi, 2012). 2.6. Arginina Uscátegui, (2010) mencionó a la arginina como un aminoácido semiesencial que se encuentra en nuestro organismo que se convierte en esencial durante las situaciones hipermetabólicas y sépticas es necesaria para la síntesis de colágeno en la cicatrización de las heridas, modifica la inducción y desarrollo de tumores malignos a través de sus efectos sobre el sistema inmunológico, tiene capacidad de estimular la respuesta del timo, además favorece la liberación de diferentes hormonas como la hormona del crecimiento, insulina, glucagón, catecolaminas, aldosterona y vasopresina , la arginina modula la respuesta inflamatoria e inmunológica, además también se obtiene de los alimentos o a través del ciclo de la úrea, es resistente a la exposición de ácidos provenientes de la dieta, con propiedades de baja conductancia hidráulica y con una exposición química baja en nitrógeno y carbono pero alta en oxígeno, calcio y fósforo (Espinoza et al., 2013). 2.6.1. Arginina en Odontología Muchas otras sustancias se han identificado como agente anti-caries entre estas se identificaron la arginina sustancia que podría ser capaz de controlar la caries mediante la formación de placa bacteriana ya que favorece un cambio en la composición de la flora de la boca para revertir o prevenir (Acevedo et al., 2005) 28 Entre los microorganismos menos acidúricos y que están más relacionados con la salud dental, se puede citar al Streptococcus sanguinis, microbio que contribuye a la alcanización de la placa, a través de la generación de amonio a partir de la vía de la deiminasa arginina y ureasa. Esta producción de amonio por bacterias orales influye positivamente en el equilibrio entre la nueva mineralización y la desmineralización del diente y puede ayudar a prevenir el desarrollo de la microbiota cariogénica. Dos fuentes significativas de álcali en la placa son la arginina y la úrea (Reyes et al., 2012). La actividad de arginina deiminasa, se ha asociado a un elevado nivel de arginina salival con resistencia a caries, y se ha empezado a estudiar clínicamente la capacidad de la biopelícula oral para producir álcali desde arginina y su relación con la caries. Pastas dentales que contienen arginina puede ser utilizadas para la disminución de la sensibilidad dentinaria, sobre las cuales también se ha reportado notable efecto inhibitorio en la aparición de nuevas lesiones cariosas y en su tasa de progresión, observándose que presentan resultados superiores a la sola utilización de fluoruros, constituyendo una simple y económica herramienta para reducir sustancialmente una de las enfermedades prevalentes en los niños (Reyes et al., 2012). La arginina posee una carga positiva a pH fisiológico como ingrediente en un dentífrico brinda un alivio superior contra la hipersensibilidad dentinaria, incluso en concentraciones de 8% y en conjunto con el carbonato de calcio se lo utiliza como un buen desensibilizantes (Cepeda et al., 2012). La combinación de arginina y un compuesto de calcio insoluble complementan y mejora los efectos del dentífrico con fluoruro ya que adicionalmente, actúa sobre la placa dental para reducir su patogenicidad. La arginina se metaboliza en amoníaco, el cual ayuda a neutralizar los ácidos de la placa para así prevenir los cambios de la flora de la biopelícula hacia bacterias productoras de ácido, como el S. mutans, y para mantener una placa saludable después del estímulo con azúcar. Aun más, el compuesto de calcio insoluble actúa como un reservorio de iones libres de calcio para fomentar el proceso de remineralización (Souza et al., 2103). 29 2.7. Monofluorofosfato de Sodio Monofluorofosfato (MFP) es un compuesto que contiene flúor, a menudo presente en los dentífricos. El monofluorofosfato de sodio es utilizado en estudios iniciales como en ratones y ratas indicaron que el uso de una dosis DL50 con MFP (dosis letal en el que 50% de las ratas mueren) fue tres veces mayor que NaF pero el potencial tóxico agudo de MFP no es diferente de NaF. Los altos niveles de MFP son utilizados en el tratamiento de mujeres osteoporóticas posmenopáusicas son mucho mejor tolerado que NaF, en problemas gástricos MFP es absorbida predominantemente por la mucosa intestinal donde se hidroliza en fosfato de ortofosfato y en F. Se alcalina en homogeneizados en el hígado, hueso, intestino, la saliva y la placa bacteriana de la cavidad oral, puede liberar enzimáticamente fluoruro de MFP (Lyaruu et al., 2014). Mejía & Rigalli (2013) mencionaron la administración de monofluorofosfato que favorece la reparación reduciendo el tiempo de mineralización y aumentando la calidad de hueso neoformado en ratas con un defecto óseo no crítico. 2.7.1. Monofluorofosfato de Sodio en Odontología El deseo de encontrar un dentífrico más eficaz con un principio activo y un sistema de abrasión ideal en el desarrollo de dentífricos terapéuticos, se introdujeron los principios activos del monofluorofosfato compatible con una variedad de sistemas de abrasión al igual que el fluoruro de sodio, el monofluorofosfato promueve el remplazo de la hidroxiapatita por fluorapatita en las sales dentarias y por lo tanto se puede utilizar como profiláctico anticaries. Las ventajas que tiene el monofluorofosfato frente al fluoruro de sodio son que el diente no necesita una preparación especial antes de su aplicación, es eficaz cuando se lo incluye en dentífricos, y no hay peligro de toxicidad local para las encías ni de intoxicación sistémica por ingestión (Remington, 2003). Este compuesto ha sido durante varias décadas como la fuente de fluoruro en dentífricos, está ligado más bien covalentemente que en forma iónica, el depósito de la sal del fluoruro desde el monofluorfosfato a pH bajo es ligeramente mayor que en la neutralidad, después de una compleja secuencia de reacciones el ortofosfato y los iones de fluoruro son liberados y más tarde son depositados como fluorapatita. Hay algunos indicios de que el monofluorofosfato está incorporado también como tal en la fórmula 30 del apatito, donde realmente reemplaza un grupo HPO4-2 en algunos apatitos deficitarios de calcio, el MFP ejerce su efecto cariostático de forma diferente que el NaF, ya que el MFP en la cavidad oral libera iones de fluoruro libres en líquidos orales en una extensión que puede ser similar a otros dentífricos fluorificados (Thylstrup & Fejerskov, 1988). Los dentífricos que contienen fluoruro de monofluorofosfato de sodio (MFP) como el ingrediente activo tienen un efecto anticaries, su modo de acción es controvertido. Una interacción única MFP- esmalte, se postuló originalmente, después de la demostración de que MFP puede intercambiar por grupos de fosfato en la superficie del esmalte, se descompone posteriormente al fluoruro (F-) o permanece intacta para ejercer un efecto. Por lo tanto la actividad MFPase que se encuentra a nivel dental, en la saliva y en las bacterias de la placa sugiere que la acción anti-caries de MFP puede ser debido a F- liberado de MFP en la boca, en lugar de sí mismo, las bacterias salivales hidrolizan MFP a un ritmo moderadamente rápida por ejemplo, durante los primeros 3 minutos después del cepillado dental con un dentífrico MFP, alrededor del 40% de MFP se convierte en F- sin embargo, en la placa donde los microorganismos están estrechamente empaquetados, el MFP puede hidrolizar aún más completo (Pearce & Dibdin 1995). En los preparados de monofluorfosfato de sodio, el fluoruro se encuentra unido al fosfato en forma covalente, para que este sea activo debe ser liberado por hidrólisis enzimática de la molécula de MFP durante el cepillado por acción de las fosfatasas presentes en placa y saliva. Tanto el fluoruro de sodio como el MFP se recomiendan a concentraciones de 500 ppm para niños hasta los 10 años, en territorios con fluoruración en el agua o la sal, y en concentraciones mayores a este valor para el resto de la población (Contreras et al., 2014). 31 CAPITULO III 3. MARCO METODOLÓGICO 3.1. Tipo de estudio La presente recopilación investigativa fue de carácter comparativo por el uso de 4 diluciones de tres dentífricos con agentes antibacterianos diferentes donde se midió el halo de inhibición frente al Lactobacillus acidophilus y Streptococcus mutans. Cuantitativo pues se obtuvo datos a través de la aplicación de métodos estadísticos. Descriptivo ya que se estableció las características de cada agente antibacteriano y la inhibición que provoca frente a Lactobacillus acidophilus y Streptococcus mutans. Experimental debido que se realizó en el laboratorio de microbiológico se utilizó de manera indispensable para lograr los resultados necesarios y darle importancia a la investigación. Históricos- Lógicos debido a que se realizó la revisión de la literatura actualizada sobre el tema y estudios científicos. In vitro considerando que el estudio se lo realizó en medios de cultivo que sirvieron para la inoculación de las bacterias, manejados estos en laboratorio. Transversal porque el presente estudio se ejecutó en un tiempo determinado. 32 3.2. Operacionalización de las Variables Variables Dentífricos Streptococcus mutans Lactobacillus acidophilus 3.3. Conceptos (Bordoni, 2010) Es una sustancia que se utiliza junto con la ayuda del cepillo dental para limpiar las caras accesibles de los dientes con la ayuda de sus numerosos agentes. (Martin, 2011) Es un microorganismo anaerobio, en forma esférica o en cadena, es acidógeno, ácido láctico, acidófilo y acidúrico y por lo tanto es el primer microorganismo iniciador de la caries dental. (Negrori, 2009) Son anaerobios, es acidógeno y acidófilo, tiene actividad proteolítica, es gran productor de ácido láctico, Dimensión Indicador Halo de inhibición que superen los 10mm Dilución: 4 Diluciones 1:2 1:4 1:8 1:16 Escala Nominal Milímetros Cuantitativo Tiempo 24 horas Monoflurofosfato de Sodio 0,76%. Arginina 8% Aloe Barbadensis Leaf Extract Halo de Nominal inhibición que Milímetros superen los Cuantitativo 10mm Cepa ATCC 25175 Manejo de la cepa Halo de Nominal inhibición que Milímetros superen los Cuantitativo 10mm Cepa ATCC 4356 Manejo cepa de la Población y Muestra Dado que el diseño de estudio propuesto, tuvo un alcance microbiológico in vitro, se tomó en cuenta como población la especie de cepa: Streptococcus mutans con referencia ATCC 25175 Lactobacillus acidophilus ATCC 4356 adquiridos por medio de MEDIBAC Inc.S.A. Distribuidor de Microbiologics. 33 La muestra se distribuyó en tres grupos integrados por tres dentífricos con su agente antimicrobiano respectivo: aloe barbadensis leaf extract, Arginina 8% y Monoflurofosfato de sodio 0,76%. La selección de muestra del usos de los dentífricos son comercializados de uso nacional. Para el cálculo se utilizó la siguiente formula. Dónde: n: Tamaño de la muestra p: Valor de probabilidad de éxito, donde el mayor valor es 0,5. q: Valor de probabilidad de fracaso, donde el mayor valor es 0.5. Z: Valor obtenido mediante niveles de confianza, para nuestro caso se utilizó el 95% de confianza que equivale a 1,96 (es un valor que queda a criterio del investigador). e: Limite aceptable de error de la muestra en nuestro caso es el 0,05 ( es un valor que queda a criterio del encuestador. La muestra estadísticamente es de 96. Se distribuyó 48 muestras para cada bacteria, entendiéndose que se realizaron 4 repeticiones para cada pasta dental mediante 4 diluciones 1:2, 1:4, 1:8, 1:16. 3.3.1. Criterios de Inclusión Dentífricos que contengan como agentes antibacterianos monoflurofosfato de sodio, aloe barbadensis leaf extract y arginina. Pastas dentales que no se encuentren caducadas. Cepas de Lactobacillus acidophilus y Streptococcus mutans en buenas condiciones. 34 3.3.2. Criterios de Exclusión Dentífricos que no contengan como agentes antibacterianos monoflurofosfato de sodio, aloe barbadensis leaf extract, arginina. Pastas dentales caducadas. Cepas que no correspondan a Lactobacillus acidophilus y Streptococcus mutans en buenas condiciones. 3.4. Materiales y Recursos 3.4.1. Recursos ambientales La presente investigación se desarrolló en las instalaciones de la Universidad Central del Ecuador con el apoyo de: Departamento de oferta, servicios y Productos (OPS) ubicado en la facultad de Ciencias Químicas, para la activación de la cepa Streptococcus mutans ATCC 25175 Lactobacillus acidophilus ATCC 4356 a ensayarse; así también se contó con el apoyo del Laboratorio de análisis clínico y bacteriológico, ubicado en la misma Facultad, donde se ejecutó la fase experimental. 3.4.2. Recursos humanos Para la coloración de este trabajo investigativo se tuvo especialistas en biología, biotecnología en laboratorio clínico, microbiológico y estadísticos. 3.4.3. Equipos, materiales e instrumental para la evaluación microbiológica de los dentífricos. Equipos Agitador automático. Centrifugador. 35 Cámara de irradiación. Incubadora. Refrigeración. Instrumentos para siembra microbiológica Probetas. Cajas Petri. Mechero. Tubos de ensayo. Matraz de Erlenmeyer. Gradilla. Puntas de pipetas estériles. Materiales Discos de papel filtro estériles de 6mm de diámetro. Guantes. Mascarilla. Hisopos estériles. Gorro desechable. Sustancias Agua destilada Cepas de Streptococcus mutans ATCC 25175 Lactobacillus acidophilus ATCC 4356. Agar sangre Caldo de agar Tripticasa Soya. 36 3.5. Procedimiento Tres dentífricos que se encuentran en el mercado nacional (Monoflurofosfato de Sodio 0,76 Arginina 8% y Aloe vera – Aloe Barbadensis Leaf Extract) fueron utilizados en este estudio que se llevó a cabo en el Laboratorio de Química de la Universidad Central del Ecuador, se procedió obtener una muestra de cada pasta, se realizaron cuatro diluciones de cada una, las diluciones son para obtener una muestra clara y precisa de cada pasta dental. Figura 2. Figura No. 2. Dentífricos utilizados. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Se procede a realizar las diluciones de las pastas dentales, para ello se procedió de la siguiente manera. Se colocó 4 tubos para hacer diluciones, en el tubo de ensayo 1 se colocó 10ml de agua destilada estéril y 5ml en cada uno de los 3 tubos restantes, cada uno de los tubos de ensayo previamente etiquetados con las diluciones respectivas y el nombre de la pasta respectiva. Figura 3, 4 y 5. 37 Figura No. 3. Peso del dentífrico. Autora: Karla Neira Fuente: Laboratorio de Ciencias Químicas. Se pesaron 5gr de cada pasta dental y se colocó en el tubo de ensayo 1, con los 10ml de agua destilada estéril obtuvo una solución homogénea 1:2 y luego se tomó 5 ml de la dilución 1:2 se colocó en el segundo tubo de ensayo y así se obtuvo la dilución 1:4, 1:8, 1:16 y previamente se disminuirá la concentración de la solución madre. Barreto (2005) refiere que la preparación de los sobrenadantes de cada dentífrico se realizada en base a los componentes solubles en agua de los dentífricos que son los responsables por la acción antimicrobiana de los mismos Figura 3, 4 y 5. Figura No. 4. Colocación de agua destilada. Autora: Karla Neira Fuente: Laboratorio de Ciencias Químicas 38 Figura No. 5. Obtención de todas las diluciones. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Por lo tanto las diluciones se centrifugaron durante 15 minutos a 3500 rpm, con el objetivo de precipitar las partículas sólidas de los dentífricos. Figura 6 y 7. Figura No. 6. Centrífugadora Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. 39 Figura No. 7. Soluciones después del centrifugado donde se observa el sobrenante y el precipitado. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Se manipuló una pipeta para colocar 20ul (microlitos) del sobrenadante de cada dilución, el mismo que fue calibrado con una micropipeta, cabe destacar que para cada agente antimicrobiano se usaron diferentes puntas desechables, y los discos de papel fueron esterilizados y colocados con una pinza en la caja Petri. Por lo tanto se llevó a cabo el método difusión con discos (Kirby- Bauer) (Sentila,et al., 2011). Figura 8. Figura No. 8. Colocación del sobrenante en los disco. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. 40 La cepa de Streptococcus mutans con referencia ATCC 25175 Lactobacillus acidophilus ATCC 4356. Fue obtenida comercialmente a través del laboratorio MEDIBAC. Se preparó a partir de un cultivo líquido Caldo Soya Tripticasa (TSB) para activar la cepa microbiana, fueron inoculadas en agar sangre base. Figura 9. Figura No. 9. Suspensión bacteriana que contiene la cepa ATCC 25175 de Streptococcus mutans y Lactobacillus acidophilus ATCC 4356. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Para el inóculo bacteriano se necesitó de una dilución de 10ml de suspensión bacteriana ( es decir 1ml del tubo madre de la bacteria más 9 ml de suero fisiológico) Se ajustará la turbidez del inóculo escala a 0.5 Mc. Farland, (1,5×108 UFC/mL) ,la inoculación de las placas y luego de 15 minutos de ajustado el inoculo se procederá con un hisopo estéril a tomar la muestra y se procedió a inocular la superficie seca del agar sangre por hisopado en tres direcciones para certificar una completa distribución del inóculo. Figura 10, 11 y 12. 41 Figura No. 10. Escala Mc. Farland Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Figura No. 11. Toma de muestra con hisopo del inóculo. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. 42 Figura No. 12. Hisopado en tres direcciones. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas Las cajas fueron rotulas con cada dilución y dentífrico. Figura 13. Figura No. 13. Rotulación de las cajas Petri. Autor: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Colocación de los discos de antibiograma impregnados de (Monoflurofosfato de Sodio 0,76%, Arginina 8%, Aloe Barbadensis Leaf Extract) con una pinza estéril en las placas Petri y discos para el control negativo se utilizó agua estéril. Figura 14. 43 Figura No. 14. Discos colocados. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Se colocaron en jarras de anaerobiosis Gaspak, se incubaron las placas a 370C durante 24 horas para Streptococcus mutans y para Lactobacillus en una atmosfera de microaerofilia. Figura 15. Figura No. 15. Jarra de anaerobiosis Gaspak, incubación. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Acontecidas las 24 horas de incubación se procedió a medir los halos de inhibición alrededor de los discos (milímetros) usando una regla. Figura 17, 18 y 19. Según Alves (2009) refiere que el agente antimicrobiano contenido en el disco ha de ser lo suficiente potente para producir al menos halos de inhibición de 10mm de 44 diámetro y de ahí los valores de los halos de inhibición serán tomados los 10mm según la metodología de Alves. Figura No. 16. Regla microbiológica. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Figura No. 17. Halos de inhibición de Lactobacillus acidophilus y Streptococcus mutans con arginina 8%. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. 45 Figura No. 18. Halos de inhibición de Lactobacillus acidophilus y Streptococcus mutans Aloe vera – Aloe Barbadensis Leaf Extract. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. Figura No. 19. Halos de inhibición de Lactobacillus acidophilus y Streptococcus mutans con Monoflurofosfato de Sodio 0,76%. Autora: Karla Neira. Fuente: Laboratorio de Ciencias Químicas. 46 CAPITULO IV 4. ANÁLISIS DE DATOS 4.1. Recolección de Datos Con los datos obtenidos en el Laboratorio de Ciencias Químicas de la Universidad Central Del Ecuador, la recopilación de datos se realizó mediante las mediciones en milímetros, los halos de inhibición de la acción antimicrobiana de las pastas dentales distribuidas en diluciones, para estos resultados se realizó una tabla de datos. Tabla 3. Tabla No.3. Resultados del halo de inhibición para Streptococcus mutans. PASTA ARGININA ALOE VERA MONOFLUOROFOSFATO SODIO CONTROL NEGATIVO AGUA DESTILADA ESTÉRIL DILUCIÓN 1:2 1:4 1:8 1:16 50% 25% 12,5% 6,25% HALO DE INHIBICIÓN (mm) 14 12 10 10 13 11 9 8 14 10 8 8 13 12 10 8 1:2 1:4 1:8 1:16 50% 25% 12,5% 6,25% HALO DE INHIBICIÓN (mm) 12 11 8 8 13 11 9 7 13 10 9 8 12 10 9 8 1:2 1:4 1:8 1:16 50% 25% 12,5% 6,25% HALO DE INHIBICIÓN (mm) DE 11 8 7 6 10 7 6 6 12 9 7 7 10 8 7 6 HALO DE INHIBICIÓN (mm) 0 0 0 0 Autora: Karla Neira. Fuente: laboratorio de Ciencias Químicas. 47 Tabla No.4. Resultados del halo de inhibición para Lactobacillus acidophilus. PASTA DILUCIÓN 1:2 1:4 1:8 1:16 50% 25% 12,5% 6,25% HALO DE INHIBICIÓN (mm) ARGININA 10 8 7 7 12 8 8 7 10 7 7 6 11 10 8 7 1:2 1:4 1:8 1:16 50% 25% 12,5% 6,25% HALO DE INHIBICIÓN (mm) ALOE VERA 12 7 6 6 10 8 6 6 11 7 7 6 10 7 6 6 1:2 1:4 1:8 1:16 50% 25% 12,5% 6,25% HALO DE INHIBICIÓN (mm) Monofluorofosfato De Sodio 11 6 6 6 10 7 6 6 9 8 6 6 10 7 7 6 CONTROL NEGATIVO HALO DE INHIBICIÓN (mm) AGUA DESTILADA ESTÉRIL 0 0 0 0 Autora: Karla Neira. Fuente: laboratorio de Ciencias Químicas. Se observó que a mayor dilución, el halo de inhibición y por lo tanto la efectividad fue disminuyendo, así mismo se observan valores de halo de inhibición de mayor diámetro para el grupo en que se empleó Arginina. En forma comparativa los halos presentaron menor diámetro en esta cepa que en Streptococcus mutans. A partir de estos datos se procedió a estimar los estadísticos descriptivos que se indican en las tablas 5 y 6. 48 Tabla No.5. Halo de inhibición por tipo de pasta para Streptococcus mutans PASTA Estadístico D1:2 (SM) D1:4 (SM) D1:8 (SM) D1:16 (SM) Arginina Media 13,5 11,3 9,3 8,5 Mínimo 13,0 10,0 8,0 8,0 Mediana 13,5 11,5 9,5 8,0 Máximo 14,0 12,0 10,0 10,0 0,6 1,0 1,0 1,0 Media 12,5 10,5 8,8 7,8 Mínimo 12,0 10,0 8,0 7,0 Mediana 12,5 10,5 9,0 8,0 Máximo 13,0 11,0 9,0 8,0 0,6 0,6 0,5 0,5 Monofluorofosfato Media 10,8 8,0 6,8 6,3 de Sodio Mínimo 10,0 7,0 6,0 6,0 Mediana 10,5 8,0 7,0 6,0 Máximo 12,0 9,0 7,0 7,0 1,0 0,8 0,5 0,5 Desviación estándar Aloe Vera Desviación estándar Desviación estándar Fuente: Investigación. Elaboración: Karla Neira. Al analizar el halo de inhibición para una misma dilución las distintas pastas dentales mostraron diferentes valores medio del diámetro del halo, finalmente se puede observar que hacia la dilución 1:16 no se reportan halos de inhibición, es decir la eficacia antimicrobiana es evidente en la dilución 1:2 y 1:4. Tabla 5 49 Gráfico No.1. Halo de inhibición por tipo de pasta para Streptococcus mutans. 14,0 12,0 13,5 Arginina 12,5 10,8 11,3 Aloe Vera 10,5 Monofluorofosfato de Sodio 9,3 10,0 8,0 8,8 8,0 8,5 6,8 7,8 6,3 6,0 4,0 2,0 0,0 D1:2 (SM) D1:4 (SM) D1:8 (SM) D1:16 (SM) Fuente: Investigación. Elaboración: Karla Neira. Para el caso de Streptococcus mutans el halo formado frente a la presencia de Arginina fue de diferencia significativa respecto la de Aloe vera en las diluciones 1:2 y 1:4 ( p <0,05), en tanto que no existió diferencia con respecto a la de Aloe vera para las diluciones 1:8 y 1:16. Respecto a la de monofluorofosfato de sodio si existió diferencia para todas las diluciones (p <0,05). Gráfico 2. 50 Tabla No.6. Halo de inhibición por tipo de pasta para Lactobacillus acidophilus. PASTA Estadístico D1:2 (LA) D1:4 (LA) D1:8 (LA) D1:16 (LA) Arginina Media 10,8 8,3 7,5 6,8 Mínimo 10,0 7,0 7,0 6,0 Mediana 10,5 8,0 7,5 7,0 Máximo 12,0 10,0 8,0 7,0 1,0 1,3 0,6 0,5 Media 10,8 7,3 6,3 6,0 Mínimo 10,0 7,0 6,0 6,0 Mediana 10,5 7,0 6,0 6,0 Máximo 12,0 8,0 7,0 6,0 1,0 0,5 0,5 0,0 10,0 7,0 6,3 6,0 Mínimo 9,0 6,0 6,0 6,0 Mediana 10,0 7,0 6,0 6,0 Máximo 11,0 8,0 7,0 6,0 0,8 0,8 0,5 0,0 Desviación estándar Aloe Vera Desviación estándar Monofluorofosfato Media de Sodio Desviación estándar Fuente: Investigación. Elaboración: Karla Neira. Al analizar el halo de inhibición para una misma dilución las distintas pastas dentales mostraron diferentes valores medio del diámetro del halo, finalmente se puede observar que hacia la dilución 1:4, 1:8 y 1:16 no se reportan halos de inhibición, es decir la eficacia antimicrobiana es evidente en la dilución 1:2 . Tabla 6. 51 Gráfico No.2. Halo de inhibición por tipo de pasta para Lactobacillus acidophilus 12,0 Arginina 10,8 10,8 Aloe Vera 10,0 10,0 8,3 7,5 7,3 7,0 8,0 6,3 6,3 6,8 6,0 6,0 6,0 4,0 2,0 0,0 D1:2 (LA) D1:4 (LA) D1:8 (LA) D1:16 (LA) Fuente: Investigación. Elaboración: Karla Neira. Lactobacillus acidophilus solo para 1:2, presentó efecto antibacteriano tanto para la Arginina, Aloe vera y con monofluorofosfato de sodio. Gráfico 3. Los datos obtenidos fueron sometidos a la prueba de Kolmogorov Smirnov determinó que ninguna de las dimensiones de estudio cumplió con el criterio de normalidad, por lo que fue necesario acudir a las pruebas no paramétricas; Kruskal Wallis para la comparación múltiple y U Mann Whitney para los pares correspondientes. 52 Tabla No.7. Resultados de la prueba de Kruskal Wallis Cepa Dilución Significancia Dilución 1:2 ,001 Dilución 1:4 ,001 Dilución 1:8 ,001 Dilución 1:16 ,004 Dilución 1:2 ,440 Dilución 1:4 ,178 Dilución 1:8 ,01 Dilución 1:16 ,007 Streptococcus mutans Lactobacillus acidophilus Fuente: Investigación. Elaboración: Karla Neira. Se observa que dentro de cada cepa y para cada dilución al comprar los halos de inhibición, existieron diferencias significativas entre las tres pastas para Streptococcus mutans en todas las diluciones, mientras que para Lactobacillus solo se dio diferencia para las diluciones 1:8 y 1:16 (p<0,05). En las diluciones 1:2 y 1:4 no se presentó diferencia significativa. Tabla No.8. Media del halo formado por cepa, dilución y tipo de pasta. Streptococcus mutans Lactobacillus acidophilus Dilución Dilución Dilución Dilución Dilución Dilución Dilución Dilución PASTA 1:2 1:4 Arginina 13,5 11,3 9,3 8,5 10,8 8,3 7,5 6,8 Aloe Vera 12,5 10,5 8,8 7,8 10,8 7,3 6,3 6,0 10,8 8,0 6,8 6,3 10,0 7,0 6,3 6,0 Monofluorofo sfato de Sodio 1:8 1:16 1:2 1:4 1:8 1:16 Fuente: Investigación Elaboración: Karla Neira. Tomando como base que un halo mayor a 10mm denotaría efectividad se puede observar que en los casos de Arginina para Streptococcus mutans resulta efectiva para diluciones de 1; 2 y 1; 4 y para Lactobacillus acidophilus solo para 1:2, lo mismo sucedió con Aloe Vera, que fue efectiva en esta misma dilución. El monofluorofosfato de sodio solo fue efectivo para Streptococcus mutans a la dilución 1:2. Tabla 8. 53 Gráfico No.3. Media del halo formado por cepa, dilución y tipo de pasta. 14,0 13,0 13,5 12,0 11,0 Arginina Aloe Vera Monofluorofosfato de Sodio 12,5 11,3 10,8 10,8 10,5 10,8 10,0 10,0 9,3 8,8 9,0 8,5 8,0 8,3 7,8 8,0 7,3 6,8 7,0 7,5 7,0 6,3 6,8 6,3 6,3 6,0 6,0 6,0 5,0 Dilución 1:2 Dilución 1:4 Dilución 1:8 Dilución 1:16 Dilución 1:2 Streptococcus mutans Dilución 1:4 Dilución 1:8 Dilución 1:16 Lactobacillus acidophilus Fuente: Investigación. Elaboración: Karla Neira. Con referencia a los resultados anteriores se procedió a comprobar la diferencia significativa por pares correspondientes, encontrándose las siguientes inferencias: En la gráfica 3. Puede observarse que la efectividad depende de la dilución, encontrándose que para todas las pastas y para las dos cepas siempre existió diferencia significativa al comparar los halos de las diluciones 1:2 con las otras, la de 1:4 con las restantes y que no existió diferencia significativa entre las diluciones de los pares correspondientes entre 1:8 y 1:16. Tomando como base que un halo mayor a 10mm denotaría efectividad, se puede observar que en los casos de Arginina para Streptococcus mutans resulta efectiva para diluciones de 1; 2 y 1; 4 de 13.5mm y 11.3mm y para Lactobacillus acidophilus solo para 1:2 de 10.8mm, lo mismo sucedió con Aloe vera, que fue efectiva en estas mismas diluciones tanto para la dilución 1:2 fue de 12.5mm y en la dilución 1:4 de 10.5mm. El monofluorofosfato de sodio solo fue efectivo para Streptococcus mutans a la dilución 1:2 de 10.8mm por lo tanto, para las diluciones 1:2 y 1:4 y para los tres agentes antibacterianos se notó diferencia significativa en la eficacia comparativa para lactobacillus acidophilus y para Streptococcus mutans, siendo siempre mejor para esta 54 última, en tanto que a diluciones mayores no se registraron diferencias aparente. Además el control negativo, agua destilada no presentaron halos de inhibición, esto se justifica de alguna manera porque el agua no se considera antibacteriano. 4.2. Discusión La investigación fue diseñada para determinar si alguno o todas las pastas dentales con agentes antibacterianos diferentes disponibles comercialmente tienen actividad antibacteriana sobre el Streptococcus mutans y Lactobacillus acidophilus, bacterias cariogénicas. La técnica a utilizarse, ha sido la técnica microbiológica de difusión en disco, cuya característica es la facilidad y rapidez para interpretar los resultados, tal como lo ha mencionado (Sentila et al., 2011). Algo similar al presente estudio, en el cual para disminuir el error estadístico se ha determinado realizar cuatro (4) repeticiones por cada dilución de cada pasta dental y bacteria, con la finalidad de tener un nivel de confiabilidad aceptable. En la presente investigación se buscó determinar si existe inhibición de crecimiento bacteriano in vitro de Streptococcus mutans ATCC 25175 y del Lactobacillus acidophilus ATCC 4356, mediante el uso de dentífricos con diferentes agentes antibacterianos : Monoflurofosfato de Sodio 0,76%, Arginina 8%, Aloe Vera – Aloe Barbadensis Leaf Extrac, aplicando la técnica de difusión de disco, lo cual quedó demostrado, que existe efecto inhibitorio del crecimiento de Streptococcus mutans y Lactobacillus acidophilus al utilizar Monoflurofosfato de Sodio 0,76%, Arginina 8%, Aloe Vera – Aloe Barbadensis Leaf Extrac. Criterio similares se manejaron en un estudio in vitro realizado por Dilip et al., (2009) donde compararon la eficacia antimicrobiana de gel de Aloe vera con dos dentífricos populares, disponibles en el mercado. Los resultados preliminares mostraron que el gel de aloe vera diente y las cremas dentales fueron igualmente eficaces contra la Candida albicans, Streptococcus mutans, Lactobacillus acidophilus, Enterococcus faecalis, Prevotella intermedia, y Peptostreptococcus sp. El gel de aloe vera diente demostró mejora el efecto antibacteriano frente a S. mitis. Cabe mencionar que este reporte científico, también el dentífrico Aloe vera demostró efecto antibacteriano sobre el S. mutans y L. acidophilus. 55 Por su parte Fani & Kohanted (2012), demostraron en un estudio in vitro las actividades inhibidoras de gel de Aloe vera en algunas bacterias cariogénicos (Streptococcus mutans), periodontopáticas (Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis) y un periodontopathogen oportunista (Bacteroides fragilis) éstas bacterias fueron investigados por su sensibilidad al gel de Aloe vera con el método de difusión en disco y micro dilución, donde el S.mutans fue la especie más sensible de gel de aloe vera donde en la dilución 1:2 mostró una zona de inhibición de 30mm durante 72 horas a 37°C, mientras que A. Actinobacillus, P. gingivalis y B. fragilis fueron menos sensibles, con una significancia (P <0,01). Mientras que esta investigación también se utilizó el método de difusión de disco donde la Aloe vera presentó una zona de inhibición de 13.5 mm sobre el S. mutans con una atmosfera de 37°C durante 24 horas. Ehsani et al. (2013) compararon la actividad antibacteriana de la clorhexidina con tres extractos diferentes propóleos (concentraciones de alcohol: 0, 15, 40%) y gel de Aloe vera para la eliminación de las bacterias, S. aureus, S. mutans y Enterococcus faecalis, del conducto radicular, mediante tres métodos: la difusión en disco, de microdilución y prueba de contacto directo. En la técnica de difusión de disco produjo una zona de inhibición de 8,7mm sobre Enterococcus faecalis y 9,3mm sobre el S. mutans dando resultado que el efecto de gel de Aloe vera podría ser buenas opciones para la desinfección del conducto radicular en los tratamientos de endodoncia. De acuerdo a Roesler et al. (2010) evaluaron la eficacia de Aloe vera y propóleo dentífrico en la reducción de la contaminación de las cerdas del cepillo de dientes por una cepa estándar de Streptococcus mutans (ATCC 25175, SM) después de cepillarse los dientes. La Aloe vera y propóleo dentífrico presentaron reducción de la contaminación de cerdas del cepillo de SM. Sin embargo en este reporte bibliográfico se utilizó la misma cepa ATCC 25175 del S. mutans donde presentó inhibición mayor de 10mm con el uso de la pasta dental con Aloe vera. Villalobos et al. (2001) demostraron en un estudio el gel de Aloe vera utilizada en la composición del enjuague bucal experimental a un 50% de concentración disminuyendo la cantidad de placa y la inflamación gingival. En el presente estudio no se utilizó 56 enjuague bucales solo pastas dentales donde la pasta dental con Aloe vera demostró eficacia frente a las bacterias cariogénicas. Según Pradeep et al., (2012) en un estudio prospectivo, aleatorizado, placebo y ensayo clínico controlado positivamente fue diseñado para evaluar los efectos clínicos y microbiológicos de un dentífrico disponible comercialmente que contiene Aloe vera en la reducción de la placa y gingival inflamación en pacientes con gingivitis generalizada crónica, se dividieron aleatoriamente en tres grupos: grupo 1, pasta de dientes placebo; grupo 2, pasta de dientes que contiene Aloe vera; y el grupo 3, pasta de dientes con fluoruro de polímero y triclosán, la pasta de dientes que contiene Aloe vera mostró una mejoría significativa en las puntuaciones gingivales e índice de placa, así como los recuentos microbiológicos en comparación con dentífrico placebo y el triclosán. En este estudio ninguna pasta de dientes contiene triclosán, concluyendo que la pasta de dientes que contiene Aloe vera puede ser una formulación a base de hierbas útiles para agentes de control químico de la placa y el estado gingival. Sin embargo Sunitha et al. (2012) encontró que los extractos acuosos de Aloe vera en el uso de dentífrico produjo una inhibición de S. mutans (13.05mm), S. mitis (15.15mm), L. brevis (15.07mm), L. acidophilus (17,95mm) y A. viscosus (17mm). En la investigación presente el dentífrico con aloe vera demostró una inhibición de 12.05mm frente a S. mutans y L. acidophilus (10,08mm) demostrando una eficacia antibacteriana sobre bacterias cariogénicas. En cuanto a la efectividad antimicrobiana de la arginina, supera la actividad antimicrobiana de S. mutans y L. acidophilus, los resultados encontrados en este estudio se puede relacionar con otros estudios realizados por Márquez et al. (2011) quienes evaluaron y compararon la eficacia en la reducción de la hipersensibilidad dentinaria con el uso de arginina al 8%- carbonato de calcio, fluoruro de sodio (1.450 ppm), obteniéndose valores de reducción que son estadísticamente significativos, logrando incluso la reducción completa de la sensibilidad. En la presente investigación también se utilizó Arginina al 8%, donde mostró mayor efectividad que la Aloe vera y el Monofluorofosfato de sodio. El uso de la arginina junto con el carbonato de calcio, interaccionan generando una obstrucción física/mecánica del túbulo dentinario expuesto, logrando el alivio del paciente con hipersensibilidad dentinaria y al cepillarse, 57 la arginina contenida en el dentífrico, en conjunto con la saliva del paciente, reaccionarían con el carbonato de calcio, formando una estructura central de bicarbonato de arginina el cual es altamente soluble, rodeado de carbonato de calcio el cual es poco soluble. La arginina puede aumentar el beneficio ecológico de fluoruro enriqueciendo bacterias alcalinas generando en el biofilm de la placa y por lo tanto un efecto sinérgico con fluoruro en el control de la caries dental. Se evaluaron los efectos combinatorios de NaF/arginina sobre cultivos planctónicos y biofilm de S. mutans, S. sanguinis y Porphyromonas gingivalis con ensayos de micro dilución, donde la combinación óptima de NaF / arginina mantuvo una "presión estreptocócica" contra el potencial de crecimiento de anaerobios orales P. gingivalis dentro del biofilm alcalinizada. Con los que concordamos ya que en este estudio también demostró la aplicación combinatoria de fluoruro y la arginina, donde también demostró un potencial efecto sinérgico sobre el S. mutans (Zheng et al. 2015). Según Ten Cate & Cummins (2013) utilizaron pasta de dientes que contiene 1,5% de arginina, un compuesto de calcio insoluble, y fluoruro, demostraron remineralización superior en las lesiones blancas del esmalte. Demostrando que los dentífricos combina eficazmente los efectos establecidos de fluoruro en desmineralización del esmalte y la dentina y mejorar la remineralización reduciendo la caries que inducen factores patológicos resultantes del metabolismo de la placa, ya que las formulaciones que contienen arginina se han comercializado para su utilización en enjuagues bucales y pastas orales para el tratamiento de la hipersensibilidad dentinaria y la prevención de caries. El mecanismo de acción de la arginina podría permanecer en la cavidad oral después de la exposición, resultando la desestabilización a largo plazo biofilm oral (Kolderman et al. (2015). Por consiguiente la utilización de arginina en pasta de dientes aumentó significativamente la actividad del sistema deiminasa de arginina (ADS) en la placa de individuos caries activa CA (P = 0,026). Los perfiles microbianos placa de CA tratados con la arginina pasta de dientes mostraron un cambio en la composición bacteriana a una comunidad más sana. Por lo tanto, en este estudio demuestra que la arginina posee un efecto anti-caries debido en gran parte a la mejora de los niveles de actividad 58 del sistema deiminasa (ADS) y el potencial de la modificación favorable a la composición del microbiota oral (Nascimiento et al., 2014). Estudios in vitro evaluaron la actividad antibacteriana de diferentes dentífricos disponibles en el mercado, sobre el Streptococcus mutans (SM), el Streptococcus sobrinus (SS) y el Lactobacillus acidophilus (LA), asociados a las caries de superficies lisas de fosas y fisuras. Utilizaron Colgate, Close Up, Crest gel (niños), conteniendo fluoruro de sodio (NaF); Listerine Menta, conteniendo Monofluorofosfato de Sodio (MFPNa); Viadent, con NaMFP y Sanguinarina; Crest, con fluoruro de estaño, Blend a Med, con triclosan; Retar-Dent, conteniendo dióxido de clorine, y vaselina sólida como control. Los resultados obtenidos, demostraron que los tres microorganismos, fueron sensibles a todos los dentífricos excepto al Retar-Dent y a vaselina (p<0,05). El microorganismo más sensible fue el SM, seguido por el SS y el LA (au) es decir que el monofluorofosfato actúa frente al S. mutans, L. acidophilus y S. sobrinus (Lucas & Lucas, 2001). Respecto a este estudio el monofluorofosfato de sodio, solo en la dilución 1:2 frente a Streptococcus mutans presentó una inhibición de 10.08mm y en el Lactobacillus acidophilus fue 10mm si existió diferencia para todas las diluciones (p <0,05). Kiranmayi et al. (2011) evaluaron in vitro el potencial remineralizante de dentífricos con fórmula infantil en dientes temporales con lesiones cariosas artificiales, donde el monofluorofosfato de sodio (458 ppm) y el fluoruro de sodio (500 ppm), mostraron disminución significativa de la profundidad de las lesiones cariosas. En la presente investigación se utilizó pasta de dientes de uso adulto donde el monofluorofosfato fue de 1458ppm mostrando eficacia frentes a las bacterias cariogénicas. Satyawan et al. (2012) evaluaron la eficacia de dentífricos fluorados en la prevención de caries y placa, dentífricos que contienen monofluorofosfato de sodio (1000ppm) donde los resultados evaluaron que el monofluorofosfato de sodio fue eficaz en la inhibición de la progresión de la placa y caries dental. Depaola et al. (1993) demostraron en un estudio de 36 meses de caries clínicos doble ciego se llevó a cabo para determinar la eficacia anticaries, comparativos de monofluorofosfato de sodio (MFP) y el fluoruro de sodio (NaF), incorporado en formulaciones dentífricas. Las dos formulaciones utilizadas en la comparación NaF 59 frente MFP eran Winterfresh gel Colgate con 0,76% monofluorofosfato de sodio en una base de sílice y pasta de dientes Crest Sabor regular con fluoruro de sodio 0,24% en una base de sílice. Una tercera dentífrico NaF disponible comercialmente, Colgate junior pasta de dientes con fluoruro de sodio 0,243% en una base de sílice, se incluyó en el estudio para su posterior comparación donde la eficacia anticaries proporcionada por la formulación MFP, (Winterfresh gel Colgate con 0,76% MFP) es "tan bueno como" la proporcionada por la formulación NaF, (cresta Regular Pasta de dientes sabor, con 0,243% NaF), y la eficacia anticaries proporcionada por la formulación de NaF (Colgate junior pasta de dientes, con 0,243% NaF) es "tan bueno como" la proporcionada por la otra, (cresta de la pasta de dientes sabor regular, con 0,243% NaF). Se necesitan más estudios reportados en la literatura respecto a los efectos antibacterianos de las distintas pastas dentales con Aloe vera, arginina y monofluorofosfato de sodio sobre el S. mutans y L. acidophilus son muy limitados e imposibilita tener con que comparar este estudio, se espera que se ejecución abra un camino que permita crear una línea de investigación al respeto. 60 CAPÍTULO V 5. CONCLUSIONES Y RECOMENDACIONES 5.1. Conclusiones Todas los dentífricos evaluados con diferentes agentes antibacterianos, mostraron actividad inhibitoria frente al Streptococcus mutans y Lactobacillus acidophilus, pero la pasta dental de contenido arginina presentó mayor halo de inhibición microbiana. Se evidenció que las tres pastas no tuvieron diferencias estadísticamente significativas en cuanto el poder inhibitorio entre las tres pastas dentales evaluadas, sin embargo se observa mejor desempeño la pasta dental de contenido de arginina tanto para Streptococcus mutans como para Lactobacillus acidophilus. En conclusión todas las pastas dentales presentaron acción antibacteriana óptima ya que los diámetros de inhibición son mayores de 10mm, se encontró que la arginina fue más eficaz, ya que presentó halo de inhibición de 13.5mm. 5.2. Recomendaciones Sería importante dar un enfoque general a este tipo de estudios con el apoyo económico de entidades gubernamentales, que podrían posibilitar investigaciones a largo plazo. En el caso de los agentes terapéuticos, cabe destacar que estos ayudan en el mantenimiento de un equilibrio microbiano oral sano y por lo tanto representa un enfoque ecológico prometedor para el tratamiento de caries dental, además se debería implementar un mayor aporte literario ya que existe escasa información sobre el tema tratado. Finalmente sería fundamental que los Odontólogos tengan una mayor base científica respeto a la composición de las pastas dentales, que facultarían a la realización de un auto crítica enfocada en los riesgos y beneficios, los que a su vez permitirá realizar una mejor guía para el paciente. Recordando siempre que 61 la concentración de la pasta dental es más importante que la cantidad de pasta dental que se coloque en el cepillo. 62 BIBLIOGRAFÍA Acevedo, A., Machado, C., Rivera, L., Wolff, M., Kleinberg, I. (2015). The inhibitory effect of an arginine bicarbonato/calcium carbonate (cavistat®).containing dentrifice on the development of dental caries in Venezuela school children. The journal of clinical dentistry, 16(3), 63-70. Acuña, L. (2008). La historia de la pasta dental. Recuperado de https://www.elsiglodetorreon.com.mx/noticia/393956.su-salud-bucal-la-historia-dela-pasta-dental.html Alarcón, M., Fernández, R. (2013). Aplicación terapéutica del aloe vera l. en odontología. Redalyc.org. 17(3), 33-38. Alves, R. (2009) Estudo in vitro da eficácia anti-bacteriana de seis dentífricos em Streptococcus mutans e Lactobacillus acidophillus. Universidade Fernando Pessoa, Porto. Araújo, S., Torres, T., Silva, S., Lima, S. (2008). Effect of a dentifrice containing aloe vera on plaque and gingivitis control. A double-blind clinical study in humans. J. Appl. Oral Sci. 16(4). Barbería, E. (2014). Atlas de Odontología Infantil para Pediatras y Odontólogos. Madrid: Ripano. Barrancos, J., & Barrancos, P., (2006). Operatoria dental. Argentina: Acta médica panamericana. pág. 343. Barreto, L., & Col. (2005). Acción antimicrobiana in vitro de dentífricos contenido fitoterápicos. Avances en Odontoestomatología. 21(4), 195-201. Barroso, J., Guinot, F., & Barbero, V., (2011).La importancia de la dieta en la prevención de la caries. Gaceta dental. Recuperado de http://www.gacetadental.com/2011/09/la-importancia-de-la-dieta-en-la-prevencinde-la-caries-25430/ Basconez, A. (2009). Periodoncia clínica e Implantologia Oral. Madrid: Ediciones avances. Boj, J., Catalá, M., Garcia, C., Mendoza, A. (2011) .La evolución del niño al adulto joven. 1era Ed. Ripano S.A. Madrid. Pág.212-240. 63 Bordoni, N., Escobar A., & Castillo R. (2010). Odontología Pediátrica; la salud bucal del niño y adolescente en el mundo actual. Buenos Aires: Médica Panamericana. Bravo, J. A., & Amaury, M. F. (2012). Eficacia clínica de una pasta desensibilizante de uso en consultorio a base de arginina al 8.0% y carbonato de calcio. Revista ADM, 68-75. Calixto, M. (2006). Plantas medicinales utilizadas en odontología. Kiru 3 (2), 80-85. Cameron, A. & Widmer, R. (2010). Manual de odontología pediátrica. BarcelonaEspaña: Elsevier. Cárdenas, A., & Aguilera, F., (2013). Técnicas y ayuda odontológica y estomatológica. Madrid: Paraninfo. Cárdenas, C. & Perona, M. (2013). Factores de riesgo asociados a la prevalencia de caries de aparición temprana en niños de 1 a 3 años en una población peruana. Odontología Pediátrica, 12 (2). Carmona L., González F., y Lujan M. (2013). Toothpaste efficacy with different Fluoride concentrations on white spot lesions, a randomized clinical trial.Rev. CES Odont, 26(2), 22-35. Cepeda, J., Pozos, A., Zermeño, M., Vásquez, F. (2013). Eficacia clínica de una pasta desensibilizante de uso en consultorio a base de arginina al 8.0% y carbonato de calcio. Revista ADM, 70(2), 68-75. Chamorro, A., Ospina, A., Arango, J., & Martínez, C., (2013). Acción de la inmunoglobulina A secretora en el proceso de adherencia del Streptococcus mutans al diente humano. Revista ces odontología. 26(2), 76-106. Contreras Rosales, J., De la Cruz Cardoso, D., Castillo Chaires, I., Arteaga Mejía, A. (2014). Dentífricos fluorurados: composición. Revista Especializada en Ciencias de la Salud, 17(2):114-119.. Corrales, I., Reyes, J. (2015). Actividad etnofarmacológica y antimicrobiana de los componentes químicos de las plantas medicinales utilizadas en estomatología. Órgano Científico Estudiantil de Ciencias Médicas Cuba, 54(257): 71-83. Cuenca, E., & Baca, P. (2005). Odontología preventiva y comunitaria. BarcelonaEspaña: Masson S.A. 64 Damle, S. G., Deoyani, D., Hiteshwar, Bhattal., Renu, Yadav., Ashish, Lomba. (2012). Comparative efficacy of dentifrice containing sodium monofluorophosphate + calcium glycerophosphate and non-fluoridated dentifrice: A randomized, doubleblind, prospective study. Dental Research Journal. (9) 68-73. DePaola, PF., Soparkar, PM., Triol, C., Volpe, AR., Garcia, L., Duffy, J., Vaughan, B.(1993).The relative anticaries effectiveness of sodium monofluorophosphate and sodium fluoride as contained in currently available dentifrice formulations. Am J Dent. S7-12. Dilip, G., Sham, S., Beena, A. (2009). Comparative evaluation of the antimicrobial efficacy of Aloe vera tooth gel and two popular commercial toothpastes: an in vitro study. Gen Dent, 57(3), 238-241. Enrile de Rojas, F. & Fuenmayor, V. (2009). Manual de Higiene Bucal. Buenos Aires: Médica Panamericana. Espinoza, J., González, L., Ruiz, P. (2013).Tratamiento de la hipersensibilidad dentinaria post terapia periodontal, mediante el uso de dos dentífricos desensibilizantes. Rev. Clin. Periodoncia Implantol. Rehabil. Oral, 6(2), 78-82. Expósito Raúl, Rubio Pilarte, Solorzano Jesús y Sánchez Manuel. (2012). Historia de un “flechazo” el cepillo de dientes y la pasta dentífrica. Recuperado de http://www.aniorte-nic.net/archivos/trabaj_cepillo_dientes_pasta_dentrifica.pdf Fani, M., Kohanteb, J. (2012). Inhibitory activity of Aloe vera gel on some clinically isolated cariogenic and periodontopathic bacteria. J Oral Sci, 54(1), 15-21. Feng, Y., Yin, W., Hu, D., Zhang, Y, P., Ellwood, R, P., Pretty, L, A. (2007).Assessment of Autofluorescence to Detect the Remineralization Capabilities of Sodium Fluoride, Monofluorophosphate and Non-Fluoride Dentifrices. Caries Research, (41), 358–364. doi: 10.1159/000104793 Fernández, E. (2014). Influencia de 2 dentífricos con agentes desensibilizantes en la conductabilidad hidráulica dentinaria. Revista clínica de periodoncia, implantologia y rehabilitación oral, 7(3), 157-163. Figueroa et al., (2009). Microorganismos presentes en las diferentes etapas de la progresión de la lesión de caries dental. Acta odontológica Venezolana. 47 (1). 65 Freeman, A. (1989). Microbiología de Burrows. DF-México: Nueva editorial interamericana. Guerrero, V., Godinez, A., y Melchor C. (2009). Epidemiología de caries dental y factores de riesgo asociados a la dentición primaria en preescolares. Revista ADM, 65 (3), 10-20. Gutiérrez, J., (2006). Fundamentos de ciencias básicas aplicadas a la odontología. Bogotá: Pontificia Universidad Javeriana. Harris, N., & García, F., (2005). Odontología preventiva primaria. España: Editorial el manual moderno. Henostroza, G. (2007). Caries Dental: Principios y Procedimientos para el diagnóstico. Lima, Perú: Universidad Peruana Cayetano Heredia. Herazo (2012). Clínica del sano en Odontología. Bogotá-Colombia: ECOE. Higashida, B. (2009). Odontología Preventiva. México: Mc Graw Hill. Jawetz, Melnick & Adelberg. Medical microbiology. Mexico: Mcgraw-Hill Lange. Karkare, S. R., Ahire, N. P., Khedkar, S. U. (2015).Comparative evaluation of antimicrobial activity of hydroalcoholic extract of Aloe vera, garlic, and 5% sodium hypochlorite as root canal irrigants against Enterococcus faecalis: An in vitro study. Journal of Indian Society of Pedodontics and Preventive Dentistry, 33(4), 274-8. doi: 10.4103/0970-4388.165658 Kolderman, E., Bettampadi, D., Samarian D., Dowd, SE., Foxman, B., Jakubovics, NS., Rickard, AH. (2012).L-arginine destabilizes oral multi-species biofilm communities developed in human saliva. PLoS One. 10(5). Liébana, (1995). Microbiología oral. Madrid, España: Interamericana. Lindhe J., L. N. (2009). Periodontología Clínica e Implantologia Odontológica (quinta ed.). Buenos Aires: Médica Panamericana. Lucas, Gabriela Q; Lucas, Oscar N. (2001). An in vitro evaluation of the antibacterial activity of different dentifrices on Streptococcus mutans, Streptococcus sobrinus and Lactobacillus acidophilus. Rev. Fac. Odontol. Univ. Valparaiso. 2(5): 370-374. Lyaruu, D., Schoonderwoerd, M., Tio, D., Tse, C., Bervoets, T., DenBesten, P., Bronckers, A. (2014). Parenteral monofluorophosphate (MFP) is a more potent 66 inducer of enamel fluorotic defects in neonatal hamster molars than sodium fluoride. Odontology, 102(2), 147–153. M. Kiranmayi, S. V. S. G. Nirmala, Sivakumar Nuvvula.(2015). Appraisal of the remineralizing potential of child formula dentifrices on primary teeth: An in vitro pH cycling model. Contemporary Clinical Dentistry, 6 (1). Mangaiyarkarasi, S., Manigandan, T., Elumalai, M., Priyanka, K. Cholan & Roopam Pal Kaur. (2015). Benefits of Aloe vera in dentistry. J Pharm Bioallied Sci, 7(1). Márquez, M., Quintero, A., Sanz, A., Ramírez, V., Inostroza, C., Chaparro, A. (2011). Efecto de la arginina 8%-carbonato de calcio y del fluoruro de sodio al 5% en la reducción de la hipersensibilidad dentinaria post terapia periodontal. Revista Clínica de Periodoncia, Implantología y Rehabilitación Oral, 4(1), 22- 25. Marsh, P. & Martin, M. (2011). Microbiología Oral. Madrid-España: Elservier. Mejía, S., Rigalli, A. (2013). Comparación de los efectos del tratamiento con monofluorofosfato de sodio o fluoruro de sodio sobre el proceso de reparación ósea en ratas. Actualizaciones en Osteología, 9(1), 28-35. Moromi, H., Martínez E., Ramos, D., (2009). Antibacterianos naturales orales. Estudios en la Facultad de Odontología de la Universidad Nacional Mayor de San Marcos, 12 (1). Muñiz Brito, A., Dantas, L., Fiquene De Brito, A., Silva Muniz, A., Alves Ramos, I., Rodrigues Cardoso, A. (2015). Loss on drying, calcium concentration and pH of fluoride dentifrices. Comtemporany clinical dentistry, 6(5), 72-76. Muñoz, M. (2000). Higiene bucodental. Pastas dentífricas y enjuagues bucales. Farmacéutica. Recuperado de http://apps.elsevier.es/watermark/ctl_servlet?_f=10&pident_articulo=15465&piden t_usuario=0&pident_revista=4&fichero=04v19n03a03008pdf001.pdf&ty=75&acci on=L&origen=doymafarma&web=www.doymafarma.com&lan=es Nagpal, R., Kaur, V., Kumar, M., Marotta, F. (2012). Effect of Aloe vera juice on growth and activities of Lactobacilli in-vitro. Acta Biomed, 83(3):183-8. Nahás, S. (2009). Odontopediatría: en la primera infancia. SauPaulo-Brasil: Livraria Santos Editora Hda. 67 Nascimento, MM., Browngardt, C., Xiaohui, X., Klepac-Ceraj, V., Paster, BJ., Burne, RA. (2014).The effect of arginine on oral biofilm communities. Mol Oral Microbiol, 29(1), 45-54. doi: 10.1111/omi.12044 Núñez, P. & García, L. (2010). Bioquímica de la caries dental. Habanara de Ciencias Médicas. 9 (2). Ojeda, J. & Eliana, L. (2013). Streptococcus mutans and dental caries.Revista CES Odontología. Recuperado dehttp://www.scielo.org.co/pdf/ceso/v26n1/v26n1a05.pdf Oliva, A. (2006). Biofilm y microorganismos orales bacterianos (Titulo de Cirujano Dentista). Universidad Peruana Cayetano Heredia, Lima, Perú. Palma, A. & Sánchez, F. (2013). Técnicas de ayudas odontológicas y estomatológicas. Madrid: Paraninfo. Pág. 225-226. Patel, R., Chopra, S., Vandeven, M., Cummins D. (2011). Comparison of the effects on dentin permeability of two commercially available sensitivity relief dentifrices. J Clin Dent, 22(4) ,108-12. Pearce, E. & Dibdin, G. (1995). The Diffusion and Enzymic Hydrolysis of Monofluorophosphate in Dental Plaque. Journal Dental Research, 74(2): 691-697. Pinkham et al., (1994). Odontología pediátrica. México: Interamericana Mcgraw-Hill. Pradeep, AR, Agarwal, E,, Naik, SB.(2012) Clinical and microbiologic effects of commercially available dentifrice containing aloe vera: a randomized controlled clinical trial. J Periodontol. 83(6):797-804. doi: 10.1902/jop.2011.110371 Prescolt, H., & Klein. (2006). Microbiología. España: Mc. Graw Hill Internacional. Reyes, E., Casielles, J., López, I., Neira, M., Palma, P., Gordan, V., Moncada, G.(2012). Activity and effects of urease and arginine deiminase in saliva and human oral biofilm. Rev Fac Odontol Univ Antioq. 23(2), 343-352. Roesler, P., Biondi, O., Pomilio, A., (2009). Antimicrobial capacity of Aloe vera and propolis dentifrice against Streptococcus mutans strains in toothbrushes: an in vitro study. Journal of Applied Oral Science, 20(1). Rosales, J. C., & Cardoso, D. D. (2014). Dentífricos fluorurados: composición. Especializada en Ciencias de la Salud, 114-119. 68 Sarabia, M., Gómez, M. & García, O. (2005). La dieta y su relevancia en la caries dental y la enfermedad periodontal. Instituto Superior de Ciencias Médicas. Facultad de Estomatología, 9(1), Seif, (1997). Cariología: Prevención, diagnóstico y tratamiento contemporáneo de la caries dental. Caracas-Venezuela: Amolca. Sharma, S., Lavender, S., Woo, J., Guo, L., Shi, W., Kilpatrick, L., Gimzewski, JK.(2014).Nanoscale characterization of effect of L- arginine on Streptococcus mutans biofilm adhesion by atomic force microscopy. Microbiology Society, 160(7), 1466-73. doi: 10.1099/mic.0.075267-0 Silva, M. A. (noviembre de 2013). Aplicación terapéutica del Aloe vera L. en Odontología. Scielo, XVII(3). Silverstone, (1985). Caries dental, etiología, patología y prevención. D.F., México: El manual moderno. Soria, María et al., (2008). Hábitos de higiene bucal y su influencia sobre la frecuencia de caries dental. Acta Pediátrica Mexicana, 29(1). Souza, M., Cury, J., Ándalo, L., Zhang, Y., Mateo, L., Cummins, D. (2013). Comparación de la Eficacia de un Dentífrico que Contiene Arginina al 1.5% y 1450 ppm de Fluoruro con la de un Dentífrico que Contiene 1450 ppm de Fluoruro Solamente, en el Manejo de la Caries Radicular Primaria. Elservier, doi: 10.1016/j.jdent.2013.10.015 Sturdevant et al. (2007). Arte y Ciencia de la odontología conservadora. España: Elsevier. Sunitha, J., Shilpa, P., Madhusudan, AS., Ravindra, S. (2012). An in vitro antimicrobial activity of few plants extracts on dental caries microorganisms. Sunithajd etal, Int.J.A.PS.BMS, 1(3),294-303. Ten Cate, J.M., Cummins, D. (2013). Fluoride toothpaste containing 1.5% arginine and insoluble calcium as a new standard of care in caries prevention. J Clin Dent. 24(3) ,79-87. 69 Thylstrup, A. & Fejerskov, O. (1988).Caries.España- Barcelona: Ediciones Doma. Pág. 280. Titipong Prueksrisakul, Soranun Chantarangsu & Pasutha Thunyakitpisal. (2015). Effect of daily drinking of Aloe vera gel extract on plasma total antioxidant capacity and oral pathogenic bacteria in healthy volunteer: a short-term study. J Complement Integr Med, 12(2), 159–164. Ureña, J. l. (2002). Microbiología Oral . Madrid: Mc Graw Hill Interamericana. Uscátegui, H. (2010).Immunonutrition: Approach on surgical patient. Rev. Chilena de Cirugía, 62(1), 87-92. Valencia, E., Pascual, F., Vela, C. (2009). Selladores de fosas y fisuras para higienistas dentales. España: Ideas propias. Villafranca et al. (2005). Manual del Técnico Superior en Higiene Bucodental. Temarios generales. España: MAD. Villalobos, O., Salazar, C., & Raminerez, G. (2001). Efecto de un enjuague bucal compuesto de aloe vera en la placa bacteriana e inflamación gingival. Acta odontológica venezolana, 39 (2). Villalobos, O., Salazar, C., Ramírez de Sánchez, G. (2001).Efecto de un enjuague bucal compuesto de aloe vera en la placa bacteriana e inflamación gingival. Acta odontológica de Venezuela, 39 (2). Vitoria, I., & Grupo Infancia Adolescencia (2011). Promoción de la salud bucodental. Revista Pediatría Atención Primaria, 13(51), 435-458. Wang, XL., Cheng, CY., Peng, D., Wang, B., Gan, YH. (2002). Dental plaque pH recovery effect of arginine bicarbonate rinse in vivo. The Chinese Journal of dental research, 15(2). Wilkinson, J., Moore, J. Cosmetología de Harry. Madrid: Díaz de Santos S.A. Pág. 680. Recuperado de https://books.google.com.ec/books?id=fnQ9mGMH15oC&printsec=frontcover&hl =es#v=onepage&q&f=false 70 Zheng, X., Cheng, X., Wang, L., Qiu, W., Wang, S., Zhou, Y., Li, M., Li, Y., Cheng, L., Li, J., Zhou, X., Xu, X. (2015). Combinatorial Effects of Arginine and Fluoride on Oral Bacteria. Journal of Dental Research, 94(2) ,344–353. Zimmer, S., Seeman, N., Z. Zahnartz, Z., Barthel, C. (1994). Que pueden aportar los “otros componentes” de las pastas dentífricas. Revista Quintessenz, 45, 924-940. 71 ANEXOS Anexo No. 1. Certificado de autenticidad del Streptococcus mutans ATCC 25175. 72 Anexo No. 2. Certificado de autenticidad del Lactobacillus acidophilus ATCC 4356. 73 Anexo No. 3. Recolección de datos del Lactobacillus acidophilus. 74 Anexo No. 4. Recolección de datos del Streptococcus mutans. 75 Anexo No. 5. Certificado Traducción 76 Anexo No. 6. Fórmulas para obtención de diluciones para las pastas dentales. Dilución 1:4 – Concentración 25% C1 V1 = C2 – V2 V1 = ( )( V2 = ) V1= 5ml Significa que los 5ml tomados de la solución al 50%, se debe llevar a 10ml para llegar a una concentración al 25%, por lo tanto adicionar 5ml de agua destilada. Dilución 1:8 – Concentración 12,5% V1 = ( )( V2 = ) V1= 5ml Significa que los 5ml tomados de la solución al 25%, se debe llevar a 10ml para llegar a una concentración al 12,5%, por lo tanto adicionar 5ml de agua destilada. Dilución 1:16 – Concentración 6,25% V1 = ( )( V2 = ) V1= 5ml Significa que los 5ml tomados de la solución al 6,25%, se debe llevar a 10ml para llegar a una concentración al 12,5%, por lo tanto adicionar 5ml de agua destilada. CANTIDAD DE PASTA Y AGUA EN CADA DILUCIÓN Dilución Partes pasta dental Partes agua destilada 1:2 5g 10ml 1:4 5g 20ml 1:8 5g 40ml 1:16 5g 80ml Fuente: Elaborado por el Investigador. 77 Anexo No. 7. Renuncia de los derechos de autoría del trabajo estadístico. 78