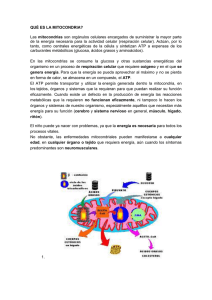
Síndrome de Dravet y enfermedad mitocondrial
Anuncio

Correspondencia El caso descrito, contemplado a lo largo de toda su evolución (depresión psicótica y discinesias faciales en las primeras semanas, bajo nivel de conciencia, crisis epilépticas, necesidad de ven­ tilación asistida y disautonomía, con necesidad de ingreso prolongado en la unidad de cuida­ dos intensivos en el período de estado, y recu­ peración tras inmunoterapia), constituye un tí­ pico ejemplo de la encefalitis por anticuerpos antirreceptor de NMDA, pero posee la peculiari­ dad de que el paciente sufrió un episodio muy similar 25 años antes, catalogado como menin­ goencefalitis linfocitaria. El cuadro clínico de la encefalitis por anti­ cuerpos antirreceptor de NMDA no siempre pa­ sa por las fases de pródromos, manifestaciones psiquiátricas, trastornos del movimiento, alte­ ración del lenguaje y disminución de concien­ cia, asociadas a hipoventilación y disautonomía. Así, su espectro clínico actual se ha vuelto tan amplio que comprende manifestaciones tan dis­ pares como trastornos parecidos al autismo en niños, cuadros psiquiátricos puros o en los que se observan movimientos involuntarios más o menos prominentes (crisis oculógiras, discine­ sias faciales, coreoatetosis y distonías focales, aumento del parpadeo, mioclonías, parkinso­ nismo...), síndromes epilépticos similares a la encefalitis de Rasmussen [5], síndromes de Klei­ ne-Levin y Klüver-Bucy, y cuadros de neuromieli­ tis óptica. Algunas situaciones clínicas, conside­ radas antaño como trastornos disociativos de trance y posesión diabólica [6], se han diagnos­ ticado como encefalitis por anticuerpos antirre­ ceptor de NMDA. Un 80% de los afectados son mujeres, y se encuentra teratoma ovárico en la mitad de las menores de 20 años. También se ha descrito en pacientes con cáncer de pulmón de células pe­ queñas, tumor testicular de células germinales, tumor pseudopapilar de páncreas, cáncer de mama y neuroblastoma [7]. Se han notificado algunos casos puntuales que siguieron a vacu­ naciones, infecciones por micoplasma virus de Epstein-Barr y síndrome de Guillain-Barré [8]. En un estudio global de las encefalitis realizado en el Reino Unido, esta nueva entidad nosoló­ gica fue la causa del 4% de los casos. La prueba princeps para el diagnóstico es la determinación de los anticuerpos antirreceptor de NMDA, que pueden estar presentes tanto en el suero como en el LCR, aunque pueden desa­ parecer en el suero tras la terapéutica con plas­ maféresis o inmunoglobulinas, y también en www.neurologia.com Rev Neurol 2014; 59 (9) las fases de remisión de la enfermedad. En el 80% de los pacientes se encuentra, en el LCR, pleocitosis linfoide y grados variables de hiper­ proteinorraquia, y en un 60% se detectan ban­ das oligoclonales. El estudio de resonancia mag­ nética puede ser anormal en la mitad de los ca­ sos, y en el resto pueden observarse, en las se­ cuencias potenciadas en T2 y FLAIR, áreas de hi­ perseñal en los hipocampos, corteza insular, ganglios basales y cerebelo. En nuestro caso, las numerosas lesiones detectadas podrían ser, al menos parcialmente, secuelas del primer epi­ sodio, en el que el paciente sufrió parada car­ díaca. El electroencefalograma es anormal en muchos pacientes y muestra lentificación más o menos difusa y actividad epileptiforme. Es reco­ mendable realizar un cribado de neoplasia ocul­ ta en todos los casos; en las mujeres jóvenes debe repetirse la investigación, si resultó nega­ tiva, a los dos años. En la primera fase de tratamiento se em­ plean corticoides más plasmaféresis o inmuno­ globulinas intravenosas. En los casos no secun­ darios a neoplasia puede ser necesario admi­ nistrar rituximab y ciclofosfamida. La mortalidad en las grandes series alcanza el 25% de los casos. Un tercio de los pacientes con encefalitis por anticuerpos antirreceptor de NMDA no paraneo­ plásica experimenta recaídas, la mayoría entre los tres meses y los seis años [9]. Nuestro caso, con una recidiva 25 años después del primer episodio, sería el de más largo intervalo docu­ mentado hasta la fecha, aunque, claro está, no disponemos del estudio serológico del primer episodio. Bibliografía 1. 2. 3. 4. 5. Dalmau J, Tüzün E, Wu HY, Masjuán J, Rossi JE, Voloschin A, et al. Paraneoplastic anti-N-methylD-aspartate receptor encephalitis associated with ovarian teratoma. Ann Neurol 2007; 61: 25-36. Dalmau J, Gleichman AJ, Hughes EG, Rossi JE, Peng X, Lai M, et al. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. Lancet Neurol 2008; 7: 1091-8. Florance NR, Davis RL, Lam C, Szperka C, Zhou L, Ahmad S, et al. Anti-N-methyl-D- aspartate receptor (NMDAR) encephalitis in children and adolescents. Ann Neurol 2009; 66: 11-8. Dalmau J, Lancaster E, Martínez-Hernández E, Rosenfield MR, Balice-Gordon R. Clinical experience and laboratory investigations in patients with antiNMDAR encephalitis. Lancet Neurol 2011; 10: 63-74. Greiner H, Leach JL, Lee KH, Krueger DA. Anti-NMDA receptor encephalitis presenting with imaging findings and clinical features mimicking Rasmussen syndrome. Seizure 2011; 20: 266-70. 6. Sebire G. In search of lost time from ‘demonic possession’ to anti-N-methyl-D-aspartate receptor encephalitis. Ann Neurol 2010; 67: 141-2. 7. Uruha A, Kitazawa Y, Masatoshi K, Tanaka K, Koide R. Anti-NMDAR encephalitis in small-cell lung cancer: a case report. Clin Neurol Neurosurg 2011; 114: 260-1. 8. Tojo K, Nitta K, Ishii W, Sekijima Y, Morita H, Takahshi Y, et al. A young man with anti-NMDAR encephalitis following Guillain-Barré syndrome. Case Rep Neurol 2011; 3: 7-13. 9. Irani SR, Bera K, Waters P, Zuliani L, Maxvell S, Zandi MS, et al. N-methyl-D-aspartate antibody encephalitis: temporal progression of clinical and paraclinical observations in a predominantly non-paraneoplastic disorders of both sexes. Brain 2010; 133: 1655-67. Síndrome de Dravet y enfermedad mitocondrial, ¿patologías comórbidas? Verónica Cantarín-Extremera a, M. Luz Ruiz-Falcó Rojas a, Marta García-Fernández b, Anna DuatRodríguez a, Laura López-Marín a, M. Lourdes Calleja-Gero a a Sección de Neurología Pediátrica. b Servicio de Electrofisiología. Unidad de Videoelectroencefalografía. Hospital Infantil Universitario Niño Jesús. Madrid, España. Correspondencia: Dra. Verónica Cantarín Extremera. Sección de Neurología Pediátrica. Hospital Infantil Universitario Niño Jesús. Menéndez Pelayo, 65. E-28009 Madrid. E-mail: verocantarin@hotmail.com Aceptado tras revisión externa: 17.09.14. Cómo citar este artículo: Cantarín-Extremera V, Ruiz-Falcó Rojas ML, García-Fernández M, Duat-Rodríguez A, LópezMarín L, Calleja-Gero ML. Síndrome de Dravet y enfermedad mitocondrial, ¿patologías comórbidas? Rev Neurol 2014; 59: 429-31. © 2014 Revista de Neurología De acuerdo con la clasificación de la Liga Inter­ nacional contra la Epilepsia, el síndrome de Dra­ vet (SD) constituye un cuadro caracterizado por el desarrollo de crisis convulsivas con y sin fie­ bre, generalizadas y unilaterales, clónicas o to­ nicoclónicas, de inicio durante el primer año de vida de un niño, por otra parte, normal. Poste­ riormente se asocian mioclonías, ausencias atí­ picas y crisis parciales. Todas las crisis son re­ fractarias al tratamiento antiepiléptico. Un retra­ so psicomotor es evidente desde el segundo año de vida, y constituye un déficit cognitivo perma­ nente, así como diversos trastornos comporta­ mentales. Este síndrome se asocia con mutacio­ nes, principalmente, en los canales de sodio dependientes de voltaje (SCN1A). Un espectro clínico similar se describe en pa­ cientes con enfermedades mitocondriales, lo que 429 Correspondencia lleva a una confusión clínica, un retraso en el diagnóstico y dificultades en el tratamiento. Presentamos el caso de una adolescente diag­ nosticada inicialmente de enfermedad mitocon­ drial, hasta que la revisión de su biografía de­ terminó la realización del estudio genético de SD, que resultó positivo. Adolescente de 16 años, previamente sana, quien, a la edad de 3 meses, el mismo día de la admi­ nistración de la primera dosis de la vacuna po­ lio-difteria-tétanos-pertussis, presentó un esta­ do epiléptico sin fiebre. En ese momento se reali­ zó un videoelectroencefalograma y una reso­ nancia magnética craneal, que resultaron nor­ males, y fue dada de alta sin tratamiento. Al mes siguiente comenzó a presentar crisis, cada 2-4 semanas, hemiclónicas, algunas prolonga­ das, con y sin fiebre. Desde los 7-8 meses se hi­ cieron evidentes crisis mioclónicas. En relación con su desarrollo psicomotor, alcanzó los hitos normales los primeros 6 meses de vida, pero, desde el segundo semestre, la madre notó re­ traso en las adquisiciones. Inició deambulación a los 17 meses, pero con retraso del lenguaje, tanto expresivo como comprensivo. A lo largo de este tiempo se realizaron nue­ vas pruebas complementarias: cariotipo 46 XX, estudio de enfermedades heredodegenerativas en sangre, orina y líquido cefalorraquídeo (ami­ noácidos, ácidos orgánicos, SAICAR, CDT, bioti­ nidasa, metabolismo de creatina, pterinas, fo­ lato, láctico y neurotransmisores), oligosacári­ dos y mucopolisacáridos normales. Durante los años siguientes, la paciente presentó una epi­ lepsia refractaria a pesar del empleo de diver­ sas politerapias, y asoció déficit cognitivo y pro­ blemas comportamentales graves. A los 3 años de edad, dada su evolución, se planteó la posi­ bilidad diagnóstica de una enfermedad mito­ condrial. En ese sentido, se realizó una biopsia muscular que objetivó déficit del complejo IV de la cadena respiratoria mitocondrial, sin delecio­ nes ni depleciones en el estudio del ADN mito­ condrial, salvo por una variación en la secuen­ ciación, que no podía descartar patogenicidad. En ese momento se añadió al tratamiento car­ nitina, vitamina C y coenzima Q10. Con 11 años, la paciente acudió a nuestro centro. Hasta entonces había recibido tratamien­ to con multitud de fármacos antiepilépticos y dieta cetogénica, sin conseguir control de los episodios convulsivos. En ese momento persis­ tían crisis cada 6-7 días, y estaba en tratamien­ 430 to con ácido valproico, zonisamida, clonacepam y los distintos cofactores indicados anterior­ mente. En varias ocasiones se había observado que, cuando los niveles de ácido valproico dis­ minuían por debajo de 100 mg/L, aumentaban las crisis convulsivas, por lo que se había man­ tenido tratamiento con este fármaco antiepi­ léptico a pesar de la sospecha de diagnóstico de enfermedad mitocondrial. Dada la biografía de la paciente con el inicio a los 3 meses, estados convulsivos con y sin fie­ bre de crisis hemiclónicas, desarrollo de retraso psicomotor, crisis mioclónicas y parciales desde el segundo año de vida y el hecho de que preci­ sara niveles de ácido valproico en el límite alto de la normalidad para mejorar su control de cri­ sis, se planteó la posibilidad de que realmente se tratase o no de una enfermedad mitocon­ drial. En este sentido, se realizó un estudio ge­ nético para SD y se encontró una mutación framshift p.P1166Vfs*28, localizada en el exón 17 del gen SCN1A, en heterocigosis. Con el diag­ nóstico de SD se asoció a su tratamiento estiri­ pentol, y se consiguió un mejor control de los episodios convulsivos. El desarrollo en niños, previamente sanos, de una epilepsia refractaria con episodios de esta­ dos convulsivos frecuentes y regresión psicomo­ tora puede ser un patrón presente tanto en el SD como en enfermedades mitocondriales [1-3]. El diagnóstico del SD se basa, principalmen­ te, en una serie de criterios electroclínicos, y se confirma con la determinación de mutaciones o deleciones en el gen SCN1A, los receptores del ácido γ-aminobutírico A o γ-2 (GABRG2) [1,2]. Las enfermedades debidas a alteraciones de la cadena respiratoria mitocondrial pueden pre­ sentarse con un amplio espectro clínico [3], po­ cas veces patognomónico. La falta de unos cri­ terios diagnósticos estandarizados hace que la confirmación o exclusión de un trastorno de la cadena respiratoria mitocondrial suponga un dilema en la práctica clínica habitual. Walker et al propusieron los primeros criterios diagnósti­ cos en 1996 [4], pero no fue hasta el año 2002 cuando Bernier et al evaluaron su valor en la población pediátrica, proponiendo unos nuevos criterios generales con una mejor sensibilidad y especificidad [5]. Cuando conocimos a esta paciente, tenía un diagnóstico probable de enfermedad mitocon­ drial, pero su espectro electroclínico podía equi­ pararse también a los pacientes con SD. Desde siempre, el desarrollo en la infancia de una epilepsia mioclónica progresiva se ha asociado a enfermedades mitocondriales del tipo de la encefalopatía epiléptica con fibras ro­ jas rasgadas; en 1991, Harbord et al publicaron ocho pacientes pediátricos con un cuadro epi­ léptico sugestivo de esta entidad, pero con ano­ malías no específicas en el microscopio electró­ nico. Se realizaron estudios enzimáticos de la cadena respiratoria mitocondrial en cinco pa­ cientes, y en tres de ellos se encontraron altera­ ciones en el complejo I. Con estos hallazgos, los autores concluyeron que, en el contexto de una epilepsia mioclónica progresiva, la no existen­ cia de fibras rojas rasgadas en la biopsia muscu­ lar no elimina la posibilidad de que se trate de una enfermedad mitocondrial [6]. En la bibliografía podemos encontrar dos perfiles de pacientes con la asociación SD y en­ fermedad mitocondrial: uno, con diagnóstico electroclínico y genético de SD, con alteraciones de la cadena respiratoria mitocondrial, sin ha­ llar genética específica de esta última; y otro perfil de pacientes, con genética conocida tanto de SD como de enfermedad mitocondrial. Teniendo en cuenta el primer grupo de pa­ cientes, en 1995, Castro-Gago et al describieron la primera mención de un paciente con cuadro compatible clínica y eléctricamente con un SD, pero con asociación únicamente de una defi­ ciencia parcial del complejo II y IV de la cadena respiratoria mitocondrial [7]. En 1997, los mis­ mos autores publicaron el caso de una chica con SD e hiperlactacidemia. Se le realizó una pri­ mera biopsia muscular a los 19 meses que evi­ denció mitocondrias anormalmente agrupadas, con algunas alteraciones inespecíficas en el es­ tudio ultraestructural, pero con cadena respira­ toria mitocondrial normal. Se trató a la pacien­ te con altas dosis de ácido valproico (80 mg/ kg/día), clonacepam y carnitina. A los 32 meses ingresó por reagudización de crisis en el contex­ to de síndrome febril, desarrolló un fallo hepáti­ co con coma y deterioro multiorgánico, y falle­ ció poco después. Los estudios de la cadena respiratoria mitocondrial en muestra de biopsia muscular realizada inmediatamente tras su muer­ te pusieron de manifiesto un déficit parcial del complejo IV. El análisis de ADN mitocondrial ex­ cluyó la existencia de mutaciones puntuales [8]. En 1998, Fernández-Jaén et al publicaron el caso de otro paciente con la misma clínica de SD e hiperlactacidemia con un número llama­ tivo de anomalías estructurales mitocondriales www.neurologia.com Rev Neurol 2014; 59 (9) Correspondencia en la biopsia muscular, y cuyo estudio enzimáti­ co reveló un déficit grave del complejo IV de la cadena respiratoria mitocondrial [9]. A partir del año 2010, aparecieron publica­ dos los primeros casos con confirmación genéti­ ca, y no sólo clínica, de SD. Así, Nishri et al des­ cribieron el caso de un varón de 11 meses que desarrolló un fallo hepático en un estado con­ vulsivo febril estando en tratamiento con ácido valproico por una epilepsia mioclónica con crisis parciales y generalizadas. El diagnóstico de en­ fermedad de Alpers-Huttenlocher fue la prime­ ra posibilidad que se consideró. Se realizó una biopsia muscular que evidenció alteraciones mi­ tocondriales, pero no se pudieron determinar depleciones del ADN mitocondrial ni mutacio­ nes en la secuenciación del gen POLG1. Dada la clínica del paciente, se solicitó la secuenciación de SCN1A, que mostró una mutación de novo de sustitución de aminoácidos (p.Val 1537 Glu) [10]. Uno de los últimos ejemplos lo tendríamos en 2012, cuando Craig et al revisaron una cohorte de 24 pacientes con SD y mutaciones patogéni­ cas en SCN1A, demostrando en dos de ellos una alteración de la cadena respiratoria mitocon­ drial, disfunción del complejo IV en uno y del complejo III en otro [11]. Con estos casos queda constancia de que en ocasiones es difícil encontrar la confirmación de enfermedad mitocondrial, aunque la sospecha diagnóstica y los estudios complementarios sean exhaustivos. En este sentido, la posibilidad de que el déficit de la cadena respiratoria mitocon­ drial sea secundario toma más fuerza. Por otra parte, debemos destacar a aquellos pacientes en los que se confirma tanto la gené­ tica de SD como de alguna enfermedad mito­ condrial. Así, Bolszak et al, en 2009, describie­ ron el caso de un niño con SD con mutación en SCN1A y alteración en el gen mitocondrial γ-po­ limerasa 1 (POLG1) [12], y Frye publicó en 2011 los casos de dos pacientes con patrón electroclí­ nico de SD con mutaciones en SCN1A, encon­ trando en ambos mutaciones del ADN mitocon­ drial asociado con neuropatía óptica heredita­ ria de Leber [13]. En nuestro caso, al igual que en otros de la bibliografía, destaca la posible comorbilidad en­ tre las enfermedades mitocondriales y el SD. El SD podría estar asociado con una disfunción mi­ tocondrial, pero no ha sido posible todavía iden­ tificar a priori a estos pacientes y establecer una www.neurologia.com Rev Neurol 2014; 59 (9) hipótesis que pudiese explicar esta relación. Al­ gunas teorías en este sentido son las expuestas por Castro-Gago et al [14] y por Frye [15]. Am­ bos sugirieron la posibilidad de que algunas deleciones o depleciones de ADN mitocondrial fuesen sólo evidentes a diferentes edades. Del mismo modo, proponían la posible relación con el nivel de fosforilación de los canales de sodio neuronales. En condiciones normales, estos ca­ nales están menos fosforilados en edades tem­ pranas de la vida, y son más excitables; a eda­ des adultas aumentaría su fosforilación y se re­ duciría el flujo de sodio a su través, haciéndolos menos excitables [14]. Frye añade la teoría de que la disfunción mitocondrial podría ser secun­ daria a varios procesos fisiopatológicos que son responsables o consecuencia de la actividad con­ vulsiva. Así, la inflamación y la situación de es­ trés oxidativo que interviene en la patogénesis y propagación de las crisis convulsivas pueden dar lugar a un incorrecto funcionamiento mito­ condrial. Por ejemplo, los productos provenien­ tes del estrés oxidativo y las concentraciones elevadas del factor de necrosis tumoral, citoci­ na proinflamatoria, pueden alterar las funcio­ nes mitocondriales [15]. Otro dato a favor es la existencia de ERRγ, un factor activador que re­ gula a la vez la expresión de SCN1A y de múlti­ ples genes mitocondriales en el músculo cardía­ co de diferentes animales; sin embargo, no está claro si esta corregulación ocurre de la misma manera en el músculo esquelético y el tejido ce­ rebral de humanos [16]. En conclusión, una explicación convincente pa­ ra la asociación existente entre enfermedades mitocondriales y SD está todavía por llegar. In­ dependientemente de encontrar esta explica­ ción, es importante conocer la posibilidad, ba­ sándose en la bibliografía, de que ambas enti­ dades pueden coexistir. Esto conllevará implica­ ciones pronósticas y de consejo genético, así como un correcto tratamiento de estos pacien­ tes, pues, por ejemplo, el uso de ácido valproi­ co es la primera línea de tratamiento en el SD [1], pero su empleo en algunos tipos de enfer­ medades mitocondriales relacionadas con defi­ ciencias de la cadena respiratoria mitocondrial ha demostrado significativos efectos secunda­ rios [17]. Debido a lo expuesto, creemos que el uso de carnitina en los niños con SD que reci­ ban ácido valproico es altamente sugerible. Bibliografía 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Dravet C, Guerrini R. Dravet syndrome. Topics in Epilepsy series, vol. 3. London: John Libbey Eurotext; 2011. Gambardella A, Marini C. Clinical spectrum of SCN1A mutations. Epilepsia 2009; 50: 20-3. El Sabbagh S, Lebre AS, Bahi-Buisson N, Delonlay P, Soufflet C, Boddaert N, et al. Epileptic phenotypes in children with respiratory chain disorders. Epilepsia 2010; 51: 1225-35. Walker UA, Collins S, Byrne E. Respiratory chain encephalomyopathies: a diagnostic classification. Eur Neurol 1996; 36: 260-7. Bernier FP, Boneh A, Dennett X, Chow CW, Cleary MA, Thorburn DR. Diagnostic criteria for respiratory chain disorders in adults and children. Neurology 2002; 59: 1406-11. Harbord MG, Hwang PA, Robinson BH, Becker LE, Hunjan A, Murphy EG. Infant-onset progressive myoclonus epilepsy. J Child Neurol 1991; 6: 134-42. Castro-Gago M, Eirís J, Fernández-Bustillo J, Escribano D, Pintos E, Monasterio L, et al. Severe myoclonic epilepsy associated with mitochondrial cytopathy. Childs Nerv Syst 1995; 11: 630-3. Castro-Gago M, Martinón-Sánchez JM, RodríguezNúñez A, Herranz-Fernández JL, Eirís-Puñal J. Severe myoclonic epilepsy and mitochondrial cytopathy. Childs Nerv Syst 1997; 13: 570-1. Fernández-Jaén A, León MC, Martínez-Granero MA, Martínez-Bermejo A, López-Martín V, PascualCastroviejo I. Diagnóstico en la epilepsia mioclónica severa de la infancia: estudio de 13 casos. Rev Neurol 1998; 26: 759-62. Nishri D, Blumkin L, Lev D, Leshinsky-Silver E, Abu-Rashid M, Birch R, et al. Hepatic coma culminating in severe brain damage in a child with a SCN1A mutation. Eur J Paediatr Neurol 2010; 14: 456-9. Craig AK, De Menezes MS, Saneto RP. Dravet syndrome: patients with co-morbid SCN1A gene mutations and mitochondrial electron transport chain defects. Seizure 2012; 21: 17-20. Bolszak M, Anttonen AK, Komulainen T, Hinttala R, Pakanen S, Sormunen R, et al. Digenic mutations in severe myoclonic epilepsy of infancy. Epilepsy Res 2009; 85: 300-4. Frye RE. Leber’s hereditary optic neuropathy mutations associated with infantile-onset myoclonic epilepsy. J Child Neurol 2011; 26: 782-5. Castro-Gago M, Pérez-Gay L, Eirís-Puñal J. Dravet syndrome and mitochondrial dysfunction. J Child Neurol 2011; 26: 1331-4. Frye RE. Mitochondrial dysfunction and myoclonic epilepsy: cause or effect or both? J Child Neurol 2011; 26: 1332-4. Alaynick WA, Kondo RP, Xie W, He W, Dufour CR, Downes M, et al. ERRgamma directs and maintains the transition to oxidative metabolism in the postnatal heart. Cell Metab 2007; 6: 13-24. Silva MFB, Aires CCP, Luis PBM, Ruiter JP, Ijlst L, Duran M, et al. Valproic acid metabolism and its effects on mitochondrial fatty acid oxidation: a review. J Inherit Metab Dis 2008; 31: 205-16. 431