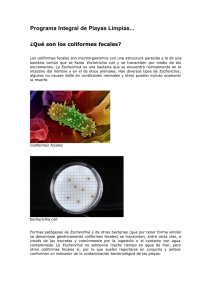
anexo 2 - Repositorio Digital UTE
Anuncio

UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL FACULTAD DE CIENCIAS DE LA INGENIERÍA CARRERA DE INGENIERÍA DE ALIMENTOS IDENTIFICACIÓN DE MICROORGANISMOS INDICADORES DE HIGIENE Y Salmonella EN HORNADO EXPENDIDO EN CUATRO LOCALES DE COMIDA TÍPICA DEL MERCADO MUNICIPAL DE SANGOLQUÍ TRABAJO PREVIO A LA OBTENCIÓN DEL TÍTULO DE INGENIERO DE ALIMENTOS JUAN FRANCISCO RIVERA CEVALLOS DIRECTORA: BIOQ. MARÍA JOSÉ ANDRADE Quito, Junio 2012 © Universidad Tecnológica Equinoccial. 2012 Reservado todos los derechos de reproducción DECLARACIÓN Yo Juan Francisco Rivera Cevallos, declaro que el trabajo aquí descrito es de mi autoría; que no ha sido previamente presentado para ningún grado o calificación profesional; y, que he consultado las referencias bibliográficas que se incluyen en este documento. La Universidad Tecnológica Equinoccial puede hacer uso de los derechos correspondientes a este trabajo, según lo establecido por la Ley de Propiedad Intelectual, por su Reglamento y por la normativa institucional vigente. _____________________________ Juan Francisco Rivera Cevallos C.I. 171467289-4 CERTIFICACIÓN Certifico que el presente trabajo que lleva por título “Identificación de microorganismos indicadores de higiene y Salmonella en hornado expendido en cuatro locales de comida típica del Mercado Municipal de Sangolquí.”, que, para aspirar al título de Ingeniero de Alimentos fue desarrollado por Juan Francisco Rivera, bajo mi dirección y supervisión, en la Facultad de Ciencias de la Ingeniería; y cumple con las condiciones requeridas por el reglamento de Trabajos de Titulación artículos 18 y 25. _____________________________ Bioq. María José Andrade Cuvi DIRECTORA DEL TRABAJO C.I. 171233837-3 DEDICATORIA Dedicado con mucho amor a mis padres, Jorge y Susana. Ellos han sido el pilar de mi formación personal y académica. Gracias por su cariño, consejos y apoyo durante todos mis años como estudiante. A mis hermanos, Jorge, Iván, Carolina y José Luis, por estar presentes en mi vida y por ser un ejemplo a seguir. A toda mi familia. Y en especial a la persona que siempre ha estado a mi lado y me ha apoyado en todo momento, Dany. Dedicado también a aquellas personas que han compartido momentos inolvidables a lo largo de mi vida universitaria y hemos vivido risas, preocupaciones, alegrías, buenos y malos momentos pero en especial aprendimos lo que significa la amistad, mis amigos. Y aquellos que luchan día a día por hacer sus sueños realidad. AGRADECIMIENTOS Agradezco principalmente a mis padres por darme el ejemplo y enseñarme lo bueno y lo malo de la vida. Gracias, por el apoyo brindado a lo largo de la realización de esta tesis, especialmente por la ayuda y soporte incondicional ofrecido. Gracias, a mi familia por apoyarme siempre y estar pendientes de mí. Agradezco a mi Directora de tesis, Bioq. María José Andrade por permitirme trabajar en este proyecto y por las enseñanzas, ayuda y apoyo brindado durante la elaboración del mismo. Además, de ser la guía oportuna en la dirección de mi tesis, su paciencia y por estar pendiente de mi futuro. Y por ser una excelente profesional. Agradezco a la Universidad Tecnológica Equinoccial y a la Carrera de Ingeniería en Alimentos por haberme formado durante estos años, me ha impartido conocimientos y experiencia que me permitirán desarrollarme como un buen profesional en esta área. Tambien agradezco a mis profesores por impartirme sus conocimientos y por su continuo esfuerzo para hacer que el Ecuador siga avanzando por el rumbo del éxito y por darme la formación para ser un gran profesional y una buena persona. Para afrontar los retos del futuro y ser alguien competitivo. Finalmente agradezco a mis amigos y compañeros por haber compartido conmigo esta etapa tan importante de mi vida. Por haber estado ahí desde el inicio hasta el final de la carrera universitaria, de cada uno de ustedes me llevo recuerdos inolvidables. ÍNDICE DE CONTENIDOS PÁGINA RESUMEN ...................................................................................................... vii ABSTRACT .................................................................................................... viii 1. INTRODUCCIÓN .......................................................................................... 1 1.1 Objetivos .................................................................................................. 6 2. MARCO TEÓRICO ...................................................................................... 8 2.1 Enfermedades trasmitidas por alimentos (ETA´s) .................................... 8 2.2 Contaminación en los alimentos ............................................................. 11 2.3 Microorganismos indicadores de contaminación en alimentos............... 13 2.3.1 Coliformes totales ....................................................................... 15 2.3.2 Coliformes fecales ....................................................................... 16 2.4 Escherichia coli ..................................................................................... 17 2.4.1 Generalidades ............................................................................ 17 2.4.2 Enfermedades causadas por E. coli ............................................ 19 2.4.3 Alimentos implicados................................................................... 20 2.4.4 Análisis microbiológico de E. coli ................................................ 20 2.5 Salmonella............................................................................................. 25 2.5.1 Generalidades ............................................................................ 25 2.5.2 Enfermedades trasmitidas por Salmonella .................................. 26 2.5.3 Alimentos implicados.................................................................. 27 2.5.4 Análisis microbiológico para la determinación de Salmonella ..... 27 2.5.5 Epidemiología de E. coli y Salmonella ........................................ 30 2.6 Hornado................................................................................................. 32 2.7 Intoxicaciones producidas por hornado en Ecuador.............................. 35 2.8 Agrio ...................................................................................................... 36 3. METODOLOGÍA ......................................................................................... 38 3.1 Descripción y toma de muestra ............................................................. 38 i PÁGINA 3.2 Preparación de la muestra .................................................................... 41 3.3 Recuento, aislamiento, e identificación de E. coli .................................. 41 3.3.1 Prueba presuntiva ...................................................................... 41 3.3.2 Prueba confirmativa .................................................................... 42 3.3.3 Pruebas complementarias (IMViC).............................................. 43 3.3.3.1 Prueba para indol .............................................................. 43 3.3.3.2 Prueba del rojo de metilo (RM) ......................................... 43 3.3.3.3 Prueba de voges proskauer (VP) ...................................... 43 3.3.3.4 Prueba para la utilización del citrato ................................. 43 3.4 Aislamiento e identificación de Salmonella............................................ 44 3.4.1 Pre-enriquecimiento no selectivo ................................................ 44 3.4.2 Enriquecimiento selectivo........................................................... 44 3.4.3 Aislamiento .................................................................................. 45 3.4.4 Purificación .................................................................................. 45 3.4.5 Selección..................................................................................... 45 3.4.6 Confirmación bioquímica ............................................................. 46 3.4.6.1 Prueba de la ureasa .......................................................... 46 3.4.6.2 Prueba de lisina - descarboxilasa ..................................... 46 3.4.6.3 Prueba de Voges - Proskauer ........................................... 46 3.4.6.4 Prueba del indol ................................................................ 47 3.4.6.5 Prueba de la utilización del citrato..................................... 47 3.5 Análisis estadístico ................................................................................ 47 4. RESULTADOS Y DISCUSIÓN ................................................................... 48 4.1 Recuento, aislamiento e identificación de coliformes totales, coliformes …..fecales, y Escherichia coli ...................................................................... 48 4.2 Aislamiento e identificación de Salmonella ........................................... 56 4.2.1 Aislamiento ................................................................................. 56 4.2.2 Selección .................................................................................... 58 4.2.3 Confirmación bioquímica ............................................................ 59 ii PÁGINA 5. CONCLUSIONES Y RECOMENDACIONES............................................. 62 5.1 Conclusiones ........................................................................................ 62 5.2 Recomendaciones ................................................................................. 63 GLOSARIO ..................................................................................................... 65 BIBLIOGRAFÍA .............................................................................................. 66 ANEXOS ......................................................................................................... 73 iii ÍNDICE DE TABLAS PÁGINA Tabla 2.1 Características generales de E. coli ............................................... 19 Tabla 2.2 Criterios para la evaluación microbiológica de la calidad de los -----------alimentos ........................................................................................ 32 Tabla 3.1 Clasificación de los coliformes por las pruebas IMViC ................... 44 Tabla 4.1 NMP de coliformes fecales por gramo de muestra analizada......... 52 iv ÍNDICE DE FIGURAS PÁGINA Figura 2.1 Determinación de NMP de coliformes en muestras sólidas o …………alimentos ...................................................................................... 16 Figura 2.2 Microfotografía de barrido electrónico de Escherichia coli ............ 18 Figura 2.3 Pruebas IMViC ............................................................................. 24 Figura 2.4 Microfotografía de barrido electrónico de Salmonella ................... 25 Figura 2.5 Plato de hornado ecuatoriano ....................................................... 33 Figura 2.6 Chancho hornado ecuatoriano ...................................................... 33 Figura 2.7 Agrio.............................................................................................. 37 Figura 3.1 Locales ubicados en el mercado ................................................... 38 Figura 3.2 Restaurantes ubicados en la avenida ........................................... 39 Figura 3.3 Plato de hornado ........................................................................... 39 Figura 3.4 Plato de hornado con agrio ........................................................... 40 Figura 4.1 Tubos con campana de Durham y caldo BGBL ............................ 48 Figura 4.2 NMP de coliformes totales por gramo de muestra analizada ........ 49 Figura 4.3 Recuento de coliformes fecales ................................................... 51 Figura 4.4 Prueba del Indol en caldo TSB ..................................................... 51 Figura 4.5 Cultivo de E. coli en agar EMB...................................................... 54 Figura 4.6 Tinción Gram de E. coli: bacilos Gram negativos.......................... 54 Figura 4.7 Presencia de E. coli en las muestras analizadas .......................... 55 Figura 4.8 Presencia de E. coli en los locales analizados.............................. 55 Figura 4.9 Colonias de Salmonella en BGA ................................................... 57 Figura 4.10 Colonias de Salmonella en SSA ................................................. 57 Figura 4.11 Colonias de Salmonella en BSA ................................................. 58 Figura 4.12 Crecimiento positivo de Salmonella en agar TSI y LIA ............... 58 Figura 4.13 Resultados positivos para Salmonella ........................................ 59 Figura 4.14 Presencia de Salmonella en locales analizados ........................ 60 v ÍNDICE DE ANEXOS PÁGINA ANEXO 1 Brotes de ETA en América Latina según alimento implicado.......................... 73 ANEXO 2 Tabla de enfermedades comunes trasmitidas a través de los alimentos, causadas por bacterias . ................................................................................. 74 ANEXO 3 Procedimiento recuento, aislamiento e identificación de E. coli ...................... 77 ANEXO 4 Procedimiento identififcación de Salmonella .................................................. 79 ANEXO 5 Tabla del NMP (Número mas probable) ......................................................... 81 ANEXO 6 Esquema de determinación de coliformes totales, fecales y E. coli ................ 82 ANEXO 7 Esquema de método de detección de Salmonella ......................................... 83 ANEXO 8 Autorizacion del Municipio de Rumiñahui para la selección de locales ........ 86 ANEXO 9 Informe entregado al Municipio del Cantón Rumiñahui ................................. 87 vi RESUMEN El hornado es un plato típico tradicional característico del Cantón Rumiñahui y de la región Sierra del Ecuador, es consumido por locales y extranjeros. En esta investigación se analizaron: coliformes totales, coliformes fecales, Escherichia coli y Salmonella debido a que estos microorganismos son indicadores de contaminación de alimentos. Las muestras analizadas fueron el hornado, el agrio y la mezcla hornado/agrio con el fin de determinar cuál de estas presenta contaminación. Para la identificación de coliformes totales, fecales y E. coli se aplicó la metodología establecida por la Norma INEN 1 529-8, y para el estudio de Salmonella se aplicó la Norma INEN 1 529-15. Los resultados obtenidos determinaron que las muestras analizadas de hornado de cuatro locales de la ciudad de Sangolquí se encontraron contaminadas por microorganismos como E. coli y Salmonella que indicaron deficiencia en la práctica higiénica relacionadas con este alimento. Se determinó que el 58% de muestras analizadas fueron positivas para E. coli. También se determinó la presencia de Salmonella en el 4% de las muestras analizadas correspondientes a las muestras de Agrio y la mezcla de Hornado/Agrio. Cabe recalcar que en las muestras de Hornado no se encontró la presencia de Salmonella. Uno de los resultados más relevantes de este estudio de investigación fue la notoria presencia de microorganismos indicadores de higiene en las muestras de hornado/agrio. Estos resultados indican que las muestras pudieron haber sido contaminadas por causas tales como: mala higiene de los manipuladores directos, la calidad sanitaria de las materias primas usadas para la elaboración de este plato, por contaminación cruzada de los utensilios utilizados o de los espacios físicos donde se procesó este alimento. Se recomienda un mayor control de higiene de los locales de expendio de comidas típicas. . vii ABSTRACT Hornado is a traditional dish of the Rumiñahui zone and the Sierra region of Ecuador and is consumed by domestic and foreign visitors. In this study we analyzed: total coliforms, fecal coliforms, Escherichia coli and Salmonella, because these organisms are indicators of fecal contamination in foods. The samples were hornado, agrio and the mix of hornado/ agrio with the objective to identify which of these samples are contaminated. For the identification of total and fecal coliforms and E. coli we followed the methodology established by the Norm INEN 1 529-8, and for the study of Salmonella was used the Norm INEN 1 529-15. The results determined that the samples from four locations in the city of Sangolquí were found contaminated by microorganisms such as E. coli and Salmonella which indicate deficiencies in hygienic practice that has to do with this food. It found that 58% of samples tested positive for E. coli. We also found the presence of Salmonella in 4% of the mixtures tested for samples of Agrio and the Hornado/Agrio mixture. It is noteworthy that the samples of Hornado did not show the presence of Salmonella. One of the main findings of this research was the strong presence of hygiene indicator microorganisms in samples of hornado/agrio. These results indicate that the samples could have been contaminated for reasons like: poor hygiene of direct food handlers, sanitary quality of raw materials used in the preparation of this dish, crosscontamination of equipment used or the physical spaces where this food was processed. We recommend greater control of hygiene of local typical food restaurants. viii 1. INTRODUCCIÓN 1. INTRODUCCIÓN Las Enfermedades Transmitidas por alimentos (ETA’s) son aquellas que “causan daño a los consumidores cuando estos ingieren comida contaminada por microorganismos patógenos” (Pacheco, 2007), esta contaminación puede originarse de muchas formas, desde que el alimento es producido, manipulado, conservado y transportado hasta cuando es servido o comercializado. La forma más común de contaminación es debido a la falta de higiene y por deficiencias en la manipulación por parte de las personas que están en contacto directo con el alimento. Las ETA’s pueden causar problemas muy graves en la salud de los seres humanos e incluso la muerte especialmente en los grupos más vulnerables que son los niños, ancianos y mujeres embarazadas. Estas enfermedades se manifiestan como: infecciones que ocurren cuando se ingieren microorganismos vivos perjudiciales; intoxicaciones que se producen por la ingesta de toxinas presentes en alimentos y toxi-infecciones que resultan de la ingestión de comida contaminada por microorganismos y éstos a su vez producen o liberan toxinas. Los síntomas más comunes en las ETA’s son las diarreas y los vómitos, pero pueden presentarse signos como: dolores abdominales, dolores de cabeza, fiebre, síntomas neurológicos, visión doble, ojos hinchados, dificultades renales, entre otras, de manera que varían de acuerdo a la cantidad de alimento contaminado consumido y al tipo de contaminación. Según la FDA (Food and Drug Administration) el 2 o 3% de ETA’s pueden llevar a una enfermedad de largo plazo (Fernández y col., 2001); por ejemplo, la bacteria Escherichia coli O157:H7 puede causar fallas en el riñón en niños y la Salmonella puede provocar artritis reactiva y serias infecciones. Según brotes que fueron notificados al Sistema Regional de Vigilancia Epidemiológica de las ETA’s (SIRVETA), desarrollado por el Instituto Panamericano de Protección de alimentos y Zoonosis (PANALIMENTOS) y que se encuentra en “fase de consolidación” respecto a la detección y registro de brotes y casos (Mattar y col., 2005), entre 1993 y el 2002, se produjeron 6324 brotes de ETA’s en América Latina y el Caribe que 1 provocaron 228.579 casos y 314 muertes (Mattar y col., 2005) y a través de estudios realizados por la FAO (Food and Agriculture Organization) los alimentos más susceptibles a sufrir contaminación y que pueden hacer daño a las personas incluyen el pescado, agua y carnes rojas. Por tal motivo y de acuerdo con la información sobre la ocurrencia de ETA’s en América, los riesgos que rodean a la inocuidad alimentaria plantean una preocupación evidente para la salud pública, que además de afectar las condiciones de salud de la población general, tienen un impacto directo en actividades como el turismo y el comercio de alimentos, que se encuentran en expansión; por ejemplo, en Ecuador y en países subdesarrollados o pobres es muy popular la venta de comidas típicas ambulantes, en mercados o en sitios donde la higiene es escasa y esto repercute cuando se dan casos de enfermedades transmitidas por alimentos y causan daño a la población nacional, tomando relevancia cuando turistas extranjeros consumen alimentos en estos lugares y a causa de ello sufren la muy conocida “diarrea del viajero” originada por microorganismos contaminantes. En Ecuador se han reportado 28 brotes de ETA’s con un total de 1859 enfermos y 12 fallecidos entre los años 1997 al 2002 (Rivero y Baquero, 2004). Por otro lado, el hornado sin duda alguna es uno de los platos más tradicionales y deliciosos del Ecuador principalmente de la región sierra, el origen de su nombre se debe a que el cerdo, chancho o puerco que es criado y engordado para este fin se lo hornea en un horno de arcilla dando así su sabor característico (Abad, 2000). La preparación de este plato gastronómicamente típico del país es todo un arte y se lo elabora artesanalmente; se lo hace realizando unos hábiles cortes en la carne y agregando ciertos condimentos como: sal, ajo, achiote, comino, pimienta, chicha, manteca de chancho y otras especias que varían de local en local. Al plato de hornado siempre se lo sirve con una guarnición (acompañante) que en términos del argot popular se lo conoce como “agrio” el mismo que está elaborado a partir de: agua, sal, cebolla, tomate riñón, trozos de ají, panela raspada, perejil, culantro, entre otros (Pazos, 2002). Muchas son las 2 ciudades que tradicionalmente ofrecen este alimento, por ejemplo: Sangolquí, Ibarra, Riobamba, Guamote y Azogues. Sin embargo, el contraste entre la alta demanda en el consumo de este alimento con las malas condiciones sanitarias de algunos de los lugares donde se lo expende y las incorrectas prácticas de manufactura por parte de las personas que manipulan este producto han hecho que la ciudadanía y las autoridades pongan en la mira a los procesos sanitarios de elaboración del hornado. En el año 2006 el Diario Hoy (distribuido a nivel nacional) publicó que: “La elaboración del hornado genera debate cada año pero igual se consume. Creen que el problema tiene relación con el reportaje de un canal de televisión que mostró un hornado lleno de gusanos en el mercado de San Roque (Quito)”. Como se explicó anteriormente, el hornado es comercializado con el agrio, estos dos productos pueden estar contaminados con microorganismos como Escherichia coli, Salmonella, Listeria monocytogenes, Trichinella spiralis y Staphylococcus aureus, causantes de ETA´s, si no se siguen correctas normas de manipulación de alimentos (FSIS, 2003). Las bacterias Escherichia coli y Salmonella son dos de los microorganismos patógenos más comunes y estudiados dentro del campo alimenticio ya que son considerados indicadores de contaminación fecal, lo que permite a los investigadores saber si los alimentos estudiados son o no de buena calidad, inocuos y aptos para el consumo humano (Fernández, 2008). Ambos se encuentran en el intestino de humanos y de animales, pertenecen a la familia de las Enterobacteriaceae, es decir son bacterias entéricas o enterobacterias, estas bacterias comprenden un grupo relativamente homogéneo de las gamma Proteobacterias, que fenotípicamente se caracterizan por ser bacilos Gram negativos no esporulados, inmóviles (en su gran mayoría) y anaerobios facultativos (Madigan y col., 2006). Entre las enterobacterias se encuentran especies patógenas para el hombre, los géneros más comunes y más representativos 3 de las bacterias entéricas patógenas son, entre otros, la Escherichia coli y Salmonella. Los miembros del género Escherichia son habitantes universales de todos los animales de sangre caliente (incluido el hombre), viven en el intestino, donde cumplen una función nutricional, sintetizando vitaminas, en especial la vitamina K. Algunas cepas de E. coli son patógenas y han sido relacionadas con el desarrollo de cuadros diarréicos en niños especialmente en guarderías infantiles; estas cepas enteropatógenas de E. coli cada vez están más frecuentemente asociadas a infecciones cuasidisentéricas y cuadros febriles agudos; dichas cepas forman antígeno K, el cual permite la colonización del intestino delgado y producción de una enterotoxina la misma que es la responsable de los cuadros diarreicos (Madigan y col., 2006). Salmonella y Escherichia son muy parecidos ya que ambos géneros tienen un 50% de homología en su ADN y debido a que estos dos microorganismos están genéticamente muy relacionadas, a veces su identificación genera considerable dificultad. Sin embargo, y en contraste con la mayoría de las Escherichia, los miembros del género Salmonella son usualmente patógenos para humanos o para otros animales de sangre caliente. En humanos, las enfermedades más comunes causada por la Salmonella son la fiebre tifoidea y la gastroenteritis (Madigan y col., 2006). Debido a la trascendencia de enfermedades producidas por estas bacterias, se han tomado medidas elementales para prevenirlas como la aplicación de principios de inocuidad alimentaria que aseguran la calidad en la producción y elaboración de los productos alimenticios y garantiza la obtención de alimentos sanos, nutritivos y libres de peligros para la población (Insunza y Soto, 1998). Las bacterias pueden estar presentes en los alimentos y los consumidores no se dan cuenta de aquello porque éstas no son visibles, a menudo no producen cambios de sabor, olor o, incluso, alteraciones en su aspecto, muchas veces los productos están contaminados y no se los detecta; debe tomarse en cuenta además que, los alimentos son fuente principal de contaminación por parte de agentes patógenos, tanto químicos 4 como biológicos (bacterias, virus y parásitos) a los cuales ninguna persona es inmune, ya sea en los países en desarrollo o en los desarrollados. El ICMSF (por sus siglas en inglés: International Commission on Microbiological Specifications for Foods), en su guía simplificada para el entendimiento y uso de objetivos de inocuidad de los alimentos y objetivos de rendimiento explica que las enfermedades causadas por patógenos alimentarios constituyen a lo largo y ancho del mundo problemas de Salud Pública y prevenirlos es la mayor meta de la sociedad (ICMSF, 2006). Mientras la eliminación total de las ETA´s se mantenga como una meta inalcanzable, los agentes gubernamentales de Salud Pública y la industria están conminados a reducir la incidencia de enfermedades debida a los alimentos contaminados” (ICMSF, 2006). Las principales causas para la contaminación con microorganismos transmisores de enfermedades alimentarias se deben a una mala preparación, cocción, manipulación o almacenamiento de los alimentos, una vez contaminados, las bacterias comienzan a multiplicarse y hacen que el consumo de estos sea peligroso para la salud, es por eso que se debe aplicar el concepto de inocuidad alimentaria que constituye un factor clave para garantizar la salud de la población (Pacheco, 2007). La alimentación representa una de las actividades más importantes del ser humano de manera que al preparar alimentos estos deben ser elaborados con las más altas normas de higiene y contar con buenas condiciones sanitarias con el objetivo de brindar alimentos saludables, a fin de mejorar la calidad de vida de los consumidores. La ingesta de alimentos contaminados por microorganismos es una de las causas más comunes de contraer enfermedades, es por eso que se debe concienciar a la sociedad sobre los riesgos que se corre al consumir alimentos en lugares donde las condiciones sanitarias no son adecuadas; de esta manera se puede beneficiar a la salud de las personas que frecuentan estos establecimientos de comida típica en general, previniendo 5 enfermedades que perjudiquen a la salud y creando buenos hábitos alimenticios. El empleo del índice de coliformes como indicadores de organismos patógenos en los alimentos es una práctica vigente en la actualidad. Los organismos coliformes son buenos indicadores de la calidad higiénica. El hallazgo de gran número de estos microorganismos en los alimentos y en el agua indica polución o contaminación fecal. Ya que las enfermedades transmitidas generalmente son de carácter intestinal, la presencia de polución indica la posibilidad de que existan agentes etiológicos productores de estas enfermedades (García, 2004). Por tal motivo, este estudio se basa en el recuento e identificación de microorganismos indicadores de higiene en el hornado y el agrio con el fin de detectar deficiencias higiénicas en estos productos que se expenden en locales de venta popular, y de esta manera dar a conocer a las autoridades competentes del Municipio del Cantón Rumiñahui para que se tomen las medidas de prevención necesarias respecto al tema. A través de las autoridades de Salud e Higiene del Cantón Rumiñahui se concienciará a los propietarios de los locales en donde se expende este tipo de comida con el fin de que mejoren la calidad de los alimentos que se expenden, mediante la aplicación de buenas prácticas de manipulación de alimentos, higiene personal y buenas condiciones sanitarias. 1.1 OBJETIVOS Objetivo general Determinar microorganismos indicadores de higiene y Salmonella en hornado expendido en cuatro locales de comida típica del Mercado Municipal de Sangolquí. 6 Objetivos específicos Realizar el recuento de coliformes totales y fecales en muestras de hornado en cuatro locales de comida típica del Mercado Municipal de Sangolquí. Realizar el recuento, aislamiento e identificación de E. coli en hornado en cuatro locales de comida típica del Mercado Municipal de Sangolquí. Identificar la presencia de Salmonella en muestras de hornado en cuatro locales de comida típica del Mercado Municipal de Sangolquí. Elaborar recomendaciones para los locales de venta de comida típica, que se entregarán a través del Ilustre Municipio del Cantón Rumiñahui. 7 2. MARCO TEÓRICO 2. MARCO TEÓRICO 2.1 ENFERMEDADES TRANSMITIDAS POR ALIMENTOS (ETA’S) Las Enfermedades Transmitidas por alimentos (ETA’s, sigla como se las reconoce en los distintos ámbitos vinculados a la alimentación) son aquellas que se originan por la ingestión de alimentos contaminados con agentes en cantidades suficientes para afectar la salud del consumidor. Sean sólidos naturales, preparados o bebidas simples como el agua, los alimentos pueden originar dolencias provocadas por patógenos, tales como bacterias, virus, hongos, parásitos o componentes químicos, que se encuentran en su interior (PANALIMENTOS, 2005). Según Benenson (1997), las enfermedades de origen alimentario, incluidas las intoxicaciones e infecciones, son patologías producidas por la ingestión accidental, incidental o intencional de alimentos o agua, contaminados en cantidades suficientes con agentes químicos o microbiológicos, debido a la deficiencia en el proceso de elaboración, manipulación, conservación, transporte, distribución o comercialización de los alimentos y agua. Bajo ciertas circunstancias los alimentos comunes pueden causar consecuencias graves, incluso la muerte. A pesar del progreso que actualmente se ha logrado en el mejoramiento general de la calidad e inocuidad de los alimentos producidos, todavía se presentan enfermedades transmitidas a través de los alimentos, causadas por patógenos microbianos (Knabel, 2009). Durante las últimas décadas, se han identificado varios nuevos patógenos importantes que se transmiten a través de los alimentos, algunos de los cuales pueden crecer a temperaturas de refrigeración. También se 8 han identificado nuevos métodos de propagación de estos microorganismos patógenos. Los cambios en las poblaciones, en los estilos de vida de los consumidores y en las preferencias alimentarias han producido cambios en la formulación, manufactura y distribución de los alimentos. Estos cambios, asociados a la habilidad que tienen los microorganismos para evolucionar rápidamente y adaptarse a su medio ambiente, presentan nuevos retos microbiológicos para todas las personas involucradas en la industria alimentaria (Knabel, 2009). Según el Codex Alimentarius (Código Alimentario), debe asegurarse la inocuidad de los alimentos para garantizar que los mismos, al ser preparados o ingeridos, no causen daño al consumidor. Los alimentos son fuentes principales de exposición a agentes contaminantes, tanto químicos como biológicos (virus, parásitos y bacterias). Por tanto, la inocuidad de los alimentos es reconocida universalmente como una prioridad de Salud Pública para evitar que los consumidores sufran ETA’s, que se originan por la ingestión de alimentos infectados con agentes contaminantes en cantidades suficientes para afectar la salud del consumidor (Arenas y col., 2009). Los agentes responsables de las ETA’s son: bacterias y sus toxinas, virus, parásitos, sustancias químicas, metales, tóxicos de origen vegetal y sustancias químicas tóxicas que pueden provenir de herbicidas, plaguicidas, fertilizantes (Arenas y col., 2009). Dentro de todas las posibles causas mencionadas, las ETA’s de origen bacteriano son las más frecuentes de todas. Estos microorganismos se encuentran en una gran variedad de alimentos. Especialmente en aquellos conocidos como de alto riesgo. En algunos casos los alimentos pueden contaminarse durante su producción o recolección, en otros casos el descuido durante la elaboración de estos en el hogar así como el uso de utensilios que fueron previamente utilizados para preparar alimentos contaminados (OPS, 1999). Productos de origen animal, tales como pescados y mariscos, carnes rojas, pollos, además de frutas y verduras, 9 huevos y productos lácteos están asociados con las ETA´s (Cast, 1994; Bean y Griffin, 1990). Por otro lado, la carne que es uno de los productos finales del proceso agroindustrial del ganado bovino o porcino, por su composición química y sus ingredientes sensibles a la contaminación, es considerada como un alimento de alto riesgo en Salud Pública. En su proceso agroindustrial de obtención, la carne y sub-productos inadecuadamente manipulados, pueden contaminarse con diversos agentes patógenos y químicos causantes de ETA’s, muchos de los cuales proceden de los animales vivos, por lo que el control en su aprovechamiento es esencial para reducir el nivel de contaminación en mataderos, plantas de procesamiento y en la manipulación del producto final (Arenas y col., 2009). En el grupo de las ETA´s se pueden distinguir tres tipos: infecciones, intoxicaciones y toxi-infecciones (OPS, 1999): Infecciones alimentarias.- Producidas por la ingestión de alimentos o agua contaminados con agentes infecciosos específicos tales como bacterias, virus, hongos, parásitos, que en el intestino pueden multiplicarse y/o producir toxinas (OPS, 1999). Intoxicaciones alimentarias.- Producidas por la ingestión de toxinas producidas en los tejidos de plantas o animales, o productos metabólicos de microorganismos en los alimentos, o sustancias químicas que se incorporan a ellos de modo accidental o intencional en cualquier momento desde su producción hasta su consumo (OPS, 1999). Toxi-infecciones alimentarias.- Producidas por la ingestión de comida contaminada por microorganismos y éstos a su vez producen o liberan toxinas. Los síntomas de estas enfermedades se desarrollan durante 1-7 días posteriores al consumo del alimento contaminado e incluyen alguno de los siguientes: fiebre, dolor de cabeza, nauseas, vómitos, dolor abdominal, diarrea. Los síntomas tanto de las infecciones como intoxicaciones varían de acuerdo al tipo de agente responsable así como la cantidad de alimento 10 contaminado que fue consumido. Para las personas sanas, las ETA’s son enfermedades pasajeras, que sólo duran un par de días y sin ningún tipo de complicación. Pero para las personas susceptibles (niños, ancianos, mujeres embarazadas y personas enfermas), pueden llegar a ser muy graves, dejar secuelas o incluso provocar la muerte (PANALIMENTOS, 2007). 2.2 CONTAMINACIÓN EN LOS ALIMENTOS La calidad de los alimentos es un factor de vital importancia para el desarrollo del ser humano es por ello que el comer es una actividad básica para el hombre, la selección y el planeamiento de los alimentos se ven influidas por la historia, la cultura y el ambiente, además de la disponibilidad y las preferencias personales. De este modo, la comida preparada en condiciones sanitarias, asociada a una correcta nutrición, resulta un factor esencial para la salud. Una alimentación saludable contribuye a elevar la calidad de vida de las personas y un plato de comida apetitoso influye benéficamente sobre el crecimiento, desarrollo, rendimiento escolar y laboral. (Schinitman, 2005). En general la producción de alimentos libres de contaminantes no sólo depende del lugar de su producción sino también de los procesos de elaboración y de las personas que tienen contacto con ellos. La contaminación de los mismos puede producirse en cualquier momento desde su cosecha, pasando por la elaboración a nivel industrial, hasta cuando se prepara la comida en el hogar (Ortiz y col., 2008). Con frecuencia, la contaminación bacteriana de los alimentos es la principal causa de problemas de salud en relación con el consumo de alimentos. Las consecuencias de una contaminación bacteriana de alimentos más comunes incluyen gastroenteritis, diarreas, molestias gastrointestinales, entre otros. Por orden de importancia, las salmonelosis son la principal causa de problemas alimentarios, seguidas por los trastornos provocados por los estafilococos y los clostridios. Además de estos 11 contaminantes, existen los llamados patógenos emergentes: Campylobacter, Yersinia, Listeria y ciertas cepas de Escherichia coli, de importancia creciente, debido en parte a que, según Ortiz y col., (2008) cuando se aplican las medidas higiénicas preventivas para evitar la presencia de los microorganismos clásicos, se favorece involuntariamente el crecimiento de los emergentes, menos competitivos que los clásicos, pero más resistentes a las medidas habituales de control del crecimiento microbiano. Debido a la importancia en Salud Pública de las toxiinfecciones alimentarias, la labor del microbiólogo de alimentos se dirige, en muchos casos, al control destinado a evitar el consumo de productos elaborados en condiciones deficientes y que, por tanto, sean potencialmente peligrosos. Para ello, según expone Narang (2004), debe tenerse en cuenta, a la hora de realizar un análisis microbiológico de alimentos: a) Las fuentes de contaminación del alimento. b) Las rutas de infección del patógeno. c) La resistencia de los patógenos a condiciones adversas. d) Las necesidades de crecimiento de los patógenos. e) Minimizar la contaminación y el crecimiento de los microorganismos. f) Técnicas de detección y aislamiento. g) Método de muestreo proporcional al riesgo. Todas las personas involucradas en la industria alimentaria (desde el productor hasta la persona que prepara el alimento) deben reconocer la necesidad de vigilancia para controlar los riesgos microbiológicos, a fin de reducir las enfermedades transmitidas a través de los alimentos (Knabel, 2009). 12 Los microorganismos presentes en los alimentos son muy preocupantes para la Salud Pública a escala mundial; actualmente se reconoce que más de 200 enfermedades son causadas por alimentos, donde los microorganismos comúnmente involucrados han sido Salmonella spp., Escherichia coli enterotoxigénica (ETEC), Escherichia coli enteropatógena (EPEC), Escherichia coli enterohemorrágica 0157:H7 (EHEC), Campylobacter jejuni, Listeria monocytogenes y Staphylococus aureus. Estos microorganismos se encuentran relacionados con productos de origen pecuario. Aunque la mayoría de las bacterias causantes de ETA's normalmente se destruyen por los procesos normales de cocción, aquellos alimentos mal cocidos o almacenados en condiciones inapropiadas, pueden originar casos de diarreas, colitis, gastroenteritis aguda, además de causar complicaciones a largo plazo como artritis reactiva (debida a Salmonella, Shigella y Yersinia) síndrome de Guillan Barré (debida a Campylobater) y el síndrome urémico hemolítico (debido a E. coli O157:H7). Estas bacterias patógenas, se caracterizan por causar alta morbilidad en la población en general; no obstante, son los niños, ancianos, mujeres embarazadas y pacientes inmunocomprometidos quienes constituyen la población más susceptible, pudiendo sufrir consecuencias graves y hasta fatales (Arenas y col., 2009). 2.3 MICROORGANISMOS INDICADORES DE CONTAMINACIÓN EN ALIMENTOS Se consideran microorganismos indicadores aquellos organismos (o grupos de microorganismos) que advierten oportunamente de un manejo inadecuado o contaminación, que incrementan el riesgo de presencia de microorganismos patógenos en alimentos. Además, permiten un enfoque de prevención de riesgos, puesto que advierten manejo inadecuado y/o contaminación (Pierson y Smoot, 2001). Los principales microorganismos indicadores en alimentos se dividen en: 13 - Indicadores de condiciones de manejo o de eficiencia de proceso: mesófilos aerobios (determinados por recuento total), hongos y levaduras, y coliformes totales. - Indicadores de contaminación fecal: coliformes fecales, E. coli, Enterococos, Cl. perfringens. El grupo de los coliformes constituyen un grupo heterogéneo con hábitat primordialmente intestinal para la mayoría de las especies que involucra. Son enterobacterias que pertenecen al género Escherichia y a otros relacionados como Klebsiella, Enterobacter, Citrobacter o Serratia. Son gérmenes de gran ubicuidad y capacidad de proliferación, y a la vez de fácil cultivo e identificación, y por lo tanto muy útiles como indicadores de contaminación, pero no son enteropatógenos como grupo (como tampoco lo es E. coli) y por lo tanto su presencia en alimentos, ambiente o pacientes no certifica la etiología de una infección intestinal o un brote de ETA (Camacho y col., 2009). Debido a que un gran número de enfermedades son transmitidas por vía fecal-oral utilizando como vehículo los alimentos y el agua, es necesario contar con microorganismos que funcionen como indicadores de contaminación fecal. Estos deben ser constantes, abundantes y exclusivos de la materia fecal, deben tener una sobrevivencia similar a la de los patógenos intestinales y deben ser capaces de desarrollarse fuera del intestino (Camacho y col., 2009). El grupo coliforme es constante, abundante y casi exclusivo de la materia fecal, sin embargo, las características de sobrevivencia y la capacidad para multiplicarse fuera del intestino también se observan en aguas potables, por lo que el grupo coliforme se utiliza como indicador de contaminación fecal en agua; conforme mayor sea el número de coliformes en agua, mayor será la probabilidad de estar frente a una contaminación reciente (Camacho y col., 2009). 14 Cuando los coliformes llegan a los alimentos, no sólo sobreviven, sino que se multiplican, por lo que en los alimentos el grupo coliforme adquiere un significado distinto al que recibe en el agua. En productos alimenticios que han recibido un tratamiento térmico (pasteurización, horneado, cocción, entre otros), se utilizan como indicadores de malas prácticas sanitarias (Camacho y col., 2009). La selección de indicadores en un alimento depende fundamentalmente de los riesgos implicados y de lo que se requiera saber para liberar, controlar o mejorar el alimento, manteniendo el enfoque preventivo (Osuna, y col. 2010). Entre los microorganismos indicadores incluidos en este estudio, están los coliformes totales, coliformes fecales, Escherichia coli y Salmonella. 2.3.1 COLIFORMES TOTALES El grupo de las bacterias coliformes totales, comprende todos los bacilos Gram negativos aerobios o anaerobios facultativos, no esporulados, que fermentan la lactosa con producción de gas en un lapso máximo de 48 horas a 35°C ± 1ºC. Durante mucho tiempo se consideraron evidencia de contaminación fecal, pero se ha demostrado que muchos de ellos pueden vivir e incluso crecer en el suelo, el agua y otros ambientes. Actualmente se consideran un excelente indicador de la eficiencia de los procesos de sanitización y desinfección, así como de calidad sanitaria en agua, vegetales y diversos productos procesados. Su determinación se basa generalmente en la capacidad de fermentar lactosa (Osuna, y col. 2010). Para la cuantificación de cantidades muy bajas de coliformes totales se utiliza el método del número más probable (NMP) que es un método estadístico en tres etapas. También se pueden detectar por recuento en placa utilizando agar bilis-rojo violeta (ABRV) en el cual las colonias fermentadoras de lactosa causan el viraje del indicador; pueden detectarse 15 por filtración en membrana (Millipore) e incubación en medios adecuados, además se utilizan métodos rápidos como las placas Petrifilm y reacciones cromogénicas o fluorogénicas (Alonso y Poveda, 2008). 2.3.2 COLIFORMES FECALES Las bacterias coliformes fecales se consideran el indicador más adecuado de contaminación con heces de animales y humanos, por ejemplo en pescados y mariscos, carnes, leche, alimentos procesados, entre otros. La determinación se hace a partir de la segunda etapa (confirmativa) del método del NMP. Generalmente se combinan las determinaciones, según se requiere (Osuna, y col. 2010). La demostración y el recuento de organismos coliformes, puede realizarse mediante el empleo de medios de cultivo líquidos y sólidos con características selectivas y diferenciales (Camacho y col., 2009). En la figura 2.1 se muestra un diagrama para detectar el número más probable de coliformes (FDA, 2003) en muestras sólidas o alimentos. Figura 2.1 Determinación de NMP de coliformes en muestras sólidas o alimentos. (FDA, 2003). El grupo de las bacterias coliformes fecales, está constituido por bacterias Gram negativas capaces de fermentar la lactosa con producción 16 de gas a las 48 horas de incubación a 44.5 ± 0.1°C. Este grupo no incluye una especie determinada, sin embargo la más prominente es Escherichia coli (Osuna, y col. 2010). La E. coli se considera indicador de contaminación fecal reciente, humana o animal en productos como agua embotellada, leche y jugos, alimentos infantiles y alimentos procesados en general. Se caracteriza por ser termotolerante (fermenta lactosa a 44.5°C), produce indol a partir de triptófano y produce glucuronidasa, características que se usan para su identificación en laboratorio, generalmente en la etapa final del NMP o de alguno de los otros métodos, incluyendo Petrifilm (Osuna, y col. 2010). 2.4 Escherichia coli 2.4.1 GENERALIDADES La Escherichia coli forma parte de la familia Enterobacteriaceae (Ewing, 1985), fue descubierta por el biólogo alemán Theodor Von Escherich en 1860. Von Escherich la bautizó como bacterium coli “bacteria del intestino”, del griego kolon “intestino”. La microbiología sistemática se encargó de nombrar el género Escherichia en honor a su descubridor (Páez, 2009). E. coli es una de las especies bacterianas más minuciosamente estudiadas (Figura 2.2), no solamente por sus capacidades patogénicas sino también como sustrato y modelo de investigaciones metabólicas, genéticas, poblacionales y de diversa índole (Neidhardt, 1999). 17 Figura 2.2 Microfotografía de barrido electrónico de Escherichia coli. (Rocky Mountain Laboratories, 2005). La familia de las enterobacterias está integrada por bacilos Gram negativos no esporulados, móviles con flagelos perítricos o inmóviles, aerobios-anaerobios facultativos, capaces de crecer en agar MacConkey y en medios simples con o sin agregado de NaCl, fermentadores y oxidativos en medios con glucosa u otros carbohidratos, catalasa positivos, oxidasa negativos, reductores de nitratos a nitritos (Benavides, 2010). Según Olivet (2008), son bacterias de rápido crecimiento y amplia distribución en el suelo, el agua, vegetales y gran variedad de animales. En conjunto, la importancia de las enterobacterias en patología humana puede cuantificarse constatando que constituyen el 50% aproximadamente de todos los aislamientos clínicamente significativos en los laboratorios microbiológicos y hasta el 80% de todos los bacilos Gram negativos identificados. Integran también esta familia otros géneros asociados con infecciones intestinales, como son Salmonella, Shigella y Yersinia. E. coli y otras especies del género Escherichia son generalmente móviles, producen ácido y gas a partir de la glucosa, arabinosa y habitualmente de la lactosa y otros azúcares. Producen reacción positiva de rojo de metilo y negativa de vogues-proskauer. Son incapaces de crecer en medio con citrato como única fuente de carbono y energía. Son H2S, ureasa y fenilalanina negativos, pero en general son indol positivo y tienen la capacidad de decarboxilar la lisina, como lo muestran los datos presentados 18 en la tabla 2.1. Se clasifican en más de 170 serogrupos O según las características antigénicas de su LPS (lipopolisacáridos) y en serotipos por la combinación de antígenos O y H flagelares. Otros antígenos presentes en distintas cepas (capsulares, fimbriales y otros) han sido empleados para su clasificación o identificación (Olivet, 2008). Tabla 2.1 Características generales de Escherichia coli. (Neidhardt, 1999). (+) = amplia mayoría de cepas positivas 2.4.2 ENFERMEDADES CAUSADAS POR Escherichia coli E. coli puede ser causa de enfermedad endógena en pacientes debilitados o en situación de alteración de la pared intestinal (peritonitis, sepsis, entre otras), pero las infecciones entéricas provocadas por este germen no son causadas por las cepas que habitan normalmente el intestino, sino por líneas especialmente patógenas en esta localización (Nataro y Kaper, 1998), que se transmiten por vía fecal-oral de persona a persona o a través del agua y alimentos. La dosis requerida para enfermar parece ser del orden de 10 a 100 células por gramo o mililitro. Se produce diarrea acuosa o usualmente con sangre, dolores abdominales severos, náuseas, vómitos y a veces fiebre. La 19 colitis hemorrágica puede derivar en una falla aguda del riñón o en Síndrome Urémico Hemolítico (SUH) en el 5 % de los infectados. Del 3 a 5 % de los que padecen SUH sufren la muerte. Los que consiguen recuperarse padecen fallas renales, complicaciones neurológicas y otras secuelas por mucho tiempo (Michanie, 2003). 2.4.3 ALIMENTOS IMPLICADOS Son varios los alimentos implicados en infecciones por E. coli como por ejemplo carne picada insuficientemente cocida, hamburguesas, carne de cerdo, agua de pozos, jugos no pasteurizados, frutas, yogur, vegetales crudos, salame, lechuga, leche cruda y otros como sustitutivos del café, hortalizas, ensaladas y purés de patatas, sushi y quesos blandos madurados por mohos. Los alimentos con mayor índice de contaminación por E. coli son: carne de vacuno, carne de cerdo, aves de corral y carne de cordero. También están implicadas diversas carnes de mamíferos y aves. La carne bovina ha sido el alimento involucrado con mayor frecuencia en brotes en los EE.UU., y las hamburguesas poco cocidas el alimento más frecuente (Michanie, 2003). 2.4.4 ANÁLISIS MICROBIOLÓGICO DE E. coli Los métodos de laboratorio utilizados para la detección o recuento de microorganismos forman parte del criterio microbiológico. La selección del método a utilizar debe privilegiar a aquellos métodos estandarizados y de alta sensibilidad que hayan sido validados por organismos internacionales y nacionales de referencia (Código Alimentario Argentino, 2005). Según Pascual y Calderón (2000), para la detección de la bacteria E. coli, intervienen las siguientes pruebas: 1) Presuntiva 2) Confirmativa 20 3) Complementaria La prueba presuntiva para diferenciación de los bacilos entéricos Gram negativos se basa en la valoración de la fermentación de la lactosa sobre medios de cultivo adicionados con este carbohidrato, como el caldo lactosa (BGBL), el caldo lauril triptosa (CLT), el caldo MacConkey, o el Medio E.C. que son medios selectivos y de enriquecimiento ya que inhiben el crecimiento de microorganismos distintos de los del grupo de los coliformes a la vez que permite que éstos crezcan sin restricción. Los coliformes son lactosa positiva, es decir, son capaces de fermentarla con producción de ácido y gas, estos signos son los que se buscan en la prueba presuntiva (Camacho, 1990). La prueba confirmativa se basa en la siembra en agar EMB Levine; el cual es utilizado para el aislamiento selectivo de bacilos Gram negativos de rápido desarrollo y escasas exigencias nutricionales. Permite el desarrollo de todas las especies de la familia Enterobacteriaceae. Este medio combina las fórmulas de Holt-Harris y Teague con la de Levine, para obtener un mejor rendimiento en el aislamiento selectivo de enterobacterias y otras especies de bacilos Gram negativos. La diferenciación entre organismos capaces de utilizar la lactosa y/o sacarosa, y aquellos que son incapaces de hacerlo, está dada por los indicadores eosina y azul de metileno; éstos ejercen un efecto inhibitorio sobre muchas bacterias Gram positivas. Muchas cepas de Escherichia coli y Citrobacter spp. presentan un característico brillo metálico. Las cepas que utilizan la lactosa poseen centro oscuro con periferia azulada o rosada, mientras que las que no lo hacen son incoloras (MacFaddin, 2003). Cuando coincide crecimiento positivo (gas) en caldo BGBL a 44,5 ºC, producción de indol y crecimiento característico sobre el agar EMB, se hace la lectura en la tabla del NMP para obtener el número de E. coli por gramo o ml de muestra (Pascual y Calderón, 2000). 21 En la prueba complementaria, según explica MacFaddin (2003), las bacterias pertenecientes a la familia Enterobacteriaceae, pueden identificarse a través de una serie de pruebas bioquímicas, que permiten determinar la presencia o ausencia de ciertas enzimas y a veces incluso permiten determinar la existencia de una secuencia metabólica. Con este fin se han desarrollado diversos esquemas de clasificación, uno de los más conocidos y utilizados corresponde al IMViC que son un grupo de cuatro reacciones bioquímicas que se utilizan para la diferenciación fisiológica de los bacilos coliformes. Las cuatro reacciones bioquímicas son (IMViC): I: Formación de indol a partir de triptófano M: Prueba del rojo de metilo V: Prueba de Voges-Proskauer iC: La utilización del citrato como fuente de carbono Prueba del indol (I): Esta prueba se la puede analizar en los medios de SIM (sulfuro indol movilidad) o TSB (caldo triptona de soya), el primero es utilizado también para investigar la motilidad y la producción de H2S. Estos medios están enriquecidos con triptófano, aminoácido suministrado por una peptona adecuada que se descompone en indol por acción de la enzima triptofanasa, presente en algunos microorganismos. Esta prueba va a consistir en observar si el microorganismo es capaz de producir indol cuando está en presencia de agua de peptona. El indol producido es detectado por indol de kovacs que produce una coloración al reaccionar con él (MacFaddin, 2003). Prueba del rojo de metilo (M): Esta es una prueba cualitativa de la acidez producida por el crecimiento de una bacteria en agua de peptona glucosa con tampón fosfato. Debido a la acidez producida, el medio virará de amarillo a rojo considerando 22 la prueba positiva al añadir un reactivo. El procedimiento es el mismo que el del indol, con la diferencia que, en lugar de añadir indol de kovacs, debe añadirse rojo de metilo (como indicador) (MacFaddin, 2003). Prueba de Voges-Proskauer (V): Algunas bacterias producen acetil-metil-carbinol (producto intermedio en la degradación de la glucosa de los hidratos de carbono), que en presencia de KOH y aire, se oxida para dar di-acetilo, que reacciona con αnaftol y un producto de descomposición de la arginina de la peptona, para producir un color rojo (MacFaddin, 2003). Prueba del citrato (iC): Esta prueba determina la capacidad que presenta el microorganismo problema para utilizar el citrato como única fuente de carbono. Para esta prueba se utiliza el agar de Simmons que contiene citrato de sodio y azul de timol como indicador. Si la reacción es positiva el indicador se vuelve azul (debido a la producción de amoníaco que lo alcaliniza). Los demás microorganismos no crecen y el medio conserva su color verde, indicando una reacción negativa (MacFaddin, 2003). Escherichia coli responde a las pruebas IMViC de la forma siguiente (Figura 2.3): Indol (I) = positivo (+). rojo de metilo (M) = positivo (+). Voges -Proskauer (V) = negativo (-). citrato (iC) = negativo (-). 23 Figura 2.3 Pruebas IMViC Por otro lado, según estadísticas de los CDC (2006) (U.S. centers for disease control and prevention por sus siglas en inglés (CDC) o centros para el control y la prevención de enfermedades) se calcula que la E. coli causa unos 73,000 casos de infección, entre ellos 61 muertes, cada año en los Estados Unidos. Los alimentos implicados en brotes de ETA’s son alimentos mal cocinados (en especial carnes crudas o poco cocidas) y otros alimentos, como espinacas, coles de Bruselas, lechuga, leche sin pasteurizar y jugo. Según la Norma Legal Peruana (2003) de "criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano" se considera microorganismo de riesgo para la salud: moderado, directo y de diseminación posiblemente extensa a Escherichia coli patógeno. En productos cárnicos crudos los límites para E. coli son 50 - 5x102 UFC, mientras que en productos cárnicos (embutidos) cocidos o escaldados el límite es de 10 - 102 UFC. En comidas preparadas cocidas a base de 24 carnes la presencia de E. coli tiene que ser <10 UFC (Norma Legal Peruana, 2003). La Norma Técnica Ecuatoriana INEN de carne y productos cárnicos (carne molida) INEN 1 348 1895-11, establece como requisitos microbiológicos valores máximos de 250 UFC/g para coliformes totales y para coliformes fecales debe ser negativo. Para embutidos cárnicos escaldados o cocidos el límite máximo es de <3 UFC/g (indica que en el método de NMP (con tres tubos por dilución), no debe dar ningún tubo positivo); sin embargo no existe en el Ecuador una norma que indique los requisitos microbiológicos para el hornado. 2.5 Salmonella 2.5.1 GENERALIDADES El género Salmonella es de taxonomía difícil, modificada en estos últimos años por el aporte de estudios moleculares de homología de ADN que han clarificado el panorama taxonómico de las enterobacterias. Para la bacteriología clínica, Salmonella es un bacilo (Figura 2.4) patógeno primario (como Shigella, Yersinia y ciertas cepas de E. coli), anaerobio facultativo, algunos son móviles y no fermentan la lactosa. Salmonella typhi es la única serovariedad que no produce gas en la fermentación de los azúcares (Brooks y col., 2002). Figura 2.4 Microfotografía de barrido electrónico de Salmonella. (Velilla, 2006.) 25 Clásicamente se distinguían tres únicas especies patógenas primarias: S. typhi, S. cholerae-suis y S. enteritidis. A su vez, según la serotipificación de Kauffman y White (1997), eran clasificadas en más de 2000 serotipos con base en los antígenos flagelares H (proteicos) y antígenos somáticos O (fracción polisacárida del lipopolisacárido bacilar). S. typhi posee además un antígeno de virulencia (Valentí y Rozman, 2000). La Salmonella recibe su nombre por Daniel Elmer Salmon, un patólogo veterinario estadounidense, quien descubrió la bacteria por primera vez en 1885, aislándola de cerdos con cólera. La salmonelosis entérica está habitualmente causada por Salmonella entérica subespecie entérica, con más de 2.000 cepas descritas (Ryan y Ray, 2004), es de importancia en países en desarrollo, donde su incidencia está en aumento, y en algunos países, la enfermedad es endémica (Méndez y col., 2006). 2.5.2 ENFERMEDADES CAUSADAS POR Salmonella La salmonelosis es una enfermedad de transmisión alimentaria, en especial por alimentos de origen animal y pueden aparecer en brotes en escuelas, guarderías, restaurantes y residencias de ancianos. El período de incubación es por lo general entre 12 a 36 horas, a veces hasta 6 y 48 horas (Durango y col., 2004). En el caso de la Salmonella, la sola presencia de esta bacteria ya es motivo para provocar síntomas en humanos saludables, según estudios hechos con voluntarios (Bravo y col., 2007). La Salmonella habita normalmente en la superficie de los huevos, la piel de tomates y de aquellos frutos y verduras que tienen contacto con la tierra. La fiebre tifoidea es otra de las enfermedades que pueden ser ocasionadas por bacterias del género Salmonella. Habitualmente esta enfermedad está provocada por cepas de Salmonella entérica serotipo typhi (Salmonella typhi). El único reservorio de la Salmonella typhi es el hombre, de modo que se transmite de una persona a otra (Valentí y Rozman, 2000). 26 2.5.3 ALIMENTOS IMPLICADOS El género Salmonella, agente etiológico de la salmonelosis, afecta a aves de corral, vacunos, porcinos y ovinos, entre otras especies. Estas bacterias, son los más frecuentes agentes causales de enfermedades transmitidas por alimentos (ETA’s). En el período 1995-1999 fueron el segundo grupo bacteriano más importante causante de ETA’s en Latinoamérica y el Caribe. La carne de aves, huevos y productos derivados son alimentos que, muy frecuentemente, ocasionan brotes de ETA’s (Velilla, 2006). La Salmonella es la causa mayoritaria de los brotes de toxiinfecciones alimentarias y de alteraciones gastroentéricas. El principal reservorio de Salmonella son las aves de corral, el ganado vacuno y el porcino; por lo tanto, son fuentes de infección importantes las carnes de estos animales y los huevos. Tradicionalmente, los ovoproductos y los preparados a base de huevo han sido los alimentos que han causado el mayor índice de brotes de Salmonella y los de mayor riesgo sanitario, especialmente aquellos que contienen huevo crudo, como la mayonesa, las salsas, los helados, las cremas, las masas de pastelería, entre otros. Otros alimentos implicados son la leche no pasteurizada, el chocolate, así como los brotes de semillas de soja o alfalfa y las carnes poco cocinadas, principalmente de cerdo, de ave y carnes fermentadas (CRESA, 2003). 2.5.4 ANÁLISIS MICROBIOLÓGICO PARA LA DETERMINACIÓN DE Salmonella Según se indica en el manual de bacteriología analítica (BAM) de los Estados Unidos y la metodología de otros países de la Comunidad Económica Europea, el usar métodos de cultivo tradicionales sigue siendo la referencia más importante para la detección de microorganismos de interés sanitario para el ser humano (Quintanilla, 2008). 27 Todos los métodos para detección de Salmonella, involucran en mayor o menor grado las siguientes etapas: 1) Pre-enriquecimiento 2) Enriquecimiento Selectivo 3) Aislamiento Diferencial 4) Pruebas Bioquímicas Presuntivas 5) Pruebas Bioquímicas Confirmativas 6) Serología con anticuerpos específicos Cada una de las etapas anteriores tiene una duración mínima de 24 a 48 horas, lo cual lleva a terminar el ensayo o análisis del patógeno en períodos no menores a 7 días en la mayoría de los casos. Para Salmonella, específicamente serían 9 días (Quintanilla, 2008). El pre-enriquecimiento, según explica Quintanilla (2008) tiene como objetivo el desarrollo general de microorganismos del tipo similar a aquel que se está buscando que se desarrollen por lo menos 2 o 3 logaritmos. Todos aquellos microorganismos que no son del mismo grupo (en el caso de Salmonella, aquellos diferentes al grupo Enterobacteriaceae) suelen ser inhibidos o tienen crecimiento marginal durante este paso. Los caldos más usados suelen ser el lactosado, el agua peptonada bufferada y el caldo soya tripticaseína. El enriquecimiento selectivo (E.S.) como su nombre lo indica, es buscar llevar a un nivel cercano al 1,000,000 de células/mL (106) y neutralizar eficazmente a otros miembros que puedan tener un desarrollo similar en la microflora del alimento que se está analizando. En el caso específico de Salmonella, durante esta etapa se busca desarrollarla por encima de bacterias coliformes como E. coli, Citrobacter y Proteus. En esta 28 etapa suelen usarse caldos selectivos como el tetrationato, el Rappaport Vassiliadis y el selenito cistina (Quintanilla, 2008). Durante el aislamiento diferencial, se toma una asada del medio de E.S. y se re-siembra por estriado en una sola placa o máximo en la mitad de una placa de petri regular. El estriado debe ser lo suficientemente espaciado para que al término del mismo, puedan llegarse a seleccionar colonias puntiformes que puedan ser aisladas para el siguiente paso. Para el análisis de Salmonella, existen más de 5 formulaciones de agar ampliamente usadas entre los que están el agar entérico Hektoen, el agar verde brillante, el agar de sulfito bismuto, el agar McConkey, el agar XLD y el agar Salmonella Shigella (Quintanilla, 2008). Las pruebas bioquímicas presuntivas se enfocan a buscar ciertas características bioquímicas relacionadas con motilidad o desarrollo de algún color, turbidez o precipitación sobre un agar o un caldo selectivo en tubo. Estas pruebas permiten descartar si bacterias con un desarrollo en agar muy parecido a la bacteria objetivo (para Salmonella, bacterias como Proteus vulgaris, E. coli y Citrobacter freundii) y determinar en esta etapa si conviene continuar a la búsqueda del género y especie del microorganismo en el siguiente paso. Para Salmonella, los dos ensayos analíticos más comunes incluyen el uso del agar triple azúcar hierro (TSI) y el agar lisina hierro (LIA) (Quintanilla, 2008). Las pruebas bioquímicas confirmativas, acorde al manual de Bergey (Bergey, 1994), son el conjunto de análisis específicos para la determinación del género y especie de los microorganismos. Estas incluyen pruebas como el indol, citrato de Simmons, manitol, urea, rojo de metilo y Voges proskauer. Acorde a los resultados de cada una de ellas, se determina la identidad del microorganismo. La serología, usa antisueros específicos para cada microorganismo que indican el detalle exacto de las características bioquímicas y fisiológicas. 29 Casi todas ellas son por aglutinación en látex y suelen demorar de 1 a 3 días (Quintanilla, 2008). Según la Norma Legal Peruana (2003) de "criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano" se considera microorganismos de riesgo para la salud: moderado, directo y de diseminación posiblemente extensa a Salmonella. La ausencia de Salmonella indica que los alimentos cárnicos crudos o cocidos y comidas preparadas en base a carnes, pueden ser aptos para el consumo humano sin riesgo a la salud (Norma Legal Peruana, 2003). Por otra parte la Norma Técnica Ecuatoriana INEN de carne y productos cárnicos (carne molida) INEN 1 348 1895-11, establece que para cualquier producto cárnico la Salmonella debe estar ausente en 25 g de muestra, para ser apto como producto de consumo humano. 2.5.5 EPIDEMIOLOGÍA DE E. coli y Salmonella Bacterias causantes de ETA’s como E. coli y Salmonella pueden contaminar diferentes tipos de alimentos como por ejemplo: E. coli puede contaminar carne picada insuficientemente cocida, hamburguesas, carne de cerdo, agua de pozos, jugos no pasteurizados (pH 3,5), agua contaminada por la bacteria, frutas, yogur, vegetales crudos, salame, lechuga, quesos, leche cruda y otros. La carne bovina ha sido el alimento involucrado con mayor frecuencia en brotes en los EE.UU., y las hamburguesas poco cocidas el alimento más frecuente. Desde 1982 esta bacteria está asociada a alimentos causantes de brotes en EE.UU y más tarde en Japón y otros países (Michanie, 2003). En Ecuador, no se ha documentado el aislamiento de este tipo de E. coli de alimentos comprometidos en brotes; es decir, no existen aún evidencias epidemiológicas documentadas de los casos esporádicos o brotes por alimentos. 30 La infección por Salmonella está asociada con la ingestión de alimentos preparados o manipulados inapropiadamente o previamente contaminados. Las carnes, los productos lácteos y los huevos crudos son las fuentes más probables de infección o de contaminación extra intestinal fecal (Durango y col., 2004). Los alimentos más proclives a contener Salmonella son los huevos crudos o a medio cocer (mayonesas caseras, huevo poché, clara batida, bebidas con yema de huevo, entre otros) carnes mal cocidas o que hayan perdido la cadena de frío. En sí, todo alimento crudo de origen animal y las frutas o verduras mal lavadas pueden trasmitir la enfermedad, también hay que tener en cuenta que si éstos entran en contacto con utensilios o productos listos para el consumo pueden contaminarlos y de ese modo propagar la infección. Los alimentos que se contaminan con mayor frecuencia corresponden a productos de origen animal, tales como: carnes de ave, cerdo, bovino, huevo, leche y sus derivados y mariscos, especialmente aquellos que habitan en el litoral y donde confluyen aguas servidas (Insunza y Soto, 1998). La presencia de Salmonella en platos preparados puede tener varios orígenes, entre los más importantes, figuran la presencia del agente en las materias primas animales o vegetales y la acción de personas al manipular los alimentos en forma inadecuada que pueden producir una contaminación cruzada entre materias primas y productos terminados. Por otra parte, si los manipuladores son portadores sanos de Salmonella, existe también el riesgo de que sean fuente de contaminación de los alimentos que manipulan (Insunza y Soto, 1998). Se debe tomar en cuenta los criterios o límites de presencia de microorganismos que causan enfermedades al consumirlos en distintos alimentos como se muestra en la tabla 2.2. 31 Tabla 2.2 Criterios para la evaluación microbiológica de la calidad de los alimentos. Microorganismo Límites Bacterias aerobias mesófilas (alimentos crudos) < 1 x 106 UFC/g Bacterias aerobias mesófilas (alimentos cocidos) < 1 x 104 UFC/g Mohos < 20 UFC/g Levaduras < 50 UFC/g Escherichia coli (alimentos crudos) < 100/g Escherichia coli (alimentos cocidos) < 3 /g Salmonella Ausencia en 25 g (Arango y col., 1997) UFC/g: unidades formadoras de colonias por gramo de muestra. 2.6 HORNADO El hornado de chancho o cerdo es un plato típico del Ecuador y hay muchos lugares en los mercados populares que se especializan en la elaboración de este producto, por lo general hornean el chancho o cerdo entero en un horno de arcilla. Es un plato que utiliza el pernil del cerdo y luego de un proceso de curación con ajo, sal, pimienta, comino y pimentón se somete a procesos de cocinado y fritado. La receta original utiliza una bebida tradicional llamada chicha y también utiliza manteca de chancho. Como muchos otros platos típicos ecuatorianos este plato se consume con acompañantes como el mote (maíz), el curtido de cebollas y aguacate, como se indica en la figura 2.5. 32 Figura 2.5 Plato de hornado ecuatoriano. La elaboración del hornado toma tiempo debido a que la carne de chancho se debe marinar por tres días, esta es la manera de lograr que todos los sabores de los condimentos sean absorbidos por la carne, pero también se puede dejarlo marinar por solo un día o hasta un par de horas. El proceso de horneado tarda aproximadamente 8 horas a una temperatura que oscila entre 280°C a 300°C (Pazos, 2002). El consumo de puerco horneado es una práctica que vino de España (Pazos, 2002), en el Ecuador el plato es conocido con el nombre de “hornado”. No hay ciudad, pueblo o caserío del Ecuador que no ofrezca hornado. Los lugares más populares donde se consume este plato típico en la sierra, incluyen la provincia de Carchi, Sangolquí, Riobamba, Guamote, Azogues. Los cerdos se exhiben enteros con ajíes frescos entre los dientes y en grandes bandejas (Figura 2.6). Figura 2.6 Chancho hornado ecuatoriano. 33 El hornado ecuatoriano se acompaña con agrio o chiriucho, palabra quichua que significa ají frío. Agua, sal, cebolla, trozos de ají, algo de panela o de chicha componen esta salsa. El contraste resalta el sabor de las lonchas de carne blanca. De paso, se debe señalar que la edad del cerdo determina la calidad del hornado (Pazos, 2002). Según un reporte de la prensa escrita publicado en el año 2010; Este plato típico se elabora en Ecuador desde la época de la conquista, cuando los españoles trajeron los cerdos, pero es desde hace 50 años que empieza a ser vendido a escala comercial. En aquel entonces no había más de dos o tres familias que se dedicaban a prepararlos para entregarlos a los mercados de Quito. La crianza de cerdos en la zona se da porque el cantón Rumiñahui fue conocido como “el granero” de Quito. Con los sobrantes del maíz y del trigo se alimentaba a los cerdos. La costumbre era asar a los cerdos luego de haber sacado el pan de los hornos de cangagua calentados con leña. Hace aproximadamente 15 años la elaboración del hornado empezó a convertirse no solo en el plato insigne de la zona, sino también en una fuente de ingresos económicos. Al momento, el 30% de los 75000 habitantes de este cantón basa su economía en la comercialización del hornado, según explica un estudio realizado por el Ministerio de Turismo en el año 2010, donde indica además que semanalmente se preparan unos 1000 chanchos, de cada uno se saca un promedio de 150 platos. Cada porción oscila entre los U$D 3 y 4. La particularidad de este plato está en la elaboración. Por tradición culinaria, la preparación y cocción demora un día. El cerdo es aliñado con ajo, cebolla, canela, comino y se mantiene así por un día. El proceso de asado dura toda la noche en horno de leña. Además, hay otro detalle que identifica a este plato, es el agrio, que en contraste a su nombre, es una salsa ligeramente dulce. Según Ivette Celi, subsecretaria de Patrimonio del Ministerio de Cultura, “el hornado se lo halla, principalmente en la Sierra, pero este de Sangolquí se caracteriza por su agrio dulce”. El 34 agrio también tiene un secreto: la cebolla se curte con la chicha de jora, que lo hace una especie de vinagreta. El plato se sirve con tortillas de papa, mote, aguacate y por supuesto el hornado con el agrio. La ciudad de Sangolquí ubicada en el Cantón Rumiñahui (sur de la provincia de Pichincha) es conocida como la “Capital mundial del hornado”. Los comerciantes de hornado de Sangolquí adquieren los cerdos de los criadores de chanchos de Quinindé, Chone, El Carmen y Santo Domingo. La demanda de hornado en Quito y sus alrededores es superior a la capacidad de crianza, por lo que se busca a estos animales en la Costa. Un vendedor de hornado de Sangolquí puede vender hasta 100 chanchos por semana a un precio que va de 40 a 120 U$D (Abad, 2000). 2.7 INTOXICACIONES PRODUCIDAS POR HORNADO EN ECUADOR El 1 de marzo del 2004 el diario Hoy de la ciudad de Quito, informó que La Comisaría del Valle de Los Chillos realizó un operativo exhaustivo en los locales donde se expende hornado en El Tingo, luego de que dos ciudadanos denunciaron que se estaba vendiendo hornado que contenía gusanos. La denuncia la presentaron, luego de que presenciaran que los platos de hornado contenían gusanos vivos. El Comisario Metropolitano de la administración se trasladó hasta el restaurante para comprobar lo señalado, por lo que ordenó el decomiso y retiro del producto. El 15 de Noviembre del 2007 el mismo diario publicó que “Hornado insalubre intoxica a 400 personas”, donde se informó que la intoxicación por la ingesta de alimentos contaminados fue lo que intoxicó alrededor de 400 personas en Calpi (provincia de Chimborazo), según fuentes médicas. Alrededor de unas 1000 personas, procedentes de Quito, Cuenca y Guayaquil ingirieron un plato de hornado, mote, tortillas de papa, cebolla y tomate. Al cabo de dos horas, el malestar estomacal llevó a varios de los 35 participantes de la fiesta a pedir atención médica en varias unidades de salud. Autoridades del servicio de emergencia del Hospital Docente de Riobamba, informaron que el cuadro clínico que presentaron los pacientes fue de deshidratación aguda: el vómito y diarrea dieron lugar a una grave pérdida de líquido, calambres musculares y dolor abdominal. Todo se debió a que los alimentos fueron preparados en condiciones antihigiénicas. En la parroquia de Cangagua (Cayambe), en junio del 2010 se reportó una intoxicación masiva, 260 pacientes se intoxicaron en una comunidad. Se presume que se enfermaron por ingerir comida en mal estado. Infección intestinal, vómitos, diarreas y fiebre, fueron los síntomas presentados. Se informa a través de la prensa escrita que “Todo indica que se trata de una intoxicación masiva por la ingesta de alimentos” fue el diagnóstico previo que realizó desde la jefatura de la Unidad de Salud y Seguridad. Entre los alimentos ingeridos, se encontraba chancho hornado. 2.8 AGRIO El agrio es el acompañante del hornado, especias, vegetales y otros ingredientes componen esta salsa. El agrio es característico por su sabor a chicha de jora acompañado de cebollas, sal, trozos de ají, tomate riñón, algo de panela, culantro y perejil. Como se mencionó anteriormente, el agrio está compuesto por vegetales como cebollas, tomate riñón, culantro, perejil, entre otros (Figura 2.7), los cuales son propensos a presentar contaminación, de igual forma la presencia de panela en el agua utilizada para la elaboración del agrio puede ser fuente de glucosa para el crecimiento de distintos tipos de bacterias. 36 Figura 2.7 Agrio. No se han registrado datos de análisis microbiológicos realizados al agrio, acompañante del hornado, por lo que resulta de gran importancia identificar si presenta contaminación microbiana, debido a que en el proceso de elaboración, transporte y conservación a temperatura ambiente durante el momento de su expendio este producto podría ser fuente principal de contaminación al plato de hornado. 37 3. METODOLOGÍA 3. METODOLOGÍA En el presente capítulo se describe la metodología utilizada para la determinación de microorganismos indicadores de higiene y Salmonella, estos incluyen el recuento de coliformes totales y fecales; recuento, aislamiento e identificación de E. coli e identificación de Salmonella en muestras de hornado expendido en cuatro locales de comida típica del Mercado Municipal de Sangolquí. 3.1 DESCRIPCIÓN Y TOMA DE MUESTRA Se seleccionaron al azar cuatro locales de comida típica en Sangolquí, Cantón Rumiñahui, Provincia de Pichincha, Ecuador; con los debidos permisos de la autoridad pertinente (Anexo 8), dos de los cuatro locales escogidos se encuentran ubicados en el Mercado Municipal de la Ciudad de Sangolquí en el Cantón Rumiñahui, Provincia de Pichincha (Figura 3.1) y los otros dos locales son restaurantes de comida típica ubicados en una avenida principal de la misma ciudad (Figura 3.2). Figura 3.1 Locales ubicados en el Mercado 38 Figura 3.2 Restaurantes ubicados en la Avenida Los platos fueron tomados en condiciones normales de manipulación y venta, el hornado y sus aderezos fueron colocados en recipientes plásticos por la vendedora (sin uso de guantes y manipulación del dinero de la venta con las mismas manos), el hornado permanecía en bandejas de lata (Figura 3.1 y 3.2), estos platos fueron colocados en una lonchera plástica e inmediatamente trasladados (asépticamente) al Laboratorio de Microbiología de la Facultad de Ciencias de la Ingeniería de la Universidad Tecnológica Equinoccial (Quito) para su análisis y se procesaron dentro de 2 horas. Como se observa en la figura 3.3, el plato de hornado en la mayoría de los casos consiste en: hornado (carne de cerdo), tortilla de papa, mote, lechuga, aguacate y agrio. Figura 3.3 Plato de Hornado 39 Se analizó específicamente el hornado (llamada así a la carne de cerdo), el agrio (guarnición acompañante elaborada a partir de: agua, sal, cebolla, tomate riñón, trozos de ají, panela raspada, perejil y culantro) y la mezcla de hornado y agrio con el fin de conocer el origen de la contaminación. El transporte de las muestras se realizó en recipientes individuales tanto para la carne de cerdo como para el agrio. Cabe recalcar que el agrio es un acompañante infaltable en este plato y está elaborado a partir de: agua, sal, cebolla, tomate riñón, trozos de ají, panela raspada, perejil, culantro, entre otros, se puede observar en la figura 3.4 que este acompañante se coloca sobre la carne de cerdo para su consumo. Figura 3.4 Plato de Hornado con Agrio Con el fin de conocer el origen de la contaminación, en caso de haberla, de cada plato de hornado, se dividen 3 muestras: hornado (H), agrio (A) y una mezcla de hornado y agrio (H/A), de cada unas de estas se efectuaron dos análisis uno para E. coli y el otro para Salmonella. Los análisis se realizaron por duplicado. En cada análisis el período transcurrido entre la toma de muestra y el inicio del análisis microbiológico no superó las dos horas. 40 3.2 PREPARACIÓN DE LA MUESTRA Con el fin de mantener la muestra y el ambiente de manipulación estéril los ensayos se realizaron en una cámara de flujo laminar marca Telstar. Asépticamente se homogenizó 25 gramos de cada muestra (hornado, agrio y una mezcla de hornado/agrio) por 2 minutos utilizando una licuadora marca Oster. A partir del homogenizado se realizaron los análisis de E. coli y Salmonella que se detallan en las siguientes secciones. 3.3 RECUENTO, AISLAMIENTO E IDENTIFICACIÓN DE COLIFORMES TOTALES, COLIFORMES FECALES Y Escherichia coli El recuento, aislamiento e identificación de Escherichia coli se realizó según la norma INEN (NTE INEN 1 529-8). 3.3.1 PRUEBA PRESUNTIVA Se pesó 25 g de muestra (homogenizada) en 225 ml de solución salina estéril (0,75%) para obtener la dilución 10-1, a partir de la cual se realizaron 2 diluciones sucesivas. Con el fin de realizar el recuento de coliformes totales, coliformes fecales y E. coli, de cada dilución se inoculó 1 ml en una serie de 9 tubos de ensayo (3 tubos para cada dilución: 10-1, 10-2 y 10-3) que contenían 9 ml de caldo BGBL (verde brillante bilis lactosa) con una campana de Durham en cada uno. Los tubos se incubaron a 30ºC por 24 horas en una incubadora marca Memmert. Transcurrido el tiempo de incubación se contó el número de tubos positivos en cada dilución para obtener una combinación numérica que fue comparada con la tabla de NMP, según se observa en el Anexo 5. 41 Posteriormente, se tomaron los tubos con coliformes totales positivos en gas y turbidez y de cada uno, se realizaron dos siembras, una en tubos de ensayo con 3 mL de caldo TSB (caldo de triptona y soya) y otra en tubos con 10 ml de caldo BGBL que contenían campanas de Durham. Los tubos con TSB y BGBL se incubaron a 45ºC por 48 horas para realizar el recuento de coliformes fecales. Luego del período de incubación se consideraron como tubos positivos aquellos que dieron positiva la prueba de indol y produjeron gas en caldo BGBL. 3.3.2 PRUEBA CONFIRMATIVA Se seleccionaron los tubos coliformes fecales positivos en gas e indol (BGBL = gas, TSB = indol), de lo cuales se tomó una asada y se inoculó por estriado en agar EMB (eosina azul de metileno) por separado a cada uno de los tubos BGBL positivos; después se incubaron las cajas petri a 35ºC por 24 horas; a continuación de las cajas petri que presentaron colonias con el centro negro y brillo verde metálico alrededor se tomaron colonias aisladas y se las Inoculó por estría en tubos con agar PCA (agar conteo en placa) en pico de flauta e inmediatamente se incubaron a 35ºC durante 24 horas. Al término de este tiempo, con las bacterias que crecieron se efectuó la tinción Gram con el fin de comprobar la presencia de bacilos Gram negativos (E. coli) y saber si el cultivo presentaba un solo tipo de microorganismo. El método de tinción Gram se lo efectúo de la siguiente manera: se tomó una colonia del cultivo con la punta del asa y se realizó un frotis en un portaobjetos limpio, se secó la muestra flameando en el mechero, después se cubrió la muestra con gotas de cristal violeta durante 1 minuto, se lavó el portaobjetos con agua destilada, luego se cubrió la muestra con gotas de lugol por 1 minuto, se lavó con alcohol cetona, por último se cubrió la muestra con gotas de safranina durante 30 segundos, se lavó con agua destilada, se dejó secar al ambiente y se observaron las muestras en un microscopio marca Olimpus CX31. Posteriormente y con las mismas bacterias de los tubos con PCA se realizaron las pruebas IMViC. 42 3.3.3 PRUEBAS COMPLEMENTARIAS (IMVIC) Con el fin de confirmar la presencia de E. coli en las muestras de hornado, agrio y la mezcla de hornado/agrio, se realizaron las pruebas IMViC, que incluyen la prueba para indol, prueba de rojo de metilo, Voges Proskauer y uso del citrato, según se detalla a continuación: 3.3.3.1 Prueba para indol. Se sembró en un tubo que contenía 3 mL de caldo TSB (marca Scharlau) una asada de cultivo puro, se incubó por 24 horas a 35ºC, luego de este tiempo se añadió al tubo 3 gotas del reactivo de Kovac. La aparición de un anillo color rojo oscuro en la superficie del reactivo indica una prueba positiva. 3.3.3.2 Prueba del rojo de metilo (RM). Se sembró en un tubo que contenía 3 mL de caldo MR-VP (rojo de metilo – Voges Proskauer, marca Scharlau), con un asa de cultivo puro, se incubó por 24 horas a 35ºC, posteriormente se añadió 3 gotas de la solución de rojo de metilo, se agitó, el cambio de color del medio a rojo indica una prueba positiva. 3.3.3.3 Prueba de Voges -Proskauer (VP). Se sembró en un tubo con 3 mL de caldo MR-VP (marca Scharlau) una asada de cultivo puro, se incubó por 24 horas a 35ºC, al cabo de este período se añadió 2 gotas de KOH (hidróxido de potasio) al 40% y 3 gotas de α-naftol al 6% (solución acuosa) se esperó 5 minutos. La no alteración del medio y la formación de un anillo transparente en la superficie indica que la prueba es negativa, caso contrario, el resultado es positivo cuando se forma un anillo de color rosado o rojo. 3.3.3.4 Prueba para la utilización del citrato. Se sembró por estría en la superficie de la lengüeta de agar citrato de Simmons (marca Himedia) inclinado en un tubo, se incubó por 24 horas a 35ºC. El 43 crecimiento visible de bacterias que no cambian de color el medio indica una prueba negativa; la reacción es positiva cuando hay crecimiento visible y el medio cambia su color de verde a azul. Se considera como E. coli a los microorganismos que presentan las siguientes características: bacilos Gram negativos no esporulados que producen gas a partir de la lactosa y reacción IMViC (Tabla 3.1). Tabla 3.1 Clasificación de los coliformes por la pruebas “IMViC” CLASIFICACIÓN DE LOS COLIFORMES POR LAS PRUEBAS "IMViC" Tipo de Gas en caldo Prueba del MR (rojo de VP (voges- Crecimiento E. coli BGBL 45,5ºC indol 45,5ºC metilo) proskauer) en citrato Típico (tipo I) + + + - - Atípico(tipo II) - - + - - E. coli (INEN, 1990) 3.4 AISLAMIENTO E IDENTIFICACIÓN DE Salmonella El aislamiento e identificación de Salmonella se realizó según la norma INEN (NTE INEN 1 529-15:96). 3.4.1 PRE-ENRIQUECIMIENTO NO SELECTIVO Se pesó 25 g de muestra en 225 ml de agua peptona tamponada y se homogenizó, luego se tapó el frasco y se dejó a temperatura ambiente por 60 minutos, después de este tiempo se ajustó el pH a 6.8 ± 0,2 con NaOH 1N ó HCl 1N, también se agregó 2 gotas de Tritón X-100 y se incubó a 37ºC de 16 a 20 horas. 3.4.2 ENRIQUECIMIENTO SELECTIVO Transcurrido el período de incubación, se tomó una alícuota de 10 ml de muestra y se colocó en 100 ml de caldo tetrationato (marca Difco), así mismo se tomaron 10 ml de la misma muestra y se colocaron en 100 ml de 44 caldo selenito cistina (marca Acumedia), los tubos de ensayo se incubaron a 42,5ºC y a 37ºC por 24-48 horas para el caldo tetrationato y el caldo selenito cistina, respectivamente. 3.4.3 AISLAMIENTO Los caldos tetrationato y selenito cistina, por separado, fueron sembrados en estría sobre la superficie seca de placas de BGA (agar verde brillante, marca Scharlau), SSA (agar Salmonella Shigella, marca BBL) y BSA (agar bismuto sulfito, marca Himedia); después se invirtieron las cajas petri y se incubaron a 37ºC por 24 horas. 3.4.4 PURIFICACIÓN Con el fin de obtener un cultivo axénico de Salmonella se examinaron y se compararon las cajas incubadas, se seleccionaron las colonias típicas o sospechosas aisladas y se inoculó por estría en la superficie seca de placas individuales de agar MacConkey (marca Acumedia) e inmediatamente se invirtieron las cajas petri para ser incubadas a 37ºC durante 24 horas. Pasado este tiempo se seleccionaron colonias incoloras (lactosa negativa) y se las sembró en agar nutritivo inclinado y se incubaron los tubos a 37ºC por 24 horas. A partir de estos tubos con agar nutritivo inclinado se realizaron tinciones por el método de Gram para comprobar la pureza de los cultivos bacilos Gram negativos. 3.4.5 SELECCIÓN De cada cultivo en agar nutritivo inclinado se tomaron las colonias de Salmonella y con una aguja se inoculó por picadura la columna del agar y por estría la superficie inclinada de los tubos con agar TSI (tres azúcares hierro) (marca BioCen), mientras que en los tubos con agar LIA (agar lisina hierro) (marca Difco) se sembró con un asa por estría únicamente en la 45 superficie inclinada del medio. Los tubos se incubaron a 37ºC por 24 horas. Al término de este período se procedió a examinar los cambios producidos en los medios de cultivo. Con el fin de mantener la viabilidad del cultivo, a partir de los tubos con TSI y LIA se inocularon en tubos con agar nutritivo (marca Himedia) inclinado, llevando estos tubos a incubación por 24 horas a 37ºC. Con estos cultivos se realizó la confirmación bioquímica. 3.4.6 CONFIRMACIÓN BIOQUÍMICA Con el fin de confirmar la presencia o ausencia de Salmonella en las muestras de hornado, agrio y la mezcla de agrio y hornado, se realizaron las pruebas bioquímicas de la ureasa, lisina-descarboxilasa, indol, voges Proskauer y uso del citrato, según se detalla a continuación: 3.4.6.1 Prueba de la ureasa. Se inoculó en estría sobre la superficie de agar urea inclinado (marca Himedia), se incubó entre 24 y 48 horas a 37ºC. La reacción es positiva cuando el color del medio cambia a rosa más intenso o cereza intenso. La no alteración del medio indica una reacción negativa. La presencia de Salmonella da reacción negativa. 3.4.6.2 Prueba de la lisina-descarboxilasa. Se inoculó por estría en la superficie de agar LIA inclinado, se incubó por 24 horas a 37ºC. La reacción es positiva cuando el color del medio cambia a púrpura, el cambio a amarillo indica una reacción negativa. La Salmonella da reacción positiva. 3.4.6.3 Prueba de voges-proskauer. El cultivo en análisis se sembró en un tubo con caldo MR-VP, se incubó a 37ºC durante 24 horas, después de este período se añadió 2 gotas de KOH al 40% y 3 gotas de α-naftol al 6%, se esperó 5 minutos. La no alteración del medio y la 46 formación de un anillo transparente en la superficie indica que la prueba es negativa; el resultado es positivo cuando se forma un anillo de color rosado o rojo en la superficie del caldo de cultivo. La Salmonella da reacción negativa. 3.4.6.4 Prueba del indol. El cultivo en análisis se sembró en un tubo con caldo TSB, se incubó por 24 horas a 37ºC, luego de este tiempo se añadió al tubo 3 gotas del reactivo de Kovac. La aparición de un anillo color rojo oscuro en la superficie del reactivo indica una prueba positiva y la formación de una anillo transparente o amarillo en la superficie indica una reacción negativa. La Salmonella es indol negativa. 3.4.6.5 Prueba de la utilización del citrato. Se sembró en estría sobre la superficie inclinada de agar citrato de Simmons, se incubó por 24 horas a 37ºC. El crecimiento visible de bacterias que no cambian de color del medio indica una prueba negativa; la reacción es positiva cuando hay crecimiento visible y el medio cambia su coloración de verde a azul fuerte. La mayoría de las Salmonella dan una reacción positiva, pero a veces es variable dependiendo de la región y del alimento analizado, de manera que la Salmonella puede dar también una reacción negativa. 3.5 ANÁLISIS ESTADÍSTICO En todas las experiencias se empleó un Diseño factorial AxB. Los resultados fueron procesados mediante un análisis de varianza (ANOVA) y las medias comparadas por la DMS (Diferencia Mínima Significativa) o por sus siglas en inglés LSD (Least Significant Difference) con una significancia de 0,05 usando el software STATGRAPHICS Plus versión 5.1 47 4. RESULTADOS Y DISCUSIÓN 4. RESULTADOS Y DISCUSIÓN En el presente capítulo se describen los resultados y la discusión del recuento, aislamiento e identificación de coliformes totales, coliformes fecales, E. coli y Salmonella en muestras de hornado, agrio y una mezcla de hornado y agrio de cuatro locales de venta de comida típica de Sangolquí (cantón Rumiñahui). Los locales se designaron numéricamente del 1 al 4. 4.1 RECUENTO, AISLAMIENTO E IDENTIFICACIÓN DE COLIFORMES TOTALES, COLIFORMES FECALES Y Escherichia coli El análisis de E. coli comprende el recuento de coliformes totales y coliformes fecales, también conocidas como; prueba presuntiva, prueba confirmativa y prueba complementaria. Coliformes totales: El recuento de coliformes totales se expresó como el número más probable por gramo de muestra (NMP/g de muestra) (hornado, agrio y la mezcla hornado y agrio), según la combinación numérica obtenida en los tubos de BGBL luego de la incubación de 48 h a 35°C ± 1ºC (Figura 4.1). Figura 4.1 Tubos con campana de Durham y caldo BGBL 48 Como se puede observar en la figura 4.2, la muestra de hornado del local 4 presentó mayor población de coliformes totales que los locales 1, 2 y 3 (columna azul). Mientras que el agrio presentó mayor población en los locales 1, 3 y 4 (columna roja). La mezcla de hornado y agrio presentó NMP (coliformes totales/g) mayor población de coliformes totales en el local 3 (columna verde). Hornado Agrio Hornado/Agrio 2600 2400 2200 2000 1800 1600 1400 1200 1000 800 600 400 200 0 b b ab a L1 L2 L3 L4 Locales Figura 4.2 NMP de coliformes totales por gramo de muestra analizada (hornado, agrio y hornado/agrio.) Coliformes totales en muestras de hornado (H), agrio (A) y una mezcla de hornado/agrio (H/A) en 4 locales de comida típica de Sangolquí. LSD = 726 Letras distintas indican diferencia significativa entre los locales analizados. En el Ecuador no existen normas que indiquen los valores permisibles máximos de coliformes totales en el hornado, por lo tanto el análisis de resultados no podrá realizarse para verificar el cumplimiento o incumplimiento de un criterio microbiológico sino más bien como un indicador de la aplicación de buenas prácticas de higiene durante la elaboración de este alimento. Entonces, al comparar las muestras de agrio y hornado, es el agrio el que presenta mayor población de coliformes totales, siendo éste el que produce la contaminación del producto, como se puede observar en el recuento de la mezcla de las dos. El local 4 presentó la mayor contaminación 49 con coliformes totales tanto en el hornado como en el agrio y en la mezcla de ambas. Los coliformes son microorganismos que comúnmente se encuentran en las plantas, el suelo, agua y los animales incluyendo el hombre, por lo tanto, podría decirse que el local que presentó mayor contaminación (local 4) probablemente presenta falencias en la aplicación de buenas prácticas de higiene durante la elaboración de alimentos lo que provocaría que sus productos se contaminen con este tipo de microorganismos, sin embargo estos microorganismos no necesariamente constituyen un riesgo para el consumidor, debiendo considerarse también la posibilidad de contaminación del producto posterior a la cocción, es decir durante el almacenamiento previo a la venta. Además debe tomarse en cuenta la preparación del agrio, ya que presenta la mayor presencia de contaminación por coliformes totales. Este sería el componente del plato que contribuye a la contaminación del hornado, debido probablemente a una contaminación procedente de las materias primas para su elaboración (agua, sal, cebolla, tomate riñón, trozos de ají, panela raspada, perejil, culantro, entre otros), su incorrecta manipulación al momento de utilizarlos en la elaboración de este acompañante del plato de hornado o por la deficiente higiene del manipulador. Además, cuando un producto presenta alta actividad de agua (Aw), como el agrio, es más propenso a la proliferación de contaminación microbiana, además de conservarse a temperatura ambiente durante su comercialización. Como se mencionó anteriormente la presencia de bacterias coliformes en los alimentos no significa necesariamente que hay contaminación de origen fecal o que hay patógenos entéricos presentes. Las bacterias coliformes son particularmente útiles como componentes de criterios microbiológicos para indicar contaminación postproceso térmico. Estos organismos se eliminan fácilmente por tratamiento térmico, por lo cual 50 su presencia en alimentos sometidos al calor sugiere una contaminación posterior al tratamiento térmico o que éste ha sido deficiente. El análisis de coliformes totales en una muestra como el agrio cobra importancia, debido a que éste no sufre ningún tratamiento térmico que elimine las bacterias presente en él. Coliformes fecales: Por otro lado, las muestras analizadas presentaron coliformes fecales, su presencia se comprobó debido a la producción de gas resultante de la fermentación de la lactosa a las 48 horas de incubación en el medio BGBL (Figura 4.3) y debido a que se produjo indol a partir de triptófano en el medio TSB (Figura 4.4). Figura 4.3 Recuento de coliformes fecales. Figura 4.4 Prueba de indol en caldo TSB. a) Resultado (-) anillo amarillo, y b) Resultado (+) anillo rojo. Luego de la adición del reactivo Kovac posterior a la incubación a 35°C a 24 h. 51 En la tabla 4.1 se observan los valores de NMP de coliformes fecales por gramo de muestra en relación con los 4 locales (L1, L2, L3 y L4) y las muestras de Hornado (H), Agrio (A) y Hornado/Agrio (H/A). El local 3 presentó mayor incidencia de contaminación por coliformes fecales seguido en menor proporción por el local 4, luego por el local 1 y el local que tuvo menos contaminación fue el número 2. Por otro lado, las muestras que presentaron mayor incidencia de contaminación fecal fueron las de Hornado/Agrio (H/A) (especialmente en el local 3) seguidas por las de Agrio (A) (con menor incidencia en el local 2); las muestras de Hornado (H) son las que presentaron en todos los locales menor incidencia de contaminación por coliformes fecales. Tabla 4.1 NMP de coliformes fecales por gramo de muestra analizada. NMP DE COLIFORMES FECALES / g DE MUESTRA L1 L2 L3 L4 H N/D 29.25 25.75 4.5 A 406.5 N/D 1375.25 357.5 H/A 108.5 146 1883.5 870 H = hornado, A = agrio, H/A = hornado/agrio L1, L2, L3, L4 = locales analizados. ND = no detectable Como se puede observar en la tabla 4.1 el local 3 (L3) presentó mayor contaminación con coliformes fecales en las muestras analizadas, seguido del local 4 (L4), 1 (L1) y 2 (L2). Determinar la presencia y cuantificar la población de coliformes fecales en productos alimenticios de este tipo es muy importante para saber si existe un déficit en la inocuidad e higiene en el expendio del producto en estos establecimientos, representando un riesgo para la salud de las personas que lo consumen ya que hay la posibilidad de contraer enfermedades. Hay que tener en cuenta que el consumo de alimentos inocuos variará dependiendo de los establecimientos y lugares donde se elabora, procesa y vende este producto, los resultados obtenidos en el 52 análisis del hornado, agrio y hornado/agrio de los cuatro locales analizados demuestran deficiencia higiénica en alguna o todas las partes del proceso. La sola presencia de coliformes fecales en alimentos indica contaminación de origen fecal. La presencia de coliformes fecales indica una clara deficiencia higiénica tanto de las personas que manipulan los alimentos, utensilios o equipos o del ambiente del local donde se comercializa. Los resultados obtenidos (Tabla 4.1) representan un riesgo para la salud ya que la sola presencia de estas bacterias es un indicador de la mala calidad del alimento y de su deficiente inocuidad. En muchos de los casos los alimentos consumidos no causan daño a las personas, pero en algunas ocasiones sí puede ser perjudicial ocasionando malestar estomacal, diarreas, entre otras. Es el caso del agrio, donde el producto no tiene un proceso previo de cocción y se lo consume crudo, hay que tomar en cuenta la cantidad consumida y el tiempo que se lo conserva al ambiente, tiempo en el cual la población de bacterias pudiera aumentar. Por otro lado, el hornado se somete a un proceso de cocción por lo cual la carga microbiológica se anula y el producto final muestra un nivel mínimo o casi nulo de contaminación. Escherichia coli: Los análisis realizados a las diferentes muestras demostraron la presencia de E. coli. Las colonias en agar EMB mostraron brillo metálico verdoso (+) (Figura 4.5). La presencia de E. coli fue confirmada con tinción Gram (Figura 4.6). 53 Figura 4.5 Cultivo de E. coli en agar EMB Figura 4.6 Tinción Gram de E. coli: bacilos Gram negativos Una vez comprobado los resultados de las pruebas complementarias (IMViC) se identificó la presencia de la bacteria Escherichia coli en 28 muestras de un total de 48, en donde, 13 de éstas corresponden a muestras de hornado y agrio (H/A), mientras que de las muestras de Agrio (A) 10 muestran fueron positivas y en cuanto al Hornado (H) se encontraron 5 muestras positivas. En la figura 4.7 se presenta el análisis global del número de muestras con la presencia de la bacteria Escherichia coli, donde las muestras positivas fueron mayores en número que las muestras negativas. 54 Figura 4.7 Presencia de E. coli en las muestras de hornado, agrio y la mezcla de hornado/agrio. El local 3, como se observa en la figura 4.8, fue el que presentó mayor porcentaje de casos positivos de E. coli en relación a los demás locales que expenden comida típica en la ciudad de Sangolquí. Figura 4.8 Presencia de E. coli en los locales analizados. La presencia de la bacteria Escherichia coli en más del 50% de muestras analizadas indica mala manipulación, deficiencia en el procesamiento y una defectuosa práctica higiénica de las personas que están involucradas con la elaboración, producción, distribución, conservación 55 y manipulación del producto. Por tal razón la inocuidad alimentaria está totalmente afectada con lo que respecta al expendio de hornado en locales de comida típica de la zona. Lo anteriormente expuesto representa un riesgo para la salud de los consumidores, ya que E. coli es el mejor indicador de contaminación fecal y al estar está presente en alimentos demuestra claramente que el producto examinado no es de buena calidad y se revelan las deficiencias en la limpieza y desinfección del lugar de expendio y del manejo del producto por parte de las personas que laboran en estos locales. La validación del proceso térmico por el cual pasa el hornado beneficia en la eliminación de esta bacteria, sin embargo, el agrio al no pasar por un proceso térmico es una fuente para la proliferación de estos microorganismos en el caso de que exista un foco de contaminación fecal en el proceso o en la materia prima utilizada. 4.2 AISLAMIENTO E IDENTIFICACIÓN DE Salmonella En la identificación de Salmonella los cambios y las reacciones típicas que se produjeron en los medios de cultivo específicos indicaron la posible presencia de este microorganismo. Cabe recalcar que como indicador de inocuidad e higiene alimentaria la sola presencia de esta bacteria indica un riesgo para la salud. 4.2.1 AISLAMIENTO A partir de los cultivos de pre-enriquecimiento y enriquecimiento selectivo se aislaron las colonias de Salmonella. A continuación se describe el aspecto de las colonias de Salmonella en los medios utilizados de agar selectivo: 56 En BGA las colonias de Salmonella se presentaron opacas o translúcidas de color rosa, rojo o de color del medio (Figura 4.9). A. BGA negativo (-) B. BGA positivo (+) Figura 4.9 Colonias de Salmonella en BGA luego de 24 horas de incubación a 37ºC. a) Resultado negativo. b) Resultado positivo. . En SSA la mayoría de las colonias típicas de Salmonella fueron transparentes e incoloras con o sin centro negro (Figura 4.10). A. SSA negativo (-) B. SSA positivo (+) Figura 4.10 Colonias de Salmonella en SSA luego de 24 horas de incubación a 37ºC. a) Resultado negativo. b) Resultado positivo. En BSA las colonias típicas de Salmonella presentaron un centro negro, borde claro con brillo metálico alrededor formando el “ojo de pez” (Figura 4.11). 57 A. BSA negativo (-) B. BSA positivo (+) Figura 4.11 Colonias de Salmonella en BSA luego de 24 horas de incubación a 37ºC. a) Resultado negativo. b) Resultado positivo. 4.2.2 SELECCIÓN A partir de las colonias sospechosas de Salmonella en los medios de cultivo BGA, SSA y BSA se seleccionaron aquellas colonias que en los medios TSI y LIA presentaron los siguientes cambios (Figura 4.12): TSI: la lengüeta presentó un color rojo y la columna cambió a color negro y amarillo. LIA: la lengüeta presentó color violeta y la columna presentó color negro y amarillo. Figura 4.12 Crecimiento positivo de Salmonella en a) TSI y b) LIA. 58 4.2.3 CONFIRMACIÓN BIOQUÍMICA Los resultados en la identificación bioquímica mostraron que varias colonias aisladas no eran positivas para la presencia de Salmonella mientras que otras sí. Salmonella responde a las pruebas de identificación bioquímica de la forma siguiente (Figura 4.13): Urea = negativo (-) Lisina-descarboxilasa = positivo (+). Voges-Proskauer = negativo (-). Indol = negativa (-). Citrato = positivo (+). Figura 4.13 Resultados positivos para Salmonella luego de 24 h de incubación a 37°C en a) agar urea, b) LIA, c) voges-proskauer, d) Indol y e) agar citrato. Según las normas de requisitos microbiológicos de huevo, carnes crudas y productos lácteos de queso no pasteurizados se determina la presencia y ausencia de Salmonella. El análisis de Salmonella en muestras como el hornado y el agrio es de gran importancia ya que permite valorar la 59 inocuidad del producto, porque la sola presencia de este microorganismo es perjudicial para la salud del consumidor. Se analizaron 48 muestras entre Hornado (H), Agrio (A) y Hornado/Agrio (H/A), en cuatro locales; se identificó la bacteria Salmonella en 2 de las 48 muestras (4% del total) como se observa en la figura 4.14, donde la presencia de esta bacteria tuvo incidencia en la muestra de Agrio (A) precisamente en un plato del local 1 y en la de Hornado/Agrio (H/A) en un plato del local 2; cabe recalcar que ninguna de las muestras de Hornado (H) tuvo presencia de Salmonella. Los locales 1 y 2, fueron los que mostraron en igual porcentaje presencia de Salmonella y los locales 3 y 4 se los registró con ausencia de esta bacteria ya que no presentaron ningún resultado positivo en su análisis. Figura 4.14 Presencia de Salmonella en locales analizados. Encontrar Salmonella en los alimentos indica una deficiencia en la práctica higiénica de las personas que están en contacto con el producto y del lugar donde se lo comercializa, constituyendo el consumo del producto un riesgo para la salud ya que como se mencionó anteriormente, esta bacteria produce enfermedades de gravedad como salmonelosis y gastroenteritis (Bravo y col., 2007). 60 Las muestras de hornado, agrio y la mezcla de ambas, presentaron mayor contaminación con coliformes totales y fecales (presencia de E. coli) en el local 3, mientras que la presencia de Salmonella se dio en los locales 1 y 2 en muestras de agrio y hornado/agrio. En el Ecuador, no existe una norma microbiológica que indique los niveles máximos permisibles de microorganismos coliformes totales, coliformes fecales, Escherichia coli y Salmonella en hornado, siendo un plato típico de consumo masivo que atrae turismo en muchos lugares del Ecuador debería poseer criterios microbiológicos de calidad, de forma que se pueda controlar la inocuidad del producto. 61 5. CONCLUSIONES Y RECOMENDACIONES 5. CONCLUSIONES Y RECOMENDACIONES 5.1 CONCLUSIONES El análisis global de resultados indica que los locales analizados presentaron contaminación con E.coli y coliformes en muestras de hornado, agrio y hornado/agrio. Y en menor proporción con Salmonella. De los 4 locales de expendio de hornado, el local 4 presentó mayor población de coliformes totales (expresado como NMP/g) tanto en muestras de hornado, agrio y la mezcla de ambas, seguido por los locales designados con los números 3, 1 y 2. Estos resultados indicarían bajo nivel de aplicación de buenas prácticas de higiene durante la elaboración de alimentos en los locales analizados. Se determinó que el 58% de las muestras analizadas fueron positivas para E. coli. Los porcentajes de presencia de contaminación de E.coli por local fueron: 25% para el local 1, 18% para el local 2, 36% para el local 3 y 21% para el local 4. E. coli es un indicador de contaminación fecal, la sola presencia de éste microorganismo indica deficiencia de higiene tanto en la elaboración, almacenamiento, y distribución del plato de hornado. De las muestras analizadas, la que mayor índice de contaminación por E. coli presentó fue la combinación de hornado y agrio, siendo el agrio la principal fuente de contaminación de este plato típico probablemente debido a las características de los ingredientes y al carecer de proceso térmico que elimine a los microorganismos. Se identificó la presencia de Salmonella en el 4% de las muestras analizadas (2 de las 48 muestras analizadas fueron positivas) y fue identificada en muestras de Agrio (A) de local 1 y en la de Hornado/Agrio (H/A) en el local 2. Cabe recalcar que en ninguna de las muestras de 62 Hornado se detectó la presencia de Salmonella, debido al tratamiento térmico al cual la carne fue sometida. Estos resultados indicarían que probablemente las muestras pudieron haber sido contaminadas por diversas causas, como la mala higiene de los manipuladores directos (personas que expenden este plato), la calidad sanitaria de las materias primas usadas para la elaboración de este plato o por contaminación cruzada de los utensilios utilizados o de los espacios físicos donde se procesó este alimento. 5.2 RECOMENDACIONES Las recomendaciones del presente trabajo de investigación se han dividido en tres partes: Con respecto a los ensayos de identificación de microorganismos indicadores de higiene en alimentos: Uno de los principales procesos que garantizan la calidad alimentaria y que hacen que los alimentos sean seguros para el consumo humano son la Buenas Prácticas de Manufactura (BPM), las cuales se aplican en el proceso de producción de los alimentos para disminuir la contaminación durante su elaboración, esto se lleva a cabo a través del control sanitario del personal, limpieza de equipos, utensilios, instalaciones físicas y sanitarias, limpieza y desinfección y control de plagas. La implementación o el conocimiento de estas normas son necesarios para la elaboración de cualquier tipo de alimento. Se debe capacitar al personal que trabaja en expendio de alimentos con estos conocimientos. Se recomienda el monitoreo continuo de cualquier establecimiento de expendio de comidas de consumo público, este monitoreo debe estar a cargo de entidades competentes del Municipio, así mismo deben estar dirigidas a establecer mecanismos de control y prevención respecto al 63 expendio de alimentos en especial de productos o comida típica ecuatoriana expendida en mercados municipales. Es necesario realizar análisis sobre contaminación microbiana y parasitaria en alimentos que se expenden en el Mercado Municipal de Sangolquí a través de un estudio que a largo plazo permita determinar la calidad sanitaria de los locales del Mercado Municipal que expenden comida típica y con el fin de establecer las causas de la contaminación de alimentos e implantar medidas de control. Estas medidas incluyen: 1) Tomar las debidas precauciones al momento de conservar las muestras en el transcurso de tiempo desde el lugar de la toma de la muestra hasta el inicio del análisis en el laboratorio, se debe tener en cuenta el tiempo de traslado y la temperatura del producto y del ambiente; 2) Los materiales y utensilios a usarse en el análisis deben estar totalmente asépticos para evitar contaminación cruzada de las muestras y obtención de falsos positivos; y 3) Documentar cada uno de los procesos realizados y la forma en los que se realizó para verificar si no existen fallos en las técnicas realizadas. 64 GLOSARIO FDA: Food and drug administration SIRVETA: Sistema de información para la vigilancia de las enfermedades transmitidas por los alimentos. FAO: Food and agriculture organization. ETA’s: Enfermedades trasmitidas por alimentos. BPM: Buenas prácticas de manufactura. ICMSP: International commission on microbiological specifications for foods OPS: Organización panamericana de la salud UFC: Unidades formadoras de colonias. NMP: Número más probable. CDC: Centro para el control y prevención de enfermedades USDA: United States department of agriculture BAM: Bacteriological analytical manual BGA: Brilliant green agar – Agar de verde brillante SSA: Salmonella shigela agar BSA: Bismuto sulfito agar LIA: Lisina and iron agar – Agar hierro y lisina. TSI: Triple sugra iron – Agar tres azucares y hierro 65 BIBLIOGRAFÍA BIBLIOGRAFÍA Abad, G. (2000). Fortunas hechas en los zaguanes, Publicado en la Revista Electrónica Blanco y Negro el 7 de Octubre del 2000. Alonso, L. y Poveda, J. (2008). Estudio comparativo en técnicas de recuento rápido en el mercado y placas PetrifilmTM 3MTM para el análisis de alimentos. Bogotá D.C.- Colombia. Pág. 22. ANMAT, sin fecha. Guía de interpretación de criterios microbiológicos. Arango, J.; Agostini, A. y Silvestre, A. (1997). Condiciones sanitarias de los comedores comunitarios del Conurbano de Buenos Aires, Argentina. Rev Panam Sal Pub; 2:225-31. Arenas, L.; Rodas, A.; Narváez, C.; Jerez, N.; Huerta, N.; Giuffrida, M. y Uzcátegui, S. (2009). calidad microbiológica de la carne y de los productos cárnicos. AGROTECNICO No. 25. Pág. 44. Bean, N.H. y Griffin, P.M. (1990). Foodborne disease outbreaks in the United States, 1973-1987: Pathogens, vehicles, and trends. 1. Food Protect. 53: 804. Benavides, K. (2010). Caracterización microbiológica de lixiviados de materias primas para la fabricación de un compostaje de material ruminal. Universidad Católica de Manizales. Manizales Caldas- Colombia. Pág. 40. Benenson, A. (1997). Manual para el control de enfermedades transmisibles. Organización Mundial de la Salud. Págs. 272-273. Bergey, D.H. (1994). Bergey’s Manual of Determinative Bacteriology. 9th Edition. Baltimore-USA. Bravo, R.; Puga, M. y Barreiro, D. (2007). Presentación de un caso atípico de fiebre tifoidea. Rev Cub Med Mil. [online]. vol.31, no.1. Pág. 54-57. 66 Brooks, G.F.; Butel, S.S. y Morse, S.A. (2002). Microbiología Médica Jawets, Melnick y Adelberg. 17ª edición. México: El Manual Moderno. Camacho, A.; Giles, M.; Ortegón, A.; Palao, M.; Serrano B. y Velázquez, O. (2009). Técnicas para el Análisis Microbiológico de alimentos. 2ª ed. Facultad de Química, UNAM. México. Versión para Administrador de Manuales y Documentos (AMyD). Facultad de Química, UNAM. Págs. 125-126 Camacho, J. (1990). Informe final de actividades del servicio social. Universidad Autónoma Metropolitana. Iztapalapa-México. Pág. 20. CAST (Council for Agricultural Science and Technology). (1994). Foodborne Pathogens: Risks and Consequences. A report of a Task Force of the Council for Agricultural Science and Technology, Ames. Iowa-USA. Pág. 8 CDC (Centers of Disease Control and Prevention). (2006). Questions and Answers: Sickness caused by E. coli. Atlanta-USA Cliver, D.O. (1993). "Eating Safely: Avoiding Foodborne Illness," Editorial. A. Golaine, American Council on Science and Health, New York-USA. Págs. 18-19 Código Alimentario Argentino, Art. 1413 y 1414, (2005). Guía de Interpretación de Resultados microbiológicos de alimentos. Pág. 9. CRESA. (2003). Centro de Recerca de Sanidad Animal. Salmonelosis. Cataluña- España. Durango, J.; Arrieta, G. y Mattar S. (2004). Presencia de Salmonella spp. En un área del Caribe colombiano: un riesgo para la salud pública. Biomédica vol.24 no.1 Bogotá. Instituto de Investigaciones Biológicas del Trópico, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba, Montería, Córdoba-Colombia. E & O Laboratories (2006). Salmonella Chromogenic agar. USA. 67 Ewing, W.H. (1985). Edwards and Ewing´s Identification of Enterobacteriaceae. 4th. Edition, Elsevier. FAO (Food and Agriculture Organization), (2002). SISTEMAS DE CALIDAD E INOCUIDAD DE LOS ALIMENTOS. Manual de capacitación sobre higiene de los alimentos y sobre el sistema de Análisis de Peligros y de Puntos Críticos de Control (APPCC). Publicado por la Organización de las Naciones Unidas para la Agricultura y la Alimentación y el Ministerio de Sanidad y consumo de España. FDA (Food and Drug Administration). (2003). “Bacteriological Analytical Manual”. 9th ed. Arlington, VA: AOAC. Fernández, J., Martínez, A. y González, W. (2001). Las enfermedades de trasmisión alimentaria (ETA). ¨Seguridad, Higiene y Salud¨. Capítulo 5. Pág. 1. Fernández-Escartín, E. (2008). “Microbiología e inocuidad de los alimentos”, Universidad Autónoma de Querétaro. Segunda edición. México. FSIS. (2003). inocuidad de la carne de cerdo desde el criadero hasta la mesa del consumidor. Food Safety and Inspection Service United States Department of Agriculture Washington, D.C. Información para los Consumidores. García, M. (2004). Microbiología de los alimentos. Pág. 144-148. [en línea] http://iso22000yhaccp.blogspot.com/2008/11/metodologa-para-anlisisde-salmonella.html. ICMSF. (2006). Guía Simplificada para el entendimiento y uso de objetivos de inocuidad de los alimentos y objetivos de rendimiento. International Commission on Microbiological Specifications for Foods. United Stated. Pág. 14. 68 Instituto Panamericano de Protección de alimentos y Zoonosis (PANALIMENTOS), (2007). Enfermedades Alimentarias. Publicado en la revista electrónica Salud y Sociedad. Buenos Aires-Argentina. Instituto Panamericano de Protección de alimentos y Zoonosis (PANALIMENTOS), (2005). Oficina de Comunicación Social y Educación. Buenos Aires-Argentina. Insunza, B. y Soto C. (1998). Salmonelosis: Una enfermedad que se transmite por alimentos. TECNO VET: Año 4 N°2, agosto 1998. Knabel, S. (2009), Enfermedades transmitidas a través de los alimentos, publicado en The World of Food Science. www.worldfoodscience.org MacFaddin, J. (2003). “Pruebas bioquímicas para la identificación de bacterias de interés biológico”. Tercera edición; Editorial MEDICA. PANAMERICANA: Montevideo, Uruguay. Págs. 145, 850. Madigan, M.; Martinko, J. y Parker, J. (2006). Biología de los Microorganismos, Ed. Pearson, Décima Edición, Madrid-España. Pág. 376- 377. Mattar, S.; Arrieta, G.; Durango, J. y Santos, A. (2005). Valoración del riesgo microbiológico de los alimentos en el Caribe Colombiano. Méndez, I.; Mossos, N.; Mogollón, D.; Poutou, R. y Máttar, S. (2006) Epidemiological relationships among strains of Salmonella entérica subsp. entérica isolated from humans, poultry and food. Universitas Scientiarium - Revista de la Facultad de Ciencias. Vol. 11, No. 1, 5-13. enero-junio de 2006. Michanie, S. (2003). Escherichia coli O157:H7 La bacteria que disparó el HACCP en la industria de la carne. Publicado en la revista Énfasis alimentos. Año IX, Nº3. Julio-Agosto. Argentina. Pág. 3. Narang, S. P. (2004). Food Microbiology. Chaman Enterprises. India. Pág. 132. 69 Nataro, J.P. y Kaper J.B. (1998). Diarrheagenic Escherichia coli. Clin. Microbiol. Rev. 11: 201. Neidhardt, F.C. (1999). Escherichia coli and Salmonella: cellular and molecular Biology. 2nd edition. ASM Press, Washington, USA. Norma Ecuatoriana INEN de carne y productos cárnicos INEN 1 348 189511. Norma Legal Peruana. (2003). "criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano". RESOLUCIÓN MINISTERIAL Nº 615-2003-SA/DM. Lima, 30 de mayo del 2003. Publicado en la Revista de Normas Legales “El Peruano”. Pág. 246850 – 246860. Norma Técnica Ecuatoriana para Control Microbiológico de los alimentos. Determinación de coliformes fecales y E. coli (NTE INEN 1 529-8). Norma Técnica Ecuatoriana para Control Microbiológico de los alimentos. Salmonella. Método de detección (NTE INEN 1 529-15:96). Olivet, J. (2008). Determinación de Escherichia coli y Escherichia coli O157:H7 en leches obtenidas artesanalmente y distribuidas en 15 lecherías de la cabecera departamental de Chiquimula. Universidad de San Carlos de Guatemala. Guatemala. Pág. 4-5 OPS, ORGANIZACIÓN PANAMERICANA DE LA SALUD/INPPAZ. (1999). II Reunión sobre “Información y Vigilancia de Enfermedades Transmitidas por alimentos” (SIRVETA). 6 al 8 de Diciembre de 1999. Martínez, Buenos Aires, Argentina. Ortiz, R.; Gutiérrez, R.; Vega, S.; Díaz, G. y Schettino, B. (2008). Contaminación de los alimentos. Universidad Autónoma Metropolitana Unidad Xochimilco. México. Pág. 7. Publicado en revista virtual RECITELA - v.8 n.1 70 Osuna, J.; Salazar, S.; Doyon, G.; Nolasco, Y.; Goenaga, R. (2010). Guía para el monitoreo de la calidad del agua de proceso y superficies de contacto en empacadoras de mango para exportación. INIFAP, CIRPAC. Campo Experimental Santiago Ixcuintla. Folleto Técnico Nº1, Santiago Ixcuintla, Nayarit, México. Págs. 5-8 Pacheco, M. (2007). Situación actual de las Enfermedades Trasmitidas por alimentos (ETA) en Honduras. Proyecto Especial de Graduación del Programa de Ingeniería en Agroindustria Alimentaria. Zamorano, Honduras. 50 p. Páez, C. (2009). Determinación de coliformes fecales y totales en expendio de alimentos en establecimientos formales en el Macrodistrito Centro de la Ciudad de la Paz de septiembre a diciembre del 2007. Universidad Mayor de San Andrés. La Paz-Bolivia. Pág. 26 Pascual M. y Calderón V. (2000). Microbiología Alimentaria: Metodología Analítica para alimentos y bebidas. Editorial Díaz de Santos S.A., Madrid-España. 2da Edición. Pág. 19. Pazos, J. (2002). Puerco Hornado. Publicado en Ecuador: Terra Incógnita en Septiembre del 2002. Artículo Nº 19. Pierson M. y Smoot L. (2001). Indicator Microorganisms and Microbiological Criteria. In: Food Microbiology. Fundamentals and Frontiers. 2nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA. Pag. 85. Quintanilla, L. (2008). Metodología para análisis de Salmonella. Seguridad Alimentaria. Publicado el domingo 30 de noviembre de 2008. Ramos-Ortega, L.M.; Vidal, L.; Vilardy, S. y Saavedra-Díaz, S. (2008). Análisis de la contaminación microbiológica (coliformes totales y fecales) en la Bahía de Santa Martha, Caribe Colombiano. Acta Biol. Colom. Vol.13 (3) 87-98 71 Rivero, H. y Baquero, M. (2004). inocuidad, calidad y sellos alimentarios. Documento Técnico. Biblioteca de Venezuela IICA. Quito – Ecuador. Rocky Mountain Laboratories. (2005). NIAID (National Institute of Allergy and Infectious Diseases), NIH (National Institute of Health). USA. Ryan, K.J. y Ray, C.G. (2004). Sherris Medical Microbiology, 4th ed. edición, McGraw Hill. ISBN 0-8385-8529-9. Schinitman, N. (2005). alimentos: prevención de su contaminación (31/03/05). www.ecoportal.net/content/view/full/43716 Valentí, P. y Rozman, C. (2000). Infecciones causadas por clamidias, Medicina Interna, (2)303:2694-2699, 14ª Harcourt, Madrid, España. Velilla, A., Terzolo, H. y Feingold, S. (2006). Avances en el Diagnóstico Molecular de Salmonella. Revista Mundo Láctico y cárnico. Pág. 18. 72 ANEXOS ANEXO 1 BROTES DE ETA EN AMÉRICA LATINA SEGÚN ALIMENTO IMPLICADO BROTES DE ETA EN AMERICA SEGUN ALIMENTO IMPLICADO (1995-1999) Frutas Hongos 1,3 1,4 Farináceos 1,7 Bebidas 1,7 Postres Hortalizas-legumbres 2 4,5 Huevo-mayonesa 4,7 Carne de aves 6,3 Otros Lácteos Mixtos Carnes rojas (FAO, 2002) Agua Pescado Alimentos Identificados 0,6 Porcentaje (%) 0 5 9 9,2 12,6 16,6 28,4 10 15 20 25 30 (FAO, 2002) 73 ANEXO 2 TABLA DE ENFERMEDADES COMUNES TRANSMITIDAS A TRAVÉS DE LOS ALIMENTOS, CAUSADAS POR BACTERIAS Enfermedad Periodo de (agente causante) Latencia Síntomas alimentos Modo de Prevención de Principales Típicos Contaminación la Enfermedad (duración) (Bacillus cereus) 8-16 hrs. Diarrea, cólicos, productos intoxicación (12-24 hrs.) vómitos cárnicos, sopas, polvo enfriando ocasionales salsas, rápidamente los vegetales alimentos alimentaria, diarreico (Bacillus cereus) 1-5 hrs. Náuseas, intoxicación (6-24 hrs.) vómitos, a veces cocidos alimentaria, Arroz y pasta De la tierra o del Calentando o De la tierra o del Calentando o polvo diarrea y cólicos enfriando rápidamente los emético alimentos Botulismo; 12-36 hrs. Fatiga, Tipos A y B: intoxicación (meses) debilidad, visión vegetales; Tipos A y B: de Calentando o la tierra o del enfriando alimentaria (toxina doble, habla frutas; productos polvo; Tipo E: rápidamente los de Clostridium arrastrada, cárnicos, avícola del agua y alimentos botulinum lábil al insuficiencia y de pescado; calor) respiratoria, a condimentos; sedimentos veces la muerte Tipo E: pescado Botulismo; No conocida Estreñimiento, Miel, de la tierra Esporas No se de miel a intoxicación debilidad, ingeridas de la alimentaria, insuficiencia tierra, del polvo, se va a prevenir los bebés –no infección infantil respiratoria, a o de la miel; veces la muerte coloniza el todo intestino Campilobacteriosis 3-5 días Diarrea, dolores alimentos de Pollo, leche Cocinando muy (Campylobacter (2-10 días) abdominales, cruda (no bien el pollo; pasteurizada) evitar la jejuni) origen animal, fiebre, náuseas, infectados vómitos contaminación cruzada; irradiando los pollos; pasteurizando la leche Cholera (Vibrio 2-3 días de Heces líquidas Mariscos crudos Heces humanas Cocinando muy cholera) horas a días profusas; a o mal cocinados en el entorno veces vómitos, deshidratación; marino bien los mariscos; higiene general si no se trata 74 puede ser mortal (Clostridium 8-22 hrs. Diarrea, cólicos, Pollo y carne de De la tierra , Calentando o perfringens) (12-24 hrs.) rara vez alimentos enfriando crudos rápidamente los intoxicación náuseas y alimentaria vómitos res cocidos alimentos (Escherichia coli) 12-60 hrs. Diarrea líquida, carne de res Ganado Cocinando muy infecciones (2-9 días) sanguinolenta cruda o mal infectado bien la carne de enterohemorrágicas cocida, leche res, transmitidas por los cruda pasteurizando la alimentos leche (Escherichia coli) por lo menos Cólicos, diarrea, alimentos Contaminación Cocinando muy infecciones 18 hrs. fiebre, disentería crudos fecal humana, bien los enteroinvasoras (incierta) directa o a alimentos través del agua higiene general transmitidas por los alimentos (Escherichia coli) 10-72 hrs. Diarrea líquida Contaminación Cocinando muy infecciones (3-5 días) profusa; a veces crudos fecal humana, bien los cólicos, vómitos directa o a alimentos través del agua higiene general enterotoxigénicas alimentos transmitidas por los alimentos Listeriosis (Listeria 3-70 días monocytogenes) Meningo- Leche, queso y De la tierra o de Pasteurizando la encefalitis; vegetales animales leche; mortinatos; crudos infectados, cocinando los septicemia o directamente o alimentos meningitis en por estiércol neonatos Salmonelosis 5-72 hrs. Diarrea, dolores Huevos crudos, alimentos de Cocinando muy (Salmonella abdominales, mal cocinados: origen animal, bien los huevos, especies) escalofríos, leche, carne y infectados; la carne y el fiebre, vómitos, pollos crudos heces humanas pollo; deshidratación pasteurizando la leche; irradiando los pollos alimentos higiene general Shigelosis (Shigella 12-96 hrs. Diarrea, fiebre, alimentos Contaminación Higiene general; especies) náuseas, a crudos fecal humana, cocinando muy veces vómitos y directa o a bien los cólicos través del agua alimentos Operarios con Calentando o resfríos, dolor enfriando (4-7 días) Intoxicación 1-6 hrs. Náuseas, Jamón, alimentaria por (6-24 hrs.) vómitos, diarrea productos 75 estafilococos cárnicos y de garganta o rápidamente los (enterotoxina de y cólicos avícola, cortadas que alimentos Staphylococcus pastelería están aureus estable al rellena de infectadas, calor crema, rebanadoras de mantequilla carne batida, queso Infección por 1-3 días Diversos, Leche cruda, Operarios con , Higiene general, estreptococos (varía) incluso dolor de huevos dolor de pasteurizando la transmitidos por los garganta, "endiablados" garganta y otro leche alimentos erisipela, tipo de (Streptococcus escarlatina infecciones por pyogenes) estreptococos Infección por Vibrio 12-24 hrs. Diarrea, cólicos, Pescado y Entorno marino Cocinando muy parahemolyticus a veces de la costa bien el pescado (4-7 días) mariscos transmitidos por los náuseas, alimentos vómitos, fiebre, y mariscos dolor de cabeza Infección por Vibrio En personas Escalofríos, Ostiones y Entorno marino Cocinando muy almejas crudas de la costa bien los vulnificus que tienen alto postración, a transmitida por los hierro sérico: 1 menudo la alimentos día muerte Yersiniosis 3-7 días Diarrea, dolores carne de res y Animales Cocinando muy (Yersinia (2-3 semanas) imitando puerco cruda o infectados, bien la carne, apendicitis, mal cocida, tofu especialmente clorinando el fiebre, vómitos, empacado en cerdos; aguas agua etc. agua de contaminadas enterocolítica) mariscos manantial (Cliver, 1993). 76 ANEXO 3 PROCEDIMIENTO RECUENTO, AISLAMIENTO E IDENTIFICACIÓN DE E. coli PESADO DE LA MUESTRA HOMOGENIZADO DILUCIONES DECIMALES RECUENTO DE COLIFORMES SIEMBRA EN PLACAS 77 LECTURA DE PLACAS EMB TINCIÓN GRAM PRUEBAS IMVIC PURIFICACION EN TUBOS PCA CONFIRMACIÓN BACILOS GRAM (-) RESULTADOS IMVIC (E. coli positivo) 78 ANEXO 4 PROCEDIMIENTO IDENTIFICACIÓN DE Salmonella PESADO PRE-ENRIQUECIMIENTO AISLAMIENTO HOMOGENIZADO ENRIQUECIMIENTO SELECTIVO PURIFICACIÓN 79 SELECCIÓN IDENTIFICACIÓN 80 ANEXO 5 (Pascual y Calderón, 2000) 81 ANEXO 6 ESQUEMA DE DETERMINACIÓN DE COLIFORMES TOTALES, FECALES Y E. coli 82 ANEXO 7 ESQUEMA DE MÉTODO DE DETECCIÓN DE Salmonella 83 84 85 ANEXO 8 AUTORIZACION DEL MUNICIPIO DE RUMIÑAHUI PARA LA SELECCIÓN DE LOCALES 86 ANEXO 9 INFORME ENTREGADO AL MUNICIPIO DEL CANTÓN RUMIÑAHUI 87 88 89 90 91