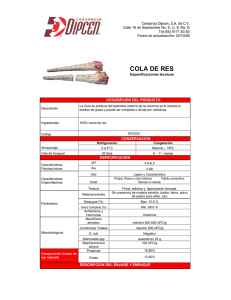
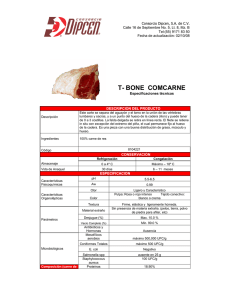
Efecto del pH Sobre la Conservación de Carne de Bovino
Anuncio

UNIVERSIDAD AUSTRAL DE CHILE FACULTAD DE CIENCIAS AGRARIAS ESCUELA DE INGENIERÍA EN ALIMENTOS Efecto del pH Sobre la Conservación de Carne de Bovino de Corte Oscuro (DFD) Envasada al Vacío, Almacenada a 0ºC Tesis presentada como parte de los requisitos para optar al grado de Licenciado en Ciencia de los Alimentos Jacqueline Patricia Jara Villegas Valdivia-Chile 2007 Profesor Patrocinante: Sra. Renate Schöbitz T. Tecnólogo Médico, M.Sc. Instituto de Ciencia y Tecnología de los Alimentos Facultad de Ciencias Agrarias Profesores Informantes: Dra. Carmen Gallo St. Médico Veterinario, Ph.D. Instituto de Ciencia Animal y Tecnología de Carnes Facultad de Ciencias Veterinarias Sr. Wilhelm Heimlich M. Químico Instituto de Ciencia y Tecnología de los Alimentos Facultad de Ciencias Agrarias Dedicada con cariño a mi madre…. Jeannett Villegas G. ÍNDICE DE MATERIA Capítulo Página 1 INTRODUCCIÓN 1 2 REVISIÓN BIBLIOGRÁFICA 3 2.1 Mercado de carne bovina 3 2.2 Referencias generales sobre la carne 4 2.2.1 Valor nutricional de la carne 4 2.2.2 Calidad de la carne 5 2.3 Transformación del músculo en carne 6 2.3.1 Rigor mortis 6 2.3.2 pH de la carne 7 2.4 Influencias de la temperatura en la duración de la carne 9 2.5 Efectos del estrés en la calidad de la carne 11 2.5.1 Carne pálida, blanda y exudativa (PSE) 12 2.5.2 Carne oscura, firme y seca (DFD) 13 2.6 Microbiología de la carne 15 2.7 Conservación de la carne mediante envasado al vacío 16 2.8 Alteraciones de la carne envasada al vacío 17 2.8.1 Bacterias ácido lácticas 18 2.8.2 Brochothrix thermosphacta 19 2.8.3 Enterobacterias 19 2.9 Características sensoriales de la carne 20 3 MATERIAL y MÉTODOS 23 3.1 Lugar del estudio 23 3.2 Materia prima 23 3.2.1 Control de pH en la carne 24 3.2.2 Selección de las muestras 24 3.2.3 Almacenamiento 25 3.3 Metodología de los análisis 26 3.3.1 Análisis sensorial 26 3.3.2 Análisis microbiológicos 27 3.3.3 Variación del pH en el tiempo 30 3.4 Metodología estadística 30 3.4.1 Diseño experimental 30 3.4.2 Análisis estadístico 30 4 PRESENTACIÓN y DISCUSIÓN DE RESULTADOS 32 4.1 Estudio del desarrollo de diferentes microorganismos en tres rangos de pH de la carne 32 4.1.1 Bacterias ácido lácticas (BAL) 32 4.1.2 Brochothrix thermosphacta 35 4.1.3 Enterobacterias 38 4.2 Variación del pH a través del tiempo 42 4.3 Análisis sensoriales 43 4.3.1 Jugosidad 43 4.3.2 Terneza 45 4.3.3 Intensidad sabor a carne 47 4.3.4 Aceptación general 48 5 CONCLUSIONES 51 6 7 RESUMEN 52 SUMMARY 53 BIBLIOGRAFÍA 54 ANEXOS 63 ÍNDICE DE CUADROS Cuadro Página 1 Factores que influyen en la calidad de la carne 6 2 Disminución del pH en la carne luego de la faena (post- 15 mortem) como indicador de la calidad de la misma 3 Distribución de muestras para análisis microbiológico y 25 sensorial 4 Condiciones de siembra para microorganismos en estudio 29 ÍNDICE DE FIGURAS Figura 1 2 3 4 Página Diferencias en color en carne PSE (1), normal (2) y DFD (3) Cocción de bifes y medición de temperatura Cartilla y presentación de muestra para evaluación sensorial Análisis microbiológico 12 26 27 29 Desarrollo de Bacterias Ácido Lácticas en carne de 5 bovino a tres rangos de pH, almacenada al vació a 34 0±1ºC Desarrollo de Brochothrix thermosphacta en carne de 6 bovino a tres rangos de pH, almacenada al vació a 37 0±1ºC 7 8 9 Desarrollo de Enterobacterias en carne de a tres rangos de pH, almacenada al vació a 0±1ºC Desarrollo de los tres microorganismos en estudio en los diferentes rangos de pH. Variación en el pH de la carne, envasada al vacío, almacenada a 0±1ºC 39 41 42 Evaluación de la jugosidad en los tres tiempos 10 analizados, en carne envasada al vacío, almacenada a 0 45 ±1ºC 11 Evaluación de la terneza en los tres tiempos analizados en carne envasada al vacío, almacenada a 0 ±1ºC 46 Evaluación de la intensidad de sabor a carne en los tres 12 tiempos analizados en carne envasada al vacío, 48 almacenada a 0 ±1ºC Evaluación de la aceptación general en los tres tiempos 13 analizados, en carne envasada al vacío, almacenada a 0 ±1ºC 49 ÍNDICE DE ANEXOS Anexo Página 1 Ficha para evaluación descriptiva 64 1 Ficha escala hedónica 65 2 Recuento y D.E. para Bacterias ácido lácticas en carne 67 envasada al vacío en tres rangos de pH 3 Análisis de varianza para bacterias ácido lácticas 68 4 Recuento y D.E. para Brochothrix thermosphacta en 70 carne envasada al vacío en tres rangos de pH 5 Análisis de varianza para Brochothrix thermosphacta 71 6 Recuento y D.E. 72 para Enterobacterias en carne envasada al vacío en tres rangos de pH. 7 Análisis de varianza para Enterobacterias 73 8 Variación de pH a través del tiempo 75 9 Análisis de varianza para pH 76 10 Evaluación sensorial de carne envasada al vacío 77 almacenada a 0±1ºC 11 Análisis de varianza para JUGOSIDAD 78 12 Análisis de varianza para TERNEZA 79 13 Análisis de varianza para INTENSIDAD SABOR A 80 CARNE 14 Análisis de varianza para ACEPTACIÓN GENERAL 81 1. INTRODUCCIÓN Las características biológicas y la composición química de la carne la convierten en un excelente medio de cultivo para los microorganismos. Por ello, los métodos de conservación deben estar encaminados a retrasar o inhibir el crecimiento microbiano para aumentar la vida útil de la carne fresca. La calidad de la carne se deteriora más rápido cuando el pH final es igual o mayor a 5,8, carne denominada de corte oscuro o DFD. El pH de la carne influye sobre las características organolépticas, ya que tiene una relación directa o indirecta con el color, la terneza, capacidad de retención de agua, conservabilidad y el sabor. La carne DFD debido a su alto pH y alta capacidad de retención de agua es susceptible al rápido deterioro microbiano, caracterizándose por presentar color oscuro y una superficie seca. Hipótesis La carne de bovino con un pH igual o superior a 5,8, almacenada al vacío, conservada a 0ºC, mantiene las características organolépticas de una carne de pH 5,7, almacenada en iguales condiciones, durante un periodo de dos meses. Objetivo General El objetivo general del presente estudio fue, evaluar la durabilidad de la carne bovina en tres rangos de pH, envasada al vacío y almacenada durante dos meses a una temperatura de 0 ºC. Objetivos específicos • Estudiar el desarrollo de microorganismos de descomposición en carne envasada al vacío con tres rangos de pH. • Analizar sensorialmente la carne de corte oscuro (pH ≥ 5,8), sometida a cocción, comparándola con carne de pH normal (pH ≤ 5,7), almacenadas a 0ºC. • Evaluar la durabilidad de carne de corte oscuro, en comparación con la carne de pH normal, envasada al vacío a 0ºC en base a características sensoriales y microbiológicas. 2. REVISIÓN BIBLIOGRÁFICA 2.1 Mercado de carne bovina Los estudios estadísticos más recientes en el sector pecuario chileno revelan que en el año 2003 el consumo de carne por habitante fue de 71,7 kg anuales, con una variación de 1,0% respecto a 2002. El 2004 el consumo de carne fue de 76,9 kg por habitante, con una tasa de crecimiento de un 5% anual en el periodo 1990 – 2004. La carne de mayor consumo en el año 2003 fue la de ave (28,0 Kg por habitante), seguida por el bovino 23,4kg, cerdo 19,3 kg y otras 1,0%. En el primer semestre del 2000 los envíos al exterior de carne bovina alcanzaron las 33 toneladas, situándose en el año 2004, en 2.372 toneladas (ODEPA, 2005). Este crecimiento de los últimos años se debe a la apertura de mercados, mejoramiento en la eficiencia de producción y desarrollo económico (INE, 2005). En el comercio mundial de carne bovina se pronosticó que ésta tendría un aumento superior al 6% en volumen total en el año 2005. Según las proyecciones, las exportaciones totales rondarán los 6,6 millones de toneladas (peso en canal). El aumento provendrá fundamentalmente de los países sudamericanos, con Brasil a la cabeza. Por otro lado, la Unión Europea seguirá aumentando sus importaciones, en la medida que vaya reduciendo su producción de carne. Las exportaciones australianas de carne bovino se mantendrán en torno a 1,3 millones de toneladas en el 2005. Argentina, a su vez, alcanzaría los mayores volúmenes de exportación de los últimos 25 años. China, también batirá el récord de aumento de producción, aumentando en el 2005 en relación al año 2000 en casi 1,8 millones de toneladas la cual corresponde a un 33% en volumen (FAO, 2005) y (USDA, 2005). 2.2 Referencias generales sobre la carne 2.2.1 Valor nutricional de la carne. La carne esta compuesta por un 70,4% de agua, 20,8% de proteínas, 7,2 % de grasa y 1,2 % de sales minerales. La mayor importancia de las proteínas de nuestro alimento es su función como materias constitutivas de los tejidos blandos del organismo, pero al mismo tiempo sirven también de fuente de energía. Son necesarias además para la formación de enzimas, hormonas y hemoglobina (pigmento rojo de la sangre). Las grasas desempeñan una función triple en nuestra nutrición; constituyen una fuente de energía y son además portadoras de vitaminas liposolubles, así como de ácidos grasos imprescindibles o esenciales. Las sustancias minerales participan de múltiples maneras en los procesos fisiológicos del organismo, actuando como catalizadores en varios procesos biológicos y ejerciendo una acción estimulante sobre la actividad de muchas enzimas (SENSER y SCHERZ, 1999) y (FRITZ y ANTILA, 1993). El consumo de carne y productos cárnicos contribuye fundamentalmente a la provisión de proteína, hierro, zinc, vitamina A y vitamina B. También contribuye a la incorporación frecuentemente demasiado elevada, de grasa, sodio, purinas y colesterol. Sin embargo, las cantidades de sodio, purinas y colesterol en la carne y productos cárnicos no presentan ningún riesgo adicional para la salud de las personas con un metabolismo sano y peso normal (SEUB, 1991). FRITZ y ANTILA (1993), señalan que el organismo requiere proteínas para la formación de tejidos blandos y sustancias minerales como fósforo y calcio para constituir el tejido óseo y los dientes. El agua tiene asimismo una gran importancia, ya que el organismo consta de una porción aproximada de un 70% de ésta. 2.2.2 Calidad de la carne. Calidad es un término complejo del que no existe una única definición que sea válida para todos los niveles de la producción cárnica. Todas las definiciones de la calidad de la carne implican características de composición de la canal como determinantes del valor en el mercado y las más recientes consideran sus propiedades nutritivas, organolépticas, tecnológicas e higiénico sanitarias (MORENO et al., 1999). La calidad organoléptica de la carne viene determinada por las propiedades de la misma que son percibidas por los sentidos como color, textura, jugosidad y sabor, que son los atributos de calidad más importantes en el momento del consumo. La obtención de estos parámetros de calidad está determinada por todos y cada uno de los eslabones que intervienen en la producción de la carne, como son el ganadero, el matadero, la comercialización y el consumidor (HARGREAVES et al., 2004). De acuerdo con esto HERVÉ (1995), señala que los factores que determinan calidad de la carne son variables y también dependientes de lo que el consumidor valora como calidad. Sin embargo, generalmente la terneza se visualiza como aquella característica de la carne bovina que es más importante para el consumidor que otros factores como jugosidad, sabor, textura, color entre otros. Según BUXADÉ (1998), la calidad de la carne depende tanto de la composición como de la estructura de la misma. Para obtener carne de calidad los tratamientos posteriores al sacrificio deben servir para mejorar la estructura de la carne, ya que la canal es mucho más susceptible que el animal vivo a tratamientos que puedan determinar en gran medida los atributos de la calidad sensorial. La calidad de la carne debe entenderse como un factor posterior de la cadena donde surgen factores tales como color de grasa y músculo, textura, firmeza, composición química, y todas las de apariencia general (HERVÉ, 1995). CUADRO 1. Factores que influyen en la calidad de la carne. Factores Productivos Factores Biológicos Especie Raza Sexo Edad al sacrificio Susceptibilidad al estrés Tipo de músculo Factores Productivos Factores Tecnológicos Sacrificio Medio ambiente Manejo Alimentación Patología Sistema de explotación Factores Postsacrificio Transporte Recepción, reposo Desangrado Condiciones higiénicas Composición cuantitativa Enfriamiento Condiciones rigor-mortis T° y tiempo maduración Envasado Exposición Estructura CALIDAD DE LA CARNE FUENTE: BUXADÉ (1998). 2.3 Transformación del músculo en carne 2.3.1 Rigor mortis. El sacrificio del animal interrumpe, de inmediato, el aporte de oxígeno y detiene la ruta aeróbica de producción de ATP. Las reservas de fosfocreatina se agotan rápidamente. La fuente de ATP que sigue funcionando es la constituida por la ruta anaeróbica, la glicólisis. En estas condiciones, sin embargo, la conversión de glucógeno o glucosa en ácido láctico, con producción de ATP, es autolimitante, ya que el acúmulo de ácido láctico conduce a un descenso del pH que inhibe a las enzimas participantes de la glicólisis. El rápido agotamiento del ATP está también relacionado con el fallo del sistema regulador que controla la concentración de Ca2+. La elevada concentración de Ca2+ que esto genera en el sarcoplasma induce la contracción de las fibras musculares y el consumo de ATP. Como no queda ATP para disociar el complejo actina-miosina, el músculo pierde su extensibilidad natural. A este fenómeno post mortem se le conoce como rigor-mortis (WONG, 1995). El rigor mortis o rigidez cadavérica es la contracción severa de los músculos de los animales sacrificados. La rigidez se presenta cuando el nivel de ATP es menor de 1 µg/g de tejido y como consecuencia de esto se pierde el agua de los espacios entre las miofibras y la carne se vuelve dura y seca (BADUI, 1997). La rigidez observada en el rigor mortis se debe a la formación de enlaces cruzados permanentes entre los filamentos de actina y de miosina del músculo. Es la misma reacción química que forma actina-miosina en vida durante la contracción muscular. La diferencia entre el estado vivo y el rigor es que en el último la relajación es imposible, ya que no se dispone de energía para separar la actina-miosina (FORREST et al., 1979). 2.3.2 pH de la carne. PALEARI et al. (1995), señalan que el agotamiento del glucógeno muscular es atribuido a situaciones de estrés. Los animales que son transportados al matadero sufren especialmente trauma y miedos durante la carga, descarga y transporte, y son estresados además por las luchas de jerarquía entre ellos. Bajo estas condiciones las reservas de glucógeno que se han visto reducidas tardan un cierto tiempo hasta volver a regenerarse. De acuerdo con ello GALLO (1997), señala que el estrés físico y la falta de alimento pueden tener importantes efectos sobre la calidad de la carne. El estrés ante-mortem provoca consumo excesivo de glucógeno muscular, minimizando la cantidad de ácido láctico en el músculo post-mortem e impidiendo con ello la caída natural del pH en este periodo. La energía requerida para la actividad muscular en un animal vivo se obtiene de los azúcares (glucógeno) presentes en el músculo. En un animal sano y descansado, el nivel de glucógeno de sus músculos es alto. Una vez sacrificado el animal, este glucógeno se convierte en ácido láctico y el músculo y la canal se vuelven rígidos (rigor mortis). Este ácido láctico es necesario para producir carne tierna y de buen sabor, calidad y color. Pero si el animal está estresado antes y durante el sacrificio, se consume todo el glucógeno y se reduce el nivel de ácido láctico que se desarrolla en la carne luego de su sacrificio. Esto puede tener efectos adversos muy graves en la calidad de la carne (GRANDIN, 2000). El ácido láctico en el músculo tiene el efecto de retardar el desarrollo de bacterias que contaminan la canal durante el sacrificio y el faenado. Estas bacterias deterioran la carne durante su almacenamiento, especialmente en ambientes cálidos y la carne desarrolla olores desagradables, cambios de color y rancidez (FAO, 2001). Según HOFMANN (1988), el pH tiene una influencia directa o indirecta sobre: el color, la terneza, el sabor, la capacidad de fijación de agua y la conservabilidad de la carne. HOOD y TARRANT (1980), señalan que la calidad de la carne se deteriora cuando el pH final es igual o mayor a 5,8 y éste es el valor que en la práctica la mayoría de las plantas faenadoras están considerando como problemático. Según GALLO (2003), con este valor de pH, en general el problema de color oscuro no se detecta a la vista y por ello, algunos procesadores aceptan hasta un pH 6,0 como máximo. Valores sobre 6,0 son siempre asociados a una carne oscura, firme y seca y generalmente ya hay relación entre el color oscuro a la apreciación visual. El tiempo de espera antes del sacrificio produce un estado de estrés que influye sobre el proceso de maduración de la carne. Los bovinos con menor tiempo de espera manifiestan un descenso del pH de la carne más cercano al normal, con un proceso de maduración más largo con respecto de los bovinos con más tiempo de espera, que presentan un descenso leve del pH. Existe por lo tanto una directa relación entre los valores de glucosa en la sangre en el momento del sacrificio, y los valores de pH de la carne (FLORES y ROSMINI ,1993). 2.4 Influencias de la temperatura en la duración de la carne. La carne fresca antes de su conservación en frío, puede contener bacterias que crecen a bajas temperaturas (psicrótrofas) como otros que no crecen bajo estas condiciones, o bien lo hacen muy lentamente, como las bacterias mesófilas (GILL y LANDERS, 2003). Las temperaturas de refrigeración y enfriado (1 a 7°C) tienen una importante acción selectiva sobre la flora mixta formada por microorganismos mesófilos y psicrótrofos y pueden afectar la composición de la carga inicial de la carne, conduciendo a modificaciones durante el almacenamiento. Existen dos razones importantes por las cuales las temperaturas de refrigeración reducen el crecimiento de las bacterias psicrótrofas sobre la superficie de la carne: la extensión de la fase de latencia y la reducción de la velocidad de crecimiento (CARDENAS y GIANNUZZI, 2005). A temperaturas de 20°C, la carne fresca en filetes o picada se altera rápidamente en 3 - 4 días. Los primeros síntomas de alteración (olores anormales) se detectan en los 2 primeros días. Cualquiera sea la temperatura de almacenamiento cuando los recuentos alcanzan 107 ufc/cm2, hay producción de olores extraños. A temperaturas próximas a 0°C se aprecia una caída inicial del número de bacterias viables la cual se debe, probablemente, a la muerte o lesión de muchos tipos de bacterias a estas temperaturas. A medida que la temperatura se aproxima a los 0°C, el crecimiento bacteriano es mucho más lento y cada vez son menos los tipos de microorganismos que pueden crecer (HAYES, 1993). Se ha observado que casi todas las bacterias que se desarrollan a temperaturas de refrigeración en la superficie de la carne son de características aeróbicas, principalmente ante la presencia de atmósferas húmedas de almacenamiento. En tanto, los géneros anaeróbicos facultativos, tales como Lactobacillus o algunas Enterobacterias, se desarrollan más lentamente y la putrefacción externa precede al enverdecimiento y agriado inducido por estos microorganismos (GILL, 1982). El buen resultado del almacenamiento bajo refrigeración de la carne fresca depende fundamentalmente de la calidad higiénica de la materia prima, de la velocidad de refrigeración y de la mantención de una cadena de frío permanente (matanza, desposte, almacenamiento, distribución, venta). Esto se conoce como la Ley de Monvoisin (ROSSET, 1982), la cual señala: • la contaminación inicial debe ser la menor posible ya que los microorganismos no son eliminados por la refrigeración, éstos sólo disminuyen o se inhibe su crecimiento • es importante enfriar el producto tan rápido o tempranamente como sea posible, para prevenir el crecimiento de bacterias mesófilas, organismos degradadores o patógenos • la cadena de frío no debe ser interrumpida, sin embargo debe recordarse que una cadena efectiva de frío no inhibe totalmente el crecimiento de las bacterias psicrótroficas y psicrofílicas. La sanidad microbiológica del producto depende si ha sido constantemente mantenido a temperaturas bajas ya que cualquier periodo sobre 4°C puede permitir el crecimiento de especies mesófilas, especialmente patógenas. 2.5 Efectos del estrés en la calidad de la carne. Según Selye citado por GALLO (1991), “el estrés es la acción de estímulos nerviosos y emocionales provocados por el ambiente de un animal sobre los sistemas nerviosos, circulatorio, endocrino, respiratorio y digestivo”. Dentro de las situaciones de estrés más importantes está el transporte demasiado prolongado o en malas condiciones hasta las plantas faenadoras, esfuerzos físicos desacostumbrados, ajetreo y excitación antes y durante el proceso de faenamiento, ayunos prolongados, genética, mezcla de animales de diferentes sexos y procedencias. Existen dos alteraciones principales de la calidad de la carne producidas por estrés: las carnes DFD (dark =oscura, firm =consistente, dry = seca) y las carnes PSE (pale =pálida, soft= blanda, exudative = acuosa), éstas últimas se han descrito únicamente en el ganado porcino (MANTECA, 2004). Según WIRTH (1987), el origen de la carne tanto PSE como DFD, es atribuido a la misma causa genética vale decir elevada susceptibilidad al estrés, debido a un aumento en la secreción de adrenalina. La diferencia radica en que en la musculatura de la carne PSE se encuentra suficiente glucógeno disponible mientras que en la carne DFD este glucógeno ha sido agotado en gran medida. El buen manejo del ganado, es decir en forma eficiente, experta y calmada utilizando las técnicas e instalaciones recomendadas y tomando medidas para evitar el dolor y las lesiones accidentales, reducirá el estrés en los animales y se evitarán así deficiencias en la calidad de las carnes (CAÑEQUE y SAÑUDO, 2000). 1 2 3 FIGURA 1 (*). Diferencias en color en carne PSE (1), normal (2) y DFD (3). 2.5.1 Carne pálida, blanda y exudativa (PSE). Los músculos en las carnes PSE se caracterizan por ser blandos, de color entre rosado claro y gris amarillento La condición PSE en los cerdos es causada por un estrés severo, inmediatamente antes de su sacrificio durante la descarga, el manejo, al encerrarlos en los corrales o al inmovilizarlos y aturdirlos. En estas circunstancias, los animales están sujetos a una fuerte ansiedad y miedo por el (*) FUENTE: http://www.fao.org. Consultado 20/08/05 manejo que le proporciona el hombre, por las peleas en los corrales o por las malas técnicas de aturdimiento. Todo esto trae como resultado una serie de procesos bioquímicos en el músculo, en especial, la rápida degradación del glucógeno. La carne se vuelve muy pálida y adquiere una acidez muy pronunciada (valores de pH de 5,4-5,5 inmediatamente después del sacrificio), y con poco sabor. Este tipo de carne es difícil de aprovechar y de hecho no la pueden usar los carniceros o los procesadores de carne. En casos extremos se desperdicia. Si se permite que los cerdos descansen una hora antes de su sacrificio y se les da un buen manejo, se reduce considerablemente el riesgo de PSE (FAO, 2001; PREUB, 1991). Según DOYLE et al. (1997), la carne PSE es una condición que ocurre en cerdos, pavos y en menor medida en vacuno, en el cual la glicólisis postmortem acelerada disminuye el pH muscular a su nivel más bajo mientras la temperatura muscular es todavía muy alta. WIRTH (1987), señala que debido al brusco descenso de pH en un momento en que la carne aún presenta elevada temperatura, se produce una desnaturalización proteica que afecta la fijación de agua, por lo cual la carne PSE presenta sobre todo una mala fijación del agua. Además el color de la carne PSE es marcadamente claro. 2.5.2 Carne oscura, firme y seca (DFD). En el caso de las carnes DFD o de corte oscuro la musculatura es muy consistente o dura, de color rojizo oscuro y seca, en ocasiones pegajosa (PREUB, 1991). En cuanto a los factores genéticos GALLO (2003), señala que existen razas más propensas que otras a la presentación de corte oscuro. Los animales de temperamento más excitable son más sensibles, por ejemplo los toritos presentan más corte oscuro que los machos castrados y las hembras. Por carne DFD se entiende una carne oscura, firme y seca y también “untuosa” al tacto. Esta anomalía se presenta tanto en la carne de cerdo como en la de vacuno siendo en esta última conocida también bajo la denominación de “dark cutting beef” (KATSARAS y PEETZ ,1990). El corte oscuro es una anomalía que se caracteriza por el color rojo oscuro y el pH alto de algunos músculos de la canal, especialmente el lomo. Esta condición puede presentarse en canales de ganado vacuno u ovino, y ocasionalmente en cerdos y pavos, al poco tiempo de su sacrificio (GALLO 2003). En la carne DFD la glucólisis (formación de ácido) se desarrolla más lentamente o de manera incompleta o casi no se produce. Este tipo de carne no alcanza en ningún momento el pH normal, sino que permanece en niveles elevados de pH final por sobre 6,2, generalmente superiores e incluso hasta 7,0. El glucógeno muscular se consume durante el transporte y el manejo en el período anterior al sacrificio. Por consiguiente, hay poca generación de ácido láctico luego del sacrificio, produciéndose así carne DFD (FAO, 2001; WIRTH ,1987). En el CUADRO 2 se puede observar la disminución del pH en la carne luego de la faena. La carne de vacuno con características DFD es un problema para la industria de la carne. La presencia de esta característica en la canal influye no sólo sobre la calidad de la misma sino que desmejora también su aptitud para la comercialización (PALEARI et al. ,1995). Esta carne almacenada y envasada al vacío, o en atmósfera modificada se deteriora rápidamente resultando, una decoloración verde la cual se debe a la producción de sulfuro de hidrógeno desde cisteina o glutatión por Shewanella putrefaciens, reaccionando con la mioglobina en el tejido muscular para formar sulfomioglobina, un pigmento de color verde (DOYLE et al., 1997). CUADRO 2. Disminución del pH en la carne luego de la faena (postmortem) como indicador de la calidad de la misma. Calidad de carne Evolución de la glucólisis Valor de pH inicial pH al final de la glucólisis Normal lenta 7,2 PSE rápida 7,2 <5,8 45 min DFD lenta, incompleta 7,2 >6,2 24 h Aprox.5,5 Momento de la medición post-mortem. 24 h FUENTE: HOFMANN (1988). WIRTH (1987), indica que la carne con características PSE puede ser empleada, con ciertas limitaciones, para embutidos secos, jamón crudo y en ocasiones para embutido escaldado. No es adecuada, sin embargo, para jamón cocido y otros productos cocidos curados. La carne con características DFD puede emplearse para embutidos escaldados y productos cocidos curados, pero no es apropiada para embutidos secos, jamón crudo y carne seca. 2.6 Microbiología de la carne La carne es un alimento altamente perecible ya que posee ciertas propiedades de importancia microbiológica que la hacen un excelente medio para el desarrollo de microorganismos, entre las cuales se encuentran, los nutrientes. El desarrollo de los microorganismos ocurre primeramente a expensas de los constituyentes solubles como carbohidratos, ácidos lácticos y aminoácidos y la digestión de las proteínas se produce en etapas secundarias. La actividad de agua de la carne fresca tiene un valor aproximado de 0,99, valor apropiado para la mayoría de los microorganismos, principalmente bacterias. El potencial de óxido-reducción es el factor central en la respiración tisular que consume 02 y libera CO2. Después de la muerte del animal, el potencial redox va bajando paulatinamente hasta que la masa cárnea en su interior se hace anaeróbica. El pH en la carne al ser faenado el animal es cercano a 7,0, que es el óptimo para muchas bacterias alterantes y patógenas. Valores de pH inferiores a 5,5 son desfavorables para las bacterias y en combinación con otros factores como temperaturas bajas, pueden prevenir el desarrollo bacteriano (SCHMIDTHEBBEL, 1984). Según GARCÍA et al. (1995), Los microorganismos desempeñan un papel fundamental en los cambios metabólicos que ocurren antes, durante y después del rigor mortis. Estos factores afectan por tanto el valor potencial de la carne para su posterior procesado y también su aceptabilidad por el consumidor. La microflora bacteriana habitual de la carne fresca es muy heterogénea; está formada principalmente por Pseudomonas, géneros de la familia Enterobacteriaceae, Acinetobacter, Brochotrix thermosphacta y Lactobacillus, que dependiendo de su número y especie pueden causar numerosas alteraciones y en algunos casos intoxicaciones. Dentro de las bacterias patógenas se pueden encontrar Salmonella, Staphylococcus aureus, Yersinia enterocolitica, E. coli enteropatógeno, Clostridium perfringens y ocasionalmente Clostridium botulinium (CARDENAS y GIANNUZZI, 2005). 2.7 Conservación de la carne mediante envasado al vacío El envasado al vacío consiste en la eliminación total del aire del interior del envase sin que sea reemplazado por otro gas, existiendo una diferencia de presión entre el exterior y el interior del envase (FAO, 2001). BRODY (1996) señala, que los alimentos metabólicamente activos envasados al vacío, como lo son las carnes, continúan con sus actividades respiratorias, consumiéndose así la pequeña cantidad de oxígeno presente en los tejidos del producto, con lo que aumenta el vacío y se produce dióxido de carbono y vapor de agua. El aumentar las concentraciones de CO2 en el envase tiene sus ventajas, ya que es inhibidor frente a muchos microorganismos, incluidos mohos y pseudomonas, las cuales constituyen la flora dominante de las carnes frescas alteradas. Las bacterias lácticas y las levaduras son mucho más resistentes a niveles altos de CO2 (HAYES, 1993). Para tener éxito en la extensión de la vida útil de la carne al vacío y lograr un almacenamiento de ocho a más semanas, la temperatura de la carne deberá estar bajo los 10° C y lo más cercana a los 0°C. En cuanto al pH, en el momento del envasado éste debe ser igual o inferior a 5,8. Esto implica que los animales antes del sacrificio no deben haber estado sometidos a ningún tipo de “estrés” y el enfriado post mortem debe haber sido adecuado (SCHÖBITZ, 1991). 2.8 Alteraciones de la carne envasada al vacío Según SCHÖBITZ et al. (1990), la técnica del envasado de carne al vacío, ha significado un avance importante en la conservación de este producto por un tiempo prolongado, sin que sea necesaria su congelación. Para poder extender la duración es necesario sin embargo, almacenarla a una temperatura cercana a los 0ºC. La carne con pH elevado (pH 6,0) presenta durante el envasado al vacío una conservabilidad muy escasa. Las bacterias sensibles al ácido, especialmente Enterobacteriaceae y Brochothrix, pueden competir mejor bajo estas condiciones de pH más elevado. Además debido a la falta de azúcares fermentables, se produce una rápida degradación microbiana de aminoácidos, originando productos de olor desagradable como H2S o NH3 (SCHILLINGER y LÜCKE, 1991). JAY (2000), además señala, que cuando las carnes envasadas al vacío experimentan alteraciones, con frecuencia los organismos predominantes son lactobacilos, Brochotrix thermosphacta o ambos. El deterioro de la carne envasada al vacío ocurre principalmente por B thermosphacta, A. putrefaciens y E. liquefaciens. B. thermosphacta se desarrolla en ausencia de oxígeno sólo a elevadas temperaturas y sobre todo, cuando se trata de carne DFD. El deterioro va acompañado de un olor ácido ligeramente “a encierro”. A. putrefaciens crece solamente en presencia de pH elevado (carne DFD), con la formación de color verdoso en la carne y un olor desagradable. E. liquefaciencs también provoca el deterioro, sobre todo en carne DFD, con un olor desagradable, ligeramente acidulado (BEM y HECHELMANN, 1996). El desarrollo de microorganismos que afectan la conservabilidad de la carne y productos cárnicos, depende del pH. Con un pH elevado el riesgo de deterioro (degradación proteica, putrefacción) es mayor. La carne y productos cárnicos con pH superior a 6,0 son particularmente riesgosos (WIRTH, 1987). Los principales grupos microbianos presentes en la carne DFD envasada al vacío son: 2.8.1 Bacterias ácido lácticas. Este grupo de bacterias no necesitan oxígeno para crecer, son tolerantes a la presencia de CO2, nitritos, humo y concentraciones de sal relativamente altas y toleran valores de pH bajos. Por ello, las condiciones existentes en las carnes envasadas al vacío y en los productos cárnicos favorecen el crecimiento de estos microorganismos. En general las condiciones que favorecen el crecimiento de las bacterias lácticas resultan en un incremento considerable de la vida útil de la carne refrigerada, ya que inhiben el desarrollo de microorganismos alterantes y patógenos y mejoran la calidad microbiológica de la carne (GARCÍA et al., 1995). De acuerdo con SCHILLINGER y LÜCKE (1991), la disminución del pH, provocada por la actividad metabólica de las bacterias lácticas, origina una inhibición de la mayoría de las bacterias patógenas. Las bacterias lácticas homofermentativas transforman los hidratos de carbono principalmente en ácido láctico, el cual como ácido no disociado, posee cierta acción bacteriostática. 2.8.2 Brochothrix thermosphacta. Bacilo pequeño, gram positivo e inmóvil, como en el caso de las pseudomonas, no se desarrolla bien en los envases impermeables al oxígeno, pero en los permeables a veces representa el 2030% de la flora alterante total (HAYES, 1993). B. thermosphacta no es afectada por la presencia de CO2 y corrientemente alcanza recuentos altos en la carne de cordero y de cerdo, sobretodo cuando se envasan en películas de permeabilidad intermedia, cuyos envases acumulan algo de dióxido de carbono o si bien contiene aún niveles bajos de oxígeno. También requiere de pH igual o superior a 5,8 para crecer (BROWN y BAIRD-PARKER, 1982; SCHÖBITZ, 1991). 2.8.3 Enterobacterias. Las enterobacterias son bacilos cortos gram negativos, sin pigmentos, que fermentan la glucosa y la lactosa con producción de ácidos y gas, como H2 y CO2; abundan en las plantas, los granos, el agua y en tracto gastrointestinal (BADUI, 1997). Las enterobacterias comprenden ocho géneros de interés Escherichia, Salmonella, Shigella, Enterobacter, Proteus, Yersinia y Erwinia (HAYES, 1993). El efecto de la permeabilidad del envase está directamente relacionado con el desarrollo de Escherichia coli. En carnes con diferentes pH almacenadas a temperaturas cercanas a los 0°C en envase permeable, se puede observar un crecimiento de hasta 108 UFC/g en aproximadamente 20 días, en cambio en envases impermeables sólo las que presentan pH elevado muestran niveles máximos de 105 UFC/g. En tanto a pH menores se observa un menor desarrollo del número microbiano inicial, durante un tiempo de conservación de 50 días (CÁRDENAS y GIANNUZZI, 2005). 2.9 Características sensoriales de la carne Cuando se requiere evaluar la calidad sensorial de un alimento, es decir, el resultado de las sensaciones que experimentan los consumidores, el único camino es preguntárselo a ellos mismos, ya que la calidad sensorial no es una característica intrínseca del alimento, sino el resultado de la interacción entre el alimento y el hombre. El análisis de la composición química y de las propiedades físicas de un alimento proporciona información sobre la naturaleza del estímulo que percibe el consumidor, pero no sobre la sensación que éste experimenta (BUXADÉ, 1998). Según McGUIRE (2001), debido al costo, la carne y sus productos regularmente son percibidos como alimentos de “lujo”, por lo que el gusto de consumirlos es un factor determinante para su compra. Las características “normales” de la carne son color entre rojo claro y oscuro, consistencia dura elástica, buena capacidad de retención del jugo, estabilidad de color tras un proceso de curado, suficiente capacidad de conservación, olor y sabor limpios y peculiares de la especie (PREUB, 1991). Según BIFANI (1988) y BUXADÉ (1998), la sensación de satisfacción que deriva del consumo de la carne dependerá de las respuestas psicológicas de cada individuo, las que están influenciadas por factores tales como apariencia, jugosidad, aroma, terneza, sabor. Lo primero que espera el consumidor es que el color del producto que ingiere sea atractivo. El color oscuro de una carne asada se asocia a que ha sido bien preparada, lo cual influye en las reacciones del consumidor, estimulando las glándulas salivales, con lo cual lo predispone aún antes de probarla. La apariencia reseca de una carne sobre cocinada se asocia de inmediato a una falta de aroma y a sequedad. La presencia de grasa afecta la palatabilidad, más aún si ésta no se presenta en la forma que agrada al consumidor (WONG, 1995). La sensación combinada del gusto y el olor es lo que se conoce con el término sabor y que corresponde al término inglés “flavour”. La carne tiene que ser sometida a tratamiento térmico para que desarrolle su sabor y durante este proceso ocurren numerosas reacciones. En la carne de vacuno cocida (hervida, asada) se han identificado más de 200 compuestos volátiles. Algunos precursores del sabor son los aminoácidos, péptidos, azúcares reductores, vitaminas y nucleótidos. La interacción de estos componentes y su degradación produce una gran cantidad de compuestos intermediarios o volátiles que contribuyen al desarrollo y generación de aroma típico durante el cocimiento de la carne. Los lípidos también juegan un papel importante en el sabor general de la carne y están intrínsicamente ligados al sabor de cada especie (LIEN, 2002). La terneza es el criterio organoléptico más importante de los consumidores, ésta se puede definir como la facilidad de morder y masticar la carne. En la carne la terneza varía ampliamente, lo cual está dado por dos causas principales: el tejido conectivo y las miofibrillas musculares. El colágeno depende del músculo y del animal, mientras que el estado de las miofibrillas varía también por las condiciones post mortem (SCHACKELFORD et al., 1997). La jugosidad representa durante el consumo, la percepción de más o menos sequedad de la carne. Dos son los principales factores: agua y lípidos contenidos en el músculo. La retención de agua en la carne cocida depende del pH y de las condiciones de cocción (BUXADÉ, 1998). El problema de la carne de corte oscuro existe en todos los países, y representa altas pérdidas económicas para la industria cárnica. Es por ello que en el presente estudio se evalúa la durabilidad de la carne corte oscuro envasada al vacío mediante el desarrollo de los microorganismos y las características sensoriales de ésta, almacenada a 0ºC por 2 meses. 3 MATERIAL y MÉTODOS 3.1 Lugar del estudio Todas las muestras fueron tomadas en la sala de desposte de la industria FRIVAL (Frigorífico Valdivia S.A), ubicada en calle Balmaceda # 8010 de la ciudad de Valdivia. Los análisis microbiológicos y sensoriales se realizaron en los laboratorios de microbiología y evaluación sensorial, el almacenamiento de la carne envasada al vacío a 0 ± 1ºC por dos meses se realizó en el laboratorio de productos vegetales, todos pertenecientes al Instituto de Ciencia y Tecnología de los Alimentos (ICYTAL), de la Facultad de Ciencias Agrarias de la Universidad Austral de Chile. El estudio experimental fue realizado en el periodo de invierno- primavera (24 agosto al 24 octubre del 2005). 3.2 Materia prima La materia prima utilizada fue carne de vacuno de animales de categoría V (novillito) obtenida de la industria FRIVAL. Se trabajó con un corte del cuarto posterior, el lomo liso (desde la 10ª costilla hacia atrás), que corresponde al músculo Longissimus thoracis. Se obtuvieron ambos lomos de un mismo animal. Se utilizaron tres animales por rango de pH en los siguientes rangos: ≤5,7 (pH normal), 5,8-6,1(pH intermedio) y ≥6,2 (pH alto), sumando un total de 9 animales o 18 lomos, los cuales fueron obtenidos del mismo lote y faenados el mismo día. Las muestras fueron obtenidas dentro de las 48 h posteriores a su faenamiento y fueron envasadas al vacío en la misma empresa. Los animales fueron seleccionados de acuerdo a los 3 rangos de pH y en triplicado, dando un total de 9 animales distintos (CUADRO 3). 3.2.1 Control de pH en la carne. La medición del pH se realizó en la cámara de frío de la empresa, a cada canal del animal y fue medido después de 24 h del faenamiento, utilizando un peachímetro con electrodo de punción (HANNA, modelo HI 1270, U.S.A.), el que fue calibrado con sus respectivos buffer. Posteriormente la canal fue pasada a la sala de pre - desposte donde se realizó un seguimiento para obtener los dos lomos lisos de un mismo animal. Nuevamente se controló el pH a lo largo de todo el lomo liso, cada 5 centímetros y a 2 centímetros de profundidad, para verificar que el pH fuese homogéneo y constante en toda la longitud del corte. 3.2.2 Selección de las muestras. Una vez comprobada la homogeneidad del pH se cortaron los bifes con un cuchillo previamente esterilizado. Cada bife tuvo un grosor de 1,0 cm para los análisis microbiológicos y 2,5 cm para el estudio sensorial. Posteriormente fueron envasados al vacío (bolsas Cryovac, tipo BL-4) con el equipo disponible en la planta de la industria FRIVAL. Finalmente los trozos de carne fueron sometidos al proceso de termoencogido, sumergiendo la bolsa en agua caliente (80ºC durante 2s). CUADRO 3. Distribución de muestras para análisis microbiológico y sensorial. Tiempo (días) 0 15 30 45 60 Animal Rango pH 1-2-3 ≤ 5,7 4-5-6 5,8 -6,1 7-8-9 ≥ 6,2 1-2-3 ≤ 5,7 4-5-6 5,8 -6,1 7-8-9 ≥ 6,2 1-2-3 ≤ 5,7 4-5-6 5,8 -6,1 7-8-9 ≥ 6,2 1-2-3 ≤ 5,7 4-5-6 5,8 -6,1 7-8-9 ≥ 6,2 1-2-3 ≤ 5,7 4-5-6 5,8 -6,1 7-8-9 ≥ 6,2 3.2.3 Almacenamiento. El almacenamiento de la carne envasada al vacío, tanto para los análisis sensoriales como microbiológicos se realizaron dentro de cajas de cartón, las cuáles se mantuvieron en un refrigerador a una temperatura de 0º ± 1ºC ubicado en el laboratorio de productos vegetales (ICYTAL). El tiempo total de almacenamiento de la carne fue de 60 días para el análisis microbiológico y 45 días para el análisis sensorial. 3.3 Metodología de los análisis 3.3.1 Análisis sensorial. Los bifes de 2,5 cm de grosor fueron sometidos a cocción en un sartén eléctrico cubierto con teflón (OSTER, Alemania) a 200ºC envueltos en papel aluminio. La temperatura fue controlada en el centro térmico con un registrador de temperatura (FAIRGROVE, Alemania) para verificar la cocción. Cuando el bife alcanzó los 70ºC fue retirado y cortado en trozos de aproximadamente 2,5cm de ancho por 2,5cm de alto, los trozos se mantuvieron a una temperatura de 40ºC en un horno eléctrico (HERAEUS, Alemania), hasta su evaluación sensorial. A cada panelista se le otorgó un trozo de cada bife con su respectiva codificación según el rango de pH. El control de la temperatura de cocción se observa en la FIGURA 2. El panel sensorial estuvo constituido por 8 panelistas semientrenados, todos estudiantes de la carrera Ingeniería en Alimentos y de 23 a 28 años. Se evaluaron tres atributos: jugosidad, terneza e intensidad de sabor a carne mediante una prueba de evaluación descriptiva. El parámetro de aceptación general se evaluó mediante una escala hedónica de 7 puntos (LARMOND, 1987). La cartilla se presenta en el ANEXO 1. FIGURA 2. Cocción de bifes y medición de temperatura. Las evaluaciones se hicieron en un bife por cada rango de pH y en triplicado (3 animales por pH). Los panelistas realizaron 3 sesiones de evaluación, en cada una recibieron 3 muestras codificadas correspondientes a cada rango de pH, las evaluaciones fueron realizadas cada 30 días, tomando como tiempo 0 el día posterior a la obtención de la muestra luego el día 30 y finalmente el día 60. En la FIGURA 3 se observa la presentación de las muestras a los panelistas para el análisis sensorial. FIGURA 3. Cartilla y presentación de muestra para evaluación sensorial 3.3.2 Análisis microbiológicos. Se procedió a realizar los análisis microbiológicos microorganismos: thermosphacta. necesarios para determinar Bacterias ácido lácticas, el desarrollo enterobacterias, de tres Brochothrix Los análisis microbiológicos se realizaron cada 15 días, por un tiempo total de 60 días de almacenamiento, partiendo en el tiempo 0 correspondiente al día siguiente a la obtención de muestra, luego al tiempo 15, 30, 45 y 60 días. Cada bife en el tiempo correspondiente fue retirado de la bolsa con una pinza estéril (flameada en alcohol) y se colocó en una bolsa Stomacher, luego fue medido el largo y el ancho del bife utilizando un pie de metro (Vernier Caliper Mitutoyo Corporation), con el objetivo de obtener el área total para expresar el resultado final de los recuentos como ufc/cm2. Se agregó 90 ml de buffer fosfato (APHA, 1992) a la bolsa, obteniéndose la dilución 10-1 .La muestra se homogeneizó por 1 minuto a velocidad lenta en un homogeneizador (Stomacher Seward Medical, modelo 400, U.K.). Posteriormente se realizaron las diluciones adicionales necesarias para los recuentos de BAL, enterobacterias y B. thermosphacta. Los microorganismos y sus condiciones de siembra se presentan en el CUADRO 4. Se analizaron tres muestras de un mismo pH (triplicado). Para la siembra de las muestras de carne, se utilizó agar MRS (de Man, Rogasa y Sharpe) , para el recuento de bacterias ácido lácticas, para la cual se hicieron diluciones hasta 10-6 utilizando el método de siembra en superficie (ICMSF, 1988). Para el recuento de B. thermosphacta se utilizó agar STAA (streptomycin thallous acetate actidione) se hicieron diluciones hasta 10-6, y se usó la técnica de siembra en superficie (OXOID, 1991). Para el recuento de Enterobacterias se utilizó Bilis Rojo Neutro Crista Violeta + Glucosa y se hicieron diluciones hasta 10-5, realizándose la siembra por el método en profundidad (ICMSF, 1988). Las placas fueron incubadas en estufas de 25 y 36ºC (Napco, U.S.A.). El esquema de siembra se presenta en la FIGURA 4. CUADRO 4. Condiciones de siembra para microorganismos en estudio. Microorganismo Medio de cultivo Tiempo Temperatura Referencia Enterobacterias Bilis Rojo Neutro Crista Violeta + Glucosa (profundidad) 20-24 h 36±1º C ICMSF (1988) Brochotrix thermophacta STAA (superficie) 48 h 25±1º C OXOID (1991) Bacterias ácido lácticas MRS (superficie) 72h 25±1ºC ICMSF (1988) FIGURA 4. Análisis microbiológico 3.3.3 Variación del pH en el tiempo. Para cuantificar la evolución del pH de la carne envasada al vacío, a lo largo del tiempo de almacenamiento, se procedió a tomar un trozo de bife de cada rango de pH y se midió este valor según el método de la Norma Chilena Oficial. El método consistió en preparar una papilla de carne durante un minuto en Stomacher, con igual peso de agua destilada (N.Ch. 1370/10 Of.1978). El pH se midió con un peachímetro (EZEDO) previamente calibrado con buffer. Posteriormente se aplicó el electrodo a la solución de carne y se leyó el resultado. 3.4 Metodología estadística 3.4.1 Diseño experimental. Para los análisis sensoriales y microbiológicos se empleó un diseño multifactorial. Los análisis microbiológicos fueron de 2 factores: pH (3 niveles) y tiempo (5 mediciones) resultando el modelo 31 x 51. Para el análisis sensorial se utilizaron 2 factores: pH (3 niveles) y tiempo (3 mediciones) resultando el modelo 3 1 x 31. 3.4.2 Análisis estadístico. Para el análisis sensorial tanto para las pruebas descriptivas y de aceptación se realizó el test de Bartlett para ver la homogeneidad entre los panelistas. Se aplicó el análisis de varianza (ANDEVA), con un 95% de significancia y el test de Tukey para determinar las posibles diferencias entre las muestras de distintos rangos de pH. Se trabajó con el programa estadístico Statgraphics plus 5.1. Para los recuentos microbiológicos, se realizó el test de Bartlett para ver si existían diferencias entre los tres animales del mismo rango de pH, el análisis de varianza (ANDEVA) con el fin de comparar el desarrollo de los microorganismos en estudio. Cuando hubo diferencias significativas se realizó una prueba de comparación múltiple de Tukey al 95 % de confianza, además de métodos gráficos de representación de resultados. 4. PRESENTACIÓN y DISCUSIÓN DE RESULTADOS 4.1 Estudio del desarrollo de diferentes microorganismos en tres rangos de pH de la carne. En el estudio microbiológico fueron analizados tres microorganismos para determinar la factibilidad de envasar la carne de bovino de pH>5,8 al vacío. Los microorganismos estudiados fueron Bacterias Acido Lácticas, Brochothrix thermosphacta y enterobacterias. Los recuentos se realizaron cada 15 días partiendo del tiempo cero hasta el día 60. En primer lugar se aplicó el test de Bartlett para ver si existía homogeneidad entre los recuentos de los animales de un mismo pH. El test de Bartlett arrojó que no existía diferencia significativa (P≥0,05) entre los animales del mismo pH, por lo que se pudo aplicar el análisis de Andeva y en el caso de existir diferencias el test de Tukey. El resultado de los recuentos de enterobacterias al comenzar este estudio fue muy bajo, es por ello todos los resultados microbiológicos fueron expresados en Log ufc/25cm2 para poder cuantificarlos. 4.1.1 Bacterias ácido lácticas (BAL). El crecimiento de bacterias ácido lácticas en la carne envasada al vacío es deseable, ya que éstas poseen la capacidad de inhibir a otras bacterias, porque al desarrollarse acidifican el medio con un descenso del pH (LAMA, 2002). Es por ello la importancia del desarrollo de estas bacterias en el presente estudio, puesto que podrían permitir conservar por más tiempo la carne de corte oscuro. En el ANEXO 2 se presentan los recuentos obtenidos para las bacterias ácido lácticas en cada rango de pH y su desviación estándar. En la FIGURA 5 se observa el desarrollo de las bacterias ácido lácticas durante el almacenamiento de la carne en los 3 rangos de pH. Estas presentaron un mayor desarrollo durante el tiempo de almacenamiento a pH ≥6,2 (alto), es necesario mencionar que hubo desarrollo de levaduras, lo cual pudo tener consecuencia sobre los valores de recuento, en particular en éste rango de pH, en comparación a los pH <5,7(normal) y 5,8 – 6,1 (intermedio). Se aprecia que en el tiempo cero los tres rangos de pH arrojaron un promedio cercano a Log 2,6 ufc/25cm2 (Log 1,0 ufc/cm2), finalizando al día 60 con un recuento de Log 5,9 ufc/25cm2 (Log 1,4 ufc/cm2), para el pH normal, el pH intermedio tuvo un aumento leve en comparación al pH normal, en cambio, el pH alto tuvo un aumento creciente hasta llegar a Log 8,0 ufc/25cm2 (Log 1,5 ufc/cm2) al día 60 de almacenamiento. El análisis estadístico arrojó diferencias significativas (p≤0,05) en el tiempo y pH (ANEXO 3) esto se puede ver con mayor detalle en la prueba de contraste según tiempo y según pH en el cual se observa que existe homogeneidad entre el rango de pH normal e intermedio. Los primeros 15 días hubo un aumento significativo en los tres rangos de pH, del día 30 al 60 no hubieron diferencias significativas (p≥0,05) en los tres rangos de pH. Los resultados obtenidos, concuerdan con los de SCHÖBITZ et al. (1990), los cuales realizaron un estudio similar, conservando la carne de pH normal envasada al vacío a -2ºC, 4ºC y 8ºC, estos autores obtuvieron recuentos, al tiempo 0 de Log 1,2 ufc/cm2, manteniéndose el desarrollo hasta alcanzar un recuento de Log 6,0 ufc/cm2 al día 60 a -2ºC. Un estudio de SOTO (2000), con una carne a pH ≤ 5,7, almacenada a 4ºC, el tiempo cero los recuentos para bacterias ácido lácticas fueron de Log 2,7 ufc/cm2, concordando con los recuentos iniciales de la presente investigación a igual periodo de estudio. No obstante, al tiempo 30 obtuvo un recuento de Log 6,2 ufc/cm2, superior en un ciclo logarítmico a igual tiempo en este estudio. Este valor fue alcanzado al tiempo 60 en esta investigación. LOG(ufc/25cm2) <5,7 9 5,8-6,1 8 >6,2 7 6 *) 5 4 3 2 1 0 0 15 30 45 60 Tiempo (días) *) Valores corresponden al promedio de tres bifes por cada rango de pH con sus respectivas duplicadas. FIGURA 5. Desarrollo de Bacterias Ácido Lácticas en carne de bovino a tres rangos de pH, almacenada al vació a 0 ± 1 ºC. Lo anterior puede explicarse según SCHILLINGER y LÜCKE (1987), por la baja temperatura de almacenamiento de la carne envasada al vacío, como lo es el caso de esta investigación (0ºC), ya que las BAL requieren de un largo periodo de adaptación, para posteriormente aumentar su capacidad de multiplicarse. ERICHSEN y MOLIN (1981), estudiaron la flora microbiana de carne envasada al vacío almacenada a 4ºC por 21 días, a pH normal el recuento de bacterias ácido lácticas fue Log 7,0 ufc/cm2 y a pH alto (≥6,2) Log 6,6 ufc/cm2, estos valores coinciden con la cinética de crecimiento de la presente investigación, al mismo periodo de almacenamiento, pero a 0ºC. En carnes envasadas al vacío, a pH ≤5,7 y almacenadas a 1,0±1ºC por un periodo de estudio de 35 días, se encontraron valores de bacterias ácido lácticas superior a Log 7,0 ufc/cm2, estos valores son mayores a los obtenidos en esta investigación, puesto que al tiempo 35 sólo se alcanzó un recuento de Log 5,3 ufc/25cm2 (Log 1,3 ufc/cm2) , esto se pudo deber a que al tiempo cero en nuestro estudio hubo un menor recuento de BAL (FOEGEDING et al., 1983). Por su parte, VENUGOPAL et al. (1993), estudió el efecto del crecimiento microbiano en carne fresca envasada al vacío a las temperaturas de 0, 2 y 4 ºC, por 60 días de almacenamiento, y obtuvo una concentración de Log 7,8 ufc/ cm2 a los 60 días. De la misma manera, SCHILLINGER y LÜCKE (1987), en carne envasada al vacío a pH ≤5,8 y almacenada a 2ºC, obtuvieron al tiempo 0, un recuento igual al de esta investigación, de Log 2,6 ufc/cm2, pero a diferencia de este trabajo, al tiempo 30 estos autores presentaron recuentos de Log 7,0 ufc/cm2, superiores a los de este estudio que fueron de Log 5,0 ufc/cm2. 4.1.2 Brochothrix thermosphacta. En las carnes de corte oscuro el pH es superior a 5,7, favoreciendo el desarrollo de esta bacteria. Este microorganismo no tiene dificultad para desarrollarse en atmósferas de 10 20% de CO2 y menos de 1% de O2 (HANNA et al., 1983 y SCHÖBITZ, 1991). En el ANEXO 4 se presentan los promedios de las réplicas de un mismo animal en cada rango de pH y su desviación estándar. En la FIGURA 6 se observa el comportamiento de B. thermosphacta en el periodo de almacenamiento. Esta figura muestra que los tres rangos de pH al tiempo cero partieron con un promedio de bacterias de Log 1,4 ufc/25cm2 (Log 0,7 ufc/cm2). A pH normal e intermedio comenzaron su desarrollo a los 45 días, llegando a alcanzar un desarrollo de Log 2,8 ufc/25cm2 (Log 1,0 ufc/cm2) al tiempo 60, en comparación con el pH alto, el cual presentó un significativo aumento de la concentración de este microorganismo a los 15 días, manteniéndose estos recuentos hasta el termino del periodo, llegando a una concentración final de Log 6,4±0,50 ufc/25cm2 (Log 1,4±0,50 ufc/cm2). Esto puede traer como consecuencia el acortamiento de la vida útil de la carne de corte oscuro, ya que este microorganismo puede producir una rápida degradación de aminoácidos originando olores desagradables, también puede originar un olor "dulzón " en la carne. El análisis estadístico arrojó diferencias significativas (p≤0,05) como era de esperar entre los rangos de pH marcando la diferencia el pH alto, en comparación con el pH normal e intermedio, como se aprecia en el test de comparación múltiple de Tukey (ANEXO 5). BLIXT y BORCH (2002), en carne de pH 5,4 envasada al vacío a 4ºC, obtuvieron un desarrollo para B. thermosphacta constante hasta el tiempo 30, estos resultados concuerdan con los resultados de esta investigación, considerando que ésta se mantuvo constante, para pH ≤5,7 y el pH del rango intermedio, hasta el tiempo 45. Los resultados de este estudio también concuerdan con SCHÖBITZ et al. (1990), quienes encontraron en carne de pH normal envasada al vacío a -2ºC, un recuento inicial de Log 1,8 ufc/cm2, manteniéndose constante hasta los 45 días, presentándose igual cinética de crecimiento entre ambas investigaciones, con valor al tiempo 60 de Log 3,0 ufc/cm2. SORIANO (1992), obtuvo recuentos iniciales de Log 1,3 ufc/cm2 para el tiempo cero, terminando al tiempo 60 con Log 3,9 ufc/cm2. <5,7 9 5,8-6,1 8 >6,2 LOG(ufc/25cm2) 7 6 5 4 3 *) 2 1 0 0 15 30 45 Tiempo(días) 60 *) Valores corresponden al promedio de tres bifes por cada rango de pH con sus respectivas duplicas. FIGURA 6. Desarrollo de Brochotrix thermosphacta en carne de bovino a tres rangos de pH, almacenada al vació a 0 ± 1ºC. SCHILLINGER y LÜCKE (1987), reportaron en carne a pH 5,8 un recuento de Log 2,0 ufc/cm2 al tiempo cero, sin embargo, ya al tiempo 30 estos autores obtuvieron recuentos de Log 4,0 ufc/cm2 almacenando la carne a 2ºC, siendo este valor superior al encontrado en este estudio, puesto que al tiempo 30 los recuentos alcanzaron un valor de Log 2,1 ufc/25cm2 (Log 0,9 ufc/cm2); partiendo al tiempo 0 con un recuento de Log 1,55 ufc/25cm2 ( Log 0,8 ufc/cm2) para pH intermedio, estas diferencias se atribuyen a la temperatura de almacenamiento ya que en este estudio se trabajó con una temperatura de almacenamiento de 0ºC. ERICHSEN y MOLIN (1981) en carne envasada al vacío a pH alto (≥6,2), almacenada a 4ºC por 21 días, encontraron una concentración de esta bacteria de Log 5,5 ufc/cm2. Esto coincide con valores entregados en este estudio, puesto que en el día 15 se alcanzó un recuento similar en la carne de pH ≥ 6,2 para terminar al día 60, con un recuento de Log 6,4 ufc/25cm2 ( Log 1,4 ufc/cm2). 4.1.3 Enterobacterias. El recuento de enterobacterias, bacterias coliformes y Escherichia coli se utiliza como índice de contaminación de la canal, con microorganismos asociados al contenido intestinal del animal, pudiendo también provenir de la piel de éste (Grau citado por SCHÖBITZ et al., 1990). En la FIGURA 7 se observa el comportamiento de las enterobacterias con un crecimiento similar en la carne con los tres rangos de pH. En la carne de pH intermedio tuvieron un crecimiento más lento comparado con los otros dos rangos, pero al día 30 se desarrollaron rápidamente hasta alcanzar recuentos cercanos a la carne de pH alto. En el ANEXO 6 se presentan los promedios de las réplicas de un mismo animal en cada rango de pH y su desviación estándar. El análisis estadístico no arrojó diferencias significativas (p≥0,05) entre los rangos de pH (ANEXO 7), pero sí hubo diferencia significativa (p≤0,05) entre el tiempo encontrándose la diferencia en los tiempos 30, 45 y 60. Es importante destacar que estas bacterias comenzaron a desarrollarse a los 15 días, alcanzando elevados recuentos a los 45 días de almacenamiento para los tres rangos de pH. Ello explica por que la carne bajo estas circunstancias no podría mantenerse en condiciones óptimas para el consumo hasta los dos meses. <5,7 9 5,8-6,1 8 >6,2 LOG(ufc/25cm2) 7 6 5 *) 4 3 2 1 0 0 15 30 45 60 Tiempo(días) *) Valores corresponden al promedio de tres bifes por cada rango de pH con sus respectivas duplicas. FIGURA 7. Desarrollo de Enterobacterias en carne de bovino a tres rangos de pH, almacenada al vació a 0 ± 1ºC. BLIXT y BORCH (2002) en una carne de pH normal y envasada al vacío a 4ºC, obtuvieron recuentos de Log 7,3 ufc/g al tiempo 45, valor mayor al obtenido en esta investigación, en que a igual tiempo de estudio, el recuento fue de Log 2,0 ufc/25cm2 (Log 0,9 ufc/cm2). SCHILLINGER y LÜCKE (1987) obtuvieron valores muy bajos los primeros días de muestreo alcanzando posteriormente como máximo, recuentos de Log 4,0 ufc/cm2 en carne envasada al vacío a pH normal, en éste estudio al mismo tiempo de almacenamiento hubo un desarrollo de Log 2,0 ufc/25cm2 (Log 0,9 ufc/cm2) . Por su parte PUENTES (2004), en una investigación similar a la nuestra, donde estimó la durabilidad de la carne envasada al vacío con anomalía corte oscuro almacenada a 4ºC, este autor obtuvo una cinética de crecimiento para enterobacterias similar a éste estudio, pero con valores finales para los 28 días de Log 5,3 ufc/cm2 para pH alto e intermedio y Log 5,0 ufc/cm2 para pH bajo. Comparando ambos estudios, en la presente investigación se obtuvieron recuentos considerablemente más bajos, con un valor de Log 2,8 ufc/25cm2 (Log 1,0 ufc/cm2) en la carne a pH alto, de igual manera en la carne con pH normal se obtuvo un valor de Log 2,0 ufc/25cm2 (Log 1,0 ufc/cm2) y para pH intermedio Log 1,74 ufc/25cm2 ( Log 0,8 ufc/cm2), para el mismo periodo de almacenamiento, alcanzando recién el día 45 valores similares a PUENTES (2004), a los 28 días. En la FIGURA 8 se observa la evolución de los recuentos de los tres microorganismos en estudio, en cada rango de pH; en éste se aprecia que a lo largo del tiempo de estudio, las bacterias ácido lácticas predominaron sobre enterobacterias y B. thermosphacta en todos los rangos de pH, alcanzando mayor desarrollo a pH alto. Su crecimiento es deseable, porque impide el crecimiento de otros microorganismos, influyendo directamente sobre la durabilidad de la carne envasada al vacío. También se aprecia que el comportamiento de B. thermosphacta, fue el esperado, puesto que se desarrollo en mayor número en carne de pH alto. p H < 5 ,7 Log (ufc/25cm2) 9 8 7 6 5 4 3 2 1 0 0 15 30 T ie m p o ( d ía s ) 45 60 Log(ufc/25cm2) p H 5 ,8 - 6 ,1 9 8 7 6 5 4 3 2 1 0 0 15 30 45 T ie m p o ( d ía s ) 60 Log(ufc/25cm2) p H > 6 ,2 9 8 7 6 5 4 3 2 1 0 0 15 30 45 60 T ie m p o ( d ía s ) BA L B .th e r m o s p h a c ta En te r o b a c te r ia s Figura 8. Desarrollo de los tres microorganismos en estudio en los diferentes rangos de pH. 4.2 Variación del pH a través del tiempo El pH fue medido a lo largo del tiempo de almacenamiento, de manera de determinar su variación en la carne los tres rangos. Las mediciones se presentan en el ANEXO 8. En la FIGURA 9 se observa que el pH al tiempo 15 disminuyo levemente en todos los rangos. El análisis estadístico arrojó diferencias significativas (p≤0,05) entre los tres rangos de pH (ANEXO 9), no pH existiendo diferencia significativa a través del tiempo (p≥0,05). pH <5,7 6,6 6,5 6,4 6,3 6,2 6,1 6,0 5,9 5,8 5,7 5,6 5,5 pH 5,8-6,1 pH >6,2 *) 0 15 30 45 60 Tiempo (días) *) Valores promedios entre los tres animales y sus duplicados FIGURA 9. Variación en el pH de la carne envasada al vacío, almacenada a 0 ± 1ºC. Los resultados no coinciden cor los entregados por SOTO (2000), quien encontró diferencias mayores , porque al día 30 la carne con el pH intermedio bajo desde pH 5,8 a 5,0 en carne envasada a 4ºC. Los resultados de este estudio coinciden con la variación de pH, en carne de rango normal (pH ≤5,7) de la investigación realizada por OLIETE et al. (2006), quienes analizaron la calidad de la carne envasada al vacío a los días 7,14 y 21 de almacenamiento a 0±2ºC, y encontraron que en todo momento los valores de pH oscilaron dentro de los rangos de valores normales de la carne de vacuno (5,54 - 5,47). 4.3 Análisis sensoriales Los atributos analizados fueron: jugosidad, terneza, intensidad de sabor a carne y aceptación general, los que fueron evaluados en carne cocida. Los paneles se realizaron en el tiempo 0, a los 30 y 45 días, el cual fue el tiempo en que la carne se mantuvo en buen estado para su consumo, en condiciones de envasado al vacío y almacenada a 0ºC. Se realizaron tres paneles por día con 8 jueces cada evaluación. Para el análisis de los datos se aplicó test de Barlett, para ver si existía homogeneidad entre los panelistas, éste arrojo que no existía diferencia significativa (P≥0,05) entre ellos, se pudo aplicar el análisis de Andeva y en el caso de existir diferencias el test de Tukey. 4.3.1 Jugosidad. Las calificaciones entregadas por los jueces en este atributo se observan en la FIGURA 10. Los valores promedio y desviación estándar obtenidos para los paneles sensoriales se muestran en el ANEXO 10. En la FIGURA 10 se puede apreciar que en todos los tiempos evaluados el mayor puntaje fue obtenido en la carne pH alto (≥6,2). Esto indica que esta carne presenta mayor jugosidad en comparación con la carne de pH normal (≤5,7) y pH intermedio (5,8-6,1).Los resultados en este atributo arrojaron deferencias estadísticamente significativas (P≤0,05) entre los pH (ANEXO 11), sin embargo, no se presentaron diferencias significativas (P≥0,05) entre los tiempos. El test de comparación múltiple de Tukey, indica que la diferencia mayor fue entre el pH normal y alto, como se observa en la FIGURA 10, donde el pH alto obtuvo la mayor calificación en relación a los otros dos rangos de pH. Como se observa en la FIGURA 10 la calificación entregada por los jueces para el pH alto fluctúo entre 3 y 3,5 lo que equivale a jugosidad moderada a alta, de la misma manera el rango para pH intermedio y bajo fue menor que para pH alto, con un puntaje entre 2,0 y 2,7, que correspondió a jugosidad baja. Estos resultados coinciden con GALLO (1991), KATSARAS y PEETZ (1990), quienes señalan que la carne con pH alto, posee escasa pérdida de agua durante el calentamiento o cocción, puesto que aumenta considerablemente la fijación del agua, siendo una carne más jugosa y tierna al momento de su consumo. En cambio WULF et al. (2002), evaluaron la jugosidad en corte normal (pH<5,7) y oscuro (pH>6,1) y no encontrando diferencias significativas entre ambos cortes. No obstante los mayores puntajes entregados por los jueces fueron para el corte normal. Similares resultados fueron reportados por DRANSFIELD (1980), quien no encontró diferencias significativas entre la jugosidad de una carne pH normal y una de pH alto. <5,7 5,8-6,1 5 >6,2 3,5 Puntaje 4 2,9 2,3 3 2,7* 3,0 2,6 2,3 2,1 2 2,0 1 0 30 Tiempo(días) 45 *Valores promediados de valuación en triplicado, obtenidos por cada rango de pH. FIGURA 10. Evaluación de la jugosidad en los tres tiempos analizados en carne envasada al vacío, almacenada a 0 ± 1ºC. 4.3.2 Terneza. La terneza no se encuentra determinada solamente por la firmeza sino que también por la jugosidad, la cual desempeña un papel muy importante debiéndose prevenir la pérdida de jugosidad por cocción (SEUB y HONIKEL, 1990). En el ANEXO 10 se presenta un resumen de las calificaciones entregadas por los jueces en cada panel y desviaciones estándar. Los jueces no encontraron diferencias estadísticamente significativas (P≥0,05) entre los tres rangos de pH (ANEXO 12) y fueron calificados entre “tierna” y “moderadamente tierna” (FIGURA 11). El mayor puntaje entregado fue 3,8, coincidiendo con el rango de pH alto. <5,7 5,8-6,1 5 >6,2 3,8 3,7 3,5 4 Puntaje 3,2 3,5* 3,2 3,2 3,1 3,1 3 2 1 0 30 45 Tiempo(días) *Valores promediados de valuación en triplicado, obtenidos por cada rango de pH. FIGURA 11. Evaluación de la terneza en los tres tiempos analizados en carne envasada al vacío, almacenada a 0 ±1 ºC. OLIETE et al. (2006), reportaron para carnes envasadas al vacío con pH normal almacenada a 0±2ºC, la terneza aumentó a partir del día 21. Estos resultados coinciden con los de esta investigación, puesto que al día 30 los jueces entregaron el puntaje de 3,5 que equivale a moderadamente tierno a tierno. Los resultados de esta investigación no concuerdan con los obtenidos por Barrida citado por MORENO et al. (1999), quienes indican que al aumentar el pH sobre 5,8 se reduce la terneza de la carne. WULF et al. (2002), comparó la carne con pH alto y pH normal en carne envasada al vacío, encontrando diferencias significativas entre ambas, destacándose con un puntaje más bajo la carne con pH alto, evaluándola como menos tierna en comparación a la carne de pH normal. Por su parte DRANSFIELD (1980), señaló que la carne corte oscuro es más tierna que la carne de vacuno de pH normal. 4.3.3 Intensidad sabor a carne. En la FIGURA 12 se aprecia que no hubo diferencias entre los tres rangos de pH, esto también se observó en el análisis estadístico, el cual arrojó que no existen diferencias significativas en los tres rangos de pH ni a través de tiempo (ANEXO 13). Para el atributo de intensidad del sabor, los puntajes entregados por los jueces van desde 2,9 a 3,1 lo que equivale a intensidad moderada. Los promedios y las desviaciones estándar obtenidas para este atributo se presentan en el ANEXO 10. Es importante señalar que en el presente estudio se les solicitó a los jueces caracterizar e identificar los sabores extraños que pudiesen haber detectado en la carne. En el tiempo cero los panelistas no encontraron sabores extraños, el día 30 y 45 sólo un 20% de los panelistas detectaron sabores extraños en la carne a pH alto, siendo los más recurrentes el sabor ácido y metálico. SCHÖBITZ et al. (1990), encontraron que no existieron diferencias significativas para jugosidad e intensidad del sabor a carne, entre carnes a pH normal e intermedio, coincidiendo con los puntajes entregados por los jueces para estudio. WULF et al. (2002), tampoco encontró diferencias significativas para el atributo intensidad del sabor, entre carnes de pH alto (>6,1) y pH normal (<5,7). Sin embargo, Cabrero citado por MORENO et. al (1999), señala que el aumento del pH por encima de 5,6 dificulta la liberación de jugo, dilata la estructura fibrilar y reduce la intensidad del sabor. <5,7 5,8-6,1 5 >6,2 3,1 4 3,0 Puntaje 3,1 3,0 3,0 3 2,9 2,9 3,1* 2,9 2 1 0 30 45 Tiempo(días) *Valores promediados de valuación en triplicado, obtenidos por cada rango de pH. FIGURA 12. Evaluación de la intensidad de sabor a carne en los tres tiempos analizados en carne envasada al vacío, almacenada a 0 ± 1ºC. 4.3.4 Aceptación general. En cuanto a este atributo, se puede señalar que no hubo diferencias significativas (P≥0,05) en los puntajes entregados por los jueces (ANEXO 14), fluctuando éste, como se aprecia en la FIGURA 13, entre 4,5 y 5,2 lo que significa que los tres rangos de pH tuvieron una aceptación moderada, destacándose que los mayores puntajes fueron en la carne a pH alto. Los promedios y las desviaciones estándar obtenidas para este atributo se presentan en el ANEXO 10. <5,7 5,8-6,1 7 >6,2 4,8 4,9 4,7 4,7 4,8 5 Puntaje 5,2 5,0 6 4,5* 4,6 4 3 2 1 0 30 45 Tiempo(días) *Valores promediados de valuación en triplicado, obtenidos por cada rango de pH. FIGURA 13. Evaluación de la aceptación general en los tres tiempos analizados en carne envasada al vacío, almacenada a 0 ±1ºC WULF et al. (2002), evaluaron la aceptación general en carnes a pH normal y alto, señalando que los jueces entregaron los mayores puntajes en la carne de pH normal, siendo lo contrario a lo obtenido en esta investigación. En el presente estudio la aceptación general, depende de los atributos de jugosidad, terneza e intensidad del sabor a carne, marcando una diferencia entre los tres rangos de pH estudiados el atributo jugosidad, el cual fue mayor en la carne con pH alto, siendo posiblemente este factor el que marcó la diferencia al momento de evaluar la aceptación general, como se aprecia en la FIGURA 13. De acuerdo con estos resultados se puede apreciar que la carne corte oscuro sensorialmente no presenta alteraciones al ser envasada al vacío a 0±1ºC y evaluada durante 45 días en comparación con la carne de pH normal. Sin embargo, a los 60 días la carne con pH intermedio y alto presenta olor desagradable es por esto que la evaluación sensorial se dio por finalizada a los 45 días y no al día 60 como se había estipulado. 5. CONCLUSIONES En este estudio las bacterias responsables del deterioro de la carne envasada al vacío fueron Brochotrix thermosphacta en especial en el rango de pH alto ≥6,2 y las enterobacterias. Estas últimas alcanzaron recuentos elevados al final del estudio para los tres rangos. Las bacterias ácido lácticas (BAL) se desarrollaron en los tres rangos de pH, es importante señalar que también hubo desarrollo de levaduras, lo cual pudo tener efecto sobre los valores de recuento, en particular en el pH más alto. No se presentó una variación significativa (P≥0,05) de pH a través del tiempo de almacenamiento. En el análisis sensorial se registraron deferencias significativas (P≤0,05) en la jugosidad entre los rangos de pH siendo mayor en el rango de pH alto, lo cual se debió a la capacidad de fijación de agua de esta carne. Los demás parámetros no presentaron diferencias significativas (P≥0,05) entre los tres rangos de pH. Según los análisis realizados en éste estudio, la carne con pH intermedio (5,8-6,1) y pH alto (≥6,2) puede ser envasada al vacío, almacenada a 0±1ºC por un periodo no superior a 45 días, conservando sus características organolépticas. 6. RESUMEN El problema de la carne de corte oscuro en bovinos existe a nivel mundial, con una presentación de un 3 %. En Chile su incidencia fluctúa entre un 4 % y 10 %. Este trabajo tuvo como objetivo determinar la durabilidad de la carne de corte oscuro envasada al vacío, almacenada a 0ºC durante 60 días. Durante ese periodo se cuantificó el desarrollo de microorganismos responsables del deterioro y se evaluó las características sensoriales de la carne cocida, en tres rangos de pH: normal (≤5,7), intermedio (5,8-6,1) y alto (≥6,2). Para el análisis microbiológico se realizaron recuentos cada 15 días de bacterias ácido lácticas (BAL), Brochotrix thermosphacta y enterobacterias. El análisis sensorial se realizó en el tiempo cero a los 30 y 45 días, con ocho jueces, que evaluaron la jugosidad, terneza, intensidad de sabor y aceptación general. Los resultados mostraron el desarrollo gradual de las BAL para los tres rangos de pH, alcanzando mayor crecimiento en la carne de pH alto, con recuentos de Log 8,03 ufc/25cm2 (Log 1,5 ufc/cm2) a los 60 días y de Log 5,9 ufc/25cm2 (Log 1,4 ufc/cm2), en la carne de pH normal. Por su parte B. thermosphacta también presentó mayor desarrollo en la carne de pH alto. Los tres rangos de pH tuvieron un similar crecimiento de enterobacterias, siendo mayores para los pH alto e intermedio, con un promedio de Log 6,8 ufc/25cm2 (Log 1,4 ufc/cm2) a los 60 días. El pH de la carne se mantuvo sin grandes variaciones en los tres rangos. El análisis sensorial demostró que la carne corte oscuro presentó mayor jugosidad en comparación a la carne normal. En cuanto a los demás parámetros no se presentaron variaciones entre los tres rangos de pH, hasta los 45 días. A partir de esa fecha la carne presentó evidentes signos de deterioro. Se puede concluir de esta investigación que la carne de corte oscuro puede ser envasada al vacío, con una duración de 45 días, al ser conservada a 0±1ºC, manteniendo sus características aceptables durante ese periodo. sensoriales y microbiológicas 6. SUMMARY The dark cutting beef problem in bovines exists on a worldwide level, with a presence of 3%. In Chile its incidence varies between 4% and 10%. The objective of the study was, to determine the durability of vacuum- packaged dark cutting beef, stored at 0ºC during 60 days. During that period the development of microorganisms responsible for deterioration was quantified and the sensory characteristics of the cooked meat in three ranks of pH evaluated, normal (≤5,7), intermediate (5,8-6,1) and high (≥6,2). For the microbiological analysis every 15 days plate count of lactic acid bacteria (LAB), B. thermosphacta and enterobacterias was done. The sensory analysis was performed at times zero, 30 and 45 days with eight judges, who evaluated the juiciness, tenderness, intensity of flavor and general acceptance. The results showed the gradual development of the LAB for the three ranks of pH, reaching greater growth in the high pH meat, with counts of Log 8.03 cfu/25cm2 (Log 1,5 ufc/cm2) after 60 days and of Log 5,9 ufc/25cm2 (Log 1,4 ufc/cm2), in the normal pH meat. Brochotrix thermosphacta also showed greater development in the high pH meat. The three ranks of pH had a similar growth of enterobacterias, being greater for high and intermediate pH, with an average of 6,8 Log cfu/25cm2 (Log 1,4 ufc/cm2) after 60 days. The pH of the meat stayed without great variations in the three ranks during 60 days. The sensory analysis showed that the dark cutting beef presented greater juiciness in comparison to the normal meat. As far as the other parameters, variations between the three ranks of pH did not appear until 45 days, when the meat presented evident signs of deterioration. It is concluded that the dark cutting beef can be vacuum-packed, with a duration of 45 days, when stored at 0±1ºC, maintaining acceptable sensory and microbiological characteristics during this period. 7. BIBLIOGRAFÍA AMERICAN PUBLIC HEALTH ASSOCIATION (APHA). 1992. Standard methods for the examination of dairy products. 16ª Ed. Washington, USA. 546 p. BADUI, S. 1997. Química de los alimentos. Editorial Acribia. Zaragoza, España. 648 p. BEM, Z. y HECHELMANN, H. 1996. Refrigeración y almacenamiento de la carne refrigerada, procesos microbiológicos. Fleischwirtschaft (Español) 76(1): 33 - 40. BIFANI, V. 1988. Métodos de cocción y calidad de carne y productos cárneos. Informativo sobre carne y productos cárneos. Universidad Austral de Chile. Facultad de Ciencias Veterinarias, Valdivia, Chile. pp 44 - 60. BLIXT, Y. y BORCH, E. 2002. Comparison of shelf life of vaccum-packed pork and beef. Meat Science 60: 371 - 378. BRODY, A. 1996. Envasado de alimentos en atmósferas controladas, modificadas y al vacío. Editorial Acribia. Zaragoza, España. 213 pp. BROWN, M. y BAIRD-PARKER, A. 1982. The microbiological examination of meat. Meat microbiology. Applied Science Publishers Ltd, England. 529pp. BUXADÉ, C. 1998. Vacuno de carne: aspectos claves. 2ª edición. Ediciones Mundi - Prensa. Madrid, España. 655 pp. CAÑEQUE,V. y SAÑUDO,C. 2000. Metodología para el estudio de la calidad de la canal y de la carne en rumiantes. Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (INIA). Madrid, España. 255pp. CARDENAS, F. y GIANNUZZI, L. 2005. Influencia del envasado en flora cárnica. La Industria Cárnica Latinoamericana 137: 40 - 45. CHILE, INSTITUTO NACIONAL DE ESTADISTICA (INE). 2005. Disponible en http://www.ine.cl/16-agrope/l-menuagro. Consultado el 20/09/2005. CHILE, OFICINA DE ESTUDIOS Y POLÍTICAS AGRARIAS (ODEPA). 2005. Disponible en http://www.odepa.gob.cl/estadisticas/importaciones/carne bovino. Consultado el 20/09/2005. CHILE, INSTITUTO NACIONAL DE NORMALIZACIÓN (NCh). 1978. NCh 1370/10 Of 78. Carne y productos cárneos. Determinación del pH. DRANSFIELD, E. 1980. Eating quality of DFD beef. En: HOOD, D. y TARRANT, P. 1980. The problem of Dark-Cutting in Beef. Martinus Nijhoff Publishers. The Hague, Netherlands. pp 344 - 361. DOYLE, M., BEUCHAT, L. y MONTVILLE, T. 1997. Food Microbiology Fundamentals and Frontiers. ASM Press. Washington D.C. 768 pp. ERICHSEN, I. y MOLIN, G. 1981. Microbial flora of normal and high pH beef stored al 4ºC in different gas environments. Journal of Food Protection 44 (11): 866 - 869. FLORES, A. y ROSMINI, M. 1993. Efectos del estrés por el tiempo de espera antes del sacrificio sobre la glucemia y el pH de la carne en bovinos. Flischwirtschaft (Español) 2: 16 - 20. FOEGEDING,E., NAUMANN, H. y STRINGER, W. 1983. Effect of aerobic storage before vacuum packaging on the pH,color and bacterial flora of beef. Journal of Food Protection 46 (4): 287 - 291. FOOD AND AGRICULTURA ORGANIZATION OF THE UNITED NATIONS (FAO). 2005. Disponible en http://www.fao.org/documents/show _cdr.asp?url_file = /docrep/005/y7744s/y7744s1.1.htm. Consultado el 19/10/05. FOOD AND AGRICULTURA ORGANIZATION OF THE UNITED NATIONS (FAO). 2001. Disponible en http://www.fao.org/documents/show_cdr.asp? url_file=/DOCREP/005/x6909S/x6909s04.htm. Consultado el 20/08/05. FORREST, J., ABERLE, E., HEDRICK, H., JUDGE, M. y MERKEL, R. 1979. Fundamentos de ciencia de la carne. Editorial Acribia. Zaragoza, España. 364p. FRITZ, P. y ANTILA, P. 1993. Valor nutritivo de la carne. Editorial Acribia Zaragoza, España. 184 pp. GALLO, C. 2003. Carnes de corte oscuro en bovinos. Vetermas 2(2): 16 - 21. GALLO, C. 1997. Efectos del manejo pre y post faenamiento en la carne. III Jornadas de Buiatría. Osorno. Chile. pp 68 - 74. GALLO, C. 1991. Carnes oscuras, firmes y secas (DFD) y pálidas, blandas y exudativas (PSE). Sus efectos en las carnes envasadas. Informativo sobre carne y Productos Cárneos. 20: 41 - 49. GARCÍA, T., MARTÍN R., SANZ, B., y HERNÁNDEZ, P. 1995. Extensión de la vida útil de la carne fresca. I: envasado en atmósfera modificada y utilización de bacterias lácticas y bacteriocinas. Revista Española de Ciencia y Tecnología de Alimentos 1: 1 - 15. GILL, C. O. y LANDERS, C. 2003. Effects of spray cooling processes on the microbiological conditions of decontaminated beef carcasses. Journal of Food Protection 66 (7): 1247 - 1252. GILL, C. O. 1982. Microbiology of fresh meta. En: BROWN. 1982. Meat microbiology. Applied Science Publisher Ltda. England. pp 127 - 186. GRANDIN, T. 2000. El ganado arisco y la carne oscura: Cómo minimizar su impacto. Beef 1: 16 - 18. HANNA, M., SAVELL, J., SMITH, G., PURSER, D., GARDNER, F. y VANDERZANT, C. 1983. Journal of Food Protection 46 (3): 216 - 221. HARGREAVES, A., BARRALES, L., PEÑA, I., LARRAÍN, R., y L. ZAMORANO. 2004. Factores que Influyen en el pH Ultimo e Incidencia de Corte Oscuro en Canales de bovinos. Ciencia e Investigación Agraria 3: 155 166. HAYES, P. 1993. Microbiología e higiene de los alimentos, 1ª edición .Editorial Acribia. Zaragoza, España. 369 p. HERVÉ, M. 1995. Razas Bovinas y calidad de carnes. Sociedad Chilena de Producción Animal. SOCHIPA .Chile. En: Factores que inciden en la calidad de la carne Bovina. pp 20 - 26. HOFMANN, K. 1988. El pH, una característica de calidad de la carne. Fleischwirtschaft (Español) 1: 13 - 18. HOOD, D. Y TARRANT, P. 1980. The problem of dark cutting beef. Martinus Nijhoff Plublischers. The Hague, Netherlands. 190 p. INTERNACIONAL COMISIÓN ON MICROBIOLOGY SPECIFICATION FOR FOOD (ICMSF). 1988. Microorganisms in Food 1, their significance and methods of enumeration. 2ª Edición. University of Toronto. 436 p. JAY, M. 2000. Microbiología moderna de los alimentos, 4ª edición. Editorial Acribia. Zaragoza, España. 616 p. KATSARAS, K. y PEETZ, P. 1990. Cambios morfológicos en el “dark cutting beef” originados por el tratamiento térmico. Flischwirtschaft (Español) 2: 58 - 60. LAMA, P. 2002. Caracterización de una bacteriocina producida por una bacteria ácido láctica de carne envasada al vacío. Tesis, Ingeniería en Alimentos. Universidad Austral de Chile, Facultad de Ciencias Agrarias. Valdivia, Chile. 85 p. LARMOND, E. 1987. Laboratory methods for sensory evaluation of food. Canadá. 221 p. LIEN, R. 2002. El sabor de la carne. CarneTec. 5: 30 - 37. MANTECA, X. 2004. El bienestar animal en el marco de la nueva PAC. Disponible en: www.edicionestecnicasreunidas.com/ produccion/cammay 5.htm . Consultado el 21/10/05. McGUIRE, B. 2001. Evaluación sensorial de la carne. Carne Tec 6: 42-44. MORENO, A., RUEDA, V. y CEULAR, A. 1999. Análisis cuantitativo del pH de canales de vacuno en matadero. Archivos de zootecnia 48: 33 - 42. OLIETE, B., MORENO, T., CARBALLO, J., MONSERRAT, L. y SÁNCHEZ, L. 2006. Estudio de la calidad de la carne de ternera de raza rubia gallega a lo largo de la maduración al vacío. Archivos zootecnia. 55(209): 3 - 14. OXOID. 1991. Selective microbiology, for food and Dairy Laboratorios. England. 70 p. PALEARI, M., BERETTA, G., GIGNI, E., PARINI, M., RASI, M., CRIVELLI, G. y BERTOLO, G. 1995. Electroestimulación con muy bajo voltaje y carne vacuna con características DFD. Flischwirtschaft (Español) 2: 8 - 9. PREUB, B. 1991. Fundamentos de la Inspección de carnes. Editorial Acribia. Zaragoza, España. 219 p. PUENTES, J. 2004. Caracterización microbiológica, sensorial y estimación de la durabilidad de carne de bovino con anomalía de corte oscuro, envasada al vacío. Tesis, Ingeniería en Alimentos. Universidad Austral de Chile, Facultad de Ciencias Agrarias. Valdivia, Chile. 90 p. ROSSET, R. 1982. Chilling, Freezing and Thawing. En: BROWN. Meat microbiology. Applied Science Publisher Ltda. England. pp 276 - 277. SCHACKELFORD, S., WHEELER, T. y KOOHNARAIE, M. 1997. Tenderness classification of beef: I. Evaluation of beef longissimus shear force at 1 o 2 days post mortem as a predictor of aged beef tenderness. Journal of Animal Science 18: 405 - 409. SCHILLINGER, U. y LÜCKE, F. 1991. El empleo de bacterias ácido lácticas como cultivos protectores en productos cárnicos. Fleischwirtschaft (Español) 1: 35 - 40. SCHILLINGER, U. y LÜCKE, F. 1987. Bacterias lácticas en carne envasada al vacío y su influencia sobre la conservabilidad. Fleischwirtschaft (Español) 2: 46 - 52. SCHMIDT- HEBBEL, H. 1984. Carne y productos carnicos, su tecnología y análisis. Editorial Universitaria. Santiago, Chile. 114 p. SCHÖBITZ, R. 1991. Aspectos que influyen sobre la calidad y el tiempo de vida útil de la carne empacada al vacío. Informativo sobre carne y Productos Cárneos. 20: 34 - 40. SCHÖBITZ, R., DE LA VEGA, J. y TAMAYO, R. 1990. Calidad microbiológica y sensorial de la carne de vacuno envasada al vacío almacenada a diferentes temperaturas. Fleischwirtschaft (Español) 2: 31 - 36. SENSER, F. y SCHERZ, H. 1999. Tabla de composición de Alimentos. Editorial Acribia. Zaragoza, España. 215 p. SEUB, I. 1991. Valor nutricional de la carne y de los productos cárnicos. Fleischwirtschaft (Español) 1: 47 - 50. SEUB, I. y HONIKEL, K. 1990. Terneza de la carne y factores que influyen sobre la misma durante la preparación. Fleischwirtschaft (Español) 2: 2226. SORIANO, K. 1992. Contribución al estudio de diferentes membranas en la conservación de la carne envasada al vacío.Tesis, Medicina Veterinaria. Universidad Austral de Chile, Facultad de Ciencias Veterinarias. Valdivia, Chile. 69 p. SOTO, V. 2000. Estudio sobre el comportamiento de una cepa láctica commercial de Lactobacillus alimentarius, en carne envasada al vacío. Tesis, Ingeniería en Alimentos. Universidad Austral de Chile, Facultad de Ciencias Agrarias. Valdivia, Chile. 95 p. UNITED STATES DEPARTMENT OF AGRICULTURE (USDA). 2005. Disponible en http://www.elsitioagricola.com/Vinculos/resultadoVinculos.asp?v_ busqueda=carne&v_pais=zz. Consultado el 19/10/05. VENUGOPAL, R., INGHAM, C., McCURDY, A. y JONES, G. 1993. Anaerobic microbiology of fresh beef packaged Under modified atmosphere or vacuum. Journal of Food Science 58 (5): 935 - 938. WIRTH, F. 1987. Tecnología para la transformación de carne de calidad anormal. Fleischwirtschaft (Español). 1: 22 - 28. WONG, D. 1995. Química de los Alimentos. Editorial Acribia. Zaragoza, España. 475 p. WULF, D., EMNETT, R., LEHESKA, J. y MOELLER, S. 2002. Relationships among glycolytic potential, dark cutting (dark,firm,and dry) beef, and cooked beef palatability. Journal of Animal Science 80: 1895 - 1903. ANEXOS ANEXO 1 Ficha para evaluación descriptiva Nombre................................................. Fecha....................... Muestras 1 Jugosidad 2 Terneza 3 Intensidad de sabor a carne 4 Sabores extraños 5 4 3 2 1 5 4 3 2 1 5 4 3 2 1 muy alta alta moderada baja muy baja muy tierna tierna moderadamente tierna algo dura dura muy intenso intenso moderadamente intenso poco intenso muy poco intenso 5 4 3 2 1 muy intenso intenso moderadamente intenso poco intenso muy poco intenso Observación…………………………………………………………………………….. ……………………………………………………………………………………………. Ficha escala hedónica Muestras 5 Aceptación 7 me gusta extremadamente 6 me gusta mucho 5 me gusta ligeramente 4 no me gusta ni me disgusta 3 me disgusta ligeramente 2 me disgusta mucho 1 me disgusta extremadamente Observación…………………………………………………………………………….. ……………………………………………………………………………………………. Descripción ficha de evaluación descriptiva Usted recibirá 3 muestras de carne, evalúe cada muestra conforme a las instrucciones proporcionadas. Responda cada pregunta en la secuencia dada, marcando en el casillero correspondiente al juicio que mejor expresa su descripción de la característica de la muestra. Se entiende por: Jugosidad = La cantidad de agua liberada por el producto durante el primer mordisco. Terneza = Fuerza requerida para deformar un trozo de alimento entre los molares, mordiscos cada 1 segundo. Si usted no siente sabor a carne normal y siente un sabor extraño identifique el sabor y marque la intensidad en la escala de 5 puntos. Sabor extraño = ejemplos: Agrio = Sabor asociado con la formación de distintas sustancias ácidas por parte del producto, este no es el sabor ácido típico. Ácido = Sabor penetrante asociado a distintos productos, como de las bacterias ácido lácticas. Descompuesto =Sabor característico a productos en vías de descomposición Metálico = Sabor asociado a la presencia de hierro en la muestra. Envase = Sabor avinagrado y agrio se combina con características químicas de la bolsa no definidas. ANEXO 2 Recuento y D.E. para Bacterias ácido lácticas en carne envasada al vacío en tres rangos de pH. Bacterias ácido lácticas Rango pH Tiempo 0 Promedio LOG(ufc/25cm2 ) 2,38* ≤5,7 DE 0,31 5,8-6,1 0 2,62 0,23 ≥6,2 0 2,75 0,45 ≤5,7 15 3,35 0,32 5,8-6,1 15 4,02 0,43 ≥6,2 15 4,96 0,10 ≤5,7 30 4,81 1,15 5,8-6,1 30 5,03 1,32 ≥6,2 30 6,57 0,14 ≤5,7 45 4,84 0,55 5,8-6,1 45 4,80 0,75 ≥6,2 45 6,94 0,76 ≤5,7 60 5,85 1,05 5,8-6,1 60 5,92 2,13 ≥6,2 60 8,03 0,19 *Promedio y desviación estándar obtenidas de 3 animales distintos en el mismo rango de pH. ANEXO 3 Análisis de varianza para bacterias ácido lácticas. -------------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados GL Cuadrado medio F P-Valor -------------------------------------------------------------------------------------------------------------------Efectos principales A:pH 6,02377 2 3,01189 13,92 0,0025 B:tiempo 31,8558 4 7,96396 36,82 0,0000 8 0,216312 RESIDUO 1,73049 -------------------------------------------------------------------------------------------------------------------TOTAL (corr.) 39,6101 14 -------------------------------------------------------------------------------------------------------------------- Contraste Múltiple de Rangos para bacterias ácido lácticas según pH -------------------------------------------------------------------------------------------------------------------Método: 95% HSD de Tukey pH Recuento Media Sigma Grupos homogéneos -------------------------------------------------------------------------------------------------------------------normal 5 4,512 0,207996 X intermedio 5 4,636 0,207996 X alto 5 5,914 0,207996 X -------------------------------------------------------------------------------------------------------------------Contraste Diferencia +/- Limites -------------------------------------------------------------------------------------------------------------------alto - normal *1,402 0,839077 alto - intermedio *1,278 0,839077 -0,124 0,839077 normal - intermedio ---------------------------------------------------------------------------------------------------------* indica una diferencia significativa. Contraste Múltiple de Rangos para bacterias ácido lácticas según tiempo -------------------------------------------------------------------------------------------------------------------Método: 95% HSD de Tukey Tiempo Recuento Media Sigma Grupos homogéneos -------------------------------------------------------------------------------------------------------------------0 3 2,65 0,268522 X 15 3 4,17 0,268522 30 3 5,68 0,268522 X 45 3 5,77 0,268522 X 60 3 6,83 0,268522 X X ----------------------------------------------------------------------------------------------------------Contraste Diferencia +/- Limites ----------------------------------------------------------------------------------------------------------0 - 15 *-1,52 1,30959 0 - 30 *-3,12333 1,30959 0 - 45 *-3,03 1,30959 0 - 60 *-4,18 1,30959 15 - 30 *-1,60333 1,30959 15 - 45 *-1,51 1,30959 15 - 60 *-2,66 1,30959 30 - 45 0,0933333 1,30959 30 - 60 -1,05667 1,30959 45 - 60 -1,15 1,30959 ---------------------------------------------------------------------------------------------------------* indica una diferencia significativa. ANEXO 4 Recuento y D.E. para Brochothrix thermosphacta en carne envasada al vacío en tres rangos de pH. Brochothrix thermosphacta Rango pH Tiempo 0 Promedio LOG(ufc/25cm2 ) 1,34* ≤5,7 DE 0,07 5,8-6,1 0 1,43 0,13 ≥6,2 0 1,44 0,08 ≤5,7 15 1,37 0,10 5,8-6,1 15 1,55 0,11 ≥6,2 15 4,89 0,29 ≤5,7 30 1,41 0,06 5,8-6,1 30 2,11 0,79 ≥6,2 30 5,58 0,78 ≤5,7 45 1,47 0,14 5,8-6,1 45 1,78 0,56 ≥6,2 45 5,66 0,38 ≤5,7 60 2,77 0,40 5,8-6,1 60 2,64 0,26 ≥6,2 60 6,44 0,50 *Promedio y desviación estándar obtenidas de 3 animales distintos en el mismo rango de pH. ANEXO 5 Análisis de varianza para Brochothrix thermosphacta. -------------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados GL Cuadrado medio F P-Valor -------------------------------------------------------------------------------------------------------------------Efectos principales A:pH 30,8505 2 15,4252 15,5 0,0018 B:tiempo 10,7108 4 2,67769 2,6 0,1086 8 0,993838 RESIDUO 7,95071 -------------------------------------------------------------------------------------------------------------------TOTAL (corr.) 49,512 14 -------------------------------------------------------------------------------------------------------------------- Contraste Múltiple de Rangos para Brochothrix thermosphacta según pH -------------------------------------------------------------------------------------------------------------------Método: 95% HSD de Tukey pH Recuento Media Sigma Grupos homogéneos -------------------------------------------------------------------------------------------------------------------normal 5 1,736 0,445834 X intermedio 5 1,978 0,445834 X alto 5 4,892 0,445834 X ----------------------------------------------------------------------------------------------------------Contraste Diferencia +/- Limites ---------------------------------------------------------------------------------------------------------alto - normal *3,156 1,79854 alto - intermedio *2,914 1,79854 normal - intermedio -0,242 1,79854 ---------------------------------------------------------------------------------------------------------* indica una diferencia significativa. ANEXO 6 Recuento y D.E. para Enterobacterias en carne envasada al vacío en tres rangos de pH. Enterobacterias Rango pH Tiempo ≤5,7 DE 0 Promedio LOG(ufc/25cm2 ) 0,58* 0,47 5,8-6,1 0 0,51 0,11 ≥6,2 0 0,44 0,08 ≤5,7 15 0,51 0,19 5,8-6,1 15 0,57 0,15 ≥6,2 15 0,76 0,35 ≤5,7 30 2,01 1,43 5,8-6,1 30 1,74 0,92 ≥6,2 30 2,78 0,86 ≤5,7 45 2,04 1,98 5,8-6,1 45 3,94 0,82 ≥6,2 45 5,05 0,60 ≤5,7 60 5,14 0,74 5,8-6,1 60 6,41 0,35 ≥6,2 60 7,15 0,15 *Promedio y desviación estándar obtenidas de 3 animales distintos en el mismo rango de pH. ANEXO 7 Análisis de varianza para Enterobacterias. -------------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados GL Cuadrado medio F P-Valor -------------------------------------------------------------------------------------------------------------------Efectos principales A:pH 1,88148 2 0,94074 3,24 0,0932 B:tiempo 73,9933 4 18,4983 63,69 0,0000 RESIDUO 2,32359 8 0,290448 -------------------------------------------------------------------------------------------------------------------TOTAL (corr.) 78,1984 14 -------------------------------------------------------------------------------------------------------------------- Contraste Múltiple de Rangos para Enterobacterias según tiempo -------------------------------------------------------------------------------------------------------------------Método: 95% HSD de Tukey Tiempo Recuento Media Sigma Grupos homogéneos -------------------------------------------------------------------------------------------------------------------0 3 0,556667 0,311153 X 15 3 0,63 0,311153 X 30 3 2,57667 0,311153 45 3 4,18333 0,311153 60 3 6,40333 0,311153 X X X -------------------------------------------------------------------------------------------------------------------Contraste Diferencia +/- Limites -------------------------------------------------------------------------------------------------------------------0 - 15 -0,0733333 1,51751 0 - 30 *-2,02 1,51751 0 - 45 *-3,62667 1,51751 0 - 60 *-5,84667 1,51751 15 - 30 *-1,94667 1,51751 15 - 45 *-3,55333 1,51751 15 - 60 *-5,77333 1,51751 30 - 45 *-1,60667 1,51751 30 - 60 *-3,82667 1,51751 45 - 60 *-2,22 1,51751 ---------------------------------------------------------------------------------------------------------* indica una diferencia significativa. ANEXO 8 Variación de pH a través del tiempo. Tiempo (días) pH Animal 0 15 30 45 60 < 5,7 (normal) 1 5,56* 5,54 5,54 5,53 5,52 2 5,56 5,57 5,60 5,58 5,57 3 5,59 5,53 5,56 5,58 5,56 4 5,81 5,78 5,77 5,76 5,76 5 5,84 5,78 5,72 5,68 5,66 6 5,87 5,76 5,75 5,74 5,75 7 6,40 6,38 6,38 6,39 6,36 8 6,54 6,53 6,50 6,52 6,50 9 6,63 6,58 6,50 6,54 6,52 5,8 – 6,1 (intermedio) ≥6,2 (alto) ∗ Valores obtenidos promediando las réplicas del mismo trozo de carne ANEXO 9 Análisis de varianza para pH. -------------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados GL Cuadrado medio F P-Valor -------------------------------------------------------------------------------------------------------------------Efectos principales A:pH 2,35977 2 1,17989 B:tiempo 0,00777333 4 0,00194333 RESIDUO 0,00442667 8 0,000553333 2132,33 0,0000 3,51 0,0615 -------------------------------------------------------------------------------------------------------------------TOTAL (corr.) 2,37197 14 -------------------------------------------------------------------------------------------------------------------- Contraste Múltiple de Rangos para pH -------------------------------------------------------------------------------------------------------------------Método: 95% HSD de Tukey pH Recuento Media Sigma Grupos homogéneos -------------------------------------------------------------------------------------------------------------------normal 5 5,56 0,0105198 intermedio 5 5,762 0,0105198 alto 5 6,484 0,0105198 X X X ---------------------------------------------------------------------------------------------------------Contraste Diferencia +/- Limites ---------------------------------------------------------------------------------------------------------alto - normal *0,924 0,042438 alto - intermedio *0,722 0,042438 normal - intermedio *-0,202 0,042438 -------------------------------------------------------------------------------------------------------------------* indica una diferencia significativa. ANEXO 10 Evaluación sensorial de carne envasada al vacío almacenada a 0±1ºC. Atributo Jugosidad Terneza Intensidad sabor a carne Aceptación general Tiempo (días) pH 0 30 45 Normal 2,13±0,43* 2,71±0,31 2,00±0,33 Intermedio 2,33±0,56 2,33±0,38 2,58±0,38 Alto 2,88±0,33 3,54±0,62 3,00±0,82 Normal 3,13±0,45 3,50±0,43 3,13±0,45 Intermedio 3,17±0,56 3,17±0,26 3,21±0,26 Alto 3,75±0,66 3,46±0,19 3,71±0,51 Normal 3,00±0,13 3,13±0,50 2,92±0,51 Intermedio 2,96±0,14 2,88±0,00 2,88±0,13 Alto 3,13±0,33 2,96±0,69 3,13±0,45 Normal 4,79±0,40 4,54±0,83 4,63±0,82 Intermedio 4,79±0,19 4,67±0,52 4,67±0,19 Alto 4,96±0,63 5,17±1,06 4,88±0,50 * Promedio ± DE de las evaluaciones de 8 jueces y tres repeticiones por panal. ANEXO 11 Análisis de varianza para JUGOSIDAD. -------------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados GL Cuadrado medio F P-Valor -------------------------------------------------------------------------------------------------------------------Efectos principales A:pH 1,28149 2 0,640744 8,90 0,0337 B:tiempo 0,285089 2 0,142544 1,98 0,2525 RESIDUO 0,287978 4 0,0719944 -------------------------------------------------------------------------------------------------------------------TOTAL (corr.) 1,85456 8 -------------------------------------------------------------------------------------------------------------------- Contraste Múltiple de Rangos para Jugosidad según pH -------------------------------------------------------------------------------------------------------------------Método: 95% HSD de Tukey pH Recuento Media Sigma Grupos homogéneos -------------------------------------------------------------------------------------------------------------------normal 3 2,28 0,154913 X intermedio 3 2,41667 0,154913 XX alto 3 3,14 0,154913 X -------------------------------------------------------------------------------------------------------------------Contraste Diferencia +/- Limites -------------------------------------------------------------------------------------------------------------------alto - normal *0,86 0,780665 alto - intermedio 0,723333 0,780665 bajo - intermedio -0,136667 0,780665 -------------------------------------------------------------------------------------------------------------------* indica una diferencia significativa. ANEXO 12 Análisis de varianza para TERNEZA. -------------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados GL Cuadrado medio F P-Valor -------------------------------------------------------------------------------------------------------------------Efectos principales A:pH 0,362956 2 0,181478 5,17 0,0777 B:tiempo 0,00142222 2 0,000711111 0,02 0,9800 RESIDUO 0,140311 4 0,0350778 -------------------------------------------------------------------------------------------------------------------TOTAL (corr.) 0,504689 8 -------------------------------------------------------------------------------------------------------------------- ANEXO 13 Análisis de varianza para INTENSIDAD SABOR A CARNE. -------------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados GL Cuadrado medio F P-Valor -------------------------------------------------------------------------------------------------------------------Efectos principales A:pH 0,0430889 2 0,0215444 2,08 0,2400 B:tiempo 0,00462222 2 0,00231111 0,22 0,8091 RESIDUO 0,0413778 4 0,0103444 -------------------------------------------------------------------------------------------------------------------TOTAL (corr.) 0,0890889 8 -------------------------------------------------------------------------------------------------------------------- ANEXO 14 Análisis de varianza para ACEPTACIÓN GENERAL. -------------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados GL Cuadrado medio F P-Valor -------------------------------------------------------------------------------------------------------------------Efectos principales A:pH 0,211756 2 0,105878 6,53 0,0550 B:tiempo 0,0216889 2 0,0108444 0,67 0,5615 RESIDUO 0,0648444 4 0,0162111 -------------------------------------------------------------------------------------------------------------------TOTAL (corr.) 0,298289 8 --------------------------------------------------------------------------------------------------------------------