Solubilidad del ácido benzoico.
Anuncio

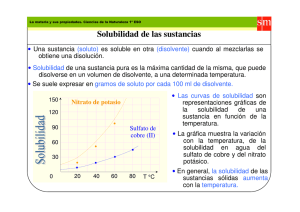
Fisicoquímica CIBEX Guía de Trabajos Prácticos 2010 Trabajo Práctico N° 6 - Solubilidad del Ácido Benzoico y Determinación de su Entalpía de Disolución Objetivo: Estudiar la solubilidad del ácido benzoico como una función de la temperatura y calcular la entalpía molar de disolución. Fundamentos Consideremos el equilibrio de disolución del ácido benzoico (B) en solución acuosa. La solución debe estar saturada en este componente. Asociada a este proceso hay cambios de entalpía, que pueden medirse analizando la dependencia de la solubilidad con la temperatura a presión constante. El proceso puede representarse como se indica en (1). ⇀ B( aq, sat ) B( s ) ↽ (1) Tal como se explicó en el TPNº 4 Curvas de Enfriamiento, la condición de equilibrio requiere la igualdad de las energías libre molares parciales de cada componente en cada fase. En un sistema de varios componentes como el que se estudia en este trabajo experimental, la energía libre molar parcial o potencial químico, µ, expresa la contribución por mol de ese componente a la energía libre total de cada fase. El potencial químico es una propiedad intensiva en esas condiciones y no depende de los tamaños relativos de las fases en equilibrio. Este aspecto se tratará con mayor detalle en las clases teóricas. El proceso de disolución puede conducir a una solución a) Ideal, en cuyo caso la solubilidad de ese componente A en otro componente líquido C no depende de la naturaleza de este último. La solubilidad se dice ideal y la expresión que describe que el comportamiento de la solubilidad con la temperatura depende de la entalpía de fusión de A a la presión de trabajo. La solución ideal que se forma está saturada en A. La dependencia de la solubilidad con la temperatura cumple con la ecuación: ∆ fusión H m ∂ ln x A = RT 2 ∂T p ,nC (2) La solubilidad en esta ecuación se expresa en fracción molar, aunque se puede escribir en una escala de molalidad –m, moles de A por kg de C, hallando la relación entre xA y m para la sustancia A. En este análisis, siempre se separa el componente que está en exceso, A en este caso, permaneciendo los moles de C en la solución, tal como se indica en la expresión previa. b) Real, en cuyo caso la solubilidad de A en C no depende solamente de la entalpía de fusión de A, sino que también intervienen las interacciones específicas que pueden existir en ambos componentes. La sustancia A puede mantener la misma estructura molecular que tiene en el sólido o puede disociarse como es el caso de sales que dan lugar a equilibrio de Kps. Esto tipo de equilibrio se analizará más adelante al ver los laboratorio de pilas. Si se identifica con s a la solubilidad en unidades de molalidad, la dependencia de esta propiedad con la temperatura mantiene la misma estructura matemática que la vista para el caso de la solubilidad ideal, pero ahora la entalpía se designará cómo ∆disHm. Así, la dependencia de la solubilidad con la temperatura se expresa de la siguiente forma, ∂ ln ( s ) ∆ H = dis 2 m RT ∂T p ,nH2O (3) Si bien esta ecuación tiene la forma de aquella que describe la solubilidad ideal (ver TP Curvas de Enfriamiento), no debe confundirse con ella. La ecuación (3) es general y por lo tanto, también puede ser aplicada a soluciones no ideales, como es el caso del sistema estudiado en este trabajo práctico. Una expresión alternativa de la ecuación (3) es 1 Fisicoquímica CIBEX Guía de Trabajos Prácticos 2010 ∆ H ∂s = s dis 2 m RT ∂T p , nH 2O (4) Observemos que esta relación permite obtener ∆disHm a partir de la pendiente de la recta tangente a una curva de s en función de T. Integrando la ecuación (3) en forma indefinida, y considerando despreciable la variación de la entalpía de disolución con la temperatura se obtiene ln( s ) = − ∆ dis H m 1 + cte R T (5) Mientras que la integral evaluada entre dos temperaturas conduce a ln( s2 / s1 ) = − ∆ dis H m R 1 1 − T2 T1 (6) Según la ecuación (6), un gráfico de ln( s ) en función de 1 / T debería ser una recta de cuya pendiente podría obtenerse ∆disHm. Procedimiento Se prepara una solución de ácido benzoico de modo tal que esta resulte saturada a temperatura cercana a la ebullición. Se calienta la solución saturada hasta que se haya disuelto todo el sólido (prácticamente hasta ebullición). De esta manera, al enfriarse se tiene seguridad de estar trabajando con una solución saturada y se favorece la formación de cristales grandes que resultan convenientes para el Trabajo Práctico como se entenderá después. La solución caliente (aproximadamente a 55-60 ºC) se coloca en un tubo de vidrio (en el que también se coloca un agitador y un termómetro) y se sumerge en un baño termostático que inicialmente se fija en 45° C. Es conveniente que la solución de ácido benzoico esté más caliente que el agua del baño termostático porque el equilibrio se alcanza más fácilmente por enfriamiento. La temperatura del baño se ajusta mediante un regulador de temperatura "ad-hoc", cuyo fundamento debe consultarse en el libro de Findlay: Prácticas de Fisicoquímica. Se deja el sistema en el baño durante unos 10 a 15 minutos con agitación para que se estabilice la temperatura y luego se procede a la toma de la muestra. Dos precauciones especiales deben ser tenidas en cuenta: 1.- que no se introduzcan cristales de ácido benzoico al pipetear. 2.- que no cristalice ácido benzoico en la pipeta. Para evitar el primer inconveniente se coloca en el extremo de la pipeta, mediante un tubo de goma, un filtro consistente en un tubo de vidrio cerrado en su extremo con una gasa varias veces plegada o algodón. En el segundo caso es conveniente que el material de vidrio esté a mayor temperatura que la muestra a extraer, por lo que se debe operar rápidamente con el material tomado de una estufa en el momento de su empleo. Se miden unos 10 ml de solución, se saca el tubo de goma de la pipeta limpiando el exterior de la misma, y la solución pipeteada se deja escurrir en un erlenmeyer tarado, que contiene 20 a 25 ml de agua. El erlenmeyer se pesa en esta cantidad de agua para evitar que el ácido benzoico cristalice en el mismo, ya que de no proceder de este modo, la dilución posterior puede demandar algún tiempo. Una vez que ha escurrido la solución de ácido benzoico se pesa el erlenmeyer nuevamente, luego se realiza una dilución conveniente y se titula el ácido con solución de NaOH 0.05N, empleando fenolftaleína como indicador. Siguiendo el procedimiento indicado, se vuelven a tomar varias muestras a distintas temperaturas, para lo cual se deja enfriar el baño termostático haciendo uso del regulador de temperatura. Es conveniente hacer 5 determinaciones entre 45 y 25ºC, para lo cual la temperatura deberá disminuirse en 5ºC aproximadamente para cada determinación. 2 Fisicoquímica CIBEX Guía de Trabajos Prácticos 2010 Actividades Previas a la Realización del Trabajo Práctico Cuestionario Previo Antes de concurrir al TP, debe resolver el siguiente cuestionario. Para ello, recurra a sus apuntes y libros del curso de Química General. (1) ¿Defina solubilidad e indique en qué unidades puede expresarse su valor? (2) Escriba la reacción de titulación que se empleará en este trabajo práctico. (3) Explique cómo se detecta el punto final de la titulación en este trabajo práctico. (4) Escriba las relaciones necesarias para calcular la solubilidad s (mol.kg-1) con los datos a manejar en la práctica: M1: masa del erlenmeyer con el agua M2: masa del erlenmeyer con la solución V1: volumen de NaOH consumidos en la titulación de normalidad N. (5) ¿Cuál cree que será la conveniencia de trabajar con molalidad frente a otras posibles unidades de concentración? Regresión Lineal Antes de concurrir al TP debe repasar este tema de sus apuntes del curso de Análisis de Datos. Recurra al manual de su calculadora para saber si puede realizar regresión lineal en ella. Realice un resumen de los paso a seguir para hacer Regresión Lineal en su calculadora. Gráficos Para la realización de las actividades en el laboratorio, deben traerse los siguientes gráficos. Recuerde escribir el título de cada eje y las unidades correspondientes. Si va a realiza los gráficos en forma manual, utilice papel milimetrado. En caso de realizar los gráficos con algún programa informático, asegúrese de imprimir también la grilla, de manera equivalente a un papel milimetrado. Gráfico 1. (s vs T) Represente los datos de solubilidad (mol.kg-1) como una función de la temperatura empleando los datos de la Tabla I. Gráfico 2. (ln s vs 1/T) Represente los datos de ln s en función de la inversa de la temperatura absoluta empleando los datos de la Tabla I. Discuta si la consideración de que la ∆disHm es constante puede aplicarse en todo el intervalo de temperaturas indicado en la tabla. Tabla I. Solubilidad de ácido benzoico en agua (resumida de Solubilities of Organic Compounds, Vol. 2, A. Seidell Van Nostrand, N. York, 1941. T /º C T/K T −1 / K −1 %p p C (gr.ácido/100gr agua) s / mol.kg −1 0 273.2 0.003660 0.170 0.170 0.01392 10 283.2 0.003531 0.209 0.210 0.01720 20 293.2 0.003410 0.289 0.290 0.02376 25 298.2 0.003354 0.343 0.345 0.02826 30 303.2 0.003298 0.408 0.410 0.03359 40 313.2 0.003193 0.551 0.555 0.04545 50 323.2 0.003094 0.768 0.775 0.06348 60 333.2 0.003002 1.142 1.155 0.09460 80 353.2 0.002831 2.643 2.715 0.2224 100 373.2 0.002680 5.549 5.875 0.4812 ln( s / mΘ ) -4.2744 -4.0628 -3.7398 -3.5663 -3.3935 -3.0911 -2.7570 -2.3581 -1.5033 -0.7315 3 Fisicoquímica CIBEX Guía de Trabajos Prácticos 2010 Informe del Trabajo Práctico Título del Trabajo Práctico: Solubilidad del Ácido Benzoico Nombre:____________________________________________________ Turno:_________________________Comisión:______________________ Fecha:_________________________ Objetivo:_______________________________________________________________ Ecuaciones y Leyes empleadas: Medidas Experimentales (1) Complete la siguiente tabla con los datos experimentales Tabla II: Datos experimentales. T /º C T/K T −1 / K −1 s / mol.kg −1 ln( s ) (2) Agregue sus puntos experimentales al Gráfico 1 realizado con los datos de la Tabla I. A) Cálculo ∆ dis H m a partir de los datos de la Tabla I. (i) Empleando la relación diferencial Determine gráficamente el valor de la relación diferencial ∂s a partir la pendiente de la recta ∂T tangente a la curva de Gráfico 1 y calcule el ∆H dis a 25 y 55ºC. Utilice para ello la ecuación (4): ∆ H ∂s = s dis 2 m ∂T RT (ii) Empleando el cociente incremental Para incrementos no demasiado grandes, la derivada anterior puede aproximarse mediante un cociente incremental. ∆ H ∆s ≅ s dis 2 m ∆T RT Utilice los puntos correspondientes a 20 y 30ºC para calcular ∆ dis H m a 25ºC. Repita el cálculo a 55ºC empleando los puntos correspondientes a 50 y 60ºC. (iii) Empleando la ecuación integrada en forma indefinida Seleccione un rango de puntos alrededor de 25ºC para los cuales la gráfica de ln( s ) en función de T −1 (Gráfico 2) sea lineal. Realice regresión lineal con los puntos correspondientes y calcule el ∆ dis H m empleando la ecuación (5): 4 Fisicoquímica CIBEX Guía de Trabajos Prácticos 2010 ln( s ) = − ∆ dis H m 1 + cte R T Repita el procedimiento anterior, pero en un entorno de 55ºC. Informe los parámetros del ajuste en cada caso. (iv) Empleando la ecuación integrada en forma definida También pueden realizarse los cálculos empleando la ecuación integrada en forma definida (6): 1 1 − T2 T1 Utilice los puntos correspondientes a 20 y 30ºC para calcular ∆ dis H m a 25ºC. Repita el cálculo a 55ºC ln( s2 / s1 ) = − ∆ dis H m R empleando los puntos correspondientes a 50 y 60ºC. B) Cálculo de ∆ dis H m a partir de los datos obtenido en el laboratorio Realice regresión lineal de los puntos experimentales de ln( s ) en función de T −1 . Informe la pendiente, ordenada al origen y coeficiente de correlación lineal del ajuste. Calcule el ∆ dis H m a partir de la pendiente. C) Cuestiones Relacionadas al Trabajo Práctico. (I) (II) (III) Defina el calor molar de disolución. Diferencie entre entalpía integral de disolución y entalpía diferencial de disolución. En el intervalo de temperaturas medido en el trabajo práctico ¿Pueden considerar que ∆ dis H m es independiente de la temperatura? ¿Por qué? (IV) Discuta si la consideración de que ∆ dis H m es constante puede aplicarse en todo el intervalo de temperaturas indicado en la Tabla I. D) Gráficos. En el informe deben incluirse los gráficos 1 (con los puntos experimentales) y 2. E) Discusión. Discuta brevemente los resultados del Trabajo Práctico. Bibliografía Especial Moore: Phisical Chemitry Barrow: Química Física Findlay: Prácticas de Fisicoquímica Glasstone: Tratado de Química Física. Glasstone: Elementos de Físicoquímica Lewis & Randall: Termodinamics 5