metabolismo energetico
Anuncio

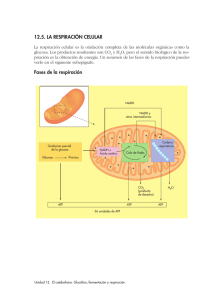
METABOLISMO ENERGETICO (Parte I) Por: MVZ Rodolfo Jose Medeles Orozco Los carbohidratos, grasas, y proteinas contenidos en los alimentos y forrajes, son las macromoléculas que suministran energía a un organismo, una vez que son metabolizadas en glucosa ó glucógeno (precursor de la glucosa) por el hígado principalmente. Aunque existe una interconexión entre el metabolismo de proteinas, carbohidratos y grasas; la glucosa, como único componente, tanto del almidón como del glucógeno, es clave en el metabolismo energético. Las vías del metabolismo para que un ser vivo obtenga energía (desde la bacteria más simple, hasta la planta ó animal más complejo) son: la catabólica, para degradar la glucosa (glucólisis) y la anabólica, para sintetizar glucosa (gluconeogénesis). Por lo tanto, la glucosa fuente de energía para la mayoría de las células, pasa a ser disponible, por la ingestión de glucosa ó de sus precursores, en éste caso por los animales. Para tratar el tema de la energía y la glucosa, es obligado tocar aunque sea a groso modo, el proceso del metabolismo intermedio de los carbohidratos, que comprende los siguientes pasos: Del glucógeno: Glucogenogénesis (síntesis del glucógeno). Glucogenólisis (degradación del glucógeno). De la glucosa: Glucólisis (degradación de la glucosa). Gluconeogénesis (síntesis de la glucosa). Vía oxidativa colateral de la glucosa. GLUCOGENOGENESIS Cuando la glucosa sanguínea se eleva por la ingestión de alimentos que contienen carbohidratos, se secreta insulina, dando inicio a la formación de glucógeno, polímero similar al almidón que se almacena en las células hepáticas y musculares como reserva de glucosa para cuando el organismo la requiera. Para éste proceso, se requiere de dos moléculas de adenosín trifosfato por cada molécula de glucosa; éstas se unen para formar la cadena larga del glucógeno. Para lograr unir ésta cadena, se utiliza un compuesto de alta energía, el uridín trifosfato; ilustrandose como sigue: Glucosa+ATP---------Glucosa-6-fosfato+ADP Glucosa-6-fosfato---------Glucosa-1-fosfato Glucosa-1-fosfato+UTF---------UDP-glucosa+pirofosfato UDP-glucosa---------Glucógeno+UDP GLUCOGENOLISIS La conversión de glucógeno nuevamente a glucosa-1-fosfato, se hace por un proceso inverso al de la glucogenogénesis, aunque los pasos no son mismos. Debido a que el glucógeno es ramificado, para que éste pueda ser convertido en glucosa, se requier además de la enzima fosforilasa, de otra que desdoble las ramificaiones y de una transferasa. Los pasos del proceso pueden observarse en la figura No. 1 que muestra las vías metabólicas usadas en la conversión de los carbohidratos y grasas en energía. El glucógeno muscular, por la influencia de la epinefrina, es transformado en glucosa-6-fosfato que entra al ciclo glucolítico para proveer ATP. Como el músculo no tiene glucosa-6- fosfatasa para hidrolizar a la glucosa-6-fosfato y ésta no puede salir de las células por difusión, éste metabolito solo puede ser usado con fines energéticos en el interior de las células. En el hígado, sin embargo, la glucogenólisis se realiza en respuesta a la hormona glucagon secretada por el pancreas, cuando se detecta un bajo nivel de glucosa sanguinea. La glucosa-6fosfato resultante, es hidrolizada por la glucosa-6-fosfatasa presente en las células hepáticas, liberandose glucosa a la circulación. GLUCOLISIS La conversión de glucosa en piruvato y después en lactato en condiciones anaeróbicas en el músculo, tiene lugar mediante una serie de transformaciones metabólicas que se dan en el camino glucolítico ó de Embden- Meyerhoff (figura No. 1). El piruvato formado mediante el camino glucolítico, queda disponible para entrar en el ciclo del ácido tricarboxílico, el camino final común del metabolismo energético. El primer paso en la oxidación de la glucosa a CO2 y H2O, es la fosforilación de ésta, para dar glucosa-6-fosfato por la enzima hexoquinasa que utiliza un grupo fosforilo del ATP. Un segundo ATP más una reacción de isomerización producen fructosa-1,6-difosfato. Ya que la fructosa es una molécula de 6 carbonos, de ella se derivan dos moles de gliceraldehido-3-fosfato que se transforma posteriormente en piruvato. La glucólisis en resúmen, consiste en la conversión de un mol de glucosa a dos moles de piruvato, mediante el empleo de 2 ATP; la producción de 4 ATP y la reducción de NAD a NADH. El NAD es una coenzima denominada dinucleótido de adenina nicotinamida, que es un derivado de la vitamina niacina. El NADH, se considera un compuesto de alta energía, debido a la facilidad con que transfiere electrones a otras moléculas que atraen electrones. GLUCONEOGENESIS Algunas células tienen la capacidad de transformar productos del metabolismo, que no tienen carácter de glúcidos como tales, en glucosa y posteriormente en glucógeno. Este proceso recibe el nombre de, gluconeogénesis, lo que significa una nueva fuente de glucosa. Los principales compuestos de carácter no glucídico que pueden originar glucosa en el organismo animal son: propionatos, lactatos, aminoácidos glucoformadores y ciertos glicoles. Todos ellos son denominados compuestos glucogénicos, cuya vía degradativa es el ciclo del ácido tricarboxílico (ciclo de Krebs), proceso del metabolismo intermedio, que corresponde al análisis del destino del acetil CoA producido a partir de la descarboxilación del piruvato proveniente de la glucólisis, de la degradación de varios aminoácidos y la oxidación de los ácidos grasos; hasta la producción de malato (en el interior de la mitocondria) que puede atravesar la pared mitocondrial y ser transformado en oxalato, el cual posteriormente por medio de la acción de tres enzimas, inicia el proceso de obtención de glucosa por la ruta inversa de la glucólisis. PROPIONATOS. Los propionatos se transforman en el hígado en oxalacetatos, que condensandose con la acetil CoA, entran en el ciclo del ácido tricarboxílico (ciclo de Krebs), incrementando la formación de glucosa y favoreciendo el almacenamiento de glucógeno (precursor de la glucosa) en el hígado. Sin el oxalacetato correspondiente, la acetil CoA se desvía a otra ruta metabólica para la formación de cuerpos cetónicos. Esta desviación metabólica es un factor fundamental en la patogénia de la acetonemia. La conversión de propionatos en glucosa, requieren que éstos entren primero al ciclo del ácido tricarboxílico, como succinil CoA. Estas reacciones involucran a dos vitaminas: la biotina y la B12; por lo que la tasa de utilización de los propionatos por el hígado, depende de la disponibilidad de éstas vitaminas (figura No. 2) Así mismo, una carencia de cobalto, interfiere igualmente en el metabolismo de los hidratos de carbono, lo que da origen a niveles de ácidos grasos disminuidos, en los animales con carencias. LACTATOS. En el caso de los rumiantes, los propionatos son la fuente primaria de glucosa, contribuyendo a la síntesis del 30 al 50 porciento de la glucosa. Esta variación en la contribución proviene de las cantidades de propionatos transformadas en la pared del rúmen a lactato durante la absorción. En la práctica, ésta conversión que puede suponer hasta un 70 porciento de los propionatos, no tiene consecuencias destacables, dado lactatos y propionatos son transformados en glucosa por el hígado. AMINOACIDOS GLUCOFORMADORES. Los aminoácidos glucoformadores, contribuyen a formar hasta el 25 porciento de la glucosa necesaria. Estos aminoácidos, son el resultado de la digestión de las proteinas de los alimentos, de la digestión de las proteinas bacterianas del rúmen ó del catabolismo de las proteinas corporales. Son considerados glucogénicos, todos los aminoácidos no escenciales, junto con varios escenciales. En realidad, la parte glucogénica de los aminoácidos son los “esqueletos” de carbono resultantes del proceso de desaminación de los mismos, como parte del catabolismo protéico. Los residuos de la degradación, pueden integrarse en el ciclo del ácido tricarboxílico como acetato, piruvato ó acetoglutarato. Hay aminoácidos que se integran como ácido acetoacético y pueden convertirse en glucosa, considerandolos glucoformadores; pero también existen aquellos que se integran como acetil CoA ó ácido acetoacetato que no se convierten en glucosa, pero proveen de cetonas y se les conoce como cetogénicos (ver cuadro No. 1 y Figura No. 3). GLICOLES. Otra fuente de glucosa permitida para la gluconeogénesis a partir de sustancias glucogénicas, son ciertos glicoles y el glicerol; los cuales tienen la particularidad de que no son degradados por las bacterias del rúmen. Los glicoles son practicamente reabsorbidos en su totalidad, sin modificación estructural, transformándose en glucosa en el hígado (figura No.5). Además, pueden ser utilizados completamente por el organismo, para la producción de energía, pasando por el ciclo del ácido cítrico (ciclo de Krebs). Los glicoles se metabolizan como ácidos grasos, de los cuales, dos moles de éstos, producen un mol de glucosa. VIA OXIDATIVA COLATERAL DE LA GLUCOSA No toda la glucosa-6-fosfato necesita pasar a través del ciclo glucolítico; otro mecanismo para el catabolismo de la glucosa, es la vía oxidativa fosfoglucónica (camino pentosa-fosfato, derivación oxidativa, derivación pentosa), con el propósito primordial de sintetizar azucar de 5 carbonos (ribosa) y la coenzima reductiva NADPH2. La ribosa es usada en la síntesis del ADN, ARN y ATP; en tanto que la enzima NADPH2 aporta el poder reductor para la síntesis de los ácidos grasos. METABOLISMO DE LOS CARBOHIDRATOS EN LOS RUMIANTES Digestión y absorción. Inicialmente, todos los carbohidratos de la dieta son convertidos a glucosa, sin embargo, ésta se encuentra presente solo en forma transitoria, ya que pronto es convertida en ácidos grasos volátiles, pasando por piruvato (figura No. 4). Existen investigaciones que establecen que los ácidos grasos producidos por la acción microbiana, son absorbidos directamente desde el rumen, retículo, omaso e intestino grueso; la absorción ruminal es rápida, notandose niveles elevados en la sangre portal, diez minutos después de haber comido el animal. El epitelio ruminal no es un simple cedazo y tiene la capacidad de metabolizar los ácidos grasos volatiles a medida que son absorbidos. Se cree que entre el 80 y el 90 porciento del butirato es convertido en cuerpos cetónicos (ácido acetoacético y ácido b-hidroxibutírico). Hasta el 50 porciento del propionato puede ser metabolizado a lactato y piruvato durante la absorción. Relativamente poco acetato es usado, aparte de cómo fuente energética, por el epitelio ruminal y músculo. Metabolismo de los ácidos grasos volatiles. Por la sangre portal llegan al hígado una gran variedad de metabolitos, ninguno de los cuales es glucosa, como sucede en los no rumiantes. El acetato solo pasa por el hígado para integrarse a la corriente sanguinea, siendo el único ácido graso volátil que se puede encontrar en cantidades apreciables en la circulación periférica. Este es fosforilado a acetil CoA y entra al ciclo de krebs. El acetato también puede ser usado directamente para la síntesis de la grasa de la leche en especial para los ácidos grasos de cadena corta. La mayor parte del ácido propiónico es removido de la sangre portal por el hígado, que lo convierte en glucosa: de hecho el ácido propiónico es la fuente primaria de glucosa para los rumiantes. Como ya se señaló anteriormente, la conversión de propionato a glucosa requiere que éste entre primero al ciclo del ácido tricarboxílico, como succinil Coa (figura No.2). Estas reacciones requieren de tres enlaces de alta energía e involucran a dos vitaminas, la biotina y la b12. Puesto que las reacciones oxalacetato-fosfoenolpiruvato no son reversibles, la succinil CoA debe sobrepasar éstas reacciones en su camino a fosfoenolpiruvato y hacia la glucosa. El oxalacetato no puede pasar a través de la membrana mitocondrial, mientras que el malato sí, la succinil CoA es convertida a malato, que pasa a través de la membrana y posteriormente se convierte en oxalacetato y después en fosfoenolpiruvato; éste pasa a producir glucosa utilizando la ruta inversa de la glucólisis. El ácido butírico es absorbido como cuerpo cetónico y eventualmente es metabolizado como acetil CoA. METABOLISMO ENERGETICO (Parte II) SINTESIS DEL METABOLISMO AEROBIO DE LA GLUCOSA EN LA PRODUCCION DE ENERGIA La glucólisis considerada una vía anaerobia para producir ATP, incluso en ausencia de oxígeno, genera un número limitado de moléculas de ATP, ya que por cada molécula de gliceraldehido-3fosfato oxidada a piruvato, se producen dos moléculas de ATP por fosforilación a nivel de sustrato. Puesto que cada molécula de glucosa produce dos moléculas de gliceraldehido-3-fosfato, se generan 4 moléculas de ATP por molécula oxidada a piruvato. Por otra parte, se deben hidrolizar 2 moléculas de ATP para iniciar la glucólisis. Esto genera una ganancia neta para la célula de 2 moléculas de ATP por cada molécula de glucosa oxidada. El piruvato, producto final de la glucólisis, es un compuesto clave, porque se sitúa en el punto donde se unen las vías anaerobia (independiente de oxígeno) y aerobia (dependiente de oxígeno). En ausencia de oxígeno, el piruvato sufre fermentación; en presencia de oxígeno se descompone por respiración aerobia. La fermentación es un subterfugio para regenerar NAD+, cuando la concentración de oxígeno es baja, de modo que la glucólisis puede continuar y mantener la producción de ATP (ciclo de Cori). En muchos microorganismos, la fermentación es un proceso coadyuvante necesario para el metabolismo y en algunos anaerobios es la única fuente de energía metabólica: aunque la energía obtenida solo por glucólisis es escasa en comparación con la oxidación completa de la glucosa (gluconeogénesis), hasta dióxido de carbono y agua. De las 686 kCal que pueden liberarse en la oxidación completa de la glucosa, solo se liberan 57 kCal cuando se convierten en etanol y nada más 47 kCal en condiciones normales. En cualquier caso solo se sintetizan 2 moléculas de ATP por molécula de glucosa oxidada mediante glucólisis ó fermentación; más del 90 porciento de la energía, simplemente se descarta en el producto de fermentación (figura No. 5). La vía aerobia (gluconeogénesis), emplea oxígeno molecular, para extraer gran cantidad de energía a partir de los productos de la glucólisis (piruvato y NADH), en cantidad suficiente para sintetizar más de 30 moléculas de ATP; éste proceso tiene lugar en las mitocondrias, descritas con frecuencia como “plantas en miniatura generadoras de energía” (figura No. 6). Cada molécula de piruvato producido por glucólisis se transporta a través de la membrana mitocondrial interna hacia el interior de la matriz, donde es descarboxilada para formar un grupo acetilo de 2 carbonos (CH3COO). A continuación, el grupo acetilo forma un complejo con la coenzima A (un compuesto orgánico derivado de la vitamina ácido pantoténico) para formar acetil CoA. Una vez formada la acetil CoA, se introduce a la vía cíclica denominada ciclo del ácido tricarboxílico ó de Krebs (por el bioquímico inglés Hans Krebs). El primer paso del ciclo de Krebs es la condensación del grupo acetilo de 2 carbonos, con un oxalacetato de 4 carbonos para formar una molécula de citrato de 6 carbonos. Durante el ciclo, la molécula de citrato disminuye la longitud de su cadena en un átomo de carbono cada vez y regenera la molécula de oxalacetato de 4 carbonos que se condensa con otra de acetil CoA. Durante el ciclo de Krebs, pueden ocurrir cuatro reacciones, en las cuales se transfiere un par de electrones de un sustrato a una coenzima aceptora de electrones. Tres de las reacciones utilizan NAD+ para formar NADH; una reacción emplea FAD (derivada de la vitamina rivoflavina), para formar FADH2 (figura No. 7). Cada par de electrones transferido del NADH al oxígeno, por medio de la cadena transportadora de electrones, libera suficiente energía para formar unas 3 moléculas de ATP. Cada par de electrones donado por FADH2 libera bastante energía para formar casi 2 moléculas de ATP. Si se suman todas las moléculas de ATP formado a partir de una molécula de glucosa completamente catabolizada por medio de la glucólisis y el ciclo de Krebs, la ganancia neta máxima es de 36 ATP (que incluye el GTP formado en cada vuelta del ciclo). Reacción No. de ATP ó Coenzimas Formadas Glucosa ----- Glucosa 6 fosfato Fructosa 6-fosfato ----- Fructosa 1,6 bifosfato 2 Gliceradehido 3 fosfato ----- 2 1,3 – bifosfoglicerato 2 1,3 bifosfoglicerato ---- 2 3 fosfoglicerato 2 Fosfoenolpiruvato ---- 2 Piruvato 2 Piruvato ---- 2 Acetil-CoA 2 Isocitrato ---- 2 Alpha cetoglutarato 2 Alpha cetoglutarato ---- Succinil CoA 2 Succinil-CoA ---- 2 Succinato 2 Succinato ---- 2 Fumarato 2 Malato ---- 2 Oxalatato - 1 ATP - 1 ATP 2 NADH 2 ATP 2 ATP 2 NADH 2 NADH 2 NADH 2 ATP ó GTP 2 FADH2 2 NADH No. de ATP -1 -1 4 a 6** 2 2 6 6 6 2 4 6 Total.- 36 a 38 Cálculo efectuado considerando que la oxidación de cada NADH ó FADH2, origina 3 ATP y 2 ATP respectivamente. El valor negativo corresponde al consumo de ATP. ** 4 es el NADH citoplasmático que fue transportado hacia la mitocondria por el transportador Glicerol-3-Fosfato y 6 por el transportador Malato-Aspartato. Tanto en la glucólisis como en la gluconeogénesis, existen reacciones irreversibles donde participan enzimas que son claves en la regulación de la actividad de las respectivas vías. Cuando se da un equilibrio en ésta regulación, la concentración de ATP permanece alta a pesar de que se presenten grandes variaciones en su consumo. La energía almacenada en el ATP, se emplea en la mayoría de los procesos celulares que consumen energía; reacciones que están potenciadas por la conversión de ATP a ADP, que implican la transmisión de señales nerviosas, el movimiento muscular, la síntesis de proteínas y la división celular. En otros casos, el fosfato se transfiere a un residuo aminoácido de una proteína para inducir un cambio de conformación, como ocurre por ejemplo, durante el movimiento de iones sodio y potasio a través de la membrana plasmática; ó como ocurre en la síntesis de glutamina, aminoácido que es un factor importante en la liberación de la hormona del crecimiento. En las células del tejido muscular y del cerebro, de los animales vertebrados, el exceso de ATP puede unirse a la creatina, proporcionando un depósito de energía de reserva. La liberación de dos grupos fosfato de ATP por la enzima adenilato ciclasa, forma AMP, un nucleótido que forma parte de los ácidos nucleicos ó el material del ADN. Esta enzima es importante en muchas de las reacciones del organismo, ya que una forma de AMP llamada AMP cíclico, originado por la acción de ésta, participa en la actividad de muchas hormonas, citando como ejemplo: la adrenalina y ACTH. En resumen, para producirse ATP, se requiere basicamente de dos sustratos, glucosa y ácidos grasos, que pueden estar libres ó polimerizados (glucógeno ó triglicéridos). La mera existencia de dos sustratos energéticos alternativos, presupone la existencia de diferencias, pues en caso contrario la evolución hubiera eliminado a uno de los dos. Hay una diferencia fundamental entre ambos sustratos; los ácidos grasos necesitan oxígeno para producir energía, pues la mayor parte de ATP que se produce se obtiene por fosforilación oxidativa, en tanto que la pequeña parte que se obtiene a nivel de sustrato también es indirectamente dependiente de oxígeno. Por el contrario, la glucosa puede seguir dos rutas: una anaerobia y otra aerobia. El que la glucosa siga una u otra vía dependerá del oxígeno que se encuentre disponible ó almacenado (mioglobina); si hay oxígeno, la utilización de la vía aerobia será preferente; si no lo hay, usará exclusivamente la vía anaerobia (la glucólisis hasta ácido láctico). Para que la glucosa sea metabolizada por la vía aerobia, es necesario activar la gluconeogénesis; esto se produce en presencia de sustratos en alta concentración, éstos sustratos, son productos altamente organizados como: propionatos, lactatos, glicerol y aminoácidos; todos ellos estructuralmente próximos al ácido pirúvico ó a intermediarios del ciclo de Krebs. La ruta de la gluconeogénesis, es escencialmente una inversión de la glucólisis que se da en el hígado; pero que en el resto de los tejidos, no puede rendir glucosa libre, sino como máximo glucosa 6-P, que se podrá emplear para síntesis endógena de glucógeno, pero no para suministrar glucosa al resto de los tejidos. Puede asegurarse que se produce gluconeogénesis, cuando: hay sustratos en alta concentración, ó bien cuando se produce poca glucólisis (baja actividad hepática). En la gluconeogénesis, se produce una reacción en una de sus vías intermedias; donde una de las moléculas intermediarias de tres átomos de carbono, el gliceraldehido-3 fosfato, puede en una reacción lateral, convertirse en 2-3 bifosfoglicerato, un compuesto que ayuda a la hemoglobina de los glóbulos rojos a descargar oxígeno en los tejidos. Esto tiene una gran importancia biomédica, porque el músculo cardiaco, con sus numerosas mitocondrias y su abundante aporte de sangre, está adaptado a una función aerobia, pero tiene una capacidad glucolítica relativamente pobre, por lo que resiste poco la anoxia (falta de oxígeno); a diferencia del músculo esquelético, que cuenta con una notable capacidad glucolítica y puede resistir la anoxia. Una pregunta final, tal vez sería, ¿qué importancia práctica tiene el que logre generarse 36 moléculas de ATP por molécula de glucosa? Imaginemos como ejemplo, que el 1% (solo el 1%!!) de las moléculas de glucosa se oxidan aerobicamente. Esto supondrá la obtención de 36/38 ATPs por esa molécula y 99 por 2, 198 por las 99 restantes. El total de ATP obtenido será de 234/236, de los cuales 36/38, el 16.10% será de origen aeróbico. Con un 5% de glucosa aeróbica, cifra muy razonable, obtendríamos 190 ATP aeróbicos frente a otros 190 anaeróbicos, el 50%; con un total de 380 ATP, marcándose una clara diferencia en el incremento y disponibilidad de energía. Todos los procesos fisiológicos de un organismo, necesitan energía para funcionar y prácticamente la obtienen directamente del adenosintrifosfato (ATP) generado por medio de la glucólisis y la gluconeogénesis. Si se genera una mayor disponibilidad de ATP, un organismo siempre contará con la energía requerida para cubrir las súbitas demandas de energía para: el desarrollo, ganancia de peso, producción de leche, producción de huevo y reproducción. REFERENCIAS BIBLIOGRAFICAS 1.- M. en C. Juan de Jesus Taylor preciado, PhD Jose Rogelio Orozco Hernandez, MVZ Gerarado Simon Estrada Michel; Módulo de Nutrición Animal, Cuarto Seminario de Titulación; Universidad de Guadalajara CUCBA División de Ciencias Veterinarias, Junio de 1999. 2.- Compagne Chimique D’ Aquitaine; Notas sobre Las Necesidades de Glucosa en la Vaca Lechera de Alta Producción: 1994. 3.- BIOIBERICA, S.A.; Información Técnica sobre Aminoácidos y su Acción Bioestimulante; 1992. 4.- Leonard A. Maynard, Jhon K. Lossli, Harold F hintz, Richard G. Warner; Nutrición Animal; Cuarta Edición 1989. 5.- Chuch/Pond: Bases Científicas para la Nutrición y Alimentación de los Animales Domésticos. 6.- Gerald Karp; Biología Celular y Molecular; 1996. 7.- Jose Miguel Fernandez; Apuntes de Bioquímica del Ejercicio; 1992-1998 Libro 2. 8.- Ernesto Krebs A.; Informativo Creatina; Munnich Pharma Medical, Linea Natural; 2000. 9.- Smith y Wood, Addison Wesley Longman; Biología Celular; 1997. 10.- Laguna, E. Vazquez; Oxidación de los Acidos Grasos; Fac. de Medicina UNAM; 2000 11.- Michael W. KING,PhD/Medical Biochemistry/Terre Haute Center for Medical Education. Sergio Marchesini, Professor of Biochemistry/ University of Brecia /Italy. Gluconeogenesis. 2001. 12.- Michael W.KING,PhD/Medical Biochemistry/Terre Haute Center for Medical Education. Sergio Marchesini, Professor of Biochemistry/University of Brecia/Italy. Amino Acid Metabolism. 2001. 13.- Michael W. KING,PhD/Medical Biochemistry/Terre Haute Center for Medical Education. Sergio Marchesini, Professor of Biochemistry/University of Brecia/Italy. The TCA Cycle. 2001. 14.- Michael W. KING,PhD/Medical Biochemistry/Terre Haute Center for Medical Education. Sergio Marchesini, Professor of Biochemistry/University of Brecia/Italy. The PHD Complex and TCA Cycle. 2001. 15.- Michael W. KING,PhD/Medical Biochemistry/Terre Haute Center for Medical Education. Sergio Marchesini Professor of Biochemistry/University of Brecia/Italy. Fatty Acid Oxidation and Ketone Bodies. 2001. 16.- Michael W. KING,PhD/Medical Biochemistry/Terre Haute Center for Medical Education. Sergio Marchesini, Professor of Biochemistry/University of Brecia/Italy. The Glucose-Alanine Cycle. 2001. 17.- Michael W. KING,PhD/Medical Biochemistry/Terre Haute Center for Medical Education. Sergio Marchesini, Professor of Biochemistry/University of Brecia/Italy. Vitamins and Co-enzimes. 2002 18.- E.J. Baran. Química Bioinorgánica, Mc. Graw Hill Interamericana de España S.A. Madrid. 1995. 19.- E.J. Baran. Metal Ions In Biological Systems, Vol. 31, Cap. 4. H. Sigel & A. Sigel (Eds.), Marcel Dekker, New York, 1995. 20.- Carlos Olegario Hidalgo Ordoñez, Carolina Tamargo Miguel, Enrique Gomez Piñeiro, Nieves Facal Fernandez, Carmen Diaz Manforte. El Propilenglicol Mejora los Resultados de la Transferencia de Embriones. Servicio Regional de Investigación y Desarrollo Agroalimentario (SERIDA) España. 2007 21.- Michael W King, Ph. D / IU School of Medicine/ Liking at iupui. edu. Gluconeogénesis. Last modified, 2008. 22.- Base de datos del Comité Selecto de Sustancias GRASS (SCOGS) Opiniones Propionato de Sodio; Informe No. 79. Página última actualización 10/31/2006. 23.-. Base de Datos del Comité Selecto de Sustancias GRASS (SCOGS) Opiniones Propilenglicol Informe No. 27. Página última actualización 10/31/2006. DERECHOS RESERVADOS © MVZ RODOLFO JOSE MEDELES OROZCO 2012