V-009 - Universidad Nacional del Nordeste
Anuncio

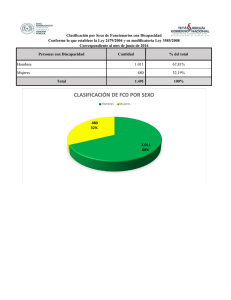
Resumen: V-009 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2006 Disminución del desarrollo de Focos de Criptas Displásicas en el colon de ratas suplementadas con ácido butírico* Catuogno, María S. - Montenegro, María A. - Sánchez Negrette, Marcial Cátedra Patología General y Sistemática. Facultad de Ciencias Veterinarias de la UNNE. Sargento Cabral 2139 – Corrientes 3.400 – E- mail: patgral@vet.unne.edu.ar *Trabajo subsidiado por la SGCyT- UNNE. Introducción El rol de la dieta en la prevención del cáncer de colon cada vez adquiere mayor importancia. Estudios epidemiológicos destacan que las sociedades que consumen dieta con alto contenido de carne roja y grasa de origen animal, tienen mayor incidencia de cáncer de colon, explicando en parte el elevado porcentaje de esta afección en Argentina y Uruguay, históricamente grandes consumidores de carnes rojas (4,11,12,13). Por otra parte estudios experimentales con animales de laboratorio han determinado que no todas las grasas son nocivas para el organismo, así diversos componentes de la leche bovina son considerados como potenciales inhibidores del proceso de la carcinogénesis. Tales componentes lo constituyen la esfingomielina, el ácido linoleico conjugado, la vitamina A, beta caroteno, la vitamina D, el calcio y el ácido butírico (9). El ácido butírico juega un importante rol en la regulación del crecimiento celular. En este sentido es un inhibidor de la proliferación celular y un potente inductor de diferenciación in Vitro para una amplia variedad de células neoplásicas, incluyendo leucemia, linfoma, glándula mamaria, colon, recto, hígado, cervix y ovario (2,6,8) . Los modelos experimentales con animales de laboratorio brindan una excelente oportunidad para el estudio de procesos tumorales y lesiones preneoplásicas (5,7). Así, el estudio de estados preneoplásicos en el colon, es posible mediante la identificación de dos tipos de lesiones conocidas como Focos de Criptas Aberrantes (FCA) (3,5,7) y Focos de Criptas Displásicas (FCD) (1). Los FCA son lesiones encontradas tanto en roedores tratados con carcinógenos, como en forma espontánea en seres humanos, y representan el estado inicial del cáncer colónico. El estudio de FCA es realizado en trozos de intestino observados bajo lupa y en cortes histológicos. Dichos FCA abarcan lesiones en criptas con fenómenos proliferativos, hiperplásicos, diferentes grados de displasia y pequeños adenomas (1,3). Por otra parte, los FCD están formados por áreas focales de criptas con diferentes grados de displasia, luces dilatadas y en ocasiones de contornos irregulares, con marcada basofília celular, frecuentes figuras mitóticas, disminución de células mucosas, así como estratificación y pérdida de la polaridad. Los FCD comprometen sólo la mucosa y no van más allá de la muscular de la mucosa (10). El objetivo del presente trabajo consiste en determinar el efecto anticancerígeno de un componente normal de la leche como lo es el ácido butírico sobre el desarrollo de Focos de Criptas Displásicas en el colon de ratas tratadas con el carcinógeno 1,2-dimetilhidrazina (DMH). Materiales y Métodos Fueron utilizadas ratas Wistar, machos, de 6 semanas de edad, con un peso promedio de 160 gr. Las mismas fueron alojadas en jaulas individuales en ambiente con temperatura controlada de 21 ºC, mantenidas con agua y dieta adlibitum. El ácido butírico (AcBu) fue administrado en el agua de bebida a la concentración de 4 mg/ml. Los FCD en el intestino grueso fueron inducidos mediante una inyección subcutánea semanal de DMH durante 17 semanas a la dosis de 20 mg/kg de peso corporal. Los animales fueron divididos al azar en dos grupos con diferentes lotes de la siguiente manera: Grupo Control (sin la administración de DMH) compuesto por lote 1 (sin tratamiento. n=10), lote 2 (tratado con AcBu. n=20) y Grupo experimental (con la administración de DMH) compuesto por lote 3 (tratado sólo con DMH n=20), lote 4 (tratado con DMH + AcBu. n=20). Se utilizó ácido butírico con pureza 99% de Sigma-Aldrich. El AcBu fue administrado en el agua de bebida 14 días antes del primer tratamiento con DMH y continuado hasta el momento del sacrificio de los animales transcurridas las 26 semanas de experiencia. La DMH (Symetrical Dimethylhydrazine Dihydrochloride – Sigma, Chem. Co-) fue preparada como una solución madre conteniendo 400 mg de DMH disuelta en 100 ml de agua destilada estéril conteniendo 37 mg de EDTA como agente estabilizador y mantenida a pH 6,5 con hidróxido de sodio. Esta solución fue preparada cada semana, momentos antes de cada inoculación. Todos los animales fueron sacrificados 8 semanas posteriores a la última dosis de DMH. En cada uno de los animales el intestino grueso en su totalidad fue extraído, abierto longitudinalmente y colocado sobre una plancha de cartón, fijado con formol bufferado al 10 % durante 24 horas, procesado por la técnica histológica clásica para bloques parafinados, cortado en micrótomo tipo Minot, en 5µm de espesor y coloreados con la técnica de Hematoxilina-Eosina. Fueron analizados cortes histológicos de cada uno de los segmentos del intestino grueso (ciego, colon proximal, colon distal y recto) a fin de detectar, localizar y caracterizar a los FCD. Resumen: V-009 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2006 Resultados Los FCD fueron observados en la mayoría de los animales tratados con DMH, en ciego, colon proximal (CP), colon distal (CD) y recto. En el lote tratado con AcBu se observó una significativa menor incidencia de FCD (n= 50), comparado con el lote que solo recibió DMH (n= 117). Los FCD se localizaron en ambos lotes con mayor frecuencia en el colon distal, 34 (68%), y 68 (58,12%) para el lote Ac Bu y lote DMH respectivamente. El número y localización de los FCD se encuentran en la tabla 1. Estos FCD se caracterizaron por comprometer grupos de 1 a 10 criptas, hasta grupos con numerosas criptas, ubicándose en la superficie de la mucosa, en su parte media o comprometiendo casi todo el espesor de la misma. Los mismos se caracterizaron por marcada basofilia citoplasmática, disminución y/o ausencia de células caliciformes, núcleos prominentes con cromocentros gruesos y evidente nucléolo; en ocasiones estratificación celular y pérdida de la polaridad, así como dilatación y formación de pseudopapilas y/o formación de brotes glandulares. No se observaron diferencias significativas entre los diferentes lotes con respecto a la localización de los FCD en las diferentes porciones del intestino grueso; no obstante las ratas suplementadas con AcBu mostraron menor número de FCD. Tabla 1: Frecuencia y localización anatómica en las diferentes porciones del intestino grueso de FCD en ambos lotes tratados con 1,2-DMH. Lote DMH AcBu + DMH Nº de ratas n = 20 n = 19 Nº de FCD 117 50 Nº de ratas, sin FCD 1 3 Recto 2 (1,71%) 2 (4%) Colon Distal 68 (58,12%) 34 (68%) Colon proximal 34 (29,06%) 12 (24%) Ciego 13 (11,11%) 2 (4%) ( ) Corresponde al porcentaje de FCD en cada segmento del intestino grueso, sobre el total de cada lote. Discusión y conclusiones El ácido butírico juega un rol importante en la regulación del crecimiento celular, promueve la proliferación lenta de células así como la actividad de las enzimas del ribete en cepillo. También estimula la proliferación de criptas normales. A nivel molecular causa acetilación de histonas, induce apoptosis y regula la expresión de varios oncogenes, induce apoptosis y posee efectos antiinflamatorios. Sus efectos anticancerígenos fueron investigados utilizando butirato de sodio como fuente de ácido butírico. El mismo fue administrado vía oral y de manera intracecal en altas concentraciones. Algunos resultados mostraron efectos promotores mientras que otros presentaron efectos anticancerígenos. Intentando demostrar que era el sodio y no el butirato el responsable del aumento de neoplasias colónicas, otros autores trabajaron con tributirina sin obtener diferencias en áreas focales de displasia o tumores colónicos. Nosotros trabajamos con AcBu puro diluido en agua y obtuvimos como resultado una marcada disminución del número de FCD, comparado con casi el doble de los hallados en el lote DMH. Este dato respalda la teoría de que diversos componentes de la dieta juegan un rol importante en el desarrollo del cáncer de colon, tanto en seres humanos como en animales de experimentación. Bibliografía: 1- Bird, R.P.; Wood, C.K.(2000) The significance of aberrant crypt foci in understanding the pathogenesis of colon cancer. Toxicol. Lett. 15:395-402. 2- Chen, Z.X.; Breitman, T.R. (1994). Tributyrin: A prodrug of butyric acid for potential - clinical application in differentiation therapy. Cancer Res. 54: 3494-3499. 3- Fenoglio-Preiser, C.M.; Noffsinger, A.(1999) Aberrant crypt foci: A review . Toxicol. Pathol: 27:632-642. 4- Haenszel, W.; Berg, J.W,; Kurihara,M.; Locke, F,V.(1976). Large-bowel cancer in Hawaiian Japanese. J.Natl. Cancer.Inst. 51:1764-1799. 5- Mc Lellan, E.A.; Medline, A; Bird, R.P.( 1991) Dose response and proliferative characteristics of aberrant crypt foci: putative preneoplastic lesions in the rat colon. Carcinogenesis 12: 2093-2098. 6- Nichenametla, S.N.; South, E.H.; Exon, J.H. (2004). Interaction of Conjugated Linoleic Acid , Sphingomyelin, and Butyrate on formation of colonic aberrant crypt foci and immune functions in rats. Journal of Toxicology and Environmental Health, Part A, 67: 469-481. Resumen: V-009 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2006 7- Otori, K.; Sugiyama, K.; Hasebe, T.; Fukushima, S.; Esumi, H.(1995). Emergente of adenomatous aberrant crypt foci, (ACF) from hyperplastic ACF with concomitant increase in cell proliferation. Cancer Res. 55: 4743-4746. 8- Pryde, S.E.; Duncan, S.H.; Hold, G.L.; Stewart, C.S.; Flint, H.J. (2002). The microbiology of butyrate formation in the human colon. FEMS Microbiology Letters 217: 133-139. 9- Sánchez Negrette, M.; Montenegro, M. A.;Lértora, W.J.; Catuogno, M.S. Disminución del número de tumours intestinales inducidos por 1,2-dimetilhidrazina en ratas alimentadas con leche descremada. (2005) Revista Veterinaria. 16.Nº 1 : 28-31. (50) 10- Ward, J.M.; Rise, J.M.; Roller, P.P.; Wenk, M. (1977) Natural history of intestinal neoplasms induced in rats by a single inyection of methyl (acetoxymethyl) nitrosamine. Cancer Res. 37:3046-3052. 11- Wynder, E.L.; Kajitani, T.; Ishikawa, T.; Dodo, H.; Takano, A. (1969) Environmental factors of cancer of the colon and rectum. II, Japanese Epidemiological data. Cancer 23:1210-1220. 12- Wynder, E.L.; Reddy, B.S.(1973) Studies of large bowel cancer: Human leads to experimental application. J.Natl. Cancer. Inst. 50:1099-1106. 13- Wynder, E.L.; Shigematsu, T. (1977) Environmental factors of cancer of the colon and rectum. Caner 20:15201561.