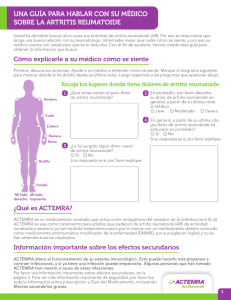
Información sobre prescripción
Anuncio

ASPECTOS DESTACADOS SOBRE LA INFORMACIÓN DE PRESCRIPCIÓN Estos aspectos destacados no incluyen toda la información necesaria para usar ACTEMRA segura y eficazmente. Consulte la información de prescripción completa de ACTEMRA. Artritis idiopática juvenil sistémica (2.3) Dosificación intravenosa recomendada para SJIA cada 2 semanas Pacientes de menos de 30 kg de 12 mg por kg peso Pacientes de 30 kg de peso o más 8 mg por kg ACTEMRA® (tocilizumab) inyección, para uso intravenoso inyección, para uso subcutáneo Aprobación inicial en EE.UU.: 2010 Información de dosificación general (2.4) • No se recomienda iniciar ACTEMRA en los pacientes con un recuento de neutrófilos absoluto (ANC, por sus siglas en inglés) por debajo de 2000 por mm3, recuento de plaquetas por debajo de 100,000 por mm3, o que tengan ALT o AST 1.5 veces por encima del límite superior a lo normal (ULN, por sus siglas en inglés). (2.1, 5.3) • No se recomiendan las dosis de ACTEMRA que excedan los 800 mg por infusión en los pacientes con RA. (2.1, 12.3) ADVERTENCIA: RIESGO DE INFECCIONES GRAVES Consulte la información de prescripción completa para ver la advertencia completa de la caja. • Las infecciones graves que llevan a la hospitalización o muerte que han ocurrido en los pacientes que reciben ACTEMRA incluyen la tuberculosis (TB) bacteriana, micótica invasiva, viral y otras infecciones oportunistas. (5.1) • Si se contrajera una infección grave, interrumpir ACTEMRA hasta que se controle la infección. (5.1) • Realizar la prueba de TB latente; si fuera positiva, iniciar el tratamiento de la TB antes de iniciar ACTEMRA. (5.1) • Vigilar a todos pacientes para detectar TB activa durante el tratamiento, aunque la prueba inicial de TB latente sea negativa. (5.1) -------------------- CAMBIOS PRINCIPALES RECIENTES -------------------Indicaciones y uso (1.2) 04/2013 Posología y administración (2.1, 2.2, 2.3, 2.5, 2.6, 2.7) 10/2013 Advertencias y precauciones (5.3, 5.5) 10/2013 -------------------------------INDICACIONES Y USO ------------------------------ACTEMRA® (tocilizumab) es un antagonista del receptor de la interleucina6 (IL-6) indicado para el tratamiento de: Artritis reumatoide (RA) (1.1) • Pacientes adultos con artritis reumatoide activa de moderada a severa que han tenido una respuesta inadecuada a uno o más Medicamentos Antirreumáticos Modificadores de la Enfermedad (DMARD, por sus siglas en inglés). Artritis idiopática juvenil poliarticular (PJIA, por sus siglas en inglés) (1.2) • Pacientes a partir de los 2 años de edad con artritis idiopática juvenil poliarticular activa. Artritis idiopática juvenil sistémica (SJIA, por sus siglas en inglés) (1.3) • Pacientes a partir de los 2 años de edad con artritis idiopática juvenil sistémica activa. ---------------------- POSOLOGÍA Y ADMINISTRACIÓN ---------------------ACTEMRA puede ser usado solo o en combinación con metotrexato: y en la RA, pueden usarse otros DMARD. (2) Artritis reumatoide (2.1) Dosificación intravenosa (IV) recomendada para adultos: Cuando se usa en combinación con los DMARD o como monoterapia, la dosis inicial recomendada es de 4 mg por kg cada 4 semanas seguidos por un aumento a 8 mg por kg cada 4 semanas basado en la respuesta clínica. Dosificación subcutánea (SC) recomendada para adultos: Pacientes de menos de 100 162 mg administrados por vía subcutánea semana kg de peso por medio, seguidos por un aumento a cada semana basado en la respuesta clínica Pacientes de 100 kg de 162 mg administrados por vía subcutánea cada peso o más semana Artritis idiopática juvenil poli articular (2.2) Dosificación intravenosa recomendada para PJIA cada 4 semanas Pacientes de menos de 30 kg de 10 mg por kg peso Pacientes de 30 kg de peso o más 8 mg por kg Administración de la formulación intravenosa (2.5) • Para adultos, en los pacientes con PJIA y SJIA de 30 kg o más, diluya a 100 ml en cloruro de sodio al 0.9% para infusión intravenosa usando una técnica aséptica. • Para los pacientes con PJIA y SJIA de menos de 30 kg, diluya a 50 ml en cloruro de sodio al 0.9% para infusión intravenosa usando una técnica aséptica. • Administre como infusión por goteo intravenoso único durante 1 hora; no lo administre como bolo o inyección directa. Administración de la formulación subcutánea (2.6) • Siga las instrucciones de uso de la jeringa prellenada Modificaciones de las dosis (2.7) • Recomendadas para el manejo de ciertos cambios de laboratorio relacionados con la dosis, que incluyen enzimas hepáticas elevadas, neutropenia y trombocitopenia. --------- FORMAS FARMACÉUTICAS Y CONCENTRACIONES -------Ampollas de uso único de ACTEMRA (20 mg por ml) para administración intravenosa: • 80 mg por 4 ml (3) • 200 mg por 10 ml (3) • 400 mg por 20 ml (3) Jeringa prellenada (PFS, por sus siglas en inglés) para administración subcutánea: • PFS de uso único que proporciona 162 mg de ACTEMRA en 0.9 ml (3) ----------------------------- CONTRAINDICACIONES ---------------------------• ACTEMRA está contraindicado en los pacientes con hipersensibilidad conocida a ACTEMRA. (4) --------------------- ADVERTENCIAS Y PRECAUCIONES -------------------• Infecciones graves– no administre ACTEMRA durante una infección activa, incluyendo infecciones localizadas. Si se contrajera una infección grave, interrumpa ACTEMRA hasta que se controle la infección. (5.1) • Perforación gastrointestinal (GI) – use con precaución en los pacientes que puedan tener aumento del riesgo. (5.2) • Vigilancia del laboratorio– recomendada debido a las consecuencias potenciales de los cambios relacionados con el tratamiento en los neutrófilos, las plaquetas, los lípidos y las pruebas de función hepática. (2.7, 5.3) • Han ocurrido reacciones de hipersensibilidad, incluyendo anafilaxia y muerte. (5.5) • Vacunas vivas – Evite el uso con ACTEMRA. (5.8, 7.3) ---------------------------- REACCIONES ADVERSAS ---------------------------Reacciones adversas más comunes (incidencia de al menos 5%): infecciones del tracto respiratorio superior, nasofaringitis, cefalea, hipertensión, aumento de ALT, reacciones en el sitio de la inyección. (6.1) Para informar sobre SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Genentech al 1-888-835-2555 o la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch ------------------- USO EN POBLACIONES ESPECÍFICAS ------------------• Embarazo: Basado en los datos de animales, puede causar daño fetal. (8.1) 1 • Madres que amamantan: Suspenda el medicamento o el amamantamiento tomando en consideración la importancia del medicamento para la madre. (8.3) Consulte 17 para INFORMACIÓN SOBRE EL ASESORAMIENTO AL PACIENTE y la Guía de medicamentos Revisado: 11/2014 ____________________________________________________________________________________________________________________________________ 2 INFORMACIÓN DE PRESCRIPCIÓN COMPLETA: CONTENIDO* ADVERTENCIA: RIESGO DE INFECCIONES GRAVES 1 7 6.5 Experiencia de postmercadeo INTERACCIONES FARMACOLÓGICAS 7.1 Otros medicamentos para el tratamiento de la Artritis reumatoide 7.2 Interacciones con los sustratos de CYP450 7.3 Vacunas vivas USO EN POBLACIONES ESPECÍFICAS 8.1 Embarazo 8.3 Madres que amamantan 8.4 Uso pediátrico 8.5 Uso geriátrico 8.6 Insuficiencia hepática 8.7 Insuficiencia renal ABUSO Y DEPENDENCIA A LAS DROGAS SOBREDOSIS DESCRIPCIÓN FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción 12.2 Farmacodinámica 12.3 Farmacocinética TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad ESTUDIOS CLÍNICOS 14.1 Artritis reumatoide – Administración IV 14.2 Artritis reumatoide – Administración SC 14.3 Artritis idiopática juvenil poliarticular – Administración IV 14.4 Artritis idiopática juvenil sistémica – Administración IV PRESENTACIÓN/ALMACENAMIENTO Y MANEJO INFORMACIÓN SOBRE EL ASESORAMIENTO AL PACIENTE INDICACIONES Y USO 1.1 Artritis reumatoide (RA, por sus siglas en inglés) 8 1.2 Artritis idiopática juvenil poliarticular (PJIA, por sus siglas en inglés) 1.3 Artritis idiopática juvenil sistémica (SJIA, por sus siglas en inglés) 2 POSOLOGÍA Y ADMINISTRACIÓN 2.1 Artritis reumatoide 2.2 Artritis idiopática juvenil poliarticular 2 3 Artritis idiopática juvenil sistémica 9 2.4 Consideraciones generales de la administración 10 2.5 Instrucciones de preparación y administración de la infusión IV 11 2.6 Instrucciones de preparación y administración de la inyección SC 12 para RA 2.7 Modificaciones de las dosis debido a infecciones graves o anormalidades de laboratorio 3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES 13 4 CONTRAINDICACIONES 5 ADVERTENCIAS Y PRECAUCIONES 14 5.1 Infecciones graves 5.2 Perforaciones gastrointestinales 5.3 Parámetros de laboratorio 5.4 Inmunosupresión 5.5 Reacciones de hipersensibilidad, incluyendo anafilaxia 16 5.6 Trastornos desmielinizantes 17 5.7 Enfermedad hepática activa e insuficiencia hepática 5.8 Vacunaciones *Las secciones o subsecciones omitidas de la información de prescripción 6 REACCIONES ADVERSAS completa no se enumeran. 6.1 Experiencia en estudios clínicos con ACTEMRA IV en los pacientes con RA 6.2 Experiencia en estudios clínicos con ACTEMRA SC en los pacientes con RA 6.3 Experiencia en estudios clínicos con ACTEMRA IV en los pacientes con PJIA 6.4 Experiencia en estudios clínicos con ACTEMRA IV en los pacientes con SJIA ____________________________________________________________________________________________________________________________________ INFORMACIÓN DE PRESCRIPCIÓN COMPLETA ADVERTENCIA: RIESGO DE INFECCIONES GRAVES Los pacientes tratados con ACTEMRA se encuentran en mayor riesgo de contraer infecciones graves que pueden llevar a la hospitalización o muerte [consulte Advertencias y precauciones (5.1), Reacciones adversas (6.1)]. La mayoría de los pacientes que contrajeron estas infecciones estaban recibiendo inmunosupresores concomitantes tales como metotrexato o corticosteroides. Si se contrajera una infección grave, interrumpa ACTEMRA hasta que se controle la infección. Las infecciones informadas incluyen: • Tuberculosis activa, que puede presentarse con enfermedad pulmonar o extrapulmonar. Los pacientes deben evaluarse para detectar tuberculosis latente antes de usar ACTEMRA y durante la terapia. El tratamiento de la infección latente debe iniciarse antes de usar ACTEMRA. • Infecciones micóticas invasivas, incluyendo candidiasis, aspergilosis y pneumocystis. Los pacientes con infecciones micóticas invasivas pueden presentar enfermedad diseminada en lugar de localizada. • Infecciones bacterianas, virales y otras debido a patógenos oportunistas. Los riesgos y beneficios del tratamiento con ACTEMRA deben considerarse cuidadosamente antes de iniciar la terapia en los pacientes con infección crónica o recurrente. Los pacientes deben vigilarse de cerca para evaluar el desarrollo de signos y síntomas durante y después del tratamiento con ACTEMRA, incluyendo el posible desarrollo de tuberculosis en los pacientes que resultaron negativos para la infección de tuberculosis latente antes de iniciar la terapia [consulte Advertencias y precauciones (5.1)]. 3 1 INDICACIONES Y USO 1.1 Artritis reumatoide (RA) ACTEMRA® (tocilizumab) está indicado para el tratamiento de pacientes adultos con artritis reumatoide activa de moderada a severa que han tenido una respuesta inadecuada a uno o más medicamentos antirreumáticos modificadores de la enfermedad (DMARD). 1.2 Artritis idiopática juvenil poliarticular (PJIA) ACTEMRA® (tocilizumab) está indicado para el tratamiento de la artritis idiopática juvenil poliarticular activa en pacientes a partir de los 2 años de edad. 1.3 Artritis idiopática juvenil sistémica (SJIA) ACTEMRA® (tocilizumab) está indicado para el tratamiento de la artritis idiopática juvenil sistémica activa en pacientes a partir de los 2 años de edad. 2 POSOLOGÍA Y ADMINISTRACIÓN 2.1 Artritis reumatoide ACTEMRA puede ser usado como monoterapia o concomitantemente con metotrexato u otros DMARD no biológicos como infusión intravenosa o como inyección subcutánea. Régimen de dosificación intravenosa recomendada (IV): La dosificación recomendada de ACTEMRA para pacientes adultos administrada como infusión por goteo intravenoso único en 60 minutos es de 4 mg por kg cada 4 semanas seguida por un aumento a 8 mg por kg cada 4 semanas basada en la respuesta clínica. • • Se recomienda la reducción de la dosis de 8 mg por kg a 4 mg por kg para el manejo de ciertos cambios de laboratorio relacionados con la dosis incluyendo enzimas hepáticas elevadas, neutropenia y trombocitopenia [consulte Posología y administración (2.7), Advertencias y precauciones (5.3) y Reacciones adversas (6.1)]. No se recomiendan las dosis que excedan los 800 mg por infusión en los pacientes con RA [consulte Farmacología clínica (12.3)]. Régimen de dosificación subcutánea recomendada (SC): Pacientes de menos de 100 kg de peso Pacientes de 100 kg de peso o más 162 mg administrados por vía subcutánea semana por medio, seguidos por un aumento a cada semana basado en la respuesta clínica 162 mg administrados por vía subcutánea cada semana Al hacer la transición de la terapia intravenosa con ACTEMRA a la administración subcutánea, administre la primera dosis subcutánea en lugar de la siguiente dosis intravenosa programada. Se recomienda la interrupción de la dosis o la reducción en la frecuencia de la administración de la dosis subcutánea de todas las semanas a la dosificación semana por medio para el manejo de ciertos cambios de laboratorio relacionados con la dosis, incluyendo enzimas hepáticas elevadas, neutropenia y trombocitopenia [consulte Posología y administración (2.7), Advertencias y precauciones (5.3) y Reacciones adversas (6.2)]. 2.2 Artritis idiopática juvenil poliarticular ACTEMRA puede ser usado solo o en combinación con metotrexato. La dosificación recomendada de ACTEMRA para los pacientes con PJIA administrada una vez cada 4 semanas como infusión por goteo intravenoso único en 60 minutos es: 4 Dosificación intravenosa recomendada para PJIA cada 4 semanas Pacientes de menos de 30 kg de peso 10 mg por kg Pacientes de 30 kg de peso o más 8 mg por kg • • • No cambie la dosis basándose solamente en una medida de peso corporal en una sola visita, ya que el peso puede fluctuar. Puede ser necesaria la interrupción de la dosis para el manejo de ciertos cambios de laboratorio relacionados con la dosis, incluyendo enzimas hepáticas elevadas, neutropenia y trombocitopenia [consulte Posología y administración (2.7)]. La administración subcutánea no está aprobada para PJIA. 2.3 Artritis idiopática juvenil sistémica ACTEMRA puede ser usado solo o en combinación con metotrexato. La dosis recomendada de ACTEMRA para los pacientes con SJIA administrada una vez cada 2 semanas como infusión por goteo intravenoso único en 60 minutos es: Dosificación intravenosa recomendada para SJIA cada 2 semanas Pacientes de menos de 30 kg de peso 12 mg por kg Pacientes de 30 kg de peso o más 8 mg por kg • • • No cambie la dosis basándose solamente en una medida de peso corporal en una sola visita, ya que el peso puede fluctuar. Puede ser necesaria la interrupción de la dosis para el manejo de ciertos cambios de laboratorio relacionados con la dosis, incluyendo enzimas hepáticas elevadas, neutropenia y trombocitopenia [consulte Posología y administración (2.7)]. La administración subcutánea no está aprobada para SJIA. 2.4 Consideraciones generales para la administración • ACTEMRA no ha sido estudiada en combinación con DMARD biológicos tales como los antagonistas de TNF, antagonistas de IL-1R, anticuerpos monoclonales anti-CD20 y moduladores selectivos de coestimulación debido a la posibilidad de aumento de la inmunosupresión y aumento del riesgo de infección. Evite usar ACTEMRA con DMARD biológicos. • No se recomienda iniciar ACTEMRA en los pacientes con un recuento de neutrófilos absoluto (ANC) por debajo de 2000 por mm3, recuento de plaquetas por debajo de 100,000 por mm3, o que tengan ALT o AST 1.5 veces por encima del límite superior a lo normal (ULN). 2.5 Instrucciones de preparación y administración de la infusión intravenosa ACTEMRA para infusión intravenosa debe ser diluida por un profesional de atención médica usando una técnica aséptica de la siguiente manera: • • Pacientes con PJIA y SJIA de menos de 30 kg: use una bolsa o botella de infusión de 50 ml de cloruro de sodio al 0.9%, y luego siga los pasos 1 y 2 a continuación. Pacientes con RA adulto, PJIA y SJIA de 30 kg de peso o más: use una bolsa o botella de infusión de 100 ml, y luego siga los pasos 1 y 2 a continuación. − Paso 1. Extraiga un volumen de inyección de cloruro de sodio al 0.9%, igual al volumen de la inyección de ACTEMRA necesario para la dosis del paciente de la bolsa o botella de infusión [consulte Posología y administración (2.1, 2.2, 2.3)]. Para uso intravenoso: Volumen de la inyección de ACTEMRA por kg de peso corporal Dosificación Indicación Volumen de la inyección de ACTEMRA por kg de peso corporal 5 4 mg/kg 8 mg/kg 10 mg/kg 12 mg/kg RA adulto RA adulto SJIA y PJIA (≥ 30 kg de peso corporal) PJIA (< 30 kg de peso corporal) SJIA (< 30 kg de peso corporal) 0.2 ml/kg 0.4 ml/kg 0.5 ml/kg 0.6 ml/kg – Paso 2. Extraiga la cantidad de ACTEMRA para infusión intravenosa de la(s) ampolla(s) y añada lentamente a la bolsa o botella de infusión con cloruro de sodio. Para mezclar la solución, invierta suavemente la bolsa para evitar que haga espuma. • • • • • • Las soluciones para infusión totalmente diluidas de ACTEMRA pueden almacenarse de 2° a 8°C (36° a 46°F) o temperatura ambiente hasta por 24 horas, debiendo protegerse de la luz. Las soluciones de ACTEMRA no contienen preservativos; por ello no debe usarse el producto restante no utilizado en las ampollas. Permita que la solución totalmente diluida de ACTEMRA alcance la temperatura ambiente antes de la infusión. La infusión debe ser administrada durante 60 minutos, debiendo administrarse con un equipo de infusión. No la administre como inyección directa o bolo. ACTEMRA no debe ser infundida concomitantemente en la misma línea intravenosa con otros medicamentos. No se han realizado estudios de compatibilidad física o bioquímica para evaluar la coadministración de ACTEMRA con otros medicamentos. Los productos farmacéuticos parenterales deben ser inspeccionados visualmente para ver materia particulada y descoloración antes de la administración, siempre que lo permitan la solución y el envase. Si se notaran partículas y descoloraciones, no debe usarse el producto. Las soluciones totalmente diluidas de ACTEMRA son compatibles con las bolsas para infusión de polipropileno, polietileno y cloruro de polivinilo y las botellas de infusión de vidrio. 2.6 Instrucciones de preparación y administración de la inyección subcutánea para RA ACTEMRA para inyección subcutánea solamente está indicado en el tratamiento de pacientes con RA adulto; no está indicado para el tratamiento de pacientes con PJIA o SJIA. ACTEMRA para inyección subcutánea no está previsto para la infusión por goteo intravenoso. • • • • La inyección subcutánea de ACTEMRA está prevista para el uso bajo la guía de un profesional de atención médica. Luego de la capacitación adecuada en la técnica de inyección subcutánea, un paciente puede autoinyectarse ACTEMRA o el cuidador del paciente puede administrar ACTEMRA si un profesional de atención médica determina que es adecuado. Los pacientes o sus cuidadores deben ser instruidos para seguir las indicaciones proporcionadas en las Instrucciones de uso (IFU, por sus siglas en inglés) para ver detalles adicionales sobre la administración del medicamento. Los productos farmacéuticos parenterales deben ser inspeccionados visualmente para ver materia particulada y descoloración antes de la administración. No use las jeringas prellenadas (PFS) de ACTEMRA que exhiban materia particulada, turbidez o descoloración. ACTEMRA para administración subcutánea debe ser trasparente e incoloro a amarillo pálido. No la use si cualquier parte de las PFS pareciera estar dañada. Los pacientes que usan ACTEMRA para administración subcutánea deben ser instruidos para inyectarse la cantidad total de la jeringa (0.9 ml), que proporciona 162 mg de ACTEMRA, según las indicaciones proporcionadas en las IFU. Los sitios de inyección deben rotarse con cada inyección, no debiendo aplicarse nunca en lunares, cicatrices o áreas donde la piel esté sensible, magullada, enrojecida, dura o no intacta. 2.7 Modificaciones de la dosificación debido a infecciones graves o anormalidades de laboratorio Retenga el tratamiento con ACTEMRA si el paciente contrajera una infección grave hasta que se controle la infección. 6 Artritis reumatoide Anormalidades de las enzimas hepáticas [consulte Advertencias y precauciones (5.3)]: Valor de laboratorio Recomendación Mayor que 1 a 3x Modifique la dosis de DMARD concomitantes si correspondiera ULN Para aumentos persistentes en este rango: • Para los pacientes que reciben ACTEMRA intravenoso, reduzca la dosis a 4 mg por kg o retenga ACTEMRA hasta que la ALT o AST se haya normalizado • Para los pacientes que reciben ACTEMRA subcutáneo, reduzca la frecuencia de la inyección a semana por medio o retenga la dosis hasta que la ALT o AST se haya normalizado. Reanude ACTEMRA semana por medio y aumente la frecuencia a cada semana según sea clínicamente adecuado. Mayor que 3 a 5x Retenga la dosis de ACTEMRA hasta que sea menor que 3x ULN y siga las ULN recomendaciones anteriores para mayor que 1 a 3x ULN (confirmado por repetición de la prueba) Mayor ULN que Para aumentos persistentes mayores que 3x ULN, suspenda ACTEMRA 5x Suspenda ACTEMRA Recuento de neutrófilos absoluto bajo (ANC) [consulte Advertencias y precauciones (5.3)]: Valor de laboratorio (células por mm3) Recomendación ANC mayor de Mantenga la dosis 1000 ANC de 500 a Retenga la dosis de ACTEMRA 1000 Cuando ANC sea mayor que 1000 células por mm3: ANC menor que 500 • Para los pacientes que reciben ACTEMRA intravenoso, reanude ACTEMRA a 4 mg por kg y aumente a 8 mg por kg según sea clínicamente adecuado • Para los pacientes que reciben ACTEMRA subcutáneo, reanude ACTEMRA semana por medio y aumente la frecuencia a cada semana según sea clínicamente adecuado Suspenda ACTEMRA 7 Recuento de plaquetas bajo [consulte Advertencias y precauciones (5.3)]: Valor de laboratorio (células por mm3) 50,000 a 100,000 Recomendación Retenga la dosificación de ACTEMRA Cuando el recuento de plaquetas sea mayor que 100,000 células por mm3: Menor que 50,000 • Para los pacientes que reciben ACTEMRA intravenoso, reanude ACTEMRA a 4 mg por kg y aumente a 8 mg por kg según sea clínicamente adecuado • Para los pacientes que reciben ACTEMRA subcutáneo, reanude ACTEMRA semana por medio y aumente la frecuencia a cada semana según sea clínicamente adecuado Suspenda ACTEMRA Artritis idiopática juvenil poliarticular y sistémica: No ha sido estudiada la reducción de la dosis de ACTEMRA en las poblaciones con PJIA y SJIA. Se recomiendan interrupciones de la dosis de ACTEMRA por anormalidades de las enzimas hepáticas, recuentos de neutrófilos bajos y recuentos de plaquetas bajos en los pacientes con PJIA y SJIA en niveles similares a los detallados anteriormente para los pacientes con RA. Si correspondiera, modifique la dosis o suspenda el metotrexato concomitante y/u otros medicamentos y retenga la dosificación de ACTEMRA hasta que se haya evaluado la situación clínica. En la PJIA y SJIA la decisión de suspender ACTEMRA por una anormalidad de laboratorio debe basarse en la evaluación médica del paciente individual. 3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES Ampollas de uso único de ACTEMRA (20 mg por ml) para la administración IV: • 80 mg por 4 ml • 200 mg por 10 ml • 400 mg por 20 ml Jeringa pre llenada (PFS) para la administración SC: • Jeringa de vidrio pre llenada de uso único que proporciona 162 mg de ACTEMRA en 0.9 ml 4 CONTRAINDICACIONES ACTEMRA está contraindicada en los pacientes con hipersensibilidad conocida a ACTEMRA [consulte Advertencias y precauciones (5.5)]. 5 ADVERTENCIAS Y PRECAUCIONES 5.1 Infecciones graves Se han informado infecciones graves y a veces fatales debido a patógenos bacterianos, micobacterianos, micóticos invasivos, virales, protozoáricos, u otros patógenos oportunistas en los pacientes que recibían agentes inmunosupresores incluyendo ACTEMRA para la artritis reumatoide. Las infecciones graves más comunes incluyeron neumonía, infección del tracto urinario, celulitis, herpes zoster, gastroenteritis, diverticulitis, sepsia y artritis bacteriana [consulte Reacciones adversas (6.1)]. Entre las infecciones oportunistas, se informaron tuberculosis, criptococos, aspergilosis, candidiasis y neumocistosis con ACTEMRA. También pueden ocurrir 8 otras infecciones graves, no informadas en estudios clínicos, (por ej., histoplasmosis, coccidioidomicosis, listeriosis). Los pacientes han presentado enfermedad diseminada en lugar de localizada, y a menudo recibían inmunosupresores concomitantes tales como metotrexato o corticosteroides que además de la artritis reumatoide pueden predisponerlos a infecciones. No administre ACTEMRA a los pacientes con una infección activa, incluyendo infecciones localizadas. Los riesgos y beneficios del tratamiento deben ser considerados antes de iniciar ACTEMRA en los pacientes: • • • • • con infección crónica o recurrente; que han estado expuestos a la tuberculosis; con antecedentes de infección grave u oportunista; que han residido o viajado a áreas de tuberculosis endémica o micosis endémicas; o con afecciones subyacentes que pueden predisponerlos a infecciones. Vigile a los pacientes de cerca para ver el desarrollo de signos y síntomas de infección durante y después del tratamiento con ACTEMRA, ya que los signos y síntomas de inflamación aguda pueden estar disminuidos debido a la supresión de los reactivos de la fase aguda [consulte Posología y administración (2.4), Reacciones adversas (6.1), e Información de asesoramiento para el paciente (17)]. Retenga ACTEMRA si un paciente contrajera una infección grave, una infección oportunista o sepsia. Un paciente que contraiga una nueva infección durante el tratamiento con ACTEMRA debiera someterse a análisis diagnósticos rápidos y completos adecuados a un paciente inmunocomprometido, iniciar terapia antimicrobiana adecuada y vigilar al paciente de cerca. Tuberculosis Evalúe en los pacientes los factores de riesgo de la tuberculosis y haga pruebas para infección latente antes de iniciar ACTEMRA. Considere la terapia antituberculosa antes de iniciar ACTEMRA en los pacientes con antecedentes de tuberculosis latente o activa en quienes no puede confirmarse un curso adecuado de tratamiento y en los pacientes con una prueba negativa de tuberculosis latente pero que tengan factores de riesgo de infección por tuberculosis. Se recomienda la consulta con un médico con experiencia en el tratamiento de tuberculosis para ayudar con la decisión si iniciar la terapia antituberculosa es adecuado para el paciente individual. Vigile a los pacientes de cerca para ver el desarrollo de signos y síntomas de tuberculosis incluyendo los pacientes que resultaron negativos para la infección de tuberculosis latente antes de iniciar la terapia. Se recomienda que se evalúe en los pacientes la infección de tuberculosis latente antes de iniciar ACTEMRA. La incidencia de tuberculosis en programas de desarrollo clínico mundial es del 0.1%. Los pacientes con tuberculosis latente deben ser tratados con terapia antimicobacteriana estándar antes de iniciar ACTEMRA. Reactivación viral Se ha informado sobre reactivación viral con terapias biológicas inmunosupresoras y se observaron casos de exacerbación del herpes zoster en estudios clínicos con ACTEMRA. No se observaron casos de reactivación de Hepatitis B en los estudios; sin embargo, fueron excluidos los pacientes que resultaron positivos para hepatitis. 5.2 Perforaciones gastrointestinales Se han informado eventos de perforación gastrointestinal en estudios clínicos, principalmente como complicaciones de diverticulitis en los pacientes con RA. Use ACTEMRA con precaución en los pacientes que puedan tener aumento del riesgo de padecer perforación gastrointestinal. Evalúe rápidamente a los pacientes que presenten un nuevo inicio de síntomas abdominales para la identificación precoz de la perforación gastrointestinal [consulte Reacciones adversas (6.1)]. 9 5.3 Parámetros de laboratorio Artritis reumatoide Neutropenia El tratamiento con ACTEMRA estuvo asociado con una mayor incidencia de neutropenia. Rara vez se ha informado sobre infecciones asociadas con neutropenia relacionada con el tratamiento en estudios de extensión de largo plazo y experiencia clínica de postmercadeo. – No se recomienda iniciar el tratamiento con ACTEMRA en los pacientes con recuento de neutrófilos bajo, es decir, recuento de neutrófilos absoluto (ANC) menor que 2000 por mm3. No se recomienda el tratamiento en los pacientes que desarrollen un recuento de neutrófilos absoluto menor que 500 por mm3. – Vigile los neutrófilos 4 a 8 semanas luego de comenzar la terapia y cada 3 meses a partir de allí [consulte Farmacología clínica (12.2)]. Para modificaciones recomendadas basadas en los resultados de ANC [consulte Posología y administración (2.7)]. Trombocitopenia El tratamiento con ACTEMRA estuvo asociado con una reducción en los recuentos de plaquetas. La reducción relacionada con el tratamiento de las plaquetas no estuvo asociada con eventos de sangrado serios en estudios clínicos [consulte Reacciones adversas (6.1, 6.2)]. – No se recomienda iniciar el tratamiento con ACTEMRA en los pacientes con recuento de plaquetas por debajo de 100,000 por mm3. No se recomienda el tratamiento en los pacientes que desarrollen un recuento de plaquetas menor que 50,000 por mm3. – Vigile las plaquetas 4 a 8 semanas luego de iniciar la terapia y cada 3 meses a partir de allí. Para modificaciones recomendadas basadas en los recuentos de plaquetas [consulte Posología y administración (2.7)]. Enzimas hepáticas elevadas El tratamiento con ACTEMRA estuvo asociado con una mayor incidencia de elevaciones de las transaminasas. Estas elevaciones no dieron como resultado una lesión hepática clínicamente evidente o aparentemente permanente en estudios clínicos [consulte Reacciones adversas (6.1, 6.2)]. Se observó una frecuencia y magnitud aumentadas de estas elevaciones cuando se usaron medicamentos potencialmente hepatotóxicos (por ej., MTX) en combinación con ACTEMRA. En un caso, un paciente que había recibido ACTEMRA 8 mg por kg como monoterapia sin elevaciones de las transaminasas experimentó elevación en la AST por encima de 10x ULN y elevación en la ALT hasta por encima de 16x ULN cuando se inició MTX en combinación con ACTEMRA. Las transaminasas se normalizaron cuando se retuvieron ambos tratamientos, pero las elevaciones se repitieron cuando MTX y ACTEMRA se reiniciaron con dosis más bajas. Las elevaciones se resolvieron cuando MTX y ACTEMRA se suspendieron. – No se recomienda iniciar el tratamiento con ACTEMRA en los pacientes con transaminasas ALT o AST elevadas mayores que 1.5x ULN. No se recomienda el tratamiento en los pacientes que desarrollaron ALT o AST elevadas mayores que 5x ULN. – Vigile los niveles de ALT y AST 4 a 8 semanas después de iniciar la terapia y cada 3 meses a partir de allí. Cuando esté clínicamente indicado, deben considerarse otras pruebas de la función hepática tales como bilirrubina. Para modificaciones recomendadas basadas en transaminasas [consulte Posología y administración (2.7)]. Anormalidades de los lípidos El tratamiento con ACTEMRA estuvo asociado con aumentos en los parámetros de lípidos tales como colesterol total, triglicéridos, colesterol LDL, y/o colesterol HDL [consulte Reacciones adversas (6.1, 6.2)]. 10 – Evalúe los parámetros de lípidos aproximadamente 4 a 8 semanas luego de iniciar la terapia con ACTEMRA, luego a intervalos de aproximadamente 24 semanas. – Controle a los pacientes según las pautas clínicas [por ej., Programa Educativo Nacional del Colesterol (NCEP, por sus siglas en inglés)] para el manejo de hiperlipidemia. Artritis idiopática juvenil poliarticular y sistémica Se observa un patrón similar de elevación de la enzima hepática, recuento de neutrófilos bajo, recuento de plaquetas bajo y elevaciones de lípidos con el tratamiento con ACTEMRA en las poblaciones con PJIA y SJIA. Vigile los neutrófilos, las plaquetas, la ALT y AST en el momento de la segunda infusión y a partir de allí cada 4 a 8 semanas para PJIA y cada 2 a 4 semanas para SJIA. Vigile los lípidos como más arriba para RA [consulte Posología y administración (2.7)]. 5.4 Inmunosupresión Se desconoce el impacto del tratamiento con ACTEMRA sobre el desarrollo de neoplasias, pero se observaron neoplasias en estudios clínicos [consulte Reacciones adversas (6.1)]. ACTEMRA es un inmunosupresor; el tratamiento con inmunosupresores puede dar como resultado un aumento del riesgo de neoplasias. 5.5 Reacciones de hipersensibilidad, incluyendo anafilaxia Se han informado reacciones de hipersensibilidad, incluyendo anafilaxia en asociación con ACTEMRA [consulte Reacciones adversas (6)] y eventos anafilácticos con resultados fatales con la infusión intravenosa de ACTEMRA. Se informaron anafilaxia y otras reacciones de hipersensibilidad que requirieron la suspensión del tratamiento en 0.1% (3 de 2644) de los pacientes en los ensayos controlados de 6 meses de ACTEMRA intravenoso, 0.2% (8 de 4009) de los pacientes en la población con RA de exposición total intravenosa, 0.7% (8 de 1068) en los ensayos de RA controlados de 6 meses subcutáneos y en 0.7% (10 de 1465) de los pacientes en la población de exposición total subcutánea. En el ensayo controlado de SJIA con ACTEMRA intravenoso, 1 de 112 pacientes (0.9%) experimentó reacciones de hipersensibilidad que requirió la suspensión del tratamiento. En el ensayo controlado de PJIA con ACTEMRA intravenoso, 0 de 188 pacientes (0%) en la población de exposición total a ACTEMRA experimentó reacciones de hipersensibilidad que requirió la suspensión del tratamiento. Las reacciones que requirieron la suspensión del tratamiento incluyeron eritema generalizado, erupción y urticaria. Las reacciones en el sitio de la inyección fueron categorizadas separadamente [consulte Reacciones adversas (6)]. En el ambiente de postmercadeo, han ocurrido eventos de reacciones de hipersensibilidad, incluyendo anafilaxia y muerte en los pacientes tratados con una variedad de dosis de ACTEMRA intravenoso, con o sin terapias concomitantes para artritis. Han ocurrido eventos en pacientes que recibieron pre medicamentos. Ha ocurrido hipersensibilidad, incluyendo eventos de anafilaxia, con o sin reacciones anteriores de hipersensibilidad y tan pronto como en la primera infusión de ACTEMRA [consulte Reacciones adversas (6.5)]. ACTEMRA para uso intravenoso solo debe ser infundida por un profesional de atención médica con apoyo médico adecuado para manejar la anafilaxia. Para la inyección subcutánea de ACTEMRA, aconseje a los pacientes que busquen atención médica inmediata si experimentaran algún síntoma de reacción de hipersensibilidad. Si ocurriera anafilaxia u otra reacción de hipersensibilidad, detenga la administración de ACTEMRA inmediatamente y suspenda ACTEMRA permanentemente. No administre ACTEMRA a pacientes con hipersensibilidad conocida a ACTEMRA [consulte Contraindicaciones (4) y Reacciones adversas (6)]. 5.6 Trastornos desmielinizantes Se desconoce el impacto del tratamiento con ACTEMRA sobre los trastornos desmielinizantes, pero raramente se informó sobre esclerosis múltiple y polineuropatía desmielinizante inflamatoria crónica en estudios clínicos de RA. Vigile a los pacientes para ver signos y síntomas potencialmente indicativos de trastornos desmielinizantes. Quienes recetan deben ser cautos al considerar el uso de ACTEMRA en los pacientes con trastornos desmielinizantes preexistentes o de inicio reciente. 11 5.7 Enfermedad hepática activa e insuficiencia hepática No se recomienda el tratamiento con ACTEMRA en los pacientes con enfermedad hepática activa o insuficiencia hepática [consulte Reacciones adversas (6.1), Uso en poblaciones específicas (8.6)]. 5.8 Vacunaciones Evite el uso de vacunas vivas concurrentemente con ACTEMRA ya que no se ha establecido la seguridad clínica. No se dispone de datos sobre la trasmisión secundaria de infección de personas que reciben vacunas vivas a los pacientes que reciben ACTEMRA. No se dispone de datos sobre la eficacia de la vacunación en los pacientes que reciben ACTEMRA. Debido a que la inhibición de IL-6 puede interferir con las respuestas inmunitarias normales a nuevos antígenas, se recomienda que todos los pacientes, particularmente los pacientes con PJIA y SJIA, si fuera posible, se actualicen con todas las inmunizaciones de acuerdo con las pautas de inmunización actuales antes de iniciar la terapia con ACTEMRA. El intervalo entre las vacunaciones vivas y el inicio de la terapia con ACTEMRA debe hacerse según las pautas de vacunación actuales respecto a los agentes inmunosupresores. 6 REACCIONES ADVERSAS Debido a que los estudios clínicos se realizan bajo condiciones ampliamente variables, las tasas de reacción adversa observadas en los estudios clínicos de un medicamento no pueden ser directamente comparadas con las tasas en los estudios clínicos de otro medicamento, no pudiendo predecir las tasas observadas en una población más amplia de pacientes en la práctica clínica. 6.1 Experiencia en estudios clínicos con los pacientes con Artritis reumatoide tratados con ACTEMRA intravenoso (ACTEMRA-IV) Los datos de ACTEMRA-IV en la artritis reumatoide (RA) incluyen 5 estudios de doble ciego, controlados y multicéntricos. En estos estudios, los pacientes recibieron dosis de ACTEMRA-IV de 8 mg por kg como monoterapia (288 pacientes), ACTEMRA-IV de 8 mg por kg en combinación con DMARD (incluyendo metotrexato) (1582 pacientes), o ACTEMRA-IV de 4 mg por kg en combinación con metotrexato (774 pacientes). La población de exposición total incluye a todos los pacientes en los estudios de registro que recibieron al menos una dosis de ACTEMRA-IV. De los 4009 pacientes en esta población, 3577 recibieron tratamiento durante al menos 6 meses, 3309 durante al menos un año; 2954 recibieron tratamiento durante al menos 2 años y 2189 durante 3 años. Todos los pacientes en estos estudios tenían artritis reumatoide activa de moderada a severa. La población del estudio tenía una edad promedio de 52 años, 82% era de sexo femenino y 74% era caucásica. Las reacciones adversas graves más comunes fueron infecciones graves [consulte Advertencias y precauciones (5.1)]. Las reacciones adversas más comúnmente informadas en los estudios controlados hasta 24 semanas (que ocurrieron en al menos 5% de los pacientes tratados con ACTEMRA-IV como monoterapia o en combinación con DMARD) fueron infecciones del tracto respiratorio superior, nasofaringitis, cefalea, hipertensión y aumento de la ALT. La proporción de los pacientes que suspendieron el tratamiento debido a reacciones adversas durante los estudios de doble ciego, controlados por placebo fue del 5% para los pacientes que recibían ACTEMRA-IV y el 3% para los pacientes tratados con placebo. Las reacciones adversas más comunes que requirieron la suspensión de ACTEMRA-IV fueron el aumento de los valores de las transaminasas hepáticas (por requisito del protocolo) e infecciones graves. Infecciones generales En los estudios clínicos controlados de 24 semanas, la tasa de infecciones en el grupo de ACTEMRA-IV como monoterapia fue de 119 eventos por 100 paciente-años y fue similar en el grupo de metotrexato como monoterapia. La tasa de infecciones en los grupos de 4 mg por kg y 8 mg por kg ACTEMRA-IV más DMARD 12 fue de 133 y 127 eventos por 100 paciente-años, respectivamente, comparada con 112 eventos por 100 pacienteaños en el grupo de placebo más DMARD. Las infecciones más comúnmente informadas (5% a 8% de los pacientes) fueron infecciones del tracto respiratorio superior y nasofaringitis. La tasa general de infecciones con ACTEMRA-IV en la población de exposición total permaneció coherente con las tasas en los períodos controlados de los estudios. Infecciones graves En los estudios clínicos controlados de 24 semanas, la tasa de infecciones graves en el grupo de ACTEMRA-IV como monoterapia fue de 3.6 por 100 paciente-años comparada con 1.5 por 100 paciente-años en el grupo con metotrexato. La tasa de infecciones graves en los grupos de 4 mg por kg y 8 mg por kg ACTEMRA-IV más DMARD fue de 4.4 y 5.3 eventos por 100 paciente-años, respectivamente, comparada con 3.9 eventos por 100 paciente-años en el grupo de placebo más DMARD. En la población de exposición total, la tasa general de infecciones graves permaneció coherente con las tasas en los períodos controlados de los estudios. Las infecciones graves más comunes incluyeron neumonía, infección del tracto urinario, celulitis, herpes zoster, gastroenteritis, diverticulitis, sepsia y artritis bacteriana. Se han informado casos de infecciones oportunistas [consulte Advertencias y precauciones (5.1)]. Perforaciones gastrointestinales En los estudios clínicos controlados de 24 semanas, la tasa general de perforación gastrointestinal fue de 0.26 eventos por 100 paciente-años con la terapia con ACTEMRA-IV. En la población de exposición total, la tasa general de perforación gastrointestinal permaneció coherente con las tasas en los períodos controlados de los estudios. Los informes de perforación gastrointestinal fueron principalmente informados como complicaciones de diverticulitis incluyendo peritonitis purulenta generalizada, perforación GI baja, fístula y absceso. La mayoría de los pacientes que desarrolló perforaciones gastrointestinales estaba recibiendo medicamentos antiinflamatorios no esteroides concomitantes (NSAID), corticosteroides, o metotrexato [consulte Advertencias y precauciones (5.2)]. Se desconoce la contribución relativa de estos medicamentos concomitantes comparada con ACTEMRA-IV para el desarrollo de perforaciones GI. Reacciones a la infusión En los estudios clínicos controlados de 24 semanas, se informaron eventos adversos asociados con la infusión (que ocurrieron durante o dentro de las 24 horas del inicio de la infusión) en 8% y 7% de los pacientes en los grupos de 4 mg por kg y 8 mg por kg ACTEMRA-IV más DMARD, respectivamente, comparada con 5% de los pacientes en el grupo de placebo más DMARD. El evento reportado más frecuentemente en las dosis de 4 mg por kg y 8 mg por kg durante la infusión fue hipertensión (1% para ambas dosis), mientras que los eventos reportados más frecuentemente que ocurrieron dentro de las 24 horas de finalizar una infusión fueron cefalea (1% para ambas dosis) y reacciones de la piel (1% para ambas dosis), incluyendo erupción, prurito y urticaria. Estos eventos no limitaron el tratamiento. Anafilaxia Se informaron reacciones de hipersensibilidad que requirieron la suspensión del tratamiento, incluyendo anafilaxia, asociadas con ACTEMRA-IV en 0.1% (3 de 2644) en los estudios controlados de 24 semanas y en 0.2% (8 de 4009) de la población de exposición total. Generalmente estas reacciones fueron observadas durante la segunda a cuarta infusión de ACTEMRA-IV. Debe disponerse de tratamiento médico adecuado para el uso inmediato en caso de una reacción grave de hipersensibilidad [consulte Advertencias y precauciones (5.5)]. Anormalidades de laboratorio Neutropenia En los estudios clínicos controlados de 24 semanas, ocurrieron disminuciones en los recuentos de neutrófilos por debajo de 1000 por mm3 en 1.8% y 3.4% de los pacientes en los grupos de 4 mg por kg y 8 mg por kg ACTEMRA-IV más DMARD, respectivamente, comparadas con 0.1% de los pacientes en el grupo de placebo 13 más DMARD. Aproximadamente la mitad de las instancias de ANC por debajo de 1000 por mm3 ocurrió dentro de las 8 semanas del inicio de la terapia. Las disminuciones en los recuentos de neutrófilos por debajo de 500 por mm3 ocurrieron en 0.4% y 0.3% de los pacientes en los grupos de 4 mg por kg y 8 mg por kg ACTEMRAIV más DMARD, respectivamente, comparadas con 0.1% de los pacientes en el grupo de placebo más DMARD. No hubo una relación clara entre las disminuciones de los neutrófilos por debajo de 1000 por mm3 y la ocurrencia de infecciones graves. En la población de exposición total, el patrón de incidencia de las disminuciones de los recuentos de neutrófilos permaneció coherente con lo visto en los estudios clínicos controlados de 24 semanas [consulte Advertencias y precauciones (5.3)]. Trombocitopenia En los estudios clínicos controlados de 24 semanas, las disminuciones en los recuentos de plaquetas por debajo de 100,000 por mm3 ocurrieron en 1.3% y 1.7% de los pacientes con 4 mg por kg y 8 mg por kg ACTEMRA-IV más DMARD, respectivamente, comparadas con 0.5% de los pacientes con placebo más DMARD, sin eventos de sangrado asociados. En la población de exposición total, el patrón de incidencia de las disminuciones de los recuentos de plaquetas permaneció coherente con lo visto en los estudios clínicos controlados de 24 semanas [consulte Advertencias y precauciones (5.3)]. Enzimas hepáticas elevadas En la Tabla 1 se resumen las anormalidades en las enzimas hepáticas. En los pacientes que experimentaron elevación de las enzimas hepáticas, la modificación del régimen de tratamiento, tal como la reducción de la dosis de DMARD concomitante, la interrupción de ACTEMRA-IV, o la reducción de la dosis de ACTEMRAIV, dio como resultado una disminución o normalización de las enzimas hepáticas [consulte Posología y administración (2.5)]. Estas elevaciones no estuvieron asociadas con aumentos clínicamente relevantes en la bilirrubina directa, ni estuvieron asociados con evidencia clínica de hepatitis o insuficiencia hepática [consulte Advertencias y precauciones (5.3)]. Tabla 1 Incidencia de anormalidades de la enzima hepática en el período controlado de 24 semanas de los Estudios I a V* ACTEMRA 8 mg por kg MONOTERAPIA Metotrexato ACTEMRA 4 mg por kg + DMARD ACTEMRA 8 mg por kg + DMARD Placebo + DMARD N = 288 (%) N = 284 (%) N = 774 (%) N = 1582 (%) N = 1170 (%) 34 1 0.1 41 2 0.2 17 0.3 < 0.1 45 5 1.3 48 5 1.5 23 1 0.3 AST (U/L) > ULN a 3x ULN 22 26 > 3x ULN a 5x ULN 0.3 2 > 5x ULN 0.7 0.4 ALT (U/L) > ULN a 3x ULN 36 33 > 3x ULN a 5x ULN 1 4 > 5x ULN 0.7 1 ULN = Límite superior a lo normal *Para una descripción de estos estudios, consulte la Sección 14, Estudios clínicos. En la población de exposición total, las elevaciones en ALT y AST permanecieron coherentes con lo visto en los estudios clínicos controlados de 24 semanas Lípidos Las elevaciones en los parámetros de lípidos (colesterol total, LDL, HDL, triglicéridos) fueron evaluadas por primera vez a las 6 semanas luego del inicio de ACTEMRA-IV en los estudios clínicos controlados de 24 semanas. Se observaron aumentos en este punto temporal, los que permanecieron estables a partir de allí. Se 14 observaron raramente aumentos en los triglicéridos a niveles por encima de 500 mg por dl. Se evaluaron los cambios en otros parámetros de lípidos desde el inicio hasta la semana 24, los cuales se resumen a continuación: – El LDL medio aumentó 13 mg por dl en el grupo con ACTEMRA 4 mg por kg+DMARD, 20 mg por dl en el grupo con ACTEMRA 8 mg por kg+DMARD y 25 mg por dl en el grupo con ACTEMRA 8 mg por kg como monoterapia. – El HDL medio aumentó 3 mg por dl en el grupo con ACTEMRA 4 mg por kg+DMARD, 5 mg por dl en el grupo con ACTEMRA 8 mg por kg+DMARD y 4 mg por dl en el grupo con ACTEMRA 8 mg por kg como monoterapia. – La proporción de LDL/HDL media aumentó un promedio de 0.14 en el grupo con ACTEMRA 4 mg por kg+DMARD, 0.15 en el grupo con ACTEMRA 8 mg por kg+DMARD y 0.26 en el grupo con ACTEMRA 8 mg por kg como monoterapia. – Las proporciones de ApoB/ApoA1 no cambiaron esencialmente en los pacientes tratados con ACTEMRA. Los lípidos elevados respondieron a los agentes de disminución de lípidos. En la población de exposición total, las elevaciones en los parámetros de lípidos permanecieron coherentes con lo visto en los estudios clínicos controlados de 24 semanas. Inmunogenicidad En los estudios clínicos controlados de 24 semanas, se ha evaluado un total de 2876 pacientes por anticuerpos anti-tocilizumab. Cuarenta y seis pacientes (2%) desarrollaron anticuerpos positivos a anti-tocilizumab, de los cuales 5 tuvieron una reacción de hipersensibilidad asociada, médicamente significativa, que llevó al retiro. Treinta pacientes (1%) desarrollaron anticuerpos neutralizantes. Los datos reflejan el porcentaje de los pacientes cuyos resultados de pruebas fueron positivos para anticuerpos a tocilizumab en ensayos específicos. La incidencia observada de positividad en los anticuerpos en un ensayo depende altamente de varios factores, incluyendo la sensibilidad y especificidad del ensayo, metodología del ensayo, manejo de la muestra, momento de la recolección de muestras, medicamentos concomitantes y enfermedad subyacente. Por estos motivos, la comparación de la incidencia de anticuerpos a tocilizumab con la incidencia de anticuerpos a otros productos puede ser engañosa. Neoplasias Durante el período controlado de 24 semanas de los estudios, se diagnosticaron 15 neoplasias en los pacientes que recibieron ACTEMRA-IV, comparadas con 8 neoplasias en los pacientes en los grupos de control. La incidencia ajustada a la exposición fue similar en los grupos con ACTEMRA-IV (1.32 eventos por 100 paciente-años) y en el grupo con placebo más DMARD (1.37 eventos por 100 paciente-años). En la población de exposición total, la tasa de neoplasias permaneció coherente con la tasa observada en el período controlado de 24 semanas [consulte Advertencias y precauciones (5.4)]. Otras reacciones adversas En la Tabla 2 se resumen las reacciones adversas que ocurrieron en 2% o más de los pacientes con 4 u 8 mg por kg ACTEMRA-IV más DMARD y al menos en el 1% mayor que el observado en pacientes con placebo más DMARD. Tabla 2 Término preferido Reacciones adversas que ocurrieron en al menos 2% o más de los pacientes con 4 u 8 mg por kg de ACTEMRA más DMARD y al menos en el 1% mayor que el observado en los pacientes con placebo más DMARD Población del estudio controlado en la fase 3 de 24 semanas ACTEMRA Metotrexato ACTEMRA ACTEMRA 8 mg por kg 4 mg por kg + 8 mg por kg + MONOTERAPIA DMARD DMARD Placebo + DMARD 15 Infección del tracto respiratorio superior Nasofaringitis Cefalea Hipertensión Aumento de la ALT Mareos Bronquitis Erupción Ulceración bucal Dolor abdominal superior Gastritis Aumento de la transaminasa N = 288 (%) N = 284 (%) N = 774 (%) N = 1582 (%) N = 1170 (%) 7 5 6 8 6 7 7 6 6 3 3 2 2 2 1 1 6 2 2 4 1 2 1 2 2 2 5 4 6 4 3 2 4 4 1 3 1 2 6 5 4 3 3 3 3 2 3 2 2 4 3 3 1 2 3 1 1 2 1 1 Otras reacciones adversas infrecuentes y médicamente relevantes que ocurrieron con una incidencia menor al 2% en los pacientes con artritis reumatoide tratados con ACTEMRA-IV en los ensayos controlados fueron: Infecciones e infestaciones: herpes oral simple Trastornos gastrointestinales: estomatitis, úlcera gástrica Investigaciones: aumento de peso, aumento de la bilirrubina total Trastornos sanguíneos y del sistema linfático: leucopenia Trastornos generales y condiciones de los sitios de administración: edema periférico Trastornos respiratorios, torácicos y mediastínicos: disnea, tos Trastornos oculares: conjuntivitis Trastornos renales: nefrolitiasis Trastornos endocrinos: hipotiroidismo 6.2 Experiencia en estudios clínicos en los pacientes con Artritis reumatoide tratados con ACTEMRA subcutáneo (ACTEMRA-SC) Los datos de ACTEMRA-SC en la artritis reumatoide (RA) incluyen 2 estudios de doble ciego, controlados y metacéntricos. El estudio SC-I fue un estudio de no inferioridad que comparó la eficacia y seguridad de tocilizumab 162 mg administrado cada semana por vía subcutánea (SC) y 8 mg/kg por vía intravenosa (IV) cada cuatro semanas en 1262 sujetos adultos con artritis reumatoide. El estudio SC-II fue un estudio de superioridad controlado con placebo que evaluó la seguridad y eficacia de tocilizumab 162 mg administrado semana por medio SC o placebo en 656 pacientes. Todos los pacientes en ambos estudios recibieron DMARD no biológicos de fondo. La seguridad observada para ACTEMRA administrado por vía subcutánea fue coherente con el perfil de seguridad conocido de ACTEMRA intravenoso, con la excepción de las reacciones en el sitio de la inyección, que fueron más comunes con ACTEMRA-SC comparadas con las inyecciones de placebo SC (grupo IV). Reacciones en el sitio de la inyección En el período de control de 6 meses, en SC-I, la frecuencia de las reacciones en el sitio de la inyección fue de 10.1% (64/631) y 2.4% (15/631) para los grupos semanales de ACTEMRA-SC y placebo SC (grupo IV), respectivamente. En SC-II, la frecuencia de las reacciones en el sitio de la inyección fue de 7.1% (31/437) y 4.1% (9/218) para los grupos de semana por medio de ACTEMRA SC y placebo, respectivamente. Estas reacciones en el sitio de la inyección (incluyendo eritema, prurito, dolor y hematoma) fueron de leves a moderadas en severidad. La mayoría se resolvió sin ningún tratamiento y ninguna necesitó suspender el medicamento. 16 Inmunogenicidad En el período de control de 6 meses en SC-I, 0.8% (5/625) en el grupo con ACTEMRA-SC y 0.8% (5/627) en el grupo IV desarrollaron anticuerpos anti-tocilizumab; de estos, todos desarrollaron anticuerpos neutralizantes. En SC-II, 1.6% (7/434) en el grupo con ACTEMRA-SC comparados con 1.4 % (3/217) en el grupo con placebo desarrollaron anticuerpos anti-tocilizumab; de estos, 1.4% (6/434) en el grupo con ACTEMRA-SC y 0.5% (1/217) en el grupo con placebo también desarrollaron anticuerpos neutralizantes. Se ha evaluado un total de 1454 (> 99%) pacientes que recibieron ACTEMRA-SC en el grupo de exposición total para detectar anticuerpos anti-tocilizumab. Trece pacientes (0.9%) desarrollaron anticuerpos antitocilizumab, y de estos, 12 pacientes (0.8%) desarrollaron anticuerpos neutralizantes. La tasa es coherente con la experiencia intravenosa previa. No se observó correlación entre el desarrollo de anticuerpos y los eventos adversos o pérdida de la respuesta clínica. Anormalidades de laboratorio Neutropenia Durante el monitoreo de laboratorio de rutina de los estudios clínicos controlados de 6 meses, ocurrió una disminución en el recuento de neutrófilos por debajo de 1 × 109/l en 2.9% y 3.7% de los pacientes que recibieron ACTEMRA-SC semanalmente y semana por medio, respectivamente. No hubo una relación clara entre las disminuciones en los neutrófilos por debajo de 1 x 109/l y la ocurrencia de infecciones graves. Trombocitopenia Durante el monitoreo de laboratorio de rutina de los estudios clínicos controlados de 6 meses de ACTEMRASC, ninguno de los pacientes tuvo una disminución en el recuento de plaquetas a ≤ 50 × 103/mcl. Enzimas hepáticas elevadas Durante el monitoreo de laboratorio de rutina de los estudios clínicos controlados de 6 meses, ocurrió elevación de ALT o AST ≥ 3 x ULN en 6.5% y 1.4% de los pacientes, respectivamente, en los que recibieron ACTEMRA-SC semanalmente y 3.4% y 0.7% en los que recibieron ACTEMRA-SC semana por medio. Lípidos Durante el monitoreo de laboratorio de rutina de los estudios clínicos de 6 meses de ACTEMRA-SC, 19% de los pacientes con dosis semanales, 19.6% de los pacientes con dosis semana por medio y 10.2% de los pacientes con placebo experimentaron elevaciones sostenidas en el colesterol total > 6.2 mmol/l (240 mg/dl), con 9%, 10.4% y 5.1% que experimentaron un aumento sostenido en el LDL a 4.1 mmol/l (160 mg/dl) en los que recibieron ACTEMRA-SC semanalmente, semana por medio y placebo, respectivamente. 6.3 Experiencia en estudios clínicos en pacientes con Artritis idiopática juvenil poliarticular tratados con ACTEMRA intravenoso (ACTEMRA-IV) Se estudió la seguridad de ACTEMRA-IV en 188 pacientes pediátricos de 2 a 17 años de edad con PJIA que tuvieron una respuesta clínica inadecuada o fueron intolerantes al metotrexato. La exposición total de los pacientes en la población de exposición total de ACTEMRA-IV (definida como pacientes que recibieron al menos una dosis de ACTEMRA-IV) fue de 184.4 paciente-años. Al inicio, aproximadamente la mitad de los pacientes estaba tomando corticosteroides orales y casi el 80% estaba tomado metotrexato. En general, los tipos de reacciones farmacológicas adversas en los pacientes con PJIA fueron coherentes con aquellos vistos en los pacientes con RA y SJIA [consulte Reacciones adversas (6.1 y 6.4)]. 17 Infecciones La tasa de infecciones en la población de exposición total de ACTEMRA-IV fue de 163.7 por 100 pacienteaños. Los eventos más comunes observados fueron nasofaringitis e infecciones del tracto respiratorio superior. La tasa de infecciones graves fue numéricamente mayor en los pacientes que pesaban menos de 30 kg tratados con 10 mg/kg de tocilizumab (12.2 por 100 paciente-años) comparados con los pacientes que pesaban 30 kg o más, tratados con 8 mg/kg de tocilizumab (4.0 por 100 paciente-años). La incidencia de infecciones que llevaron a interrupciones de la dosis también fue numéricamente mayor en los pacientes que pesaban menos de 30 kg tratados con 10 mg/kg de tocilizumab (21%) comparados con los pacientes que pesaban 30 kg o más, tratados con 8 mg/kg de tocilizumab (8%). Reacciones a la infusión En los pacientes con PJIA, las reacciones relacionadas con la infusión se definen como todos los eventos que ocurrieron durante o dentro de las 24 horas de una infusión. En la población de exposición total de ACTEMRAIV, 11 pacientes (6%) experimentaron un evento durante la infusión y 38 pacientes (20.2%) experimentaron un evento dentro de las 24 horas de una infusión. Los eventos más comunes que ocurrieron durante la infusión fueron cefalea, náuseas e hipotensión y los que ocurrieron dentro de las 24 horas de la infusión fueron mareos e hipotensión. En general, las reacciones farmacológicas adversas observadas durante o dentro de las 24 horas de una infusión fueron de naturaleza similar a aquellas vistas en los pacientes con RA y SJIA [consulte Reacciones adversas (6.1 y 6.4)]. No se informaron reacciones de hipersensibilidad clínicamente significativa asociadas con tocilizumab que requirieran la suspensión del tratamiento. Inmunogenicidad Un paciente, en el grupo de 10 mg/kg de menos de 30 kg, desarrolló anticuerpos positivos a anti-tocilizumab sin desarrollar una reacción de hipersensibilidad y subsecuentemente se retiró del estudio. Anormalidades de laboratorio Neutropenia Durante el monitoreo de laboratorio de rutina en la población de exposición total de ACTEMRA-IV, ocurrió una disminución en los recuentos de neutrófilos por debajo de 1 × 109 por l en 3.7% de los pacientes. No hubo una relación clara entre las disminuciones en los neutrófilos por debajo de 1 x 109 por l y la ocurrencia de infecciones graves. Trombocitopenia Durante el monitoreo de laboratorio de rutina en la población de exposición total de ACTEMRA-IV, 1% de los pacientes tuvo una disminución en el recuento de plaquetas de 50 × 103 por mcl o menor sin eventos de sangrado asociados. Enzimas hepáticas elevadas Durante el monitoreo de laboratorio de rutina en la población de exposición total de ACTEMRA-IV, ocurrió la elevación en ALT o AST de 3 x ULN o mayor en 4% y menos del 1% de los pacientes, respectivamente. Lípidos Durante el monitoreo de laboratorio de rutina en la población de exposición total de tocilizumab, ocurrió la elevación en el colesterol total mayor de 1.5-2 x ULN en un paciente (0.5%) y la elevación en el LDL mayor de 1.5-2 x ULN en un paciente (0.5%). 18 6.4 Experiencia en estudios clínicos en pacientes con Artritis idiopática juvenil sistémica tratados con ACTEMRA intravenoso (ACTEMRA-IV) Los datos descritos a continuación reflejan la exposición a ACTEMRA-IV en un estudio aleatorizado, doble ciego, controlado con placebo, de 112 pacientes pediátricos de 2 a 17 años de edad con SJIA que tuvieron una respuesta clínica inadecuada a medicamentos antiinflamatorios no esteroides (NSAID) o corticosteroides debido a toxicidad o falta de eficacia. Al inicio, aproximadamente la mitad de los pacientes estaba tomando 0.3 mg/kg/día o más de corticosteroides y casi 70% estaba tomando metotrexato. El ensayo incluyó una fase controlada de 12 semanas seguida por una extensión de etiqueta abierta. En la porción doble ciega, controlada de 12 semanas del estudio clínico, 75 pacientes recibieron tratamiento con ACTEMRA-IV (8 o 12 mg por kg basado en el peso corporal). Luego de 12 semanas o en el momento del escape, debido al empeoramiento de la enfermedad, los pacientes fueron tratados con ACTEMRA-IV en la fase de extensión de etiqueta abierta. Los eventos adversos más comunes (al menos 5%) vistos en los pacientes tratados con ACTEMRA-IV en la porción controlada de 12 semanas del estudio fueron: infección del tracto respiratorio superior, cefalea, nasofaringitis y diarrea. Infecciones En la fase controlada de 12 semanas, la tasa de todas las infecciones en el grupo de ACTEMRA-IV fue de 345 por 100 paciente-años y 287 por 100 paciente-años en el grupo con placebo. En la extensión de etiqueta abierta con una duración promedio de 73 semanas de tratamiento, la tasa general de infecciones fue de 304 por 100 paciente-años. En la fase controlada de 12 semanas, la tasa de infecciones graves en el grupo de ACTEMRA-IV fue de 11.5 por 100 paciente-años. En la extensión de etiqueta abierta con una duración promedio de 73 semanas de tratamiento, la tasa general de infecciones graves fue de 11.4 por 100 paciente-años. Las infecciones graves más comúnmente informadas incluyeron neumonía, gastroenteritis, varicela y otitis media. Síndrome de activación de macrófagos En el estudio controlado de 12 semanas, ningún paciente en cualquier grupo de tratamiento experimentó síndrome de activación de macrófagos (MAS) mientras recibía el tratamiento asignado; 3 de 112 (3%) desarrollaron MAS durante el tratamiento de etiqueta abierta con ACTEMRA-IV. Un paciente en el grupo con placebo escapó a ACTEMRA-IV 12 mg por kg en la Semana 2 debido a actividad severa de la enfermedad y finalmente desarrolló MAS en el Día 70. Dos pacientes adicionales desarrollaron MAS durante la extensión a largo plazo. En los 3 pacientes se interrumpió la dosis de ACTEMRA-IV (2 pacientes) o se suspendió (1 paciente) por un evento de MAS, recibieron tratamiento y el MAS se resolvió sin secuelas. Basada en el número limitado de casos, la incidencia de MAS no parece estar elevada en la experiencia de desarrollo clínico de SJIA con ACTEMRA-IV; sin embargo no se han sacado conclusiones definitivas. Reacciones a la infusión Los pacientes no fueron pre medicados, sin embargo la mayoría de los pacientes estaba en corticosteroides concomitantes como parte de su tratamiento de fondo para SJIA. Las reacciones relacionadas con la infusión fueron definidas como todos los eventos que ocurrieron durante o dentro de las 24 horas posteriores a la infusión. En la fase controlada de 12 semanas, 4% de los pacientes tratados con ACTEMRA-IV y 0% de los de placebo experimentaron eventos que ocurrieron durante la infusión. Un evento (angioedema) fue considerado serio y con riesgo de vida, siendo el paciente suspendido del tratamiento del estudio. Dentro de las 24 horas posteriores a la infusión, 16% de los pacientes en el grupo de tratamiento con ACTEMRA-IV y 5% de los pacientes en el grupo con placebo experimentaron un evento. En el grupo con ACTEMRA-IV los eventos incluyeron erupción, urticaria, diarrea, malestar epigástrico, artralgia y cefalea. Uno de estos eventos, la urticaria, se consideró grave. 19 Anafilaxia Se informó sobre anafilaxia en 1 de 112 pacientes (menos que el 1%) tratados con ACTEMRA-IV durante el estudio controlado y la extensión de etiqueta abierta [consulte Advertencias y precauciones (5.5)]. Inmunogenicidad Se evaluó a los 112 pacientes por anticuerpos anti-tocilizumab al inicio. Dos pacientes desarrollaron anticuerpos positivos para anti-tocilizumab: uno de esos pacientes experimentó eventos adversos graves de urticaria y angioedema consistentes con una reacción anafiláctica que llevó al retiro; el otro paciente desarrolló síndrome de activación de macrófagos mientras se encontraba con terapia de escape, siendo suspendido del estudio. Anormalidades de laboratorio Neutropenia Durante el monitoreo de rutina en la fase controlada de 12 semanas, ocurrió una disminución en los neutrófilos por debajo de 1 × 109 por l en 7% de los pacientes en el grupo con ACTEMRA-IV, y en ningún paciente en el grupo con placebo. En la extensión de etiqueta abierta, sobre una duración promedio de 73 semanas de tratamiento, ocurrió una disminución en el recuento de neutrófilos en 17% del grupo con ACTEMRA-IV. No hubo una relación clara entre la disminución en los neutrófilos por debajo de 1 x 109 por l y la ocurrencia de infecciones graves. Trombocitopenia Durante el monitoreo de rutina en la fase controlada de 12 semanas, 1% de los pacientes en el grupo con ACTEMRA-IV y 3% en el grupo con placebo tuvo una disminución del recuento de plaquetas a no más de 100 × 103 por mcl. En la extensión de etiqueta abierta, sobre una duración promedio de 73 semanas de tratamiento, ocurrió disminución del recuento de plaquetas en 4% de los pacientes en el grupo con ACTEMRA-IV, sin sangrado asociado. Enzimas hepáticas elevadas Durante el monitoreo de laboratorio de rutina en la fase controlada de 12 semanas, ocurrió elevación en ALT o AST a 3x ULN o mayor en 5% y 3% de los pacientes, respectivamente en el grupo con ACTEMRA-IV y en 0% de los pacientes con placebo. En la extensión de etiqueta abierta, sobre una duración promedio de 73 semanas de tratamiento, ocurrió elevación en ALT o AST a 3x ULN o mayor en 13% y 5% de los pacientes tratados con ACTEMRA-IV, respectivamente. Lípidos Durante el monitoreo de laboratorio de rutina en la fase controlada de 12 semanas, ocurrió elevación del colesterol total mayor que 1.5x ULN – 2x ULN en 1.5% en el grupo con ACTEMRA-IV y 0% en los pacientes con placebo. Ocurrió elevación en el LDL mayor que el 1.5x ULN – 2x ULN en 1.9% de los pacientes en el grupo con ACTEMRA-IV y 0% del grupo con placebo. En la extensión de etiqueta abierta, sobre una duración promedio de 73 semanas de tratamiento, el patrón y la incidencia de elevaciones en los parámetros de lípidos permanecieron coherentes con los datos del estudio controlado de 12 semanas. 6.5 Experiencia de postmercadeo Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de ACTEMRA intravenoso. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera fiable su frecuencia o establecer una relación causal con la exposición al medicamento. 20 • Anafilaxia fatal [consulte Advertencias y precauciones (5.5)] • Síndrome de Stevens-Johnson 7 INTERACCIONES FARMACOLÓGICAS 7.1 Otros medicamentos para el tratamiento de la Artritis reumatoide El análisis farmacocinética de la población no detectó ningún efecto del metotrexato (MTX), medicamentos antiinflamatorios no esteroides o corticosteroides sobre la depuración del tocilizumab. La administración concomitante de una dosis intravenosa única de 10 mg por kg de ACTEMRA con 10-25 mg de MTX una vez por semana no tuvo efecto clínico significativo sobre la exposición al MTX. ACTEMRA no ha sido estudiado en combinación con DMARD biológicos tales como los antagonistas de TNF [consulte Posología y administración (2.1)]. 7.2 Interacciones con los sustratos de CYP450 Los citocromos P450 en el hígado están disminuidos por estímulos de infección e inflamación incluyendo a las citocinas tales como la IL-6. La inhibición de la señalización de IL-6 en los pacientes con RA tratados con tocilizumab puede restaurar las actividades de CYP450 a niveles más altos que aquellos en la ausencia de tocilizumab llevando al aumento del metabolismo de medicamentos que son sustratos de CYP450. Los estudios in vitro mostraron que tocilizumab tiene el potencial de afectar la expresión de múltiples enzimas de CYP incluyendo CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D6 y CYP3A4. Se desconocen sus efectos sobre CYP2C8 o los transportadores. Los estudios in vivo con omeprazole, metabolizados por CYP2C19 y CYP3A4, y simvastatina, metabolizada por CYP3A4, mostraron hasta 28% y 57% de disminución en la exposición una semana después de una dosis única de ACTEMRA, respectivamente. El efecto de tocilizumab sobre las enzimas de CYP puede ser clínicamente relevante para los sustratos de CYP450 con índice terapéutico estrecho, donde la dosis se ajusta individualmente. Al iniciar o suspender ACTEMRA, en los pacientes tratados con estos tipos de productos medicinales, realice el monitoreo terapéutico del efecto (por ej., warfarina) o la concentración del medicamento (por ej., ciclosporina o teofilina) y ajuste la dosis individual del producto medicinal según sea necesario. Tenga precaución al coadministrar ACTEMRA con sustratos de CYP3A4 donde la disminución de la eficacia es indeseable, por ej., anticonceptivos orales, lovastatina, atorvastatina, etc. El efecto de tocilizumab sobre la actividad de la enzima CYP450 puede persistir durante varias semanas luego de suspender la terapia [consulte Farmacología clínica (12.3)]. 7.3 Vacunas vivas Evite el uso de vacunas vivas concurrentemente con ACTEMRA [consulte Advertencias y precauciones (5.8)]. 8 USO EN POBLACIONES ESPECÍFICAS 8.1 Embarazo Embarazo Categoría C. Registro de exposición al embarazo Existe un registro de exposición al embarazo que vigila los resultados del embarazo en mujeres expuestas a ACTEMRA durante el embarazo. Se alienta a los médicos a registrar a las pacientes y a las mujeres embarazadas a registrarse ellas mismas llamando al 1-877-311-8972. Resumen del riesgo No se han realizado estudios bien controlados con ACTEMRA en mujeres embarazadas. En los estudios de reproducción de animales, la administración de tocilizumab a monas cynomolgus durante la organogénesis causó aborto/muerte embriofetal a exposiciones de la dosis 1.25 veces la exposición a la dosis para humanos de 8 mg por kg cada 2 a 4 semanas. No ha sido establecida la incidencia de malformaciones y pérdida del 21 embarazo en embarazos humanos para ACTEMRA. Sin embargo, todos los embarazos, sin importar la exposición a medicamentos, tienen una tasa histórica de 2 a 4% para malformaciones importantes y 15 a 20% para pérdida del embarazo. ACTEMRA debe usarse en el embarazo solamente si el beneficio potencial justifica el riesgo potencial para el feto. Consideraciones clínicas En general, los anticuerpos monoclonales se transportan a través de la placenta de manera lineal a medida que progresa el embarazo, siendo la cantidad más grande transferida durante el tercer trimestre. Datos en animales Se realizó un estudio de toxicidad del desarrollo embriofetal en el cual monas cynomolgus preñadas fueron tratadas por vía intravenosa con tocilizumab (dosis diarias de 2, 10, o 50 mg por kg desde el día de gestación 20-50) durante la organogénesis. Aunque no hubo evidencia de un efecto teratogénico/dismorfogénico con ninguna dosis, tocilizumab produjo un aumento en la incidencia de aborto/muerte embriofetal con dosis de 10 mg por kg y 50 mg por kg (1.25 y 6.25 veces la dosis humana de 8 mg por kg cada 2 a 4 semanas basado en una comparación de mg por kg). La prueba de un análogo murino de tocilizumab en ratones no arrojó evidencia alguna de daño a la cría durante la fase de desarrollo pre y postnatal cuando se dosificó a 50 mg por kg por vía intravenosa con tratamiento cada tres días desde la implantación hasta el día 21 después del nacimiento (destete). No hubo evidencia de deterioro funcional alguno en el desarrollo y comportamiento, capacidad para aprender, la inmuno competencia y fertilidad de la cría. 8.3 Madres que amamantan Se desconoce si tocilizumab está presente en la leche humana o si sería absorbida sistemáticamente en un lactante después de la ingestión. La IgG se excreta en la leche humana y por ello se espera que tocilizumab pudiera estar presente en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana, y debido al potencial para reacciones adversas graves de ACTEMRA en los lactantes, debe tomarse una decisión si suspender el amamantamiento o suspender el medicamento, tomando en consideración la importancia del medicamento para la madre. 8.4 Uso pediátrico ACTEMRA para uso intravenoso está indicado para el tratamiento de pacientes pediátricos con: • • Artritis idiopática juvenil sistémica activa en pacientes a partir de los 2 años de edad Artritis idiopática juvenil poli articular activa en pacientes a partir de los 2 años de edad No se ha establecido la seguridad y eficacia de ACTEMRA en los pacientes pediátricos con afecciones que no sean PJIA o SJIA. No se ha estudiado a niños menores de 2 años. No se ha estudiado la administración SC en los pacientes pediátricos. La prueba del análogo murino de tocilizumab no produjo toxicidad en los ratones juveniles. En particular, no hubo deterioro del crecimiento esquelético, la función inmunitaria y la maduración sexual. 8.5 Uso geriátrico De los 2644 pacientes que recibieron ACTEMRA en los Estudios I a V [consulte Estudios clínicos (14)], un total de 435 pacientes con artritis reumatoide tenía 65 años de edad o mayores, incluyendo a 50 pacientes de 75 años o mayores. De los 1069 pacientes que recibieron ACTEMRA-SC en los estudios SC-I y SC-II había 295 pacientes de 65 años de edad o mayores, incluyendo 41 pacientes de 75 años o mayores. La frecuencia de infección grave entre los sujetos tratados con ACTEMRA de 65 años de edad o mayores fue mayor que los de menos de 65 años de edad. Ya que hay una incidencia más alta de infecciones en la población anciana en general, debe usarse precaución al tratar a los ancianos. 8.6 Insuficiencia hepática No se ha estudiado la seguridad y eficacia de ACTEMRA en los pacientes con insuficiencia hepática, incluyendo los pacientes con serología positiva para HBV y HCV [consulte Advertencias y precauciones (5.7)]. 22 8.7 Insuficiencia renal No se requiere ajuste de la dosis en los pacientes con insuficiencia renal leve. No se ha estudiado ACTEMRA en los pacientes con insuficiencia renal de moderada a severa [consulte Farmacología clínica (12.3)]. 9 ABUSO Y DEPENDENCIA A LAS DROGAS No se han realizado estudios sobre el potencial de ACTEMRA de causar dependencia. Sin embargo, no hay evidencia de los datos disponibles que el tratamiento con ACTEMRA cause dependencia. 10 SOBREDOSIS Se dispone de datos limitados sobre sobredosis con ACTEMRA. Se informó sobre un caso de sobredosis accidental con ACTEMRA intravenoso en el cual un paciente con mieloma múltiple recibió una dosis de 40 mg por kg. No se observaron reacciones adversas al medicamento. No se observaron reacciones adversas graves al medicamento en voluntarios sanos que recibieron dosis únicas de hasta 28 mg por kg, aunque los 5 pacientes a la dosis más alta de 28 mg por kg desarrollaron neutropenia limitante de la dosis. En caso de sobredosis, se recomienda que el paciente sea vigilado para ver signos y síntomas de reacciones adversas. Los pacientes que desarrollaron reacciones adversas debieran recibir tratamiento sintomático adecuado. 11 DESCRIPCIÓN ACTEMRA (tocilizumab) es un anticuerpo monoclonal receptor de la interleucina 6 antihumana humanizada recombinante (IL-6) de la subclase de inmunoglobulina IgG1κ (gamma 1, kappa) con una estructura polipeptídica H2L2 típica. Cada cadena liviana y cadena pesada consta de 214 y 448 aminoácidos, respectivamente. Las cuatro cadenas de polipéptidos están ligadas intra e intermolecularmente con enlaces disulfuro. ACTEMRA tiene un peso molecular de aproximadamente 148 kDa. ACTEMRA se presenta como una solución estéril sin preservativos para la infusión intravenosa (IV) infusión a una concentración de 20 mg por ml. ACTEMRA es un líquido incoloro a amarillo pálido, con un pH de alrededor de 6.5. Se dispone de ampollas de uso único para la administración intravenosa que contienen 80 mg por 4 ml, 200 mg por 10 ml o 400 mg por 20 ml de ACTEMRA. Las soluciones inyectables de ACTEMRA están formuladas en una solución acuosa que contiene dodecahidrato de fosfato disódico y dihidrógeno fosfato de sodio dihidrato (como un tampón de fosfato de 15 mmol por l), polisorbato 80 (0.5 mg por ml) y sucrosa (50 mg por ml). La solución de ACTEMRA para administración subcutánea se presenta como una solución líquida estéril, de incolora a amarillenta, sin preservativos de aproximadamente pH 6.0. Se presenta en una jeringa prellenada (PFS), de 1 ml, de uso único, lista para usar, con un dispositivo de seguridad para la aguja. Cada dispositivo administra 0.9 ml (162 mg) de ACTEMRA, en una solución tamponada de histidina compuesta por ACTEMRA (180 mg/ml), polisorbato 80, L-histidina y monoclorhidrato de L-histidina, L-arginina y clorhidrato de Larginina, L-metionina y agua para inyección. 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción Tocilizumab se liga específicamente tanto a los receptores IL-6 solubles como los ligados a la membrana (sIL6R y mIL-6R), habiéndose mostrado que inhibe la señalización mediada por IL-6 por medio de estos receptores. IL-6 es una citocina proinflamatoria pleiotrópica producida por una variedad de tipos celulares que incluyen a las células T y B, linfocitos, monocitos y fibroblastos. Se ha demostrado que IL-6 está involucrada en diversos procesos fisiológicos tales como la activación de células T, inducción de la secreción de inmunoglobulinas, iniciación de la síntesis de proteínas de fase aguda hepática y estimulación de la proliferación y diferenciación de la célula precursora hematopoyética. IL-6 también está producida por células endoteliales y sinoviales que llevan a la producción local de IL-6 en las articulaciones afectadas por procesos inflamatorios tales como la artritis reumatoide. 23 12.2 Farmacodinámica En estudios clínicos con las dosis de 4 mg por kg y 8 mg por kg IV o las dosis SC de 162 mg semanales y semana por medio de ACTEMRA, se vieron disminuciones en los niveles de proteína C reactiva (CRP) a dentro de los rangos normales ya desde la semana 2. Se observaron cambios en los parámetros farmacodinámicos (es decir, disminuciones en el factor reumatoide, tasa de sedimentación de los eritrocitos (ESR), amiloide sérico A y aumentos en la hemoglobina) con las dosis, sin embargo las mejorías más grandes se observaron con 8 mg por kg de ACTEMRA. También se observó que ocurrieron cambios farmacodinámicos después de la administración de ACTEMRA en los pacientes con PJIA y SJIA (disminuciones en CRP, ESR y aumentos en la hemoglobina). Se desconoce la relación entre estos hallazgos farmacodinámicos y la eficacia clínica. En sujetos sanos que recibieron ACTEMRA en dosis de 2 a 28 mg por kg por vía intravenosa y 81 a 162 mg por vía subcutánea, el recuento de neutrófilos absoluto disminuyó al nadir 3 a 5 días después de la administración de ACTEMRA. A partir de allí, los neutrófilos se recuperaron hacia el inicio de manera dependiente de la dosis. Los pacientes con artritis reumatoide demostraron un patrón similar en el recuento de neutrófilos absoluto después de la administración de ACTEMRA [consulte Advertencias y precauciones (5.3)]. 12.3 Farmacocinética Artritis reumatoide—Administración intravenosa La farmacocinética caracterizada en sujetos sanos y pacientes con RA sugiere que la PK es similar entre las dos poblaciones. La depuración (CL) de tocilizumab disminuyó con el aumento de las dosis. En la dosis única de 10 mg por kg en los pacientes con RA, la CL media fue de 0.29 ± 0.10 ml por hr. por kg y la terminal aparente media t1/2 fue de 151 ± 59 horas (6.3 días). La farmacocinética de tocilizumab fue determinada usando el análisis farmacocinético de una población de 1793 pacientes con artritis reumatoide tratados con ACTEMRA 4 y 8 mg por kg cada 4 semanas durante 24 semanas. Los parámetros farmacocinéticos de tocilizumab no cambiaron con el tiempo. Se observó un aumento más que proporcional para la dosis en el área bajo la curva (AUC) y la concentración mínima (Cmin) para las dosis de 4 y 8 mg por kg cada 4 semanas. La concentración máxima (Cmax) aumentó en proporción a la dosis. En el estado estacionario, el AUC y Cmin estimados fueron 2.7 y 6.5 veces mayores a 8 mg por kg comparados con 4 mg por kg, respectivamente. En un estudio a largo plazo con dosificación durante 104 semanas, la Cmin observada se sostuvo con el tiempo. Para las dosis de ACTEMRA 4 mg por kg administradas cada 4 semanas, las medias estimadas (± DE) del AUC, Cmin y Cmax en estado estacionario de tocilizumab fueron 13000 ± 5800 mcg•h por ml, 1.49 ± 2.13 mcg por ml y 88.3 ± 41.4 mcg por ml, respectivamente. Las proporciones de acumulación para AUC y Cmax fueron 1.11 y 1.02, respectivamente. La proporción de acumulación fue mayor para Cmin (1.96). El estado estacionario se alcanzó luego de la primera administración para Cmax y AUC, respectivamente y luego de 16 semanas para Cmin. Para las dosis de ACTEMRA 8 mg por kg administradas cada 4 semanas, las medias estimadas (± DE) del AUC, Cmin y Cmax en estado estacionario de tocilizumab fueron 35000 ± 15500 mcg•h por ml, 9.74 ± 10.5 mcg por ml y 183 ± 85.6 mcg por ml, respectivamente. Las proporciones de acumulación para AUC y Cmax fueron 1.22 y 1.06, respectivamente. La proporción de acumulación fue mayor para Cmin (2.35). El estado estacionario se alcanzó luego de la primera administración y después de las 8 y 20 semanas para Cmax, AUC y Cmin, respectivamente. El AUC, Cmin y Cmax de tocilizumab aumentó con el aumento de peso corporal. Al peso corporal de 100 kg o mayor, las medias estimadas (± DE) del AUC, Cmin y Cmax en estado estacionario de tocilizumab fueron 55500 ± 14100 mcg•h por ml, 19.0 ± 12.0 mcg por ml y 269 ± 57 mcg por ml, respectivamente, que son más altas que los valores de exposición media para la población de pacientes. Por ello, no se recomiendan las dosis de ACTEMRA que excedan los 800 mg por infusión [consulte Posología y administración (2.1)]. 24 Artritis reumatoide—Administración subcutánea La farmacocinética de tocilizumab se caracterizó usando el análisis farmacocinético de una población usando la base de datos compuesta de 1759 pacientes con artritis reumatoide tratados con 162 mg SC cada semana, 162 mg SC semana por medio y 8 mg/kg cada 4 semanas durante 24 semanas. Los parámetros farmacocinéticos de tocilizumab no cambiaron con el tiempo. Para la dosis de 162 mg cada semana, las medias estimadas (±DE) del AUC1semana, Cmin y Cmax en estado estacionario de tocilizumab fueron 8200 ± 3600 mcg•h/ml, 44.6 ± 20.6 mcg/ml, y 50.9 ± 21.8 mcg/ml, respectivamente. Las proporciones de acumulación para AUC, Cmin y Cmax fueron 6.83, 6.37 y 5.47, respectivamente. Se alcanzó el estado estacionario luego de 12 semanas para AUC, Cmin y Cmax. Para la dosis de 162 mg de semana por medio, las medias estimadas (±DE) del AUC2semanas, Cmin y Cmax en estado estacionario de tocilizumab fueron 3200 ± 2700 mcg•h/ml, 5.6 ± 7.0 mcg/ml y 12.3 ± 8.7 mcg/ml, respectivamente. Las proporciones de acumulación para AUC, Cmin y Cmax fueron 2.67, 5.6 y 2.12, respectivamente. Se alcanzó el estado estacionario luego de 12 semanas para AUC y Cmin y luego de 10 semanas para Cmax. Artritis idiopática juvenil poliarticular—Administración intravenosa La farmacocinética de tocilizumab se determinó usando el análisis farmacocinético de una población usando la base de datos compuesta de 188 pacientes con artritis idiopática juvenil poliarticular. Para las dosis de 8 mg/kg de tocilizumab (pacientes con un peso corporal de 30 kg o mayor) administradas cada 4 semanas, las medias estimadas (± DE) del AUC4semanas, Cmax y Cmin de tocilizumab fueron 29500 ± 8660 mcg•hr/ml, 182 ± 37 mcg/ml y 7.49 ± 8.2 mcg/ml, respectivamente. Para las dosis de 10 mg/kg de tocilizumab (pacientes con un peso corporal menor de 30 kg) administradas cada 4 semanas, las medias estimadas (± DE) del AUC4semanas, Cmax y Cmin de tocilizumab fueron 23200 ± 6100 mcg•hr/ml, 175 ± 32 mcg/ml y 2.35 ± 3.59 mcg/ml, respectivamente. Las proporciones de acumulación fueron 1.05 y 1.16 para AUC4semanas, 1.43 y 2.22 para Cmin para las dosis de 10 mg/kg (peso corporal menor de 30 kg) y 8 mg/kg (peso corporal de 30 kg o mayor), respectivamente. No se observó acumulación para Cmax. Artritis idiopática juvenil sistémica—Administración intravenosa La farmacocinética de tocilizumab se determinó usando el análisis farmacocinético de una población usando la base de datos compuesta de 75 pacientes con SJIA tratados con 8 mg por kg (pacientes con un peso corporal de 30 kg o mayor) o 12 mg por kg (pacientes con un peso corporal menor de 30 kg), administrados cada 2 semanas. Las medias estimadas (± DE) del AUC2 semanas, Cmax y Cmin de tocilizumab fueron 32200 ± 9960 mcg•hr por ml, 245 ± 57.2 mcg por ml y 57.5 ± 23.3 mcg por ml, respectivamente. La proporción de acumulación para Cmin (semana 12 sobre semana 2) fue de 3.2 ± 1.3. Se alcanzó el estado estacionario en la semana 12 o después. Las medias estimadas de los parámetros de exposición de tocilizumab fueron similares entre los dos grupos de dosis definidas por peso corporal. Absorción Luego de la dosificación SC en pacientes con artritis reumatoide, la vida media de absorción fue de alrededor de 4 días. La biodisponibilidad para la formulación SC fue 0.8. Distribución A continuación de la dosificación intravenosa, tocilizumab experimenta una eliminación bifásica de la circulación. En los pacientes con artritis reumatoide, el volumen central de distribución fue de 3.5 l y el 25 volumen periférico de distribución fue de 2.9 l, dando como resultado un volumen de distribución en estado estacionario de 6.4 l. En los pacientes pediátricos con PJIA, el volumen central de distribución fue de 1.98 l, el volumen periférico de distribución fue de 2.1 l, dando como resultado un volumen de distribución en estado estacionario de 4.08 l. En los pacientes pediátricos con SJIA, el volumen central de distribución fue de 0.94 l, el volumen periférico de distribución fue de 1.60 l dando como resultado un volumen de distribución en estado estacionario de 2.54 l. Eliminación La depuración total de tocilizumab depende de la concentración, siendo la suma de la depuración lineal y la depuración no lineal. Se estimó que la depuración lineal en el análisis farmacocinético de la población era de 12.5 ml por hr. en la RA, 5.8 ml por hr. en los pacientes pediátricos con PJIA y 7.1 ml por hr. en los pacientes pediátricos con SJIA. La depuración no lineal dependiente de la concentración juega un papel principal con concentraciones bajas de tocilizumab. Una vez que la vía de depuración no lineal está saturada, a mayores concentraciones de tocilizumab, la depuración se determina principalmente por la depuración lineal. La t1/2 de tocilizumab depende de la concentración. Para la administración IV, la t1/2 aparente dependiente de la concentración sube a 11 días para 4 mg por kg y hasta 13 días para 8 mg por kg cada 4 semanas en los pacientes con RA en estado estacionario. Para la administración SC, la t1/2 aparente dependiente de la concentración sube a 13 días para 162 mg cada semana y 5 días para 162 mg semana por medio en los pacientes con RA en estado estacionario. La t1/2 de tocilizumab en niños con PJIA sube a 16 días en las dos categorías de peso corporal (8 mg/kg por peso corporal a 30 kg o mayor o 10 mg/kg para el peso corporal menor de 30 kg) durante un intervalo de la dosificación en estado estacionario. La t1/2 de tocilizumab en los pacientes pediátricos con SJIA sube a 23 días en las dos categorías de peso corporal en la semana 12. Farmacocinética en poblaciones especiales En los análisis farmacocinéticos de la población, los pacientes adultos con artritis reumatoide mostraron que la edad, el género y la raza no afectan la farmacocinética de tocilizumab. Se encontró que la depuración lineal aumentaba con el tamaño corporal. La dosis basada en el peso corporal (8 mg por kg) dio como resultado una mayor exposición en aproximadamente 86% de los pacientes que pesaban más de 100 kg comparados con los pacientes que pesaban menos de 60 kg. Hubo una relación inversa entre la exposición a tocilizumab y el peso corporal en los regímenes SC con la misma dosis. Insuficiencia hepática No se realizó un estudio formal del efecto de la insuficiencia hepática sobre la farmacocinética of tocilizumab. Insuficiencia renal No se realizó un estudio formal del efecto de la insuficiencia renal sobre la farmacocinética of tocilizumab. La mayoría de los pacientes con RA en el análisis farmacocinética de la población tuvo función renal normal o insuficiencia renal leve. La insuficiencia renal leve (depuración de la creatinina menor de 80 ml por min y a 50 ml por min o mayor basada en Cockcroft-Gault) no impactó la farmacocinética of tocilizumab. No se requiere ajuste de la dosis en los pacientes con insuficiencia renal leve. Interacciones farmacológicas Los datos in vitro sugieren que IL-6 redujo la expresión de mRNA para varias isoenzimas CYP450 incluyendo CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D6 y CYP3A4 y que esta expresión reducida fue revertida por la coincubación con tocilizumab en concentraciones clínicamente relevantes. En consecuencia, la inhibición de la señalización de IL-6 en los pacientes con RA tratados con tocilizumab puede restaurar las actividades de 26 CYP450 a niveles más altos que aquellos en la ausencia de tocilizumab llevando al aumento del metabolismo de medicamentos que son sustratos de CYP450. Se desconoce su efecto sobre CYP2C8 o los transportadores (por ej., P-gp). Esto es clínicamente relevante para los sustratos de CYP450 con un índice terapéutico estrecho, donde la dosis se ajusta individualmente. Al iniciar ACTEMRA, en los pacientes tratados con estos tipos de productos medicinales, debe realizarse la vigilancia terapéutica del efecto (por ej., warfarina) o la concentración del medicamento (por ej., ciclosporina o teofilina) en la dosis individual del producto medicinal ajustado según sea necesario. Debe tenerse precaución cuando se coadministre ACTEMRA con medicamentos donde la disminución de la eficacia sea indeseable, por ej., anticonceptivos orales (sustratos de CYP3A4) [consulte Interacciones farmacológicas (7.2)]. Simvastatina Simvastatina es un sustrato de CYP3A4 y OATP1B1. En 12 pacientes con RA no tratados con ACTEMRA, que recibieron 40 mg de simvastatina, las exposiciones de simvastatina y su metabolito, ácido simvastatínico, fueron de 4 a 10 veces y 2 veces mayores, respectivamente, que las exposiciones observadas en los sujetos sanos. Una semana después de la administración de una infusión única de ACTEMRA (10 mg por kg), la exposición de simvastatina y ácido simvastatínico disminuyó en 57% y 39%, respectivamente, a exposiciones que eran similares o levemente mayores a aquellas observadas en sujetos sanos. Las exposiciones de simvastatina y ácido simvastatínico aumentaron al retirar ACTEMRA en los pacientes con RA. La selección de una dosis particular de simvastatina en los pacientes con RA debiera tomar en consideración las exposiciones potencialmente más bajas que pueden resultar después de la iniciación de ACTEMRA (debido a la normalización de CYP3A4) o exposiciones más altas luego de la suspensión de ACTEMRA. Omeprazol Omeprazol es un sustrato de CYP2C19 y CYP3A4. En pacientes con RA que recibieron 10 mg de omeprazol, la exposición a omeprazol fue aproximadamente 2 veces mayor que la observada en los sujetos sanos. En los pacientes con RA que recibieron 10 mg de omeprazol, antes y una semana después de la infusión de ACTEMRA (8 mg por kg), el AUCinf de omeprazol disminuyó 12% en metabolizadores malos (N=5) y metabolizadores intermedios (N=5) y 28% en metabolizadores extensos (N=8) y fue levemente mayor que la observada en los sujetos sanos. Dextrometorfan Dextrometorfan es un sustrato de CYP2D6 y CYP3A4. En 13 pacientes con RA que recibieron 30 mg de dextrometorfan, la exposición a dextrometorfan fue comparable a la de los sujetos sanos. Sin embargo, la exposición a su metabolito, dextrorfan (un sustrato de CYP3A4), fue una fracción de la observada en los sujetos sanos. Una semana después de la administración de una infusión única de ACTEMRA (8 mg por kg), la exposición de dextrometorfan disminuyó aproximadamente 5%. Sin embargo, se observó una disminución mayor (29%) en los niveles de dextrorfan luego de la infusión de ACTEMRA. 13 TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad Carcinogénesis. No se han realizado estudios de largo plazo en animales para establecer la carcinogenicidad potencial de tocilizumab. Deterioro de la fertilidad. Los estudios de fertilidad realizados en ratones machos y hembras usando un análogo murino de tocilizumab administrada por vía intravenosa a una dosis de 50 mg/kg cada tres días no mostraron deterioro de la fertilidad. 14 ESTUDIOS CLÍNICOS 14.1 Artritis reumatoide–Administración intravenosa Se evaluó la eficacia y seguridad de ACTEMRA administrada por vía intravenosa en cinco estudios aleatorizados, doble ciego, multicéntricos en pacientes mayores de 18 años con artritis reumatoide activa diagnosticados según los criterios del Colegio de Reumatología (ACR, por sus siglas en inglés). Los pacientes tenían al menos 8 articulaciones doloridas y 6 hinchadas al inicio. ACTEMRA fue administrada por vía 27 intravenosa cada 4 semanas como monoterapia (Estudio I), en combinación con metotrexato (MTX) (Estudios II y III) u otros medicamentos antirreumáticos modificadores de la enfermedad (DMARD) (Estudio IV) en los pacientes con una respuesta inadecuada a esos medicamentos, o en combinación con MTX en los pacientes con una respuesta inadecuada a los antagonistas de TNF (Estudio V). El Estudio I evaluó a pacientes con artritis reumatoide activa de moderada a severa que no habían sido tratados con MTX dentro de las 24 semanas anteriores a la aleatorización, o que no habían suspendido el tratamiento previo con metotrexato como resultado de efectos tóxicos clínicamente importantes o falta de respuesta. En este estudio, 67% de los pacientes no habían recibido tratamiento previo con MTX y más del 40% de los pacientes habían tenido artritis reumatoide durante menos de 2 años. Los pacientes recibieron ACTEMRA 8 mg por kg como monoterapia o MTX solo (dosis valorada durante 8 semanas desde 7.5 mg hasta un máximo de 20 mg por semana). El criterio de valoración principal fue la proporción de los pacientes con ACTEMRA que alcanzó una respuesta ACR 20 en la Semana 24. El Estudio II fue un estudio de 104 semanas con una fase de extensión opcional continuada de 156 semanas que evaluó a pacientes con artritis reumatoide activa de moderada a severa que tuvieron una respuesta clínica inadecuada a MTX. Los pacientes recibieron ACTEMRA 8 mg por kg, ACTEMRA 4 mg por kg, o placebo cada cuatro semanas, en combinación con MTX (10 a 25 mg por semana). Al completar las 52 semanas, los pacientes recibieron el tratamiento de etiqueta abierta con ACTEMRA 8 mg por kg hasta las 104 semanas o tuvieron la opción de continuar su tratamiento doble ciego si mantenían una mejoría mayor que el 70% en el recuento de articulaciones hinchadas/doloridas. Se realizaron dos análisis intermedios preespecificados en la semana 24 y la semana 52. El criterio de valoración principal en la semana 24 fue la proporción de los pacientes que alcanzó una respuesta ACR 20. En las semanas 52 y 104, los criterios de valoración principales fueron el cambio desde el inicio de la puntuación Sharp-Genant total modificada y el área bajo la curva (AUC) del cambio desde el inicio de la puntuación HAQ-DI. El Estudio III evaluó a pacientes con artritis reumatoide activa de moderada a severa que tuvieron una respuesta clínica inadecuada a MTX. Los pacientes recibieron ACTEMRA 8 mg por kg, ACTEMRA 4 mg por kg o placebo cada cuatro semanas, en combinación con MTX (10 a 25 mg por semana). El criterio de valoración principal fue la proporción de los pacientes que alcanzó una respuesta ACR 20 en la semana 24. El Estudio IV evaluó a pacientes que tuvieron una respuesta inadecuada a su terapia existente, incluyendo uno o más DMARD. Los pacientes recibieron ACTEMRA 8 mg por kg o placebo cada cuatro semanas, en combinación con los DMARD estables. El criterio de valoración principal fue la proporción de los pacientes que alcanzó una respuesta ACR 20 en la semana 24. El Estudio V evaluó a pacientes con artritis reumatoide activa de moderada a severa que tuvieron una respuesta clínica inadecuada o fueron intolerantes a una o más terapias antagonistas de TNF. La terapia antagonista de TNF se suspendió antes de la aleatorización. Los pacientes recibieron ACTEMRA 8 mg por kg, ACTEMRA 4 mg por kg, o placebo cada cuatro semanas, en combinación con MTX (10 a 25 mg por semana). El criterio de valoración principal fue la proporción de los pacientes que alcanzó una respuesta ACR 20 en la semana 24. Respuesta clínica En la Tabla 3 se muestran los porcentajes de los pacientes tratados con ACTEMRA intravenoso que alcanzaron ACR 20, 50 y 70. En todos los estudios intravenosos, los pacientes tratados con 8 mg por kg de ACTEMRA tuvieron tasas de respuesta mayores de ACR 20, ACR 50 y ACR 70 comparadas con los pacientes tratados con MTX o placebo en la semana 24. Durante las porciones controladas de la semana 24 de los Estudios I a V, los pacientes tratados con ACTEMRA con una dosis de 4 mg por kg en los pacientes con respuesta inadecuada a los DMARD o a la terapia con antagonistas de TNF tuvieron tasas de respuesta más bajas comparadas con los pacientes tratados con ACTEMRA 8 mg por kg. 28 Tabla 3 Respuesta clínica en las semanas 24 y 52 de los ensayos activos y controlados con placebo de ACTEMRA intravenoso (Porcentaje de pacientes) Estudio I MTX Tasa de respuesta ACR 20 Semana 24 N=284 ACTEMRA 8 mg por kg Placebo + MTX N=286 N=393 (95% CI)a 53% 70% (0.11, 0.27) N/C 27% 44% (0.04, 0.20) N/C 10% 2% 1% Semana 52 N/C ACR 50 Semana 24 34% Semana 52 N/C ACR 70 Semana 24 15% Semana 52 N/C 28% (0.07, 0.22) N/C N/C N/C Porcentaje de pacientes Estudio III Estudio II 25% 10% 4% ACTEMRA 4 mg por kg + MTX N=399 ACTEMRA 8 mg por kg + MTX N=398 Placebo + MTX (95% CI)a (95% CI)a 51% (0.17, 0.29) 47% (0.15, 0.28) 56% (0.23, 0.35) 56% (0.25, 0.38) 27% 25% (0.09, 0.20) 29% (0.14, 0.25) 32% (0.16, 0.28) 36% (0.21, 0.32) 11% 11% (0.03, 0.13) 16% (0.08, 0.17) 13% (0.05, 0.15) 20% (0.12, 0.21) 2% 4% (0.01, 0.06) 7% (0.03, 0.09) Estudio IV ACTEMRA 4 mg por kg + MTX N=213 ACTEMRA 8 mg por kg + MTX N=205 (95% CI)a (95% CI)a 48% (0.15, 0.32) N/C 59% (0.23, 0.41) N/C 24% 32% (0.13, 0.29) N/C 44% (0.25, 0.41) N/C 9% N/C 12% (0.04, 0.18) N/C 22% (0.12, 0.27) N/C N/C N/C N/C N=204 N/C N/C Placebo + DMARD N=413 ACTEMRA 8 mg por kg + DMARD N=803 Estudio V Placebo + MTX N=158 (95% CI)a N/C N/C 3% 61% (0.30, 0.40) N/C 10% 38% (0.23, 0.33) N/C 4% N/C N/C 1% ACTEMRA 4 mg por kg + MTX N=161 ACTEMRA 8 mg por kg + MTX N=170 ( 95% CI)a (95% CI)a 30% (0.15, 0.36) N/C 50% (0.36, 0.56) N/C 17% (0.05, 0.25) N/C 29% (0.21, 0.41) N/C 12% (0.03, 0.22) N/C N/C N/C 21% (0.13, 0.21) N/C N/C 5% (-0.06, 0.14) N/C N/C N/C N/C N/C Respuestas clínicas principales b Semana 52 a b CI: Intervalo de confianza del 95% de la diferencia ponderada al placebo ajustada para el sitio (y duración de la enfermedad solamente para el Estudio I) Respuesta clínica principal se define como el alcance de una respuesta CR 70 durante un período continuo de 24 semanas 29 En el Estudio II, una mayor proporción de los pacientes tratados con 4 mg por kg y 8 mg por kg ACTEMRA + MTX alcanzó un nivel bajo de actividad de la enfermedad según la medición de un DAS 28-ESR menor que 2.6 comparados con los pacientes tratados con placebo +MTX en la semana 52. En la Tabla 4 se muestra la proporción de pacientes tratados con ACTEMRA que alcanzó un DAS 28-ESR menor que 2.6 y el número de articulaciones activas residuales en estos encuestados en el Estudio II. Tabla 4 Proporción de pacientes con DAS28-ESR menor que 2.6 con el número de articulaciones activas residuales en los ensayos de ACTEMRA intravenoso Estudio II Placebo + MTX N = 393 ACTEMRA 4 mg por kg + MTX N = 399 ACTEMRA 8 mg por kg + MTX N = 398 DAS28-ESR menor que 2.6 Proporción de encuestados en la semana 52 (n) 3% (12) 18% (70) 32% (127) Intervalo de confianza del 95% 0.10, 0.19 0.24, 0.34 De los encuestados, proporción con 0 33% (4) 27% (19) 21% (27) articulaciones activas (n) De los encuestados, proporción con 1 8% (1) 19% (13) 13% (16) articulación activa (n) De los encuestados, proporción con 2 25% (3) 13% (9) 20% (25) articulaciones activas (n) De los encuestados, proporción con 3 o más 33% (4) 41% (29) 47% (59) articulaciones activas (n) *n denota el numerador para todo el porcentaje. El denominador es la población con intención de tratar. No todos los pacientes recibieron evaluaciones de DAS28 en la Semana 52. En la Tabla 5 se muestran los resultados de los componentes de los criterios de respuesta ACR para los Estudios III y V. Resultados similares al Estudio III se observaron en los Estudios I, II y IV. Tabla 5 Componente (media) Número de articulaciones doloridas (0-68) Número de articulaciones hinchadas (0-66) Componentes de la respuesta ACR en la Semana 24 en los ensayos con ACTEMRA intravenoso ACTEMRA 4 mg por kg + MTX N=213 Inicio Semana 24a Estudio III ACTEMRA 8 mg por kg + MTX N=205 Inicio Semana 24 a Placebo + MTX N=204 Semana 24 33 25 Inicio 33 19 -7.0 (-10.0, -4.1) 32 14.5 -9.6 (-12.6, -6.7) 20 10 -4.2 (-6.1, -2.3) 19.5 8 -6.2 (-8.1, -4.2) 21 Dolorb 61 60 Evaluación global del 66 33 -11.0 (-17.0, -5.0) 34 -10.9 (-17.1, -4.8) 30 -15.8 (-21.7, -9.9) 31 -14.9 (-20.9, -8.9) 64 26 -5.6 (-10.5, -0.8) 64 1.64 1.01 -0.18 1.55 paciente b Evaluación global del médico b Índice de discapacidad 65 ACTEMRA 4 mg por kg + MTX N=161 Inicio Semana 24 a Estudio V ACTEMRA 8 mg por kg + MTX N=170 Inicio Semana 24 a Placebo + MTX N=158 Semana 24 30 30 Inicio 31 21 -10.8 (-14.6, -7.1) 32 17 -15.1 (-18.8, -11.4) 15 19.5 13 -6.2 (-9.0, -3.5) 19 11 -7.2 (-9.9, -4.5) 19 18 57 43 63.5 65 48 45 70 33 -23.9 (-33.7, -14.1) 36 -17.4 (-27.8, -7.0) 64 64 43 -12.4 (-22.1, -2.1) 46 -10.0 (-20.3, 0.3) 71 51 23 -9.0 (-13.8, -4.2) 64 32 66.5 39 -10.5 (-18.6, -2.5) 66 28 -18.2 (-26.3, -10.0) 67.5 43 0.96 -0.21 1.55 1.21 1.67 1.39 -0.25 1.75 1.34 -0.34 1.70 1.58 70 30 (HAQ) c (-0.34, -0.02) CRP (mg por dl) 2.79 1.17 -1.30 (-2.0, -0.59) (-0.37, -0.05) 2.61 0.25 -2.156 (-2.86, -1.46) (-0.42, -0.09) 2.36 1.89 3.11 1.77 -1.34 (-2.5, -0.15) (-0.51, -0.17) 2.80 0.28 -2.52 (-3.72, -1.32) 3.705 3.06 a Los datos mostrados son la media de la semana 24, diferencia en el cambio medio ajustado desde el inicio comparado con placebo + MTX en la semana 24 e intervalo de confianza del 95% para esa diferencia b Escala análoga visual: 0 = mejor, 100 = peor c Cuestionario de evaluación de la salud: 0 = mejor, 3 = peor; 20 preguntas; 8 categorías: vestirse y arreglarse, levantarse, comer, caminar, higiene, alcance, agarre y actividades En la Figura 1 se muestra el porcentaje de encuestados de ACR 20 por visita para el Estudio III. Se observaron curvas de respuesta similares en los estudios I, II, IV y V. Porcentaje de encuestados de ACR 20 por visita para el Estudio III (Respuesta inadecuada a MTX)* Porcentaje (%) de encuestados de ACR20 (+/- DE) Figura 1 SEM 2 SEM 4 SEM 8 SEM 12 SEM 16 SEM 20 SEM 24 Visita Grupo de tratamiento *Los mismos pacientes podrían no haber respondido en cada punto temporal. Respuesta radiográfica En el Estudio II, se evaluó el daño articular estructural radiográficamente y se expresó como el cambio en la puntuación Sharp-Genant total y sus componentes, la puntuación de erosión y la puntuación del estrechamiento del espacio articular. Las radiografías de manos/muñecas y pies se obtuvieron al inicio, 24 semanas, 52 semanas y 104 semanas y fueron calificadas por lectores que no conocían los grupos de tratamiento y número de visitas. En la Tabla 6 se muestran los resultados desde el inicio hasta la semana 52. ACTEMRA 4 mg por kg retardó 31 (inhibición menor que 75% comparada con el grupo de control) y ACTEMRA 8 mg por kg inhibió (inhibición de al menos 75% comparada con el grupo de control) la progresión del daño estructural comparada con el placebo más MTX en la semana 52. Tabla 6 Cambio radiográfico medio desde el inicio hasta la Semana 52 en el Estudio II Placebo + MTX ACTEMRA 4 mg por kg + MTX N=343 ACTEMRA 8 mg por kg + MTX N=353 1.17 (3.14) 0.33 (1.30) -0.83 (-1.13, -0.52) 0.25 (0.98) -0.90 (-1.20, -0.59) 0.76 (2.14) 0.20 (0.83) -0.55 (-0.76, -0.34) 0.15 (0.77) -0.60 (-0.80, -0.39) 0.41 (1.71) 0.13 (0.72) 0.10 (0.49) -0.28 (-0.44, -0.11) -0.30 (-0.46, -0.14) N=294 Semana 52* Puntuación de Sharp-Genant total, Media (DE) Diferencia media ajustada** (95%CI) Puntuación de erosión, Media (DE) Diferencia media ajustada** (95%CI) Puntación de estrechamiento del espacio articular, Media (DE) Diferencia media ajustada** (95%CI) * El análisis de la Semana 52 emplea datos extrapolados linealmente para pacientes después del escape, retiro o pérdida al seguimiento. ** Diferencia entre medias ajustadas (ACTEMRA + MTX - Placebo + MTX) DE = desviación estándar El cambio medio desde el inicio hasta la semana 104 en la puntuación de Sharp-Genant total para los grupos de ACTEMRA 4 mg por kg fue de 0.47 (DE = 1.47) y para los grupos de 8 mg por kg fue de 0.34 (DE = 1.24). En la semana 104, la mayoría de los pacientes en el grupo de control (placebo + MTX) se había pasado al tratamiento activo, y por ello los resultados no se incluyen en la comparación. Los pacientes en los grupos activos pueden haberse pasado al grupo de dosis activa alternativa, y los resultados se informan por grupo de dosis aleatorizada original. En el grupo con placebo, 66% de los pacientes no experimentó progresión radiográfica (cambio en la puntuación de Sharp-Genant total ≤ 0) en la semana 52 comparada con 78% y 83% en el de ACTEMRA 4 mg por kg y 8 mg por kg, respectivamente. Luego de 104 semanas de tratamiento, 75% y 83% de los pacientes inicialmente aleatorizados para ACTEMRA 4 mg por kg y 8 mg por kg, respectivamente, no experimentaron progresión del daño estructural comparada con 66% de los pacientes tratados con placebo. Resultados relacionados con la salud En el Estudio II, se evaluaron la función física y discapacidad usando el Índice de discapacidad del cuestionario de evaluación de la salud (HAQ-DI, por sus siglas en inglés). Ambos grupos de dosificación de ACTEMRA demostraron una mejoría mayor comparada con el grupo con placebo en el AUC de cambio desde el inicio en el HAQ-DI hasta la semana 52. La media del cambio desde el inicio hasta la semana 52 en HAQ-DI fue de 0.6, 0.5 y 0.4 para los grupos de tratamiento con ACTEMRA 8 mg por kg, ACTEMRA 4 mg por kg y con placebo, 32 respectivamente. Sesenta y tres por ciento (63%) y sesenta por ciento (60%) de los pacientes en los grupos de tratamiento con ACTEMRA 8 mg por kg y ACTEMRA 4 mg por kg, respectivamente, alcanzaron una mejoría clínicamente relevante en HAQ-DI (cambio desde el inicio de ≥ 0.3 unidades) en la semana 52 comparada con 53% en el grupo de tratamiento con placebo. 14.2 Artritis reumatoide–Administración subcutánea Se evaluó la eficacia y seguridad de ACTEMRA administrada por vía subcutánea en dos estudios de doble ciego, controlados y multicéntricos en los pacientes con RA activa. Un estudio (SC-I) fue de no inferioridad que comparó la eficacia y seguridad de ACTEMRA 162 mg administrada cada semana por vía subcutánea (SC) a 8 mg por kg por vía intravenosa cada cuatro semanas. El segundo estudio (SC-II) fue de superioridad controlado con placebo, que evaluó la eficacia y seguridad de ACTEMRA 162 mg administrada semana por medio SC al placebo. Tanto SC-I como SC-II requirieron que los pacientes fueran > 18 años de edad con artritis reumatoide activa de moderada a severa diagnosticada según los criterios de ACR que tenían al menos 4 articulaciones doloridas y 4 articulaciones hinchadas al inicio (SC-I) o al menos 8 articulaciones doloridas y 6 hinchadas al inicio (SC-II) y una respuesta inadecuada a la terapia con los DMARD existentes, donde aproximadamente 20% también tenía antecedentes de respuesta inadecuada a al menos un inhibidor de TNF. Todos los pacientes en ambos estudios SC recibieron DMARD no biológicos de fondo. En SC-I, 1262 pacientes fueron aleatorizados 1:1 para recibir ACTEMRA SC 162 mg cada semana o ACTEMRA intravenoso 8 mg/kg cada cuatro semanas en combinación con los DMARD. En SC-II, 656 pacientes fueron aleatorizados 2:1 para ACTEMRA SC 162 mg semana por medio o placebo, en combinación con los DMARD. El punto de valoración principal en ambos estudios fue la proporción de pacientes que alcanzó una respuesta ACR20 en la Semana 24. En la Tabla 7 se muestra la respuesta clínica a 24 semanas de terapia con ACTEMRA SC. En SC-I, la medida de resultado principal fue ACR20 en la Semana 24. El margen de no inferioridad preespecificado fue la diferencia en el tratamiento de 12%. El estudio demostró la no inferioridad de ACTEMRA con respecto a ACR20 en la Semana 24; las respuestas ACR50, ACR70 y DAS28 también se muestran en la Tabla 7. En SC-II, una mayor porción de los pacientes tratados con ACTEMRA 162 mg SC semana por medio alcanzó respuestas ACR20, ACR50 y ACR70 comparada con los pacientes tratados con placebo (Tabla 7). Más aún, una mayor proporción de los pacientes tratados con ACTEMRA 162 mg SC semana por medio alcanzó un nivel bajo de actividad de la enfermedad según la medición de un DAS28-ESR menor que 2.6 en la Semana 24 comparado con aquellos tratados con placebo (Tabla 7). Tabla 7 Respuesta clínica en la Semana 24 en los ensayos de ACTEMRA subcutáneo (Porcentaje de pacientes) SC-Ia TCZ SC 162 mg TCZ IV cada semana 8mg/kg + DMARD + DMARD N=558 N=537 SC-IIb TCZ SC 162 mg Placebo semana por + DMARD medio N=219 + DMARD N=437 ACR20 Semana 24 Diferencia ponderada (95% CI) 69% 73.4% -4% (-9.2, 1.2) 61% 32% 30% (22.0, 37.0) Semana 24 Diferencia ponderada (95% CI) 47% 49% -2% (-7.5, 4.0) 40% 12% 28% (21.5, 34.4) 24% 20% ACR50 ACR70 Semana 24 28% 5% 33 Diferencia ponderada (95% CI) Cambio en DAS28 [media ajustada] Semana 24 Diferencia media ajustada (95% CI) DAS28 < 2.6 Semana 24 Diferencia ponderada (95% CI) TCZ = tocilizumab a Por población del protocolo b Población con intento de tratar -4% (-9.0, 1.3) -3.5 15% (9.8, 19.9) -3.5 0 (-0.2, 0.1) 38.4% 36.9% 0.9 (-5.0, 6.8) -3.1 -1.7 -1.4 (-1.7, -1.1) 32.0% 4.0% 28.6 (22.0, 35.2) Los resultados de los componentes de los criterios de respuesta ACR y el porcentaje de encuestados de ACR20 por visita para ACTEMRA-SC en los Estudios SC-I y SC-II fueron coherentes con aquellos observados para ACTEMRA-IV. Respuesta radiográfica En el estudio SC-II, se evaluó la progresión del daño articular estructural radiográficamente y se expresó como el cambio desde el inicio en la puntuación de Sharp total modificada por van der Heijde (mTSS). En la semana 24, se observó significativamente menos progresión radiográfica en los pacientes que recibieron ACTEMRA SC semana por medio más DMARD comparados con placebo más DMARD; cambio medio desde el inicio en mTSS de 0.62 vs. 1.23, respectivamente, con una diferencia media ajustada de -0.60 (-1.1, -0.1). Estos resultados son coherentes con aquellos observados en los pacientes tratados con ACTEMRA intravenoso. Resultados relacionados con la salud En los estudios SC-I y SC-II, la disminución media desde el inicio hasta la semana 24 en HAQ-DI fue de 0.6, 0.6, 0.4 y 0.3 y la proporción de los pacientes que alcanzó una mejoría clínicamente relevante en HAQ-DI (cambio desde el inicio de ≥ 0.3 unidades) fue de 65%, 67%, 58% y 47%, para SC cada semana, IV 8 mg/kg, SC semana por medio y grupos de tratamiento con placebo, respectivamente. 14.3 Artritis idiopática juvenil poliarticular-Administración intravenosa Se evaluó la eficacia de ACTEMRA en un estudio de tres partes que incluyó una extensión de etiqueta abierta en niños de 2 a 17 años de edad con artritis idiopática juvenil poliarticular activa (PJIA), quienes tuvieron una respuesta inadecuada a metotrexato o la incapacidad de tolerar metotrexato. Los pacientes habían tenido al menos 6 meses de enfermedad activa (duración media de la enfermedad de 4.2 ± 3.7 años), con al menos cinco articulaciones con artritis activa (hinchazón o limitación del movimiento acompañado por dolor y/o sensibilidad) y/o al menos 3 articulaciones activas con limitación del movimiento (media, 20 ± 14 articulaciones activas). Los pacientes tratados tenían subtipos de JIA que al inicio de la enfermedad incluyeron factor reumatoide positivo, JIA poliarticular negativa, o JIA oligoarticular extendida. El tratamiento con una dosis estable de metotrexato estaba permitido pero no era necesario durante el estudio. No se permitió el uso concurrente de los medicamentos antirreumáticos modificadores de la enfermedad (DMARD), que no fueran metotrexato, u otros biológicos (por ej., antagonistas de TNF o modulador de coestimulación celular de células T) en el estudio. La Parte I consistió en un período inicial de tratamiento activo de 16 semanas con ACTEMRA (n=188) seguido por la Parte II, un período de retiro aleatorizado, doble ciego, controlado con placebo de 24 semanas, seguido por la Parte III, un período de etiqueta abierta de 64 semanas. Los pacientes elegibles que pesaban 30 kg o más recibieron ACTEMRA a 8 mg/kg IV una vez cada cuatro semanas. Los pacientes que pesaban menos de 30 kg 34 fueron aleatorizados 1:1 para recibir ACTEMRA 8 mg/kg o 10 mg/kg IV cada cuatro semanas. Al concluir la Parte I de etiqueta abierta, 91% de los pacientes que recibía MTX de fondo además de tocilizumab y 83% de los pacientes con tocilizumab como monoterapia alcanzaron una respuesta ACR 30 en la semana 16 comparada con el inicio y entraron en el período de retiro ciego (Parte II) del estudio. Las proporciones de los pacientes con JIA con respuestas ACR 50/70 en la Parte I fueron 84.0% y 64%, respectivamente para los pacientes que recibían MTX de fondo además de tocilizumab y 80% y 55% respectivamente para los pacientes con tocilizumab como monoterapia. En la Parte II, los pacientes (ITT, n=163) fueron aleatorizados para ACTEMRA (misma dosis recibida en la Parte I) o placebo en una proporción 1:1 que fue estratificada por el uso concurrente de metotrexato y el uso concurrente de corticosteroides. Cada paciente continuó en la Parte II del estudio hasta la Semana 40 o hasta que el paciente hubiera satisfecho los criterios de exacerbación en JIA de ACR 30 (relativos a la Semana 16) y calificaran para el escape. El punto de valoración principal fue la proporción de los pacientes con exacerbación en JIA de ACR 30 en la semana 40 relativa a la semana 16. La exacerbación en JIA de ACR 30 se definió como el empeoramiento de 3 o más de las 6 variables de resultado principales en al menos 30% con no más de 1 de las variables restantes que mejoró en más del 30% relativa a la Semana 16. Los pacientes tratados con ACTEMRA experimentaron significativamente menos exacerbaciones de la enfermedad comparados con los pacientes tratados con placebo (26% [21/82] versus 48% [39/81]; diferencia ajustada en las proporciones -21%, 95% CI: -35%, -8%). Durante la fase de retiro (Parte II), más de los pacientes tratados con ACTEMRA mostraron respuestas en JIA de ACR 30/50/70 en la Semana 40 comparados con los pacientes retirados a placebo. 14.4 Artritis idiopática juvenil sistémica-Administración intravenosa Se evaluó la eficacia de ACTEMRA para el tratamiento de la SJIA activa en un estudio de 12 semanas, aleatorizado, doble ciego, controlado con placebo, de grupo paralelo, de dos grupos. Los pacientes tratados con o sin MTX fueron aleatorizados (ACTEMRA:placebo = 2:1) a uno de dos grupos de tratamiento: 75 pacientes recibieron infusiones de ACTEMRA cada dos semanas a 8 mg por kg para los pacientes de 30 kg o más o 12 mg por kg para los pacientes de menos de 30 kg y 37 fueron aleatorizados para recibir infusiones de placebo cada dos semanas. La reducción de los corticosteroides podía ocurrir desde la semana seis para los pacientes que alcanzaron una respuesta de ACR 70 en JIA. Luego de 12 semanas o en el momento del escape, debido al empeoramiento de la enfermedad, los pacientes fueron tratados con ACTEMRA en la fase de extensión de etiqueta abierta con dosificación adecuada al peso. El punto de valoración principal fue la proporción de los pacientes con al menos 30% de mejoría en el conjunto básico de ACR en JIA (respuesta ACR 30 en JIA) en la Semana 12 y ausencia de fiebre (sin temperatura a 37.5°C o mayor en los 7 días anteriores). Las respuestas de ACR (Colegio Americano de Reumatología) en JIA se definen como el porcentaje de mejoría (es decir, 30%, 50%, 70%) en 3 de 6 variables de resultado básicas cualesquiera comparadas con el inicio, con empeoramiento en no más de 1 de las variables restantes en 30% o más. Las variables de resultado básicas consisten en evaluación global del médico, evaluación global del paciente por los padres, número de articulaciones con artritis activa, número de articulaciones con limitación del movimiento, tasa de sedimentación de los eritrocitos (ESR) y capacidad funcional (cuestionario de evaluación de salud en la infancia-CHAQ). En la Tabla 8 se muestran el resultado del punto de valoración principal y las tasas de respuesta de ACR en JIA en la Semana 12. 35 Tabla 8 Hallazgos de eficacia en la Semana 12 ACTEMRA N=75 Placebo N=37 Punto de valoración principal: respuesta de ACR 30 en JIA + ausencia de fiebre Encuestados Diferencia ponderada (95% CI) 85% 62 (45, 78) Tasas de respuesta de ACR en JIA en la Semana 12 24% - ACR 30 en JIA Encuestados 91% 24% Diferencia ponderadaa 67 (95% CI)b (51, 83) ACR 50 en JIA Encuestados 85% 11% Diferencia ponderadaa 74 (95% CI) b (58, 90) ACR 70 en JIA Encuestados 71% 8% Diferencia ponderadaa 63 (95% CI) b (46, 80) a La diferencia ponderada es la diferencia entre las tasas de respuesta de ACTEMRA y placebo, ajustadas para los factores de estratificación (peso, duración de la enfermedad, dosis de corticosteroide oral de fondo y uso de metotrexato de fondo). b CI: intervalo de confianza de la diferencia ponderada. El efecto del tratamiento con ACTEMRA fue coherente en todos los componentes de las variables básicas de respuesta de ACR en JIA. Las respuestas de puntuaciones de ACR en JIA y la ausencia de fiebre en la extensión de etiqueta abierta fueron coherentes con la porción controlada del estudio (datos disponibles hasta las 44 semanas). Características sistémicas De los pacientes con fiebre o erupción al inicio, aquellos tratados con ACTEMRA tuvieron menos características sistémicas; 35 de 41 (85%) no tuvieron más fiebre (sin registros de temperatura a 37.5°C o más en los 14 días anteriores) comparados con 5 de 24 (21%) de los pacientes tratados con placebo y 14 de 22 (64%) no tuvieron más erupción comparados con 2 de 18 (11%) de los pacientes tratados con placebo. Las respuestas fueron coherentes en la extensión de etiqueta abierta (datos disponibles hasta las 44 semanas). Reducción de los corticosteroides De los pacientes que recibieron corticosteroides orales al inicio, 8 de 31 (26%) con placebo y 48 de 70 (69%) pacientes con ACTEMRA alcanzaron una respuesta ACR 70 en JIA en la semana 6 u 8 permitiendo la reducción de la dosis de corticosteroides. Diecisiete (24%) pacientes con ACTEMRA comparados con 1 (3%) paciente con placebo pudieron reducir la dosis de corticosteroides en al menos 20% sin experimentar una exacerbación u ocurrencia de síntomas sistémicos subsecuentes de ACR 30 en JIA hasta la semana 12. En la porción de etiqueta abierta del estudio, en la semana 44, había 44 de 103 (43%) pacientes con ACTEMRA sin corticosteroides orales. De estos 44 pacientes, 50% dejaron los corticosteroides a las 18 semanas o más. Resultados relacionados con la salud Se evaluaron la función física y la discapacidad usando el Índice de discapacidad del cuestionario de evaluación de salud de la infancia (CHAQ-DI). Setenta y siete por ciento (58 de 75) de los pacientes en el grupo de tratamiento con ACTEMRA alcanzó una mejoría mínima clínicamente importante en CHAQ-DI (cambio desde el inicio de ≥ 0.13 unidades) en la semana 12 comparada con 19% (7 de 37) en el grupo de tratamiento con placebo. 36 16 PRESENTACIÓN/ALMACENAMIENTO Y MANEJO Para infusión intravenosa ACTEMRA (tocilizumab) se presenta como solución para infusión intravenosa en ampollas de uso único, sin preservativos, en un concentrado estéril (20 mg por ml). Se dispone de las siguientes configuraciones de empaque: Ampollas de uso único empacadas en forma individual: NDC 50242-135-01 que proporcionan 80 mg por 4 ml NDC 50242-136-01 que proporcionan 200 mg por 10 ml NDC 50242-137-01 que proporcionan 400 mg por 20 ml Para inyección subcutánea ACTEMRA (tocilizumab) para administración subcutánea se presenta como solución líquida, estéril, sin preservativos, en una jeringa prellenada de uso único. Se dispone de las siguientes configuraciones de empaque: NDC 50242-138-01 jeringa prellenada que proporciona 162 mg por 0.9 ml Almacenamiento y estabilidad: No lo use después de la fecha de expiración en el envase, paquete o jeringa prellenada. ACTEMRA debe ser refrigerada de 2ºC a 8ºC (36°F a 46°F). No la congele. Proteja las ampollas y jeringas de la luz almacenándolas en el paquete original hasta el momento de usarlas, y mantenga las jeringas secas. Los productos farmacéuticos parenterales deben ser inspeccionados visualmente para ver materia particulada y descoloración antes de la administración, siempre que lo permitan la solución y el envase. Si se observaran partículas opacas, descoloración u otras partículas extrañas visiblemente, la solución no debiera usarse. 17 INFORMACIÓN SOBRE EL ASESORAMIENTO AL PACIENTE Consulte el folleto para el paciente aprobado por la FDA (Guía de medicamentos) Asesoramiento al paciente Aconseje a los pacientes y padres o tutores de menores con PJIA o SJIA sobre los beneficios y riesgos potenciales de ACTEMRA. Los médicos deben instruir a sus pacientes a leer la Guía de medicamentos antes de iniciar la terapia con ACTEMRA. • • • Infecciones: Informe a los pacientes que ACTEMRA puede disminuir su resistencia a las infecciones. Instruya al paciente sobre la importancia de comunicarse inmediatamente con su médico cuando aparezcan los síntomas que sugieren infección con el fin de asegurar la evaluación rápida y el tratamiento adecuado. Perforación gastrointestinal: Informe a los pacientes que algunos pacientes que han sido tratados con ACTEMRA han tenido efectos secundarios serios en el estómago y los intestinos. Instruya al paciente sobre la importancia de comunicarse inmediatamente con su médico cuando aparezcan síntomas de dolor abdominal persistente y severo para asegurar la evaluación rápida y el tratamiento adecuado. Hipersensibilidad y reacciones alérgicas graves Evalúe la idoneidad del paciente para el uso doméstico de la inyección SC. Informe a los pacientes que algunos pacientes que han sido tratados con ACTEMRA han desarrollado reacciones alérgicas graves, incluyendo anafilaxia. Aconseje a los pacientes a buscar atención médica inmediata si experimentaran cualquier síntoma de reacciones alérgicas graves. Instrucción sobre la técnica de inyección 37 Aplique la primera inyección bajo la supervisión de un profesional de atención médica calificado. Si un paciente o cuidador fuera a administrar ACTEMRA subcutáneo, instrúyalo sobre las técnicas de inyección y evalúe su capacidad para inyectar por vía subcutánea para asegurar la administración adecuada de ACTEMRA subcutáneo y la idoneidad para el uso doméstico [Consulte Instrucciones de uso para el paciente]. Antes del uso, retire la jeringa pre llenada del refrigerador para permitir que repose a temperatura ambiente fuera de la caja durante 30 minutos, fuera del alcance de los niños. No entibie ACTEMRA de ninguna otra forma. Aconseje a los pacientes a que consulten con su proveedor de atención médica si no se recibe la dosis completa. Debe usarse un recipiente resistente a pinchazos para la eliminación de agujas y jeringas, debiendo mantenerse fuera del alcance de los niños. Instruya a los pacientes o cuidadores sobre la técnica al igual que la eliminación adecuada de la jeringa y la aguja, y prevenga sobre volver a usar estos artículos. 38 GUÍA DE MEDICAMENTOS ACTEMRA® (AC-TEM-RA) (tocilizumab) Solución para infusión intravenosa ACTEMRA® (AC-TEM-RA) (tocilizumab) Inyección, solución para la administración subcutánea Lea esta Guía de medicamentos antes de iniciar ACTEMRA, antes de cada infusión, o cada vez que surta una nueva receta. Podría haber nueva información. Esta Guía de medicamentos no reemplaza la conversación con su proveedor de atención médica sobre su enfermedad o su tratamiento. ¿Cuál es la información más importante que debo saber sobre ACTEMRA? ACTEMRA puede causar efectos secundarios graves incluyendo: 1. Infecciones graves. ACTEMRA es un medicamento que afecta su sistema inmunitario. ACTEMRA puede disminuir la capacidad de su sistema inmunitario de combatir infecciones. Algunas personas tienen infecciones graves mientras reciben ACTEMRA, incluyendo tuberculosis (TB), e infecciones causadas por bacterias, hongos, o virus que pueden diseminarse por el cuerpo. Algunas personas han muerto debido a estas infecciones. Su médico debe hacerle pruebas para TB antes de iniciar ACTEMRA. • Su médico debe vigilarlo de cerca para ver signos y síntomas de TB durante el tratamiento con ACTEMRA. No debe comenzar a recibir ACTEMRA si tiene cualquier tipo de infección a menos que su proveedor de atención médica diga que está bien. Antes de iniciar ACTEMRA, informe a su proveedor de atención médica si usted: • piensa que tiene una infección o tiene síntomas de una infección, con o sin fiebre, tales como: o sudoración o escalofríos o dolores musculares o tos o falta de aire o sangre en la flema o pérdida de peso o piel tibia, enrojecida o dolorosa o llagas en el cuerpo o diarrea o dolor estomacal o ardor al orinar u orinar más de frecuentemente que lo normal o sentirse muy cansado • está siendo tratado por una infección • contrae muchas infecciones o tiene infecciones que continúan regresando • tiene diabetes, VIH, o un sistema inmunitario débil. Las personas con estas afecciones tienen una mayor probabilidad de contraer infecciones. • tiene TB, o ha estado en contacto cercano con alguien con TB • vive o vivió, o han viajado a ciertas partes del país (como los valles del río Mississippi u Ohio y el suroeste) donde hay un aumento de la probabilidad de contraer ciertos tipos de infecciones micóticas (histoplasmosis, coccidiomicosis o blastomicosis). Estas infecciones 39 • pueden suceder o volverse más severas si usa ACTEMRA. Consulte con su proveedor de atención médica, si no sabe si ha vivido en un área donde estas infecciones son comunes. tiene o ha tenido hepatitis B Luego de iniciar ACTEMRA, llame a su proveedor de atención médica inmediatamente si tiene algún síntoma de infección. ACTEMRA puede hacerlo más susceptible a contraer infecciones o empeorar cualquier infección que tenga. 2. Desgarros (perforación) del estómago o los intestinos. • • 3. Informe a su proveedor de atención médica si ha tenido diverticulitis (inflamación en partes del intestino grueso) o úlceras en el estómago o los intestinos. Algunas personas que reciben ACTEMRA tienen desgarros en el estómago o los intestinos. Esto sucede con más frecuencia en las personas que también toman medicamentos antiinflamatorios no esteroides (NSAID), corticosteroides o metotrexato. Informe a su proveedor de atención médica inmediatamente si tiene fiebre y dolor en el área estomacal que no desaparece y un cambio en sus hábitos intestinales. Cambios en ciertos resultados de pruebas de laboratorio. Su proveedor de atención médica debe hacer análisis de sangre antes de que comience a recibir ACTEMRA, después de las primeras 4 a 8 semanas para artritis reumatoide (después de lo cual los análisis deben hacerse cada 3 meses), cada 4 a 8 semanas para PJIA y cada 2 a 4 semanas para SJIA durante el tratamiento para verificar los siguientes efectos secundarios de ACTEMRA: • • • recuento de neutrófilos bajo. Los neutrófilos son glóbulos blancos que ayudan al cuerpo a combatir las infecciones bacterianas. recuento de plaquetas bajo. Las plaquetas son glóbulos sanguíneos que ayudan con la coagulación de la sangre y detienen el sangrado. aumento en ciertas pruebas de función hepática. No debe recibir ACTEMRA si sus recuentos de neutrófilos o plaquetas son demasiado bajos o sus pruebas de función hepática son demasiado altas. Su proveedor de atención médica podría suspender su tratamiento con ACTEMRA durante un período de tiempo o cambiar su dosis del medicamento si fuera necesario debido a cambios en los resultados de estos análisis de sangre. • 4. aumento en los niveles de colesterol sanguíneo. También podría tener cambios en otros análisis de laboratorio, como los niveles de colesterol sanguíneo. Su proveedor de atención médica debe hacer análisis de sangre para verificar sus niveles de colesterol 4 a 8 semanas después de que comience a recibir ACTEMRA y luego cada 6 meses a partir de allí. Cáncer. ACTEMRA podría aumentar su riesgo de tener ciertos cánceres al cambiar la manera en que funciona su sistema inmunitario. Informe a su proveedor de atención médica si alguna vez ha tenido cualquier tipo de cáncer. Consulte “¿Cuáles son los efectos secundarios posibles con ACTEMRA?” para obtener más información sobre efectos secundarios. 40 ¿Qué es ACTEMRA? ACTEMRA es un medicamento recetado llamado antagonista del receptor de Interleucina-6 (IL6). ACTEMRA se usa para tratar: Adultos con artritis reumatoide (RA) activa de moderada a severa después de haber usado al menos otro medicamento llamado medicamento antirreumático modificador de la enfermedad (DMARD) sin que haya funcionado bien. • Personas con artritis idiopática juvenil poliarticular activa (PJIA) a partir de los 2 años de edad. • Personas con artritis idiopática juvenil sistémica activa (SJIA) a partir de los 2 años de edad. ACTEMRA no está aprobada para el uso subcutáneo en personas con PJIA o SJIA. • Se desconoce si ACTEMRA es segura y eficaz en los niños con PJIA o SJIA de menos de 2 años de edad o en los niños con enfermedades que no sean PJIA o SJIA. ¿Quién no debe recibir ACTEMRA? No reciba ACTEMRA si es alérgico a tocilizumab o a cualquiera de los ingredientes de ACTEMRA. Consulte el final de esta Guía de medicamentos para ver una lista completa de ingredientes de ACTEMRA. ¿Qué debo decirle a mi proveedor de atención médica antes de recibir ACTEMRA? ACTEMRA puede no ser adecuado para usted. Antes de recibir ACTEMRA, informe a su proveedor de atención médica si usted: • • • • • • • • • tiene una infección. Consulte “¿Cuál es la información más importante que debo saber sobre ACTEMRA?” tiene problemas hepáticos tiene cualquier dolor en el área estomacal (abdominal) o ha sido diagnosticado con diverticulitis o úlceras en el estómago o los intestinos ha tenido una reacción a tocilizumab o cualquiera de los ingredientes de ACTEMRA antes tiene o tuvo una enfermedad que afecte su sistema nervioso, como esclerosis múltiple recientemente ha recibido o tiene programado recibir una vacuna. o Todas las vacunas deben actualizarse antes de iniciar ACTEMRA. o Las personas que reciben ACTEMRA no deben recibir vacunas vivas. o Las personas que reciben ACTEMRA pueden recibir vacunas no vivas planea someterse a cirugía o un procedimiento quirúrgico tiene cualquier otra afección médica planea quedar embarazada o está embarazada. Se desconoce si ACTEMRA dañará a su bebé no nacido. Registro de embarazo: Genentech tiene un registro para mujeres embarazadas que reciben ACTEMRA. El propósito de este registro es comprobar la salud de la mujer embarazada y su bebé. Si está embarazada o quedara embarazada mientras recibe ACTEMRA, hable con su proveedor de atención médica sobre cómo unirse a este registro de embarazo o puede comunicarse con el registro al 1-877-311-8972 para inscribirse. • planea amamantar o está amamantando. Usted y su proveedor de atención médica debieran decidir si recibirá ACTEMRA o amamantará. No debe hacer ambos. 41 Informe a su proveedor de atención médica sobre todos los medicamentos que tome, incluyendo medicamentos con o sin receta, vitaminas y suplementos herbales. ACTEMRA y otros medicamentos podrían afectarse uno al otro causando efectos secundarios. Informe especialmente a su proveedor de atención médica si toma: • • cualquier otro medicamento para tratar su RA. No debe tomar etanercept (Enbrel®), adalimumab (Humira®), infliximab (Remicade®), rituximab (Rituxan®), abatacept (Orencia®), anakinra (Kineret®), certolizumab (Cimzia®) o golimumab (Simponi®), mientras reciba ACTEMRA. Recibir ACTEMRA con estos medicamentos podría aumentar su riesgo de infección. medicamentos que afecten la manera en que funcionan ciertas enzimas hepáticas. Consulte con su proveedor de atención médica si no está seguro que su medicamento sea uno de estos. Conozca los medicamentos que recibe. Mantenga una lista de ellos para mostrarla a su proveedor de atención médica y farmacéutico cuando obtenga un medicamento nuevo. ¿Cómo recibiré ACTEMRA? En una vena (IV o infusión intravenosa) para Artritis reumatoide, PJIA o SJIA: • • • • • • Si su médico receta ACTEMRA como infusión IV, usted recibirá ACTEMRA de su proveedor de atención médica por medio de una aguja colocada en una vena de su brazo. La infusión tomará cerca de 1 hora para administrarle la dosis completa de medicamento. Para artritis reumatoide o PJIA usted recibirá una dosis de ACTEMRA alrededor de cada 4 semanas. Para SJIA usted recibirá una dosis de ACTEMRA alrededor de cada 2 semanas. Si omite una dosis programada de ACTEMRA, consulte con su proveedor de atención médica cuándo programar la siguiente infusión. Mientras reciba ACTEMRA, puede continuar usando otros medicamentos que ayuden a tratar su artritis reumatoide, PJIA o SJIA tales como metotrexato, medicamentos antiinflamatorios no esteroides (NSAID) y esteroides recetados, según la indicación de su proveedor de atención médica. Mantenga todas sus citas de seguimiento y sométase a los análisis de sangre indicados por su proveedor de atención médica. Bajo la piel (SC o inyección subcutánea) para Artritis reumatoide: • • • • Consulte las Instrucciones de uso al final de esta Guía de medicamentos para ver las instrucciones sobre la manera correcta de preparar y administrar sus inyecciones de ACTEMRA en su casa. ACTEMRA se presenta como jeringa prellenada de uso único. También podría recibir ACTEMRA como inyección bajo la piel (subcutánea). Si su médico decide que usted o su cuidador puede aplicarle las inyecciones de ACTEMRA en su casa, usted o su cuidador debe recibir capacitación sobre la manera correcta de preparar e inyectar ACTEMRA. No intente inyectar ACTEMRA hasta que su proveedor de atención médica le haya mostrado la manera correcta de aplicar las inyecciones. Su proveedor de atención médica le dirá cuánto ACTEMRA usar y cuándo usarlo. 42 ¿Cuáles son los efectos secundarios posibles con ACTEMRA? ACTEMRA puede causar efectos secundarios graves, incluyendo: • Consulte “¿Cuál es la información más importante que debo saber sobre ACTEMRA?” • Infección por hepatitis B en las personas que transportan el virus en su sangre. Si usted es portador del virus de la hepatitis B (un virus que afecta al hígado), el virus podría activarse mientras use ACTEMRA. Su médico podría hacer análisis de sangre antes de que inicie el tratamiento con ACTEMRA y mientras esté usando ACTEMRA. Informe a su proveedor de atención médica si tiene cualquiera de los siguientes síntomas de una posible infección por hepatitis B: o sentirse muy cansado o piel u ojos amarillentos o poco o ningún apetito o vómitos o movimientos intestinales del color de arcilla o fiebres o escalofríos o malestar estomacal o dolores musculares o orina oscura o erupción de la piel • Reacciones alérgicas graves. Las reacciones alérgicas graves, incluyendo la muerte, pueden suceder con ACTEMRA. Estas reacciones pueden suceder con cualquier infusión o inyección de ACTEMRA, aunque no hayan ocurrido con una infusión o inyección anteriormente. Informe a su proveedor de atención médica antes de su dosis siguiente si tuvo urticaria, erupción o rubor después de su inyección. Busque atención médica inmediatamente si tiene alguno de los siguientes signos de reacción alérgica grave: o falta de aliento o dificultad para respirar o hinchazón de los labios, la lengua o la cara o dolor en el pecho o sentirse mareado o débil o dolor abdominal de moderado a severo o vómitos • Problemas del sistema nervioso. Aunque es rara, se ha diagnosticado esclerosis múltiple en personas que reciben ACTEMRA. Se desconoce qué efecto puede tener ACTEMRA sobre algunos trastornos del sistema nervioso. Los efectos • • • • secundarios comunes de ACTEMRA incluyen: infecciones del tracto respiratorio superior (resfrío común, infecciones sinusales) cefalea aumento de la presión arterial (hipertensión) reacciones en el sitio de la inyección Informe a su proveedor de atención médica si tuviera algún efecto secundario que le moleste o que no desaparezca. Estos no son todos los efectos secundarios posibles de ACTEMRA. Para obtener más información, consulte con su proveedor de atención médica o farmacéutico. 43 Llame a su médico para pedir consejo médico sobre efectos secundarios. Puede informar sobre efectos secundarios a la FDA al 1-800-FDA-1088. También puede informar sobre efectos secundarios a Genentech al 1-888-835-2555. Información general sobre ACTEMRA. A veces los medicamentos son recetados para fines que no son aquellos enumerados en una Guía de medicamentos. Esta Guía de medicamentos resume la información más importante sobre ACTEMRA. Si deseara más información, hable con su proveedor de atención médica. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre ACTEMRA que esté escrita para profesionales de la salud. Para obtener más información, vaya a www.ACTEMRA.com o llame al 1-800-ACTEMRA. ¿Cuáles son los ingredientes de ACTEMRA? Ingrediente activo: tocilizumab Ingredientes inactivos de ACTEMRA intravenoso: sucrosa, polisorbato 80, dodecahidrato de fosfato disódico, dihidrógeno fosfato de sodio dihidrato. Ingredientes inactivos de ACTEMRA subcutáneo: L-arginina, clorhidrato de L-arginina, Lmetionina, L-histidina, monoclorhidrato de L-histidina. Esta Guía de Medicamentos ha sido aprobada por la Administración de Alimentos y Medicamentos de EE.UU. GM revisada: Octubre de 2013 ACTEMRA es una marca registrada de Chugai Seiyaku Kabushiki Kaisha Corp., un miembro del Grupo Roche. © 2014 Genentech, Inc. Todos los derechos reservados. 44