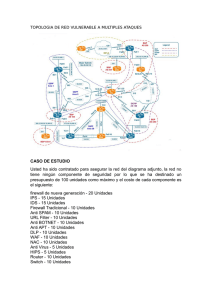
Hematolog a22000emplane
Anuncio

Rev Cubana Hematol Inmunol Hemoter 2000;16(2):78-89 Artículos de revisión Instituto de Hematología e Inmunología UTILIZACIÓN DE LA SANGRE Y SUS COMPONENTES CELULARES Dr. Lázaro Cortina Rosales y Dra. María del Rosario López De Roux RESUMEN La terapia transfusional es una ciencia en constante renovación. En la actualidad las ventajas de la transfusión de componentes individuales han limitado el empleo de sangre total. Los parámetros clínicos y no la cifra de hemoglobina son determinantes al decidir una transfusión de concentrados de hematíes. Se ha podido comprobar que la refractariedad a la administración de plaquetas como consecuencia de la aloinmunización es elevada, por lo tanto, las indicaciones para su empleo son precisas. La poca efectividad de los concentrados de granulocitos y sus múltiples efectos adversos han cuestionado su empleo. Los componentes celulares especiales son costosos y requieren de procedimientos engorrosos para su elaboración, por lo que deben utilizarse en pacientes seleccionados con indicaciones estrictas. Las características anátomo-fisiológicas de los pacientes pediátricos y especialmente de los recién nacidos y lactantes, hacen que la terapia transfusional tenga sus particularidades. Los beneficios de la transfusión de componentes celulares son reales, sin embargo, pueden presentarse efectos adversos importantes y por eso cada indicación requiere una valoración profunda que garantizará un mejor aprovechamiento y éxito de la hemoterapia. Descriptores DeCS: TRANSFUSION SANGUINEA; PEDIATRIA; TRANSFUSION DE COMPONENTES SANGUINEOS. La transfusión de sangre ha adquirido en nuestros días un gran desarrollo y seguridad; sin embargo, una práctica transfusional adecuada requiere de una constante y crítica valoración clínica, si se tiene en cuenta que la transfusión de sangre alogénica continúa siendo riesgosa. En un estudio publicado recientemente en Estados Unidos de Norteamérica se determinó que las complicaciones como la reacción febril no hemolítica (RFNH) y la urticaria se presentan en 1:100 unidades transfundidas, la hemólisis inmune en 1-6 000 unidades y la hemólisis inmune fatal en 1-100 000 unidades; el riesgo de transmisión de hepatitis B y C es de 1 x 65 000 y 1 x 100 000 unidades, respectivamente, mientras que para el VIH es de 1 x 500 000 unidades y los virus 78 − Concentrados de hematíes congelados. − Concentrados de hematíes libres de leucocitos por filtración. − Plasma rico en plaquetas. − Concentrados de plaquetas. − Concentrados de plaquetas obtenidos por aféresis. − Concentrados de leucocitos. − Componentes irradiados. − Plasma fresco congelado. − Plasma homólogo. − Crioprecipitado. linfotrópicos humanos I y II tienen una probabilidad de 1 x 50 000.1,2 Algunos de los problemas presentes en la práctica transfusional corriente, son la elevada proporción de transfusiones que son catalogadas como innecesarias y la variabilidad en los criterios para determinar la necesidad de una transfusión, los que suelen ser complejos y de difícil aplicación a una población heterogénea.2,3 Estos hechos representan una preocupación para la medicina transfusional y exigen una revisión sobre el uso de la sangre y sus componentes. SANGRE TOTAL FRESCA LA TRANSFUSIÓN DE SANGRE Y SUS COMPONENTES El empleo de sangre fresca de menos de 24 horas es una práctica transfusional del pasado. Una unidad de sangre total contiene hematíes, leucocitos, plaquetas, proteínas plasmáticas, globulinas, anticuerpos, factores estables de la coagulación, etc., y 63 mL de anticoagulante. Tiene un hematócrito ligeramente menor al del donante, debido a la dilución por el anticoagulante / preservativo (CPDA-1) y su volumen es de 450 +/- 45 mL. Existen varios elementos que no aconsejan su uso, como son: mayor posibilidad de transmisión de enfermedades virales; no suele estar disponible de forma fresca dado los complejos y numerosos controles que requiere la sangre; las plaquetas y proteínas de la coagulación contenidas en una unidad de sangre total fresca son insuficientes en cantidad y calidad para corregir defectos específicos, solo aportados por los concentrados de plaquetas y factores de la coagulación. No obstante, algunas instituciones emplean la sangre total en las siguientes circunstancias:5 La sangre es una mezcla de diversas poblaciones celulares y proteínas plasmáticas en un medio acuoso. Cada uno de estos elementos tiene una función bien definida. El objetivo de la transfusión es remplazar el producto sanguíneo deficitario en el paciente desde el punto de vista cuantitativo o cualitativo. Desde los inicios del siglo XX, algunos médicos predicaban el empleo de componentes individualizados a partir de la sangre total, recomendaban la utilización de hematíes desplasmatizados en la anemia sin hipovolemia y el uso solo de plasma en caso de quemaduras graves.4 No fue hasta la década de los 60, con el desarrollo de material plástico para las bolsas y equipos de transfusión, que se hizo una práctica rutinaria la separación de la sangre en componentes, lo que permitió una mayor racionalidad y respetar las necesidades del enfermo. SANGRE Y SUS COMPONENTES − Transfusión masiva. − Exanguinotransfusión. − Cirugía cardio-pulmonar con circulación extracorpórea. − Sangre total fresca. − Concentrados de hematíes. − Concentrados de hematíes lavados. 79 En estas situaciones, es más adecuado el empleo de concentrados de glóbulos rojos combinados con sustancias cristaloides y coloides y según los resultados de laboratorio y la existencia de sangramiento microvascular, se administrarán otros componentes (concentrados de plaquetas, plasma fresco congelado o ambos). No está indicada como expansor de volumen.5 Dosis: debe ajustarse a las necesidades clínicas del paciente. Una unidad debe producir un incremento de la concentración de hemoglobina (Hb) en 10 g/L. La duración de la administración no debe ser mayor de 4 horas. se correlaciona con la cuantía de esta y el estado clínico del paciente:7,9,10 − Pérdidas menores del 20 % del volumen sanguíneo estimado no suelen ocasionar síntomas y la transfusión de hematíes no es necesaria, salvo en aquellos pacientes que previamente tenían niveles de Hb menores de 100 g/L o exista alguna enfermedad de base que determine la aparición de trastornos cardiovasculares y síntomas de hipovolemia. − Las pérdidas mayores o iguales al 20 % del volumen sanguíneo estimado suelen ser sintomáticas y deben administrarse glóbulos rojos precedidos de sustancias cristaloides y coloides para reponer el volumen sanguíneo y la capacidad de transporte de oxígeno; otros componentes de la sangre se administrarán según los resultados de los exámenes de laboratorio. 3. La transfusión perioperatoria: la práctica de la anestesia quirúrgica ha sido guiada por la creencia de que un valor de Hb menor de 100 g/L o un hematócrito menor del 30 % es una indicación para la transfusión. En nuestros días estos criterios son discutidos y se señala con insistencia que en lugar de corregir un valor de laboratorio, deberán tomarse en consideración múltiples factores como la duración de la anemia, el volumen intravascular, extensión de la cirugía, probabilidad de una pérdida masiva de sangre, así como otras condiciones coexistentes, como son: deterioro de la función respiratoria, gasto cardíaco inadecuado, isquemia miocárdica o cerebrovascular y la enfermedad vascular periférica. Si la persona está sana y no existen factores de riesgo adicionales asociados a la naturaleza de la cirugía, los niveles de Hb menores o iguales a 80 g/L serán bien tolerados si el paciente está bien controlado. Un estudio de 82 pacientes con un hematócrito medio de 24,5 % Concentrados de hematíes Se obtienen después que la sangre total ha sido centrifugada y separado el plasma y la capa leucoplaquetaria. Las células rojas en solución CPDA-1 se almacenan hasta 35 días a una temperatura entre 2 y 6 °C; tiene un volumen de 250 a 300 mL y un hematócrito final no mayor del 80 %. El objetivo fundamental de su empleo es mejorar la capacidad de transportar oxígeno. Una unidad de concentrado de hematíes debe incrementar los niveles de hemoglobina en 10 g/L y el hematócrito en 3 % en un receptor de 70 kg de peso. En la actualidad, los criterios más aceptados para la transfusión de concentrados de hematíes son los siguientes: 5-8 1. Anemia sintomática en un paciente normovolémico independiente de los niveles de Hb. El estado clínico del paciente y no el resultado de laboratorio es el factor más importante para determinar las necesidades transfusionales. 2. En las pérdidas agudas de sangre la necesidad de la transfusión de glóbulos 80 no reveló un aumento de la morbilidad intraoperatoria, ni de la mortalidad posoperatoria.5 4. Hemoglobina menor o igual a 90 g/L en un paciente en régimen de hipertransfusión crónica (β talasemia mayor).11 5. Complicaciones de la drepanocitosis: la transfusión de glóbulos suele ser necesaria en muchas de las complicaciones como son la crisis aplástica, crisis de secuestro, accidentes vasculares encefálicos, síndrome torácico agudo, priapismo, entre otras. Teniendo en cuenta las características y la gravedad de estas se emplea la transfusión simple, la exanguinotransfusión o el régimen de transfusión crónica.12,13 6. Hemoglobina menor o igual a 80 g /L en pacientes que reciben radioterapia o quimioterapia. No constituyen indicaciones de transfusión de hematíes la promoción de la cicatrización de heridas, la prevención de infecciones o la corrección del tiempo de sangría prolongado. plaquetas del paciente, el valor que se desea alcanzar, el volumen sanguíneo y la presencia de factores secundarios que compliquen la respuesta; sin embargo, empíricamente se ha adoptado la dosis de 1 unidad / 10 kg de peso o 4 unidades / m2 de superficie corporal, con lo cual se logra un incremento de la cifra de plaquetas mayor o igual a 50 x 109/L sobre el conteo previo y se obtiene un efecto terapéutico satisfactorio. El intervalo entre las siguientes dosis lo determinará el estado clínico del paciente y la existencia de situaciones que disminuyan la sobrevida plaquetaria; en casos de trambocitopenia no complicada la transfusión está indicada 2 ó 3 veces por semana, mientras que en pacientes que presenten fiebre, sepsis, hepatoesplenomegalia, sangrado activo, sometidos a quimioterapia y otros agravantes, es necesario suministrar plaquetas 2 veces al día. El PRP suele ser similar al concentrado de plaquetas obtenido de un donante, con la desventaja de contener un mayor volumen de plasma. La velocidad de administración está determinada por la tolerancia al volumen y el tiempo máximo de infusión debe ser de 4 horas. Las plaquetas se almacenan en agitación continua a 22 °C por un período de 5 días, si permanecen a 4 °C sin agitación su viabilidad disminuye. La transfusión de plaquetas puede ser profiláctica o terapéutica y los criterios para su indicación son los siguientes: 5-7,13,14 CONCENTRADOS DE PLAQUETAS Y PLASMA RICO EN PLAQUETAS (PRP) La transfusión de plaquetas es apropiada para prevenir o controlar los sangramientos asociados a defectos cualitativos o cuantitativos de las plaquetas. El concentrado de plaquetas obtenido de una unidad de sangre entera contiene de 0,55-0,75 x 1011 plaquetas en 40-60 mL de plasma y en condiciones óptimas es de esperar que eleve el recuento plaquetario en un receptor de 70 kg de peso en 5 000 a 10 000. Para establecer la dosis óptima y la frecuencia de administración, se deben tener en cuenta el número de TRANSFUSIÓN PROFILÁCTICA 1. Trombocitopenia hipoproliferativa con: − Recuento plaquetario menor o igual a 10 x 109/L sin sangramiento. − Recuento plaquetario menor o igual a 20 x 109/L sin sangramiento, pero con factores que favorecen la ocurrencia del mismo: infecciones, fiebre, espleno- 81 − − − 2. megalia, lesión anatómica, medicación anticoagulante, coagulopatía. Recuento plaquetario menor o igual a 50 x 10 9 /L y cirugía mayor o proceder invasivo. Recuento plaquetario menor o igual a 100 x l0 9/L y cirugía de cerebro. Los pacientes con leucemia y recuento de blastos mayor de 100 000 en sangre periférica deben mantener niveles de plaquetas mayores de 50 x 109/ L por el peligro de leucostasis cerebral o pulmonar. En pacientes con disfunción plaquetaria y cirugía inminente, parto, proceder invasivo, extracción dentaria, teniendo presentes las características individuales de cada paciente. tromboféresis. Contiene una dosis terapéutica para un paciente adulto (>3 x 1011 plaquetas). El volumen oscila entre 200 y 500 mL. El contenido en leucocitos varía según el separador celular empleado y si el procedimiento incluye filtrado prealmacenaje. Están particularmente indicados en aquellos pacientes que van a recibir múltiples transfusiones de plaquetas (trasplante de médula ósea), para disminuir el número de exposiciones a donantes y así reducir el riesgo de sensibilización a antígenos leucocitarios y plaquetarios. También si se necesitan plaquetas tipadas HLA-HPA o con prueba cruzada compatible para aquellos pacientes que desarrollan una refractariedad de tipo inmunológico. No son más útiles que los concentrados de plaquetas en la coagulación intravascular diseminada, púrpura trombocitopénica autoinmune y esplenomegalia. La conservación, caducidad y administración es similar a los concentrados de plaquetas habituales. El aumento esperado de recuento plaquetario es de 30 a 60 x 109/L a los 60 minutos posteriores a la transfusión.15 TRANSFUSIÓN TERAPÉUTICA 1. Síndromes hemorrágicos en el curso de trombocitopenia; en estos casos constituye una meta razonable alcanzar cifras en el recuento plaquetario postransfusional mayores o iguales a 40 x 109 /L. 2. Sangramiento microvascular difuso en un paciente con coagulación intravascular diseminada o transfusión masiva y un recuento de plaquetas no disponible o menor de 50 x 109/L. 3. Sangramiento microvascular difuso que se presenta posterior a un bypass cardiopulmonar o balón intraaórtico y recuento plaquetario no disponible o menor de 100 x 109/L. 4. Sangramiento microvascular y disfunción plaquetaria con tiempo de sangramiento prolongado. CONCENTRADOS DE GRANULOCITOS Se preparan por 2 métodos: leucoféresis por centrifugación con flujo continuo o intermitente y leucoféresis por filtración, se almacenan entre 20 y 24 °C durane 24 horas, pero lo mejor es transfundirlos tan pronto como sea posible luego de la extracción, ya que a partir de las 8 horas de almacenamiento muestran una reducción de la capacidad circulante y migratoria de los granulocitos.5 Aunque los primeros estudios mostraron beneficios en adultos con neutropenia reversible e infecciones por CONCENTRADOS DE PLAQUETAS OBTENIDOS POR AFÉRESIS Suspensión de plaquetas de donante único obtenido mediante procedimiento de 82 que a las 48 horas no responde al tratamiento antibiótico agresivo, con hipoplasia mieloide y la posibilidad razonable de recuperar la función de la médula ósea. − Los pacientes con disfunción granulocítica documentada (enfermedad granulomatosa crónica) y sepsis bacterianas progresivas.16,17 gérmenes gramnegativos que no respondían al tratamiento antibiótico, la experiencia acumulada posteriormente en pacientes sometidos a trasplante de médula ósea con infecciones ha sido decepcionante, es por eso que su eficacia clínica en adultos es un tema de controversia actualmente. 16-18 Se señalan otros elementos que han reducido su empleo, como el uso de nuevos agentes antimicrobianos más potentes, 5,16 los factores estimuladores de colonias que acortan el período de aplasia 16 y los efectos adversos, que suelen ser frecuentes y de importancia clínica (transmisión de citomegalovirus, reacción pulmonar fatal, enfermedad de injerto contra huésped (EICH), inmunomodulación, reacciones febriles no hemolíticas).16,17 Dosis: es otro aspecto en discusión. Los concentrados habitualmente (75 %) tienen al menos 1010 neutrófilos, lo que para un paciente de 70 kg de peso equivale a 1,5/108 neutrófilos x kg de peso. Sin embargo, un individuo saludable tiene un recambio diario de 10 11 neutrófilos y es mucho mayor en pacientes con enfermedades inflamatorias. La dosis de 10 10 es sólo la décima parte del recambio diario, si fuera posible suministrar 10 11 neutrófilos por transfusión podría esperarse una respuesta clínica convincente.13 En lactantes sépticos los resultados obtenidos han sido satisfactorios, esto se ha atribuido a la dosis relativamente mayor en receptores con menor superficie corporal o porque está ausente la aloinmunización. 5,7,16 A pesar de que el uso de la transfusión de granulocitos ha disminuido considerablemente, los criterios clínicos para su empleo no han cambiado:16-18 Siempre que se decida indicar una transfusión de concentrado de granulocitos, debe administrarse una dosis diaria hasta que se controle la infección o cese el período de aplasia. La velocidad de infusión debe ser lenta, de 1 a 4 horas y se debe tener presente no administrar Anfotericin B en las primeras 4 horas posteriores a la transfusión de granulocitos, ya que se ha observado un aumento en la incidencia de disfunción pulmonar aguda.16 La transfusión profiláctica no es aceptada. TRANSFUSIÓN EN PEDIATRÍA Muchos de los lineamientos señalados para la transfusión en adultos son aplicados en pacientes pediátricos, aunque existen diferencias anatomofisiológicas que determinan indicaciones particulares, principalmente en recién nacidos y lactantes. Estos pacientes tienen un volumen sanguíneo mayor en relación con su superficie corporal (85 mL x kg de peso), los mecanismos de compensación cardiovascular son inmaduros, esto los hace más susceptibles a la hipovolemia y el control de la temperatura corporal no es eficiente con peligro de desarrollar hipotermia si se emplean componentes sin la temperatura adecuada. El defecto fisiológico del sistema inmune ocasiona una mayor susceptibilidad a las infecciones − Pacientes con neutropenia menor de 0,5 x 109, e infección bacteriana severa 83 transmitidas por la sangre, así como la inmadurez de órganos vitales (riñón e hígado) determina el empleo de componentes frescos (menores de 5 días) para evitar las complicaciones metabólicas.5,19 flebotomías para exámenes de laboratorios exceden el 10 % del volumen de sangre, en una semana. − Hemoglobina menor de 80 g/L en un recién nacido con manifestaciones clínicas de anemia. SANGRE TOTAL O SANGRE RECONSTITUIDA NIÑOS MAYORES DE 4 MESES DE EDAD Indicaciones: 6,19,20 Los criterios para su uso son: − Hemoglobina preoperatoria menor de 80 g/L cuando la terapia alternativa no es aconsejable o la Hb posoperatoria es menor de 80 g/L y el paciente tiene síntomas y signos de anemia. − Pérdida aguda mayor o igual al 15 % del volumen de sangre o existen síntomas y signos de anemia que no responden a la administración de fluidos. − Hemoglobina menor de 130 g/L y enfermedad cardiopulmonar severa. − Hemoglobina menor de 80 g/L en pacientes que reciben quimioterapia y/o radioterapia. − Complicaciones de la drepanocitosis. 12,13 − Hemoglobina menor de 80 g/L en pacientes con anemia crónica sin esperanza de respuesta a medicamentos o síntomas y signos de anemia. − Enfermedades con régimen de transfusión crónica (talasemia, etc). 1. Exanguinotransfusión por enfermedad hemolítica del recién nacido u otra entidad que ocasiona aumento de la bilirrubina no conjugada con peligro de kerníctero. 2. Oxigenación por membrana extracorpórea y bypass cardiopulmonar. 3. Reposición de más de un volumen de sangre en 24 horas. CONCENTRADOS DE GLÓBULOS ROJOS Se emplearán a razón de 5 a 15 mL/kg de peso y la velocidad de infusión debe ser de 2 a 5 mL/kg de peso x hora. NIÑOS MENORES DE 4 MESES DE EDAD La transfusión de glóbulos rojos en este grupo de edad está generalmente relacionado con la anemia del prematuro y menos comúnmente con la pérdida aguda de sangre, aplasia de células rojas y episodios agudos de hemólisis secundarios a esferocitosis hereditaria, déficit enzimáticos, etc.19 Indicaciones: 5, 6, 19,20 CONCENTRADOS DE PLAQUETAS Y PRP En los pacientes prematuros menores de 37 semanas de edad gestacional, la administración de este componente tiene indicaciones específicas:6,15 − Hemoglobina menor de 130 g/L y enfermedad pulmonar severa, cardiopatía cianótica o fallo cardíaco. − Pérdida aguda de más del 10 % del volumen de sangre o cuando las − Recuento de plaquetas menor de 50 x 109 L en ausencia de sangrado. − Recuento de plaquetas menor de 100 x 10 9 /L y hemorragia activa. 84 En los no prematuros: - especiales, estos son costosos, requieren tiempo adicional de preparación y su vida media es corta; es por eso que su indicación debe ser previamente justificada. Neonatos con menos de 20 x 109/L. Si el exceso de volumen representa un problema potencial, se debe extraer plasma de la unidad y la velocidad de infusión estará determinada por esta situación, aunque no debe ser mayor de 4 horas. En neonatología el objetivo habitualmente es aumentar la cifra de plaquetas por encima de 100 x 10 9/L. Siempre que sea posible transfundiremos isogrupo. La transfusión de plasma incompatible es más peligrosa que en adultos, debido a que su volumen de sangre es menor. El plasma incompatible debe eliminarse hasta donde sea posible y resuspender las plaquetas en plasma compatible. CONCENTRADOS DE HEMATÍES DESLEUCOCITADOS POR FILTRACIÓN Los componentes celulares que contienen células blancas pueden causar efectos adversos, incluyendo reacciones febriles, aloinmunización, refractariedad plaquetaria, enfermedad de injerto contra huésped, inmunomodulación e infecciones. La reducción de leucocitos en los concentrados de hematíes previene algunos de estos efectos. Existen varios tipos de filtros disponibles para la remoción de leucocitos, que pueden extraer entre el 70 y el 99,9 % de los leucocitos presentes en la unidad, en dependencia del tipo de filtro utilizado. Sus indicaciones más frecuentes son: 4,6,7,22 CONCENTRADOS DE GRANULOCITOS Indicaciones en neonatos:6,19-21 − Infección bacteriana en recién nacido menor de 2 semanas de edad con conteo de neutrófilos menor de 3 x 109/L. − Infección bacteriana o fúngica diseminada que no responde al tratamiento antibiótico en pacientes mayores de 2 semanas de edad y conteo de neutrófilos menores de 0,5 x 109/L. − Infección que no responde a los antibióticos y la presencia de un defecto cualitativo de los neutrófilos independiente del recuento. − Prevención de la reacción transfusional febril no hemolítica recurrente. − Prevención o retraso de la aloinmunización por antígenos leucocitarios de histocompatibilidad (HLA) y de la refractariedad plaquetaria en pacientes seleccionados que requieren transfusiones repetidas. − Prevenir la trasmisión de virus intraleucocitarios particularmente CMV. La dosis promedio es de 10 mL/kg de peso y la velocidad de infusión lenta (4 horas). Su utilidad para prevenir la enfermedad de injerto contra huésped es discutida y no es una técnica aceptada para prevenir la reacción pulmonar aguda, ya que en ella el elemento fisiopatogénico más importante es el paso de anticuerpos del donante con especificidad por antígenos leucocitarios.6,7 COMPONENTES CELULARES ESPECIALES En ciertos grupos de pacientes es aconsejable el empleo de componentes 85 − Unidades para la transfusión de pacientes aloinmunizados, cuando las unidades antígeno negativas son de difícil obtención por poseer múltiples aloanticuerpos o ser un antígeno muy frecuente en la población. − Reservas para movilizaciones militares y catástrofes civiles.5 − Como en su preparación se emplean lavados múltiples, las indicaciones de hematíes lavados y desleucocitados se hacen extensivas a este tipo de componente. CONCENTRADOS DE HEMATÍES LAVADOS Este proceso elimina la mayor parte de las proteínas del plasma, microagregados y citocinas, así como cantidades variables de plaquetas y leucocitos. Su desventaja reside en que son más costosos, tienen una corta vida de almacenamiento (6 horas), ocurren pérdidas hasta del 20 % de eritrocitos y es menos efectivo que los filtros en la eliminación de los leucocitos. Los criterios para su uso son:6,7,22 − Pacientes con historia de reacción anafiláctica a componentes de la sangre. − Déficit de IgA documentada con anticuerpos anti IgA. − Reacciones urticarianas severas no prevenibles con antihistamínicos. − Prevención de la aloinmunización contra antígenos leuco-plaquetarios y la reacción febril no hemolítica cuando se carece de filtros de absorción de leucocitos y plaquetas. − Reacciones febriles no prevenibles por el empleo de hematíes desleucocitados. − Púrpura aloinmune neonatal cuando la madre es la donante. COMPONENTES LIBRES DE CMV No es necesario suministrar sangre CMV-negativa o libre de leucocitos a todos los pacientes porque la infección adquirida de CMV raramente causa secuelas clínicas en individuos inmunocompetentes. Los pacientes inmunocomprometidos presentan riesgo de enfermedad grave; los métodos habituales que reducen el riesgo de infección por CMV son la transfusión de sangre de donantes seronegativos y los concentrados desleucocitados, sin embargo, el primer método es más seguro. Indicaciones de sangre seronegativa para CMV:6,22,23 − Mujeres embarazadas y fetos CMVseronegativos − Recién nacidos con un peso menor 1 200 g nacidos de madres seronegativas. − Receptor de trasplante de médula ósea (TMO) alogénico CMV-seronegativo y donante también seronegativo. − En pacientes con infección por VIH y que son CMV seronegativos. HEMATÍES CONGELADOS Y DESGLICEROLIZADOS La producción de estos concentrados suele ser costosa y engorrosa. Además, ocurre cierto grado de hemólisis con disminución del hematócrito inicial cuando se conservan a –196 °C en nitrógeno líquido. Hay un aumento del potasio extracelular. La no desglicerolización total puede producir hemólisis in vivo. El período de almacenamiento es largo, de 10 años o más, lo cual le confiere indicaciones precisas: 5-7,22 Son más controvertidas las siguientes indicaciones de concentrados libres de CMV: − Receptor de trasplante de órgano CMVseronegativo y donante seropositivo. − Para almacenamiento de unidades de hematíes autólogos por más de 42 días. 86 − Pacientes CMV seronegativos candidatos potenciales a TMO alógenico o autólogo. − Receptor de TMO autólogo CMV seronegativos. − Pacientes CMV seronegativos que se les ha practicado esplenectomía. − Pacientes con tumores sólidos con tratamiento inmunosupresor. − Prematuros con peso menor de 1 200 g. En los últimos años, la percepción del riesgo-beneficio de la transfusión sanguínea ha cambiado dramáticamente. Al exponer en este trabajo criterios actualizados en relación con el empleo de la sangre total y sus componentes celulares, no pretendemos imponer esquemas de indicaciones absolutas, sino que cada institución teniendo en cuenta su experiencia clínica y los recursos a su alcance, sea capaz de introducir estos nuevos conceptos en la práctica. Todo médico al indicar una transfusión debe formularse las siguientes preguntas: ¿existe una indicación real para la transfusión de sangre o sus componentes?, ¿cuál es el componente ideal que necesita el paciente? ¿cuáles son los efectos adversos de la transfusión, su prevención y control? La adecuada valoración de cada respuesta redundará en un mejor aprovechamiento y éxito de la terapia transfusional. COMPONENTES SANGUÍNEOS IR RADIADOS Con la irradiación de los componentes se reduce el riesgo de EICH al reducir la respuesta proliferativa de los linfocitos. La dosis habitual es de 25 Gy en la parte central de la unidad con un mínimo de 15 Gy en las otras partes del componente. Están indicados en:4,6,7,22 − Receptores de TMO. − Pacientes con síndromes de inmunodeficiencia congénita. − Fetos que reciben transfusión intrauterina o recién nacidos a los que se les practica exanguinotransfusión siguiendo la transfusión intrauterina. − Pacientes con enfermedad de Hodgking. − Receptores de donaciones directas de un miembro de la familia. AGRADECIMIENTO Algunas instituciones también incluyen, aunque no de forma absoluta, los casos siguientes:6 Agradecemos la asesoría científica de la Dra. María Elena Alfonso Valdés, el Lic. Antonio Bencomo Hernández y el Prof. José Manuel Ballester Santovenia. − Pacientes con otras enfermedades malignas que no sean Hodgking. SUMMARY Transfusion therapy is a science of ongoing development. At present, the advantages of the individual blood component transfusions have restricted the use of whole blood. The clinical parameters rather than hemoglobin figures are determining in deciding transfusion of red cell concentrates. It has been proved that refractoriness to platelet administration as a consequence of alloimmunization is high, so indications for their use should be clear. The low effectiveness of granulocyte concentrates and their multiple adverse effects have questioned their use. Special cellular components are expensive and require embarrassing procedures for their manufacture and therefore, they should be used in selected patients under strict indications. The anatomical and physiological 87 characteristics of the pediatric patients specially infants and newborn provide transfusion therapy with certain particularities. The benefits of transfusion of cellular components are real; however, important adverse effects may come up and that is why each indication demands a thorough assessment that assures a better use and the success of hemotherapy. Subject headings: BLOOD TRANSFUSION; PEDIATRICS; BLOOD COMPONENT TRANSFUSION. REFERENCIAS BIBLIOGRÁFICAS 1. Kasper CK. Transfusion risks: what’s necessary?. Hemophilia Bull 1998;(Nov):1-4. 2. Hasley PB, Lave JR, Kapoor WN. The necessary and the unnecessary transfusion: a critical review of reported appropriateness rates and criterio for red cell transfusions. Transfusion 1994;34:110-5. 3. Blumberg N, Triulzi DJ, Heal JM. Transfusion-induced immunomodulation and its clinical consequences. Transfus Med Rev 1990;4:24-5. 4. Genetet B, Mannoni P. Antecedentes históricos. En: Genetet B, Mannoni P. La transfusión. La Habana: Editorial Científico-Técnica, 1984:1-9. 5. American Association of Blood Bank, Asociación Española de Hematología y Hemoterapia. Manual técnico. 10 ed. Barcelona: Pecalo, 1990:407-19. 6. Stehling L, Lubabn NLC, Anderson KC, Sayers MH, Long A, Attar S, et al. Guidelines for blood utilization review. Transfusion 1994;34:438-48. 7. Linares J. Uso clínico de los componentes celulares. En: López Borrasca A. Enciclopedia Iberoamericana de Hematología IV. Salamanca: Universidad, 1992:187-98. 8. Gibbs WN, Michel G. Clinical aspects of blood transfusion in adults. Vox Sang 1994; 67 (Suppl 5):43-9. 9. Maatta TK. Management of acute blood loss. Vox Sang 1994;67 (Suppl 5):59-61. 10. Carbonell F. Transfusión masiva. En: López Borrasca A. Enciclopedia Iberoamericana de Hematología IV. Salamanca: Universidad, 1992:235-9. 11. Rund D, Rachmilewitz E. Advances in the pathophysiology and treatment of thalassemia. Oncol Hematol 1995;20:234-54. 12. Vichinsky E. Transfusion therapy. Sickle cell disease: basic principles and clinical practice. New York: Raven, 1994:781-95. 13. Serjean GE. Transfusion. En: Sickle cell disease. 3 ed. Oxford: Oxford University, 1992:433-9. 14. Morera Barrios LM. Concentrado de plaquetas: II. Evaluación in vivo. Rev Cubana Hematol Inmunol Hemoter 1990;6:208-17. 15. Sheinbaurn AJ, Herman JH. Platelet transfusion: a review of key concepts. Immunohematology 1996;12:123-6. 16. Huestis DW, Glasser L. The neutrophil in transfusion medicine. Transfusion 1994;34:630-41. 17. Straus R. Therapeutic granulocyte transfusion in 1993. Blood 1993;81:1675-8. 18. Bhatia S, McCullough J, Perry EH, Clay M, Cramsa NR, Neglia JP. Granulocyte transfusions: efficacy in treating fungal infections in neutropenic patients following bone marrow transplantation. Transfusion 1994;34;226-32. 19. Sally CD, Sally EK Clinical aspects of paediatric blood transfusion: cellular components. Vox Sang 1994;67(Suppl 5):50-3. 20. Sherwin VK, Jeb BG. Red cell transfusion. En: Nathan DG, Orkin SH, ed. Nathan and Oski’s Hematology of infancy and childhood. 5 ed. Philadelphia: WB Saunder, 1998:1784-801. 21. Levy GJ, Straus RG, Hume H. National survey of neonatal transfusion practices: red blood cell therapy. Pediatrics 1993;91:523-9. 88 22. American Association of Blood Banks, Asociación Argentina de Hemoterapia e Inmunología. Manual técnico. 12 ed. Buenos Aires: Edigraf, 1997:407-19. 23. Hillyer CD, Emmens RK, Zago Novaretti M, Berkman EM. Methods for the reduction of transfusion-transmitted cytomegalovirus infection. Filtration versus use of seronegative donor units. Transfusion 1994;34:929-34. Recibido: 25 de marzo de 1999. Aprobado: 11 de octubre de 1999. Dr. Lázaro Cortina Rosales. Instituto de Hematología e Inmunología. Apartado 8070, CP 10 800, Ciudad de La Habana, Cuba. Teléf: (537)578268. Fax:(537) 338979.e-mail:ihidir@hemato.sld.cu 89 Rev Cubana Hematol Inmunol Hemoter 2000;16(2):90-8 Instituto de Hematología e Inmunología LA HEMOSTASIA EN EL EMBARAZO Dra. Delfina Almagro Vázquez RESUMEN En el embarazo se producen alteraciones del mecanismo hemostático que determinan condiciones particulares, las cuales propician la activación de este sistema biológico ante estímulos que en otra situación serían adecuadamente controlados por el organismo. Se ha comprobado que en el embarazo existe un estado de hipercoagulabilidad, por lo que se ha incluido en el grupo de las llamadas trombofilias adquiridas. En la tendencia trombótica del embarazo intervienen decisivamente elementos esenciales del mecanismo hemostático, el sistema de la coagulación, las plaquetas y el mecanismo fibrinolítico. Durante la gestación, se ha observado un aumento progresivo del fibrinógeno y los factores VII, VIII, IX y von Willebrand, complejos solubles de fibrina, complejos trombina-antitrombina y fragmentos 1 + 2 de la protrombina. También se ha encontrado disminución de la proteína C y de la proteína S, así como un aumento de la agregación plaquetaria, reducción de la capacidad de respuesta a la estimulación por la prostaciclina y disminución de la formación de AMPC . El embarazo ejerce un efecto notable sobre el sistema fibrinolítico fundamentalmente por aumento progresivo del inhibidor del activador del plasminógeno tipo 1 (PAI-1) y el inhibidor del activador del plasminógeno tipo 2 (PAI-2). Descriptores DeCS: HEMOSTATICOS; COMPLICACIONES HEMATOLOGICAS DEL EMBARAZO; PLAQUETAS; FIBRINOLISIS. o ambos, los que tienen una marcada influencia en la mortalidad materna. Un número importante de complicaciones obstétricas se expresan por episodios hemorrágicos y algo más del 20 % se deben a trastornos de la hemostasia. Durante el embarazo ocurren alteraciones importantes en varios órganos y sistemas, particularmente en aquellos relacionados con el comportamiento de la hemodinámica renal y cardiovascular. El mecanismo hemostático sufre también notables cambios durante la gestación y en numerosas investigaciones se ha demostrado que las complicaciones relacionadas con el embarazo presentan con frecuencia trastornos hemostáticos, que se expresan por episodios hemorrágicos, trombóticos TENDENCIA TROMBÓTICA EN EL EMBARAZO En el embarazo se producen alteraciones del mecanismo hemostático que 90 determinan condiciones particulares, las cuales propician la activación de este sistema biológico ante estímulos, que en otra situación serían adecuadamente controlados por el organismo. Desde el punto de vista clínico, esto se ha comprobado por la demostración de que la enfermedad trombótica y la coagulación intravascular diseminada (CID) son más frecuentes en las gestantes que en mujeres no embarazadas1 y que en los accidentes obstétricos la CID es una complicación común,2 por lo que no fue casual que la primera descripción de la CID fuera comunicada por Seegers3 en pacientes con complicaciones obstétricas. La repercusión de estos trastornos en los índices de mortalidad materna es sin dudas relevante, si se tiene en cuenta que entre el 74 y el 81 % de las muertes maternas se deben a procesos trombóticos que incluyen la CID. 4,5 Existe una amplia variabilidad en la incidencia de trombosis no fatal debido a las dificultades diagnósticas de este trastorno por la limitación del uso de algunas técnicas como la venografía y los estudios con fibrinógeno marcado;6 no obstante, con la introducción de otros métodos diagnósticos como la pletismografía de impedancia, se ha logrado optimizar el diagnóstico de algunos eventos trombóticos en estas pacientes. Bergqvist y otros 7 encontraron el 0,07 % de trombosis durante el embarazo. Estos mismos autores habían hallado una incidencia del 1,8 % después de la cesárea.8 Por otra parte, Letsky y Swiet9 en una revisión retrospectiva de 35 000 embarazadas, observaron que el 0,09 % de los casos presentaron trombosis venosa profunda (TVP) y tromboembolismo pulmonar (TP). Más recientemente Douketis y otros 10 encontraron una incidencia de TVP sintomática de entre 0,018 y 0,27 por cada 100 partos. Durante mucho tiempo se afirmó que el riesgo de trombosis es mayor durante el tercer trimestre del embarazo y en el período de posparto. 11 Sin embargo, estudios prospectivos recientes no han confirmado este criterio.12 Los datos antes mencionados demuestran que durante la gestación existen evidencias de un estado de hipercoagulabilidad, por lo que el embarazo se ha incluido en el grupo de las llamadas trombofilias adquiridas. Esta indudable tendencia a la trombosis tiene múltiples causas. Además de los trastornos de la hemostasia a que nos referimos más adelante, otros factores, presentes durante el embarazo, pueden contribuir al desarrollo de eventos trombóticos, entre ellos la disminución de tono venoso con reducción del flujo sanguíneo y la obstrucción mecánica del útero grávido con el subsecuente estasis. A continuación se detallan los factores de riesgo que influyen en la aparición de complicaciones tromboembólicas durante el embarazo: − − − − − − − − Cesárea. Historia de trombosis. Edad. Número de partos. Obesidad. Reposo físico. Hipertensión arterial. Trombofilia congénita o adquirida. Algunos de estos factores de riesgo como la historia previa de trombosis, obesidad, reposo prolongado, hipertensión arterial y antecedentes de trombofilia congénita y adquirida son similares a los de la población general. Recientemente ha sido encontrado un aumento de la incidencia de la mutación 91 conocida como factor V Leiden en mujeres embarazadas con episodios trombóticos durante el embarazo y el puerperio.13 Esta mutación consiste en una sustitución en el residuo 506 de la molécula del factor V de una arginina por una glutamina, que es precisamente el sitio de ruptura inicial de este factor por la proteína C activa (PCA), lo que determina una inactivación más lenta del factor Va y provoca un estado de hipercoagulabilidad.14-16 Esta alteración molecular ha sido encontrada en el 90 % de los pacientes con resistencia a la PCA17 y se considera que este trastorno es el defecto de la coagulación más frecuentemente asociado con la hipercoagulabilidad.18 WeinerMegnazi y otros 19 encontraron la mutación factor V Leiden y resistencia a la PCA en cerca del 50 % de pacientes con desprendimiento prematuro de la placenta y Decker y otros 20 observaron este trastorno en el 16 % de embarazadas con preeclampsia. Algunos autores han encontrado una reducción marcada del sangramiento intraparto en mujeres con resistencia a la PCA y sugieren que la mutación factor V Leiden, aunque es particularmente riesgosa en la población general, confiere ciertas ventajas en cuanto a la supervivencia en las portadoras de la mutación, por la disminución del riesgo de sangramiento durante el parto.21 La tendencia trombótica que se presenta en el embarazo es expresión de cambios importantes en componentes esenciales del mecanismo hemostático: sistema de la coagulación, plaquetas y mecanismo fibrinolítico. en el mecanismo de la coagulación, que son: − Aumento de fibrinógeno. − Aumento de los factores VII, VIII, IX y von Willebrand. − Aumento de los complejos trombinaantitrombina. − Aumento de los fragmentos 1+2 de la protrombina. − Disminución de la proteína C. − Disminución de la proteína S. Entre estos cambios se observa el aumento progresivo de algunos factores de la coagulación, particularmente el fibrinógeno y los factores VII, VIII, IX y von Willebrand. Se ha demostrado que el aumento de fibrinógeno es un factor de riesgo independiente de trombosis.22-24 . Por otra parte, el incremento de factor VII se ha asociado con enfermedad coronaria isquémica, y aunque no es un criterio generalizado, algunos autores coinciden en que el aumento de este factor es también un factor de riesgo independiente de trombosis.25 La elevación de los factores VIII y von Willebrand se ha observado en sujetos con tendencia trombótica.26 Actualmente se consideran como marcadores de la activación del mecanismo de la coagulación algunos complejos moleculares que se forman durante este proceso. En el embarazo se ha observado un aumento de los complejos solubles de fibrina, 27 los complejos trombina-antitrombina (TAT),28 que junto con el incremento de los fragmentos 1+2 de la protrombina, expresan la existencia de activación de la coagulación. Los moduladores o inhibidores fisiológicos del mecanismo de la coagulación son de gran importancia en el desarrollo de episodios trombóticos. En el embarazo se han encontrado trastornos CAMBIOS EN EL MECANISMO DE LA COAGULACIÓN DURANTE EL EMBARAZO Se ha observado que durante el embarazo ocurre una serie de cambios 92 en el sistema de la proteína C (PC) con disminución de la PC y de la proteína S (PS).29,30 La PC es un importante modulador de la formación y degradación de la fibrina, se sintetiza en el hígado en presencia de vitamina K y es activada por un complejo formado por la trombina y la trombomodulina, que es una proteína integral de la membrana presente en la superficie de las células endoteliales y un receptor de alta afinidad para la trombina. La trombomodulina provoca un cambio conformacional en la trombina que le permite ejercer una acción activadora sobre la PC, que es entonces liberada de la superficie endotelial y se une a la PS que es su cofactor. El complejo PCA-PS inactiva los factores Va y VIIIa y promueve la fibrinólisis por inhibición del inhibidor del activador del plasminógeno-1 (PAI-1) (fig.1). 31,32 Es importante señalar que el 40 % de la PS se encuentra en el plasma en forma libre, que es su estado funcional, y el resto no tiene actividad biológica y está unida al componente del complemento C4b. 33 La PS actúa incrementando la afinidad de la PCA por los fosfolípidos cargados negativamente, lo que propicia su concentración en la superficie donde se producen las reacciones procoagulantes y permite que los factores Va y VIIIa sean fácilmente accesibles a la acción de este inhibidor.29 Algunos autores han estimado que las manifestaciones trombóticas se presentan en el 30 % de los pacientes con déficit de PC y en el 35 % de los deficientes de PS.34 Munster y otros35 en un estudio realizado en 42 mujeres embarazadas encontraron que el 95 % de los casos tenía disminución de la PS. Sin embargo, no hallaron ninguna alteración en los niveles de PC y antitrombina III. Aunque se ha sugerido la posibilidad de que el inhibidor de la vía del factor tisular, que ejerce su acción sobre el complejo factor tisular-factor VIIa, tenga algún papel en el estado de hipercoagulabilidad que se presenta en el embarazo, aún no se conoce bien qué factores influyen en los niveles de este inhibidor durante la gestación.36 Proteína C Trombina Trombomodulina Células endoteliales Proteína C activada-proteína S libre Inactivación de los factores Va y VIIIa Inhibición del PAI-1 93 FIG. 1. Activación de la proteína C. CAMBIOS EN LAS PLAQUETAS DURANTE EL EMBARAZO otros40 comprobaron que la sensibilidad de las plaquetas a un análogo de la PGI2 disminuyó progresivamente durante la gestación hasta llegar al 30 % al final del embarazo. Más recientemente se ha demostrado que durante el tercer trimestre del embarazo existe una reducción de la capacidad de respuesta de la adenilatociclasa a la estimulación por la PGI2 con una disminución de la formación de AMPc, lo que explicaría, al menos en parte, la activación plaquetaria in vivo que se presenta en el embarazo.41 El AMPc es un segundo mensajero de la activación plaquetaria y se forma a partir del ATP por acción de la adenilatociclasa (fig.2). Se ha demostrado que los agentes que aumentan el AMPc intracelular, tales como la PGE1 y la PGI2, limitan la reactividad plaquetaria, ya que su elevación incrementa la liberación de Ca++ a través de la membrana y promueve su ingreso en el sitio de almacenamiento, el sistema tisular denso.42,43 Por otra parte, se ha demostrado que la mayoría de las agonistas de la activación plaquetaria suprimen la formación de AMPc.44 Las plaquetas tienen también una función importante en la tendencia trombótica que se produce durante el embarazo y pueden ocurrir los siguientes cambios: − Aumento de la agregación plaquetaria. − Aumento de la prostaciclina en vasos maternos y fetales. − Reducción de la respuesta de la adenilatociclasa a la estimulación por la prostaciclina. − Disminución de la formación de AMPc. Al inicio de la década de los 80 se comprobó que en la gestación existía un aumento de la agregación plaquetaria.37 Algunos autores han observado que la producción de prostaciclina (PG12), prostaglandina sintetizada en la pared vascular a partir de los endoperóxidos lábiles y de conocida acción antiagregante y vasodilatadora, está aumentada en los vasos maternos y fetales cuando se compara con vasos de mujeres no embarazadas.38,39 Sin embargo, Briel y Fosfodiesterasa AMP ATP AMPc Adenilatociclasa Prostaciclina (PGI 2 ) FIG. 2. Formación del AMPc. 94 Además de los trastornos plaquetarios relacionados con la tendencia trombótica antes mencionados, durante el embarazo se ha observado con cierta frecuencia la presencia de tombocitopenia. Aunque puede tener diversas causas, la mayoría de los casos corresponde a la llamada trombocitopenia gestacional o incidental, si se descarta la preeclampsia.45 Este tipo de trombocitopenia puede aparecer entre el 6 y el 60 % de los embarazos y no representa ningún riesgo para la madre y el feto.46 Altes y otros 47 encontraron una incidencia significativamente superior, con el 62 % de trombocitopenia de carácter benigno en gestantes. Por otra parte, Boehlen y otros48 hallaron el 8,7 % de gestantes con trombocitopenia y anticuerpos antiplaquetarios. Sin embargo, dichos autores señalan que la presencia de estos anticuerpos no está relacionada con la severidad de la trombocitopenia, su persistencia después del parto y el riesgo de trombocitopenia neonatal. Para algunos autores, la trombocitopenia que se presenta en el embarazo traduce probablemente la hiperdestrucción plaquetaria fisiológica del último período de la gestación49 o un estado de CID crónica compensada. 37,50 El embarazo ejerce un efecto notable sobre el sistema fibrinolítico, en el que pueden ocurrir cambios tales como: − Aumento del inhibidor del activador del plasminógeno-1. − Aumento del inhibidor del activador del plasminógeno-2. − Disminución del activador tisular del plasminógeno. Hasta el tercer trimestre: − Aumento de productos de degradación del fibrinógeno. − Aumento de dímero D. Estos cambios provocan una disminución evidente de su activación, lo que contribuye de manera importante al estado de hipercoagulabilidad. La causa principal de este trastorno es el aumento progresivo del PAI-1 y el PAI-2.5 El PAI-1, que se sintetiza en las células endoteliales, llega a alcanzar al término del embarazo hasta 3,5 veces su nivel basal, mientras que el PAI-2, que se origina en la placenta, puede aumentar hasta 30 veces su nivel basal al término de la gestación. 51 Algunos autores, 52,53 han observado la disminución del activador tisular del plasminógeno (t-PA). Sin embargo, Reyes y Gil 51 encontraron niveles estables de t-PA en un grupo de mujeres embarazadas. Aunque durante la gestación existen algunas evidencias de activación del sistema fibrinolítico, como aumento de los productos de degradación del fibrinógeno (PDF)27 y del dímero D, se ha observado que a diferencia de lo que ocurre con el PAI-2 que aumenta progresivamente durante el embarazo, el incremento de estos parámetros se detiene en el tercer trimestre, mientras que los complejos TAT continúan ascendiendo hacia el final de la gestación, por lo que se produce en esta última etapa una franca tendencia hacia la hipercoagulabilidad.28 CAMBIOS EN EL MECANISMO FIBRINOLÍTICO DURANTE EL EMBARAZO El sistema fibrinolítico representa el evento final del proceso hemostático, pues se encarga de lisar los coágulos de fibrina para propiciar la restauración de la pared vascular. Este mecanismo, en el cual intervienen numerosas proteínas con actividad enzimática, así como activadores e inhibidores, consiste fundamentalmente en la conversión de un zimógeno, el plasminógeno, en una enzima activa: la plasmina. 95 Los cambios más relevantes en el mecanismo hemostático durante la gestación se expresan por activación de la coagulación sanguínea y de las plaquetas, así como disminución de la activación del sistema fibrinolítico, lo que explica la frecuencia de la enfermedad tromboembólica y la CID observadas en el embarazo y en un grupo numeroso de complicaciones de este. SUMMARY There are hemostatic mechanism alterations in pregnancy that determine particular conditions which facilitate the activation of this biological system before stimuli that otherwise would be adequately controlled by the body. It has been confirmed that there exists hypercoagulability in pregnancy, therefore it has been included in the group of the so called acquired thrombophilias. Basic elements of the hemostatic mechanism, the coagulation system, platelets and fibrinolytic mechanism affect in a decisive way the thrombotic trend of pregnancy. During pregnancy, a series of changes is observed in the clotting mechanism such as progressive increase of fibrinogen and factors VII, VIII, IX and von Willebrand, soluble fibrin complexes, thrombin-prothrombin complexes and 1 + 2 fragments of prothrombin. A decrease in protein C and protein S has also been found. Platelets play an important role in the thrombotic trend during pregnancy, also an increase of platelet aggregation, a reduction of responsive capacity to activation by prostacycline and a decline in AMPc formation have been observed. Pregnancy has a remarkable effect on the fIbrinolytic system, fundamentally due to a progressive increase of type-1 plasminogen activator inhibitor (PA1-I) and the type-2 plasminogen activator inhibitor (PAI-2). Subject headings: HEMOSTATICS; PREGNANCY COMPLICATIONS, HEMATOLOGIC; BLOOD PLATELETS; FIBRINOLYSIS. REFERENCIAS BIBLIOGRÁFICAS 1. Pajor A, Lehoczky D. Splenec thrombosis complicating pregnancy in patients with poor obstetrical outcome. A report of four cases. Ann Hematol 1993;66:319-21. 2. Bick RL. Disseminated intravascular coagulation: objective criteria for clinical and laboratory diagnosis and assessment of therapeutic response. Clin Appl Thromb Hemost 1995;:3-23. 3. Seegers WM. Factors in the control of bleeding. Cincinnati J Med 1950;31:395-401. 4. Angelov A. Intravascular coagulation in relation to pregnancy and delivery. Zentralbe Gynakol 1989;111:1169-75. 5. Gilabert J, Estelles A, Aznar J, España F, Vila J, Galbis M. Problemas trombóticos en obstetricia y ginecología. Rev Iberoam Tromb Hemost 1991;4:1-5. 6. Greer IA. The problem and profilaxis of thromboembolism in pregnancy. Curr Med Lit 1991;1:131-4. 7. Bergqvist A, Bergqvist D, Hallbrook T. Deep vein thrombosis during pregnancy. Acta Obstet Gynecol Scand 1983;62:443-8. 8. . Acute deep venous thrombosis after caesarean section. Acta Obstet Gynecol Scand 1979;58:473-5. 9. Letsky E, Swiet M. Thromboembolism in pregnancy and its management. Br J Haematol 1984;57:543-52. 10. Douketis JD, Ginsberg JS. Diagnostic problems with venous thromboembolism disease in pregnancy. Haemost 1995;25:58-71. 11. Aaro LA, Juergens JL. Thrombophlebitis associated with pregnancy. Am J Obstet Gynecol 1971;109:1128-33. 12. Ginsberg JS, Brill-Edwaeds P, Burrows RF. Venous thrombosis during pregnancy: leg and trimester of presentation. Thromb Haemost 1992;67:519-20. 96 13. Hellgren M, Svensson PJ, Dahlbäck B. Resistance to activated protein C as basis for venous thromboembolism associated with pregnancy and oral contraceptives. Am J Obstet Gynecol 1995;173:210-3. 14. Dahlback P, Hildebrand B. Inherited resistance to activated protein C is corrected by anticoagulant cofactor activity found to be property of factor V. Proc Natl Acad Sci USA 1994;91:1396-1400. 15. Bertina R, Koeleman SPC, Koster T. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 1994;369:64-7. 16. Kalafatis M, Rand MD, Man KG. The mechanism of activation of human V and human factor Va by activated protein C. J Biol Chem 1994;269:31869-75. 17. Dahlback B. Resistance to activated protein C caused by a common factor V gene mutation is a major risk factor for venous thrombosis. Rev Iberoam Tromb Hemost 1996;9:1-6. 18. Griffin JH, Evatt B, Wideman C, Fernández JA. Anticoagulant protein C pathway defective in majority of thrombophilic patients. Blood 1993;82:1989-93. 19. Weiner-Megnazi Z, Ben-Shlomo Y, Goldberg Y, Shalev E. Resistance to activated protein C and the Leiden mutation: high prevalence in patients with abruptio placentae. J Obstet Gynecol 1998;179:1565-7. 20. Decker GA, Vries JI de, Dorlitzsch PM, Hvijgens PC, Blomberg BM von, Jakobs C, et al. Underlying disorders associated with severe early-onset preeclampsia. Am J Obstet Gynecol 1995;173:1042-8. 21. Lindquist PG, Svensson PJ, Dahlbäck B, Marsal K. Factor VQ506 mutation (activated protein C resistance) associated with reduced intrapartum blood loss a possible evolutionary selection mechanism. Thromb Haemost 1998;79:69-73. 22. Wilhelmsen L, Svardsudd K, Korsan-Bergten K, Larsson B, Welin L, Tibblin G. Fibrinogen as a risk factor for stroke and myocardial infarction. N Engl J Med 1984;311:943-5. 23. Moller L, Kristensen TS. Plasma fibrinogen and ischemic heart disease risk factos. Arterioscl Thromb 1991;11:344-50. 24. Potron G, Ngoyen P, Pignon B. Fibrinogen arterial risk in clinical practice. Clin Hemorrh 1994;14:739-67. 25. Dalaker K, Smith P, Arnesen H, Prydz H. Factor VII-phospholipid complex in male survivors of acute myocardial infarction. Ach Med Scand 1987;222:111-6. 26. Koster T, Blann AD, Briet E, Vandenbroucke JP, Rosendeal FR. Role of clotting factor VIII effect of von Willebrand factor in occurrence of deep vein thrombosis. Lancet 1995;345:152-5. 27. Mak M. Coagulation fibrinolysis platelet and kinin forming system during toxemia of pregnancy. Biol Res Pregan 1983;4:152-4. 2 8 . Reyes M, Gil R. Balance coagulación-fibrinolisis en el embarazo y postparto. Sangre 1991;36: Suppl 2:129. 29. Mannucci PM, Vigano S. Deficiencies of protein C an inhibitor of blood coagulation. Lancet 1982;2:463-7. 30. Comp PC, Thurnay GR, Welson J, Esman CT. Functional and inmunologic protein S levels are decreased during pregnancy. Blood 1988;68:881-5. 31. Preissner KT. Biological relevance of the protein C system and laboratory diagnosis of protein C and protein S deficiencies. Clin Sci 1990;78:351-64. 32. Almagro D. Estados de hipercoagulabilidad. Rev Cub Hematol Inmunol Hemoter 1997;13:90-108. 33. Bertina PM. Hereditary protein S deficiency. Haemostasia 1988;15:241-6. 34. De Stefano V, Finazzi G, Mannucci PM. Inherited thrombophilia pathogenesis clinical syndromes and management. Blood 1996;87:3531-44. 35. Munster M, Guidpzii F, Jacobson BF. Thrombophilia profiles in normal pregnancies. Abstractr XVIth Congress of the International Society on Thrombosis and Haemostasis, 1997:266. 36. Shimada H, Ikeuchi M, Ihara Y, Hoshiro T, Sniotani M, Takasghina E, et al. Changes of plasma concentrations of tissue factor and tissue factor pathway inhibitor during pregnancy and puerperium. Abstract XVIth Congress of the International Society on Thrombosis and Haemostasis, 1997:730. 37. Mc Kay OG. Chronic intravascular coagulation in normal pregnancy and preeclampsia. Cont Nephrol 1981;26:108-19. 38. Mc Kenzie IZ, Mac Lean OKI, Mitchell MD. Prostaglandins in the human fetal circulation in midtrimester and term pregnancy. Prostaglandins 1980;20:649-52. 39. Lewis PJ, Boglan P, Friedman BA, Hensby CN, Downing Y. Prostacyclin in pregnancy. Br Med J 1980; 282:1581-4. 97 40. Briel RC, Kieback DG, Lippert TH. Platelet sensitivity to a prostacyclin analogous in normal and pathological pregnancy. Prost Leuk Med 1984;13:335-40. 41. Almagro D. La hemostasia en el embarazo normal. En: la hemostasis en las complicaciones obstétricas. La Habana: Editorial Ciencias Médicas, 1997:9-19. 42. Feinster MB, Egan JJ, Sheap RI, White J. The cytoplamic concentration of free calcium platelets is controlled by stimulators of Cyclin AMP production (PGD2 PGE1 foskolin). Biochem Biophys Res Commun 1983;113:598-602. 43. Kser-Glanzmann R, Jakabova M, George JN, Luscher EF. Stimulation of calcium uptake in platelet membrane vesicles by cAMP and protein kinase. Biochem Biophys Acta 1977;466:429-34. 44. Authi KS, Crawford N. Inositol 1 4 5-Triphosphate-induced release of sequestered Ca++ from highly purified human platelet intracelular membranes. Biochem J 1985;230:247-52. 45. Flores A. Trombocitopenia y gestación. Med Clin 1996;107:735-7. 46. Burrows RF, Kelton JG. Fetal thrombocytopenia and its relation to maternal thrombocytopenia. N Engl J Med 1993;329:1463-6. 47. Altes A, Muñíz-Díaz E, Pujol-Moix N, Matero J, Fontcuberla J, Parra J, et al. Tromcitopenia aislada en el curso de la gestación. Estudio etiopatogénico y actitud terapéutica en 60 pacientes. Med Clin 1996;107:721-5. 48. Boehlen F, Hohlfeld P, Extermann P, de Moerloose P. Incidence of maternal thrombocytopenia and characterization of maternal antiplatelet antibodies (MAIPA). Abstract XVIth Congress of the International Society on Thrombosis and Haemostasis, 1907:735. 49. Fay RA, Hughes AO, Farron NT. Platelets in pregnancy: hyperdestruction in pregnancy. Obstet Gynecol 1983;61:238-40. 50. Gerbas FR, Bottoms S, Farag A, Mammen E. Increased intravascular coagulation associated with pregnancy. Obstet Gynecol 1990;75:385-9. 51. Reyes M, Gil R. Estudio de la relación entre los niveles de t-PA, PAI-1 y PAI-2 durante el embarazo y postparto. Sangre 1991;36: Suppl 2, 129. 52. Bonnar J. Blood coagulation and fibrinolysis in human pregnancy. Bibl Anat 1973;12:58-63. 53. Gow Y, Campbell DM, Ogston D. The fibrinolytic system in pre-eclampsia. J Clin Pathol 1984;37:56-8. Recibido: 14 de octubre de 1999. Aprobado: 20 de octubre de 1999. Dra. Delgina Almagro Vázquez. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf: (537) 578268. Fax: (537)338979. e-mail:ihidir@hemato.sld.cu 98 Rev Cubana Hematol Inmunol Hemoter 2000;16(2):99-104 Instituto de Hematología e Inmunología LA PENICILINA Y SUS DERIVADOS COMO AGENTES DESENCADENANTES DE LA RESPUESTA INMUNE Lic. Yulién Alpízar Olivares RESUMEN Con el uso de la penicilina y sus derivados aparecen comúnmente reacciones de hipersensibilidad. Con el fin de caracterizarlas, se estudia la estructura química de estos antibióticos y su influencia en dichas reacciones. Existen factores que pueden predisponer al desarrollo de estos efectos adversos, entre los que se encuentran la gran heterogeneidad en la restricción por el sistema principal de histocompatibilidad (SPH), el fenotipo de los clones celulares reactivos a estas drogas y el patrón de citocinas que se liberan. Todo lo anterior da origen al cuadro clínico tan diverso que exhiben las reacciones causadas por estos fármacos. La profundización en el conocimiento de los mecanismos que condicionan estas respuestas constituye un reto para los investigadores en el campo de la inmunología. Descriptores DeCS: PENICILINAS/efectos adversos; HISTOCOMPATIBILIDAD; ALERGIA E INMUNOLOGIA. En la actualidad, cada día es más amplio el arsenal de nuevos antibióticos disponibles para el tratamiento de los diferentes procesos infecciosos. No obstante, la penicilina y sus derivados constituyen drogas de primera línea en muchos de estos procesos. Estos antibióticos no son relativamente tóxicos, inclusive a altas dosis; sin embargo, su uso frecuente conduce a la aparición de reacciones de hipersensibilidad que pueden definirse como aquellas donde aparece una respuesta inusual tras la administración de un medicamento o producto biológico, después de que el paciente se ha puesto en contacto con concentraciones normales de este en una o más ocasiones anteriores (contacto sensibilizante y contacto desencadenante).1 La inmensa mayoría de los medicamentos se comportan como haptenos, es decir, son capaces de desencadenar la respuesta de hipersensibilidad cuando se combina con macromoléculas, principalmente proteínas endógenas. Muchas veces no es el medicamento en sí quien se une a estas macromoléculas, sino sus metabolitos o las impurezas que estos contienen.1 Existen 4 tipos de reacciones de hipersensibilidad descritas por Coombs y 99 Gell en 1963: tipo I o inmediata, tipo II o citotóxica dependiente de anticuerpos, tipo III o mediada por complejos inmunes y tipo IV o retardada. Tanto la penicilina como sus derivados son capaces de desencadenar todas estas reacciones, lo que habla de su gran poder reactivo.2 Además de la prueba cutánea, la medida de la respuesta proliferativa de las células T a estos medicamentos in vitro a través de la prueba de transformación linfoblástica mediante criterio morfológico o con timidina tritiada, es el método más común usado para demostrar una sensibilización previa in vivo de células T específicas. 3,4 Se han realizado diferentes investigaciones acerca del fenotipo de las células T respondedoras y su patrón de citocinas, así como de la participación de enzimas mitocondriales, por ejemplo: citocrono P450 en el metabolismo de las drogas. Se conoce por estos estudios que algunos medicamentos pueden interactuar con proteínas y enzimas que potencian el metabolismo de esas drogas y alteran su inmunogenicidad, lo que influye en el desarrollo de la respuesta inmune.5,6 En este trabajo se realiza una revisión del papel del sistema inmune en el desarrollo de las reacciones de hipersensibilidad frente a la penicilina y sus derivados. para la actividad biológica. La cadena lateral determina muchas de las características antibacterianas y farmacológicas de un tipo determinado de penicilinas. La estructura química de la penicilina es la siguiente: O S CH3 R C NH CH CH B O C C A N CH CH3 COOH Los antibióticos β-lactámicos producen efectos característicos sobre las bacterias, estos actúan sobre enzimas sintetizadoras de la pared celular de los microorganismos sensibles y provocan el engrosamiento de esta pared y su lisis posterior.7 Los metabolitos que se derivan de la molécula intacta de penicilina actúan como haptenos a través de su unión de tipo covalente, con las proteínas endógenas, preferentemente por ataques a los grupos ε-amino de la lisina de estas proteínas. El intermediario antigénico de las penicilinas es el ácido peniciloil (determinante mayor) que se forma al abrirse el anillo β-lactámico. El 95 % de la droga unida a los tejidos aparece en esta forma. Dicho ácido, conjugado con un carrier inmunogénico (poli-L-lisina), es uno de los agentes más usados en las pruebas cutáneas. Además hay otros determinantes menores, que incluyen al benzilpeniciloato y la amina-benzilpeniciloil. Todos estos productos se forman in vivo y pueden también encontrarse en las soluciones de penicilina preparadas para su administración.8-11 Los términos determinante mayor y menor se refieren a la frecuencia con la que aparecen los anticuerpos frente a estos haptenos y no a la intensidad de la reacción. ESTRUCTURA QUÍMICA Y FUNCIÓN DE LAS PENICILINAS La estructura química básica de la penicilina consiste en un anillo de tiazolidina (A) unido a un anillo βlactámico (B), al que está unido una cadena lateral (R). El núcleo de la penicilina en sí es el principal requerimiento estructural 100 REACCIONES DE HIPERSENSIBILIDAD A LAS PENICILINAS. CARACTERÍSTICAS vitro y capaz de producir in vivo la eliminación acelerada del antígeno y efectos favorables o perjudiciales, según los casos, para el individuo en que se desarrolla. 16 Ha sido posible obtener clones de células T específicas a las penicilinas de individuos alérgicos a ella. Los clones aislados son heterogéneos en relación con el fenotipo, a la restricción con respecto al SPH y al patrón de citocinas liberadas después de la estimulación (tabla ).17 En contraste con los antígenos proteicos convencionales, la penicilina tiene la capacidad de unirse a diferentes tipos celulares independientemente del mecanismo de captura del antígeno, es decir, debido a que se comporta como un hapteno, su presentación antigénica a las células T no está restringida a una célula presentadora de antígeno clásica. Se ha sugerido que es precisamente esta presentación no clásica quien conduce a la activación de clones de células T específicas a las penicilinas, lo que da origen al cuadro clínico tan diverso de las alergias a dichas drogas y sus manifestaciones en diferentes órganos.18,19 En una investigación realizada con el fin de conocer cómo son presentados los péptidos inmunogénicos que de la droga se derivan, se aislaron células T provenientes de personas sensibles a estos medicamentos, las cuales fueron estimuladas con penicilina, oxacillín, ampicillín y antígenos solubles (tuberculina y toxoide tetánico), antígenos virales (virus de Epstein-Barr) e influenza tipo A. Los resultados de este estudio demostraron una estimulación de subpoblaciones de células T que recuerda más a una reacción frente a antígenos virales que a antígenos solubles. Estos resultados sugieren que los péptidos antigénicos son presentados a las células T como lo son las proteínas virales. E s t o tiene gran importancia, ya que corrobora la semejanza en el cuadro clínico Este tipo de reacciones es el efecto adverso más común que aparece con el uso de este antibiótico. Sus síntomas varían ampliamente: anafilaxia, enfermedad del sueño, anemia hemolítica, enfermedades renales, angioedema, urticaria, vasculitis y otros, y pueden llegar a ocasionar la muerte.12 La mayor frecuencia de reacciones de hipersensibilidad aparece en los jóvenes y personas de mediana edad, no así en niños y ancianos, lo que está relacionado con la capacidad de respuesta del sistema inmune; la vía de administración más frecuente con la cual aparecen estas reacciones es la endovenosa, y raramente ocurre cuando se administra por vía oral.13 Para desarrollar la reacción se necesita de una exposición inicial al medicamento o sus determinantes antigénicas, que puede ser ambiental u ocupacional. Por ejemplo: al ingerir leche o carne de animales tratados con penicilina, a través de la leche materna o por el contacto con la droga al administrarla. Se ha observado además que la posibilidad de experimentar reacciones adversas tiende a disminuir con el tiempo transcurrido desde la última exposición al medicamento.14,15 LAS PENICILINAS Y LA DINÁMICA DE LA RESPUESTA INMUNE La respuesta inmune es el conjunto de fenómenos en virtud de los cuales el reconocimiento de un antígeno, da lugar a la producción de moléculas o células capaces de unirse a él con la misma especificidad. Estos productos finales dan lugar a la reacción inmune, detectables in 101 TABLA. Heterogeneidad de la respuesta inmune en la reacción de hipersensibilidad a las penicilinas Subpoblaciones de células T respondedoras Clones de células CD4+ y CD8 + en niveles variables Haplotipos del SPH Detección de anticuerpos frente al determinante mayor Patrón de citocinas DR52 (89,4 %), DR3 (36,8 %), A2 (35%) DR4 (10 %) IgM (64 %), IgG (13 %), IgM e IgG (5 %) Concentraciones altas de I12, INF y TNF Concentraciones variables de I14 e I15 TH1 y TH2 (sin predominio característico) Tipo de respuesta a la diferenciación, maduración y producción de las diferentes clases de inmunoglobulinas que se producen como consecuencia de este reto antigénico. Los anticuerpos antipenicilina son detectables prácticamente en todos los individuos que han recibido la droga y en otros muchos que a sabiendas, nunca han estado expuestos a esta.23 Investigaciones realizadas con pacientes de diferentes edades y sexos, indican que el 64 % tiene anticuerpos IgM que reaccionan con el determinante mayor de la penicilina, el 13 % tiene anticuerpos IgG para este compuesto, el 5 % tiene ambos tipos y sólo el 16 % no tenía ninguno (tabla).23 Las citocinas son importantes mediadores de las funciones efectoras de las células T. Las concentraciones que estas alcanzan, así como su fenotipo, están muy relacionadas con el tipo de respuesta inmune. La evaluación del patrón de citocinas secretadas por los clones de células T generadas por el medicamento, revelan un patrón muy diverso: altas concentraciones de interleucina 2, interferón gamma, factor de necrosis tumoral alfa y concentraciones variables de interleucina 4 e interleucina 5, lo que no habla a favor de respuestas auxiliadoras de células T del tipo 1 (TH1, del inglés T helper 1) o auxiliadora de células T del tipo 2 (TH2, del inglés T helper 2) características (tabla).19 Como se ha discutido, es difícil caracterizar la respuesta inmune específica que produce el uso de estos antibióticos y las enfermedades virales. Un ejemplo de esto lo constituye el hecho de que las reacciones dermatológicas que aparecen con el uso de esos antibióticos, son similares a los síntomas en piel con que cursan las enfermedades virales.20 Numerosos datos sugieren que la penicilina y sus derivados son capaces de unirse a los antígenos del SPH, pero aún no está claro cómo ocurre dicha unión. Esta unión puede identificar un único mecanismo patogénico para las reacciones de hipersensibilidad a los β-lactámicos, ya que existe de manera general una analogía en los haplotipos de pacientes sensibles. Estos son: DR52 (89,4 %) DR3 (36,8 %) A2 (35 %) y DR4 (10 %) (tabla).21,22 En relación con el análisis fenotípico de las subpoblaciones de células T respondedoras, este indica que hay una gran heterogeneidad (clones CD4+ y CD8+ en niveles variables de acuerdo con la susceptibilidad individual de cada paciente), lo que está dado por su capacidad de unirse a diferentes estructuras de las moléculas del SPH, es decir, no existe una restricción definida. Esta heterogeneidad clonal refleja la amplia gama de efectos adversos inducidos por la penicilina (tabla ).19 Los clones de células T participan en este tipo de reacciones, bien como activadores de diferentes células o como auxiliadores de las célula B, lo que conlleva 102 a la penicilina y sus derivados, debido entre otras causas a que las reacciones de las células T a los haptenos aún no es un mecanismo conocido.24,25 Constituye pues, un reto a los investigadores, avanzar en el conocimiento de los mecanismos que condicionan dicha respuesta, puesto que estas reacciones son una limitación en el uso de agentes tan importantes dentro de la terapéutica moderna como lo son la penicilina y sus derivados. SUMMARY The use of penicillin and its derivatives very often brings about hypersensitivity reactions. To characterize them, we studied the chemical structure of these antibiotics and their influence on such reactions. There are factors that may predispose people to the development of these adverse reactions, among them are the great heterogeneity in restriction by the main histocompatibility system, the phenotype of reactive cell clones to these drugs and the pattern of cytokines that are released. All the above-mentioned gives rise to the so diverse clinical picture of the reactions caused by these drugs. Widening of knowledge on mechanisms leading to these reactions becomes a challenge for researchers in the field of immunology. Subject headings: PENICILLINS/adverse effects; HISTOCOMPATIBILITY; ALLERGY AND IMMUNOLOGY. REFERENCIAS BIBLIOGRÁFICAS 1. Anderson JA, Adkison NF. Reacciones alérgicas a fármacos y agentes biológicos. En: OPS. Compendio de enfermedades alérgicas e inmunológicas. Washington DC, 1989:82-5. 2. Roitt Y, Brostoff J, Male D. Inmunología. 2da. ed. Barcelona: Salvat, 1991. 3. Lawrence D. Delayed hypersensivity in vitro. Proc Natl Acad Sci USA 1966;56:72-5. 4. Vischer L. Lymphocyte cultures indug hypersensivity. Lancet 1966;467-9. 5. Kemeny DM, Díaz-Sánchez D, Holmes BJ. CD8+T cells in allergy. Allergy 1992;47:12. 6. Hanh C, Roseler S, Fritscher R, Schneider R, Merck HF. Allergic contact reaction to dexpanthenol: lymphocyte transformation test and evidence for microsomal depend metabolism of the allergen. Contact Dermatitis 1993;28:81. 7. Goodman G, Rall TW, Nies AS, Taylor P. Las bases farmacológicas de la terapéutica. 8va. ed. New York: Editorial Médica Panamericana, 1991:1108. 8. Sullivan TJ, Wedner H, Shatz G, Yecies L, Parker C. Skin testing to detect penicillin allergy. Allergy 1981;68:171. 9. Silvio D, Phillip S, Warrington R. Clinical aspects of allergic disease: the frecuency of skin test reaction to side chain penicillin determinants. Allergy 1993;91:684. 10. Weck AL de. Drugs as allergens. Allergy 1986;78:1047. 11. Mayorga C, Pérez E, Svau R, Juárez C, Vega JM, Carmona MJ. Determination of IgE antibodies to the benzilpenicilloil determinant: comparison between poly-L-lisine and human serum albumin as carriers. J Immunol Methods 1992;153:99. 12. Matthews KP. Clinical spectrum of allergic and pseudoallergic drug reactions. Allergy 1984;74:558. 13. López S, Villas F, Cabañas R, Contreras J. Delayed hypersensivity to beta-lactams. J Invest Allergol Clin Immunol 1994;4:315-9. 14. Ortiz IJ. Delayed hypersensivity to penicillin. Allergy 1996;51:69-71. 103 15. Davies DM. Textbook of adverse drug reactions 4ta. ed. Oxford: University Press, 1991. 16. Larraga V, Fresno M, Enjuanes L. Inmunología. La Habana: Editorial Científico-Técnica, 1988:88-101. 17. Nalefski E, Rao A. Nature of the ligand recognized by a hapten and carrier specif MHC restricted T cell receptor. J Immunol 1993;151:678. 18. Pichler WJ, Wyss-Corow T. T cell as antigen presenting cell. Immunol Today 1994;15:312. 19. Brandar C, Maun-Hellweg D, Bettens F, Rolli H, Goldman M, Pichler WJ. Heterogeneous T cell responses to ß-lactam modified self-structures are observed in penicillin-allergic individuals. J Immunol 1995;156:2670. 20. Hertl M, Geisel J, Boecker C, Merck HF. Selective generation of CD8+ T cell clones from peripheral blood of patients with cutaneous reactions to beta-lactams antibiotics. Br J Dermatol 1993;128:619. 21. Martin S, Bonin A van, Fessler C, Pflugfelder U, Weltzier H. Structural complexity of antigenic determinants for class I MHC restricted hapten specific T cells. J Immunol 1993;151:678. 22. Ortmann B, Martin S, Bonin A von, Schiltz E, Weltzien H. Synthetic peptides anchar T cell specific TNP epitopes to MHC antigens. J Immunol 1992;148:1445. 23. Pichler WJ. T cell reactivity to drogs. Prog Allergy Clin Immunol 1989:442. 24. Coleman JW. Allergic reactions to drugs: current concepts and problems. Allergy 1990;20;79. 25. Gleichmann E. Adverse immune reactions to drugs. Exp Haematol 1995;23:664. Recibido: 28 de octubre de 1999. Aprobado: 1 de diciembre de 1999. Lic. Yulién Alpízar Olivares. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf: (537) 578268. Fax: (537) 338979. e-mail:ihidir@hemato.sld.cu 104 Rev Cubana Hematol Inmunol Hemoter 2000;16(2):105-14 Artículos originales Instituto de Hematología e Inmunología TÍTULO Y CONCENTRACIÓN DE IgG ANTI D EN LA ENFERMEDAD HEMOLÍTICA DEL FETO Y EL RECIÉN NACIDO Dra. María Elena Alfonso Valdés,1 Dr. Víctor H. Cortés Rodríguez,1 Lic. Patricia Hernández Díaz,2 Lic. Antonio Bencomo Hernández,1 Lic. Yalile Alfonso Valdés,1 Dra. Girelda Cordero López,3 Dra. Sonia Águila4 y Téc. Lisette Orbeal Aldama1 RESUMEN La predicción prenatal de la enfermedad hemolítica del feto y el recién nacido (EHFRN) y la severidad de esta, por métodos no invasivos, es de gran importancia para la adopción temprana de medidas que eviten o minimicen el daño fetal. Se realizó un estudio retrospectivo de datos de las historias clínicas y resultados de laboratorio de 14 mujeres Rh D negativas, en el que se analizó la relación entre los títulos de anticuerpos IgG anti D séricos, determinados por la prueba de anti-inmunoglobulina indirecta durante los 3 trimestres del embarazo y la afectación del feto-neonato por EHFRN. Se introdujo un método inmunoenzimático para medir la concentración de IgG anti D en los sueros conservados en el laboratorio, correspondientes al final del último trimestre del embarazo. Se concluyó que las variaciones de los títulos de anticuerpos entre los trimestres I-II y I-III son valiosas para la predicción de afectación fetal-neonatal. La concentración de IgG anti D fue mayor de 4 Ul/mL en todos los casos con afectación clínica y aumentó de acuerdo con la severidad de la enfermedad. Se propone introducir este método en el seguimiento de embarazadas Rh D negativas. Descriptores DeCS: ERITROBLASTOSIS FETAL/prevención y control; GLOBULINA INMUNE RHO(D); TEST DE ELISA. La enfermedad hemolítica del feto y el recién nacido (EHFRN) es una condición en la cual se reduce la vida media 1 2 3 4 de los eritrocitos del feto o el neonato debido a la acción de aloanticuerpos (aloAcs) eritrocitarios maternos que Instituto de Hematología e Inmunología. Laboratorios BETERA. Facultad Enrique Cabrera. Hospital Ginecoobstétrico Eusebio Hernández. 105 atraviesan la barrera placentaria. La EHFRN comienza durante la vida intrauterina, puede ser severa y causar anemia intensa en el feto, la cual puede llevar a hidropis y óbito fetal o a hiperbilirrubinemia, íctero y aún kerníctero en el recién nacido.1-3 La patogenia de la EHFRN consta de 3 estadios: aloinmunización materna, transferencia de inmunoglobulina G (IgG) al feto y destrucción de los hematíes fetales. La aloinmunización por antígenos (Ags) eritrocitarios se produce como consecuencia del contacto del sistema inmune de un individuo con antígenos presentes en los hematíes de otro individuo, de los cuales él carece.4,5 La transferencia de Acs maternos a la circulación fetal ocurre a través de la placenta; la única Ig capaz de atravesar la barrera placentaria es la IgG, de la cual sólo se transfieren pequeñas cantidades durante el primer trimestre de gestación. Aproximadamente un tercio de las embarazadas con aloAcs anti Rh D contiene solo IgG, la mayor parte de las restantes contiene una mezcla de IgG1 + IgG 3 anti D.6 Esta última combinación se asocia con frecuencia a EHFRN severa.1,7,8 Los aloAcs responsables de la EHFRN pueden estar dirigidos contra antígenos de varios sistemas de grupos sanguíneos, entre ellos ABO, Rh, Kell, Duffy, Kidd y MNSs. En Europa y Norteamerica, incluida Cuba, el aloAc más comúnmente asociado con EHFRN severa es el anti Rh D, seguido por anti c y anti K, y es además la causa más común de muerte por dicha patología. Muestra de ello es que el 60 % de los infantes con prueba de antiglobulina directa (PAD) positiva debido a anti D, necesitan exanguinotransfusión, mientras que sólo el 30 % de los que presentan anti-c requieren de este proceder.1,3,9-12 En toda mujer embarazada Rh D negativa, se debe investigar la presencia de aloAcs anti Rh (D) durante la captación del embarazo (entre las 12 y 16 semanas). De detectarse aloAcs se debe determinar su especificidad, así como el título y/o concentración sérica. En estos casos, se debe determinar el grupo sanguíneo a la pareja para determinar si posee el Ag eritrocitario contra el que la embarazada está sensibilizada. En caso de detectarse aloAc anti D, se debe repetir el título y/o concentración durante los 3 trimestres del embarazo, mensualmente hasta las 28 semanas y posteriormente cada 15 días, incluso en mujeres primíparas se pueden detectar ocasionalmente anticuerpos producto de abortos o transfusiones previas.2 En los niños nacidos de mujeres que presentan aloAcs eritrocitarios de importancia clínica, se debe realizar el diagnóstico de EHFRN, mediante la PAD. Si la prueba es positiva, se deben determinar los niveles de Hb y bilirrubina.1,2,13 En la práctica es difícil definir sólo por el íctero y la anemia si existe hemólisis inmune, ya que en la mayoría de los recién nacidos hay un aumento de la concentración de bilirrubina sérica en los 2 ó 3 primeros días de vida y existe una progresiva disminución de la concentración de hemoglobina que continúa por un período de 2 a 3 meses.2 Algunos autores consideran las cifras elevadas de bilirrubina indirecta por encima de 342 mmol/L como un buen criterio para practicar exanguinotransfusión en infantes con PAD positivas.14 La inmunoprofilaxis con anti D, los avances en la medicina fetal, y el alto nivel del manejo obstétrico, así como de los cuidados intensivos neonatales, han permitido lograr una reducción significativa de la mortalidad por esta enfer- 106 medad en las últimas 3 décadas en el mundo desarrollado.1,15,16 No existe un método único capaz de predecir el 100 % de los casos de EHFRN, por lo que el nivel de aloAcs y su variación, así como los antecedentes de EHFRN anterior, suelen ser elementos predictivos útiles. Existen varias técnicas no invasivas que miden y/o caracterizan los anticuerpos séricos maternos y son útiles para predecir la severidad de la EHFRN, entre las que se encuentran técnicas serológicas tales como la prueba de antiglobulina indirecta (PAI) y la cuantificación de anti D con el empleo de un analizador automatizado, ensayo inmunoenzimático (ELISA) y la citometría de flujo. Todas ellas tienen un valor predictivo limitado. Otros ensayos in vitro intentan mimetizar las condiciones en que se produce la hemólisis de los glóbulos rojos fetales en la EHFRN. Entre ellos se encuentran el ensayo monocíticomacrofágico y la prueba de citotoxicidad celular dependiente de Acs (ADCC).17-22 Otros métodos diagnósticos empleados son los estudios fetales por ultrasonografía, amniocentesis o a través de tomas de muestras de sangre fetal. Los 2 últimos tienen la desventaja de ser invasivos, y por lo tanto, pueden aumentar el riesgo fetal.2,16,21,22 Algunos autores señalan que las pruebas cuantitativas se correlacionan mejor con la severidad de la enfermedad que los títulos de anticuerpos. En estudios realizados en países como el Reino Unido, se ha encontrado correlación entre los niveles de anti D materno cuantificados por el autoanalizador y la severidad de la enfermedad. Un nivel de anti D mayor de 4 UI/mL es considerado significativo para provocar la destrucción mediada por células, cuando se ha utilizado el autoanalizador. 3,7,23 Sin embargo, se han encontrado altos niveles de aloAcs en algunos casos de EHFRN leves y niveles de aloAcs relativamente bajos en casos con afectación severa, lo que sugiere que la severidad de la afectación está asociada con otros factores en adición al de la concentración de Ac.22 Los ensayos inmunoenzimáticos se han utilizado para la detección de numerosas reacciones Ag-Ac y se emplean en nuestro país en numerosos centros de salud con múltiples fines. Su sensibilidad es comparable con la del radioinmunoensayo, los reactivos empleados por lo general tienen una conservación prolongada, su lectura es fácil y los resultados se pueden medir en microgramos por mililitros. Mediante esta técnica se puede determinar la concentración de aloAcs anti D en suero, por lo que se puede emplear con propósitos clínicos en el monitoreo de la inmunización feto-materna.24,25 En Cuba nunca se han aplicado métodos para cuantificar la concentración de IgG anti D en el suero materno, por lo que el seguimiento de la embarazada aloinmunizada se realiza a través del título de anticuerpos por PAI; tampoco contamos con estudios en los que se relacionen los títulos de anticuerpo o la variación de estos con el desarrollo de signos de enfermedad hemolítica en el feto y recién nacido, por lo que se decidió la realización de este trabajo. MÉTODOS Se revisaron las historias clínicas de 14 puérperas Rh D negativas con parejas Rh D positivas, a las que previamente se les había realizado el estudio inmunohematológico de seguimiento durante el 107 tratamiento o solo requirieron fototerapia o transfusión sencilla. 4. No afectados: casos sin signos clínicos o de laboratorio de EHFRN. embarazo en el Laboratorio de Inmunohematología del Instituto de Hematología e Inmunología. En el laboratorio se recogieron los datos siguientes: Se cuantificó la concentración de IgG anti D empleando un método de ELISA en todos los sueros maternos del último trimestre del embarazo. − − − − Nombre y apellidos. Número de historia clínica. Grupo ABO y Rh. Resultados de la PAI en los 3 trimestres de embarazo. − Título de IgG anti D por PAI. De las historias clínicas recolectaron los datos siguientes: Método de ELISA para la cuantificación de IgG anti D24 se Se emplearon microplacas de poliestireno con 96 pozos de fondo en U recubiertas previamente con albúmina sérica bovina al 2 % en solución amortiguadora de fosfato de sodio (SAFASB al 2 %) incubadas durante toda la noche a 4 °C. La solución se eliminó antes del uso de la placa en el ensayo. Fase de sensibilización: en cada pozo se depositaron 20 µL de eritrocitos humanos Rh D positivos al 4 % en SAF a pH 7,3; posteriormente en 8 de los pozos se añadieron 40 µL de diluciones dobles del estándar internacional de anti D (lote 68/419), con una concentración de anti D de 1,2 µg/mL; en otro pozo un suero control con una concentración de anti D de 10 µg/mL y en los restantes triplicados de cada una de las muestras de suero de las embarazadas obtenidas durante el tercer trimestre, diluidas 1/200 en SAF. Se utilizó como control negativo un suero AB de donante masculino sano. La placa se incubó a 37 °C durante 30 minutos. Después de la incubación, todos los pozos se lavaron 3 veces con SAF y se centrifugaron cada vez a 1 000 rev/min durante 2 min a 20 °C. Reacción antiglobulínica: se añadieron en cada pozo 50 µL de suero de carnero anti IgG humana conjugado con fosfatasa alcalina (Sigma), diluido 1/600 en − Antecedentes obstétricos (embarazos, partos y abortos). − Antecedentes de fetos/niños anteriormente afectados por EHFRN. − Trastornos en el curso del embarazo. − Signos de afectación por EHFRN del feto/niño del último embarazo, tales como: disminución de la cifra de Hb, aumento de las cifras de bilirrubina indirecta, hepatoesplenomegalia, PAD positiva, necesidad de fototerapia, necesidad de transfusión intraútero o exanguinotransfusión, hidropis fetal, muerte fetal/neonatal. − Grupo sanguíneo del niño. Según el grado de afectación del feto/ niño, se dividieron los casos en 4 grupos:15 1. Afectados severos: casos en que ocurrió muerte fetal/neonatal o hidropis fetal. 2. Afectados moderados: casos con algún grado de hepatoesplenomegalia, anemia moderada, ictericia severa con riesgo de kerníctero si no se efectúa tratamiento; estos casos necesitaron transfusión intraútero o exanguinotransfusión. 3. Afectados leves: casos con anemia leve (> 100 g/dL), bilirrubina inferior a 340 µmol/L, que no requirieron 108 y posteriormente se aplicó la t de Student para n-1 grados de libertad, para verificar si era significativo el valor de r obtenido. SAF-ASB al 2 %. Después de incubar durante 30 minutos a 37 °C, se lavaron los pozos de la forma antes descrita. Reacción enzimática: se añadieron 50 µL de solución de sustrato p nitrofenil fosfato de sodio (Sigma) a cada pozo, disuelto a una concentración de 1 mg/mL en solución amortiguadora de carbonato/bicarbonato 0,05 M (Na2 CO3 /NaHCO 3) con 2mM MgCl 2; pH 9,8 y se incubó la placa durante 20 minutos a 37 °C. Se centrifugó a 1 000 rev/min durante 5 minutos a 20 °C, y se transfirieron 40 µL de sobrenadante de cada pozo a los correspondientes pozos de una nueva placa que contenía 40 µL de formaldehído al 10 %. Se midió la densidad óptica (DO) a 405 nm en cada uno de los pocillos de esta nueva placa, en un espectrofotómetro ANTHOS. Con el uso de las diluciones del estándar internacional de anti D se determinaron las concentraciones de IgG anti D. Se realizó una regresión lineal y se determinó el cálculo de la correlación, mediante la recta de mejor ajuste para los puntos obtenidos, en la que los valores de y correspondían con los de la DO y los de x con los del logaritmo de la concentración de Ac. La concentración obtenida en µg/mL se convirtió a UI/mL, considerando que 1 µg = 5 UI. RESULTADOS De los 14 casos estudiados, 10 presentaron afectación clínica neonatal o fetal (2 leve, 4 moderada y 4 severa) y 4 no presentaron afectación (tabla 1). No se encontraron diferencias estadísticamente significativas entre los antecedentes obstétricos de embarazos, partos y abortos en los casos con afectación neonatal/fetal y los casos no afectados. Se encontraron diferencias estadísticamente significativas (p<0,02) entre los antecedentes de embarazo en el grupo con afectación moderada y el grupo con afectación severa, no así entre los antecedentes de partos y abortos por separado. No se observaron diferencias significativas entre los títulos de anticuerpos anti D del primer trimestre de embarazo en los casos afectados y no afectados (tabla 2). Sin embargo, se observaron diferencias significativas (p<0,004) entre los títulos de anti D del tercer trimestre de embarazo en los casos afectados y no afectados (tabla 2). También se encontraron diferencias significativas (p< 0,01) en la variación entre el título final e inicial de anti D, en los casos afectados y no afectados (tabla 3). No se observaron diferencias significativas entre la variación del título final de anti D en relación con el inicial, en los grupos con diferente grado de afectación clínica. Se observaron diferencias altamente significativas (p<0,006) entre la variación del título de anti D del segundo trimestre con relación al primero, en los casos afectados y no afectados (tabla 3) y entre los grupos con diferente grado de afectación. ANÁLISIS ESTADÍSTICO Para aplicar las pruebas estadísticas se llevaron los valores a comparar a logaritmo neperiano (de base 2). Para las comparaciones entre 2 grupos se empleó el estadígrafo t de Student y para las comparaciones entre 3 o más grupos el análisis de varianza (ANOVA), en ambos casos para un intervalo de confianza α = 0,05. Para evaluar la correspondencia entre los valores de títulos y cuantificación de anticuerpos se realizó una correlación lineal 109 TABLA 1. Antecedentes obstétricos, título y concentración de la Ig G anti D en los casos estudiados Caso No. 2 9 3 4 6 10 1 5 7 14 8 11 12 13 Grado de severidad Leve Leve Moderada Moderada Moderada Moderada Severa Severa Severa Severa No afectado No afectado No afectado No afectado Antecedentes obstétricos E P A 3 8 3 4 3 3 5 4 5 4 4 4 4 4 1 4 2 1 1 1 1 0 2 1 1 1 0 1 1 3 0 2 2 1 3 3 2 2 2 2 3 2 Título de Ig G anti D (trimestres) I II III 0 0 4 64 64 1 8 64 16 64 Puro 8 64 2 64 32 8 256 128 8 32 64 16 128 Puro 8 64 2 256 32 64 512 512 64 256 128 256 512 Puro 16 64 2 Concentración UI/mL 4,65 6,00 12,00 5,00 7,50 512 23,00 36,40 17,90 120,50 98,55 3,00 2,00 3,50 E: embarazos; P: partos; A: abortos. TABLA 2. Comparación en los títulos de IgG anti D en los trimestres I y III entre el grupo de afectados y no afectados Grado de afectación Título de IgG anti D (trimestres) I (X ± DS) III ( X ± DS) No afectados Afectados 18,75 ± 30,17 29,2 ± 30,13 20,75 ± 29,48 304 ± 194,10 Significación NS P < 0,003 TABLA 3. Comparación de la variación del título de Ig G anti D en el grupo de afectados y no afectados Grado de afectación No afectados Afectados Significación TABLA 4. Valores centrales y de dispersión de la concentración de IgG anti D materna según la severidad de la EHFRN Variación del título de IgG anti D (trimestres) III-I II-I ( X ± DS) ( X ± DS) 2 ± 3,81 274,8 ± 179,9 P < 0,006 trimestre, en casos afectados y no afectados, así como entre los grupos con diferente grado de severidad. Todos los casos con afectación clínica presentaron concentraciones de IgG anti D mayores que 4 UI/mL. Se observa un incremento en los valores de la concentración a medida que aumenta la severidad clínica de los casos estudiados (tablas 1 y 4). 0 50 ± 56,38 P < 0,01 Grado de severidad Concentración de IgG anti-D (UI/mL) (X ±DS) Leve Moderada Severa 5,325 ± 0,9545 8,5 ± 4,11 29,5 ± 48,04 No existió correlación entre el título de anticuerpo anti D determinado por la PAI en el tercer trimestre y la cuantificación de este por ELISA. No se observaron diferencias significativas entre los valores de la concentración de anticuerpos anti D determinados por ELISA en el tercer 110 DISCUSIÓN El título de Ac anti D materno por PAI se emplea como una medida de la respuesta de Ig G materna. El título crítico se define como aquel en el cual existe riesgo importante de desarrollar hidropis fetal; muchos centros usan un valor del título entre 8 y 32 para su definición de valor crítico, a partir del cual indican técnicas invasivas.26 El título de aloAcs anti Rh D determinado al inicio del embarazo no fue útil para la predicción de la afectación o grado de severidad, ya que se comportó de forma similar en los grupos con afectación y sin ella; los casos de afectación moderada y severa tuvieron títulos iniciales que fluctuaron entre 4 y 64. El valor del título de aloAcs en el tercer trimestre del embarazo fue significativamente más alto en los casos afectados en relación con los no afectados, por lo que se decidió analizar la influencia de la variación entre los títulos en los diferentes trimestres de embarazo en la predicción de la EHFRN y su grado de severidad. El incremento en el título de aloAcs en el tercer trimestre en relación con el primero, fue significativamente mayor en los casos con afectación clínica, en comparación con los no afectados (tabla 2), pero se comportó de manera similar en los grupos con diferente grado de afectación, lo que refleja la utilidad de este parámetro en la presencia o no de la enfermedad, pero no en el grado de severidad de esta. La diferencia fue también significativa cuando se analizó el incremento de los títulos de anti D en el segundo trimestre en relación con el primero (tabla 2), tanto entre los grupos con afectación y sin ella, como entre los de diverso grado de afectación. Este resultado permite proponer la diferencia entre el título de anti D del segundo y primer trimestre como un elemento de valor predictivo de la EHFRN y el grado de severidad de esta, útil además porque permite hacer una estimación en un período poco avanzado del embarazo. Estos hallazgos coinciden con otros informes.2 La predicción prenatal de la EHFRN y su severidad, a través del estudio de los aloAcs séricos maternos, es de gran importancia para el éxito en el manejo clínico de esta enfermedad y permite la adopción temprana de medidas encaminadas a disminuir la morbiletalidad en el feto o el recién nacido. Un fallo en la predicción de la EHFRN a través de los estudios in vitro de los aloAcs del suero materno, puede conducir al empleo de procedimientos invasivos en fetos no afectados o con EHFRN leve, con el consiguiente aumento de los riesgos del embarazo como la hemorragia transplacentaria, que conduce a la exacerbación de la aloinmunización materna y el peligro de anemia fetal.22 En nuestro medio sólo contamos con los antecedentes de afectación de embarazos previos y los títulos de Acs anti D, determinados por la prueba de antiglobulina indirecta, para la predicción de la severidad de la EHFRN, previo al empleo de la ultrasonografía o de pruebas invasivas fetales. No conocemos antecedentes en la literatura científica cubana de investigaciones en las que se estudie la relación entre los títulos de Acs maternos y las manifestaciones clínicas de EHFRN, por lo que no es posible comparar los resultados de este estudio con otras experiencias nacionales. Los antecedentes obstétricos generales no resultaron de valor en el análisis de la muestra seleccionada. Dos de las mujeres estudiadas presentaban antecedentes de embarazos anteriores con fetos/niños afectados por EHFRN, una de ellas tuvo un niño con afectación severa y la otra uno no afectado, el cual resultó ser Rh D negativo. Debido al pequeño número de la muestra, no se pudo realizar un análisis estadístico de este factor predictivo. 111 En Cuba no se aplicaba ninguna técnica de cuantificación de Acs anti Rh D para el seguimiento de las embarazadas Rh D negativas; estas técnicas suelen tener una mejor correspondencia con el curso clínico de la enfermedad que los métodos serológicos,3 por lo que se cumplió con el objetivo de introducir un ensayo inmunoenzimático para la determinación de la concentración sérica de IgG anti D en embarazadas Rh D negativas, como parte del desarrollo del programa de prevención de la EHFRN. El ensayo inmunoenzimático es un método ampliamente utilizado en nuestro sistema de salud con fines diagnósticos, los reactivos y equipamientos necesarios para su ejecución en la cuantificación de anti D están disponibles, con la única excepción del estándar internacional de anti D. Lo anterior, sumado a la relativa economía del método, hace factible su generalización para estos fines. Otros métodos empleados para la cuantificación de anti D tienen varias dificultades para su aplicación en nuestro medio. La cuantificación de anti D por analizador automático, a pesar de ser la más ampliamente utilizada, tiene la desventaja de su alto costo y de ser una técnica de hemaglutinación que detecta tanto Acs IgG como Ig M, estos últimos sin valor clínico en la EHFRN, porque no son capaces de atravesar la barrera placentaria. El método de citometría de flujo, que al igual que el de ELISA detecta sólo los Acs IgG, tiene un alto grado de sensibilidad y seguridad, pero tiene la desventaja de su alto costo.20 Se cuantificó la concentración de IgG anti D en las muestras obtenidas en el tercer trimestre del embarazo. No se encontraron diferencias estadísticamente significativas entre los valores de concentración de IgG anti D en el grupo sin afectación clínica y en el grupo afectado (tabla 4), porque uno de los casos no afectados presentó un valor de concentración muy elevado, sin embargo, en el resto de los casos, las concentraciones de IgG anti D fueron inferiores a 3,50 UI/mL (tabla 1). La presencia de altas concentraciones de Acs en mujeres que tienen niños sin manifestaciones clínicas, e incluso Rh D negativos, se ha observado por otros autores; 27 en esta casuística el caso con concentración elevada fue el único de los no afectados en que el niño era del grupo Rh D positivo, lo que puede explicar el valor de concentración a pesar de no haber daño fetal, ya que puede haber coexistido un aumento en la producción de aloAc con un fallo en el paso transplacentario de la IgG materna. El fallo en el paso transplacentario se puede deber a trastornos en el mecanismo de transporte, características genéticas del R Fc gamma, presencia de Acs HLA inhibitorios o a las subclase de Ig producida, ya que sólo las Igs IgG3 e IgG1 son capaces de atravesar la barrera y producir daño fetal.22 Por otra parte, se observó un aumento en los valores de concentración a medida que aumentó la severidad clínica de los casos, lo que se hace más apreciable cuando se comparan los valores obtenidos en los casos leves y moderados en conjunto con los obtenidos en los casos severos (tabla 4). Estos resultados evidencian que la concentración de Ig G determinada por ELISA puede tener valor para el pronóstico de la severidad de los casos. Los valores de concentración en los casos con afectación clínica se encuentran todos por encima de 4,7 UI/mL, lo que se corresponde con lo informado en la literatura para la predicción de severidad clínica.1,2,26 Varios investigadores8,18 han observado una falta de correspondencia entre los valores de los títulos de aloAcs y su concentración sérica, determinada por métodos de cuantificación como el ELISA o el autoanalizador; esta observación 112 también se describe aquí, ya que no se encontró correlación entre los títulos de Acs detectados en el tercer trimestre del embarazo y los valores de concentración sérica determinados por ELISA en la muestra estudiada. Todos los autores coinciden en que no existe un método infalible para la predicción de la EHFRN. La EHFRN es un proceso complejo, en el que la severidad de cada caso individual está determinada por un conjunto de factores combinados, los que se deben tener en cuenta para predecir la afectación clínica a partir de ensayos que midan o caractericen los Acs en la circulación materna. Entre estos factores se encuentran las subclases y grado de glicosilación de los Acs maternos; la estructura, densidad del sitio, madurez del desarrollo y distribución tisular de los Ags de grupo sanguíneo; la eficiencia del transporte de la IgG materna al feto, la madurez funcional del bazo fetal, polimorfismos que afectan la función del receptor Fc y la presencia de Acs inhibitorios relacionados con el sistema principal de histocompatibilidad (HLA).22 SUMMARY The prenatal prediction of the hemolytic disease of the fetus and newborn and the severity of this disease by non-invasive methods is highly important for the early adoption of measures that avoid or minimize fetal damage. We made a retrospective study of medical histories data and lab results of 14 Rh D-negative women in which the relationship between serum anti-D IgG antibodies titers, determined by indirect antiglobulin test during the three pregnancy trimesters, and the effects of the hemolytic disease on fetus and newborn was analyzed. An immunoenzymatic method was introduced to measure anti-D IgG concentrations in lab-preserved sera collected at the end of the last pregnancy trimester. It was concluded that the variations of antibody titers from the first to the second trimester and from the first to the third trimester are useful for the prediction of fetal-neonatal effects. Anti-D IgG concentration was higher than 4 Ul/mL in all the cases with clinical affection and increased with the severity of the disease. This method is proposed to be introduced in the follow-up of RhD negative pregnant women. Subject headings: ERYTHROBLASTOSIS , FETAL/ prevention and control; RHO(D) IMMUNE GLOBULIN; ENZYME- LINKED IMMUNOSORBENT ASSAY. REFERENCIAS BIBLIOGRÁFICAS 1. Silva M de, Derrick T. Haemolytic disease of the newborn and its prevention. En: Marcela Contreras ed. ABC of transfusion. 3ra. ed. London: BMJ Publishing Group, 1998:29-33. 2. Mollison PL, Engelfriet CP, Contreras M, eds. Blood transfusion in clinical medicine, 9na ed. Oxford: Blackwell Scientific, 1993:543-90. 3. Hadley AG. In vitro assays to predict the severity of hemolytic disease of the newborn. Transfus Med Rev 1995;9:302-13. 4. Issitt PD. Applied blood groups serology. 3ra de. Miami:Montgomery Scientific, 1985. 5. Heddle NM, Klama L, Frassetto R, O’Hoski P, Leamon B. A retrospective study to determine the risk of red cell alloimmunization and transfusion during pregnancy. Transfusion 1993;33:217-20. 6. Pollock JM, Bowman JM. Anti-Rh D Ig G subclasses and severity of Rh hemolytic disease of the newborn. Vox Sang 1990;59:176-9. 113 7. Garner SF, Gorick BD, Lai WY, Brown D, Taverner J, Hughes-Jhones NC, et al. Prediction of the severity of haemolytic disease of the newborn. Vox Sang 1995;68:169-76. 8. Downing Y, Bomilow IM, Templeton JG, Fraser RH. A retrospective study of red cell maternal antibodies by chemiluminiscence. Vox Sang 1996;71:226-32. 9. Depalma L, Luban NL. Alloimmune hemolytic disease of the newborn. En: Beutler E, Litchman MA, Coller BS, Kipps TJ, eds, Williams Hematology. 5ta. de. New York: Mc Graw Hill, 1995:697-703. 10. Caine ME, Muellar HE. Cell sensitization in pregnancy. Am J Obstet Gynecol 1986;154:85-90. 11. Giannacopoulo CH, Relakis K, Kalmanti M. Severe anemia due to cell alloimmunization. Haematologia Budap 1997;28:173-5. 12. Fourmaintraux A, Vitrac D, Mariette JB, Brunel F. The Kophenotype and fetal maternal alloinmunization. Arch Fr Pediatr 1993;50:779-81. 13. Brocteur J. Rh negative newborn infants with positive direct Coomb’s test. Rev Fr Transfus 1968;11:175-87. 14. Ozment E, Erdem G, Topeu M, Yurdakok M, Tekinalp G, Genc D. Long term follow-up of indirect hyperbilirrubinemia in full-term Turkish infants. Acta Paediatr 1996;85:1440-4. 15. Catalan MA. Conceptos actuales en diagnóstico y tratamiento de la enfermedad hemolítica del feto y el recién nacido.Rev Argent Transfus 1996;22:23-37. 16. Avent ND. Antenatal genotyping of the blood groups of the fetus. Vox Sang 1998;74:365-74. 17. Lucas GF, Hadley AG, Nance SJ, Garratty G. Predicting hemolytic disease of the newborn: a comparison of the monocyte monolayer assay and the chemiluminescense test. Transfusion 1993;33:484-7. 18. Hadley AG, Kumpel BM, Leader KA, Poole GD, Fraser ID. Correlation of serological, quantitative and cell mediated functional assays of maternal alloantibodies with the severity of haemolytic disease of the newborn. Br J Haematol 1991;77:221-8. 19. Kumpel BM. A simple non-isotopic method for quantitation of red cell -bound immunoglobulin. Vox Sang 1990;59:34-9. 20. Hildén J, Backteman K, Nilsson, Emerudh J. Flow-cytometric quantitation of anti -D antibodies. Vox Sang 1997;72:172-6. 21. Urbaniak SJ, Greiss MA, Crawford RJ, Fergusson MJC. Prediction of the outcome of Rhesus hemolytic disease of the newborn: Additional information using ADDC assay. Vox Sang 1984;46:323-9. 22. Hadley AG. A comparison of in vitro tests for predicting the severity of haemolytic disease of the fetus and newborn. Vox Sang 1998;74:375-83. 23. Bromilov IM, Downing SA, Walkinshaw SA, Welch CR, Duguid JKM. A case of unexplained mild Rh (D) hemolytic disease in utero. Transfus Med 1995;5:31-5. 24. Hernández Díaz P, Martín González O. Cuantificación de IgG anti D por microELISA. Rev Argent Transfer (en prensa). 25. Ruiz M, Carbonell F, Platas C, Padilla A. An enzime-linked antiglobulin test for assessing anti-D immunoglobulin preparations. Biologicals 1990;18:89-95. 26. Moise KJ. Changing trends in the managements of red cell alloimmunization in pregnancy. Arch Pathol Lab Med 1994;118:421-8. 27. Hopkins DF. Maternal anti-Rh(D) and the D-negative fetus. Am J Obstet Gynec 1970;108:268-72. Recibido: 6 de octubre de 1999. Aprobado: 23 de noviembre de 1999. Dra. María Elena Alfonso Valdés. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf: (537)578268. Fax: (537)338979. e-mail:ihidir@hemto.sld.cu 114 Rev Cubana Hematol Inmunol Hemoter 2000;16(2):115-21 Instituto de Hematología e Inmunología TRATAMIENTO CON TROFÍN EN NIÑOS INTOLERANTES A LAS SALES DE HIERRO Dra. Norma Fernández Delgado,1 Dra. Hortensia Gautier du Défaix Gómez,1 Mc. Mariela Forrellat Barrios, 1 Dra. Tamara Cedré Hernández, 1 Dr. Raúl González Hernández 2 y Dra. Elisa Aznar García2 RESUMEN Se realizó tratamiento con Trofín, producto cubano de origen natural con propiedades antianémicas, a 14 niños entre 6 y 36 meses de edad con anemia ferripriva, que no toleraban las sales de hierro oral. Se observó una recuperación de las cifras de hemoglobina en el 86 % de los casos. Se presentaron reacciones adversas ligeras en el 36 % de los pacientes, sin que ello impidiera la continuación del tratamiento. El Trofín constituye una alternativa eficaz en el tratamiento de este déficit nutricional en pacientes intolerantes a las sales ferrosas. Descriptores DeCS: DEFICIENCIA DE HIERRO/terapia; SUPLEMENTOS DIETETICOS; TRASTORNOS DE LA NUTRICION DEL NIÑO; ANEMIAS NUTRICIONALES/terapia. En el tratamiento de la anemia por deficiencia de hierro (ADH) se han utilizado de forma convencional las sales ferrosas (sulfato, gluconato, fumarato) con un efecto corrector relativamente rápido sobre el estado carencial, pero con frecuencia ocasionan reacciones adversas, fundamentalmente al nivel del tracto gastrointestinal, como son vómitos, diarreas o constipación, las que constituyen la causa fundamental de abandono del tratamiento.1-3 1 2 Además se ha planteado que la ingestión excesiva de hierro inorgánico pueden interferir con la absorción de otros nutrientes esenciales como el cinc, cuando se administra en altas dosis4 y está contraindicada su administración en enfermedades infecciosas5 y malignas.6 Además, la aplicación de la terapia parenteral con hierro dextran (Inferón) por sus conocidos efectos adversos, solo se utiliza en pacientes con intolerancia extrema al hierro oral o en la malabsorción intestinal.7-9 Instituto de Hematología e Inmunología. Centro Nacional de Biopreparados. 115 Debido a estos inconvenientes, la tendencia actual es reducir al mínimo la utilización de las sales de hierro, para lo cual se han desarrollado productos que contienen complejos hierro-proteínas o hierro-carbohidratos que son mejor tolerados.10 En nuestro país se han desarrollado algunas formulaciones con características similares, entre las que se encuentran el Trofín (BIOCEN, La Habana); producto de origen natural que contiene hierro (4 mg/mL), proteínas, aminoácidos, miel de abejas y propóleos. La presencia de 8 de los aminoácidos esenciales y de proteínas de bajo peso molecular contribuyen a mejorar las posibilidades de absorción y la biodisponibilidad del mineral, así como su tolerancia. Estudios realizados en pacientes pediátricos demostraron la eficacia y tolerancia del Trofín en niños deficientes de hierro, 11,12 lo que nos sugirió la posibilidad de que este producto pudiera ser eficaz y bien tolerado por niños con intolerancia a las sales de hierro orales. consentimiento informado de los padres, datos generales y biológicos del niño, así como una descripción del tratamiento recibido con anterioridad (sal ferrosa empleada, dosis, tiempo de consumo y tipo de reacción adversa presentada). No obstante el diagnóstico conocido de ADH, a cada uno se le realizó un estudio del estado nutricional en hierro para conocer el grado de déficit previo al inicio del tratamiento, así como electroforesis de hemoglobina, resistencia osmótica y hemograma completo. Se cuantificó el hierro sérico y la capacidad total de fijación del hierro por la transferrina por medio del método de Beale y colaboradores modificado por Loria,13 a partir de los cuales se determinó el índice de saturación de la transferrina. Los puntos de corte utilizados fueron: hemoglobina < 110 g/L, hierro sérico < 10,7 µmol/L, capacidad total de fijación de hierro por la transferrina > 75 µmol/L e índice de saturación de la transferrina <0,16. Se consideraron anémicos por deficiencia de hierro aquellos que tuvieron valores de hemoglobina e índice de saturación por debajo del punto de corte, acompañado de valores de capacidad total de fijación de hierro por la transferrina superiores a 75 µmol/L. Se excluyeron del estudio los niños con enfermedades crónicas o malignas y los que padecían síndrome de malabsorción. Se estableció tratamiento con Trofín en una dosis de 8 mg/kg/día, dividido en 2 subdosis, y el seguimiento se realizó por consultas, una a los 15 días y luego mensualmente. En cada consulta se realizó una evaluación clínica y hemograma completo y se recogió información sobre la tolerancia al tratamiento. El monitoreo se mantuvo hasta 2 meses después de alcanzar valores de hemoglobina ≥110 g/L. MÉTODOS Se incluyeron en el estudio 14 niños entre 6 y 36 meses de edad provenientes de la consulta de anemias del Instituto de Hematología e Inmunología, diagnosticados previamente como deficientes de hierro, con anemia, y que habían presentado manifestaciones de intolerancia a las sales de hierro oral. Ocho pacientes (57 %) eran del sexo femenino y 6 (43 %) del masculino. En relación con el color de la piel, 7 niños (50 %) eran blancos y el resto no blancos (negros y mestizos). A cada uno se le confeccionó una historia clínica donde se incluyó el 116 Se realizó determinación de vitamina B12 sérica,14 ácido fólico sérico15 y eritrocitario 16 a los niños en los que se sospechó un posible déficit de estas vitaminas. Se confeccionó una base de datos en la cual se incluyeron los datos contenidos en la historia clínica, los resultados del estado inicial y del seguimiento del tratamiento, así como el tiempo necesario para la recuperación de las cifras de hemoglobina. El procesamiento se realizó por el sistema STATISTICA. Se calcularon los valores promedio y las desviaciones estándar de las variables cuantitativas al inicio del estudio, así como de las cifras de hemoglobina y sus incrementos con respecto a la hemoglobina inicial en el primer trimestre de tratamiento y del tiempo de recuperación de la hemoglobina. En la figura 1 se observa un incremento progresivo de la hemoglobina durante los primeros 3 meses de tratamiento. Hb (g/L) 110 105 100 95 90 3 No. de casos 5 4 3 TABLA. Estado nutricional en hierro al inicio del tratamiento 2 Pruebas de laboratorio 1 94,00 8,40 84,28 0,09 2 Meses El tiempo de recuperación de la hemoglobina osciló entre 1 y 8 meses (fig. 2). El 50 % (n=7) alcanzó cifras normales de hemoglobina en los 3 primeros meses del tratamiento, el 36 % (n=5) entre el cuarto y el octavo mes y en el 14 % (n=2) fue necesario suspender el tratamiento y utilizar la terapia parenteral. En 4 pacientes (29 %) se asociaron otros medicamentos (fumarato ferroso o vitamina B12) para lograr la recuperación En la tabla se muestra el estado nutricional en hierro previo al inicio del tratamiento. En el 100 % de los niños se observó un índice de saturación de la transferrina por debajo de 0,16 y una capacidad total de fijación del hierro por la tranferrina mayor de 75 µmol/L. La electroforesis mostró que 13 de los casos (93 %) tenían hemoglobina AA y 1 (7 %) fue AC. La resistencia osmótica estaba aumentada (≥ ++) en el 93 % (n=13). Hemoglobina (g/L) Hierro sérico ( µmol/L) Capacidad total ( µmol/L) Índice de saturación 1 FIG. 1. Evolución en los 3 primeros meses de tratamiento. RESULTADOS X 0 DS 0 10,61 2,18 10,45 0,02 0 1 2 3 4 5 Meses 6 7 8 FIG. 2. Distribución de frecuencias del tiempo de recuperación de la hemoglobina. 117 de la hemoglobina, debido a que se produjo un estancamiento de las cifras de esta después del segundo mes de tratamiento. El fumarato ferroso se utilizó en una dosis de 4 mg/kg/día, con lo que se obtuvo una respuesta satisfactoria aproximadamente un mes después, sin que se presentaran manifestaciones de intolerancia. El 50 % de los pacientes no mostraron reacciones adversas al tratamiento con Trofín (n=7) y en el 36 % se presentaron diarreas (n=5). En 2 niños (14 %) la severidad del cuadro diarreico impidió la continuación del tratamiento (fig. 3); en los 3 casos restantes, se aplicó igual dosis de Trofín en días alternos, con lo que se logró una mejor tolerancia y la recuperación de las cifras de hemoglobina. 36 % Ninguna Diarreas Rechazo de los casos. Estas pueden evitarse con el empleo de preparados hierro - proteínas. El Trofín, producto cubano que tiene entre sus componentes hierro hemoglobínico, es útil en el tratamiento de la ADH en niños,11,12 lo que hace de él una alternativa para el tratamiento de este déficit nutricional en pacientes que no toleran las sales de hierro. El hecho de que la totalidad de los niños incluidos en el estudio mostrara un índice de saturación de la transferrina disminuido, acompañado de una capacidad total de fijación del hierro por la transferrina aumentada, evidenció que los niños estudiados eran realmente deficientes de hierro, ya que la disminución del índice de saturación de la transferrina es un indicador confiable de esta deficiencia, cuando la capacidad total de fijación de hierro por la transferrina está elevada.17 La observación en el 93 % de los casos de una resistencia osmótica mayor o igual a 2 cruces, es otro dato que apoya el diagnóstico18 y excluye la posible presencia de otras causas de anemia frecuentes en esta edad. El 50 % de los niños alcanzó cifras de hemoglobina ≥110 g/L en el primer trimestre de tratamiento. Resultados similares se observaron en pacientes pediátricos con ADH sin antecedentes de intolerancia a las sales ferrosas, tratados con Trofín,12 lo que coincide con lo comunicado en pacientes con deficiencia de hierro, a los que se les administró tratamiento con hierro hemiglobínico.19 La hemoglobina no aumentó después del segundo mes en 4 pacientes (29 %), lo que sugiere la existencia de deficiencia de otros nutrientes hematopoyéticos, no descartada en el estudio inicial, que interferían con la respuesta. A partir de este análisis, se decidió realizar dosificación de vitamina B12 y ácido fólico en estos 4 niños, y se detectaron cifras de vitamina B12 muy cercanas al límite inferior del 14 % 50 % FIG. 3. Reacciones adversas al Trofín. En 2 pacientes (14 %) se produjeron vómitos en el momento de la administración del Trofín, que no impidieron la continuación del tratamiento. DISCUSIÓN Las reacciones adversas a las sales ferrosas se presentan entre el 10 y el 20 % 118 se diagnosticó un síndrome de malabsorción intestinal, que pudiera explicar la causa del cuadro diarreico observado. En los otros 3 pacientes que presentaron diarreas se aplicó igual dosis del medicamento en días alternos, con lo que se logró la normalización de la hemoglobina en todos los casos. Estos resultados concuerdan con lo que se recomienda en la literatura: la utilización de dosis intermitentes de sales ferrosas en el tratamiento de la anemia ferropénica. Se plantea que los buenos resultados obtenidos con esta variante de tratamiento se deben a que se evita el bloqueo de la mucosa intestinal por sobresaturación, con lo que se mejora la absorción y tolerancia al medicamento,21 lo que es poco probable que haya ocurrido en el presente estudio. Es conocido que el hierro hemínico no provoca las reacciones adversas de las sales ferrosas y que su mecanismo de absorción difiere del mecanismo del hierro inorgánico. Es más probable que nuestros resultados estén relacionados con una disminución de la exposición de la mucosa intestinal a los aditivos de la formulación. En 2 niños se presentaron vómitos como manifestación de un rechazo al sabor del medicamento; esto se resolvió al mezclar el Trofín con alimentos, lo que permitió continuar el tratamiento. Este rechazo al sabor pudiera estar relacionado con los aditivos de la formulación, así como con las cantidades que necesitaban ingerir (más de 20 mL). Nuestros resultados muestran que el Trofín es eficaz y bien tolerado en niños con ADH intolerantes a las sales de hierro oral, por lo que constituye una alternativa para el tratamiento de este déficit nutricional en estos niños. Los resultados de nuestra investigación sugieren que nuevas formulaciones del Trofín que contengan pequeñas cantidades de hierro inorgánico pudieran ser de utilidad. intervalo de referencia en 2 de los pacientes, por lo que se les asoció esta vitamina al tratamiento con Trofín en dosis de 100 mg en días alternos durante 2 meses. Se conoce que el aumento de la eritropoyesis, como consecuencia del tratamiento antianémico, produce disminución de los niveles de otras vitaminas que pueden llegar a interferir con la respuesta al tratamiento, cuando los niveles séricos de éstas se encuentran en valores subnormales o cercanos al límite inferior del intervalo de referencia, como posiblemente ocurrió en estos niños. A partir de la introducción de esa vitaminoterapia, los niveles de hemoglobina ascendieron paulatinamente hasta alcanzar las cifras deseadas. En los 2 pacientes restantes, el resultado de las determinaciones de vitaminas fue normal, por lo que se decidió añadir fumarato ferroso en dosis bajas al tratamiento con Trofín, teniendo en cuenta los resultados obtenidos en mujeres con el uso del Hemoestimulín.20 Este producto contiene una proporción hierro hemoglobínico/hierro inorgánico de 2:1, similar a la empleada en estos 2 pacientes. La recuperación de las cifras de hemoglobina se alcanzó aproximadamente un mes después de la introducción de la sal ferrosa. Es interesante señalar que no hubo manifestaciones de intolerancia en ningún niño, lo que pudiera estar en relación con la baja dosis de hierro inorgánico utilizada, con lo que se evita la saturación de la mucosa intestinal, a lo que se añade que la combinación de ambos tipos de hierro favorece la absorción del mineral al utilizar simultáneamente los 2 mecanismos de absorción. El Trofín fue bien tolerado en 7 niños (50 %). En 2 pacientes fue necesario usar la terapia parenteral, debido a la existencia de diarreas que por su severidad impidieron la continuación del tratamiento oral. En estos niños, durante la investigación, 119 SUMMARY Treatment with Trofin, a Cuban-made natural product with anti-anemic properties, was given to 14 children aged 6-36 months of age suffering from iron deficiency anemia, who do not assimilate oral iron salts. Adequate levels of hemoglobin figures were observed to be restored in 80% of the cases. 36% of patients showed minor adverse reactions without interrupting the treatment. Trofin is an effective alternative in treating this nutritional disorder in patients who do not tolerate iron salts. Subject headings: IRON DEFICIENCY/therapy; DIETARY SUPPLEMENTS; CHILD NUTRITION DISORDERS; NUTRITIONAL ANEMIAS/therapy. REFERENCIAS BIBLIOGRÁFICAS 1. Dallman PR. Hierro. En: Conocimientos actuales en nutrición. 6a ed. Washington DC: OP, ILSI, 1991:277-88. 2. Dallman P, Yip R, Oski FA. Iron deficiency and related nutritional anemias. En: Nathan and Oski Hematology of infancy and childhood. 4th ed. Philadelphia: WB Saunders, 1993:413-50. 3. Lipschitz DA. Iron deficiency anemia. The anemia of chronic disease. Sideroblastic anemia and iron overload. En: Stein JH. Internal Medicine. 4th ed. St Louis: Mosby Year Book, 1994:835-45. 4. Padrón M, Fernández R, Osa R de la, Bacallao J, Reboso J, Martín I. Estado de la nutrición de oligoelementos durante el embarazo. Efecto de la suplementación con hierro sobre el estado de nutrición de zinc. Rev Cubana Aliment Nutr 1995:9:21-3. 5. Patruta SI, Hörl WH. Iron and infection. Kidney Int 1999;55 (Suppl 69):125-30. 6. Weinberg DE. Iron therapy and cancer. Kidney Int 1999;55 (Suppl 69):131-4. 7. Borus DL, Mascioli EA, Bristian BR. Parenteral iron dextran therapy. A review. Nutrition 1995;111:163-8. 8. Andrew NC, Bridge KR. Disorders of iron metabolism and sideroblastic anemia. En: Nathan and Oski. Hematology of infancy and childhood. 5th ed. Philadelphia: WB Saunders, 1998:423-61. 9. Wick M, Pinggers W, Lehmann P. Therapeutic approaches in anemias. En: Iron metabolism, diagnosis and therapy of anemias. 3th ed. New York: Springer, 1996:100-6. 10. Cremones P, Caramoza Y. Chemical and biological characterization of iron succinylate (ITF 282). Int J Clin Pharmacol Ther Toxicol 1993;3:40-51. 11. Aznar E, González R, Martín MS, Tylor V, Grau R, González M. Tratamiento de la deficiencia de hierro con Trofín (hierro-proteína de origen natural) en diferentes grupos poblacionales. I Taller Nacional de Anemia y Deficiencia de Hierro. II Taller Nacional de Trofín. Centro de Biopreparados. La Habana. Cuba, 12-13 de noviembre de 1998. 12. Gautier du Défaix H, Forrellat M, Fernández N, Gómis Y, Aznar E, González R, Almaguer J. Evaluación de Trofín en el tratamiento de la anemia ferripriva en niños. Rev Cubana Hematol Inmunol Hemoter (en prensa). 13. Loria A, Mongue B. Técnicas de dosificación séricas de hierro y capacidad de fijación de hierro. Rev Invest Clin 1966;19:17-8. 14. Gómis Y, Gautier du Défaix H, González H, Medina C. Desarrollo de un radioanálisis para la determinación de vitamina B12 con carbón hemoglobina. Rev Cubana Hematol Immunol Hemoter 1985;1:295-303. 1 5 . Waters AH, Molling DJ. Studies on the folic acid activity of human serum. J Clin Pathol 1961;14:335-44. 16. Hoffbrand AV. Method of assay of red cell folate activity and the value of the assay as a test for folate deficiency. J Clin Pathol 1966;19:17-8. 17. Finch C, Huebers H. Perspectives in iron metabolism. N Engl J Med 1982;306:1520. 18. Gautier du Défaix H, Goicochea A, Vidal H. Valor diagnóstico de la resistencia osmótica en niños entre 6 y 19 meses de edad. Rev Cubana Hematol Inmunol Hemoter 1992;8:60-1. 120 19. Heinrich HC, Gabbe EE. Hemoglobin-iron for the prophylaxis and treatment of iron -deficiency. Klin Wschr 1977;55:1043-9. 20. Vázquez L, Vidal H, Gautier du Défaix H, Díaz F, Gómis I, Martínez J. Prevalencia de anemias nutricionales en mujeres en edad fértil de un área de salud. Rev Cubana Med Gen Integr 1993;9:245-50. 21. Liu X, Yang W, Song Y. Evaluation of the effects of intermitent iron supplement on iron deficiency anemia in children. Chung Hua Yu Fang Hsueh Tsa Chih 1995;29:34-7. Recibido: 11 de noviembre de 1999. Aprobado: 30 de diciembre de 1999. Dra. Norma Fernández Delgado. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf: (537) 578268. Fax: (537) 338979. e-mail:ihidir@hemato.sld.cu 121 Rev Cubana Hematol Inmunol Hemoter 2000;16(2):122-24 Instituto de Hematología e Inmunología ESTUDIO LONGITUDINAL DE ANTICUERPOS ANTICITOPLASMA DE NEUTRÓFILOS EN PACIENTES CON ANEMIA DREPANOCÍTICA Lic. Ana María Guerreiro Hernández, Lic. Rinaldo Villaescusa Blanco, Lic. Ada A. Arce Hernández, Lic. Julio C. Merlín Linares, Lic. Luz M. Morera Barrios, Dra. Valia Pavón Morán, Dr. Edgardo Espinosa Martínez y Dr. Porfirio Hernández Ramírez RESUMEN Se realizó un estudio longitudinal para detectar anticuerpos anticitoplasma de neutrófilos (ANCA) en 13 pacientes con anemia drepanocítica en crisis vasooclusiva y en estado basal, mediante un método de inmunofluorescencia indirecta. Del total de 34 muestras de suero obtenidas, 16 fueron en crisis vasooclusiva y en 12 de ellas, correspondientes a 10 pacientes, se demostró la presencia de p-ANCA. En el resto de las muestras en crisis vasooclusiva y en estado basal no se observó la presencia de p-ANCA o c-ANCA. Los resultados obtenidos sugieren la posible participación de los p-ANCA en el daño isquémico, así como la importancia de su medición en el diagnóstico de las crisis vasooclusivas (CVO) en los pacientes con anemia drepanocítica (AD). Descriptores DeCS: ANTICUERPOS CITOPLASMATICOS ANTINEUTROFILO; ANEMIA DE CELULAS FALCIFORMES; ENFERMEDADES HEMATOLOGICAS. La anemia drepanocítica (AD) (SS) es una enfermedad crónica no transmisible que presenta diversas complicaciones vasculares y un elevado riesgo de infecciones bacterianas para los pacientes que la padecen.1-3 Los anticuerpos anticitoplasma de neutrófilos (ANCA) constituyen un grupo de autoanticuerpos que son inducidos por enzimas lisosomales de los neutrófilos, y que de acuerdo con el patrón obtenido al aplicar la técnica de tinción por fluorescencia indirecta, se clasifican en 2 tipos: los que producen un patrón citoplasmático (c-ANCA), inducidos por la proteinasa 3, y los que producen una tinción perinuclear (p-ANCA) que se ha mostrado unen mieloperoxidasa. 4 Se considera que estos autoanticuerpos intervienen en las alteraciones de las paredes vasculares que se observan en algunas enfermedades, caracterizadas por inflamación con infiltración de neutrófilos y leucocitos mononucleares, por lo que su detección se ha incluido, en ocasiones, como parte de la evaluación diagnóstica de ciertas formas de vasculitis y glomerulonefritis.5 122 de los drepanocitos y las células endoteliales estimuladas por citocinas como la interleucina 1β y el factor de necrosis tumoral α. Estas citocinas, liberadas a la circulación por diferentes factores extrínsecos, pueden también estimular los neutrófilos con la transferencia de mieloperoxidasa y proteinasa 3 a la superficie de la membrana celular, lo que provoca la síntesis de autoanticuerpos, p-ANCA y c-ANCA respectivamente, dirigidos contra dichas enzimas lisosomales; la unión de estos a los neutrófilos provoca su activación, aumenta su adhesión y amplifica el daño celular endotelial.8-11 La presencia de p-ANCA demostrada en la mayoría de los pacientes en CVO, puede ser un factor favorecedor del daño isquémico. Es de señalar que en 3 de los pacientes estudiados no se observaron los ANCA, lo que pudiera deberse, entre otras razones, a la incapacidad de estos de responder a los antígenos lisosomales expuestos en la membrama celular del neutrófilo estimulado, a la intensidad de la crisis o a la presencia en estos pacientes de autoanticuerpos con especificidades diferentes no detectables por el procedimiento empleado. Los resultados obtenidos en nuestro trabajo indican la elevada frecuencia de los p-ANCA en la CVO de la AD, ya que en el estudio longitudinal, el 75 % (12/16) de las muestras en crisis fueron positivas para dicho autoanticuerpo y negativos en estado basal; debemos señalar que en 3 pacientes en CVO no se demostró la presencia de estos autoanticuerpos, lo que pudiera estar relacionado con la intensidad de la crisis, aspecto que no se tomó en cuenta en este trabajo. Estudios posteriores nos permitirán profundizar en la posible participación de los p-ANCA en la patogenia del daño vascular en la AD. En comunicación reciente se demostró la presencia de p-ANCA en pacientes con AD en crisis vasooclusiva (CVO), no así en el grupo en estado basal.6 El significado clínico y patogénico de este resultado no se ha establecido, de ahí que nos propusiéramos un estudio longitudinal en un grupo de pacientes con AD en distintos estadios clínicos. MÉTODOS Se estudiaron 13 pacientes con AD, 5 mujeres y 8 hombres, con una edad promedio de 14 años y un rango de 6-25 años, de los que se extrajeron 34 muestras, 16 en CVO y 18 en estado basal, para determinar la presencia de ANCA. La sangre se obtuvo por punción venosa y se conservó el suero a -30 °C hasta su uso. La detección de p-ANCA y c-ANCA se realizó por inmunofluorescencia indirecta.7 RESULTADOS Se detectó la presencia de p-ANCA en 12 muestras obtenidas durante las CVO, correspondientes a 10 pacientes; las 4 muestras extraidas en CVO de los 3 pacientes restantes fueron negativas para p-ANCA y c-ANCA. No se demostraron ANCA en ninguna de las muestras de pacientes en estado basal. DISCUSIÓN El curso clínico de la AD se caracteriza por episodios vasooclusivos periódicos. Estudios recientes han sugerido que la iniciación y progresión de estas CVO pueden estar asociadas con la interacción 123 SUMMARY A longitudinal study was made to detect antineutrophil cytoplasmic antibodies (ANCA) in 13 patients with sickle cell anemia in vasocclusive crisis and basal state by using an indirect immunofluorescence method. Of 34 serum samples, 16 were in vasocclusive crisis and 12 of them corresponding to 10 patients revealed the presence of p-ANCA. Neither p-ANCA nor c-ANCA was observed in the rest of the samples taken in vasoclussive crisis and in basal state. The results achieved signaled a possible involvement of p-ANCA in ischemic damage as well as the importance of their measurement in the diagnosis of vasocclusive crisis in patients with sickle cell anemia. Subject headings: ANTIBODIES, ANTINEUTROPHIL CYTOPLASMIC; ANEMIA, SICKLE CELL; HEMATOLOGIC DISEASES. REFERENCIAS BIBLIOGRÁFICAS 1. Serjeant GR. Sickle cell disease. Oxford: University, 1992:245-60. 2. Pearson JA, Spencer RP, Cornelius EA. Functional asplenia in sickle-cell anemia. N Engl J Med 1969;281:923-6. 3. Björnson AB, Gaston MH, Zellner CL. Decreased opsonization for Streoptococcus pneumoniae in sickle cell disease: studies on selected complement components and immunoglobulins. J Pediatr 1977;91:371-8. 4. Jennette JC, Wilkman AS, Falk RJ. Antineutrophil cytoplasmic autoantibodies-associated glomerulonephritis and vasculitis. Am J Pathol 1989;135:921-30. 5. Egner W, Chapel HM. Titration of antibodies against neutrophil cytoplasmic antigens is useful in monitoring disease activity in systemic vasculitides. Clin Exp Immunol 1990;82:244-9. 6. Villaescusa R, Guerreiro AM, Merlín JC, Morera LM, Espinosa E, Ballester JM, et al. Anticuerpos anticitoplasma de neutrófilos en pacientes con anemia drepanocítica. Sangre (en prensa). 7. Wiik A, Rasmussen N, Wieslander J. Methods to detect autoantibodies to neutrophilic granulocytes. Manual of biological markers of disease. Kluwer Academic, 1993:1-14. 8. Weiss SJ. Tissue destruction by neutrophils. N Engl J Med 1989;320:365-76. 9. Ewert BH, Jennette JC, Falk RJ. Anti-myeloperoxidase antibodies stimulate neutrophils to damage human endothelial cells. Kidney Int 1992;41:375-83. 10. Gross WL, Csernok E, Helmchen U. Antineutrophil cytoplasmic autoantigens and systemic vasculitis. APMIS 1995;103:81-97. 11. Moore CM, Ehlayel M, Leiva LE, Sorensen RU. New concepts in the immunology of sickle cell disease. Ann Allergy Asthma Immunol 1996;76:385-403. Recibido: 15 de noviembre de 1999. Aprobado: 30 de diciembre de 1999. Lic. Ana María Guerreiro Hernández. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf: (537) 578268. Fax: (537) 338979. e-mail:ihidir@hemato-sld.cu 124 Rev Cubana Hematol Inmunol Hemoter 2000;16(2):125-31 Instituto de Hematología e Inmunología DIAGNÓSTICO MOLECULAR DE LA LEUCEMIA AGUDA PROMIELOCÍTICA: RESULTADOS PRELIMINARES Dra. Gisela Martínez Antuña,1 Lic. Niubys Cayado Gutiérrez, 1 Lic. Adriana Muñiz Fernández,1 Dr. Edgardo Espinosa Martínez,1 Dra. Elvira Dorticós Balea,1 Dr. Alejandro González Otero,1 Dr. José Carnot Uría,2 Dr. Oscar Fernández Ramos3 y Dr. Porfirio Hernández Ramírez1 RESUMEN La leucemia aguda promielocítica (LAP) se caracteriza por la presencia de la translocación recíproca t (15;17) que tiene como resultado la formación del gen híbrido PML-RARα. Como la LAP se considera una emergencia hematológica y además tiene hoy en día un tratamiento muy específico con ácido retinoico (ATRA), es muy importante hacer un diagnóstico rápido y preciso, que en muchos casos permite incluso salvar la vida del paciente. En la actualidad se han desarrollado métodos de RT-PCR para detectar el gen híbrido PML-RARα. Estas técnicas moleculares han sido extremadamente útiles en el diagnóstico de esta entidad. En este trabajo presentamos los resultados preliminares del diagnóstico molecular en 38 pacientes con LAP. En 36 pacientes se demostró la presencia del gen híbrido y 2 fueron negativos. Del total de enfermos con resultados positivos, 19 (55 %) fueron bcr 1, 2 (5 %) fueron bcr 2 y 14 (40 %) fueron bcr 3. Todos los pacientes con resultados positivos respondieron al tratamiento con ATRA. En 1 de los 2 pacientes con resultados negativos se demostró la presencia de la t(11;17). Ninguno de estos 2 enfermos respondió al tratamiento con ATRA. Descriptores DeCS: LEUCEMIA PROMIELOCITICA AGUDA/diagnóstico. adultos jóvenes.2 Varios estudios recientes han demostrado un aumento relativo en la frecuencia de LAP en algunas poblaciones de Europa, África y América Latina que van desde el 17 al 58 % de las LMA en niños hasta del 22 al 37 % en el adulto.3,4 En la La leucemia aguda promielocítica (LAP), M3 según la clasificación FAB (Grupo Franco-Americano-Británico),1 es uno de los subtipos más comunes de las leucemias mieloides agudas (LMA) y constituyen del 10 al 15 % de los casos en 1 2 3 Instituto de Hematología e Inmunología. Hospital Clinicoquirúrgico Hermanos Ameijeiras. Hospital Militar Carlos J. Finlay. 125 y de esta manera promueve el proceso leucemogénico.5 Los estudios citogenéticos iniciales sugirieron que la t(15;17) se encontraba presente en todos los casos morfológicamente diagnosticados como LAP. Hoy en día se sabe que existen casos raros de LAP con otras translocaciones balanceadas que también involucran al RARα . Las translocaciones alternativas asociadas con LAP descritas hasta el momento se resumen al pie de la página. Datos recientes sugieren que las proteínas PLZF y NPM, al igual que la PML, puedan tener actividad supresora de crecimiento y que la NuMA interviene en el proceso de formación del huso mitótico en la división celular. Aunque el número de pacientes con estas translocaciones es hasta el momento muy pequeño, los ensayos de diferenciación y los datos clínicos sugieren que los reordenamientos NPM-RAR α y NuMA-RAR α responden al tratamiento con ATRA como el PML-RARα y contrariamente a lo que sucede con el PLZF-RARα .5 mayoría de los pacientes con esta leucemia se observa la translocación recíproca entre los cromosomas 15 y 17: t(15;17) (q22;q11-21). Como resultado de la t(15;17) en el cromosoma 15 se interrumpe el gen PML, previamente desconocido, y en el cromosoma 17 se interrumpe el gen de la cadena α del receptor del ácido retinoico (RARα ). El RARα pertenece a la superfamilia de los receptores de hormonas y actúa como un factor de transcripción regulado por el ácido retinoico (AR), mientras que el PML recientemente se ha demostrado que forma parte de un complejo multiproteico llamado cuerpo nuclear (nuclear body). Estos cuerpos nucleares tienen un papel importante en el control del crecimiento celular y se ha sugerido que la desregulación de algunos de sus componentes puede tener importancia en el desarrollo de neoplasias.5 Como resultado de la translocación, se sintetizan las proteínas híbridas PMLRARα y su recíproca RAR α-PML. La primera se detecta en todos los casos de LAP, mientras que la segunda sólo en un 70-80 % de estos. Hoy en día se plantea que la proteína híbrida PML-RARα desempeña una función importante en la patogénesis de la LAP porque al provocar la disrupción de los cuerpos nucleares interfiere con el proceso normal de apoptosis. Esto tiene como consecuencia un aumento en la sobrevida de las células Translocación t(15;17)(q22;q 21) t(11;17)(q23;q21) t(11;17)(q13;q21) t(5;17)(q32;q21) DIAGNÓSTICO MOLECULAR DE LA LAP Esta enfermedad tiene una serie de características que hacen que se considere una emergencia hematológica y enfatizan la necesidad de un diagnóstico rápido y preciso. En la actualidad está muy claro que Oncogenes PML-RAR α PLZF-RAR α NuMA-RARα NPM-RAR α 126 Respuesta al ATRA Responde Resistente Responde? Responde? la LAP requiere un tratamiento muy específico en comparación con otros tipos de LMA. Esto se debe al riesgo de muerte por hemorragia y al gran riesgo de recaída asociada con una baja supervivencia si estos enfermos no se tratan con ATRA en combinación con quimioterapia. El subgrupo de pacientes con LAP que se benefician del tratamiento con ATRA está definido por la presencia del gen quimérico PML -RAR α. Por lo tanto, establecer la presencia del reordenamiento PML-RAR α en pacientes en los que se sospeche una LAP, es crítico para el manejo óptimo del paciente.5,6 En la mayoría de los pacientes la presencia indirecta del PML-RARα está indicada por la detección de la t(15;17). Sin embargo, en la actualidad se sabe que en algunos pacientes en los cuales se detecta por técnicas moleculares el gen PML-RARα, no se observa la translocación por técnicas citogenéticas. Esto puede deberse a fallos en la técnica citogenética, a inserciones submicroscópicas en las cuales los cromosomas 15 y 17 tienen citogenéticamente una apariencia normal, o a aberraciones cromosómicas complejas que involucran varios cromosomas. Según los datos más recientes, en el 15 % de los pacientes con LAP no se detecta la t(15;17) por los métodos citogenéticos convencionales, de los cuales el 9 % representa fallos citogenéticos, el 4 % eventos de inserciones y el 2 % es debido a aberraciones cromosómicas complejas. Sin embargo, diversos ensayos clínicos demostraron que los pacientes con el reordenamiento PMLRAR-α y resultados citogenéticos normales, reaccionan favorablemente con el mismo tratamiento que aquellos con la t(15;17) clásica.5 Varios grupos de investigadores han desarrollado métodos de RT-PCR (reverso transcripción y reacción en cadena de la polimerasa) para detectar el gen híbrido PML-RARα. Estas técnicas moleculares han sido extremadamente útiles en el diagnóstico rápido de esta entidad y también en la detección de la enfermedad mínima residual (EMR) durante el tratamiento y seguimiento de estos pacientes.6-10 Los estudios moleculares han demostrado que existen 3 puntos de ruptura dentro del gen PML: el bcr 1 (situado en el intron 6) cuya frecuencia es de aproximadamente 60 %, el bcr 3 (situado en el intron 3) cuya frecuencia aproximada es de 33 % y el bcr 2 (situado en posiciones variables del exon 6) que constituye el resto de los casos. El punto de ruptura en el RARα es siempre el mismo.5 Por todo lo anteriormente expuesto, es indudable que es muy importante realizar un diagnóstico rápido y preciso de esta entidad, por lo que el objetivo de nuestro trabajo fue estandarizar el diagnóstico molecular de la LAP en nuestro laboratorio. A continuación presentamos los resultados del estudio inicial de nuestros pacientes con LAP. MÉTODOS Se estudiaron muestras de médula ósea de 38 pacientes con LAP (15 masculinos y 23 femeninos) evaluados en el Instituto de Hematología e Inmunología de La Habana. El rango de edad fue de 4 a 75 años. El diagnóstico de LAP se hizo según el criterio de la clasificación FAB utilizando técnicas citomorfológicas y citoquímicas.11 Para realizar el diagnóstico molecular las células mononucleadas se purificaron en un gradiente de Ficoll-Telebrix y posteriormente se suspendieron en una solución de tiocianato de guanidino (GTC) 127 − R9: CTG CTG CTC TGG GTC TCA AT. − R6: GCC CAC TTC AAA GCA CTT CT. y se guardaron congeladas a -80 °C hasta la purificación del ARN. El ARN se purificó por el método fenol-guanidinio y se guardó a -80 °C hasta su posterior amplificación.12 Para los puntos de ruptura bcr 1 y bcr 2: − M2 y R4 se utilizan en el primer PCR y M3 y R9 se usan en la segunda amplificación (nested). TÉCNICAS DE RT-PCR DEL PML-RAR∝ Para hacer la reacción de comprobación de bcr1 y bcr 2 (shifted), se utilizan M3 y R6. La reacción de comprobación se realizó en los casos al diagnóstico. Para el punto de ruptura bcr 3: Se realizó la RT-PCR según el método de la Biomed. 12 Se utilizó un estuche comercial (Promega). Para la reversotranscripción (RT) se colocó 1 mg de ARN total de la muestra de LAP en un volumen de 20 µL de buffer que contenía 2,5 U de reverso transcriptasa (Mo-MLV), random hexamers como "amplímeros", buffer 5X, dNTP, DTT, inhibidor de RNasa según las condiciones del fabricante . La reacción se realizó durante 60 min a 42 °C, después 5 min a 99 °C y 5 min a 4 °C. Posteriormente se tomaron 2 µL de esta solución y se diluyeron con el buffer de PCR que contenía 1,5 mmol/L MgCl2, 10 mmol/L Tris-HCl, pH 8,3, 200 µmol/L dNTP, 1 U de Taq polimerasa y 10 pmol/µL de primers. El volumen final de la reacción fue de 50 µL. Después de una desnaturalización inicial de 1 min a 94 °C, se realizó un ciclo de desnaturalización, fortalecimiento (annealing) y extensión de 1 min cada uno con las temperaturas de 94, 65 y 72 ° C, respectivamente. Este ciclo se repitió 35 veces. De esta primera reacción, se tomó 1µL y se realizó una segunda amplificación (nested) con las mismas condiciones, pero con los oligonucleótidos adecuados según el punto de ruptura. Los oligonucleótidos utilizados fueron los siguientes: − M7 y R4 son los del primer PCR y M5 y R9 son los de la segunda amplificación (nested). Para hacer la reacción de comprobación del bcr3 (shifted), se utilizan los M5 y R6. La reacción de comprobación se realizó en los casos al diagnóstico. Como control interno de la reacción se amplifica un segmento del exon 2 del gen RARα con los siguientes oligonucleótidos: − R5: CCA CTA GTG GTA GCC TGA GGA CT. − R2: GCT CTG ACC ACT CTC CAG CA. Para la determinación de PLZF-ATRA se utilizaron los siguientes oligos:13 − Oligo A: GAC AAT GAC ACG GAG GCC AC. − Oligo F: GGC TTG TAG ATG CGG GGT AG. − Oligo C: AAC CAC AAG GCT GAC GCT GT. − M7: CTG CTG GAG GCT GTG GAC. − M5: AGC GCG ACT ACG AGG AGA T. − M3: TCA AGA TGG AGT CTG AGG AGG. − M2: CAG TGT ACG CCT TCT CCA TCA. − R4: GCT TGT AGA TGC GGG GTA GA. Los oligos A y F se utilizan en el primer PCR y para el segundo PCR (seminested) se utilizan C y F. Finalmente 15 µL del segundo PCR (nested) se colocaron en electroforesis en 128 un gel de agarosa al 3 %. Las bandas se colorearon con bromuro de etidio y se visualizaron bajo una lámpara UV. En todos los casos se realizó siempre un control negativo (los reactivos + H2O) y un control positivo conocido según el punto de ruptura que se estuviera analizando. con ATRA. Por otra parte, los ensayos clínicos realizados han demostrado que los pacientes con cariotipo normal, en los cuales solo se detecta molecularmente el reordenamiento PML-RARα , tienen el mismo pronóstico favorable que aquéllos que se identifican citogenéticamente por la presencia de la translocación. Esto constituye otra razón muy importante para indicar el estudio molecular en los pacientes cuya morfología haga sospechar una LAP.6 La paciente nuestra con la t(11;17) no respondió al tratamiento con ATRA y el otro caso con resultados negativos para el PML-RARα tampoco. Aunque no se pudo comprobar la presencia de la t(11;17), es muy probable que este paciente, por su comportamiento clínico, también fuera portador de esta variante. La técnica molecular no solo es más rápida (se puede tener el resultado en un día), sino que permite detectar siempre la presencia del gen híbrido y además contar con un marcador con una gran sensibilidad para confirmar la remisión y realizar el monitoreo de la enfermedad mínima residual durante el seguimiento de los pacientes. También permite tener una conformación objetiva de la remisión morfológica, lo que posibilita distinguir entre la regeneración medular y la persistencia de la enfermedad, que puede ser particularmente problemática en este subtipo de LMA.14,15 Los resultados preliminares obtenidos en este trabajo han confirmado la importancia práctica en el diagnóstico y pronóstico de esta enfermedad, ya que todos los pacientes con resultados positivos respondieron al ATRA y alcanzaron la remisión, mientras que los 2 casos con resultados negativos no lo hicieron. Por otra parte, también se comprobó la importancia en el diagnóstico diferencial en casos con morfología dudosa al RESULTADOS El resultado del estudio molecular mostró que de los 38 pacientes estudiados, 36 tuvieron resultados positivos y 2 mostraron resultados negativos para todos los puntos de ruptura. Del total de 36 enfermos con resultados positivos, 19 (55 %) fueron bcr 1, 2 (5 %) fueron bcr 2 y 14 (40 %) fueron bcr 3. Un paciente con un diagnóstico morfológico dudoso entre M3 y M4 mostró la presencia del gen híbrido PMLRARα , lo que confirmó el diagnóstico de LAP. Todos los pacientes con resultado positivos respondieron al tratamiento con ATRA. De los 2 pacientes con resultados negativos para el estudio del PML-RARα, uno fue positivo para la t(11;17) (PLZF-RARα). Al otro paciente no se le pudo realizar el estudio de otras translocaciones. Estos enfermos no tuvieron respuesta al tratamiento con ATRA. DISCUSIÓN La LAP constituye una emergencia hematológica, por lo que un diagnóstico rápido y preciso es esencial. Todos los estudios realizados hasta el momento demuestran la importancia de la técnica molecular como complemento del análisis citogenético convencional en aquellos pacientes donde se sospeche una LAP, para identificar rápidamente al subgrupo de pacientes que se benefician del tratamiento 129 El objetivo nuestro en este trabajo fue estandarizar la técnica en nuestro laboratorio y comprobar su importancia en el diagnóstico de los pacientes con LAP. En estos momentos estamos realizando el monitoreo molecular para detectar la enfermedad mínima residual durante el seguimiento de estos pacientes. Los resultados obtenidos serán presentados en otro trabajo. demostrar la presencia del reordenamiento PML-RARα en el paciente que se manifestaba morfológicamente como M3-M4. La frecuencia obtenida de los 3 puntos de ruptura coincide con la descrita en la literatura, es decir, el bcr 1 es el más frecuente, le sigue el bcr 3 y el bcr 2 es muy poco frecuente. SUMMARY Acute promyelocytic leukemia (APL) is characterized by the reciprocal translocation t(15; 17) that results in fusion gene PML-RARα formation. As APL is considered to be an hematological emergency and also is given a very specific treatment with retinoic acid (ATRA), then it is very important to diagnose quickly and accurately which makes it possible in many cases to save the patient’s life. At present RT- PCR methods have been developed to detect PML-RARα gen. These molecular techniques have been extremely useful in diagnosing this entity. This paper sets forth the preliminary results of molecular diagnoses of APL in 38 patients. 36 cases presented the fusion gene and 2 did not. Of the total number of positive patients, 19(55%) were bcr 1, 2 (5%) were bcr 2 and 14(40%) bcr 3. All the patients with positive results were responsive to treatment with ATRA. One of the two patients with negative results showed the existence of t (11; 17). These two patients did not respond to treatment with ATRA. Subject headings: LEUKEMIA, PROMYELOCYTIC, ACUTE/diagnosis. REFERENCIAS BIBLIOGRÁFICAS 1. Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton DAG, Gralnick HR, et al. Proposals for the classification of acute leukemias. Br J Haematol 1976;33:451-8. 2. Stone RM, Mayer RJ. The unique aspects of acute promyelocytic leukemia. J Clin Oncol 1990;8:1913-21. 3. Biondi A, Rovelli A, Cantu-Rajnoldi A, Fenu S, Basso G, Luciano A. et al. Acute promyelocytic leukemia in children: experience of the Italian Pediatric Hematology and Oncology Group (AIEOP). Leukemia 1994;8:1264-8. 4. Dower D, Preston-Martin S, Chang E, Nichols PW, Watkins KJ, Levine AM. High frequency of acute promyelocytic leukemia among latinos with AML. Blood 1996;87:308-13. 5. Grimwade D. The pathogenesis of acute promyelocytic leukemia: evaluation of the role of molecular diagnosis and monitoring in the management of the disease. Br J Haematol 1999;106:591-613. 6. Lo Coco F, Diverio D, Falini B, Biondi A, Nervi C, Pelicci PG. Genetic diagnosis and molecular monitoring in the management of acute promyelocytic leukemia. Blood 1999;94:12-22. 7. Castagine S, Balitrand N, The H de, Dejean A, Degos L, Chomienne C. A PML/ retinoic acid receptor a is constantly detected by RNA-based polymerase chain reaction in acute promyelocytic leukemia. Blood 1992;79:3110-5. 8. Biondi A, Rambaldi A, Pandolfi Pp, Rossi V, Giudici G, Alcalay M et al. Molecular monitoring of the myl/retinoic acid receptor fusion gene in acute promyelocytic leukemia by polymerase chain reaction. Blood 1992;80:492-7. 9. Liu Yin JA, Tobal K. Detection of minimal residual disease in acute myeloid leukemia: methodologies, clinical and biological significance. Br J Haematol 1999;106:578-90. 130 10. Miller WH Jr, Kaziuka A, Frankel ST, Warrell RP Jr, De-Blasio A, Levine K, et al. Reverse transcriptase polymerase chain reaction for the rearranged retinoic acid receptor alpha clarifies diagnosis and detects minimal residual disease in acute promyelocytic leukemia. Proc Natl Acad Sci USA 1992;89:2694-8. 11. Bennet JM, Catovsky, Daniel MT, Flandrin G, Galton DAG, Gralnick HR, et al. Proposed revised criteria for the classification of acute myeloid leukemia. Ann Intern Med 1985;103:626-9. 12. Dongen van, JJM Macintyre EA, Gabert JA, Delabesse E, Rossi V Saglio G, et al. Standarized RT-PCR analysis of fusion gene transcripts from chromosome aberrations in acute leukemia for detection of minimal residual disease. Report of the BIOMED-1 Concerted action: Investigation for minimal residual disease in acute leukemia. Leukemia 1999 (en prensa). 13. Chen SJ, Zelent A, Tong JH, Yu HQ, Wang ZY, Derre J, et al. Rearrangement of the retinoic acid receptor alpha and promyelocytic zinc finger genes resulting from t(11;17) (q23;q21) in a patient with acute promyelocytic leukemia. J Clin Invest 1993;91:2260-7. 14. Diverio D, Rossi V, Avvisati G, De Santis S, Pistilli A, Pane F, et al. Early detection of relapse by prospective reverse transcripatse polymerase chain reaction analysis of the PML- RARa fusion gene in patients with acute promyelocytic leukemia enrolled in the GIMEMA-AIEOP multicenter AIDA trial. Blood 1998;92:784-9. 15. Lo Coco F, Nervi C, Avvisati G, Mandelli F. Acute promyelocytic leukemia: (a curable.) Leukemia 1998;12:1866-80. Recibido: 24 de enero del 2000. Aprobado. 28 de enero del 2000. Dra. Gisela Martínez Antuña. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf: (537) 578268. Fax: (537) 338979. e-mail:ihidir@hemato-sld.cu 131 Rev Cubana Hematol Inmunol Hemoter 2000;16(2):132-7 Producción Instituto de Hematología e Inmunología Centro de Inmunología Molecular SISTEMA ANALÍTICO DE EVALUACIÓN DE LA ACTIVIDAD BIOLÓGICA DEL REACTIVO HEMOCLASIFICADOR HEMO-CIM ANTI-A Lic. Lilia Suárez Batista,1 Lic. Alina Hernández Santana, 2 Lic. René Rivero Jiménez,1 Lic. Antonio Bencomo Hernández1 y Dra. Teresita Rodríguez Obaya2 RESUMEN Con el objetivo de llevar a cabo el escalado industrial de los productos hemoclasificadores a partir de anticuerpos monoclonales murinos, se realizaron diversas actividades para crear las condiciones que permitieran su manufactura con el cumplimiento de las buenas prácticas de producción en el Centro de Inmunología Molecular. Se introdujeron los métodos analíticos para determinar la calidad del producto hemoclasificador Hemo-CIM anti-A en el Departamento de Control de la Calidad, se entrenó al personal responsable de esta actividad en el uso de estos métodos de evaluación de la actividad biológica del AcM anti-A en el sobrenadante, líquido ascítico y producto terminado; se diseñaron y elaboraron los documentos que forman parte del sistema de documentación; entre ellos, los procedimientos normalizados de operación (PNO), los expedientes maestros de lotes, los documentos para la recolección de datos, así como los registros de lote, los certificados de calidad y los registros de las mediciones de la actividad biológica para archivar los resultados en el laboratorio. Descriptores DeCS: ANTICUERPOS MONOCLONALES/análisis. El control de la calidad comprende las técnicas y actividades operativas destinadas a monitorear un proceso y eliminar las causas de resultados no 1 2 satisfactorios en todas las etapas de la espiral de la calidad, con el fin de lograr una mejor eficiencia económica.1 Por lo tanto, en una industria interesada en producir un Instituto de Hematología e Inmunología. Centro de Inmunología Molecular. 132 determinado producto, es necesario crear las condiciones en el departamento de calidad para introducir los métodos analíticos que permiten determinar la calidad del producto y entrenar al personal para que realice esta actividad. Otra actividad necesaria es la elaboración de la documentación, que es una parte esencial de cualquier sistema de aseguramiento de la calidad y está relacionada con todos los aspectos de las buenas practicas de producción (BPP), las buenas prácticas de laboratorio (BPL) y las buenas prácticas clínicas (BPC), que nos permiten tener un camino hacia la información, tener una guía de entrenamiento y un formato para el establecimiento de los compromisos.2 Los documentos directivos, entre ellos los procedimientos normalizados de operación (PNO) y los expedientes maestros de lotes, los documentos para la recolección de datos como los registros de lote y los certificados, forman parte de la documentación que componen un sistema de documentación.2 Para la producción del reactivo hemoclasificador Hemo/CIM anti-A en el Centro de Inmunología Molecular (CIM), se trabajó en estas actividades, con el fin de crear las condiciones necesarias para el establecimiento del control de la calidad de dicho reactivo, que permitiera la verificación de la conformidad de las materias primas y el producto final de acuerdo con las especificaciones establecidas y para registrar todas las etapas del proceso productivo, dejando constancia de la realización de todas las actividades que conforman la manufactura del producto. se definió por la potencia y la especificidad mediante la técnica de hemaglutinación por centrifugación en tubo; la avidez y la intensidad mediante la técnica de hemaglutinación en lámina portaobjeto utilizando los métodos recomendados por las agencias regulatorias FDA y CECMED para la evaluación de los reactivos hemoclasificadores. 3,4 La potencia y la especificidad de los AcM anti-A en los lotes de sobrenadantes se definió mediante la técnica de hemaglutinación en placa. Además se creó un panel de eritrocitos que incluye los grupos A1, B, A2B y O que se congelaron a una temperatura de-20 °C para poder realizar esta actividad. Se entrenó al personal responsable de la evaluación de la actividad biológica con el objetivo de que conociera los procedimientos necesarios para realizar esta actividad, cumpliendo con las BPP. CREACIÓN DE LA BASE DOCUMENTAL Se escribieron los PNO para la preparación de las soluciones necesarias para realizar las técnicas de hemaglutinación y los PNO de la descripción de los métodos analíticos necesarios para determinar la actividad biológica del AcM anti-A con el fin de asegurar que el personal relacionado con la aprobación o no de los lotes (sobrenadante de cultivo, líquido ascítico [LAM] y producto final), supiera lo que tenía que hacer y cuándo hacerlo y así evitar posibles errores. Además, una vez definido el proceso de producción del reactivo hemoclasificador Hemo-CIM anti-A, se elaboraron los registros de lotes para la formulación, llenado, etiquetado y envase de dicho reactivo. En la elaboración de estos documentos se tuvieron en cuenta los requisitos para que estos documentos MÉTODOS ESTABLECIMIENTO DEL SISTEMA ANALÍTICO La determinación de la actividad biológica del producto Hemo-CIM anti-A 133 fueran claros y precisos y se cumpliera con los principios de las BPL y las BPP.5,6 Se diseñaron y elaboraron los certificados de calidad para el registro de los resultados obtenidos en la evaluación de los lotes por parte del Departamento de Control de la Calidad del CIM y los registros de las mediciones de la actividad biológica para archivar los resultados en el laboratorio. que contiene anticuerpos monoclonales hemoclasificadores. Congelación de eritrocitos. Descongelación de eritrocitos. Determinación de la actividad biológica del producto final de los anticuerpos monoclonales hemoclasificadores. RESULTADOS Determinación de la Los métodos analíticos establecidos permiten evaluar los lotes de sobrenadante, LAM y producto final en el Departamento de Control de la Calidad del CIM, que cuenta en la actualidad con un personal adiestrado y capacitado para evaluar correctamente la actividad biológica del AcM anti-A. Se redactaron los PNO para la preparación de las soluciones que se utilizan en la realización de las técnicas de hemaglutinación y los PNO de la descripción de los métodos analíticos. del líquido ascítico y del PNO para la preparación de las soluciones necesarias para realizar las técnicas de hemaglutinación Solución de glicerol al 5 %. Solución de congelación. Solución de glicerol al 12 %. Solución hipertónica de cloruro de sodio. Solución de bromelina. Solución de cloruro de sodio 0,9 %/1 % de BSA. PNO de la descripción de los métodos analíticos necesarios para determinar la actividad biológica del AcM anti-A PNO-5043 PNO-5076 PNO-5077 PNO-5078 potencia y la especificidad producto final de los AcM hemoclasificadores. PNO-5079 Determinación de la avidez, la intensidad y la especificidad del líquido ascítico y del producto final de los AcM hemoclasificadores. PNO-5081 PNO-4052 PNO-4053 PNO-4054 En el formato de estos documentos se desarrollaron los siguientes acápites: título, campo de aplicación, responsabilidad, consideraciones de seguridad, equipamiento y materiales, preparación de soluciones, procedimiento y registro de datos.5,7 Se elaboraron los certificados de calidad para el registro de los resultados de la evalución del sobrenadante, LAM y producto final. PNO-4055 PNO-4056 Certificados de calidad PNO-4057 Hemoclasificador Código Hemo-CIM anti-A. Código Código REG-5102 Pruebas al producto de cultivo celular para productos diagnosticadores. REG-5111 Líquido ascítico de los Determinación de la actividad biológica del sobrenadante hemoclasificadores 134 REG-5119 Se diseñó el registro de lotes para la formulación del producto con código REG-7070 y el registro de lotes para el llenado, etiquetado, y envase del producto Hemo-CIM anti-A con código REG-7072, una vez que se definieron todos los eventos del proceso por separado. En el primer documento se incluyeron los siguientes pasos: − Toma de la muestra y entrega al Departamento de Control de la Calidad para la evaluación de la actividad biológica. − Mantenimiento del producto a 4 °C hasta su liberación para el llenado. 1. Creación de las condiciones para iniciar la formulación del producto Hemo-CIM anti-A. − Resumen del registro de la preparación del local y los equipos. − Registro del material y la cristalería necesarios. − Registro de existencia de los reactivos y agua para inyección. − Recepción del líquido ascítico. 2. Preparación del líquido ascítico para la formulación del producto Hemo-CIM anti-A. − Descongelación del líquido ascítico. − Ajuste de pH. − Preparación del filtro y filtración del líquido ascítico. 3. Preparación de la solución balanceada de fosfatos. − Pesada de los reactivos. − Disolución de los reactivos. − Ajuste de pH y enrase de la solución balanceada de fosfato a volumen final. 4. Filtración de la solución balanceada de fosfato. − Preparación del filtro. − Filtración. 5. Formulación del producto Hemo-CIM anti-A. − Mezcla del líquido ascítico y la solución balanceada de fosfatos. − Ajuste de pH. 6. Filtración del producto Hemo-CIM anti-A. − Primera etapa de filtración. − Segunda etapa de filtración. − Balance de la filtración. 7. Toma de muestra a granel. 1. Creación de las condiciones para iniciar el llenado, etiquetado y envase del Hemo-CIM anti-A. − Resumen del registro de la preparación del local y los equipos. 2. Creación de las condiciones para el llenado del Hemo CIM anti-A. − Registro de la cristalería necesaria. 3. Llenado. − Calibración de la llenadora. − Llenado. − Revisión. 4. Etiquetado. − Edición de etiquetas. − Etiquetado. − Toma de muestra y distribución de las muestras. 5. Envase del producto. 6. Entrega del lote al almacén del producto terminado. En el segundo documento se incluyeron los siguientes pasos: Todos los documentos fueron revisados y aprobados por el Jefe del Departamento de Control de la Calidad y por el Departamento de Aseguramiento de la Calidad del CIM. DISCUSIÓN Una vez que se decidió crear toda la infraestructura necesaria para la producción del reactivo monoclonal hemoclasificador Hemo-CIM anti-A en el 135 CIM, teniendo en cuenta los resultados alentadores obtenidos por los estudios de carac-terización inmunohematológica del AcM anti-A IHI-15,8,9 se hizo necesario introducir un sistema analítico que permitiera realizar la actividad de control de la calidad a los lotes producidos de dicho reactivo y las materias primas ricas en AcM anti-A. Con este objetivo, se introdujeron las técnicas de hemaglutinación recomendadas por la FDA y CECMED para la evaluación de los reactivos hemoclasificadores.3,4 Para este propósito se adiestró al personal necesario y se crearon los documentos que soportan esta actividad para cumplir con las BPP. Desde el año 1996, paralelamente con la evaluación de los lotes del producto terminado Hemo-CIM anti-A realizado en el Departamento de Control de la Calidad del CIM, también estos lotes de reactivos se evaluaron en el Instituto de Hematología e Inmunología como centro de referencia nacional y laboratorio acreditado por el CECMED, como control externo, que redundó en una garantía de la calidad del producto en el mercado y demostró la reproducibilidad de los resultados obtenidos mediante las técnicas introducidas. Para la introducción de las técnicas de hemaglutinación necesarias para determinar la actividad biológica del AcM anti-A en los lotes de sobrenadante, LAM y producto terminado, se trabajó en la confección de los PNO con el objetivo de preparar las soluciones necesarias para realizar las técnicas de hemaglutinación y los PNO de la descripción de los métodos analíticos necesarios para determinar la actividad biológica del AcM anti-A. En estos documentos se describe cómo realizar las operaciones y qué hay que hacer para llevar a cabo la actividad de evaluación de los lotes entregados al Departamento de Control de la Calidad para su liberación, evitando los errores.5 Además en la confección de los registros de lote para la formulación del reactivo Hemo-CIM anti-A y para el envase, llenado y etiquetado de dicho producto, se cuenta con un documento que describe los pasos a realizar por los operarios y permite registrar los datos dejando constancia de la realización de la actividad, con lo que se logra una trazabilidad de todos los productos que conforman el proceso productivo del reactivo Hemo-ClM anti-A.6 Los certificados de calidad nos permitieron recolectar los datos de la evaluación de los lotes, y emitir el veredicto sobre su calidad. Los registros de lote y los certificados de calidad a su vez conformaron los registros de cada lote de producto HemoClM anti-A. Este documento, permite analizar retrospectivamente un proceso productivo e identificar errores cometidos, si se detecta una desviación en la intención para la cual el producto fue destinado, además permite la creación del expediente maestro de lote.6 Estos documentos se prepararon bajo los requerimientos de las agencias regulatorias con el objetivo de cumplir con las buenas prácticas y su implantación, entre otros aspectos y permitió que la agencia regulatoria nacional CECMED, una vez que inspeccionara el CIM, le otorgara la licencia de producción de este producto. 136 SUMMARY With the objective of carrying out industrial scaling of hemoclassifier products from murin monoclonal antibodies, a number of activities were performed to create the conditions for their manufacture in compliance with good manufacturing practices of the Molecular Immunology Center. The analytical methods were introduced to determine the quality of anti-A Hemo-CIM hemoclassifier in the Quality Assurance Department. Staff responsible for this work was trained in the use of these evaluation methods of the biological action of anti-A monoclonal antibody in supernatant, ascitic fluid and finished product; the documents that are part of the documentation system were designed and prepared, among them standard operating procedures, master production batch records, documents for data-gathering, batch records, quality certificates and biological activity measurement registers to file lab results. Subject headings: ANTIBODIES, MONOCLONAL/analysis. REFERENCIAS BIBLIOGRÁFICAS 1. Rodríguez A, Martínez V, Espinosa N, Reyes N, Reyes G. Control de la calidad. Fundamentos del control de la calidad. Ciudad de La Habana, ISPAJE, 1994:1-17. 2. DeSain C. Documentations basics that support good manufacturing practices. Introduction. Eugene, Oregon: Aster, 1993:v-vii. 3. US Food and Drug Administration. Recommended methods for blood grouping reagents evaluation. Docket No. 845-0181, March 1992:1-53. 4. CECMED. Guía para la evaluación de los diagnosticadores. Anexo. Diagnosticadores en Inmunohematología. República de Cuba, 1996:3-17. 5. DeSain C. Documentations basics that support good manufacturing practices. Standard Operating Procedures. Eugene, Oregon: Aster, 1993:27-33. 6. Documentations basics that support good manufacturing practices. Master production batch records. Eugene, Oregon: Aster, 1993:34-45. 7. Peine C. Quality assurance compliance. Procedures for pharmaceutical and biotechnology manufacturers. Buffalo: Interplharm, 1994. 8. Rivero R, Suárez L, Bencomo A, González R, González JM, Palma L, et al. Generación de un hibridoma de ratón secretor de anticuerpos monoclonales contra el antígeno del grupo sanguíneo A del sistema ABO humano. Biotecnol Aplicada 1995;12:23-9. 9. Suárez L, Rivero R, Bencomo A, Díaz T, González M, Estrada J, et al. Ensayo de terreno de anticuerpos monoclonales hemoclasificadores obtenidos en Cuba. Rev Cub Hematol Inmunol Hemoter 1997;13:63-9. Recibido: 5 de octubre de 1999. Aprobado: 2 de noviembre de 1999. Lic. Lilia Suárez Batista. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf: (537) 578268. Fax: (537) 338979. e-mail: ihidir@hemato.sld.cu 137 Rev Cubana Hematol Inmunol Hemoter 2000;16(2):138-41 De la prensa médica extranjera Servicio de Transfusiones de Sangre de la Cruz Roja de Hong Kong SISTEMA AUTOMATIZADO DE DETECCIÓN DE BACTERIAS EN LAS PLAQUETAS* Lin CK, Liu HW Antes de que se introdujeran el uso de bolsas plásticas para la colección de la sangre y los sistemas cerrados de procesamiento, la contaminación bacteriana era uno de los peligros más frecuentes y graves que conllevaban las transfusiones. En los 20 últimos años, los virus de la hepatitis y de la inmunodeficiencia humana han captado de forma preponderante la atención del público y de la comunidad dedicada a la atención sanitaria, como los mayores riesgos que pueden acarrear los productos sanguíneos. Tras la puesta en práctica de programas eficaces para tamizar, eliminar e inactivar estos virus transmitidos por la sangre,1-5 la contaminación bacteriana progresivamente ha vuelto a surgir como un riesgo considerable en el proceso de la transfusión. De 1986 a 1991 se informó de 29 casos de muertes relacionadas con * transfusiones en los Estados Unidos, provocados por contaminaciones bacterianas, cifra que representa el doble de los casos registrados entre 1976 y 1985. De esos 29 fallecimientos, 21 se atribuyeron a la contaminación bacteriana acarreada por concentrados de plaquetas.6 El predominio de la contaminación bacteriana mediante las plaquetas, en comparación con otros componentes de la sangre, se ha atribuido parcialmente a que aquellas se han empleado cada vez más en los últimos años. Además, las plaquetas se almacenan a un rango de temperatura en que la mayoría de las bacterias pueden multiplicarse, lo cual significa que se le va a entregar una carga de bacterias más importante al receptor en caso de que la unidad esté contaminada, particularmente si ha estado almacenada por un período prolongado.7,8 Tomado de la Revista Transfusión Internacional, No. 75 de marzo de 1999, con la gentil autorización del Dr. In F. Young y la Sra. Robin Thompson, Director del Departamento de Sangre y Encargada del Servicio de Comunicación y Publicaciones y la Sra. Marcela García Gutiérrez, todos de la Federación Internacional de Sociedades de la Cruz Roja y la Media Luna Roja. 138 técnicas disponibles actualmente para detectar la contaminación no son lo suficientemente sensibles como para emplearse en un servicio de transfusión. El límite de detección varía entre 105 y 106 UFC/mL (unidades de formación de colonias por mililitro) para la tinción Gram;15 entre 104 y 105 UFC/mL para la tinción de naranja de Acridina;16 de entre 104 y 105 UFC/mL para la prueba genética universal del ARNr (ácido ribonucleico ribosómico) bacteriano vinculada a la quimioluminiscencia; 17,18 y de entre 107 y 108 UFC/mL para las pruebas de glucosa y de pH.19,20 El cultivo de bacterias ofrece un alto nivel de precisión, pero los métodos tradicionales son demasiado lentos para ser prácticos. Las nuevas técnicas, basadas en el control continuo de la producción de CO 2, en las botellas especialmente diseñadas para los cultivos, permiten ejercer un control altamente automatizado y una comprobación más rápida de los resultados.21 En estudios prospectivos recientes se encontró que la tasa de contaminación bacteriana presente en los concentrados de plaquetas oscilaba entre un 0,04 % y un 0,3 % y que la tasa de reacción en caso de transfusión se situaba entre un 0,007 % y un 0,046 %, 7-14 con consecuencias que pueden variar desde una reacción febril que remite espontáneamente hasta un choque séptico y la muerte. Si se toma en consideración la dosis corriente de plaquetas que reciben los pacientes en una transfusión, en especial quienes se someten a terapias de ablación de la médula ósea, se observa que el riesgo efectivo en términos prácticos para estos pacientes se multiplica varias veces con respecto a la contaminación que puede causar una unidad de plaquetas. Pese a ello, al no haber sistemas de supervisión globales y efectivos en la mayoría de entornos clínicos, el problema de la septicemia bacteriana no se ha apreciado cabalmente. En general, se reconoce que la mayoría de los organismos aislados que contiene la sangre donada provienen de la flora normal de la piel o del medio ambiente y que se introducen en las unidades de sangre en el momento de la venopunción. Al ser poco probable que con cualquiera de los métodos antisépticos pueda lograrse una esterilización absoluta de la piel antes de la venopunción, los servicios de transfusión deberán confiar en las pruebas de laboratorio para detectar y prevenir la distribución de productos contaminados. Para que tales pruebas sean eficaces, deben ser sencillas (adaptadas a un tamizaje masivo), rápidas (ya que los concentrados de plaquetas tienen una corta fecha de almacenamiento) y sensibles (para que puedan conservar su valor predictivo durante el tiempo de almacenamiento restante del producto después de haberle hecho la prueba). La mayoría de las RESULTADO DE LA INVESTIGACIÓN EN EL SERVICIO DE TRANSFUSIÓN DE SANGRE DE LA CRUZ ROJA DE HONG KONG El Servicio de Transfusión de Sangre de la Cruz Roja de Hong Kong realizó una investigación muy amplia y comprobó que el tamizaje de las unidades de plaquetas, mediante cultivos aeróbicos de corta duración con un sistema automatizado de análisis de bacterias, resulta eficaz para eliminar las plaquetas contaminadas del inventario. El sistema podría, de forma fiable, detectar una UFC en la flora común de la piel en un lapso de 13 a 30 horas. 139 Aumentando el inóculo también se reduce el tiempo necesario para el análisis y se logran diferencias más pronunciadas en la gama de 1 a 100 UFC. De enero de 1996 a diciembre de 1998, el Servicio de Transfusión de Sangre de la Sociedad Nacional realizó las pruebas en 133.777 muestras de plaquetas provenientes de sus respectivos concentrados, separadas de la sangre entera 2 días después de su colección. Las muestras se obtuvieron de los segmentos previamente mezclados de las unidades de plaquetas. Se inoculan de 1 a 1,2 mL, en botellas de cultivo aeróbico. Se confirmó que 96 unidades (0,07 %) estaban contaminadas con bacterias; la incidencia es de una magnitud similar a la que reveló un estudio clínico local realizado anteriormente, de acuerdo con el cual 1/2 150 unidades de plaquetas obtenidas de sangre entera causaba una reacción séptica en la transfusión.11 El 37,5 % de los concentrados de glóbulos rojos y el 13,5 % del plasma recientemente congelado también resultaron positivos en el cultivo de los mismos organismos. Aunque es poco probable que las bacterias presentes proliferen en mayor medida estando almacenadas a baja temperatura, los componentes afectados se siguen extrayendo del inventario en aras de la seguridad de las transfusiones. Los contaminantes eran Bacillus spp. (59 unidades) Staphylococcus spp. (27 unidades), Escherichia coli (2), Citrobacter (1), Proteus mirabilis (1), Klebsiella oxytoca (1), Haemophilus influenzae (1), Non-enteroccal spp (1), Streptocci Gp D (1), Streptococcus bovis (1) y Propionibacterium acnes (2). Salvo en 3 casos de contaminación por Staphylococcus detectados en períodos de 25, 26 y 28 horas y en 2 casos de conta- minación por Propionibacterium detectados después de las 48 horas, todos los demás contaminantes se detectaron dentro de las 48 horas de incubación. Por lo tanto, se considera que es suficientemente seguro distribuir plaquetas a partir del tercer día de la colección de la sangre. Una de las principales limitaciones del cultivo de corta duración es la lentitud del desarrollo de algunas bacterias que podrían no detectarse en un plazo de 24 horas, motivo por el cual seguimos vigilando el cultivo hasta 48 horas para detectar, particularmente, la infección por Staphylococcus, que es bastante corriente. Además, utilizando el protocolo que diseñamos, hemos encontrado que la prueba es suficientemente sensible y permite reunir 5 muestras en una botella de cultivo, cantidad que representa la dosis de plaquetas recomendada generalmente para un paciente adulto. Este procedimiento también disminuye el costo medio de la prueba de control de bacterias para nuestro servicio, incluyendo los costos de reactivos y del personal, a 2,5 dólares EE.UU. por unidad de concentrado de plaquetas. Habiendo comprobado que 1/1 394 unidades de plaquetas obtenidas de sangre entera se contamina, el costo de evitar la distribución de una unidad de concentrado de plaquetas y de los correspondientes glóbulos rojos asciende a 3.485 dólares EE.UU. Al comparar esta cifra con el costo de evitar una transmisión, mediante una transfusión sanguínea, de virus de inmunodeficiencia humana (54.487 dólares EE.UU.) o de virus de linfotrópicos de las células T humanas (62.820 dólares EE.UU.) ambos con una tasa de incidencia de 1/50 000 entre la población local de donantes, estimamos que el sistema de control bacteriano que hemos diseñado es el eficiente. 140 REFERENCIAS BIBLIOGRÁFICAS 1. Tipple MA, Bland LA, Murphy JJ, Arduino MJ, Panlilio AL, Farner JJ III, et al. Sepsis associated with transfusion of red cells contaminated with Yersinia enterocolitica. Transfusion 1990;30:207-13. 2. Katz L, MacPherson JL, Zuck TF. Yersinia and blood donation. Transfusion 1992;32:191. 3. Blajchman MA. Tranfusion associated bacterial sepsis: the most common current transfusion transmitted entity. Transfusion Today (ISBT Newletter) 1994;21:5-6. 4. . Transfusion associated bacterial sepsis: the phoenix rises yet again [editorial]. Transfusion 1994;34:940-1. 5. Klein HG, Dodb RY, Ness PM, Fratantoni JA, Nemo GJ. Current status of microbial contamination of blood components: summary of a conference. Transfusion 1997;37:95-101. 6. Krishnan LAG, Brecher ME. Transfusion transmitted bacterial infection. Haematol Oncol Clin North Am 1995;9:167-85. 7. Goldman M, Blajchman A. Blood product associated bacterial sepsis. Trans Med Rev 1991;5:73-83. 8. Barrett BB, Andersen JW, Anderson KC. Strategies for the avoidance of bacterial contamination of blood components. Transfusion 1993;33:228-33. 9. Morrow JF, Braine HG, Kickler TS, Ness PM, Dick JD, Fuller AK. Septic reaction to platelet transfusion. A persistent problem. JAMA 1991;266:555-8. 10. Yomtovian R, Lazaura HM, Goodnough LT, Hirschler NV, Morrissey AM, Jacobs MR. A prospective microbiologic surveillance program to detect and prevent transfusion of bacterially contaminated platelets. Transfusion 1993;33:902-9. 11. Chiu EKW, Yuen KY, Lie AKM, Liang R, Lau TL, Lee ACW, et al. A prospective study of symptomatic bacteraemia following platelet transfusion and of its management. Transfusion 1994;34:950-4. 12. Blajchman MA, Ali AM, Richardson HL. Bacterial contamination of cellular blood components. Vox Sang 1994;67(Suppl 3):25-33. 13. Leiby DA, Kerr KL, Campos JM, Dodd RY. A retrospective analysis of microbial contamination in outdated random donor platelets from multiple sites. Transfusion 1997;37:259-63. 14. Soeterboek AM, Welle FHW, Marcelis JH, Lopp CMF van der. Sterility testing of blood products in 1994/1995 by three cooperating blood banks in The Netherlands. Vox Sang 1997;72:61 2. 15. Reik H, Rubin SJ. Evaluation of the buffy coat smear for rapid detection of bacteria. JAMA 1981;245:357-9. 16. McCarthy LR, Senne JE. Evaluation of acridine organe stain for detection of microorganism in blood culture. J Clin Microbiol 1980;11:281-5. 17. Brecher ME, Boothe G, Kerr A. The use of a chemiluminescence linked universal bacterial ribosomal RNA gene probe and blood gas analysis for the rapid detection of bacterial contamination in white cell reduced and non reducet platelets. Transfusion 1993;33:450-7. 18. Brecher ME, Hogan JJ, Boothe G, Kerr A, McClannan L, Jabobs MR, et al. Platelet bacterial contamination and the use of a chemiluminescence linked universal bacterial ribosomal RNA gene probe. Transfusion 1994;34:750-5. 19. Wager SJ, Robinette. Evaluation of swirling. pH and glucose tests for the detection of bacterial contamination in platelet concentrates. Transfusion 1996;36:989-93. 20. Burstain JM, Brecher ME, Workman K, Foster M, Faber GH, Mair D. Rapid identification of bacterially contaminated platelets using reagent strips: glucose and pH analysis as markers of bacterial metabolims. Transfusion 1997;37:255-8. 21. Hogman CF, Gong J. Studies of one invasive and two noninvasive methods for detection of bacterial contamination of platelet concentrates. Vox Sang 1994;67:351-5. 141 Rev Cubana Hematol Inmunol Hemoter 2000;16(2):142-4 Cartas al director MARCADORES GENÉTICOS EN PACIENTES CON ANEMIA DREPANOCÍTICA DE LA PROVINCIA DE CIENFUEGOS: HAPLOTIPOS DEL BLOQUE β Y α -TALASEMIA Al Director: Los pacientes con anemia drepanocítica presentan grandes diferencias en su comportamiento clínico, ya que existen desde pacientes con anemia muy severa hasta otros que tienen una vida prácticamente normal.1 El conocimiento sobre los factores genéticos y ambientales que modifican el curso de esta enfermedad es escaso. Se ha establecido que la severidad de esta enfermedad es en gran medida el resultado de la interacción de efectos epistáticos, entre los que se incluyen la α−talasemia, los polimorfismos asociados al bloque de genes tipo β (haplotipos) y los factores ligados al cromosoma X que modulan la expresión de la hemoglobina fetal.2 Powars y otros encontraron que existe una relación positiva entre la presencia del haplotipo Senegal y la disminución de la incidencia de los eventos clínicos característicos de la enfermedad. Sin embargo, la presencia del cromosoma CAR mostró una correlación positiva con el aumento de la ocurrencia de eventos vasooclusivos en los órganos blandos, tales como: cerebro, riñón, pulmón, etc. También encontró que los pacientes con cromosomas Senegal y Benin son idénticos hasta los 20 años de edad en cuanto al riesgo de eventos clínicos agudos y recurrentes y que después de esta edad, se evidencia el efecto protector del cromosoma Senegal, al disminuir el riesgo de fallo orgánico.3 Además existen evidencias que apoyan el hecho de que la herencia conjunta de la α−talasemia en pacientes con AD provoca que estos padezcan una forma más benigna de la enfermedad, pues padecen menos anemia que aquellos pacientes con un complemento normal de genes alfa.4 En un estudio realizado en pacientes de la Ciudad de La Habana, encontramos que existen diferencias significativas entre la frecuencia de los diferentes haplotipos y su relación con la edad, ya que se encontró una disminución de cromosomas CAR y un aumento de Senegal y Benin entre los pacientes mayores de 20 años.5 También se demostró en un grupo de 234 pacientes que la α-talasemia aumenta significativamente con la edad; estos resultados apoyan el planteamiento de que la herencia conjunta de α-talasemia aumenta la sobrevida del paciente SS.6 142 El objetivo del presente trabajo fue determinar los haplotipos asociados al gen βs y la frecuencia de α-talasemia en un grupo de pacientes SS de la provincia de Cienfuegos y comparar los resultados con los obtenidos en la Ciudad de La Habana. Se estudiaron 27 pacientes con AD (54 cromosomas βs). De ellos 9 fueron niños (edades entre 5 y 17 años) y 17 adultos (edades entre 18 y 62 años). El fenotipo de estos pacientes fue identificado por electroforesis de hemoglobina, prueba de solubilidad de la hemoglobina y el estudio familiar. El análisis de los haplotipos y de la α-talasemia se realizó según los procedimientos estándar. 7,8 Para el análisis estadístico se utilizó el test de chi cuadrado. La distribución de los haplotipos asociados al gen de la hemoglobina S en la muestra total fue: Benin 40,74 %, CAR 48,15 % y Senegal 11,1 %. En la tabla 1 se comparan los resultados obtenidos en la provincia de Cienfuegos y en la Ciudad de La Habana. Los resultados del estudio de α-talasemia mostraron que la frecuencia de esta en los pacientes de Cienfuegos fue de 0,1346. En la tabla 2 se comparan los resultados obtenidos en ambas provincias. Nuestros resultados demuestran que cuando se comparan los pacientes de Cienfuegos con los enfermos estudiados anteriormente en Ciudad de La Habana, no existen diferencias significativas en cuanto a la distribución de haplotipos, con la frecuencia de α-talasemia. Sería interesante extender el estudio a otras provincias de la región central del país para corroborar nuestros resultados, así como para establecer la posible relación de estos factores genéticos con la sobrevida de los pacientes SS. TABLA 1. Comparación de la distribución de los haplotipos asociados al gen β s en los pacientes de Cienfuegos y Ciudad de La Habana TABLA 2. Comparación de la distribución de α-talasemia en los pacientes de Cienfuegos y Ciudad de La Habana Haplotipos Cienfuegos No. % Genotipo Benin CAR Senegal 22 26 6 40,74 48,15 11,1 210 135 32 Total 54 100,00 377 Ciudad de La Habana No. % α4 α3 α2 55,70 35,81 8,49 Total F (-α) 100 chi2 :4,9040,gl=2 NS. Cienfuegos Ciudad de La Habana 17 7 0 220 82 11 24 0,1340 313 0,1880 Chi2 : 1,2378,gl = 1 NS. REFERENCIAS BIBLIOGRÁFICAS 1. 2. 3. 4. 5. Higgs DR, Aldridge BE, Lamb J, Clegg JB, Weatherall DJ, Hayes RJ, et al. The interaction of α-thalassemia and homozygous sickle cell disease. N Engl J Med 1982;305:1441-6. Nagel RL. Severity, pathobiology, epistatic effects, and genetic markers in sickle cell anemia. Semin Hematol 1991;28:180. Powars D, Chan LS, Schoeder WA. The variable expression of sickle cell disease is genetically determined. Semin Hematol 1990;27:360-76. Embury SH. Alpha thalassemia. A modifier of sickle cell disease. Ann Nyn Sci 1989:565:213-8. Muñiz A, Corral L, Aláez C, Svarch E, Espinosa E, Carbonell N, et al. Sickle cell anemia and ß-gene cluster haplotypes in Cuba. Am J Hematol 1995;49:163-4. 143 6. 7. 8. Martínez G, Muñiz A, Svarch E, Espinosa E, Nagel RL. Age dependence of the gene frequency of α−thalassemia in sickle cell anemia in Cuba. Blood 1996;88:1898-9. Sutton M, Bouhassira EE, Nagel RL. Polymerase chain reaction amplification applied to the determination of ßlike globin gene cluster haplotypes. Am J Hematol 1989;32:66-9. Dodè C, Krishnamoorthy R, Lamb J, Rochette J. Rapid analysis of -α3.7 thalassaemia and αααanti3.7 triplication by enzymatic amplification analysis. Br J Haematol 1992;82:105-11. Lic. Adriana Muñíz Fernández1 Lic. Adrianet Puig Cano1 Dra. Maritza Cabrera Zamora2 Dr. Julio Fernández Águila2 Dra. Gisela Martínez Antuña1 1 Instituto de Hematología e Inmunología, Ciudad de La Habana. 2 Hospital Provincial "Gustavo Aldereguía", Cienfuegos. Recibido: 15 de noviembre de 1999. Aprobado: 18 de noviembre de 1999. Lic. Adriana Muñíz Fernández. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana. Cuba. Teléf: (537)578268. Fax:(537)338979. e-mail:ihidir@hemato.sld.cu 144