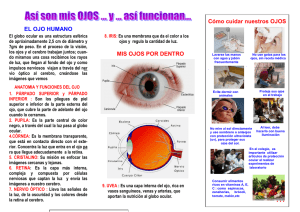
Front matter - StudentConsult.es
Anuncio

Urgencias en oftalmología Objetivos de aprendizaje ● Orientar el diagnóstico diferencial de las urgencias oftalmológicas más frecuentes y/o graves. ● Conocer las pautas de actuación inmediata y diferida en la atención oftalmológica urgente. Palabras clave/Key words Urgencia oftalmológica Ojo rojo Traumatismo ocular Disminución de visión Derivación Actuación urgente Ophthalmological emergency Red eye Ocular trauma Loss of eyesight Patient transference Urgent action Entorno De Actuación La actuación oftalmológica en situaciones de urgencia puede realizarse de manera preparada en un servicio de urgencias o en un entorno de actuación no preparado. Es por ello que el tratamiento de los distintos cuadros y/o su derivación a otro centro dependen de la patología, de los conocimientos del personal sanitario que atiende la situación de urgencia y de los medios disponibles. En todos los casos, una correcta orientación diagnóstica y terapéutica puede determinar una evolución clínica más favorable del cuadro. Asimismo, en el contexto de la atención oftalmológica de urgencia pueden generarse responsabilidades y actuaciones médico-legales derivadas de la acción agresora por parte de un tercero, de una negligencia en la prevención de riesgos laborales o por nuestra atención de la urgencia oftalmológica. La correcta actuación e información al paciente contribuirá a documentar las lesiones en el caso de una agresión, así como a prevenir problemas médico-legales derivados de nuestra actuación. e1 Evaluación Del Paciente En general, debe explorarse el ojo de la manera más completa posible en función del cuadro clínico, aunque la exploración deberá estar supeditada al tratamiento del cuadro clínico. Por ejemplo, ante una causticación, el lavado de la superficie ocular deberá realizarse inmediatamente, demorando la exploración ocular más completa para un momento posterior. La orientación diagnóstica puede establecerse en función de una causa conocida, generalmente de origen traumático como una contusión, un proyectil, o la exposición a un agente lesivo que conducirá de manera preferente nuestra actuación. El diagnóstico de la patología oftalmológica urgente debe realizarse en función de conceptos sencillos y básicos. Así, el manejo será el correcto, tanto para el tratamiento in situ como para la derivación del paciente a un centro especializado cuando corresponda. Diagnóstico Diferencial De Las Urgencias Oftalmológicas Para facilitar la orientación diagnóstica de los diferentes cuadros clínicos que acuden a urgencias podemos orientar los diagnósticos según el motivo de consulta en: 1. Ojo rojo de origen traumático. 2. Ojo rojo de origen no traumático. 3. Disminución de agudeza visual (sin ojo rojo). Algunas de las patologías han sido ya desarrolladas en los capítulos correspondientes, de modo que serán comentadas más brevemente en el presente diagnóstico diferencial. Ojo Rojo Traumático La existencia de un antecedente traumático asociado a la presencia de un cuadro de ojo rojo nos orientará hacia un grupo de patologías que también pueden estar presentes en ausencia de este antecedente, bien por omisión del e-210 © 2012. Elsevier España, S.L. Reservados todos los derechos E 1 | U rg e n c i a s e n of talmologí a Figura e1.1. Úlcera corneal con tinción de fluoresceína positiva. Figura e1.2. Causticación. Opacificación corneal e isquemia límbica. paciente o bien por haber pasado inadvertido. En la mayoría de las ocasiones, el interrogatorio dirigido puede permitirnos hallar el antecedente traumático. Con frecuencia, los pacientes con ojo rojo traumático pueden presentar disminución de agudeza visual, dolor o alteración pupilar, entre otros hallazgos, que de manera general deben ser considerados como signos de gravedad. El listado de patologías que se mencionan no es exhaustivo, pero pretende recoger al menos las causas más frecuentes de consulta, así como las más graves. y requieren, por tanto, un mayor tiempo de lavado. Los ácidos, en cambio, tienden a coagular las proteínas, lo que limita la penetración del ácido en los tejidos oculares. Erosiones Corneales Hallazgos La mayoría de las erosiones corneales se relacionan con un antecedente traumático reciente, como roce con uñas, colirios, peines, lentes de contacto, entre otros. El defecto epitelial se hace más evidente con fluoresceína y luz azul (Figura e1.1). © Elsevier. Fotocopiar sin autorización es un delito. Actuación Para favorecer la reepitelización, lubricar la superficie ocular y prevenir sobreinfecciones, aplicaremos pomada antibiótica y se realizará oclusión ocular compresiva. Puede aplicarse cicloplejía para reducir el dolor e incluso pautar analgesia por vía oral. En caso de portadores de lentes de contacto, deben dejar de llevarse hasta la resolución del cuadro. En caso de sospecha de sobreinfección se tratará como un absceso corneal, sin ocluir el ojo. Causticaciones Actuación inmediata Ante cualquier causticación debe realizarse lavado inmediato de la superficie ocular, incluyendo fondos de saco, con agua o suero abundante durante una media hora, dependiendo del agente cáustico y de su cantidad. Los álcalis suelen penetrar más que los ácidos en los tejidos oculares, por lo que pueden provocar lesiones más graves Hallazgos En estas situaciones, la exploración ocular detallada debe realizarse tras haber llevado a cabo el lavado ocular. La afectación ocular puede ser variable, según el agente cáustico, su cantidad y tiempo de exposición; pueden observarse conjuntivitis, queratitis, defecto epitelial conjuntival y corneal, blanqueamiento de los vasos conjuntivales, isquemia límbica, opacificación corneal, uveítis y glaucoma, entre otros (Figura e1.2). Actuación posterior Una vez concluido el tratamiento inicial y la exploración, se tratará el defecto epitelial con cicloplejía, pomada antibiótica y oclusión. En el seguimiento del paciente debe vigilarse la epitelización del defecto epitelial y conjuntival y prevenir la formación de adherencias conjuntivales en los fondos de saco. Observaremos, asimismo, la presencia de zonas de isquemia conjuntival y limbal, así como la posible elevación de la presión intraocular. Pueden emplearse corticoides para disminuir la reacción inflamatoria asociada y en algunos casos pueden usarse lentes de contacto terapéuticas para favorecer la reepitelización y proteger la superficie ocular. En caso de opacificación y neovascularización corneal, el pronóstico visual es pobre, pese a la posibilidad de realizar un trasplante corneal, por el alto índice de rechazo del injerto. Queratitis Actínica Hallazgos El paciente suele referir un antecedente de exposición a luz ultravioleta, soldadura o luz solar intensa 6-10 horas antes de acudir al servicio de urgencias. El cuadro clínico se caracteriza por presentar, generalmente de manera bilateral, ojo rojo, lagrimeo, fotofobia y blefaroespasmo. En la exploración con e-211 e-212 p ar t e 1 0 : C A P Í T U L O S E X T R A Figura e1.3. Queratitis actínica. Figura e1.4. Cuerpo extraño metálico corneal. fluoresceína se observa una queratitis superficial en el área correspondiente a la hendidura palpebral (Figura e1.3). Puede ser necesario realizar exploraciones radiológicas para localizar la presencia de estos cuerpos extraños intraoculares o intraorbitarios. Actuación Pomada antibiótica, cicloplejía y oclusión compresiva. Puede asociarse analgesia por vía oral. Cuerpo Extraño En La Superficie Ocular (Córnea O Conjuntiva) Hallazgos En general, el paciente refiere un antecedente traumático, con entrada de alguna partícula en el ojo. Presenta ojo rojo, fotofobia y sensación de cuerpo extraño. Éste puede encontrarse en la córnea o en la conjuntiva, y es importante evertir el párpado superior para descartar la presencia de cuerpos extraños subtarsales. Actuación Actuación En general, los cuerpos extraños intraoculares deben ser extraídos, particularmente si están compuestos por hierro. En algunos casos los cuerpos extraños inertes pueden ser tolerados, como en el caso de cristal, aluminio, oro y plata. Laceraciones Conjuntivales Y Palpebrales Hallazgos Estas lesiones pueden producirse de manera aislada o en el contexto de otras lesiones traumáticas del segmento anterior y/o posterior. En las laceraciones palpebrales debemos establecer si existe afectación de los puntos y vías lagrimales (Figura e1.5). Extracción de la partícula con irrigación con suero, torunda de algodón o aguja de insulina. Los cuerpos extraños metálicos pueden dejar un tatuaje de óxido (Figura e1.4), que puede ser retirado con aguja o mediante fresado. Posteriormente se ocluirá el ojo con pomada antibiótica y ciclopléjico. Cuerpo Extraño Intraocular/ Intraorbitario Hallazgos Debemos sospechar la presencia de un cuerpo extraño intraocular en todo antecedente traumático en el que exista la posibilidad de haberse generado un proyectil (partícula de pequeño calibre y alta velocidad). Estos proyectiles pueden quedar alojados en el segmento anterior, posterior o producir una doble perforación y quedar alojados en el espacio orbitario retroocular. Los síntomas y signos dependen de las estructuras afectadas en el traumatismo. Figura e1.5. Laceración palpebral. E 1 | U rg e n c i a s e n of talmologí a Actuación Hifema Las laceraciones conjuntivales pequeñas pueden mantenerse sin sutura, pero si son grandes o existe retracción de los bordes deben ser suturadas. En el caso de las laceraciones palpebrales hay que recomponer la anatomía palpebral y si existe afectación de la vía lagrimal debe intentarse mantener la permeabilidad de la vía lagrimal, especialmente del canalículo inferior. Hallazgos Contusión Ocular Hallazgos Las contusiones oculares son traumatismos cerrados en los que la energía del traumatismo ha producido una distensión de los tejidos oculares que puede dar lugar, entre otros, a uveítis, hifema, recesión angular, iridodiálisis, midriasis postraumática, catarata, subluxación (Figura e1.6) o luxación del cristalino, roturas esclerales y coroideas, edema retiniano, desgarros y desprendimiento de retina. Actuación El tratamiento dependerá de las lesiones producidas. Los desgarros retinianos pueden requerir fotocoagulación o crioterapia. En caso de catarata, rotura escleral o desprendimiento de retina el tratamiento será quirúrgico. Uveítis Traumática Hallazgos Cuadro clínico con algunos hallazgos comunes a otras uveítis anteriores agudas (ojo rojo con inyección ciliar, dolor, miosis y disminución de agudeza visual), junto con los hallazgos propios de otras lesiones generadas por el traumatismo. Actuación Se recomendará al paciente reposo relativo, que camine poco, o que esté sentado en la cama con la cabeza levantada 30-45° para evitar el bloqueo angular. Se colocará protector ocular rígido o gafas y se realizará tratamiento para la uveítis asociada. En ocasiones es necesario añadir tratamiento ciclopléjico o colirios hipotensores. Existe riesgo de resangrado, especialmente entre el tercer y el quinto días, que puede llegar a ser más grave que el sangrado inicial. Fractura Orbitaria Hallazgos En el contexto de una contusión oculoorbitaria o en el reborde orbitario pueden producirse fracturas de las paredes orbitarias, especialmente del suelo orbitario, que puede manifestarse por equimosis periorbitaria, anestesia del territorio del nervio infraorbitario y limitación en la mirada hacia arriba. Actuación Se instaurará tratamiento con corticoides tópicos y cicloplejía, junto con el tratamiento de otras lesiones traumáticas asociadas. La necesidad de tratamiento quirúrgico dependerá de la naturaleza de las lesiones y del desplazamiento de fragmentos y contenido orbitario, así como de las limitaciones de la mirada que se produzcan y de las lesiones neurológicas, traumatológicas y oculares asociadas. Figura e1.6. Subluxación de cristalino. Figura e1.7. Hifema y perforación corneal. Actuación © Elsevier. Fotocopiar sin autorización es un delito. El sangrado en cámara anterior o hifema proviene de una rotura vascular del segmento anterior que suele ser consecuencia de una contusión ocular. Los pacientes suelen referir disminución de la visión y presentan inyección ciliar y turbidez de medios oculares por la presencia de sangre en cámara anterior que se deposita por gravedad formando un nivel horizontal inferior. Debe realizarse una exploración ocular completa para descartar lesiones asociadas (p. ej., en la Figura e1.7 se observan hifema y herida perforante asociadas). e-213 e-214 p ar t e 1 0 : C A P Í T U L O S E X T R A Ojo Rojo No Traumático El diagnóstico diferencial del ojo rojo sin antecedente traumático dirigirá nuestra sospecha clínica preferentemente hacia los cuadros mencionados en este apartado, pero no deben descartarse causas de disminución de la visión que puedan asociarse con inflamación ocular o los cuadros de ojo rojo con antecedente traumático, ya que el paciente puede olvidar referir dicho antecedente. En ambos casos, un interrogatorio dirigido puede ayudarnos en la orientación diagnóstica. Es posible que pacientes en quienes no exista disminución de la visión presenten alteraciones visuales derivadas de la afectación lagrimal o secreciones, pero en estos casos la visión mejora o varía con el parpadeo o el lavado ocular. Asimismo, algunos de los cuadros de ojo rojo pueden afectar a la visión central si hay alteración de los medios ópticos transparentes en alguna localización del eje visual. Dacriocistitis Aguda Hallazgos La obstrucción del conducto lagrimal provocará lagrimeo, que puede asociarse con una infección bacteriana del saco lagrimal con tumefacción de la piel suprayacente y dolor. Actuación Tratamiento antibiótico y antiinflamatorio por vía oral. Si existe progresión a celulitis preseptal se administrará tratamiento antibiótico intravenoso. En caso de formación de un absceso, la lesión puede evolucionar hacia el drenaje espontáneo o requerir drenaje quirúrgico. En estos casos debe realizarse expresión del saco para eliminar el material retenido. Blefaritis Hallazgos Inflamación del borde libre palpebral que puede asociarse con conjuntivitis e incluso con queratitis. Las formas más frecuentes son la blefaritis seborreica y la secundaria a infección estafilocócica. Actuación lagrimeo, quemosis y posible presencia de papilas subtarsales. El paciente puede referir antecedentes de alergia al polvo, polen, animales, u otros alérgenos. Actuación En principio debe evitarse la exposición al alérgeno y puede ser útil el lavado con lágrimas artificiales para retirar el alérgeno de la superficie ocular. El empleo de compresas frías puede disminuir la inflamación. El tratamiento farmacológico puede incluir antihistamínicos, vasoconstrictores y corticoides tópicos. Conjuntivitis Bacteriana Hallazgos Inyección conjuntival y secreción purulenta, sin adenopatías, salvo infección gonocócica. La presencia de disminución de visión, inyección ciliar, opacidad corneal o dolor es un signo de alarma de progresión hacia lesiones de mayor gravedad. Actuación Tratamiento con antibióticos tópicos de amplio espectro. En las conjuntivitis gonocócicas puede ser necesario emplear tratamiento antibiótico intravenoso. En neonatos y en formas severas puede ser recomendable tomar muestras para cultivo y antibiograma. Conjuntivitis/Queratitis Por Adenovirus Hallazgos Conjuntivitis de carácter epidémico, altamente contagiosa. El paciente presenta inyección conjuntival (y/o ciliar en caso de queratitis), lagrimeo, fotofobia e hiperplasia folicular en conjuntiva tarsal. Puede asociar queratitis punteada superficial con o sin infiltrados con disminución de la visión. Esta pérdida visual puede ser permanente en caso de generar leucomas como secuela del episodio. Actuación Higiene palpebral con limpieza del borde palpebral con jabón suave y tratamiento con eritromicina tópica dos veces al día. Algunos casos pueden mejorar con el empleo de tetraciclina o doxiciclina por vía oral. En caso de inflamación pueden asociarse corticoides durante un corto período de tiempo. Medidas preventivas para disminuir el contagio de patología de vías respiratorias altas. Pese a no existir tratamiento antivírico específico, se recomienda pautar antibióticos tópicos para evitar sobreinfección bacteriana, y antiinflamatorio (antiinflamatorios no esteroideos [AINE] o corticoides suaves) para modular la respuesta cicatricial. Conjuntivitis Alérgica Herpes Hallazgos Hallazgos Aparte de las molestias inespecíficas de las conjuntivitis, el síntoma principal de la conjuntivitis alérgica es el picor. En la exploración pueden observarse inyección conjuntival, La primoinfección por herpes suele producir una conjuntivitis folicular en la infancia que puede pasar desapercibida. El virus (herpes simple o zóster) queda E 1 | U rg e n c i a s e n of talmologí a Figura e1.8. Queratitis dendrítica herpética. Figura e1.9. Hemorragia subconjuntival o hiposfagma. acantonado y puede reactivarse ante situaciones de estrés, tratamientos corticoideos o síndromes infecciosos de otro origen. La lesión recurrente más característica es la úlcera dendrítica que puede hacerse más visible con fluoresceína (Figura e1.8). Pueden existir lesiones cutáneas asociadas. Actuación El cuadro es autolimitado y se resuelve espontáneamente. En caso de recurrencias o en el contexto de otras lesiones hemorrágicas deben descartarse alteraciones hematológicas y patologías que generan fragilidad vascular, como hipertensión arterial. Actuación Tratamiento antivírico específico (p. ej., aciclovir) tópico y/o general. Es recomendable asociar un antibiótico para prevenir una sobreinfección bacteriana. Algunas formas con afectación estromal, de origen inmunológico, requieren tratamiento corticoideo. Queratalgia (Erosiones Recurrentes) Hallazgos Erosiones corneales recurrentes con dolor matutino. Pese a no existir antecedente traumático inmediato, en el interrogatorio dirigido suele haber un antecedente remoto de erosión corneal. Epiescleritis Hallazgos Inyección de los vasos conjuntivales y epiesclerales, móviles, de manera sectorial o generalizada (Figura e1.10). Actuación Tratamiento antiinflamatorio tópico, no esteroideo o esteroide suave. © Elsevier. Fotocopiar sin autorización es un delito. Actuación Realizaremos tratamiento de la erosión corneal como se ha descrito anteriormente. El paciente puede beneficiarse de añadir pomada o colirio antiedema para facilitar la resolución del cuadro y prevenir las recurrencias. Hemorragia Subconjuntival (Hiposfagma) Hallazgos La presencia de sangre extravasada subconjuntival sin antecedente traumático puede producirse de manera espontánea o ser secundaria a malformaciones vasculares conjuntivales o a maniobras de Valsalva. No es dolorosa, y carece de relevancia clínica (Figura e1.9). Figura e1.10. Epiescleritis sectorial. e-215 e-216 p ar t e 1 0 : C A P Í T U L O S E X T R A Figura e1.11. Escleritis nodular. Figura e1.12. Abscesos corneales. Escleritis Hallazgos Inyección del plexo vascular profundo, en relación con la esclera, no desplazable y que no se blanquea con la instilación de vasoconstrictores débiles (Figura e1.11). Se clasifica en simple, nodular y necrosante. Suele producir dolor y puede asociarse con enfermedades sistémicas como la sarcoidosis, la colitis ulcerosa, la enfermedad de Crohn y enfermedades del colágeno. Actuación El tratamiento requiere corticoides tópicos y AINE por vía oral. Absceso Corneal Figura e1.13. Uveítis aguda con precipitados endoteliales. Hallazgos El paciente suele acudir a consulta por ojo rojo doloroso, con inyección ciliar, fotofobia y lagrimeo. Es más frecuente en portadores de lentes de contacto o en sujetos con antecedentes recientes de erosión corneal u otras patologías de la superficie ocular (Figura e1.12). Actuación Es recomendable realizar tomas de muestras para cultivo y antibiograma, preferentemente antes de iniciar el tratamiento antibiótico. Emplearemos tratamiento con colirios antibióticos tópicos reforzados y/o de amplio espectro, que puede modificarse en función de la respuesta al tratamiento y de los resultados del antibiograma. fenómeno de Tyndall en cámara anterior (por proteínas y células) y precipitados endoteliales (Figura e1.13). Actuación La mayoría de las uveítis son idiopáticas, pero en ocasiones se asocian con enfermedades sistémicas como espondilitis, sarcoidosis o artritis reumatoide, entre otras. El tratamiento requiere el empleo de corticoides tópicos y ciclopléjicos y, en ocasiones, corticoides sistémicos e inmunomoduladores. Glaucoma Agudo Por Cierre De Ángulo Uveítis Anterior Hallazgos Hallazgos Ojo rojo con inyección ciliar, dolor, fotofobia y disminución de la visión. El paciente presenta midriasis media no reactiva, elevación de la presión intraocular, cámara anterior poco profunda y edema corneal. También puede tener náuseas y vómitos asociados. Ojo rojo con inyección ciliar, dolor y miosis. Con frecuencia se asocia con disminución de la agudeza visual. En la exploración con lámpara de hendidura se observan el E 1 | U rg e n c i a s e n of talmologí a Actuación Actuación Para revertir el cuadro de cierre angular inicialmente pueden pautarse pilocarpina tópica, inhibidores de la anhidrasa carbónica por vía oral o intramuscular o manitol al 20% intravenoso a dosis de 1-2 g/kg, así como tratamiento corticoideo para disminuir la reacción uveal. Estas medidas pueden mantenerse hasta realizar una iridotomía con láser en el ojo afectado e iridotomía profiláctica en el contralateral. El tratamiento del desprendimiento de retina es quirúrgico, y depende del tipo de desprendimiento y de sus características. Celulitis Preseptal Y Orbitaria Hallazgos La celulitis preseptal es la infección de los tejidos blandos por delante del septo orbitario anterior. En el caso de afectación orbitaria la inflamación conlleva dolor, proptosis, limitación de los movimientos oculares e incluso disminución de visión. Actuación La sospecha de afectación orbitaria puede requerir la realización de pruebas radiológicas. El tratamiento se realizará con antibióticos por vía sistémica en función de las etiologías sospechadas (Hemophilus influenzae en niños; estafilococos y estreptococos en adultos). Para el tratamiento de los casos leves se administrarán antibióticos por vía oral, mientras que en los casos graves se emplearán antibióticos intravenosos. © Elsevier. Fotocopiar sin autorización es un delito. Disminución De La Agudeza Visual (Sin Ojo Rojo) Maculopatía Hallazgos Los pacientes con alteraciones maculares suelen presentar disminución de agudeza visual con metamorforpsia. La mácula puede verse afectada por la presencia de hemorragias, exudados o edema originadas por patologías de diverso origen, entre las que debemos destacar la degeneración macular asociada a la edad y la diabetes. Actuación Con frecuencia debe completarse el estudio con pruebas complementarias de imagen como angiografía y/o tomografías ópticas de coherencia para establecer el diagnóstico exacto, su grado de afectación o las posibilidades de tratamiento. Hemorragia Vítrea Hallazgos Pérdida visual variable, desde miodesopsias hasta pérdida completa de la visión, en función de la cantidad y de la localización de la sangre, así como la patología que la ha originado. Entre las causas cabe destacar desprendimiento vítreo posterior, retinopatía diabética proliferante, neovascularización retiniana tras trombosis venosa, desgarro o desprendimiento de retina, macroaneurisma y traumatismos. La disminución de agudeza visual en la atención de urgencias puede presentarse en asociación con un cuadro de ojo rojo, cuyo diagnóstico diferencial se realizará entre los cuadros descritos anteriormente. En los casos de disminución de agudeza visual sin ojo rojo podemos encontrar, entre otros, los cuadros clínicos que se mencionan a continuación y que son tratados con mayor detalle en los capítulos correspondientes. No obstante, la relación que se detalla seguidamente puede servir de orientación en el diagnóstico diferencial. Actuación Desprendimiento De Retina Disminución de agudeza visual, más o menos rápida, que generalmente no hace perder de manera completa la visión. En el territorio de la vena ocluida se observan hemorragias intrarretinianas e incluso vítreas. La presencia de exudados algodonosos puede indicar un mayor componente isquémico. Hallazgos Pérdida visual indolora, referida como sensación de telón que va ocupando el campo visual hasta poder producir la pérdida total de la visión en el ojo afectado. La retina presenta un aspecto blanquecino y sobreelevado. Puede originarse a partir de una solución de continuidad en la retina (desprendimiento regmatógeno) o asociarse con otras patologías (desprendimientos traccionales y serosos). Los detalles de estas afecciones se describen con más detalle en el capítulo correspondiente. El tratamiento depende de la patología subyacente responsable del sangrado. La urgencia del esfuerzo diagnóstico depende de la patología más grave que aún no haya sido descartada del diagnóstico diferencial. Oclusión Venosa Hallazgos Actuación Revisiones periódicas para descartar complicaciones derivadas del edema, isquemia o incluso neovascularizaciones en papila, retina o incluso en el segmento anterior del ojo. e-217 e-218 p ar t e 1 0 : C A P Í T U L O S E X T R A Oclusión Arterial Hallazgos Pérdida rápida de la visión, indolora. La oclusión de la arteria central de la retina produce un área isquémica blanquecina con un mayor contraste del área macular en forma de mancha rojo-cereza debido a la mayor visibilidad de la vascularización coroidea. Actuación En caso de poder atender al paciente durante las primeras 4-5 horas tras la obstrucción, intentaremos que el émbolo avance hacia ramas arteriales más periféricas para tratar de preservar la mayor área de visión posible. Para ello sentaremos o tumbaremos al paciente, y trataremos de disminuir la presión ocular mediante masaje ocular, colirios hipotensores tópicos, inhibidores de la anhidrasa carbónica por vía sistémica y/o 299 ml de manitol al 20% i.v. Otra maniobra para hacer disminuir la presión intraocular es la punción de cámara anterior, aunque conlleva mayores riesgos (endoftalmitis y punción de estructuras intraoculares) que las maniobras anteriores, sin haber demostrado tener una mayor eficacia. También podemos tratar de mejorar la perfusión ocular mediante el empleo de diversos gases. Se han usado oxígeno (a presión normal o hiperbárico) y mezclas del 95% de oxígeno y del 5% de CO2, para lograr una relativa vasodilatación, ya que el oxígeno puro, pese a lograr un relativo aporte de éste a la retina externa desde la coroides, induce una vasoconstricción que no contribuye a resolver el cuadro. No obstante, el empleo de la mezcla de gases no obtiene resultados significativamente superiores. Asimismo, se han utilizado inyecciones retrooculares de sustancias vasodilatadoras sin lograr mayores porcentajes de éxito; además, se corre el riesgo de producir una hemorragia retroorbitaria que empeoraría el cuadro. El resultado del tratamiento en muchos casos es poco gratificante, pero existen posibilidades de recuperación de visión, especialmente si las maniobras se realizan durante los primeros minutos tras la oclusión arterial. Neuritis Ópticas Hallazgos Las neuritis ópticas suelen presentarse como un cuadro de disminución de visión con alteración de la visión cromática y, en ocasiones, dolor con los movimientos oculares. Los pacientes presentan un defecto pupilar aferente relativo y edema de papila. En los casos de neuritis retrobulbar el nervio óptico tiene un aspecto normal. La realización de campos visuales permite monitorizar la evolución del proceso. En un porcentaje elevado de estos pacientes, la neuritis puede ser la forma de presentación de una esclerosis múltiple. En las neuropatías ópticas isquémicas puede existir una pérdida importante de visión con posible afectación bilateral y asociada con arteritis de células gigantes. Actuación No existe un tratamiento específico. En las formas asociadas con arteritis de células gigantes debe instaurarse tratamiento corticoideo a altas dosis. En otros cuadros, el tratamiento con corticoides sistémicos parece acortar el período de recuperación en algunos casos, pero no mejora los resultados a largo plazo. Conclusiones – La orientación de los cuadros diagnósticos puede establecerse en función de los motivos de consulta más relevantes (ojo rojo y pérdida de visión). – El conocimiento de las pautas de actuación oftalmológica urgentes y diferidas puede mejorar el pronóstico de las urgencias más graves. Bibliografía Albert D, Miller J, Azar D, Blodi B. Albert and Jakobiec’s Principles and Practice of Ophthalmology. (3.ª ed.). Philadelphia: Saunders, 2008. Ehlers J, Shah C. The Wills Eye Manual. (5.ª ed.). Baltimore: Lippincott Williams & Wilkins, 2008. Kanski JJ. Oftalmología Clínica. (5.ª ed.). Madrid: Elsevier, 2004. E 1 | U rg e n c i a s e n of talmologí a Autoevaluación E1 1.La conjuntivitis bacteriana aguda se caracteriza por: a. Dolor ocular y miosis. b. Hipotensión ocular y sinequias en el cristalino. c. Secreción purulenta y pérdida de acomodación. d. Ojo rojo sin pérdida visual. e. Edema conjuntival y midriasis. Correcta: d. La conjuntivitis infecciosa es una patología de superficie ocular caracterizada por ojo rojo y secreción, sin disminución de agudeza visual ni alteración pupilar. 2.En la queratitis actínica, señale la respuesta incorrecta: a. Existe antecedente de exposición a luz ultravioleta o soldaduras. b. Es un proceso generalmente unilateral. c. Las recurrencias espontáneas no son frecuentes. d. Se manifiesta a las horas tras la exposición al agente causal. e. Se trata mediante oclusión y midriáticos. Correcta: b. La queratitis actínica se produce por la exposición de luz ultravioleta o soldaduras. Lo habitual es que afecte a los dos ojos. 3.El glaucoma agudo de ángulo cerrado produce todo excepto: © Elsevier. Fotocopiar sin autorización es un delito. a. Malestar general. b. Cefalea frontal. c. Secreción purulenta. d. Edema corneal. e. Náuseas y vómitos. Correcta: c. La secreción se produce en patologías infecciosas y de superficie ocular en la mayoría de las ocasiones. El glaucoma agudo se desencadena por un cierre angular y el incremento de la presión ocular se acompaña de malestar, náuseas y visión borrosa por edema corneal. 4.Señale la complicación o complicaciones que no son frecuentes en las uveítis agudas: a. Edema corneal. b. Subluxación del cristalino. c. Glaucoma secundario. d. Sinequias iridocristalinianas. e.Precipitados corneales «en grasa de carnero». Correcta: b. Las uveítis agudas son una inflamación intraocular con liberación de células inflamatorias y proteínas en la cámara anterior del ojo. Esto puede producir glaucoma secundario por obstrucción de la malla trabecular, sinequias posteriores y precipitados endoteliales. No afecta al sostén del complejo saco-cristalino. 5.En la embolia de la arteria central de la retina: a. b. c. d. e. Se produce dolor hemicraneal intenso. Se mantiene el reflejo fotomotor. Se mantiene el reflejo consensual. Se produce miosis. Se trata con fotocoagulación urgente para evitar complicaciones. Correcta: c. Al iluminar con una linterna el ojo sano, la pupila del afecto se contrae. e-219 e-220 p ar t e 1 0 : C A P Í T U L O S E X T R A Temas de trabajo E1 1. Crear un algoritmo diagnóstico en el que se agrupen los cuadros con disminución de agudeza visual en función de la presencia (o ausencia) de: a. Ojo rojo b. Alteración pupilar c. Antecedente traumático 2. Crear un algoritmo diagnóstico de los cuadros de ojo rojo en función de la presencia (o ausencia) de: a. b. c. d. Inyección ciliar o mixta Disminución de la agudeza visual Antecedente traumático Dolor Pérdida de agudeza visual Objetivos de aprendizaje ● Conocer que una historia clínica cuidadosa puede ser fundamental a la hora de hacer el diagnóstico diferencial de las pérdidas de agudeza visual y, por lo tanto, de iniciar el tratamiento. ● Entender que la mayoría de las veces la pérdida de agudeza visual suele deberse a un problema oftalmológico, aunque muchas enfermedades sistémicas pueden presentar este síntoma. ● Saber qué pacientes con pérdidas de agudeza visual deben ser remitidos de forma urgente a un oftalmólogo y quiénes han de ser remitidos a otros especialistas (internista, neurólogo, reumatólogo, cardiólogo, etc.). Palabras clave/Key words Pérdida de visión Neuroftalmología Alteraciones vasculares retinianas Intoxicaciones Desprendimiento de retina Degeneración macular Traumatismos oculares Sudden loss of vision Neurophthalmology Retinal vascular disorders Ocular toxicology Retinal detachment Macular degeneration Ocular traumatology Introducción Con mucha frecuencia la pérdida de visión es causa de consulta médica y no sólo para el médico especialista. El médico de atención primaria es, en la mayoría de las ocasio­ nes, el primer escalón, y aunque tendrá que remitir al paciente a un oftalmólogo, debe ser capaz de realizar una aproximación al diagnóstico y, lo que es más importante, conocer si debe iniciar un tratamiento que podría ser esencial para conservar en lo posible la función visual. Los datos que deberá recoger la historia clínica incluirán, además de la edad del paciente y sus antecedentes familiares de enfermedades oculares, defectos de refracción, traumatismos o cirugías oculares, el padecimiento de © 2012. Elsevier España, S.L. Reservados todos los derechos E2 enfermedades vasculares, inmunológicas, hematológicas, oncológicas, su puesto de trabajo y el contacto con posibles sustancias tóxicas, así como si mantiene algún tipo de tratamiento, preguntando directamente sobre el uso de algunos fármacos que pueden afectar a la función visual. Es muy importante diferenciar la pérdida real de la agudeza visual con otros síntomas visuales, como la diplopía, ya que algunos pacientes pueden ser incapaces de diferenciarlos. La evolución y las características de la pérdida de visión son importantes, ya que nos pueden orientar hacia el diagnóstico: su monolateralidad o bilateralidad, rapidez en la instauración y duración, existencia de episodios anteriores, síntomas que la precedieron o acompañan (fosfenos, dolor de cabeza, dolor ocular, etc.). También tiene importancia la manera cómo el paciente describe su pérdida visual, descrita a veces como una sombra que desciende, borrosidad, visión empañada, pérdidas en el campo visual periférico, filamentos o puntos negros que se mueven, etc. La exploración del paciente debería incluir la valoración de la agudeza visual mediante una escala de optotipos, siempre que esto sea posible. De no ser así, ésta puede aproximarse mediante la lectura, la visión de objetos o la cuenta de dedos a diferentes distancias. Es muy importante en el diagnóstico diferencial la exploración neuroftalmológica: tamaño y forma de las pupilas, reflejos pupilares fotomotor directo y consensual, y motilidad ocular. Asimismo, se deberá observar cuidadosamente el segmento anterior del globo ocular buscando enrojecimiento, opacidades corneales, dureza del globo, etc. Si fuera posible, y dependiendo de la experiencia del médico, se debería también realizar una exploración del polo posterior porque va a facilitar la mayoría de las veces la clave diagnóstica. Una vez completadas la historia clínica y la exploración se puede realizar el diagnóstico diferencial. Se suele clasificar la pérdida aguda de visión según la Figura e2.1. Es importante que el médico general, ante pérdidas de visión, sobre todo las indoloras y permanentes, sea capaz de buscar los diferentes orígenes: 1. Originada como consecuencia de una enfermedad sistémica o una infección (habitualmente por complicaciones neurológicas de éstas). Enfermedades inflamatorias, reumáticas, autoinmunitarias, hematológicas, del colágeno, vasculitis, etc., pueden ocasionar pérdidas de visión por diferentes mecanismos patogénicos (uveítis, neuropatías ópticas, oclusiones arteriales o venosas, hemorragias). e-221 e-222 pa r t e 1 0 : C A P Í T U L O S E X T R A serie de situaciones clínicas que pueden acompañarse de pérdida de visión y que ponen en la pista al clínico. 3. Origen tóxico, farmacológico o laboral. Este origen es más frecuente de lo esperado y se encuentran pérdidas profundas de agudeza visual, en general bilaterales, que en ocasiones pueden llegar a ser permanentes. 4. Origen traumático, por lesión directa de cualquier estructura de la vía visual o por lesiones tardías compresivas o bien por lesiones oculares que a veces aparecen semanas después del accidente. 5. No olvidar nunca la posibilidad de que el paciente sea un simulador y esté intentando sacar provecho. Pérdida De Visión Transitoria La visión va a recuperarse a sus niveles anteriores durante las 24 horas siguientes a su pérdida, frecuentemente du­ rante la primera hora. Figura e2.1. Clasificación y diagnóstico diferencial de las pérdidas de visión dependiendo de los síntomas. 2. Origen circulatorio. Habitualmente, en personas en la quinta-sexta décadas de la vida, con antecedentes conocidos de enfermedades circulatorias, en ocasiones será la pérdida de visión la que ponga en evidencia el problema subyacente. En la Tabla e2.1 se exponen una Oscurecimiento Transitorio De La Visión Pueden ser episodios de pocos segundos de duración, en uno, o más frecuentemente, en ambos ojos, y pueden precipitarse por maniobras de Valsalva. Puede ser el síntoma inicial de problemas neuroftalmológicos y asociarse posteriormente con edema de papila, anomalías papilares o drusas. Se debe realizar un examen cuidadoso del fondo de ojo y excluir otras causas oculares. Accidente Isquémico Transitorio O Amaurosis Fugax Tabla e2.1 Situaciones clínicas particulares que se pueden acompañar de pérdida de visión Cuadro clínico Sospecha Paciente con anemia aguda o crónica que sufre un síncope con pérdida de visión Neuropatía óptica Hipertenso con pérdida de visión, posible historia personal de isquemia cardíaca o accidentes cerebrovasculares Todo el espectro de: Hemorragia vítrea o macular Oclusión venosa Oclusión arterial Neuropatía óptica isquémica Cefaleas intensas si el paciente es mayor de 70 años con pérdida de visión, alteración del estado general, artralgias y aumento de la VSG Arteritis temporal, neuropatía óptica isquémica Persona joven con pérdidas transitorias de visión los días precedentes Posibles espasmos vasculares que pueden desembocar en una oclusión vascular Neuropatía óptica Politraumatizados, fracturas de huesos largos, síndromes de aplastamiento Embolias grasas VSG: velocidad de sedimentación globular. Episodios de pérdida completa de visión monocular de varios minutos de duración (entre 5 y 15). Se deben a una isquemia cerebral localizada, y la exploración oftalmológica suele ser normal. Este tipo de accidentes suelen deberse a estenosis carotídea, valvulopatía cardíaca (Figura e2.2), enfermedades del colágeno, espasmos vasculares, insuficiencias vertebrobasilares (si la pérdida es bilateral) o problemas sanguíneos, por lo que se pueden realizar un eco-Doppler, Figura e2.2. Émbolo arterial en la arteria temporal inferior, largo, blan­ quecino, descrito habitualmente como de origen plaquetario. E 2 | Pé rd i d a d e a g ud ez a v i sual ecocardiograma y estudios de coagulación. Los accidentes isquémicos transitorios deben ser considerados como un accidente cerebrovascular y el paciente debe ser estudiado cuidadosamente por los neurólogos, ya que puede desarrollar un episodio isquémico en los días siguientes. Aura Migrañosa La migraña es un tipo de dolor de cabeza, usualmente muy intenso y capaz de incapacitar a quien lo sufre. La migraña clásica o migraña con aura es precedida por un conjunto de síntomas específicos que comúnmente se experimentan como una distorsión en la visión. Los síntomas visuales son muy variables; en general se observa una «mancha» o zona de escotoma negativo que se va extendiendo progresivamente. Puede acompañarse de escotomas positivos, que son destellos, halos, sensación de aguas e incluso pérdida de visión (Figura e2.3). En general precede a la migraña, aunque puede ocurrir después, y no siempre se acompaña de cefalea. El defecto visual suele durar entre 10 y 60 minutos. La exploración oftalmológica es normal. Migraña Retiniana Es un subtipo de migraña que consiste en una alteración visual unilateral permanente o transitoria, en un sujeto afectado de migraña, que puede aparecer durante un e­ pisodio de jaqueca o bien en la intercrisis. Las crisis de cefalea se acompañan de pérdida de visión monocular en forma de escotoma o amaurosis que duran menos de una hora. En la exploración del fondo de ojo pueden verse atenuación arteriolar y hemorragias peripapilares. Obviamente, se plantea el diagnóstico diferencial con la amaurosis fugax de origen embólico arterioarterial. Como posibles otras causas de pérdidas transitorias de agudeza visual también deberían considerarse una oclusión venosa en sus fases más iniciales, neuropatía óptica isquémica, síndromes isquémicos oculares, glaucoma, cambios bruscos de la presión arterial, lesiones del sistema nervioso central, drusas del nervio óptico o arteritis de células gigantes. Pérdida De Visión No Transitoria Este tipo de pérdida de visión deberá tenerse en cuenta cuando el paciente refiera una pérdida visual de más de 24 horas de duración. Acompañada De Dolor Uveítis Inflamación de origen inmunitario o infeccioso de la úvea. Puede ser anterior (Figura e2.4), afectando al iris y al cuerpo ciliar; intermedia, cuando afecta al vítreo y a la retina periférica; posterior, cuando afecta a la retina, a la coroides (Figura e2.5) y a los vasos retinianos (Figura e2.6), o panuveítis, cuando se ven afectadas varias estructuras. Los síntomas más frecuentes son los siguientes: © Elsevier. Fotocopiar sin autorización es un delito. 1. Pérdida de visión de aparición más o menos lenta con ojo rojo y dolor. 2. Fotofobia, es un síntoma bastante habitual. 3. Cuerpos flotantes. 4. Escotomas. Los signos que se pueden encontrar en la exploración ocular son variables, dependiendo del grado de la afectación y de las estructuras afectadas, aunque es frecuente observar inyección periquerática, miosis o irregularidad Figura e2.3. El aura migrañosa ha servido de inspiración a numerosos artistas. Se muestra un cuadro de Giorgio di Chirico, con una figura central a modo de escotoma negativo cuyo contorno adquiere el típico borde dentado de las alucinaciones visuales que preceden a la migraña (tomado de Fuller GN, Gale MV. Migraine aura as artistic inspiration. Br Med J 1988;298:1670-1672). Figura e2.4. Uveítis anterior. Se observan precipitados endoteliales. e-223 e-224 pa r t e 1 0 : C A P Í T U L O S E X T R A Figura e2.5. Síndrome de múltiples puntos blancos evanescentes, ejem­ plo de enfermedad inflamatoria ocular con afectación de la úvea posterior. Figura e2.7. Endoftalmitis. El hipopión es un depósito en cámara anterior de material inflamatorio. Figura e2.6. Vasculitis con manguitos inflamatorios periarteriales y hemorragias retinianas. pupilar con falta de respuesta a la luz y turbidez que impide observar con nitidez los detalles del iris. Hay que preguntar acerca de la presencia de factores de riesgo de enfermedad sistémica autoinmunitaria, infecciones sistémicas, inmunodepresión o tóxicos, aunque la mayoría de estos procesos son idiopáticos y no suelen asociarse con patología sistémica. Se tratará con ciclopléjicos, esteroides tópicos, perioculares y sistémicos dependiendo de la severidad del cuadro. Endoftalmitis Si se observa un enrojecimiento difuso con quemosis y no se ven bien los detalles del iris o de la pupila, porque la cámara anterior está muy turbia, o incluso blanquecina, debe sospecharse la existencia de una endoftalmitis (Figuras e2.7 y e2.8). Esto será casi seguro si existe un antecedente próximo de cirugía intraocular o de traumatismo ocular penetrante. Se debería sospechar una endoftalmitis endógena en el caso de un paciente con un foco infeccioso e inmunodepresión. Se debe instaurar un tratamiento antibiótico sistémico con fármacos que tengan una alta penetración ocular y remitir de forma inmediata al paciente a un servicio de oftalmología. Figura e2.8. Endoftalmitis. Se expone un cuadro gravísimo tras un tras­ plante de córnea; cámara anterior rellena de material purulento. Alteraciones corneales La presencia de una queratitis suele afectar a la visión, aunque la sensación de cuerpo extraño o dolor, la fotofobia y las alteraciones en la transparencia corneal son muy habituales y facilitan el diagnóstico (Figura e2.9). Glaucoma agudo El glaucoma agudo de ángulo cerrado se asocia con dolor (uno de los más agudos que se han descrito), náuseas y o vómitos, con trastornos de la visión y con ojo rojo, siendo esencial la exploración del tono ocular. Si no se dispone de tonómetro se puede realizar de forma digital comparando la consistencia de ambos globos oculares, ya que el afectado tendrá una dureza pétrea. La raza, la edad avanzada, la hipermetropía elevada, el sexo femenino y la existencia de E 2 | Pé rd i d a d e a g ud ez a v i sual Figura e2.9. Pérdida de visión en un paciente con historia previa de conjuntivitis. Se observa la aparición de infiltrados corneales habituales de las queratoconjuntivitis por adenovirus. antecedentes familiares son algunos de los factores de riesgo relacionados con la aparición de este tipo de glaucoma. Además, la acción de colirios midriáticos o de algunos fármacos puede asociarse con la aparición de esta afección al tener un efecto dilatador de la pupila, como la adrenalina y la efedrina, el salbutamol o el bromuro de ipratropio. Algunos fármacos como los antidepresivos y los antagonistas de los receptores tipo 2 de la histamina tienen un efecto anticolinérgico leve. Algunos pacientes en tratamiento con topiramato por diferentes motivos, y que presenten hipersensibilidad a la sustancia, podrían presentar un cuadro grave de glaucoma agudo bilateral, parece que por edema del cuerpo ciliar y cierre angular secundario. El cuadro suele producirse en el transcurso de las primeras 2 semanas de tratamiento, revierte en 24-48 horas tras la suspensión del fármaco, y tiene mala respuesta al tratamiento. No Acompañadas De Dolor © Elsevier. Fotocopiar sin autorización es un delito. Hemorragia vítrea Figura e2.10. Hemorragia vítrea. Las lesiones blanquecinas corresponden a proliferaciones fibrovasculares en el contexto de una retinopatía diabética proliferativa. Como antecedentes de interés podemos encontrar una cirugía de cataratas, una miopía, antecedentes familiares de desprendimiento de retina o un traumatismo ocular (Figura e2.11). Oclusiones arteriales retinianas Se diferencian la oclusión de la arteria central de la retina y las oclusiones de rama arterial. La primera (Figura e2.12) se presenta como una pérdida unilateral, indolora, repentina e importante de agudeza visual (generalmente entre percepción de luz y contar dedos); el paciente suele tener factores de riesgo vascular y se presentan habitualmente de madrugada. Se observará la aparición de manchas rojo cereza e incluso la presencia de émbolos en el árbol vascular; es frecuente encontrar un defecto pupilar aferente. Se trata de una auténtica urgencia oftalmológica, debiéndose iniciar tratamiento de forma inmediata. Se suele comenzar con masaje ocular, para­ centesis de cámara anterior y fibrinólisis mediante cateterismo selectivo de la arteria en un servicio especializado. Se deben excluir una fuente embolígena, trombosis, arteritis Es una pérdida de visión indolora y muy rápida. La profundidad de la pérdida es variable. El paciente puede referir desde la visión de telas oscuras hasta la única ­percepción de luz. Los antecedentes más relevantes son el padecimiento de una diabetes de larga evolución, la aparición de fosfenos, flashes de luz y miodesopsias (desprendimiento del vítreo posterior y rotura retiniana), oclusión venosa retiniana, degeneración macular asociada a la edad, enfermedades oclusivas, traumatismos oculares, hemorragias en el sistema nervioso central (síndrome de Terson), etc. No se observa reflejo de fondo o incluso se ven masas oscuras (Figura e2.10). Desprendimiento de retina Se suele tratar de una pérdida de visión unilateral, indolora, rápidamente progresiva que se inicia con una sensación de telón que avanza hacia el centro y que puede verse precedida por una visión de relámpagos y moscas volantes. Figura e2.11. Desprendimiento de retina. Se observa la retina despren­ dida en la mitad superior, con cierta turbidez vítrea por hemorragia vítrea acompañante. e-225 e-226 pa r t e 1 0 : C A P Í T U L O S E X T R A Figura e2.12. Oclusión de la arteria central de la retina; retina de aspecto lechoso con mancha rojo cereza. Se debe a que en la fóvea no hay capa de fibras, cuyo edema es el responsable de este aspecto blanquecino, y se observa el color de la coroides subyacente. Zona pequeña respetada por arteria ciliorretiniana. Figura e2.14. Oclusión de la vena temporal inferior desde un cruce arteriovenoso. Se observan numerosas hemorragias retinianas «en llama» en el trayecto de la vena. Patología macular de células gigantes, especialmente en pacientes mayores de 55 años, enfermedades del colágeno o hipercoagulabi­ lidad. Las oclusiones de rama (Figura e2.13) no suelen provocar descensos tan profundos y no hay tratamiento establecido, aunque las causas son similares a las de una oclusión de la arteria central. Oclusiones venosas retinianas Se trata de una pérdida de visión en general rápidamente progresiva, aunque los síntomas pueden evolucionar durante unos días. El principal factor de riesgo es la hipertensión arterial y se trata de la segunda causa vascular de pérdida de visión tras la retinopatía diabética. Puede afectar a la vena central de la retina o a una rama venosa (Figura e2.14) y la afectación ocular puede variar desde contar dedos hasta 10/10 y referirse como visión de sombras. Habitualmente se observan hemorragias retinianas más o menos extensas y exudados algodonosos, junto con ingurgitación venosa y, en ocasiones, edema de papila. Figura e2.13. Oclusión de la arteria temporal inferior. Se observa el émbolo responsable de la oclusión. La presencia de un escotoma central o de metamorfopsias pueden ser la clave para diagnosticar un problema macular. La presencia de una membrana vascular subretiniana en el área macular es la lesión característica de la degeneración macular asociada a la edad y de la miopía magna (Figuras e2.15 y e2.16). Un paciente mayor de 65 años que presenta de forma aguda o en el contexto de una pérdida lenta de su agudeza visual una mancha oscura en el centro o que ve las líneas torcidas posiblemente presente una degeneración macular exudativa. Si el paciente es más joven y tiene una miopía magna con los mismos síntomas posiblemente presente una membrana subretiniana miópica. Diferentes enfermedades que afectan a la mácula pueden aparecer con una sintomatología similar. Neuropatías ópticas Podemos diferenciar las neuropatías ópticas no isquémicas y las isquémicas. Las primeras (Figura e2.17) podrían incluirse también entre las causas dolorosas de pérdida de visión, porque en ocasiones se acompañan de dolor a los movimientos oculares, aunque es un síntoma muy variable. Figura e2.15. Hemorragia macular en un paciente mayor afectado de degeneración macular asociada a la edad. E 2 | Pé rd i d a d e a g ud ez a v i sual Figura e2.16. Placa de neovascularización subretinana macular en un ojo de un paciente afectado de miopía magna. Se pueden observar los cambios de atrofia coriorretiniana que se asocian con esta enfermedad. Figura e2.18. Neuropatía óptica isquémica en un paciente con arteritis de la temporal. Se observa borrosidad papilar con venas tortuosas, exudación y hemorragias «en llama». de vitamina B1, anemia perniciosa y déficit de vitamina B12, tóxicos como cloranfenicol, etambutol, isoniazidas, digitálicos, cloroquina, estreptomicina, clorpromacina, disulfiram, citrato de sildenafilo (Viagra), y diferentes sustancias que se pueden encontrar en el ámbito laboral como el plomo, disolventes, etc. En la Tabla e2.2 se exponen sustancias potencialmente tóxicas para los ojos que pueden provocar pérdida de visión. Su conocimiento puede apartar al paciente de su fuente de toxicidad y en ocasiones impedir la evolución. Tabla e2.2 Algunas sustancias que pueden provocar pérdida de visión © Elsevier. Fotocopiar sin autorización es un delito. Figura e2.17. Neuropatía óptica no isquémica; moderada borrosidad papilar. La pérdida de visión puede ser repentina, aunque lo habitual es que se desarrolle a lo largo de unos días y la gravedad del cuadro es variable, desde pérdida profunda a sutil. La edad suele estar comprendida entre 18 y 45 años, y es típica la percepción de menos luminosidad, colores menos brillantes y alteración del reflejo pupilar aferente. Se pueden encontrar antecedentes de enfermedades virales, o ser parte o inicio de una enfermedad neurológica como la esclerosis múltiple. Se suele observar edema de papila y es frecuente la instauración de tratamiento corticoideo a altas dosis, dependiendo del grado de déficit visual. Las neuropatías ópticas isquémicas (Figura e2.18) suelen ser de aparición brusca, más intensas, sin dolor periocular y el paciente presenta antecedentes de hipertensión arterial, o en pacientes mayores ser manifestación de una arteritis temporal. En este último caso son fundamentales el diagnóstico y la instauración de tratamiento corticoideo, ya que existe un importante riesgo de afectación del ojo contralateral, incluso en horas. Por último, existe un grupo amplio de neuropatías ópticas de origen tóxico o metabólico, no dolorosas, progresivas y bilaterales que pueden aparecer en el contexto de un abuso de alcohol/tabaco, malnutrición con déficit Fármacos Ácido nicotínico Alcohol metílico Anticoagulantes, anticonceptivos orales Bifosfonatos Carboplatino, cisplatino Ciprofloxacino, cloramfenicol, estreptomicina Cloroquina, hidroxicloroquina Etambutol, isoniacida Ibuprofeno, naproxeno Interferón Tamoxifeno Edema macular Atrofia óptica Hemorragias Uveítis Ceguera cortical Neuropatía óptica Topiramato Rofecoxib, celecoxib Sildenafilo, vardenafilo, tadalafilo Vigabatrina Vincristina Maculopatía Neuropatía óptica Neuropatía óptica Retinopatía Depósitos retinianos, neuropatía óptica Glaucoma agudo Visión borrosa Pérdidas de visión Defectos en el campo visual Neuropatía óptica Hierbas medicinales Cantaxantina Datura stramonium Ginko biloba Pigmenta macula Midriasis, glaucoma agudo Hemorragias de retina Intoxicaciones laborales Hidrocarburos, disolventes y otros derivados del petróleo Dióxido de carbono Plomo Neuropatía óptica Neuropatía óptica Neuropatía óptica e-227 e-228 pa r t e 1 0 : C A P Í T U L O S E X T R A Traumatológicas Es habitual que exista un antecedente de traumatismo craneal u orbitario, con o sin pérdida de conciencia. La pérdida de visión puede aparecer desde el primer momento o bien después de unas 24-48 horas. Se debe sospechar la lesión directa o compresiva del nervio óptico y realizar pruebas de imagen para indicar una cirugía precoz. Si la pérdida visual aparece de forma tardía no debe olvidarse la posibilidad de que haya un desprendimiento de retina y remitir al paciente para la realización de una exploración oftalmológica. En resumen, debemos recalcar la importancia de una correcta y cuidadosa anamnesis de un paciente que sufre una pérdida aguda de agudeza visual, teniendo en cuenta el amplio abanico de situaciones en la práctica clínica habi­ tual que pueden desencadenarla y de la importancia que tiene el médico de atención primaria o de un especialista no oftalmólogo a la hora de evaluar correctamente el cuadro y de derivar al paciente con mayor o menor urgencia a un servicio de oftalmología. Conclusiones – Hemos aprendido que la historia clínica detallada, principalmente las características de la pérdida de visión, va a aportar datos fundamentales para llegar a un diagnóstico de aproximación. – La pérdida de visión nos puede alertar acerca de la existencia de una enfermedad sistémica o del empeoramiento de un proceso sistémico latente. Por ejemplo, una amaurosis fugax puede ser el aviso de un futuro accidente cerebral o de un ataque cardíaco. – Existen numerosos procesos sistémicos, fundamentalmente enfermedades del tejido conectivo o inmunitarias, que se pueden acompañar de pérdida visual. Deberemos tratar la enfermedad de base para poder obtener mejorías. – Estos pacientes siempre deberán ser remitidos a un oftalmólogo, aunque la urgencia de la consulta puede ser variable, y dependerá de los datos obtenidos en la historia y en la exploración. En la mayoría de las ocasio­ nes el examen de fondo de ojo será fundamental en el diagnóstico. Bibliografía Algan B. Cómo proceder en urgencias oftalmológicas. Barcelona: Ediciones Doyma para Laboratorios CUSI, 1987. Alonso Caviedes A, Collado Hornillos JA, Gómez Dacasa A. Oftalmología II. Santander.: Servicio de Publicaciones de la Universidad de Cantabria, 1991. Cullom RD, Chang B (2.ª ed. eds.); Friedberg MA, Rapuano CJ (founding editors). The Wills Eye Manual. Office and emergency room diagnosis and treatment of eye disease. Philadelphia: JB Lippincott Company, 1994. Duch F. Urgencias oftalmológicas. Barcelona: Trajecte S.A. para CIBA Vision, 1996. Fuller GN, Gale MV. Migraine aura as artistic inspiration. Br Med J 1988;24: 1670-2. Honrubia FM, (ed.). Oftalmología general. Zaragoza: Talleres Gráficos Edelvives, 2001. Stein R, Stein H, Slatt B. Management of ocular emergencies. An Allergan handbook. Montreal: Medicöpea, 1990. E 2 | Pé rd i d a d e a g ud ez a v i sual Autoevaluación E2 1. ¿Qué caracteriza a las pérdidas transitorias de la visión? a. Frecuentemente son unilaterales b. Nunca presentan lesiones de fondo de ojo asociadas c. Son episodios que duran segundos d. No se debe hacer diagnóstico por exclusión e. Duran más de una hora Correcta: c. Los episodios de pérdida de visión transitoria duran, por lo general, poco tiempo, desde segundos hasta horas, y, como su nombre indica, la visión se recupera tras el episodio. Generalmente se deben a una isquemia cerebral localizada o a cambios de tipo migrañoso, por lo que la alteración visual puede ser binocular y la exploración oftalmológica suele ser normal, aunque pueden acompañarse de alteraciones en la exploración como edema de papila, anomalías papilares o drusas, atenuación arteriolar y hemorragias peripapilares. Es importante descartar otra causa oftalmológica y, por tanto, el diagnóstico en muchos casos es de exclusión. A raíz del episodio debe hacerse un estudio general meticuloso del paciente para descartar la exis­ tencia de una patología sistémica, ya que puede desarrollar un episodio isquémico en los días siguientes. 2.Los accidentes isquémicos transitorios visuales (amaurosis fugax): © Elsevier. Fotocopiar sin autorización es un delito. a. Duran generalmente unos minutos b. Suele haber problemas ateroscleróticos c. La exploración oftalmoscópica suele ser normal d. El paciente debe ser evaluado por un neurólogo e.Todas son correctas Correcta: e. La amaurosis fugax es una situación de pérdida completa de visión monocular (binocular si el territorio afec­ tado es el vertebrobasilar) de varios minutos de duración (entre 5 y 15). Se debe a una isquemia cerebral localizada, y la explora­ ción oftalmológica suele ser normal. Este tipo de accidentes suelen deberse a estenosis carotídea, valvulopatía cardíaca, enfermedades del colágeno, espasmos vasculares, insuficiencias vertebrobasilares o problemas sanguíneos, por lo que se pueden realizar un eco-Doppler, ecocardiograma y estudios de coagu­ lación. Los accidentes isquémicos transitorios deben ser consi­ derados como un accidente cerebrovascular y el paciente debe ser estudiado cuidadosamente por los neurólogos, ya que puede desarrollar un episodio isquémico en los días siguientes, por tanto, todas las respuestas son correctas. 3. Es falso acerca de la pérdida de visión acompañada de dolor: a. Debe ser evaluada por un oftalmólogo de forma prefe­ rente-urgente b. El desprendimiento de retina es una causa frecuente de pérdida dolorosa de visión c. El glaucoma agudo se puede desencadenar por la toma de topiramato d. Un paciente con pérdida de visión y dolor en el posto­ peratorio de una cirugía de cataratas puede presentar una endoftalmitis e. Dolor, fotofobia, cuerpos flotantes y pérdida variable de visión pueden ser síntomas de uveítis Correcta: b. La pérdida visual acompañada de dolor puede estar causada por múltiples etiologías; alguna de ellas requiere tratamiento urgente para mejorar su pronóstico y, por tanto, resulta esencial la evaluación por parte de un oftalmólogo para establecer el diagnóstico y tratamiento lo antes posible. El topiramato puede hacer que los pacientes con hipersen­ sibilidad a la sustancia presenten un cuadro grave de glaucoma agudo bilateral, por edema del cuerpo ciliar y cierre angular secundario. El cuadro suele producirse en el transcurso de las primeras 2 semanas de tratamiento y revierte en 24-48 horas tras la suspensión del fármaco, pero con mala respuesta al ­tratamiento. La endoftalmitis es una inflamación ocular, generalmente de origen infeccioso, que cursa con dolor. Es más probable si existe un antecedente próximo de cirugía intraocular o de traumatismo ocular penetrante, ya que entonces existe una puerta de entrada para los gérmenes que la originarían. La uveítis es un proceso inflamatorio de origen inmunitario o infeccioso de la úvea. Puede ser anterior, afectando al iris y al cuerpo ciliar; intermedia, cuando afecta al vítreo y a la retina periférica; posterior, cuando afecta a la retina, a la coroides y a los vasos retinianos, o panuveítis, cuando se ven afectadas varias estructuras. Los síntomas más frecuentes son: pérdida de visión de aparición más o menos lenta con ojo rojo y dolor, fotofobia, cuerpos flotantes o escotomas. El desprendimiento de retina es una causa de pérdida de visión, pero el curso de la misma es indoloro; por tanto, la ­respuesta falsa es la b. 4. En cuanto a las oclusiones venosas retinianas: a. La pérdida de visión progresa en unos días b. Se dividen en oclusiones de la vena central o de rama venosa c. El descenso visual es muy variable d. La hipertensión arterial es el principal factor de riesgo e.Todas son correctas Correcta: e. Las oclusiones venosas son episodios de pérdida de visión en general rápidamente progresiva, aunque los sínto­ mas pueden evolucionar durante unos días. El principal factor de riesgo es la hipertensión arterial y se trata de la segunda causa vascular de pérdida de visión tras la retinopatía diabética. Puede afectar a la vena central de la retina o a una rama venosa y la afectación ocular puede variar desde contar dedos hasta 10/10 y referirse como visión de sombras. Habitualmente se observan hemorragias retinianas más o menos extensas y exudados algodonosos, junto con ingurgitación venosa y, en ocasiones, edema de papila. 5.Las neuropatías ópticas se caracterizan por: a. Pueden o no acompañarse de dolor, y si aparece éste suele acompañar a los movimientos oculares b. Las de etiología isquémica arterítica no tienen riesgo de bilateralidad c. La edad de los pacientes con neuropatías ópticas no isquémicas es mayor que la de los que presentan una neuropatía óptica isquémica e-229 e-230 pa r t e 1 0 : C A P Í T U L O S E X T R A d. Los corticoides a altas dosis no sirven para tratar la pér­ dida visual en las neuropatías ópticas no isquémicas e.Todas son correctas Correcta: a. La expresión neuropatía óptica hace referencia a una lesión o pérdida de funcionalidad en el nervio óptico que puede estar originada por múltiples causas y ocasiona, en general, pérdida de visión y déficit en el campo visual. Entre éstas es importante diferenciar las de tipo isquémico, que son indo­ loras, y las inflamatorias, que por lo general cursan con dolor acompañando a los movimientos oculares. Hay otras muchas causas, como compresivas, tóxicas, metabólicas, congénitas, etc., que por lo general son también indoloras. La neuropatía isquémica arterítica está causada por una enfermedad de base, generalmente la arteritis de células gigantes o de la temporal, que cursa con una inflamación de los vasos sanguíneos, que afecta a las arterias de mediano y gran tamaño, principalmente las arterias supraaórticas, con predilec­ ción por ramas de la carótida externa, en especial a la arteria temporal, que puede afectar, por tanto, al flujo del ojo contrala­ teral y bilateralizar el cuadro. Es importante hacer el diagnóstico de esta enfermedad lo antes posible y comenzar el tratamiento para evitar que se produzca un agravamiento del cuadro o una bilateralización. En la neuropatía de tipo inflamatorio, la edad suele estar comprendida entre 18 y 45 años. Se pueden encontrar antece­ dentes de enfermedades virales, o ser parte o inicio de una enfermedad neurológica como la esclerosis múltiple. Las neu­ ropatías ópticas isquémicas suelen ser de aparición brusca y el paciente presenta antecedentes de hipertensión arterial u otros factores de riesgo cardiovascular, por tanto, es más habitual encontrarla en pacientes de mayor edad. En las neuropatías ópticas de tipo inflamatorio, los corticoi­ des tienen un papel importante en la recuperación visual. La respuesta correcta, por tanto, es la a. E 2 | Pé rd i d a d e a g ud ez a v i sual Temas de trabajo E2 © Elsevier. Fotocopiar sin autorización es un delito. 1. Enumerar y razonar cinco causas por las que un paciente con pérdida de agudeza visual debe ser remitido de forma urgente a un oftalmólogo 2. Elaborar un informe con los puntos que deben recogerse en una historia clínica orientada al diagnóstico diferencial de las pérdidas de agudeza visual. e-231 Epidemiología de las enfermedades oculares Objetivos de aprendizaje ● Diferenciar los conceptos de «baja visión» y «ceguera legal». ● Conocer las principales causas de ceguera en el mundo y la evolución que éstas están sufriendo en los últimos tiempos. ● Tener presentes las diferentes iniciativas que, a nivel mundial, se están tomando para eliminar la «ceguera evitable», y las dificultades para aplicar dichos programas en los países del Tercer Mundo. e3 revisión (CIE-10), una persona con baja visión es aquella que posee una agudeza visual central reducida (inferior a 0,3 pero igual o mejor a 0,05) o un campo visual inferior a 20° del punto de fijación, en el mejor ojo y con la mejor corrección óptica posible. La baja visión se considera leve cuando la agudeza visual se sitúa entre 0,3 y 0,1, y grave cuando está entre 0,1 y 0,05 (1,2). Estas personas muestran una función visual deficiente para algunas tareas (como conducir un vehículo, leer el periódico, etc.), pero son potencialmente capaces de utilizar la visión residual (a veces con ayudas ópticas como lupas o telescopios) con propósitos funcionales, pudiendo ejecutar otras tareas (como estudiar, desplazarse de manera autónoma, etc.). Ceguera Legal Palabras clave/Key words Ceguera legal Baja visión Epidemiología Enfermedades oculares Prevención Legal blindness Low vision Epidemiology Ocular diseases Prevention Concepto De Epidemiología La epidemiología es la ciencia que estudia la frecuencia de las enfermedades en las poblaciones humanas, así como los factores que rigen su expansión y gravedad. Se encuentra estrechamente relacionada con la medicina preventiva, contribuyendo a la evaluación de medidas o campañas cuyo objetivo es la promoción de la salud. Definición De Baja Visión Y Ceguera Baja Visión La «baja visión» no es un concepto absoluto, pues depende de las necesidades visuales de cada persona. Aunque no existe una definición universalmente aceptada, según los criterios de la Organización Mundial de la Salud (OMS) en su Clasificación Internacional de Enfermedades, décima © 2012. Elsevier España, S.L. Reservados todos los derechos De acuerdo con la OMS, la ceguera legal se define como la agudeza visual inferior a 0,05 o el campo visual menor de 10° del punto de fijación, en el mejor ojo y con la mejor corrección óptica posible. En España se incluyen aquellos pacientes que presentan en su mejor ojo una agudeza visual con la mejor corrección óptica inferior a 0,1, o que independientemente de que su visión sea mejor, muestran un campo visual inferior a 10°. El concepto de ceguera legal va ligado a exenciones fiscales o a ayudas sociales, y no implica que el individuo sea funcionalmente ciego. De hecho, se considera que menos del 10% de los ciegos legales son funcionalmente ciegos (percepción sólo de luz) o totalmente ciegos (amaurosis). Causas De Ceguera En El Mundo Según la OMS, en el año 2008 eran 314 millones de personas (el 5% de la población mundial) las que presentaban alguna discapacidad visual debida a enfermedades oculares o a errores de refracción no corregidos. De ellas, 45 millones estaban ciegas (0,7%). Se estima que para el año 2020 habrá 76 millones de ciegos en el mundo. La distribución de las personas con deficiencia visual grave no es homogénea, siendo más del 80% de ellas mayores de 50 años, y encontrándose más del 90% de los casos en países con bajos ingresos. En la Figura e3.1 se expone la distribución de la ceguera por continentes. Respecto a la etiología de la ceguera, las enfermedades oculares responsables de ella son las siguientes: las cataratas (39%), los errores de refracción no corregidos (18%), el glaucoma (10%), la degeneración e-232 E 3 | E pi d e mi o l o gí a d e l a s e n fe r me d ad es oc ulares © Elsevier. Fotocopiar sin autorización es un delito. Figura e3.1. Distribución de la ceguera en el mundo. macular asociada a la edad (DMAE) (7%), la retinopatía diabética (4%), el tracoma (3%), las afecciones oculares infantiles (3%) y la oncocercosis (0,7%) (Figura e3.2). Hasta un 80% de estas cegueras podrían evitarse. Debido a la magnitud del problema, en 1999 se estableció la iniciativa mundial «VISION 20/20: the right to sight», una alianza entre la OMS y el Organismo Internacional de Prevención de la Ceguera, con el objetivo de eliminar la ceguera evitable. Esta iniciativa está basada en los principios de «colaboración» o necesidad de aunar esfuerzos y trabajo de gobiernos, organismos internacionales, sector privado, personal sanitario y organizaciones no gubernamentales (ONG) y de «compromiso» en dicho trabajo de las comunidades receptoras de estos recursos. La mejora de las políticas sanitarias y la creación de programas para definir prioridades y asignar recursos están logrando resultados esperanzadores en este campo. Muy diferentes son las causas de ceguera en los países desarrollados. En éstos, en los niños predominan las anomalías congénitas (cataratas congénitas, retinopatía de la prematuridad, atrofias ópticas, albinismo y distrofias de conos y bastones). En la edad escolar el 60% de las cegueras se deberían igualmente a anomalías congénitas, un 15% a alteraciones neurológicas y un 10% a distrofias y de­ generaciones. En los adultos de edades comprendidas entre 20 y 50 años, el 50% de las cegueras son secundarias a distrofias y degeneraciones, incluyendo la miopía patológica. En la franja de 50 a 70 años, las cataratas, el glaucoma, la diabetes y la miopía son responsables a partes iguales del 60% de las cegueras. Por encima de los 70 años, las cataratas y la DMAE suponen un 30% cada una, el glaucoma un 15%, mientras que a la diabetes, a la miopía y a las enfermedades cardiovasculares les correspondería un 5% a cada una. Estamos asistiendo, especialmente en los países desarrollados, a un incremento de las discapacidades visuales, atribuible al progresivo aumento de la esperanza de vida y al consiguiente envejecimiento poblacional. Además, aquellas enfermedades oftalmológicas que afectan a personas mayores, tales como el glaucoma, la DMAE o la retinopatía diabética, precisan tratamientos prolongados en el tiempo, lo que supone un gran coste económico y una mayor dificultad en el cumplimiento terapéutico. Las principales enfermedades que deben tratarse, según la OMS, para lograr los objetivos del programa «VISION 2020: The right to sight» son: cataratas, tracoma, oncocercosis, ceguera en la infancia, errores refractivos y baja visión, retinopatía diabética, glaucoma, DMAE, opacidades corneales y enfermedades genéticas oculares. No obstante, la OMS considera como más prioritarias las cinco primeras patologías, y sólo cuando éstas dejen de ser un problema para la salud pública se dedicarán recursos a las demás enfermedades oculares. A continuación, haremos algunos comentarios sobre las cinco enfermedades diana en la erradicación de la ceguera. Cataratas Figura e3.2. Etiología de la ceguera en el mundo. La opacificación del cristalino que impide el paso de la luz constituye la primera causa de ceguera curable en el mundo, es responsable del 48% de las cegueras, y hay 18 millones de personas ciegas por cataratas bilaterales. El único tratamiento definitivo es su extracción quirúrgica; lo ideal es colocar una lente intraocular en el mismo procedimiento (Figura e3.3). e-233 e-234 p arte 1 0 : C A P Í T U L O S E X T R A Figura e3.3. Las cataratas son la primera causa de ceguera previsible en los países del Tercer Mundo. Figura e3.5. La ceguera infantil es un problema de primer orden en los países subdesarrollados. Tracoma Ceguera Infantil Es una enfermedad endémica en muchos países africanos causada por Chlamydia trachomatis, bacteria que se contagia por transmisión directa por moscas y que provoca conjuntivitis folicular de repetición. En sus estadios avanzados ocasiona una retracción cicatricial del párpado, que se vuelve hacia dentro, con el consiguiente roce de las pestañas sobre la córnea, lo que produce la opacificación de ésta (Figura e3.4). Se cifra en 400.000 el número de afectados por debajo de los 16 años. Precisan de estrategias específicas, pues un retraso en su tratamiento puede provocar ambliopía. Las causas de ceguera infantil son distintas a las de la edad adulta y varían de forma amplia de una zona geográfica a otra. Mientras que en los países pobres las causas más frecuentes son la xeroftalmía (por deficiencia de vitamina A), opacidades corneales por sarampión, uso nocivo de remedios tradicionales, ophthalmia neonatorum, catarata rubeólica, etc., en los países más desarrollados predominan las anomalías congénitas (cataratas congénitas, retinopatía de la prematuridad, atrofias ópticas, albinismo y distrofias de conos y bastones) (Figura e3.5). Oncocercosis (Ceguera De Los Ríos) Es responsable de medio millón de ciegos y se trata de una enfermedad parasitaria causada por Onchocerca volvolus, una microfilaria transmitida por la mosca negra. Provoca opacificación corneal, uveítis anterior, coriorretinitis y neuritis óptica. Las actuaciones preventivas en esta enfermedad endémica persiguen la eliminación del vector y el tratamiento del parásito con ivermectina. La enfermedad está extendida principalmente en el África Occidental y Central y, en menor medida, en el Oriente Medio y el continente americano. En el mapa de la Figura e3.6 se ex­ ponen las zonas en las que la ceguera de los ríos es endémica. Defectos De Refracción Figura e3.4. Paciente intervenida de triquiasis secundaria a tracoma. Las ametropías (miopía, hipermetropía y astigmatismo) graves son responsables de baja visión en 124 millones de personas y causan ceguera a otros 5 millones de individuos. Las estrategias de lucha contra esta patología incluyen la corrección de errores refractivos con gafas o lentes de contacto, así como ayudas para los pacientes con baja visión. La corrección de los errores de refracción podría devolver una visión normal a más de 12 millones de niños de 5 a 15 años. Los resultados obtenidos en diferentes E 3 | E pi d e mi o l o gí a d e l a s e n fe r me d ad es oc ulares considera tan sólo la séptima patología prioritaria que debe tratarse. Ello se debe a su mayor prevalencia en personas mayores y al elevado coste que supone la dificultad para realizar el diagnóstico precoz, la ausencia de medidas preventivas y la necesidad de seguimiento a largo plazo. Esta neuropatía óptica irreversible, cuyo factor de riesgo más importante es la presión intraocular elevada, presenta una prevalencia en adultos mayores de 40 años del 1,7% para la raza blanca y del 5,6% para la raza negra. Degeneración Macular Asociada A La Edad Figura e3.6. Distribución mundial de la oncocercosis (ceguera de los ríos). Algo similar sucede con la DMAE, enfermedad que afecta a la región central de la retina (mácula), que se manifiesta a partir de los 50 años y que es la principal causa de ceguera «legal» en los países desarrollados entre la población mayor de 65 años (Tabla e3.1). Es una enfermedad que presentan entre 25 y 30 millones de personas en todo el mundo, y se suman cada año alrededor de 500.000 nuevos casos. El envejecimiento de la población triplicará esta cifra en los próximos 25 años. Sólo en España existen más de 130.000 casos diagnosticados, aunque se presume que afecta a más de 300.000 personas y que más de 3.000.000 de españoles se encuentran en riesgo de llegar a presentarla. Se estima que esta enfermedad afecta a un 6,4% de las personas de 60 a 75 años y hasta a un 15-20% de las personas mayores de 75 años. El previsible incremento del número de casos por el envejecimiento de la población hace de la DMAE un problema sociosanitario con importantes repercusiones económicas y de organización asistencial (Figura e3.8). Retinopatía Diabética © Elsevier. Fotocopiar sin autorización es un delito. Figura e3.7. Fondo de ojo de un paciente afectado de miopía ­ egenerativa. d poblaciones muestran una gran variabilidad. En España la prevalencia de la hipermetropía (35,6%) se incrementa con la edad, pasando de un 36,9 (entre 3 y 8 años) a un 55,8% (entre 66 y 93 años). La miopía parece ser más prevalente en el grupo de edad de edades comprendidas entre 30 y 35 años (30,1%) (Figura e3.7). De todo lo anterior se deduce que, si consideramos las enfermedades oculares de acuerdo con su localización anatómica, la primera causa de ceguera sigue siendo la opacidad del cristalino (cataratas), seguida de la opacidad de la córnea (ya sea secundaria a tracoma, xeroftalmía, lepra, sarampión, etc.). Con la excepción de las cataratas, hemos visto que las patologías prioritarias de la OMS no siempre coinciden con las causas más frecuentes de ceguera. La retinopatía diabética se está convirtiendo en la primera causa de ceguera irreversible en el mundo occidental. De los 1.600.000 diabéticos que existen en España, se calcula que unos 160.000 pacientes presentan una retinopatía significativa y que de unos 40.000 a unos 50.000 desarrollarán en algún momento graves problemas de visión. El principal factor de riesgo en la aparición de la retinopatía Glaucoma Así, mientras que el glaucoma es la segunda causa de ceguera en el mundo (67 millones de personas afectadas, de las cuales más de 6 millones son ciegos), la OMS la Figura e3.8. Fondo de ojo de un paciente afectado de degeneración macular asociada a la edad (DMAE) de tipo atrófico. e-235 e-236 p arte 1 0 : C A P Í T U L O S E X T R A Tabla e3.1 Cifras estimadas de prevalencia e incidencia de la degeneración macular asociada a la edad (DMAE) Prevalencia Incidencia En el mundo 25.000.000 500.000 En España 750.000 9.000 diabética es la duración de la enfermedad. Así, en la diabetes tipo 1, el 50% de los pacientes presentan retinopatía a los 10 años de diagnosticada la enfermedad, mientras que a los 30 años se alcanza el 90%. Otros factores que deben tenerse en cuenta son el control metabólico y determinados factores de riesgo cardiovascular, como la presión arterial y los valores plasmáticos de triglicéridos y de colesterol. Un adecuado control de dichos factores por parte del médico de familia retrasará la aparición de las lesiones retinianas. La prevalencia de la diabetes, que afecta del 2 al 6% de nuestra población, está aumentando debido al envejecimiento poblacional y al incremento de la obesidad por los malos hábitos alimentarios y el modo de vida sedentario tan habitual hoy día (Figura e3.9). del continente africano cuentan con menos de un oftalmólogo por cada millón de habitantes. Además, los recursos humanos existentes suelen concentrarse en las aglomeraciones urbanas de mayor tamaño, lo que hace que en las zonas rurales los servicios sanitarios sean deficientes o incluso inexistentes. En los últimos años numerosos médicos españoles han tomado conciencia de este problema participando en acciones humanitarias en países del Tercer Mundo a través de organizaciones no gubernamentales (ONG). Los oftalmólogos no han sido menos y participan activamente en numerosas acciones en países del África Negra, Sáhara, Centroamérica y Sudamérica (Figuras e3.10 y e3.11). Además, también en España, y como consecuencia del incremento de la población de origen extranjero, nuestros médicos necesitan adaptarse a aquellas patologías procedentes de países lejanos que no son tan habituales o incluso se desconocían en nuestro país. Es el caso de las cataratas hipermaduras, de formas muy severas de retinopatía diabética proliferativa con desprendimiento de retina traccional Prevenir La Ceguera Como Problema De Salud Mundial En el mundo, los datos de los que disponemos señalan que la ceguera evitable provocada por enfermedades transmisibles como tracoma, oncocercosis y las complicaciones oftálmicas ocasionadas por el sarampión está disminuyendo, mientras que las afecciones oculares crónicas ligadas a la edad (catarata, glaucoma y retinopatía diabética) siguen aumentando. Pese a los esfuerzos por fortalecer los recursos humanos destinados a mejorar la salud ocular, los países con bajos ingresos continúan aquejando un importantísimo déficit de personal de atención oftálmica. Así, numerosos países Figura e3.9. Fondo de ojo en el que se observa una retinopatía diabética no proliferativa con edema macular. Figura e3.10. Oftalmólogo de la Fundación Ilumináfrica explorando a una paciente en el hospital de Dono Manga (República de Chad). Figura e3.11. Cirujanos de la Fundación Ilumináfrica operando lesiones tracomatosas (izquierda) y cataratas (derecha) en un quirófano ­compartido. E 3 | E pi d e mi o l o gí a d e l a s e n fe r me d ad es oc ulares ción no corregidos (18%), el glaucoma (10%), la degeneración macular asociada a la edad (DMAE) (7%), la retinopatía diabética (4%), el tracoma (3%), las afecciones oculares infantiles (3%) y la oncocercosis (0,7%). – Las enfermedades que la OMS considera prioritarias para lograr erradicar la «ceguera evitable» son: cataratas, tracoma, oncocercosis, ceguera en la infancia y errores refractivos. Los principales problemas son el dé­ ficit de personal y la mala distribución de los recur­ sos sanitarios. Agradecimientos Figura e3.12. Doble pterigión en una paciente procedente de Ecuador. o del pterigión en fases muy avanzadas que tras ser extirpado requiere un injerto de membrana amniótica (Figura e3.12). Lo mismo sucede con la oncocercosis, una patología originaria de África que en España no se registraba desde hace años y que ha reaparecido con el incremento de personas provenientes del continente africano. Conclusiones © Elsevier. Fotocopiar sin autorización es un delito. – La ceguera legal se define como la agudeza visual inferior a 0,05 o el campo visual menor de 10° del punto de fijación, en el mejor ojo y con la mejor corrección óptica posible. Una persona con baja visión es aquella que posee una agudeza visual central reducida (inferior a 0,3 pero igual o mejor a 0,05) o un campo visual inferior a 20° del punto de fijación, en el mejor ojo y con la mejor corrección óptica posible. – Las enfermedades oculares responsables de la ceguera en el mundo son: las cataratas (39%), los errores de refrac- Nuestro agradecimiento a los miembros de la Fundación Ilumináfrica, que gustosamente nos han cedido algunas de las fotografías que ilustran el presente capítulo. Bibliografía Apple DJ, Ram J, Foster A, Peng Q. Overcoming cataract blindness: A goal for the new millennium. Surv Ophthalmol 2000;45:S5-6. Arias L. Epidemiología, etiopatogenia y factores de riesgo de la DMAE. Jano 2003;64:308-10. Fernández-Vigo J, Macarro A, Perianes JF. Epidemiología de la retinopatía diabética. Madrid: Luzán 5, S. A. de Ediciones, 1996. Instituto Nacional de Estadística. Encuesta sobre discapacidades, deficiencias y estado de salud. Madrid: INE, 1999. Johnson GJ, Minassian DC, Weale RA, West SK. The Epidemiology of eye disease. (Second edition). London: Arnold Hodder Headline Group, 2003. Martínez Puente A. Definición de baja visión. En: Solans T, García Sánchez J, Cárceles JA et al. (eds.). Refracción ocular y baja visión. LXXIX Ponencia Oficial de la Sociedad Española de Oftalmología. Madrid: Sociedad Española de Oftalmología, 2003. p. 259-61. OMS. Prevención de la ceguera y la discapacidad visual evitables. 124.ª Reunión del Consejo Ejecutivo. EB124/7, 11 de diciembre de 2008. Schwab L, Taylor HR, Nauze JL. Cataract and delivery of surgical services in developing nations. En: Duanes's Clinical Ophthalmology. Philadelphia: Lippincott Williams & Wilkins, 2001. p. 57. e-237 e-238 p arte 1 0 : C A P Í T U L O S E X T R A Autoevaluación E3 1Según la OMS, el concepto de «ceguera legal»: a. Incluye a aquellos pacientes con una agudeza visual inferior a 0,05 en el mejor ojo y con la mejor corrección óptica posible. b. Incluye a aquellos pacientes con un campo visual menor de 10° del punto de fijación en el mejor ojo y con la mejor corrección óptica posible. c. No implica que el individuo sea funcionalmente ciego. d. Todas las anteriores son correctas. e. Todas las anteriores son falsas. Correcta: d. De acuerdo con la OMS, la «ceguera legal» se define como la agudeza visual inferior a 0,05 o el campo visual menor de 10° del punto de fijación, en el mejor ojo y con la mejor corrección óptica posible. El concepto de ceguera legal no implica que el individuo sea funcionalmente ciego. De hecho, se considera que menos del 10% de los ciegos legales son funcionalmente ciegos (percepción sólo de luz) o totalmente ciegos (amaurosis). 2Señale la respuesta falsa entre los siguientes datos publicados por la OMS: a. El 5% de la población mundial presenta alguna discapacidad visual. b. En 2008 había 45 millones de personas ciegas en el mundo. c. Más del 90% de las personas ciegas viven en países con bajos ingresos. d. Más del 80% de los ciegos del mundo son menores de 50 años. e. Se estima que para el año 2020 habrá 76 millones de ciegos en el mundo. Correcta: d. La distribución de las personas con deficiencia visual grave no es homogénea, y más del 80% de ellas son mayores de 50 años. 3Respecto a la etiología de la ceguera en el mundo: a. La principal causa de ceguera en el mundo son las cataratas. b. En los niños, la principal causa de ceguera son las anomalías congénitas. c. El 80% de las cegueras sería evitable. d. Todas las respuestas son falsas. e. Todas las respuestas son correctas. Correcta: e. Las cataratas son la principal causa de ceguera en el mundo, y provocan el 39% de los casos. Las anomalías congénitas constituyen la principal causa de ceguera infantil. El 80% de las cegueras sería evitable con las adecuadas medidas profilácticas y terapéuticas. 4Para erradicar la denominada «ceguera evitable», la OMS considera prioritarias todas las enfermedades siguientes excepto: a. Cataratas. b. Degeneración macular asociada a la edad (DMAE). c. Tracoma. d. Oncocercosis. e. Defectos de refracción. Correcta: b. La DMAE no se encuentra entre las enfermedades prioritarias de la OMS para lograr erradicar la «ceguera evitable». Éstas son cinco: cataratas, tracoma, oncocercosis, ceguera infantil y defectos de refracción. 5 ¿Cuál de las siguientes afirmaciones es falsa? a. El principal factor de riesgo en la aparición de la retinopatía diabética es el mal control metabólico de la enfermedad. b. La ceguera de los ríos es producida por una microfilaria. c. El tracoma se debe a un microorganismo del género Chlamydia. d. El tratamiento de elección de la oncocercosis es la ­ivermectina. e. El glaucoma presenta una mayor prevalencia en la raza negra. Correcta: a. El principal factor de riesgo en la aparición de la retinopatía diabética es la duración de la enfermedad. E 3 | E pi d e mi o l o gí a d e l a s e n fe r me d ad es oc ulares Temas de trabajo E3 © Elsevier. Fotocopiar sin autorización es un delito. 1. Ceguera legal en España. Prestación de servicios sociales. Papel de la ONCE. 2. Elaborar un informe con los cambios que el fenómeno de la inmigración ha provocado en la patología ­oftalmológica atendida en España en la última década. Medidas que deberíamos plantearnos para adaptarnos a la nueva situación. e-239 La visión del color y sus anomalías Objetivos de aprendizaje ● Conocer los mecanismos fisiológicos que posibilitan al ser humano la visión del color, sus anomalías congénitas y adquiridas. ● Conocer los procedimientos de examen que se utilizan para su valoración. Palabras clave/Key words Visión del color Discromatopsia Protanopía Deuteranopía Daltonismo Color vision Dyschromatopsia Protanopia Deuteranopia Color blindness El Estímulo Cromático Afirmaba Bohr que «la radiación es la transmisión de energía entre cuerpos distantes entre sí». El sol, las estrellas y los planetas nos han proporcionado desde el principio del universo la energía necesaria para la aparición y el desarrollo de la vida en nuestro planeta. La función visual de los seres vivos depende de una forma particular la interacción entre esta radiación luminosa, los objetos que nos rodean y las estructuras de nuestro ojo. La radiación procedente del sol, de la madera de una antorcha o del filamento de una lámpara de incandescencia se escapa de la materia que la genera, viaja por el espacio sin pérdidas y, cuando tropieza en su trayectoria con átomos o molé­ culas de una determinada sustancia, podrá producir en ella cambios energéticos o estructurales específicos; ocurrirán ciertas interacciones mutuas, y la radiación podrá sufrir, fundamentalmente, tres tipos de alteración: podrá absor­ berse, podrá reflejarse o podrá refractarse. La reflexión, la refracción y otros fenómenos como la difusión producen cambios en la dirección de la luz sin alteración de la materia, mientras que la absorción produce modificaciones en aquélla que dan lugar al fenómeno fotoeléctrico con liberación de electrones, al aumento de la © 2012. Elsevier España, S.L. Reservados todos los derechos e4 temperatura o a transformaciones fotoquímicas como la fotosíntesis o los procesos que conducen a la visión. Final­ mente, puede ocurrir una reemisión de la energía, como es el caso de los fenómenos de fluorescencia y fosforescencia, o la radiación estimulada que produce el láser. El ojo humano se ha especializado en la captación de una parte de las radiaciones luminosas emitidas por el sol: aquellas cuya longitud de onda está comprendida entre los 400 y los 700 nanómetros o milimicras. Las razones filogenéticas de este hecho no están claras, aunque puede que haya influido el origen acuático de la vida, de manera que podría haberse producido una adaptación a estas radiaciones, cuya pene­ tración es preferente en este medio. No todas las fuentes luminosas poseen idéntica com­ posición espectral. Si por motivos de síntesis nos limitamos a las fuentes que emiten de forma continua en el espectro, podemos establecer que su composición depende funda­ mentalmente de la temperatura del emisor (temperatura de color). La emisión de radiaciones de larga longitud de onda se realiza a temperaturas relativamente bajas (p. ej., hierro al rojo), mientras que las radiaciones del extremo opuesto del espectro (azul) necesitan temperaturas mucho más elevadas (Figura e4.1). Generalmente la luz estimula el ojo después de interac­ tuar con la materia, de manera que éste recibe un informe de la luz que no ha absorbido aquélla. Como las fuentes luminosas poseen una variada composición espectral, el informe que recibe el ojo del mundo que le rodea no será constante, sino que irá variando a medida que nos despla­ cemos por ambientes de iluminación diferente. Sin embargo, como veremos más adelante, nuestras estructuras retinianas y cerebrales han conseguido un procedimiento para estabi­ lizar estas diferencias. Mientras que el profesional de la fotografía clásica tenía que utilizar películas diferentes si trabajaba con luz artificial o natural, el ojo humano se adapta y consigue una aparente identidad en la percepción del color. Esta «constancia del color» ha sido uno de los fenómenos más difíciles de explicar por los fisiólogos oculares. Los Pigmentos Visuales: La Teoría Tricromática En 1802, Thomas Young enunció un principio según el cual cualquier sensación cromática puede obtenerse a partir de tres colores fundamentales o primarios. La idea de que las e-240 E 4 | L a v i s i ó n d e l co l o r y sus anomalí as Figura e4.1. La «temperatura de color» define la composición espectral de la luz emitida. En una luz de tungsteno predomina el componente rojo, por su baja temperatura. En la luz solar se incrementa el componente azulado al ser mayor su temperatura (5.500 °K). © Elsevier. Fotocopiar sin autorización es un delito. células receptoras de la retina eran de tres tipos diferentes alcanzó más amplia difusión con Von Helmholtz (1856). Por ello, la teoría tricromática de la visión del color es conocida como «teoría de Young-Helmholtz» (Figura e4.2). En 1870, Küne demostró que el pigmento visual aislado de retinas de rana era blanqueado por la luz y se recuperaba en la oscuridad. De esta manera se comenzó a comprender que la descomposición de determinados pigmentos situados en los fotorreceptores sería el mecanismo que daría comienzo al mensaje visual. En 1952, Rushton, en la Universidad de Cambridge, y sólo con un año de diferencia Weale, en el Instituto de Oftalmología de Londres, pusieron a punto, de forma independiente, dos equipos capaces de medir los cambios en la absorción de los fotopigmentos. Los estudios inicia­ les de Rushton y Weale estaban dirigidos a medir los pig­ mentos de los bastones del ojo de gato, es decir, de la rodopsina. El estudio de los pigmentos de los conos se presentaba más difícil: su concentración es más baja que Figura e4.2. La mezcla de los tres colores primarios, en igual proporción, produce el blanco y en proporciones desiguales el resto de los colores. la de los bastones y, además, se suponía la existencia de tres tipos diferentes, con la consiguiente dificultad para separar sus espectros de absorción. Rushton simplificó el proble­ ma utilizando a pacientes con sólo dos tipos de conos (di­ crómatas). Al carecer estos sujetos de uno de los tipos de pigmento de conos, la posible confusión debida a la superposición de los espectros de absorción de los conos quedaba minimizada. Brindey y Rushton midieron en 1959 la reflectancia de fóveas de sujetos normales y de pacientes con defectos para el rojo, observando que en estos últimos se absorbía pre­ ferentemente el verde de 530-540 nm. Supusieron, en consecuencia, que en la fóvea de estos sujetos no existían receptores para el rojo, sino exclusivamente para el verde, bautizando a su pigmento con el nombre de «clorolabe». Entre 1958 y 1962, Rushton, y en 1962, Ripps, realizaron una serie de trabajos similares en sujetos con defecto para el verde, encontrando un pigmento cuyas preferencias de absorción se habían desplazado hacia longitudes de onda más largas, concretamente hacia los 560-590 nm, que denominaron «eritrolabe». Más discutible ha sido la com­ probación, por espectrofotometría de un pigmento para el azul, que algunos autores han podido demostrar por otros métodos. Las dificultades de su medición vendrían dadas por ser menos abundante y por quedar enmascarado por la absorción en el azul de la rodopsina y del pigmento macu­ lar. Su máximo de absorción se situaría hacia los 430-440 nm, por lo que ha sido denominado «cianolabe». Las curvas de absorción de los pigmentos, determinadas por este método, indican una menor absorción en el azul y violeta que la real. Esto se debe a que la llegada de estas radiaciones al cono está reducida por la absorción de la córnea, el cristalino y el pigmento xantofílico macular (Figura e4.3). Jeremy Nathans (1986) identificó los genes que deter­ minan los pigmentos de los conos deduciendo las secuen­ cias de los aminoácidos de las proteínas. Confirmó que los genes para el rojo y el verde se encontraban en el cro­ mosoma X, y que el de los conos para azul residía en el cromosoma 7. Supuso entonces que todos los pigmentos proceden de un ancestro común, el cual dio lugar, por un lado, a la rodopsina de los bastones y al pigmento de los Figura e4.3. Curvas de absorción de los conos. Se observa que los tres son estimulados por todo el espectro visible pero cada uno de ellos, de forma preferente, por radiaciones de longitud de onda corta (azul), media (verde) o larga (rojo). e-241 e-242 pa r t e 1 0 : C A P Í T U L O S E X T R A conos para azul, y, por otro, a un pigmento sensible a la radiación rojo-verde que sufrió una duplicación reciente (en términos evolutivos) en dos pigmentos. Apoya este argumento el hecho de que el 98% del ADN de ambos sea idéntico, y también el que los monos de América del Sur tengan un solo gen en el cromosoma X, mientras que los monos africanos, más próximos al hombre, tengan dos (G.H. Jacobs), de manera que esta duplicación de genes debió ocurrir hace 30 o 40 millones de años. En los conos, como en los bastones, la transformación de los fotones en señal bioeléctrica se hace mediante una hiperpolarización de la membrana celular. La transforma­ ción del retineno 11-cis del pigmento visual en su forma isomérica trans lo libera de su respectiva proteína, especí­ fica para cada uno de los tres tipos de pigmento. La proteína en estas condiciones rompe las moléculas de GMP cíclico que, situadas sobre la membrana celular, mantenían abiertos los poros que posibilitan la entrada de sodio, quedando ésta bloqueada. Cada bastón contiene unos 100 mi­ llones de moléculas de rodopsina. Un fotón capaz de des­ componer una molécula de pigmento provoca la rotura de cientos de moléculas de GMP cíclico y, en consecuencia, bloquea la penetración de un millón de iones Na+. La corriente eléctrica resultante es proporcional a la intensidad del estímulo luminoso y se difunde libremente en la sina­ psis por las llamadas «uniones intercelulares eléctricas “en hendidura”», contribuyendo a la confluencia de la infor­ mación de grupos de bastones contiguos. En los conos la respuesta eléctrica a un fotón es 100 ve­ ces más baja, pero sin embargo más rápida, y su intensi­ dad, para cada familia de conos, depende de la longitud de onda del estímulo. Teoría De Hering Algunos fenómenos visuales son difícilmente explicables por la teoría tricromática de la visión. Por ejemplo: después de un estímulo rojo persistente, la observación de una superficie blanca provoca la percepción de una postimagen del color complementario, el verde. Los cirujanos hemos adoptado el verde en el ambiente quirúrgico como defensa de estas incómodas postimágenes, después de observar un campo rojo e intensamente iluminado. Por otra parte, en los contornos de una imagen coloreada que se muestra sobre fondo blanco tiende a observarse el color comple­ mentario. Este fenómeno fisiológico ha sido utilizado para la inducción hipnótica, empleándose para provocar una sugestión como argumento falsamente «paranormal» (Figura e4.4). Figura e4.4. Si se observa, con luz intensa y durante algún tiempo, el centro del círculo rojo de la izquierda y a continuación se mira el centro de la imagen blanca derecha, se observará una postimagen de color verde azulado. Figura e4.5. La teoría de Hering: tres sistemas diferentes informarían de la proporción de azul y amarillo, rojo y verde y luminancia global respecto al entorno de la imagen. Ewald Hering (1834-1918), basándose en la naturaleza complementaria del azul frente al amarillo y del rojo frente al verde, así como en el contraste entre el blanco y el negro, elaboró en 1876 una teoría según la cual estas sensaciones contrarias serían elaboradas por el mismo sistema anatómico. La sensación de blanco/negro no se produciría especialmente por la cantidad de luz que llega al ojo, sino por comparación con las luminancias del entorno (Figura e4.5). La teoría ha sido complementada por autores posterio­ res, relacionándose con la comprobación de la existencia de los fotopigmentos, de manera que la degradación del pigmento daría lugar a una percepción cromática y su recombinación a la del color complementario. También ha sido ampliada, en los últimos años, en relación con las investigaciones sobre los fenómenos de influencia lateral entre los fotorreceptores retinianos, y los campos recepti­ vos con actividad oponente para el color, que estudiaremos más adelante. Por lo tanto, esta teoría no resulta contra­ dictoria con la tricromática, como se había pensado. La primera explica el funcionamiento de los fotorreceptores y la segunda el de la vía óptica. Teoría Retinex Edwing Land, creador de la película fotográfica Polaroid, expuso en 1959 una experiencia fotográfica sorprendente: si se realizan dos fotografías de una escena policromática con una película positiva en blanco y negro, a través de dos filtros de color, y las imágenes resultantes se proyectan superpuestas, interponiendo los mismos filtros, se obten­ drá una imagen que reproduce los colores originales. Pos­ teriormente Land ha ido desarrollando nuevas experiencias que compaginan los conocimientos relativos a los recep­ tores retinianos con los fenómenos de contraste, e incluso explican la «constancia para el color», es decir, la relativa independencia de la sensación respecto a la composición espectral de la iluminación. Land ilumina un cuadro compuesto de rectángulos de colores (como los que pintaba Mondrian) con tres proyec­ tores monocromáticos y estudia la luz reflejada por cada parte del cuadro, mediante otros tantos fotómetros mono­ cromáticos. Observa que, aunque se modifiquen las can­ tidades de luz de cada fuente luminosa de color primario que ilumina la escena, la percepción global del cuadro E 4 | L a v i s i ó n d e l co l o r y sus anomalí as Figura e4.6. Teoría Retinex de Edwind Land: la temperatura de color de la iluminación influye poco en la percepción de una imagen policromática (izquierda). En cualquiera de los casos, el código de grises que percibe la retina es porcentualmente constante para cada uno de los tres canales de percepción, rojo, verde y azul (derecha). © Elsevier. Fotocopiar sin autorización es un delito. permanece constante. Por lo tanto, la percepción de cada color no depende de la composición espectral de la luz que devuelve cada superficie hacia el ojo. La teoría «Retinex» contemplaría, en su conjunto, los fenómenos que ocurren en la retina y el cerebro para dar lugar a la visión del color: existirían tres retinas, una para cada color primario, es decir, para cada tipo de fotorreceptor. Cada una de ellas contemplaría una escena en blanco y negro, con diferentes grados de intensidad para cada una de sus partes, que no variaría con la intensidad de iluminación. Para la sensación final lo importante no será la intensidad global de cada una de las tres sensaciones, ni la de cada zona de la imagen en particular, sino las luminancias relativas de cada zona con respecto a las adyacentes, en cada una de las tres vías del color, aunque estas influencias se reducirían con la distancia. La integración cortical de estas tres imágenes conducirá a la percepción policromá­ tica. Una condición necesaria es que la iluminación sea policromática, aunque no uniforme, es decir que, en mayor o menor medida, se estimulen las tres familias de conos (Figura e4.6). Es una evidencia demostrada que estos fenómenos no se desarrollan en la retina sino en las vías ópticas, y que no son una adquisición filogenética reciente, puesto que David Ingle demostró en 1985 que la constancia para el color existe en la visión de los peces. La Elaboración Retiniana Y Cortical La elaboración de la información procedente de los foto­ rreceptores no es una función exclusiva del cerebro; comienza a efectuarse en la primera sinapsis entre estas células y las bipolares, por mediación de las horizontales, y continúa en las células ganglionares y en el cuerpo geniculado externo. La información de 100 millones de bastones y 20 millo­ nes de conos ha de transmitirse hacia el cerebro por tan solo un millón de fibras nerviosas. Ello obliga a una elaboración y codificación de la imagen que se realiza en los diversos escalones celulares que conducen a la célula ganglionar. Una de estas modificaciones es la compresión de la respuesta, que siendo directamente proporcional al estímulo (lineal) en el fotorreceptor, se transforma en logarítmica para adaptarse a las necesidades del amplísimo rango luminoso de la naturaleza. El potencial eléctrico del receptor es pro­ porcional al estímulo luminoso, pero la célula ganglionar envía hacia el cerebro impulsos de idéntica intensidad y variables en frecuencia (potenciales de acción). Las células ganglionares están especializadas en la captación de la forma, el color, la orientación o el movimiento. Las células ganglionares grandes suman la información procedente de los conos y no parecen tener relación con el color, mientras que las pequeñas elaboran la informa­ ción cromática. Una célula ganglionar recibe información de un gran número de fotorreceptores que constituyen su campo receptivo, de manera que, por ejemplo, en el gato cada célula ganglionar recoge información de una superfi­ cie de campo visual de unos 0,3° de diámetro. Las respues­ tas a los colores complementarios pueden ser contrarias en estas células llamadas células oponentes, estructura que se repite en el cuerpo geniculado externo y en la corteza, donde incluso se observan células oponentes dobles, en las que los colores complementarios producen respuestas diferentes según se muestren en el centro o en la periferia del campo receptivo, lo que se relaciona también con la percepción del color complementario en los bordes de una imagen (Figura e4.7). La distribución de los sistemas retinianos de captación del color es desigual. Los receptores para rojo abundan en el centro y disminuyen rápidamente hacia la periferia, como puede demostrarse mediante campimetría estática cromática. La distribución de la sensibilidad al verde es más uniforme, siendo similar a la del blanco en ilumina­ ción mesópica (crepuscular), es decir, sin que exista un predominio de sensibilidad central. Para el azul existe una ceguera central, en un área de amplitud inferior a un grado (tritanopía foveolar). La agudeza visual será baja para este color a causa de una mayor confluencia espacial de la información. Da la impresión de que el cono para azul es un «eslabón intermedio» entre el cono y el bastón, lo cual e-243 e-244 pa r t e 1 0 : C A P Í T U L O S E X T R A Figura e4.7. Los campos receptivos de las células ganglionares, las células del cuerpo geniculado y las de la corteza visual poseen mecanismos de contraste al color, respondiendo de manera diferente en el centro y en la periferia. no está fuera de lógica, a la luz de los últimos estudios genéticos que hemos comentado. Incluso se ha defendido la participación de los bastones en la visión cromática en ambiente mesópico. Mientras que las diferentes células ganglionares están dispuestas de manera no regular en la retina, en el cuerpo geniculado externo pueden diferenciarse también dos tipos de células, grandes y pequeñas, situadas en capas diferen­ tes, denominadas magnocelular y parvocelular. El primer sistema sería más rápido, menos agudo y más sensible al contraste luminoso que el segundo. El magnosistema se proyecta sobre zonas más superficiales de la corteza visual primaria que el parvosistema. Uno de los mejores resúmenes de los conocimientos actuales en este tema ha sido realizado por Semir Zeki (1990), del University College de Londres. De su trabajo hemos extraído los comentarios siguientes: Livingstone y Hubel (1984) observaron que la corteza visual primaria (V1), de arquitectura anatómica aparentemente uniforme, no lo era desde el punto de vista funcional, presentando en las capas 2 y 3, zonas de intensa actividad metabólica («gotas») con respuesta selectiva a los colores, mientras que las zonas intermedias tenían un metabolismo más bajo y eran sensibles a la orientación y a la forma, y la capa 4 estaría relacionada con el movimiento. Las zonas inter­ medias entre las «gotas» de 2 y 3, recibirían información del parvosistema, la capa 4 del magnosistema y las «gotas» de ambos. Es decir, la actividad cerebral de las «gotas» responde a mecanismos centro-periferia con oponencia al color. Aparentemente contribuyen a la constancia del color por mecanismos cercanos a la teoría de Hering. Hoy día se cree que esta constancia depende de la actividad de tres «vectores» que definen cada punto de la imagen respecto al entorno. Uno de ellos representaría las diferencias rojo-verde, otro las diferencias azul-amarillo y el tercero las diferencias blanco-negro (Figura e4.8). El área cerebral V2, vecina de V1, está compuesta por estrías alternantes, de alta y baja actividad metabólica, Figura e4.8. Constancia para el color explicada por tres vectores: cada región de la imagen quedaría definida por una proporción azul/amarillo, una proporción rojo/verde y una proporción de luminancia respecto al entorno. E 4 | L a v i s i ó n d e l co l o r y sus anomalí as que se dividen en tres grupos. Unas tienen relación con la forma y el movimiento, otras con el color y las últimas, relacionadas con el magnosistema, con la estereopsis. A continuación de V2 se situarían las áreas V3, V4 y V5 que responden, respectivamente, a la orientación y a la dis­ tancia, es decir, a la forma (V3), al color y en menor medida también a la forma (V4) y finalmente al movi­ miento (V5). Las áreas V3, V4 y V5 envían una retroseñal a V1 y V2, donde es posible que de nuevo se reprocese esta información ya elaborada. También se emite infor­ mación hacia zonas de la corteza parietal y temporal, donde parece residir el área de la memoria. La lesión selectiva de ambas áreas V4 produce una acromatopsia cen­ tral y la lesión unilateral una hemiacromatopsia (Kol­ mel, 1988). El área del color es predominante en el hemisferio izquierdo y el área de la forma en el derecho. La forma despierta actividad más importante en el lóbulo temporal que el color, indicando posiblemente que participa de manera primordial en el reconocimiento de los objetos por parte de la memoria. El color no necesitaría aprendizaje y sólo habría que aprender a darle nombre. Sistemas De Representación Del Color El estudio de los colores se ve complicado por el hecho de que sus características físicas sean matizadas por nuestros sentidos. Una representación puramente física sería insuficiente, dado que lo que realmente importa en la práctica es «cómo lo vemos» y no «cómo es». Se han realizado numerosos intentos de compaginar ambos caracteres para establecer sistemas psicofisiológicos de clasificación del color. Mediante dos parámetros físicos (longitud de onda e intensidad luminosa), podemos definir una radiación monocromática y, añadiendo un tercero (pureza), las mez­ clas de colores espectrales. La interpretación sensorial de estas características físicas se define respectivamente como: © Elsevier. Fotocopiar sin autorización es un delito. Definición física Longitud de onda Intensidad luminosa Pureza Definición sensorial Tonalidad, matiz Eficacia luminosa, brillo Saturación. Proporción de blanco Se han diseñado múltiples formas de representación del color, bidimensionales y tridimensionales, en forma de triángulo, de rombo, de cubo, etc. Entre ellas citaremos por su interés el «Atlas de Munsell», del cual están elegidos los tonos de que se componen las fichas de las pruebas de visión del color de Farnsworth, Roth y Lanthony y, por otra parte, el triángulo de Maxwell y el triángulo de la Comisión Internacional de Iluminación (CIE). El triángulo de Maxwell es de interés por su capacidad didáctica. Ya hemos comentado que uno de los pilares de la teoría tricromática reside en la observación de un hecho fisiológico: algunas combinaciones de tres luces mono­ cromáticas permiten obtener el resto de los colores. Si elegimos uno de estos tripletes de colores «primarios» y Figura e4.9. En el triángulo de Maxwell tres colores primarios se representan en sus vértices y los colores producidos por mezclas entre ellos se colocan según la distancia perpendicular a cada uno de sus lados, de manera que el blanco queda representado en el centro, al corresponder a una mezcla igualitaria de los tres. los situamos en los vértices de un triángulo equilátero podremos representar todos los colores en el interior del triángulo como mezclas de estos tres primarios, de manera que la cantidad de cada uno de ellos venga dada por la distancia a cada uno de los lados (Figura e4.9). Los colores primarios empleados serán puros, puesto que la distancia del vértice a ambos lados contiguos es cero. El color blanco estará situado en el centro del triángulo, con proporciones equivalentes de los tres colores primarios. Los colores menos saturados estarán próximos al centro (es decir, estarán «manchados de blanco») y los más satu­ rados se situarán en las proximidades de los lados. De entre los colores puros, sólo los tres primarios uti­ lizados quedan representados dentro del triángulo de Maxwell. Para evitar recurrir a coordenadas negativas, que representarían colores muy puros situados fuera del triángulo, y para dotar a éste de una distribución de los colores más acorde con las características de capacidad del ojo humano para la discriminación entre los diferentes grados de matiz y saturación, la CIE ha recurrido a otra representación en la cual todos los colores quedan situados dentro de una figura, aproximadamente triangular, en la que cada color queda representado por su distancia X e Y (siempre positiva) a un sistema de coordenadas cartesianas (Figura e4.10). Discromatopsias Congénitas Desde el siglo xviii, es decir, casi 100 años antes de enun­ ciarse las leyes de Mendel, Huddart (1777), Lort (1778) y Dalton (1798) reconocieron el carácter congénito y hereditario de algunas anomalías de la visión del color. El defecto total o parcial de uno, dos o tres de los pigmentos responsables de la visión del color, o su constitución anómala, explicarían este tipo de deficiencias. e-245 e-246 pa r t e 1 0 : C A P Í T U L O S E X T R A Figura e4.10. El triángulo de la CIE contiene todos los colores posibles y los distribuye con una separación más congruente con la percepción humana. La acromatopsia típica o congénita con ambliopía ten­ dría una trasmisión autosómico recesiva, y se explicaría por un defecto generalizado de los conos. Su incidencia es muy baja, presentando los pacientes agudeza visual igual o inferior a 0,1, nistagmo, anomalías en el electrorretinograma (ERG) y asociación con otras enfermedades como retinopa­ tía pigmentaria, queratocono, enanismo, oligofrenia, etc. La acromatopsia congénita sin ambliopía se explicaría por la existencia de una sola familia de conos sana, posi­ blemente por coincidencia de los defectos para rojo y verde. Su frecuencia también es muy escasa, aunque superior en el sexo femenino, habiéndose descrito menos de dos docenas de casos. Las anomalías protán, deután y tritán señalarían los defectos respectivos de los conos para rojo, verde y azul. La anomalía tritán es rara e incluso algunos autores discu­ ten su existencia. Los defectos absolutos de receptores para rojo o verde se denominan, respectivamente, protanopía o daltonismo y deuteranopía o naguelismo, y cada uno de ellos afecta a un 1% de los hombres, al ser su herencia recesiva ligada al sexo. Un padre no transmite nunca el gen patoló­ gico a sus hijos, pero lo transmite siempre a sus hijas, las cuales lo transmitirán a su vez a su descendencia, aunque solamente lo padecerán en el caso de tener afectados sus dos cromosomas X. Los defectos relativos protán y deután se denominan protanomalía y deuteranomalía y afectan, respectivamente, a un 1 y a un 5% de los hombres (Figura e4.11). Finalmente, en las personas no afectadas existe una gradación en la capacidad de visión del color, que ha llevado a definir un grupo de sujetos con baja discriminación o astenopía cro­ mática, en los cuales los resultados de la prueba de 100 to­ nos o el anomaloscopio, que veremos más adelante, se situarían ligeramente al margen de los límites estadísticos de normalidad. En contraposición a los déficits de percep­ ción del color, en algunos hombres, el gen de la opsina contiene una molécula de alanina en lugar de serina que aumenta la sensibilidad al rojo. Jeremy Nathans (1986) ha demostrado que en los pacientes deuteranopes no existe gen para el pigmento verde o existe un gen híbrido que coloca pigmento para rojo en los conos para verde. En los protanopes nunca falta el gen sino que aparece un gen híbrido que sitúa pigmento para verde en los conos para rojo. Los pacientes tricróma­ tas anómalos siempre presentan, junto con los tres genes normales, algún gen híbrido determinante de la presencia de proteínas con sensibilidad espectral anómala, produci­ das por un entrecruzamiento anormal de los genes de los receptores para rojo y verde, que dará lugar a pigmentos anormales, de absorción intermedia entre la conocida para los conos normales. Discromatopsias Adquiridas No pretendemos realizar una clasificación exhaustiva de todas las enfermedades capaces de producir alteraciones de la visión del color. Señarelemos simplemente que tanto algunas anomalías de los medios transparentes del ojo, Figura e4.11. Clasificación y frecuencia de las anomalías congénitas de la visión del color según afecte al pigmento para rojo (eritrolabe), para verde (clorolabe) o para azul (cianolabe). E 4 | L a v i s i ó n d e l co l o r y sus anomalí as Figura e4.12. Características diferenciales entre las discromatopsias congénitas y adquiridas. como es el caso de las cataratas, como las enfermedades retinianas, de las vías ópticas o de las estructuras corticales pueden producir alteraciones de este tipo. Son de destacar, por su valor preventivo, las anomalías de la visión del color causadas por los antipalúdicos de síntesis al comenzar a depositarse sobre la retina, o del etambutol antes de producir una neuritis óptica irreversible. Como diferencia con el sujeto con discromatopsia con­ génita, el sujeto con discromatopsia adquirida es consciente de su defecto, nota que no ve igual que antes los colores y, probablemente, observa cómo su cuadro evoluciona y no es simétrico en ambos ojos (Figura e4.12). Contrariamente a las anomalías congénitas protán y deután, cuyo eje principal de confusión se dirige del púrpura y rojo al verde, como veremos en el próximo apartado, las anomalías adquiridas suelen presentar líneas de confusión entre el azul y el amarillo, con alguna excepción en el caso de aquellas que están causadas por defectos de la vía óptica. Figura e4.13. Línea principal (gruesa) de confusión del deuteranope en el triángulo de Maxwell, que incluye a los colores con igual proporción de azul y de rojo (líneas finas). © Elsevier. Fotocopiar sin autorización es un delito. Líneas De Confusión Del Discrómata Pensemos de nuevo en el triángulo de Maxwell, donde en los vértices situaremos tres colores primarios (rojo, verde y azul) y en el centro el blanco. Para un paciente deutera­ nope el color blanco estará representado por un color cuyas proporciones de rojo y azul son idénticas. Pero esto no ocurre sólo en el centro del triángulo, sino en todos los colores situados en una línea que une al vértice verde con el centro del lado opuesto, pasando por el centro del triángulo, dado que todos los puntos situados en esta línea son equidistantes de los lados que confluyen hacia el vértice verde. A esta línea se la conoce como «línea princi­ pal de confusión» del deuteranope (Figura e4.13). Por la misma razón, todas las líneas que parten del vértice verde del triángulo y se dirigen hacia el lado opuesto representan colores cuya proporción de rojo y azul es la misma. Los colores situados en cada una de estas «líneas secundarias de confusión» son percibidos como iguales por el deuteranope. Sin embargo, estos pacientes diferen­ cian entre sí los colores situados en líneas de confusión diferentes (Figura e4.14). Otro tanto de lo dicho cabría comentar para los pacientes protanopes y tritanopes, refiriéndonos a las líneas que parten en abanico desde los otros dos lados del triángulo hasta alcanzar el lado opuesto. En las Figuras e4.15-e4.17 podemos observar estas líneas representadas en el diagrama de la CIE. Figura e4.14. Una de las múltiples líneas secundarias de confusión del deuteranope en el triángulo de Maxwell. Evaluación De La Visión Del Color El estímulo cromático ha sido adaptado a múltiples exploraciones oculares, tales como el ERG, los potenciales evocados visuales (PEV), la campimetría, etc. Sin embargo, el diagnóstico de las discromatopsias continúa estando centrado en las pruebas de confusión, clasificación y mezcla de colores. Las tablas seudoisocromáticas son láminas con signos compuestos por puntos de colores. Estos colores han sido seleccionados entre los situados en una misma línea de confusión. Entre estas láminas, las que presenta el «Atlas de e-247 e-248 pa r t e 1 0 : C A P Í T U L O S E X T R A Figura e4.15. Líneas principal (gruesa) y secundarias de confusión del protanope en el triángulo de la CIE. Figura e4.16. Líneas principal y secundarias de confusión del deuteranope en el triángulo de la CIE. Ishihara» son las más conocidas, y están dedicadas espe­ cialmente al diagnóstico de las anomalías congénitas protán y deután. Existen múltiples variantes de tablas seudoisocromáticas, muchas de ellas extendidas en un limitado número de países, y sólo algunas permiten detectar anomalías del tipo tritán. Consiguen un diagnós­ tico aproximado, con una fiabilidad comprendida entre el 80 y el 90% y no tienen capacidad para cuantificar el defecto (Figura e4.18). Las pruebas de clasificación de colores son fichas negras circulares que contienen pequeños discos de color, extraídos Figura e4.17. Líneas principal y secundarias de confusión del tritanope en el triángulo de la CIE. del «Atlas de Münsell», que el paciente ha de ordenar de forma consecutiva a lo largo del espectro. Dos de estas pruebas han sido propuestas por Lanthony: una estudia con colores bastante saturados la zona azul-verde y otra utiliza tonos muy poco saturados. Sin embargo, las más extendidas en clínica son las pruebas de 15 y 100 tonos de FarnsworthMünsell y la prueba de 28 tonos de ­Farnsworth-Roth-Münsell, que utilizan colores de saturación media. Las pruebas de 15 y 28 tonos presentan colores distri­ buidos a lo largo de todo el espectro. Podríamos imagi­ narlos dispuestos en un anillo, a media distancia entre el centro (color blanco) y los lados del triángulo de Maxwell. A los pacientes discrómatas les parecen similares muchos colores situados en regiones del círculo opuestas, y comen­ ten errores diametrales al intentar ordenar las fichas dado que, como dijimos en el apartado anterior, las líneas de confusión parten en abanico desde el vértice del triángulo hacia el lado opuesto (Figura e4.19). La prueba de 100 tonos no tiene en realidad 100 sino 85, a causa de correcciones realizadas sobre el diseño inicial. Los 85 colores se eligen entre los que pertenecen al mismo anillo de saturación, pero quedan divididos en cuatro cajas diferentes, como si el círculo se hubiese frac­ turado en cuatro cuadrantes. El paciente clasifica los colores de cada caja por separado, de manera que nunca podrá confundir colores situados en las líneas principales, porque las fichas correspondientes estarán situadas en cajas diferentes. Se confunden colores situados en líneas secun­ darias. Por ejemplo, un protanope no confundirá los rojos con los verdes porque nunca se le presentan juntos, pero sí los amarillos y verde-amarillentos por un lado y los púrpura-azulados por otro (Figura e4.20). Menos extendidos, pero aún más exactos, son los ano­ maloscopios. Estos aparatos estudian la capacidad del sujeto para igualar, sobre un campo de observación dividido en dos mitades, la mezcla de dos radiaciones monocromáticas E 4 | L a v i s i ó n d e l co l o r y sus anomalí as Figura e4.18. Láminas seudoisocromáticas. © Elsevier. Fotocopiar sin autorización es un delito. Figura e4.19. Errores diametrales al ordenar un deuteranope las fichas de la prueba de 28 tonos. con la luz procedente de una tercera fuente. Por ejemplo, el anomaloscopio tipo I de Nagel aprovecha la ecuación de Rayleigh (rojo de 670,3 nm + verde de 546 nm = amarillo de 589,3 nm). Unos pacientes utilizarán cantidades nor­ males para igualar ambas superficies, otros cantidades anormales y otros, finalmente, no las conseguirán igualar con ninguna proporción. Conclusiones – La visión del color es un tema de importancia clínica, pero sobre todo de gran relevancia para comprender la relación del ser humano con su entorno. Bibliografía Éste es un tema con escasa bibliografía actualizada que proporcione una visión general sobre el tema. El texto proporcionado se considera suficiente. Figura e4.20. Prueba de 100 tonos de Farnsworth. Lecturas recomendadas Constancia para el color y sus vías ópticas. Zeki S. Una visión del cerebro. Barcelona: Ariel Psicología, 1995. Dispositivos de ayuda al estudio Algunas páginas web pueden proporcionar información complementaria sobre este tema. Triángulo de Maxwell http://www.efg2.com/Lab/Graphics/Colors/MaxwellTriangle. htm. http://en.wikipedia.org/wiki/CIE_1931_color_space. Test de Fansworth http://www.munsell.eu/html/colour_vision_tests.html. Simulador de discromatopsias http://www.,in press http://www.colblindor.com/ coblis-color-blindness-simulator/. e-249 e-250 pa r t e 1 0 : C A P Í T U L O S E X T R A Autoevaluación E4 1.Las discromatopsias congénitas se diferencian de las adquiridas en que: a. Suelen ser asimétricas. b. No hay conciencia del cambio de sensación cromática. c. Cambian de gravedad con el tiempo. d. No hay predominio de sexo en su frecuencia. e. Se asocian con baja agudeza visual. Correcta: b. Las discromatopsias congénitas siempre afectan por igual a los dos ojos, no progresan ni mejoran, suelen tener transmisión ligada al sexo y el sujeto no tiene conciencia de su defecto. 2.Se llama «constancia para el color» a… a. La capacidad que tenemos los seres humanos de ver los colores sin modificación durante toda la vida. b. Una característica propia de una superficie cromática que le permite permanecer inmodificada a lo largo del tiempo. c. La capacidad del ojo de percibir el mismo color independientemente de la composición espectral de la ilumi­ nación. d. Una característica propia de una fuente luminosa cuya composición espectral permanece constante a lo largo del tiempo. e. La incapacidad en determinadas patologías para diferenciar ciertos colores. Correcta: c. Salvo excepciones, como la que ocurre cuando la iluminación es monocromática, el ojo humano percibe los mismos colores con independencia de la composición espectral de la iluminación. 3.La forma más frecuente de discromatopsia congénita es: a. El naguelismo con defecto completo de los receptores para rojo. b. La protanopía o defecto absoluto para el receptor para verde. c. El daltonismo o defecto simultáneo de conos para rojo y verde. d. La deuteranomalía o defecto parcial del receptor para verde. e. Ninguna de las anteriores. Correcta: d. El naguelismo es el defecto del receptores para verde y el daltonismo o protanopía el defecto de receptores para rojo. La deuteranomalía es, efectivamente, el defecto parcial de receptores para verde. 4.Se conoce como «gotas» a… a. Regiones del área V1 con respuesta oponente al color. b. Regiones del área temporal para la asociación del color. c. Regiones occipitales que relacionan color y forma. d. Regiones occipitales que relacionan color y m ­ ovimiento. e. Regiones del área V2 que relacionan color y forma. Correcta: a. Las gotas están presentes en las capas 2 y 3 de la corteza visual primaria V1, responden a mecanismos centroperiferia con oponencia al color y parecen contribuir a la constancia del color. 5.Se denomina «temperatura de color» a: a. El aspecto frío o cálido de determinados colores. b. La temperatura que irradia una superficie coloreada iluminada por la luz del sol. c. La composición espectral de una fuente luminosa, dependiente de su temperatura. d. La temperatura que se necesita una superficie para que sea visible su color. e. La temperatura óptima para la correcta percepción de un color. Correcta: c. Al irse elevando la temperatura de un cuerpo emisor de luz, primero se emiten preferentemente rojos, al alcanzarse los 5.500 o K la composición espectral es similar a la solar, y a temperaturas más altas predominan los azules. E 4 | L a v i s i ó n d e l co l o r y sus anomalí as Temas de trabajo E4 © Elsevier. Fotocopiar sin autorización es un delito. 1. Discromatopsia, enumerar y describir los principales tipos de discromatopsia. 2. Elaborar un informe con las teorías de la visión del color. e-251 Campo visual. Nociones de perímetría Objetivo de aprendizaje ● Conocer los conceptos básicos que definen el campo visual, sus procedimientos de examen y los defectos característicos del glaucoma. Palabras clave/Key words Campo visual Perimetría Campimetría Escotoma Glaucoma Visual field Perimetry Campimetry Scotoma Glaucoma Introducción Más que «Introducción» podríamos decir que este comienzo es una advertencia para el lector. El conteni­ do de este capítulo está matizado por una experiencia de 35 años sobre el tema, de manera que el autor no está en condiciones de aportar una visión absolutamente impar­ cial y distante. Su trabajo se ha caracterizado muy frecuen­ temente por fuertes discrepancias con los criterios de muchos relevantes investigadores de cada momento. En general, la historia ha dado la razón a gran parte de esta posición heterodoxa y, quizás sea por ello que se le ha encargado el capítulo. Sin embargo, el lector encontrará inevitables discrepancias con lo que pueda leer en otras fuentes, sobre cuestiones y criterios actuales. El poder de estas fuentes reside, principalmente, en la fortaleza de las publicaciones que las divulgan desde una posición dominante sobre la ciencia, a cuyo rescoldo nacen opor­ tunidades para publicar. Estas discrepancias no afectan a los conceptos básicos y, en caso de tener interés por pro­ fundizar en el tema, el lector deberá resolverlas según su propio criterio. e5 Concepto De Campo Visual El campo visual es aquella región del espacio que observamos en «posición primaria de la mirada»; es decir, mirando con los dos ojos hacia el frente. La fóvea, ese milímetro cuadrado fundamental de nuestro organismo, nos permite observar la forma, el detalle, de aquello que tenemos justamente en el eje visual. Sin embargo, ésta es sólo una pequeña porción del total del campo visual que percibimos. Mientras que la fóvea y la mácula nos permiten captar los detalles de la región central del campo visual, que profundiza rápidamente en nuestra conciencia, el campo visual periférico nos es útil para otras muchas funciones de relación, menos conscientes, pero sin duda notablemente importantes. Cuando cruzamos un semáforo en un paso de cebra, nuestra fóvea, desde el campo visual central, nos informará de que se ha encendido la luz verde y de que podemos cruzar. El campo visual periférico estará atento a las manio­ bras de los coches que se acercan y comprobará que se han parado. La detección del movimiento es una de las espe­ cialidades del campo visual periférico. Si los coches no se detienen y se detecta movimiento, el campo visual perifé­ rico se encargará de desencadenar reflejos de defensa que detendrán nuestra marcha. Serán menos conscientes, pero sin duda igual de eficaces y necesarios. El campo visual se ve dañado selectivamente en nume­ rosas enfermedades y el conocimiento de su fisiopatología es esencial, en especial en el glaucoma y en los defectos de la vía óptica. En cada fondo de ojo existe una zona sin visión. La «mancha ciega» es la proyección de la papila (cabeza del nervio óptico) en el campo visual. En la cabeza del nervio óptico no existen fotorreceptores y, al situarse en la retina nasal, en el campo temporal existirá una pequeña zona sin visión (Figura e5.1). Por lo tanto, la mancha ciega del ojo derecho estará situada en el campo visual derecho, correspondién­ dose con una zona donde el ojo izquierdo tiene visión, y lo mismo le ocurre al ojo izquierdo, de manera que en visión binocular no existe ninguna zona ciega en el campo visual. No somos conscientes de ella porque para ello necesitaríamos de fotorreceptores no excitados, que en este caso no existen. En visión diurna o fotópica, el campo visual se percibe principalmente por medio de los conos, y al ser éstos más e-252 © 2012. Elsevier España, S.L. Reservados todos los derechos E 5 | Ca mpo v i s u a l. N o c i o n e s de per í metr í a Figura e5.1. Experimento para identificar la mancha ciega: tape su ojo izquierdo, mire a la cruz y aléjese o acérquese respecto a la imagen. Cuando el punto se proyecte sobre su mancha ciega dejará de ser percibido. Figura e5.3. Definición del umbral por la frecuencia de la percepción. Un umbral de 27 dB significa que, cuando se muestra un estímulo a esta intensidad, se percibe el 50% de las ocasiones. Si la fluctuación es baja (rojo) un estímulo menor de 26 dB se percibirá siempre y si es más alta (azul) se percibirá siempre por debajo de 25 dB. Figura e5.2. La isla de Traquair: como en una isla, la sensibilidad decrece desde el centro del campo visual a la periferia, y tiene un pequeño «cráter», la mancha ciega. abundantes en la fóvea que en la periferia de la retina, la sensibilidad a la luz será mayor en el centro del campo visual. Esta distribución funcional es conocida como «isla de Traquair» porque este autor definió el campo visual como una «isla de sensibilidad rodeada de un mar de ceguera» (Figura e5.2). © Elsevier. Fotocopiar sin autorización es un delito. El Umbral De Sensibilidad Y Su Fluctuación Definimos como umbral aquel estímulo que puede ser percibido en un 50% de las ocasiones. La sensibilidad de la retina no es absolutamente constante, de manera que no podemos considerar al umbral como un concepto abso­ luto, sino como un dato probabilístico. Estímulos muy oscuros no se percibirán nunca, y estímulos muy claros se percibirán siempre. Entre ambas situaciones límite existirá una zona en la que el estímulo podrá ser percibido o no. Esta fluctuación o variabilidad del umbral es relativamente baja en sujetos sanos o en regiones normales, y se incre­ menta en situaciones de patología, especialmente en zonas con defectos importantes (Figura e5.3). En clínica no medimos el umbral absoluto, es decir, la menor intensidad de luz detectable sobre un fondo negro, sino el umbral relativo o diferencial, que se define como la capacidad para detectar un estímulo de pequeño tamaño (∆I) que se añade a un fondo uniformemente iluminado (I) con una luz de igual naturaleza física. La ventaja de este criterio es que el umbral diferencial (∆I/I) es constante en iluminación fotópica, es decir, que si se necesita 1 lux para detectar el estímulo al ser proyectado sobre un fondo de 10 lux, se necesitarán 20 lux si lo proyectamos sobre un fondo de 200 lux. Esta constancia se conoce como Ley de Weber-Fechner. Un factor muy importante que influye sobre el umbral es la edad. Existe una pérdida previsible de sensibilidad a lo largo de la vida debida a la pérdida natural de células nerviosas, que deberá tenerse en cuenta en el momento de interpretar los resultados perimétricos. Los perímetros Octopus admiten una pérdida funcional de 0,065 dB/año. Humphrey no ha publicado sus valores de referencia. Otro factor esencial es el aprendizaje. Se sabe que los resultados perimétricos mejoran durante los primeros exámenes. Como diagnóstico puede aceptarse un primer examen si es normal, pero si resulta anormal, debe repetirse al menos dos veces más antes de dar por correcto el resultado. Estos cuidados deben extremarse si se pretende realizar estudios de seguimiento, puesto que la mejoría por aprendizaje puede enmascarar la progresión de los defectos. Un tercer factor que debe tenerse en cuenta es el impropiamente denominado «efecto fatiga». El umbral se reduce a medida que se prolonga el examen perimétrico, pero no por fatiga física, sino por un agotamiento neuro­ lógico de la función retiniana. El ojo está preparado para detectar cambios consecutivos en el contraste. Las imágenes deben modificarse continuamente en nuestra retina para cumplir con esta función. La adaptación permanente a un fondo de luminancia constante, como es el fondo del perímetro, es contraria a las necesidades de la fisiología retiniana. Por esta razón hoy se admite que es preferible utilizar estrategias rápidas para la detección del umbral. A la fluctuación propia de la función retiniana se le suma una variabilidad impuesta por cambios en la aten­ ción, errores instrumentales, etc. Por esta razón, en la práctica definimos dos tipos de fluctuación, la fluctuación e-253 e-254 p a rte 1 0 : C AP Í T U L O S E X T R A a corto plazo (Short Fluctuation: SF), que es la que ocurre durante un examen del paciente, y la fluctuación a largo plazo (Long Fluctuation: LF), que es la que se produce entre dos exámenes. Técnicas Clásicas De Examen Del Campo Visual Perimetría Por Confrontación Para detectar defectos amplios y profundos en el campo visual puede ser útil este procedimiento simple: el explo­ rador se sitúa delante del paciente y le pide que le mire al puente nasal, mientras se tapa uno de los ojos. El explora­ dor también se tapa el ojo situado delante del ocluido por el paciente y mueve la mano o un objeto a mitad de camino entre ambos. Si el explorador lo percibe, el paciente también podrá hacerlo si es normal. A continuación se repite la operación con los ojos contrarios. De esta manera pueden identificarse defectos graves, como las cuadrantanopsias o las hemianopsias, frecuentes en la patología neurológica. Perimetría Cinética Aunque esta técnica ya existía de manera más rudimenta­ ria, fue Goldmann quien la dotó de rigor al fabricar un instrumento fotométrico perfectamente calibrado. Con­ sistía en una semiesfera, blanca en su interior, en cuyo centro se situaba el ojo del paciente. Sobre el fondo uni­ forme de la cúpula se proyectan estímulos de tamaño y luminancia conocidos. Al proyectarse sobre el campo visual periférico podrían no ser vistos, pero al desplazarse hacia el centro (estímulo cinético) a lo largo de uno de los meridianos del campo visual, llegaba un momento en que eran percibidos (Figura e5.4). Repitiendo el procedimiento en varios meridianos y uniendo los puntos resultantes se define una línea de isosensibilidad o «isóptera». Realizando el examen con estímulos de diferente intensidad se obtienen varias isópteras que, en su conjunto, permiten conocer la forma de la isla de sensibilidades. Cada una de ellas vendría a ser como el límite de una serie de láminas de corcho con Figura e5.4. En la perimetría cinética el estímulo se desplaza por cada meridiano hasta que es percibido. Figura e5.5. Los puntos de igual sensibilidad, unidos entre sí definen una «isóptera». las que hubiésemos construido una maqueta de la isla (Figura e5.5). Perimetría Estática En este tipo de examen se muestra un estímulo débil en una posición del campo visual y se va incrementando su intensidad hasta que es percibido, o bien se va reduciendo su intensidad hasta que deja de serlo. De esta manera, calculando la sensibilidad en cada punto, como un topógrafo que midiese diferencias de altura, se llegará a conocer la forma de la isla de Traquair (Figura e5.6). Los valores obtenidos se comparan con patrones de normalidad. Si en una zona no se responde a estímulos de máxima intensidad se define como un escotoma absoluto. Si se necesita de estímulos anormalmente elevados para obtener respuesta se define como escotoma relativo. Figura e5.6. En la perimetría estática el estímulo se mantiene inmóvil y se modifica su intensidad hasta identificar el umbral. E 5 | Ca mpo v i s u a l. N o c i o n e s de per í metr í a Al no medir perímetros, la denominación de «perime­ tría» tiene poco sentido teórico, pero se conservó avalada por la costumbre. El ojo, al igual que el oído, responde a los estímulos físicos de manera logarítmica. Ésta es una necesidad impuesta por la naturaleza, dado que el ojo necesita per­ cibir diferencias luminosas en un rango enorme; desde condiciones de penumbra a ambientes de iluminación muy intensa. Al igual que el sonido, la escala de intensidades se mide en decibelios (dB). De esta manera, para el ojo, la diferen­ cia entre un estímulo de 1 lux (30 dB) y 10 lux (20 dB) será similar a la que existe entre 100 lux (10 dB) y 1.000 lux (0 dB). Debe matizarse que las escalas en dB no son equivalentes en los diversos perímetros, sino que dependen de la intensidad del estímulo máximo que cada aparato es capaz de proyectar. Perimetía Automática © Elsevier. Fotocopiar sin autorización es un delito. La divulgación de los ordenadores orientó a diversos autores a automatizar el estudio del campo visual. Entre ellos destacaremos a Fankhauser en Suiza y a Krakau en Suecia. El primero de ellos diseñó un instrumento que alcanzó éxito comercial al final de la década de 1970, con el nombre de perímetro Octopus (Figura e5.7). Figura e5.7. El Profesor Fankhauser mostrando su primer prototipo de perímetro automático Octopus. En 1984 apareció publicada la descripción de nuestro perímetro Hipocampus y en 1985 la primera referencia del Humphrey Field Analyzer. Es justo reconocer que ambos tuvieron como esencial fuente de inspiración el diseño original de Fankhauser y su grupo. Índices Perimétricos La mayor parte de ellos derivan de las ideas del grupo suizo. Los principales son los siguientes: 1. La sensibilidad media (Mean Sensitivity: MS). Es el valor promedio de los umbrales medidos en el paciente. Como es un valor que se modifica con la edad, sólo tiene interés cuando se comparan los resultados con otros índices en los que tampoco ha sido tenida en cuenta la edad como, por ejemplo, el espesor de la capa de fibras nerviosas de la retina. 2. El defecto o desviación media (Mean Defect en Octopus o Mean Deviation en Humphrey: MD). Es el promedio de las diferencias entre el umbral observado y el esperado para un sujeto normal de la misma edad, en cada punto del campo visual examinado. Ha de advertirse que mien­ tras que Octopus presenta las desviaciones hacia la patología con sentido positivo, Humphrey lo hace con signo negativo. Los diseñadores de los perímetros Humphrey han propuesto recientemente un índice denominado VFI (visual field index) que, teóricamente, sustituiría o mejoraría el concepto de MD. Se trata de establecer un valor porcentual para cada punto, que representaría la proporción de umbral perdida por el paciente respecto a su valor normal corregido para la edad. A esto se añadiría una ponderación condicionada por la impor­ tancia funcional del punto (en especial su proximidad al punto de fijación). Nos parece una idea inadecuada porque no se pueden establecer porcentajes en una escala en las que el valor 0 es arbitrario, dependiendo de la intensidad máxima de cada perímetro. Como ejemplo, no se puede decir que una temperatura de 15 °C sea el 50% de 30 °C. 3. Desviación estándar respecto al patrón (Pattern Standard Deviation de Humphrey: PSD). Es la desviación están­ dar de todas las diferencias entre el umbral observado y el esperado para un sujeto normal de la misma edad. En los perímetros Octopus suele usarse su valor elevado al cuadrado (Loss Variance: LV) o expresarse como raíz de LV (sLV), siendo en este caso prácticamente equiva­ lente a PSD. PSD o LV son medidas de irregularidad del campo visual. La irregularidad depende principalmente de dos facto­ res: los defectos no suelen ser homogéneos, sino más profundos en unas zonas que en otras, y las medidas que obtenemos son fluctuantes. Algunos programas de perimetría examinan todos o un grupo de puntos en dos ocasiones para estimar la fluctuación. Sustrayendo la fluctuación a PSD o LV podría obtenerse su valor «corregido», que reflejaría más selectivamente la irre­ gularidad de los defectos (c-PSD y c-LV). Sin embargo, medir la fluctuación implica prolongar el examen, lo cual, a su vez, incrementa la fluctuación, de manera e-255 e-256 p a rte 1 0 : C AP Í T U L O S E X T R A que algunos autores, entre los que nos encontramos, prefieren no medirla, o bien hacerlo realizando dos exámenes cortos independientes, de manera que el período de descanso refresque la función retiniana, suprimiendo la continuidad del «efecto fatiga». La prueba de hemicampo (Hemifield Test), habitual en los perímetros Humphrey, compara diversas áreas supe­ riores con sus correspondientes especulares en el campo inferior y supone que el glaucoma provoca diferencias entre ellas que son útiles para el diagnóstico. Nosotros, como otros autores, no creemos en la capacidad diagnóstica de estos valores comparativos. Colaboración Del Paciente Tratándose de una prueba subjetiva es muy importante instruir adecuadamente al paciente, colocarlo de manera correcta ante el instrumento con la corrección óptica adecuada y comprobar su adecuada colaboración durante el examen. Para ello se establecen algunos «estímulos trampa» intercalados con los del examen. Periódicamente no se muestra ningún estímulo y si el paciente pulsa el botón de respuesta se anota que ha cometido un «falso positivo». En otras ocasiones se muestra un estímulo intenso en un punto previamente detectado como normal, y si el paciente no responde por falta de atención se anota que ha cometido un «falso negativo». Algunos perímetros advierten de los errores de fijación vigilando la posición del ojo con una cámara de vídeo (Octopus). De esta manera el examen se detiene de forma auto­ mática cuando el paciente cierra los ojos, parpadea o pierde la fijación. El sistema no es demasiado sensible, aunque tiene la ventaja de realizar una monitorización continua durante la prueba, mientras que otros instrumentos realizan evaluaciones periódicas. Uno de estos sistemas de verificación discontinua de la fijación se conoce como método de Heijl-Krakau, y consiste en proyectar estímulos en la posición de la mancha ciega, que el paciente verá si altera la fijación. Sus inconvenientes son el no ser continuo, por lo que no puede suprimir los momentos en los que se pierde la fija­ ción, y el hecho de no detectar pérdida de fijación cuando la zona sobre la que se proyecta el estímulo no tiene sufi­ ciente sensibilidad. Otra posibilidad es usar cuatro puntos de fijación, dejando libre el centro, y proyectar de forma Figura e5.8. Mallas de estímulos más usadas en perimetría. periódica en él un estímulo débil que sólo puede percibirse por la fóvea. Si no se responde, se concluye que el paciente no está mirando al centro. Al igual que el método anterior no permite una monitorización continua. Probablemente más interesante que todos estos sistemas es disponer de un buen técnico, que estimule continuamente al paciente, verifique que mantiene los ojos bien abiertos y una fijación y atención correctas, y que nos informe de su impresión general sobre la fiabilidad de los resultados al final del examen. Mallas Perimétricas Así se define la disposición de los puntos seleccionados para el examen, que podrá ser regular o irregular. Aunque se han diseñado múltiples mallas a lo largo de la historia, señalaremos sólo algunas de las más usadas. Entre las mallas regulares destaca la 32 o 30-2 que examina 76 puntos separados entre sí 6° hasta 30° de excentricidad (Figura e5.8). La malla 30 × 24 suprime las filas superior e inferior, por ser la superior causa de frecuentes falsos escotomas producidos por el párpado, y por adaptarse mejor a exámenes en los que la cúpula perimétrica se sustituye por un monitor. La malla 24-2 reduce aún más los puntos con la intención de recortar la duración del examen. Aunque presenta más puntos en el campo nasal que el temporal para favorecer el estudio del glaucoma, ha sido empleada con frecuencia en el examen de patología neu­ rológica. Finalmente, se han usado mallas regulares más densas, con estímulos separados 1-2°, para el estudio de los defectos centrales. Entre las mallas irregulares la más difundida es la G1 de los perímetros Octopus que favorece, por su función, a la región macular respecto a la periférica. Estrategias De Examen La estrategia clásica para la detección del umbral, conocida como bracketing (estrategia escalonada) o full threshold (umbral completo) consiste en mostrar estímulos sucesivos con saltos de 4 dB hasta que el paciente pasa de no percibir el estímulo a percibirlo o viceversa. Una vez delimitada la franja en la que se encuentra el umbral, se perfila su valor con saltos E 5 | Ca mpo v i s u a l. N o c i o n e s de per í metr í a © Elsevier. Fotocopiar sin autorización es un delito. de 2 dB o incluso de 1 dB. Aunque esta estrategia se ha con­ siderado durante mucho tiempo como el patrón oro, hoy sabemos que su larga duración deteriora el umbral, sobre todo en los puntos examinados al final del examen. Menor difusión han tenido otras estrategias como Fast­ pac y Dynamic que modifican la amplitud de los saltos: Fastpac de 3 en 3 dB, sin inversión de la búsqueda y Dynamic haciéndolos más cortos en las zonas normales y más amplios en las patológicas. La estrategia supraumbral prescinde de su determina­ ción para simplemente definir cada punto como normal, escotoma relativo o escotoma absoluto. Se muestra en cada punto del campo visual un estímulo que puedan percibir todos los sujetos normales. Si el sujeto responde, no se investiga más. Si no responde se muestra un segundo estímulo a la intensidad máxima del instrumento. Si en esta ocasión se obtiene respuesta, se clasifica como con esco­ toma relativo y si tampoco responde, como con escotoma absoluto. Esta estrategia se ha ido abandonando desde que se han diseñado estrategias tanto o más rápidas que informan de la magnitud local del umbral. Una mayor difusión han alcanzado las estrategias Tendency Oriented Perimetry (TOP) en los perímetros Octopus y Swedish Interactive Threshold Algorithm (SITA) en los perímetros Humphrey. TOP ha sido diseñada por el autor de este capítulo y sólo muestra un estímulo en cada posición del campo visual. Examina secuencialmente cuatro mallas de puntos intercaladas entre sí (Figura e5.9). Durante el examen de cada malla, las respuestas se aplican al punto examinado y a los situados en su entorno, siendo la duración de la prueba de 2.30-3.00 minutos. Se basa en que, como veremos más adelante, los puntos próximos tienen una sensibilidad íntimamente relacionada. La estra­ tegia SITA utiliza algoritmos basados en «inteligencia artificial». Existen dos versiones: standard y fast, con una duración que varía entre 4 y 7 minutos. La estrategia Spark de los perímetros Oculus, más reciente, también ha sido diseñada por el autor de este capítulo. Consta de cuatro fases. La primera puede usarse como entrenamiento o valoración inicial y dura unos 40 seg­ undos. Al final de la segunda fase (aproximadamente 1.30 minutos) se obtienen resultados útiles. Después de las cuatro fases (aproximadamente 3.00 minutos) se consiguen resultados promediados del umbral (Figura e5.10). Representación Del Campo Visual Las magnitudes numéricas del umbral pueden representarse en tablas que conservan su posición, o bien transformarse en un «mapa de grises» en el que cada tono de gris repre­ senta un determinado intervalo de valores: negro para los defectos absolutos (escotomas absolutos), tonos interme­ dios para los escotomas o defectos relativos y tonos claros para las zonas normales (Figura e5.11). De igual manera, pueden construirse mapas coloreados, en los que cada tono representa un rango de valores. Otra forma de representar el campo visual son tablas numéricas en las que cada valor representa la desviación respecto al umbral medio normal corregido para la edad, o bien el valor se sustituye por una pequeña mancha oscura. En ocasiones, las desviaciones situadas dentro del rango normal sólo se señalan con una cruz o con un punto (Figura e5.11). La representación tridimensional de la «isla Figura e5.9. La estrategia TOP. El examen comienza con estímulos situados a la mitad del umbral normal para la edad del paciente (1). Las respuestas, «visto» o «no visto» modifican la predicción del umbral en 4/16 del valor normal. Partiendo de la segunda estimación (2) se examina una malla de puntos intercalada en la anterior, y sucesivamente una tercera y cuarta, haciendo ajustes cada vez más finos en la predicción. e-257 e-258 p a rte 1 0 : C AP Í T U L O S E X T R A Figura e5.10. La estrategia Spark aplicada al Perimetro Oculus Easyfield obtiene cuatro resultados en 3 minutos y considera como umbral final a su mediana. Figura e5.11. Tabla numérica de umbrales, tabla de desviación respecto a la normalidad y mapa de grises del mismo caso. de sensibilidades», aunque pueda resultar curiosa, tiene poca utilidad práctica. En la «curva de defecto» o «curva de Bebie», habitual en los perímetros Octopus y Oculus, las desviaciones respecto a la normalidad se tabulan, se ordenan de menor a mayor y se representan en unos ejes de coordenadas. Las abscisas (X) indican el orden del punto y las ordenadas (Y), el grado de desviación. La gráfica incluye como referencia adicional los valores medios de la curva en la población normal y sus intervalos de confianza. En defectos difusos, como los pro­ ducidos por una catarata, la curva se deprime globalmente, mientras que en defectos focales se observarán a la izquier­ da puntos situados dentro del intervalo normal y a la derecha puntos con sensibilidad deprimida (Figura e5.12). Para intentar evitar la influencia de las cataratas, los resultados del perímetro Humphrey y de otros perímetros que han seguido su criterio, suponen que siempre existirán algunos puntos normales en cualquier campo visual. Estos Figura e5.12. A la izquierda en azul curva de defecto y en rojo intervalos de confianza de normalidad. En las dos imágenes del centro vemos la corrección de la curva, considerando que el primer tramo debería coincidir con la media normal. A la derecha mapa de desviación original y corregido mediante este método (Pattern Deviation Map). E 5 | Ca mpo v i s u a l. N o c i o n e s de per í metr í a puntos se situarían a la izquierda de la curva de defecto y su depresión respecto al valor medio normal nos informa­ ría del grado de desviación difusa causado por el cristalino (General Height: GH). Si se sustrae este valor constante a todas las desviaciones obtenidas en el paciente, se obtendrá un campo visual en el que se ha compensado el efecto del cristalino. Este campo visual se muestra en los denomina­ dos «Mapas de desviación respecto al patrón» (Pattern Deviation Maps), que generalmente reducen significativa­ mente la magnitud inicial de los defectos. En nuestra opi­ nión, ésta es una opción inadecuada, porque hemos observado que en el glaucoma y, posiblemente en otros procesos patológicos, el daño inicial es difuso, y este com­ ponente difuso se mantiene en la progresión de la enfer­ medad, de manera que al suprimirlo se reduce la sensibilidad diagnóstica del examen (Figura e5.12). Hasta que no se disponga de un criterio objetivo, la influencia del cristalino sobre los datos perimétricos debe ser evaluada subjetivamente por el examinador, teniendo en cuenta el examen del segmento anterior, la agudeza visual, la visión de contraste, la turbidez del aspecto del fondo, etc. © Elsevier. Fotocopiar sin autorización es un delito. El Campo Visual Glaucomatoso Como hemos mencionado, en las fases iniciales del glaucoma la lesión es difusa. Flammer señaló que un incremento en la fluctuación podría ser el primer signo de defecto glaucomatoso. Nosotros hemos señalado que en las estrategias rápidas se detecta una irregularidad precoz en el campo visual objetivable midiendo el índice PSD-sLV. Posteriormente, otros autores han observado en grandes series que este índice es un «factor de riesgo» en la evolu­ ción de la hipertensión ocular hacia el glaucoma. Nosotros creemos, por el contrario, que se trata de un primer dato de sufrimiento neuronal y, por lo tanto, de enfermedad. Las células ganglionares de la retina emiten axones que siguen trayectos previsibles (Figura e5.13) hasta alcanzar la papila, para continuar su trayecto por el nervio óptico en dirección al núcleo geniculado externo. Por razones que están en discusión, las fibras que penetran por los polos superior e inferior de la papila se suelen afectar de manera más frecuente, precoz e importante que el resto. Además, la afectación del campo superior es algo más frecuente que la del inferior, y la del campo nasal más que la del tempo­ ral. No obstante, la lesión afecta prácticamente siempre, en mayor o menor medida, a todo el haz de fibras que penetra por la misma posición de la cabeza del nervio. Hemos de tener en cuenta que las fibras procedentes de células próximas a la papila se disponen en planos más superficiales de la retina y las periféricas son más profun­ das, lo cual también influye en su manera de enfermar, muy posiblemente a causa de sus posiciones diferenciadas en el interior del nervio. Si analizamos la relación de las sensibilidades de unos puntos de la retina respecto a otros, encontraremos una alta correlación matemática entre todos los que pertenecen al mismo haz, aunque será mayor cuanto más próximos se sitúen los puntos entre sí. Observando los trayectos de las fibras, podemos comprender fácilmente que el glaucoma produzca lesiones «arqueadas», como el propio trayecto de las fibras. Estas zonas arqueadas, con una excentricidad de 10-25°, se conocen Figura e5.13. Trayecto de las fibras de las células ganglionares al dirigirse hacia el nervio óptico. como «área de Bjerrum». Estos defectos o escotomas suelen progresar desde la periferia nasal hacia la mancha ciega, y desde la región de los 12-30° hacia el campo central, unas veces con predominio superior y otras con predominio inferior. Podemos señalar varias áreas en el campo visual que se corresponderían aproximadamente con los respec­ tivos sectores del nervio más afectados por la enfermedad. De esta manera, los defectos glaucomatosos adoptan for­ mas relativamente previsibles (Figura e5.14). Aunque estas formas no son únicas, y ocasionalmente se detectan casos con afectación preferente central o lesión temporal relativamente precoz, estas dos zonas suelen ser las últimas en resistir a la enfermedad, de manera que en los estadios terminales suele observarse una visión tubular acompañada de un islote residual de visión temporal. Técnicas Perimétricas Especiales Se han propuesto varias técnicas como alternativa a la perimetría estática automática «blanco sobre blanco» (W/W) que hemos descrito. Perimetría Cinética Semiautomática Varios autores y en diferentes épocas han propuesto desenterrar y automatizar la perimetría cinética. Especial­ mente el modelo 900 de Octopus propone una perimetría cinética semiautomática. En nuestra opinión las ventajas son escasas o nulas y muchos los inconvenientes. El máximo interés que mantiene reside en el hecho de que, como normalmente la legislación suele tener un retraso de medio siglo respecto a la ciencia, las normativas de e-259 e-260 p a rte 1 0 : C AP Í T U L O S E X T R A Figura e5.14. Sectores del campo visual glaucomatoso y ejemplos de escotomas en las mismas regiones. muchos países para indemnizaciones, permisos de con­ ducción y similares se han copiado de generación en generación y suelen referirse a isópteras tipo Goldmann. Por esta causa, en determinados centros este tipo de equipos continúa siendo necesario. Perimetrías Objetivas Otra ilusión que se mantiene a lo largo de los años es conseguir una perimetría objetiva, en la que la interpreta­ ción del umbral no dependa de la respuesta del paciente. Periódicamente podemos encontrar trabajos sobre elec­ trorretinograma y potenciales evocados multifocales, que aportan una representación funcional topográfica. Lamen­ tablemente su capacidad diagnóstica nunca ha pasado del plano experimental, con baja capacidad de discriminación, sobre todo en la periferia. Otra posibilidad es recoger los movimientos pupilares después de estímulos luminosos multifocales. La alteración del reflejo fotomotor con la diabetes, los medicamentos, las intervenciones quirúrgicas o la edad han limitado hasta el momento su eficacia. Perimetría Azul-Amarillo O De Onda Corta (Swap) El uso de un estímulo azul presentado sobre fondo amari­ llo se ha postulado desde hace 20 años como capaz de detectar defectos precoces. Han sido innumerables los tra­ bajos publicados en revistas de renombre. Cuando inten­ tamos publicar argumentos y resultados contrarios, nuestros trabajos fueron sistemáticamente rechazados por heterodo­ xos. Nuestros criterios se encontrarán solamente en artícu­ los publicados en España (v. «Lecturas ­recomendadas»). Argumentábamos que se había tomado como señal de enfermedad lo que era simple ruido (fluctuación). La razón es que el estímulo (∆I) y el fondo (I) tienen, en esta técnica, diferente naturaleza física. No se mide realmente un umbral diferencial (∆I/I), la Ley de Weber-Fechner no se cumple y la fluctuación se incrementa. En la reunión de la Sociedad Internacional de Perimetría e Imagen (IPS) de 2010 alguien preguntó a la sala, en la que se encontraban varios de sus principales antiguos defensores, lo siguiente: «Levante la mano quien todavía crea que la perimetría azul-amarillo sirve para algo». Nadie la levantó. Perimetría De Parpadeo Se conoce desde hace mucho que la capacidad para ver como continuo un estímulo intermitente (Frecuencia Crítica de Fusión: FCF) se altera precozmente en el glaucoma. Matsu­ moto propuso calcular punto a punto la FCF con estímulos de intensidad constante y frecuencia variable. Efectivamente, el sistema es capaz de detectar defectos de forma precoz, pero presenta dos inconvenientes que lo hacen poco prác­ tico: el primero es que la respuesta del paciente es compleja (pulsar cuando parpadea y no pulsar cuando se percibe como continuo), de manera que sólo es aplicable a pacientes con un alto nivel de colaboración. El segundo es que los resul­ tados no son progresivos con la profundidad del defecto; el umbral se deteriora precozmente y se mantiene también alterado a lo largo de la evolución de la enfermedad. Perimetría De Ilusión De Doble Frecuencia Al igual que SWAP, se quiso defender inicialmente como un método de diagnóstico precoz, suponiendo que el glaucoma dañaba selectivamente alguna de las tres vías E 5 | Ca mpo v i s u a l. N o c i o n e s de per í metr í a Figura e5.15. Perimetría de ilusión de doble frecuencia (frequency doubling perimetry: FDT). Las dos imágenes de la izquierda se presentan alternativamente a una frecuencia de 25 Hz y contraste variable. El paciente debe percibir la imagen de la derecha. Abajo y a la derecha se muestra un resultado de examen. visuales: magnocelular, parvocelular o koniocelular. En este caso se trataba de percibir un fenómeno visual en el que barras claras y oscuras alternantes de un determinado ancho (frecuencia espacial), al ser mostradas en fase y contrafase a alta frecuencia temporal (25 Hz) dan la impresión de duplicar la frecuencia espacial, es decir, que aparente­ mente reducen su ancho a la mitad (Figura e5.15). Muchos trabajos han defendido su precocidad, pero otros más recientes han ido contradiciendo a los iniciales y, además, estudios realizados en monos han descartado que exista una afectación preferente de alguno de los tres sistemas. Hoy se considera que es un sistema diagnóstico útil principalmente por su bajo coste, pero no superior a la perimetría convencional, y nadie ha podido demostrar que sea más útil que aquélla para el seguimiento de la enfermedad. © Elsevier. Fotocopiar sin autorización es un delito. Perimetría Pulsar Este tipo de perimetría, diseñada por el autor de este capítulo, estudia la parte descendente de la curva de con­ traste en la retina periférica. Los estímulos, comparables a las ondas que produce una gota al caer en el agua, varían en frecuencia espacial y contraste, y se muestran en fase y contrafase a una frecuencia temporal de 30 Hz (Figura e5.16). Diversos estudios muestran que los resultados fluctúan menos que los de la perimetría convencional, siendo mejor la relación señal/ruido, que es útil para el diagnóstico, obteniéndose la máxima sensibilidad y especificidad con sLV, y que tiene una alta capacidad para medir progresión. Contra lo que han supuesto algunos investigadores, sin verificación experimental, Pulsar es un excelente sistema de detección de la progresión del defecto, como veremos al final de este capítulo. Figura e5.16. La «curva de contraste» (amarillo) define el límite de la visión cuando varía el contraste (vertical) y la frecuencia espacial (vertical). La perimetría Pulsar investiga el umbral en su parte descendente, en cada punto del campo visual, con estímulos que varían en contraste y frecuencia espacial (escalera). suficiente de entrenamiento en la tarea perimétrica. De no ser así, una posible progresión quedará enmascarada por la falsa mejoría en los resultados. En segundo lugar, ha de reducirse en lo posible la fluctuación. Esto puede alcanzarse de varias maneras: utili­ zando una estrategia promediada como Spark, sustituyendo cada valor de umbral por un promedio de los valores próximos, íntimamente relacionados con él (filtrado matemático similar a las técnicas para reducir ruido en las fotografías), utilizando técnicas perimétricas más estables (incrementando el tamaño del estímulo o usando Pulsar) o analizando la curva de defecto, que al reordenar los datos de mayor a menor, constituye por sí misma un auténtico procedimiento estabilizador. En tercer lugar, hay que establecer criterios que indiquen si los cambios observados son significativos o pueden ser causados por el azar. Estos criterios suelen conocerse como «análisis de eventos» (event analysis) y «análisis de tendencias» (trend analysis). Análisis De Eventos Este tipo de análisis ha sido usado principalmente por los fabricantes del perímetro Humphrey. Como punto de partida se analizan un par de exámenes iniciales del paciente. Conociendo que se trata de valores fluctuantes se establecen, hacia el futuro, unos límites teóricos de variabilidad que no deberían ser superados. En los exámenes posteriores se analiza si hay puntos que superan estos límites, considerán­ dose que el hecho es significativo cuando esta circunstancia se reproduce en exámenes consecutivos (Figura e5.17). Análisis De Progresión Del Campo Visual Análisis De Regresión-Análisis De Tendencias Observar si un resultado fluctuante se modifica significa­ tivamente es un problema complejo. En primer lugar, hay que asegurarse de que el paciente ha alcanzado el grado Fue propuesto hace muchos años por Krakau, pero hasta hace poco tiempo ha sido usado en varios tipos de perímetros por investigadores externos al fabricante. e-261 e-262 p a rte 1 0 : C AP Í T U L O S E X T R A Figura e5.17. Análisis de eventos. Los dos primeros campos visuales se usan como referencia. En un nuevo examen, los triángulos negros (imagen inferior derecha) indican progresión confirmada y los blancos, sospecha de progresión. Es el caso de los programas PeriData, Progressor o Threshold Noiseless Trend (TNT) diseñado por nosotros. En ellos se realiza un cálculo matemático de la recta de regresión de los umbrales y se analiza si existe una pendiente de pérdida significativa. Este cálculo puede realizarse sobre el índice MD, sobre el VFI, sobre cada valor o sector de la curva de defecto o sobre el umbral de cada punto (Figura e5.18). Al analizar numerosos índices, resulta fácil que algunos puedan indicar falsamente progresión a causa del azar. Por ello se establecen diversos criterios de recuento para conseguir un buen equilibrio entre la sensibilidad diagnóstica y la especificidad, es decir, para evitar esta­ blecer falsos diagnósticos de progresión en sujetos estables. E 5 | Ca mpo v i s u a l. N o c i o n e s de per í metr í a © Elsevier. Fotocopiar sin autorización es un delito. Figura e5.18. Resultados del análisis de progresión usando el programa TNT. Tanto el análisis de eventos como el de tendencias del VFI se han aplicado a los mapas de desviación del patrón, es decir, después de sustraer a cada valor de umbral el componente difuso al que nos hemos referido previamente. En nuestra opinión el análisis de regresión de puntos múltiples, ya sea punto a punto o en la curva de defecto, sin sustraer el defecto difuso, supera en capacidad diag­ nóstica al análisis de eventos y a la regresión de índices individuales como MD o VFI. Los puntos que alcanzan la condición de escotoma absoluto deben ser excluidos del análisis de progresión, porque aparentan ser estables y reducen la eficacia del análisis estadístico. Los puntos restantes son suficientes para proseguir con la investigación. Generalmente van quedando puntos más centrales que llegan más difícil­ mente al «fondo de escala del perímetro». Pulsar asociado a TNT, que usa esta estrategia, alcanza una gran capacidad para detectar progresión, pese a que tal habilidad haya sido discutida por algunos autores (sólo en el plano teórico) basándose en que los umbrales peri­ féricos alcanzan más fácilmente la condición de escotoma absoluto, sin que en esta crítica teórica se haya evaluado la eficacia real de la solución que hemos propuesto. Conclusión – El estudio del campo visual nos permite comprender el modo en el que determinadas enfermedades, como el glaucoma o la patología neurológica, afectan a las vías ópticas. Bibliografía Las lecturas recomendadas contienen una amplia bibliografía, por lo que no la duplicaremos aquí. Lecturas recomendadas Se reseñan algunos trabajos generales y de revisión que pueden estar al alcance directo del lector, en bibliotecas universitarias o en la Web. Una descripción amplia y general de este tema puede encontrarse en el libro ­gratuito: Weijland A, Fankhauser F, Bebie H, Flammer J, Haag-Streit AG. Automated Perimetry (5th ed.) 2004-2006, que puede descargarse en: http://www.haag-streit.com/ produkte/perimetry/octopusr-900/publications.html Una descripción en castellano, para médicos generales, del campo visual glauco­ matoso puede encontrarse en: González de la Rosa M. El glaucoma crónico de ángulo abierto. Med Clin (Barc) 2005;124:461-6. Una revisión crítica de varias perimetrías alternativas en sujetos normales y glau­ comatosos puede consultarse en: Ayala-Barroso E, Sánchez Méndez M, González Hernández M, González de la Rosa MA. Perimetriís blanco-blanco, azul-amarillo y azul-azul en sujetos normales. Arch Soc Esp Oftalmol 2003;78:609-14. González de la Rosa M. Estado actual del diagnóstico y control evolutivo del glaucoma. Arch Soc Esp Oftalmol 2003;78:299-314. Otras visiones complementarias o contrapuestas sobre el mismo tema se hallarán en: Honrubia López FM, García Sánchez J, Pastor Gimeno JC, et al. Diagnóstico precoz del glaucoma [ponencia oficial]. Madrid: Sociedad Española de Oftalmología, 1997. La capacidad de Pulsar para investigar progresión puede consultarse en: González de la Rosa M, González-Hernández M, Sánchez-Méndez M, Medina-Mesa E, Rodríguez de la Vega R. Detection of morphological and functional pro­ gression in initial glaucoma. Br J Ophthalmol 2010;94:414-8. Dispositivos de ayuda al estudio. Otras descripciones sintéticas de este tema se encontrarán en: http://es.wikipedia.org/wiki/Campimetr%C3%ADa. http://www.oftalmocom.com/Temas/Pruebas/Campimetria/Campimetria.htm. e-263 e-264 p a rte 1 0 : C AP Í T U L O S E X T R A Autoevaluación E5 1.El «umbral diferencial» es: a. La mínima cantidad de luz que puede percibirse después de adaptarse a la oscuridad absoluta. b. La capacidad para diferenciar las sombras de las luces. c. La diferencia entre la capacidad para percibir la luz en iluminación fotópica y escotópica. d. El estímulo que tiene un 50% de posibilidades de ser percibido al observarse sobre un fondo uniformemente iluminado. e. El estímulo que tiene un 99% de posibilidades de ser percibido al observarse sobre un fondo uniformemente iluminado. Correcta: d. El umbral diferencial es un concepto probabilístico, pero en clínica se calcula de forma aproximada, presentando estímulos de diversa intensidad sobre un fondo de intensidad estable y conocida, admitiendo que tiene variabilidad ­(fluctuación). 2.Las fibras (axones de las células ganglionares) que se afectan más frecuentemente en el glaucoma son: a. Las que penetran por la región nasal de la papila óptica. b. Las que penetran por las regiones superior e inferior de la papila óptica. c. Las procedentes de la mácula. d. Las que penetran por la región temporal de la papila óptica. e. Todas tienen la misma sensibilidad. Correcta: b. Estas fibras proceden de regiones correspondientes al campo visual nasal, superior e inferior (área de Bjerrum). El campo visual central y el temporal son más resistentes al daño glaucomatoso. 3.El «análisis de eventos» es: a. Un procedimiento para estimar si existe progresión en el campo visual. b. Un sistema para determinar visualmente si ocurren anomalías en un campo visual dado. c. Un método para comparar los campos visuales de los dos ojos. d. Un programa de inteligencia artificial (redes neuronales) para el análisis automático de campos visuales. e. Ninguna de las anteriores es cierta. Correcta: a. Un par de campos visuales iniciales establecen unos límites que no deben sobrepasarse si el campo visual es estable. 4.La curva de defecto es: a. Una línea cuyo trayecto indica la progresión del campo visual. b. La línea que une los puntos de igual sensibilidad en diversas zonas del campo visual, también conocida como «isóptera». c. La línea que separa la zona de visión y la zona ciega en las hemianopsias. d. Una línea en la que se representan, ordenadas de menor a mayor, las desviaciones de los umbrales respecto a su valor normal. e. Todas las anteriores son correctas. Correcta: d. En la curva de defecto, o curva de Bebie, las desviaciones respecto a la normalidad se tabulan, se ordenan de menor a mayor y se representan en unos ejes de coordenadas. 5.Una de las siguientes afirmaciones no es cierta: a. Un «mapa de grises» es una representación habitual de los umbrales desde el negro (escotomas absolutos) al blanco (zonas de alta sensibilidad). b. En los estadios terminales suele observarse una visión tubular acompañada de un islote residual de visión temporal. c. La lesión inicial del glaucoma suele presentarse como un escotoma profundo inferior. d. La fijación del paciente puede controlarse mostrando estímulos en la mancha ciega. e. La lesión inicial del glaucoma suele ser difusa o como presencia de defectos poco profundos en el área de Bjerrum. Correcta: c. La lesión inicial del glaucoma suele ser difusa o como presencia de defectos poco profundos en el área de ­Bjerrum. E 5 | Ca mpo v i s u a l. N o c i o n e s de per í metr í a Temas de trabajo E5 © Elsevier. Fotocopiar sin autorización es un delito. 1. Experimente con la Figura e5.1 para comprender el concepto de «mancha ciega». 2. Baje de Internet el libro Automated Perimetry de Albert Weijland et al y lea desde el capítulo 1.3 (pág. 8) hasta el capítulo 2.8 (pág. 18). e-265 Cirugía oftalmológica Objetivos de aprendizaje ● Esclarecer unas pautas de las indicaciones y técnicas quirúrgicas en la mayoría de las facetas de la oftalmología. ● Profundizar en algunos aspectos de las indicaciones y técnicas quirúrgicas. Palabras clave/Key words Músculos extraoculares Órbita Test de ducción-forzada Transposición Retroinserción Debilitamiento Miotomía Tenotomía Catarata Queratoplastia Pterigión Cirugía refractiva Vitrectomía de la pars plana Indicaciones de la vitrectomía Cirugía del desprendimiento de retina Cirugía filtrante Trabeculectomía Esclerectomía profunda no perforante Dispositivos de drenaje Iridotomía láser Trabeculoplastia láser Procedimientos ciclodestructivos Blefaroplastia Tarsorrafia Ptosis Ectropión Entropión Extraocular muscle Orbit Forced duction test Transposition Recession Weakening Myotomy Tenotomy Cataract Keratoplasty Pterygium Refractive surgery Pars plana vitrectomy Indications of vitrectomy Retinal detachment surgery Filtering surgery Trabeculectomy Nonpenetrating deep sclerectomy Drainage devices Laser iridotomy Laser trabeculoplasty Ciclodestructive procedures Blepharoplasty Tarsorrhaphy Ptosis Ectropion Entropion © 2012. Elsevier España, S.L. Reservados todos los derechos e6 Introducción Las propiedades cinéticas de los ojos se deben a su forma esférica. Los movimientos oculares son principalmente de rotación. La rotación del globo ocular depende de la relación entre su plano de acción, eje visual y centro de rotación. La acción de los músculos extraoculares se encuentra influida por la inserción en el globo ocular y su arco de contacto (superficie desde punto tangencial de contacto del músculo con el ojo hasta la inserción escleral). Los movimientos oculares se rigen por las leyes de inervación. La ley de inervación recíproca (ley de Sherrington), según la cual cuando el ojo realiza un movimiento en determinada dirección los agonistas de contraen y los antagonistas se relajan, y la ley de correspondencia motora (ley de Hering), que determina que los impulsos nerviosos enviados por los centros oculógiros a los músculos oculares para realizar un movimiento en una determinada dirección son simétricos para uno y otro ojo. Factores que contribuyen al éxito quirúrgico Anatomía, tamaño ocular, refracción y edad Examen motor y sensorial Cuadro clínico Técnica quirúrgica y cirujano Asepsia, posición de la cabeza Instrumental quirúrgico Uso de microscopia y telelupas Anestesia: tópica o peribulbar, general Finalidad de la cirugía Recuperar o mantener la visión binocular Vencer obstáculo mecánico Corregir tortícolis Mejorar sintomatología Tratamiento ambliopía e-266 E 6 | C i r u gí a of talmológi c a Músculos Extraoculares Avance muscular Estos músculos son cuatro músculos rectos y dos oblicuos: recto superior (RS), recto inferior (RI), recto lateral (RL), recto medio (RM), oblicuo superior (OS) y oblicuo inferior (OI). Su inserción en la esclera es el punto de referencia más importante para su cirugía. Tienen una longitud de aproximadamente 40 mm. La amplitud de la inserción escleral tendinosa es de 10 mm. En cirugía es importante respetar la relación de la inserción con respecto al limbo córneo-escleral. Se lleva a acabo en reintervenciones del músculo previamente debilitado. Retroceso o debilitamiento y resección o refuerzo son las técnicas más empleadas para los músculos rectos. Se pueden combinar en estrabismos incomitantes verticales con otros procedimientos en un mismo tiempo quirúrgico. Material De Sutura Debe provocar la menor reacción inflamatoria posible, tener resistencia y permanencia en el tiempo y deben ser flexibles para poder anudarlas. Técnicas De Exposición Conjuntival Según la técnica que empleemos, estado de la conjuntiva y preferencia del cirujano: 1. Incisión conjuntival con base en el fórnix. 2. Incisión conjuntival con base en el limbo. Es la más empleada para abordaje de los músculos rectos, ya que permite un mayor campo operatorio, la conjuntiva se puede retroinsertar para potenciar el efecto conseguido en el músculo, evita adherencias entre estructuras fasciales y estéticamente es menos visible. La apertura de la conjuntiva y acceso al músculo se deben realizar fuera de la inserción muscular para evitar desgarros de fibras musculares. Una vez abiertos la conjuntiva y tenon hay que disecar cuadrantes intermusculares para capturar el músculo con el gancho. En los músculos, tanto en refuerzos como en debilitamientos, se anuda el punto cogiendo un tercio de vientre muscular a cada lado. En la sutura escleral, la aguja pasa a un cuarto de espesor escleral sin perder la visualización a su paso por la esclera. © Elsevier. Fotocopiar sin autorización es un delito. Cirugía De Músculos Rectos Cirugía De Transposición Reajustes verticales de rectos horizontales. En paresias, o parálisis III y VI pares craneales. Las acciones de los músculos de RS y RI son transferidas en parte al campo de acción del RL en casos de parálisis total del VI par o en casos de parálisis del III par con afectación del RM al campo de acción del RM. Del mismo modo, las acciones de los músculos rectos horizontales son transferidas arriba o abajo en caso de doble parálisis de la elevación o depresión. Cirugía De Músculos Oblicuos Cirugía Del Musculo Oblicuo Superior El tendón de inserción del OS tiene dos partes diferenciadas; el cordón tendinoso, que atraviesa la tróclea y luego se ensancha en forma de abanico. El tercio anterior se inserta en la esclera por delante del ecuador y en posición primaria estas fibras con inciclotorsoras. Los dos tercios posteriores por detrás del ecuador cuando el ojo está en aducción actúan como depresoras. Refuerzo 1. Plegamiento muscular (McLean). 2. Refuerzo-intorsión (Harada-Ito). Debilitamiento 1. Tenectomía. 2. Tenotomía. Técnicas De Debilitamiento Cirugía Del Músculo Oblicuo Inferior Retroinserción Técnicas de debilitamiento Debilita la acción del músculo, desplazando su inserción hacia el ecuador del globo ocular, modifica arco de contacto, y relaja fibras musculares. 1. 2. 3. 4. Técnicas De Refuerzo Resección Reforzar la acción de un músculo quitándole una porción y volviéndola a anclar en la inserción original. Aumenta la tensión muscular. Plegamiento muscular Se realiza en cirugía del músculo oblicuo superior. Miotomía. Miectomía. Denervación y extirpación. Retroceso y anteroposición. Técnica de refuerzo Tiene pocas indicaciones. 1. Resección del músculo OI. Toxina Botulínica Es una alternativa al tratamiento quirúrgico del estrabismo. Actúa selectivamente en las terminales nerviosas colinérgicas bloqueando la salida del acetilcolina y disminuyendo la e-267 e-268 parte 1 0 : C A P Í T U L O S E X T R A actividad muscular. Se utilizan dosis muy pequeñas y se asiste de electromiógrafo para identificar el músculo y hacer más precisa la inyección de toxina en él. Oculoplastia En la oculoplastia, englobamos las cirugías realizadas para tratar las patologías en las que están implicados los anejos oculares. Por ello se emplean una gran variedad de técnicas. Entre ellas destacan la blefaroplastia, que en la mayoría de los casos es cosmética y el entropión-ectropión, así como las técnicas asistidas por láser como la dacriocistorrinostomía. Chalazión inferior. Formamos una tira tarsal libre de piel, orbicular, conjuntiva y retractores. Suturamos dicha tira a la cara interna del perisotio con sutura no reabsorbible. Finalmente cerramos plano de orbicular con sutura reabsorbible (Vicryl 5/0), realizamos punto de cantopexia y se cierra plano de piel con seda o prolene de 7/0. El mismo procedimiento puede realizarse en caso de ectropión paralítico, aunque si hay que rectificar el vector vertical lo haremos utilizando un espaciador. Nosotros utilizamos esclera de banco de ojos y la colocamos vía externa o interna entre el orbicular y los retractores. En caso de que exista acortamiento de la lamela anterior (ectropión cicatricial) será necesario realizar, además de la tira tarsal, un injerto de piel de espesor completo. Entropión La tarsorrafia puede ser temporal o permanente y lateral o medial. El procedimiento consiste en pasar suturas de doble armazón a través de la piel del párpado inferior para salir a través de las glándulas de Meibomio del borde palpebral. Lo mismo se realiza en el párpado superior y se anudan las suturas. Si queremos crear más permanencia antes de colocar las suturas debemos retirar el epitelio del margen palpebral. El aumento todavía mayor de la permanencia puede realizarse separando las lamelas anterior y posterior y cosiéndolas entre sí. Según el tipo de entropión (involutivo, cicatricial o espástico) realizaremos diferentes técnicas. En caso del involutivo, en el que hay una laxitud de los retractores del párpado inferior, los reinsertamos a través de una incisión longitudinal vía conjuntival (aunque puede realizarse también vía subciliar, externa), suturándolos al tarso con sutura reabsorbible. A este proceso puede añadírsele la realización de una tira tarsal para dar más tensión al párpado. Para tratar el entropión espástico, algunos especialistas usan las suturas de Quickert, que consisten en colocar suturas de doble armazón a través del párpado, desde el fórnix conjuntival hasta salir justo por debajo de las pestañas, de forma que tensamos mecánicamente los retractores. Puede realizarse una tira tarsal, asociada con una orbiculerectomía subciliar, procedimiento sencillo y efectivo. El entropión cicatricial es secundario a un acortamiento de la lamela posterior. Se puede tratar realizando la técnica de fractura tarsal. Realizamos una incisión horizontal en tarso y pasamos una sutura doble armazón del margen inferior del tarso y saliendo por debajo de las pestañas, esta técnica es útil si el entropión es leve. Cuando es muy importante a veces es necesario el uso de espaciadores para alargar la lamela posterior. Colocación De Pesas De Oro Blefaroplastia Calculamos para cada paciente el peso del implante que vamos a usar, siendo el ideal el que permite una buena oclusión sin crear ptosis palpebral. Realizamos una incisión en el surco palpebral superior, seccionamos en esa zona el orbicular y vamos disecando hasta exponer la parte anterior del tarso. Suturamos la pesa con sutura no reabsorbible, lo más cercano al borde palpebral posible y centrada discretamente hacia medial. Cerramos plano de orbicular con puntos sueltos de sutura reabsorbible (Vicryl 5/0) y el plano de piel con sutura continua de prolene 7/0. Mediante una incisión en el surco palpebral retiramos el exceso de piel, dejando siempre la suficiente para asegurar una buena oclusión. Si existe exceso de paquete graso (medial y/o central) abriendo el periostio retiramos la cantidad deseada. Se cierra el plano de piel con sutura continua prolene 7/0. En el párpado inferior se puede realizar por vía interna (vía conjuntival) si realizamos simplemente la extirpación del exceso de grasa. Si además existe exceso de piel la vía de abordaje externa es la de elección, realizando una incisión subciliar. Ectropión Ptosis Existen tres tipos de ectropión: el involutivo, el paralítico y el cicatricial. Según el tipo realizaremos un tratamiento u otro. El tratamiento de elección del ectropión involutivo, en el que existe gran laxitud horizontal, es la cirugía de la tira tarsal. Mediante una cantotomía lateral a través de la cual hacemos una cantólisis lateral, liberamos el párpado El factor fundamental para escoger la técnica quirúrgica para solventar una ptosis es la función del músculo elevador del párpado superior. Si existe una buena función se realizará una resección de la aponeurosis del elevador. Mediante una incisión en piel, se diseca la aponeurosis del orbicular en la parte anterior del orbicular y del tarso y La extirpación del chalazión externo se realiza, previa colocación de la pinza de chalazión, a través de una incisión de piel orbicular. Se extirpa en su totalidad el chalazión y posteriormente se coagulan los vasos sangrantes. Se cierra el plano de piel con puntos sueltos de sutura no reabsorbible (prolene 7/0 o seda 7/0). En caso de ser un chalazión interno lo extirpamos por vía conjuntival con la aguja de Corado (Valleylab) y lo dejamos cicatrizar por segunda intención. Tarsorrafia E 6 | C i r u gí a of talmológi c a Müller en la parte posterior. Resecamos la cantidad necesaria para tener una buena altura palpebral y se sutura con Vicryl 5/0 a tarso y cerramos plano de piel con prolene 7/0. Si, por el contrario, la función es mala, se recurre al frontal para levantar el párpado (suspensión al frontal). Nosotros usamos pericardios bovinos con los que, mediante la formación de un pentágono, unimos el párpado con el músculo frontal. Dacriocistorrinostomía La vía de abordaje que usamos es externa o transcanalicular. En la externa realizamos una incisión longitudinal para exponer el saco lagrimal. Una vez abierto el periostio y expuesto el saco se realiza la osteotomía, se forma el colgajo de mucosa nasal y de saco realizando así una comunicación entre la vía lagrimal y la fosa nasal. Se coloca la intubación de silicona y se suturan los colgajos con Vicryl 5/0 y el plano de piel con seda 7/0. En la transcanalicular, a través de una sonda de láser introducida por los canalículos se realiza la osteotomía, siguiendo control por un rinoscopio. Finalmente colocamos la intubación de silicona y aplicamos mitomicina en la osteotomía. Cataratas Dilatamos de forma agresiva el punto lagrimal. Realiza­ remos tres cortes para ampliar el punto. El primero lon­ gitudinal paralelo al borde palpebral, el segundo perpendicular en la parte posterior y con el tercero completamos el triángulo. La «catarata» es una opacificación del cristalino del ojo, que puede ser a causa de la edad (catarata senil), congéni­ ta, por traumatismo, por uso crónico de cortisona tópica y sistémica, o puede encontrarse asociada con enfermedades sistémicas como diabetes mellitus, dermatitis atópica, neurofibromatosis, etc. La catarata sigue siendo la primera causa mundial de ceguera según la Organización Mundial de la Salud (OMS/ WHO). El tratamiento de las cataratas es quirúrgico y se indica su intervención para la mejoría de la agudeza visual. También se puede indicar la cirugía de catarata cuando hay riesgo de presión intraocular elevada o para mejorar la visualización del fondo de ojo para su tratamiento o control, por ejemplo, en pacientes con retinopatía diabética. Evisceración Facoemusificación Se realiza una peritomía conjuntival con dos cortes de relajación, nasal y temporal. Posteriormente, llevamos a cabo una queratectomía y vaciamos el contenido ocular con una cucharilla dejándolo bien limpio. Realizamos dos cortes en esclera hasta conseguir dos flaps. Colocamos el implante de Medpore, cerramos esclera y Tenon con puntos sueltos de Vicryl 5/0 y la conjuntiva con puntos de colchonero de Vicryl 7/0 rapid. Fueron Antonio Banko y Charles Kelman quienes inventaron la técnica de facoemulsificación en la década de 1960. Consiste en la aspiración de la catarata con ultrasonidos a través de una incisión corneal o escleral pequeña (1,8-3,5 mm), con implante de una lente intraocular plegable a través de aquélla (Vídeo e6.1). Se puede hacer con anestesia tópica o local, según experiencia del cirujano y la colaboración del paciente. Esta técnica ha ido mejorando en las últimas tres décadas y actualmente se dispone de diferentes modelos, plataformas y diseños, con el fin de agilizar la recuperación visual y alcanzar la mejor calidad visual posible. La lente intraocular implantada puede ser monofocal o «multifocal», mejor dicho «bi»focal, que da una buena visión lejana y próxima (Vídeo e6.2). Hoy día sigue siendo la técnica de elección debido a su sencillez y seguridad, sobre todo en países desarrollados. Webber Botox © Elsevier. Fotocopiar sin autorización es un delito. Debido a la necesidad de tener un tejido corneal donante en perfectas condiciones, y por la dificultad para obtener córneas aptas (porque un ojo operado de cataratas o de cirugía refractiva, por ejemplo, afecta a su calidad como donante), cada día se está practicando más la queratoplastia laminar. La cirugía refractiva corneal es una de las cirugías más empleadas hoy día en personas jóvenes debido a la exigencia visual por temas profesionales y estéticos, así como por comodidad. Sin embargo, pueden aparecer complicaciones graves como el ojo seco o ectasia secundaria, por lo que un examen preoperatorio exhaustivo es imprescindible para su mejor resultado a largo plazo. Se reconstituye el vial de toxina con 2 o 4 ml de suero fisiológico según paciente y patología y se inyecta con jeringa de insulina y aguja de 30G. En el blefaroespasmo, inyectaremos en el orbicular pretarsal superior e inferior, en la zona del arco zigomático, procerus, corrugador y frontal realizando un mapa personalizado de punciones según paciente. Para uso estético se puede tratar la arruga directamente inyectando la toxina en los pliegues o inyectar en músculos antagonistas para conseguir el efecto deseado. Cirugía De Segmento Anterior El tratamiento de la catarata es quirúrgico y se indica su intervención para la mejoría de la agudeza visual. Extracción extracapsular La técnica de extracción extracapsular de la catarata empezó en el siglo xviii. Se trata de la extracción del núcleo del cristalino, limpieza de los restos corticales e implante de una lente intraocular rígida a través de una incisión cor­ neal o escleral grande (8-10 mm), como se puede ver en el Ví­ deo e6.3. Se precisa el cierre hermético de la incisión con suturas, lo cual alarga y enlentece la recuperación visual. e-269 e-270 parte 1 0 : C A P Í T U L O S E X T R A La lente intraocular implantada es monofocal, por lo que el paciente puede precisar de gafas para mejorar la visión próxima. Es una técnica también sencilla y tiene la ventaja de no precisar el aparato de ultrasonidos. Extracción intracapsular A principios del siglo xx, Ignacio Barraquer inventó la técnica de extracción intracapsular (en toto) del cristalino mediante una bomba de vacío (denominado erisifaco). En la década de 1950, Joaquín Barraquer descubrió el uso de la alfaquimotripsina que disuelve las zónulas del cristalino facilitando aún más su extracción intracapsular (Vídeo e6.4). En estos casos no se suele poner una lente intraocular, por lo que hace falta una corrección con gafas gruesas para mejorar la visión lejana y próxima. la curva de aprendizaje y la menor calidad visual debido a la interfase entre el donante y el receptor. Por esta razón, se han desarrollado diferentes técnicas laminares (con sus correspondientes siglas) conceptualizadas por varios cirujanos en todo el mundo en los últimos años. Deep Stromal Automated Endothelial Keratoplasty Deep Stromal Automated Endothelial Keratoplasty (DSAEK) es una técnica automatizada con microquerátomo para casos de descompensación corneal, quitando y trasplantando una capa interna que mide unas 150 micras (Vídeo e6.7). Deep Lamellar Endothelial Keratoplasty Córnea Queratoplastia penetrante El trasplante de córnea fue realizado por primera vez a principios del siglo xx por el austriaco Eduard Zirm. Está indicado en casos de opacidades profundas de la córnea debido a antecedentes de infección o traumatismo corneal, enfermedades degenerativas o hereditarias en la córnea, deformaciones corneales que provocan una mala agudeza visual como el queratocono o puede asociarse con enfermedades sistémicas como amiloidosis, mucopolisacaridosis, cistinosis, etc. Se trata de recortar el tejido afectado en todo su espesor, habitualmente la parte central, de la córnea del paciente, y cambiarlo por un tejido sano de un donante (Vídeo e6.5). La coaptación del injerto-receptor debe ser hermética mediante suturas y con la mínima tensión y máxima regularidad para asegurar una buena recuperación visual. Debido a la necesidad de tener un tejido corneal donante en perfectas condiciones, y por la dificultad de obtener córneas aptas (debido a que un ojo operado de catarata o de cirugía refractiva, etc., afecta a su calidad como donante) cada día se está practicando más la queratoplastia laminar. Queratoplastia laminar La gran novedad actual en la cirugía corneal es la queratoplastia laminar, en la que se retira y se trasplanta sólo la capa afectada. Por ejemplo, en casos de deformación corneal por ectasias como queratocono, o cicatrices corneales superficiales, sólo se recorta la capa anterior afectada, dejando el resto del tejido sano del paciente (Vídeo e6.6). En casos de descompensación corneal poscirugía de catarata o por distrofia de Fuchs avanzada, sólo se trasplanta la capa endotelial que está afectada. Se han comunicado menos complicaciones con la técnica laminar, una recuperación visual más rápida y un menor riesgo de rechazo inmunológico por trasplantar menos tejido de donante. Otra ventaja de esta técnica es que se pueden utilizar córneas donantes no aptas para queratoplastia penetrante, lo que aumenta el porcentaje de aprovechamiento en el banco de ojos. Sin embargo, su desventaja es Deep Lamellar Endothelial Keratoplasty (DLEK) es una técnica manual para casos de descompensación corneal quitando y trasplantando una capa interna que mide unas 150 micras. Descemet's Membrane Endothelial Keratoplasty Descemet's Membrane Endothelial Keratoplasty (DMEK) es una técnica manual para casos de descompensación corneal quitando y trasplantando una capa finísima de menos de 20 micras. Deep Anterior Lamellar Keratoplasty Deep Anterior Lamellar Keratoplasty (DALK). Esta técnica se emplea para casos de queratocono o cicatrices corneales profundas, pero sin afectar a la capa endotelial. Queratectomía superficial Es una técnica de raspado de las capas más superficiales de córnea por depósitos cálcicos, de amiloide, de hierro, o de cualquier otro material que impide una buena visión o provoca molestias oculares. También se puede indicar esta técnica para realizar biopsias o cultivos. Extirpación de pterigión El pterigión es una patología limbar en la que un tejido conjuntival fibrosado crece invadiendo la córnea de forma triangular. Existe una cierta asociación con la exposición a la luz ultravioleta, por lo que se encuentra más frecuentemente en pacientes de países cercanos al ecuador. Su tratamiento consiste en una buena disección de todo el tejido fibroso desde su ápice en la córnea hasta su base en la conjuntiva nasal, una buena limpieza del lecho escleral y la colocación de un autotrasplante conjuntival en la zona disecada para impedir su recidiva (Vídeo e6.8). Se ha demostrado que la técnica con autotrasplante conjuntival reduce su recurrencia comparando con la técnica de «esclera desnuda», en la que se cierra la conjuntiva disecada por segunda intención. E 6 | C i r u gí a of talmológi c a Cirugía Refractiva Lente intraocular fáquica Laser in-situ Keratomileusis con láser excimer En casos de miopía, hipermetropía o astigmatismo alto no aptos para las técnicas anteriores de cirugía refractiva corneal, la lente intraocular fáquica es una opción. Se trata de colocar una lente intraocular plegable con un grosor muy fino a través de una incisión corneal pequeña delante del propio cristalino del paciente. Su gran ventaja es la recuperación visual inmediata, la buena calidad visual por el diseño de la lente, y su reversibilidad como cirugía. Sin embargo, al ser una operación intraocular, conlleva los riesgos de infección en el postoperatorio, glaucoma secundario y catarata secundaria. Laser in-situ Keratomileusis con láser excimer (LASIK) es la técnica actual de la cirugía refractiva para corregir miopía, astigmatismo e hipermetropía. El concepto original fue de José Ignacio Barraquer, quien utilizaba lentículos corneales criocongelados y moldeados, posteriormente colocados en la córnea para corregir las dioptrías correspondientes. La técnica actual consiste en realizar un colgajo corneal muy fino mediante microquerátomo o láser de femtosegundo, levantamiento del colgajo y aplicación del láser excimer en el lecho estromal para corregir las dioptrías, y recolocación del colgajo corneal (Vídeo e6.9). Es la técnica actualmente más empleada debido a su sencillez y a la rapidez en la recuperación visual. Sin embargo, pueden aparecer complicaciones graves como el ojo seco post-LASIK o ectasia secundaria, por lo que un examen preoperatorio exhaustivo es imprescindible para obtener un mejor resultado a largo plazo. Laser Epithelial Keratomileusis y Photo-Refractive Keratectomy Laser Epithelial Keratomileusis (LASEK) y Photo-Refractive Keratectomy (PRK) son variaciones de la técnica descrita anteriormente. La diferencia consiste en levantar el epitelio (la capa más superficial) mediante un microquerátomo muy fino (en el caso de LASEK) o manualmente (en el caso de PRK). En la primera técnica se recoloca el epitelio tras la ablación con láser excimer, mientras en la segunda se deja cerrar el epitelio por segunda intención. Sus desventajas son una recuperación visual más lenta comparando con la técnica LASIK y las molestias oculares debido a la desepitelización durante los primeros 3-5 días. Sin embargo, el resultado a largo plazo es similar a LASIK y tiene la ventaja de no alterar la biomecánica corneal por no realizar un corte estromal. También se han comunicado menos casos de ojo seco después de la realización de estas técnicas. © Elsevier. Fotocopiar sin autorización es un delito. Segmentos intracorneales El queratocono es una ectasia corneal que puede ser primaria (hereditaria) o secundaria a cirugía refractiva (como post-LASIK o por traumatismo). Los hallazgos son astigmatismo irregular progresivo y un encurvamiento de la córnea central o paracentral. Se ha visto una asociación con el frotamiento ocular, especialmente en pacientes jóvenes portadores de lentes de contacto o en pacientes con alergia ocular. El tratamiento ha ido mejorando en la última década. Una de las novedades en casos no muy avanzados o en los que el trasplante corneal es una contraindicación es la colocación de segmentos intracorneales en la estroma corneal (Vídeo e6.10). La colocación de los segmentos puede ser con la técnica manual o mediante láser de femtosegundo. Su ventaja es la sencillez, al ser una cirugía no penetrante, y su reversibilidad. Glaucoma La cirugía del glaucoma básicamente persigue la disminución de la presión intraocular, ya sea favoreciendo la salida del humor acuoso, como en las cirugías filtrantes y dispositivos de drenaje, o disminuyendo la producción del humor acuoso, en los procedimientos ciclodestructivos. Existen, a su vez, numerosas técnicas asistidas mediante láser cuya finalidad principal es el aumento de salida del humor acuoso. Todas estas técnicas no están exentas de complicaciones y de limitaciones en su aplicación, por ello es muy conveniente realizar una indicación adecuada de cada una de ellas. Cirugía Filtrante La cirugía filtrante se realiza para el tratamiento del glaucoma que no responde a medicación máxima o bien si el paciente no tolera la medicación. Básicamente se practican dos tipos de intervenciones: 1. Intervenciones perforantes: trabeculectomía. 2. Intervenciones no perforantes: esclerectomía profunda no perforante. En ambas técnicas lo que se intenta es favorecer la salida del humor acuoso hacia una «filtración» subconjuntival, en la esclerectomía profunda no perforante (EPNP) también se intenta un drenaje subescleral. Trabeculectomía La trabeculectomía consiste en extraer un trozo de trabéculo. Para ello se realiza una disección de la conjuntiva, que puede ser base en limbo o base en fórnix, dependiendo de las preferencias del cirujano. Una vez se llega a la esclera se procede a disecar un tapete escleral hasta llegar al limbo córneo-escleral, penetramos en la cámara anterior a través del lecho del tapete escleral y procedemos a realizar la trabeculectomía, ya sea con un trabeculótomo o con cuchilletes o tijeras, a continuación se realiza una iridectomía con tijeras (habitualmente con la tijera de Vannas) y procedemos a cerrar el tapete escleral y la conjuntiva. e-271 e-272 parte 1 0 : C A P Í T U L O S E X T R A Esclerectomía profunda no perforante En la EPNP, la primera parte se realiza siguiendo los mismos pasos de la trabeculectomía, pero en lugar de penetrar en la cámara anterior, se lleva a cabo un segundo tapete escleral hasta el canal de Schlemm que permite extraer el techo del canal llegando hasta la membrana de Descemet, creando una membrana trabéculo-descemética que permite la salida del humor acuoso desde la cámara anterior de una forma controlada. La incidencia de complicaciones, como el aplanamiento de la cámara anterior, las fugas y desprendimiento coroideo hemorrágico son menos frecuentes que en la trabeculectomía. En ambas técnicas se puede asociar el uso de antimetabolitos, principalmente el 5-fluorouracilo y la mitomicina-C, con el fin de evitar la cicatrización y aumentar las tasas de éxito. Dispositivos De Drenaje Los dispositivos de drenaje para el glaucoma permiten la salida del humor acuoso hacia el espacio subconjuntival. Esto se consigue por medio de un dispositivo que está conectado a un tubo que va insertado habitualmente en la cámara anterior, aunque también puede ir insertado en la cavidad vítrea. Estos sistemas pueden disponer de una válvula que limita el flujo de salida del humor acuoso, con lo que la presión intraocular (PIO) no podrá ser demasiado baja, y los que no poseen válvula, por lo que deben ser anulados durante la cirugía hasta que no se ha encapsulado el dispositivo. Los más frecuentemente utilizados son los de Ahmed (valvulado) y los de Baerveldt y Molteno (no valvulados). Las indicaciones básicas serían los glaucomas refractarios en los que han fracasado diversas cirugías filtrantes, los glaucoma uveíticos y el glaucoma neovascular, pero cada vez surgen más partidarios de colocar dispositivos de drenaje como cirugía inicial del glaucoma crónico simple. El implante habitual de los dispositivos de drenaje es por debajo de la cápsula de Tenon, por detrás de la inserción de los músculos recto externo y recto superior, en el cuadrante temporal superior, con el tubo que penetra en cámara anterior o en la cavidad vítrea protegido en su trayecto, ya sea por un tapete escleral o con parches que pueden ser de pericardio o de fascia lata. Trabeculoplastia Láser 1. La trabeculoplastia láser puede dividirse en clásica, realizada con láser de argón y la selectiva, realizada con láser de Nd-YAG. 2. La trabeculoplastia consiste en realizar una serie de impactos en la malla trabecular con el fin de mejorar la salida del humor acuoso por ellos. 3. Trabeculoplastia clásica (ALT). Se realiza con láser de argón. La energía aplicada depende del nivel de pigmentación de la malla y se puede efectuar en 180° con 40-50 impactos, o 360° con 80-100 impactos. Las indicaciones básicas son: glaucoma primario de ángulo abierto, pigmentario, seudoexfoliativo, sobre todo en pacientes mayores de 40-50 años. 4. La trabeculoplastia selectiva con láser (SLT) es una variante de la trabeculoplastia con láser de argón (ALT). La SLT utiliza un láser de neodimio (Nd)-YAG que actúa selectivamente sobre las células pigmentadas del trabeculum sin alteración térmica de las estructuras adyacentes. La tasa de éxito al año con SLT oscila entre el 58 y el 93%. Iridotomía La iridotomía periférica (IPL) consiste en realizar uno o varios orificios en la periferia del iris mediante láser, habitualmente láser de Nd-YAG, aunque también se ha utilizado láser de argón. La IPL es básica para tratar formas agudas y crónicas del cierre angular. La IPL rompe el bloqueo pupilar y facilita la apertura del ángulo camerular. Iridoplastia La iridoplastia periférica con láser trata de alejar el iris de la malla trabecular mediante la contracción del tejido del iris periférico. Se aplica láser argón mediante una lente de contacto a la periferia del iris. Puede utilizarse para el tratamiento de los ataques agudos de ángulo cerrado de forma primaria o cuando la IPL ha fracasado, sobre todo en los casos de síndrome de iris plateau. Trabeculotomía El procedimiento se basa en la disección del canal de Schlemm con la ayuda del trabeculótomo y la rotación del mismo hacia la cámara anterior en ambos sentidos tratando entre 130 y 180°. La indicación principal de la trabeculectomía y donde se han obtenido las tasas de éxito más importantes ha sido en el glaucoma primario congénito con córnea opaca, ya que la técnica no necesita la visualización directa del ángulo. Goniotomía Consiste en rasgar la membrana de Barkam, situada en un ángulo irido-corneal que no se ha acabado de desarrollar, con la punta del goniótomo. Se realiza entrando en la cámara anterior y es necesaria la buena visualización del ángulo, para lo que se usa una lente de exploración angular directa apoyada en la córnea. La goniotomía es una de las técnicas para el tratamiento del glaucoma infantil con córnea transparente. Procedimientos Ciclodestructivos Los procedimientos ciclodestructivos intentan conseguir la disminución de la PIO causando la lesión selectiva de los procesos ciliares que son los encargados de la secreción del humor acuoso. Para ello se han utilizado diferentes fuentes de energía como diatermia, microondas, ultrasonidos, crioterapia o láseres. Estos últimos (sobre todo el E 6 | C i r u gí a of talmológi c a láser de diodo) son los más empleados en la actualidad. Habitualmente se aplican de forma transescleral, aunque hay ciertos modos de aplicación a través de la pupila o incluso endoocular, con visualización endoscópica. Las indicaciones más habituales serían el glaucoma absoluto, sobre todo con dolor, y los glaucomas refractarios tras múltiples intervenciones y mal control tensional. El mayor riesgo de los procedimientos ciclodestructivos es el sobretratamiento que conduce hacia una hipotonía grave y a phthisis bulbi. Vítreo-Retina La vitrectomía es, en la actualidad, la técnica quirúrgica más común en la cirugía de vítreo-retina. Tanto la vitrectomía como la cirugía escleral, de manera aislada o combinadas, resultan técnicas quirúrgicas muy eficaces en el tratamiento del desprendimiento de re­ tina. © Elsevier. Fotocopiar sin autorización es un delito. Vitrectomía Por Pars Plana E Indicaciones La vitrectomía por vía pars plana es una técnica quirúrgica que tiene como finalidad extraer el vítreo del ojo, una estructura gelatinosa que rellena el globo ocular y que, por su consistencia y adherencia a la retina, no debe ser extraída con una simple aspiración. La vitrectomía requiere el uso de un sofisticado dispositivo de corte y aspiración denominado vitréctomo, una fibra óptica de iluminación y de un sistema de infusión continua de suero fisiológico para mantener la tonicidad ocular y de algún modo sustituir el gel vítreo extraído. Todo ello se insertará en el interior del ojo a través de pequeñas incisiones esclerales denominadas esclerotomías. Utilizaremos un microscopio quirúrgico y lentes de contacto con aumentos y campos de ampliación variables, lo que permitirá una visualización perfecta de la cavidad vítrea y de la retina, tanto central como periférica. Existen otros instrumentos, como las sondas de láser y de crioterapia, los sistemas de diatermia (para coagular los vasos sangrantes), múltiples tipos de pinzas y tijeras, sistemas de taponamiento interno (elementos que de manera temporal o permanente sostienen la retina mientras cicatriza), etc. La técnica quirúrgica consiste en retirar la conjuntiva y la cápsula de Tenon para exponer la esclera, seleccionamos la posición de las esclerotomías para los instrumentos, habitualmente en localización nasal y temporal separándolas unos 170°, y para la infusión, en la región temporal en el canto externo. Realizamos diatermia bipolar de los vasos epiesclerales y con un esclerótomo (estilete de doble corte) de 1,4 mm, para instrumentos de 20 G, realizamos primero la esclerotomía para colocar la cánula de infusión. Una vez se ha comprobado que la infusión está dentro del espacio vítreo, se abre aquélla y se procede a la realización de la esclerotomías para los instrumentos. Lo ideal sería que estas vías de entrada se realicen a 4 mm del limbo en pacientes fáquicos y a 3 o 3,5 mm en pacientes afáquicos o seudofáquicos. La extracción del vítreo debe iniciarse desde la parte posterior central hacia la anterior periférica, en los 360° del globo, evitando movimientos bruscos y contro- lando los niveles de aspiración y corte para evitar tracciones sobre la retina, así como dirigiendo de forma adecuada la luz para iluminar en todo momento la zona de trabajo. Una vez terminada la vitrectomía, se suturarán las esclerotomías para los instrumentos, se extraerá y suturará la infusión y, finalmente, se cerrará la conjuntiva. Las indicaciones más comunes de la vitrectomía son las siguientes: 1. Complicaciones de la diabetes, por ejemplo, hemorragia vítrea, edema macular diabético traccional, desprendimientos traccionales de retina, etc. 2. Cirugía del desprendimiento de retina. 3. Luxaciones de cristalino o de lentes intraoculares. 4. Síndromes de la interfase vitreorretiniana: membranas epirretinianas, agujeros maculares y síndromes de tracción vitreomacular. 5. Endoftalmitis (infección intraocular grave) y vitritis (inflamación intraocular). Con el fin de recoger muestras vítreas para cultivo y para inyección de antibióticos intravítreos. 6. Traumatismos oculares con retención de cuerpo extraño intraocular. En la actualidad, la aparición de nuevos sistemas de vitrectomía de menor calibre, del tipo 23 y 25 e incluso 30 G, ha convertido a esta cirugía en una técnica mínimamente invasiva y sin suturas, con resultados visuales comparables con los obtenidos con la vitrectomía clásica y con una mejora evidente de la calidad de vida del paciente, al disminuir las molestias y acelerarse el tiempo de recuperación. Desprendimiento De Retina Existen dos grupos de técnicas: empujar la pared del ojo desde fuera para contactar con el agujero de la retina, denominada procedimiento de indentación escleral, o empujar la retina hacia la pared escleral desde dentro, a través de la vitrectomía. En cuanto a la vitrectomía, sólo cabe añadir a lo ya comen­ tado que las vitrectomías por desprendimiento de retina pueden ser cirugías complejas, que requerirán múltiples maniobras. De manera casi invariable inyectaremos perfluorocarbono líquido, un líquido pesado que servirá para «planchar» la retina desprendida. Para cerrar los desgarros retinianos nos valdremos de la realización de impactos de láser (quemadura por calor), o de criocoagulación (quemadura por frío). Realizaremos retinopexia neumática, es decir, taponaremos internamente los desgarros retinianos y mantendremos la retina reaplicada mientras cicatriza, por medio de la inyección de aire o gases inertes, que serán lentamente reabsorbidos y reemplazados por los fluidos normales del ojo. En casos más complicados el taponamiento lo haremos con aceite de silicona, que persistirá en el globo hasta su extracción quirúrgica. Incluso en algunos casos permanecerá de por vida en el globo ocular. Cerclaje En cuanto a los procedimientos esclerales, cabe comentar sólo el cerclaje o exoplante circunferencial. Se trata de un e-273 e-274 parte 1 0 : C A P Í T U L O S E X T R A «cinturón» de silicona de aproximadamente 4 mm de grosor que se sutura de manera permanente a la pared escleral. Éste previene las tracciones de la base de vítreo y previene la recidiva del desprendimiento de retina. Conclusiones – La cirugía en oftalmología es muy variada y completa y abarca todas las estructuras anatómicas del globo ocular y sus anejos. – La cirugía oftalmológica pretende mantener, preservar o recuperar, tanto estructural como funcionalmente, las funciones del órgano de la visión; en otros casos se realiza con el fin de prevenir futuras patologías, o incluso para mejorar la calidad de vida de los pacientes, como en el caso de la cirugía refractiva o en muchos casos de la cirugía oculoplástica. – Debido a alta especialización y al continuo avance de la cirugía oftalmológica, es de gran importancia conocer las diferentes técnicas y realizar correctamente la indicación de cada una de ellas. Bibliografía American Academy of Ophthalmology. The repair of rhegmatogenous retinal detachment. Ophthalmology 1996;103:1313-24. Barraquer J, Rutllán J. Microsurgery of the Cornea, an Atlas and Textbook. Barcelona: Ediciones Scriba, S.A., 1984. Barraquer J. Microcirugía de los glaucomas. Barcelona: Institut Barraquer, 1997. Benítez J, Durán J, Rodríguez MT. Superficie Ocular (Ponencia Oficial de la Sociedad Española de Oftalmología, 2004). Madrid: Industria Gráfica MAE, S.L., 2004. Berard PV, Queré MA, Roth A, Spielmann A, Voillez M. Chirurgie des strabismus. París: Ponencia de la SFO, 1984. Boyd BF. Highlights of Ophtalmology. Atlas de cirugía ocular. Panamá: World Atlas Series, 1997. Brancato R, Carassa RG, Bettin P, Fiori M, Trabucchi G. Contact trans-scleral cyclophotocoagulation with diode laser in refractory glaucoma. Eur J Oph­ thalmol 1995;5:32-9. Brown M, Reay H, et al. Glaucoma Laser Treatment Parameters and Practices of ASCRS Members-1999 Survey. Journal of Cataract and Refractive Surgery 2000;26:755-65. Burian H, Von Noorden GK. Binocular vision and ocular motility. St. Louis: C.V. Mosby, 1974. Clark RA, Miller JM, Demer JL. Location and stability of rectus muscle pulleys: muscle paths as a function of gaze. Invest. Ophalmol Vis Sci 1997;38:227. Collin JRO. A manual of systematic eyelid surgery. (3.ª ed.). Oxford: ButterworthHeinemann, 2006. Coret A, Cavero L. Algoritmos de Decisión en Cirugía Refractiva. Madrid: Ergón, 2003. Eid TE, Katz LJ, Spaeth GL, Augsburger JJ. Tube-shunt surgery versus neodymium: YAG cyclophotocoagulation in the management of neovascular glaucoma. Oph­ thalmology 1997;104:1692-700. Ferris J, Davies P. Cirugía de estrabismo, Barcelona: Elsevier, 2009. Grand GM. Basic and clinical science course. Pediatric Ophthalmology and Strabismus. San Francisco: American Academy of Ophtalmology, 1998. Gutiérrez E, Montero M. Dispositivos de drenaje para glaucoma (complicaciones). Madrid: Ediciones Ergón, S.A. 2002. Helveston EM. Surgical management of strabismus. St. Louis: Mosby, 1998. Helveston EM. Surgical management of strabismus. An atlas of strabismus surgery. (4.ª ed.). St. Louis: Mosby, 1993. Ho SF, Fitt A, Frimpong-Ansah K, Benson MT. The management of primary rhegmatogenous retinal detachment involving fovea. Eye 2006;20:1049-53. John T (ed.). Corneal Endothelial Transplant. DSAEK, DMEK, DLEK. Maryland: Jaypee-Highlights Medical Publishers, Inc., 2010. Kanski JJ. Oftalmología Clínica. (5.ª ed.). Barcelona: Mosby/Doyma Libros, S.A., 2004. Latina MA, Sibayan SA, Shin DH, Noecker RJ, Marcellino G. Q-switched 532-nm Nd:YAG laser trabeculoplasty (Selective Laser Trabeculoplasty). Ophthalmology 1998;105:2082-90. Lorente R, Mendicute J. Cirugía del Cristalino. (Ponencia Oficial de la Sociedad Española de Oftalmología 2008). Madrid: Gráficos Peñalara S.A., 2008. Machemer R. The development of pars plana vitrectomy: a personal account. Graefes Arch Clin Exp Ophthalmol 1995;233(8):453-68. Mermoud A, Schnyder CC. Nonpenetrating filtering surgery in glaucoma. Curr Opin Opthalmol 2000;11:151-7. Molteno AC, Straughan JL, Ancker E. Long tube implants in the management of glaucoma. S Afr Med J 1976;50(27):1062-6. Pastor SA, Singh K, Lee DA. Cyclophotocoagulation, a report by the American Academy of Ophthalmology. Ophthalmology 2001;108:2130-8. Perea J. Estrabismos. (1.ª ed.). Toledo: Artes Gráficas de Toledo, SAU, 2008. Prieto-Díaz J. Estrabismos. (1.ª ed.). Toledo: Artes Gráficas de Toledo, SAU, 2005. Rodríguez Sánchez. Técnicas quirúrgicas para el tratamiento de la DVD. Análisis de resultados y complicaciones. Acta Estrabológica 1996;25:107-11. Roth A, Speeg-Shatz C. La chirurgie oculo-motrice. Paris: Masson, 2008. Schwarts SG, Flynn HW. Primary retinal detachment: scleral buckle or pars plana vitrectomy. Current Opin Ophthalmol 2006;17(3):245-50. Tayers AG, Collin JR. Colours atlas of ophtalmic plastic surgery. Edinburgh: Churchill Livingstone, 1995. Temprano J. Queratoplastias y Queratoprótesis (Ponencia Oficial de la Sociedad Española de Oftalmología 1991). Barcelona: Artbook 90, 1991. Toledano N, Martínez Grau G, Pradas Sánchez C, Sanz López A, Blanco Mateos G. Cirugía palpebral y periocular. Madrid: Sociedad Española de Oftalmología, 2009. Walland MJ. Diode laser cyclophotocoagulation: long term follow up of a standardized treatment protocol. Clin Exp Ophthamol 2000;28(4):263-7. Wright KW. Color atlas strabismus surgery. Strategies and techniques. St. Louis: Mosby, 2007. Wright KW. Pediatric Ophthalmology and strabismus. St. Louis: Mosby, 1995. Yeshurum I, Rock T, Bartov E. Modified sutureless sclerotomies for pars plana vitrectomy. Am J Ophthalmol 2004;138:866-7. E 6 | C i r u gí a of talmológi c a Autoevaluación E6 1.Cuál de estas afirmaciones es falsa respecto a la queratoplastia: a. En la queratoplastia penetrante se realiza un injerto de espesor total. b. La indicación principal de la DSAEK son las patologías corneales que afectan al endotelio. c. La indicación principal de la DALK son los problemas de la estroma corneal que no afectan al endotelio. d. La queratoplastia lamelar superficial puede realizarse de manera manual o automatizada. e. Todas son verdaderas. Correcta: e. 2. Indica la afirmación correcta respecto a la cirugía en el glaucoma: a. La trabeculectomía presenta un índice de complicaciones inferior al de la esclerectomía profunda no perforante. b. La trabeculoplastia láser puede realizarse con láser argón o con láser de Nd-YAG, denominándose en este caso trabeculoplastia láser selectiva. c. El uso de antimetabolitos en la cirugía del glaucoma no tiene ninguna indicación. d. La goniotomía está indicada en casos de glaucoma congénito cuando la córnea no es transparente. e. Los procedimientos ciclodestructivos son de primera elección para el glaucoma crónico simple. Correcta: b. 3. Indica cuál de las siguientes no es una indicación de la vitrectomía: © Elsevier. Fotocopiar sin autorización es un delito. a. Complicaciones de la diabetes como edema macular diabético. b. Desprendimiento de retina. c. Hemovítreo. d. Cuerpo extraño intraocular alojado en la cámara anterior. e. Endoftalmitis. Correcta: d. 4.De estos tratamientos quirúrgicos, ¿cuál sería el de elección en el caso de un paciente con ectropión cicatricial de párpado inferior? a. Técnica de la tira tarsal. b. Tratamiento con toxina botulínica. c. Injerto de piel de espesor completo con tira tarsal. d. Resección en cuña palpebral. e. Sutura directa a periostio. Correcta: c. 5.Niño de 2 años con ptosis bilateral congénita, función del elevador de 1 mm en ambos ojos (AO), distancia reflejo margen de 0 en AO y Bell positivo en AO. Presenta ambliopía AO y 1 de hipermetropía en ambos ojos. ¿Cuál sería la conducta a seguir? a. Operar de suspensión al frontal usando pericardio bovino de AO. b. Operar de resección de la aponeurosis del elevador AO. c. Esperar a operar al paciente a la edad de 7-8 años. d. Operar de suspensión al frontal con fascia lata del paciente AO. e. a y c son correctas. Correcta: a. e-275 e-276 parte 1 0 : C A P Í T U L O S E X T R A Temas de trabajo E6 1. Indicaciones y técnicas en la cirugía del glaucoma. 2. Diferentes técnicas de cirugía corneal. Electrofisiología ocular Objetivos de aprendizaje ● Conocer los principios básicos de la electrofisiología ocular. ● Conocer la su utilidad y las aportaciones al diagnóstico de las enfermedades oculares. Palabras clave/Key words Electrofisiopatología Potencial córneo-retiniano Potenciales evocados visuales Electrophysiopathology Corneoretinal potential Visual evoked potential Fundamentos Anatomofisiológicos Y Psicofisiológicos La electrofisiología ocular es la ciencia que estudia y recoge los cambios eléctricos del globo ocular. La retina es considerada como una prolongación periférica del cerebro y presenta, como toda estructura nerviosa, potenciales de reposo y potenciales de acción. El globo ocular se comporta como un dipolo eléctrico, con una diferencia de potencial entre la córnea y el polo posterior próxima a los 6 mV. Las capas externas de la retina son electronegativas en relación con las internas, que son electropositivas. La córnea recibe el potencial positivo de las capas internas retinianas, en tanto que el entorno periocular recibe el potencial negativo de las capas externas. Este potencial córneo-retiniano relajado, sin la menor influencia de estimulación luminosa, fue descubierto en 1849 por Dubois-Reymond, quien lo denominó «potencial córneo-retiniano o potencial de reposo». Los potenciales de acción se obtienen, después de haber provocado respuesta de la retina, ya sea mediante estímu­ los luminosos, con diferente adaptación a la luz y diversas longitudes de onda, o bien con estímulos estructurados (pattern), que pueden ser en forma de bandas o cuadrados. © 2012. Elsevier España, S.L. Reservados todos los derechos e7 Las técnicas de electrofisiología ocular permiten re­ coger trazados que corresponderán a diversas y diferentes capas del órgano, así como de su estado, ya sea en reposo o en acción. Por tanto, se pueden distinguir para su estudio, por un lado, los potenciales de reposo y de acción de la retina, que se van generar en diferentes capas de ésta y, por otro, las variaciones del potencial eléctrico en las áreas corticales ante la llegada del influjo nervioso visual (Figura e7.1). 1. Potencial de reposo de la retina. a) Electrooculograma (EOG). – Epitelio pigmentario. 2. Potenciales de acción: a) Electrorretinograma (ERG). – Fotorreceptores y células bipolares. b) Pattern electrorretinograma (PERG). – Células ganglionares. 3. Potenciales evocados visuales: PEV y pattern potenciales evocados visuales (PPEV). a) Vías ópticas y corteza occipital. El ojo es un receptor doblemente selectivo, existiendo una selectividad según la longitud de onda y según el nivel luminoso. El ser humano ve sólo entre las longitudes de onda comprendidas entre 400 y 750 nanómetros (nm), alcanzándose la máxima sensibilidad del ojo entre los valores de longitud de onda comprendidos entre 507 y 555 nm. Su representación gráfica constituye la curva de eficacia luminosa relativa (Figura e7.2). El máximo de sensibilidad del ojo según el nivel luminoso es variable según que éste se encuentre adaptado a la luz o a la oscuridad: 1. Visión fotópica (luminancia (8 ≥ UL psb): máxima para 555 nm. 2. Visión escotópica (luminancia ≥ 4,5 UL psb): máxima para 507 nm. 3. Visión mesópica (niveles luminosos intermedios): máxima entre 507 y 555 nm. Esto es importante para explicar la dualidad retiniana: los conos son responsables de la visión fotópica, mientras que los bastones lo son de la escotópica. Por otra parte, la función fotópica es la de la visión coloreada y del detalle, mientras que la escotópica es la de una visión acromática, pero muy sensible a los niveles luminosos muy bajos. e-277 e-278 p a r t e 1 0 : C AP Í T U L O S E X T R A Con el objetivo de evitar en lo posible esta disparidad, la Sociedad Internacional de Electrofisiología Clínica de la Visión (ISCEV) ha publicado unas recomendaciones que debemos intentar seguir, básicamente para unificar los resultados. Electrooculograma Figura e7.1. Esquema de las capas de la retina y origen de las distintas pruebas de electrofisiología ocular. Asimismo, cómo veremos más adelante, la dualidad retiniana se proyecta en localización cortical, pudiendo demostrarse anatómica y fisiológicamente. La utilidad clínica y las principales indicaciones del examen electrofisiológico ocular puede verse en la Tabla e7.1. La manera de conducir la anamnesis y la exploración oftalmológica con la ayuda de estas pruebas puede verse en la Figura e7.3. Desde el punto de vista práctico, dado que existe una gran diversidad de aparatos, sus resultados no son comparables; por lo tanto, es imprescindible que cada servicio o clínica oftalmológica elabore sus resultados y sus condiciones de examen. El electrooculograma (EOG) es la medida de la variación de un potencial de reposo, de unos 6 mV, que existe entre la córnea y el polo posterior del globo ocular. La córnea sería positiva con relación a la parte posterior o retina, que se­ ría negativa. Este potencial de reposo varía bajo el efecto de la incidencia de la luz sobre la retina, variación que se puede hacer evidente por un desplazamiento ocular. El EOG explora la integridad del epitelio pigmentario, pero, además, mide el complejo que forman los fotorreceptores en su segmento externo con el epitelio pigmentario. En la clínica se evalúan las variaciones del potencial córneo-retiniano combinando a los movimientos oculares de velocidad y amplitud constantes una adaptación retiniana a diferentes niveles luminosos, con lo que se obtienen unas respuestas bajas en la oscuridad, que es cuando las ondas disminuyen más, es decir, se acorta la diferencia de voltaje. Por el contrario, al iluminar el ojo se aumenta la diferencia, que llega hasta a duplicarse en el ojo normal. El valor de la relación entre el pico luz (LP: light peak) y la depresión en la oscuridad (DT: dark through) se denomina cociente de Arden LP/DT, cuyo valor es normalmente Tabla e7.1 Principales indicaciones de la exploración electrofisiológica Sospecha de diagnóstico ERG Albinismo + Diabetes y patología vascular + Distrofias retinianas hereditarias + PERG EOG PEVF + PEVE + + Glaucoma + + Neuritis retrobulbar + + Neuropatía tóxica + Niños con pérdida visual + + Opacidad de medios + + Pérdida de visión inexplicable + Sospecha de lesión intracraneal Traumatismos + + + + + + + + + ERG: electrorretinograma; PERG: pattern electrorretinograma; EOG: electrooculograma; PEVF: potenciales evocados visuales de flash; PEVE: potenciales evocados visuales estructurados. E 7 | E l e c tro f i s iologí a oc ular © Elsevier. Fotocopiar sin autorización es un delito. Figura e7.2. Curva de eficacia luminosa relativa. Figura e7.3. Guía diagnóstica con pruebas de electrofisiología ocular tras la anamnesis y exploración oftalmológica. superior a 1,85, y que se encuentra alterado en la patología del epitelio pigmentario (Figuras e7.4 y e7.5). Su utilización es importante en las enfermedades hereditarias maculares, sobre todo en la distrofia macular de Best, en la que característicamente el estudio de ERG es normal y el EOG no lo es. En algunas intoxicaciones, como ocurre con las causadas por antipalúdicos de síntesis, puede tener cierto valor por la precocidad de su alteración, así como en algunas distrofias retinianas y en las alteraciones que cursan con ceguera nocturna estacionaria y progresiva. e-279 e-280 p a r t e 1 0 : C AP Í T U L O S E X T R A Figura e7.4. EOG normal (ambos ojos). Electrorretinograma Flash Es la respuesta tardía del potencial de acción del segmento interno de los fotorreceptores de la retina, inducida por estímulos luminosos (flash). La actividad global del conjunto de los elementos retinianos, si se estimulan con luz blanca, se va ­manifestar en forma de una onda polifásica, en la que se identifican una serie de accidentes negativos y positivos, respecto a la línea isoeléctrica. Se llaman, por orden de aparición, onda a (negativa), onda b1 y b2 (positiva) y termina por una larga y tenue onda c (positiva). En la cresta ascendente de la onda b1 se aprecian unas pequeñas ondas, llamada ondas e o potenciales oscilatorios (Figura e7.6). Origen De Las Ondas El ERG es un fenómeno retiniano dependiente esencialmente del estado ocular y se opina que es independiente de la transmisión del influjo nervioso. Cuando el estímulo luminoso alcanza el segmento externo de los fotorreceptores, descompone el pigmento visual y se produce una alteración del equilibrio iónico (Figuras e7.7 y e7.8). Los elementos sensoriales retinianos que intervienen en este proceso son los fotorreceptores, conos y bastones, y las células bipolares. En la retina humana, la distribución de los fotorreceptores es heterogénea y con una densidad relativa. Se estima que el número de bastones (unos 130 millones), es más de trece veces superior al de conos (unos 7-8 millones). En el centro de la mácula, sólo hay conos y su número se va a reducir progresivamente conforme nos alejamos del centro y nos acercamos a la periferia, a la par que aumenta el número de bastones. En la foveola no hay conos azules, sino unos 2.500 rojos y verdes. En la mácula hay unos 150.000 conos. La periferia y media periferia de la retina están casi en su totalidad pobladas por los bastones, aunque la densidad mayor de estos fotorreceptores se E 7 | E l e c tro f i s iologí a oc ular Figura e7.5. EOG anormal (ambos ojos). © Elsevier. Fotocopiar sin autorización es un delito. encuentre a unos 20° del centro. A pesar de la gran diferencia numérica de estas células, el 20-25% de la amplitud de la respuesta eléctrica corresponde a los conos, un mínimo a los conos azules y el resto, a partes iguales, es atribuible a los rojos y verdes. Figura e7.6. ERG flash normal con sus distintas ondas. Las células bipolares están situadas en la nuclear interna y son el enlace que une los fotorreceptores con las células ganglionares. Se distinguen tres tipos de células bipolares: para bastones, para conos y para un solo cono. Figura e7.7. Fenómeno de despolarización y cambio del equilibrio iónico en los segmentos externos de los receptores. e-281 e-282 p a r t e 1 0 : C AP Í T U L O S E X T R A Figura e7.10. Respuesta combinada. Respuesta flicker Figura e7.8. Fenómeno de hiperpolarización consecuente y cambio del equilibrio iónico en los segmentos externos de los receptores. Medidas Y Valores De Los Componentes De Un Electrorretinograma Se estandarizan siete tipos de respuestas o exploraciones (ISCEV): Bastones Se realiza tras la adaptación a la oscuridad. Obtendremos como respuesta un trazado que sólo contendrá la onda b2, exclusivamente escotópico (Figura e7.9). Respuesta máxima combinada A continuación se utiliza el flash estándar, estímulo blanco de alta intensidad con los ojos adaptados a la oscuridad. La respuesta que se produce es mixta, ondas a y b, una combinación de los sistemas de conos y bastones (Figuras e7.10 y e7.11). Potenciales oscilatorios Seguidamente, aumentando el filtro inferior de 75 a 100 Hz para eliminar las ondas lentas (a y b), con los ojos adaptados a la oscuridad y utilizando el mismo flash blanco estándar, se evidencian los componentes rápidos por en­ cima de 100 Hz «potenciales oscilatorios u ondas e» (Figu­ ra e7.12). Respuesta simple de conos al flash El paciente debe estar adaptado a la luz, para eliminar el sis­ tema escotópico. Los bastones llegan a suprimirse por un fondo en la superficie de la cúpula Ganzfeld con una luminancia de 17-34 cds.m−2 (5 a 10 fL) (Figuras e7.13 y e7.14). Se realiza presentando los flashes con una frecuencia de 30 herztios, bajo la misma iluminación de fondo inhibidora de bastones (Figuras e7.15 y e7.16). Adaptoelectrorretinograma El adaptoelectrorretinograma (AERG) consiste en recoger trazados a intervalos regulares (ERG dinámico), con el paciente adaptado a la oscuridad. Previamente hemos realizado un deslumbramiento con luz blanca (2-3 minutos), para normalizar el estado de adaptación inicial de la retina. Habremos anulado entonces la onda b2. Se evidenciarán, simultáneamente, la estabilidad de las ondas fotópicas (a y b1) y la evolución de la onda escotópica (b2) que aumenta de amplitud mientras transcurren los minutos de adaptación a la oscuridad. Llegará a un punto en que la amplitud de las dos ondas será igual. Éste es el denominado punto alfa adaptoelectrorretinográfico, en el cual b1/b2 es igual a uno. Electrorretinograma de fluorescencia Respuesta inducida por una estimulación luminosa ultravioleta (longitud de onda 365 nm). En circunstancias normales los trazados eléctricos no son detectables, porque la eficacia luminosa de los fotones ultravioletas es prácticamente cero. Sin embargo, si la retina estuviera impregnada de alguna sustancia fluorescente, los fotones ultravioletas adquirirían una eficacia sensorial azul-verde. En consecuencia, obtendríamos una respuesta escotópica (onda b2), ya que la longitud de onda de los fotones de fluorescencia es corta. Con esta prueba se puede detectar el depósito de sustancias como la cloroquina potencialmente tóxicas para el EPR antes de inducir toxicidad, en un estadio subclínico. Otras pruebas de detección precoz habituales en la clínica práctica en este estadio aún son negativas, como la campimetría de 10° centrales, el test de Farnsworth-Munsell y la angiografía fluoresceínica. Aplicaciones Clínicas Del Electrorretinograma (Tablas e7.2 y e7.3) Figura e7.9. Respuesta de bastones. Las alteraciones en el ERG suponen una información muy importante para llegar a un correcto diagnóstico en un gran número de afectaciones retinianas, como las distrofias de E 7 | E l e c tro f i s iologí a oc ular © Elsevier. Fotocopiar sin autorización es un delito. Figura e7.11. Respuesta combinada: ERG normal en el ojo derecho y abolido en el ojo izquierdo. Figura e7.12. Potenciales oscilatorios. Figura e7.13. Respuesta de conos. los fotorreceptores, la ceguera nocturna, la retinosquisis juvenil y la amaurosis congénita de Leber. El control electrorretinográfico tiene también un gran valor, como seguimiento de la evolución de enfermedades como retinitis pigmentaria, distrofia de conos y bastones o coroideremia. Es importante para determinar el grado de toxicidad de diversos fármacos para la retina, e incluso puede alertarnos e-283 e-284 p a r t e 1 0 : C AP Í T U L O S E X T R A Figura e7.14. Respuesta de conos: son normales en ambos ojos. Pattern-Electrorretinograma Figura e7.15. Flicker. antes de que tal efecto se produzca (antipalúdicos de síntesis). Nos indica el grado de agresión de carencias como la avitaminosis A y la nociva presencia de ciertos cuerpos extraños intraoculares. Por último, el estudio de la electrofisiología ocular será importante para normativas, protocolos y calibración de nuevos medicamentos o para terapias conducidas para la mejoría o la curación de enfermedades que afecten al área retiniana. Se define como pattern-electrorretinograma (PERG) la res­ puesta eléctrica de la retina, es decir, el ERG obtenido tras una estimulación estructurada, basada en modificaciones de contraste con luminancia constante. Desde los trabajos de Maffei y Fiorentini se puede afirmar que el origen del PERG se encuentra fundamentalmente en las células ganglionares. Estudios realizados con microelectrodos penetrantes han confirmado el papel atribuido a dichas células retinianas (Figura e7.17). Aunque es en estas células ganglionares en las que se genera la respuesta del trazado de un PERG, es impres­ cindible que las capas retinianas que la preceden no estén alteradas. De no ser así todas las respuestas estarán falseadas, ya que serán anormales. De acuerdo con la secuencia de estimulación distinguimos: 1. El PERG «reversal» (estimulación alternante). Se utilizan como estímulos unas barras verticales o un damero, blancos y negros o de dos colores seleccionados previamente, los cuales se muestran en un monitor de televisión. La pantalla mantiene una luminancia constante, y las barras o los cuadrados del damero cambian de brillantes a opacos, o de un color al otro, alternándose E 7 | E l e c tro f i s iologí a oc ular © Elsevier. Fotocopiar sin autorización es un delito. Figura e7.16. Flicker: normales en ambos ojos. Tabla e7.2 ERG muy afectado. Principales cuadros Diagnóstico Alteración ERG Evolución Coroideremia Alteración ERG escotópico Abolición Degeneracion pigmentaria Aumento latencia onda «b» Abolición Desprendimiento de retina Variable (depende extensión) Puede recuperarse Inflamación-infección Según extensión _ Metalosis: intoxicación Disminución onda «b» Abolición Obstrucción arteria oftálmica Disminución onda «b» Extinción Retinosquisis Disminución onda «b» Variable e-285 e-286 p a r t e 1 0 : C AP Í T U L O S E X T R A Tabla e7.3 Disociaciones entre electrooculograma (EOG) y electrorretinograma (ERG) Diagnóstico EOG ERG Distrofia «en alas de mariposa» A N Distrofia macrorreticular N/A N Distrofia reticular de Sjögren N/A N Disco viteliforme A N Drusas familiares N/A N Fundus flavimaculatus N/A N Coroideremia A N Degeneración pigmentaria A N Disco viteliforme A N Portadores N: normal; A: anormal. Figura e7.17. Diferentes tipos de células ganglionares existentes en los mamíferos, desde el punto de vista fisiológico: a) ganglionares «X», células pequeñas de velocidad de conducción lenta (sistema «parvocelular») que son analizadores de contrastes espaciales y como consecuencia de formas; b) ganglionares «Y», células grandes de velocidad de conducción rápida (sistema «magnocelular»), capaces de detectar movimientos y las caracterís­ ticas temporales de los estímulos (imagen cortesía del Prof. Solé). Figura e7.18. PERG «transient». separados: una onda precoz positiva, denominada P50 o P1 («b») (40-60 ms), que se considera asociada con la iluminación del estímulo, aunque parcialmente puede estar originada por las células que generan el ERG por flash. Se sigue de una inflexión negativa, onda N95 o N2 (90-100 ms), que está estrechamente relacionada con el contraste y con los factores específicos del estímulo. Algunos autores describen como la onda más precoz a una inflexión negativa, que se denomina N35. 2. Si el proceso de inversión es superior a diez veces por segundo, la respuesta aparece en forma de ondas sinusoidales, lo que se denomina «steady-state response» y se requiere un análisis de Fourier para determinar la amplitud y fase de cambio relativo del estímulo (Figura e7.19). La prueba es tan delicada que se ve afectada incluso por defectos de refracción, de forma tal que éstos deben ser corregidos previamente para que el estímulo alcance la retina con la mayor nitidez posible. A este respecto debemos subrayar la importancia de la frecuencia espacial, cuya connotación conlleva el tamaño de los estímulos (cuadrados). Si éstos son pequeños (frecuencia espacial alta) estimularemos fundamentalmente la región foveal. esta situación entre iluminación y oscuridad, de forma sincronizada. 2. PERG «on-set» u «off-set». El estímulo aparece y desaparece de forma brusca del monitor manteniéndose una luminancia constante. Según la frecuencia de estimulación temporal: 1. Cuando los estímulos estructurados (pattern) se in­ vierten una o dos veces por segundo, se obtiene un «tran­ sient PERG», que se manifiesta como una respuesta única de componentes medibles (Figura e7.18). En el trazado habitual del PERG existen dos elementos Figura e7.19. PERG «steady-state». E 7 | E l e c tro f i s iologí a oc ular Con una frecuencia espacial baja (cuadrados de gran tamaño) alcanzaremos zonas retinianas más periféricas. Aplicaciones Clínicas © Elsevier. Fotocopiar sin autorización es un delito. Por las razones anteriormente expuestas, tendrán un PERG anormal todos los pacientes con degeneración macular que afecte a los fotorreceptores. Es una prueba muy objetiva de la función macular, de hecho sus primeras aplicaciones clínicas se realizaron en este ámbito. Las DMAE afectan al componente P50 (P1). En la enfermedad de Tay-Sachs que cursa con ERG normal, el PERG está alterado por su origen en las células ganglionares. Tiene también aplicación en el diagnóstico y seguimiento de neuritis ópticas, glaucomas, atrofias del nervio óptico y ambliopías. En las neuritis retrobulbares se reduce la amplitud del componente N95 (N2). En las retinopatías diabéticas también se detectan reducciones de amplitud. El hecho de que el ERGE sea una técnica de electrofisiología que monitorice una respuesta bioeléctrica con componentes que se originan en la retina proximal y que valora la integridad funcional de las células ganglionares la convierte en una interesante prueba diagnóstica para el glaucoma ya que estas son las células «diana» de esta enfermedad. Ya se han realizado numerosos estudios de ERGE en pacientes con glaucoma y de éstos se deriva el consenso claro de que, frecuentemente, se encuentran anormalidades en el ERGE de pacientes diagnosticados de GPAA. Se informa tanto de disminución en la amplitud como de aumento de latencia (o cambios de fase) de los componentes del ERGE. Otros estudios informan Figura e7.20. ERG multifocal. también de reducciones en la amplitud del ERGE en pacientes sin evidencia de disfunción clínica, pero con sospecha de glaucoma, esto es, en pacientes con hipertensión ocular. Electrorretinograma Multifocal Se trata de una técnica muy reciente que permite llevar a cabo un mapa de respuestas eléctricas de la retina central y alrededor de los grados pericentrales. Los estímulos son elementos hexagonales negros y blancos y de tamaño creciente con la excentricidad. Los cambios se hacen con una gran frecuencia y según secuencias predeterminadas y las respuestas emitidas por la retina se registran por un electrodo colocado en el fondo de saco conjuntival para dejar el eje visual libre, realizándose la prueba con la corrección óptica adecuada. Los resultados se presentan como un mapa de señales eléctricas o bien bajo forma gráfica. En estos mapas se reconoce en con­ diciones normales el pico macular y puede estudiarse la funcionalidad de las diferentes zonas retinianas (Figu­ ra e7.20). Potenciales Evocados Visuales La llegada de un influjo nervioso aferente a las áreas corticales visuales entraña una variación de su potencial eléctrico. Esta variación de potencial se denomina potencial evocado visual (PEV). e-287 e-288 p a r t e 1 0 : C AP Í T U L O S E X T R A Transmisión Del Impulso Visual Al Sistema Nervioso Central En el plano anatómico y camino hacia la corteza occipital, el mensaje visual se encuentra con el cuerpo geniculado lateral. Éste representa la unión entre la primera neurona de la cadena visual, la célula ganglionar (si no consideramos a la célula bipolar como primera neurona), y la segunda neurona, que se denomina célula talamocortical. Estas últimas forman las radiaciones ópticas y terminan en la corteza visual (Figura e7.21). En la corteza visual, la célula especializada es la célula piramidal y corresponde a la tercera y última neurona de la vía visual. La corteza visual es el territorio de recepción y de integración de los fenómenos visuales. Se localiza en el lóbulo occipital y comprende: 1. El área estriada o área 17 de Brodmann, también llamada corteza visual primaria, que corresponde al área de proyección de las radiaciones ópticas. 2. Las áreas de integración y de respuestas motrices, que son las áreas periestriadas o área 18 de Brodmann y las paraestriadas o área 19 de Brodmann. Hay que destacar, como recuerda Guérit en su tratado sobre potenciales evocados, que las áreas visuales primarias se sitúan en la cara interna del lóbulo occipital, lo que implica que la proyección del «dipolo equivalente» correspondiente a su activación se dirige hacia la superficie hemicraneal contralateral del hemisferio que se activa. También es importante, para una buena comprensión de los PEV, conocer las representaciones respectivas de los sistemas fotópicos y escotópicos, en los distintos niveles del sistema nervioso central que podemos estudiar. Sobre las proyecciones centrales que desde la retina realizan estos dos sistemas visuales, hay que tener en cuenta: 1. El hecho de que cada cono, a diferencia de los bastones, se relaciona con una sola célula ganglionar. Esto implica que la mayoría de los axones que forman el nervio óptico provienen de la parte central de la retina. Estos axones se sitúan en la parte más central en el interior del nervio óptico. 2. Las proyecciones centrales de ambos sistemas son diferentes: a) Sistema fotópico: sus proyecciones se realizan, principalmente, en la corteza occipital (áreas 17-19), por mediación de las radiaciones ópticas. b) Sistema escotópico: sus proyecciones son más difusas. Son, a la vez, subcorticales y corticales, ya sea directamente o por mediación de las proyecciones subcorticales. Las respuestas de los PEV, tanto de estimulación a flash como estructurados, dependen en gran medida de la función visual central, pues reflejan, principalmente, la actividad eléctrica cortical que se genera tras la estimulación de la retina central. Esto se debe, fundamentalmente, a la disposición de las radiaciones ópticas en la corteza occipital, lo que se denomina «retinotopía» de las radiaciones ópticas. Por una parte, la representación de la mácula en la superficie cortical es desproporcionadamente grande con respecto a la periferia del campo visual (alrededor de un tercio de la superficie de la corteza corresponde a la mácula). Existe lo que se llama el «factor de magnificación cortical» («M»), que representa la relación entre superficie cortical y área retiniana, que es mayor cuanto más central es dicha área retiniana y que se expresa en milímetros de extensión lineal de corteza correspondiente a un grado de ángulo visual a distintas excentricidades de la fóvea; como ejemplo, en la fóvea M = 5,6 mm/grado mientras que a 10° de la fóvea M = 1,5 mm/grado. Por otra parte, las proyecciones de la mácula y de las partes más centrales del campo visual son más posteriores y más cercanas al polo occipital que las proyecciones más periféricas, que proyectan a porciones mediales más profundas de la corteza calcarina y, por tanto, las primeras están más cerca de la localización del electrodo activo. Tipos De Estimulación Y Tipos De Potenciales Evocados Visuales Figura e7.21. Potenciales evocados visuales (PEV). Los registros de los PEV, ya sean provocados por estímulos visuales lumínicos o estructurados, se representan en gráficas, en las que el eje de ordenadas corresponde a la E 7 | E l e c tro f i s iologí a oc ular © Elsevier. Fotocopiar sin autorización es un delito. amplitud del fenómeno eléctrico, expresado en microvoltios (mV), y el eje de abcisas, al tiempo de aparición de aquél, medido en milisegundos (ms). El origen del eje corresponde al momento de la presentación del estímulo. De ahí que el tiempo que tarde en aparecer el PEV se denomine «latencia». Al igual que en el ERG, los estímulos que utilizamos en la práctica son de dos tipos: 1. Estímulos basados en modificaciones de luminancia: son los PEV de flash (PEVF). Se provoca la estimulación con una fuente emisora de luz intermitente, situada frente al paciente. Podemos utilizar una lámpara de estimulación o bien las llamadas «gafas de estimulación», que se adaptan al paciente, y poseen unos «diodos emisores de luz» («LED») como fuente luminosa. 2. Estímulos basados en modificaciones del contraste: los cambios de contraste se producen sin modificación de la luminancia global y manteniéndola constante, durante el tiempo de la estimulación. Éste es el tipo de estímulo que da origen a los PEV estructurados (PPEV). Esta estimulación puede variar en función de varios parámetros: a) La forma de los contrastes: el estímulo que se usa con más frecuencia es el «tablero de damas» o «damero», donde los cuadrados cambian de color alternativamente. Existen, no obstante, estímulos más simples (barras horizontales, verticales u oblicuas) y más complejos (dianas, barras sinusoidales, aspas de molino de viento, etc.). b) El área de campo visual estimulado: en función de la posición del punto de fijación y en relación con el conjunto del estímulo. Se pueden distinguir estimulaciones de campo central (las más habituales), estimulaciones de hemicampo o estimulaciones de cuadrantes. c) La frecuencia espacial de estimulación: está relacionada con el número de períodos y grados de ángulo visual. Un estímulo de alta frecuencia espacial aparece con un aspecto más «cerrado» (hay más cuadrados en el damero porque son más pequeños), que un estímulo en el que la frecuencia espacial es más baja (los cuadrados del damero son menos numerosos y más grandes). d) La frecuencia temporal de estimulación: se refiere al ritmo de alternancia del estímulo. Puede ser «brusco», cuando los cambios de contrastes se producen de manera casi instantánea, o «suave», si los cambios se llevan a cabo lentamente. Figura e7.22. Trazado de PEV flash (nomenclatura de Harding, 1974). Figura e7.23. Trazado de PEV estructurado «transitorio» (nomenclatura de ISCEV). El componente positivo es, con mucho, el más consistente y el de mayor amplitud. Además, muestra escasa variación de latencia, tanto en un mismo individuo como entre personas. Consideraciones Especiales De Los Potenciales Evocados Visuales En Niños (Figura e7.24) En el niño hay que contar con factores que pueden influir más que en el adulto en los PEV, como pueden ser el mayor número de artefactos derivados del peor contacto de los Registros obtenidos con estimulación flash La información que ofrecen es cualitativa (respuesta/no respuesta), y sólo puede ser comparable con la estimulación del ojo adelfo pero no de otro sujeto, debido a las importantes fluctuaciones interindividuales (Figura e7.22). Registros obtenidos con estimulación estructurada. Morfología estándar Se manifiesta como una onda negativa alrededor de los 75 ms, N75, una onda positiva de gran amplitud a los 100 ms, P100, y otra negativa sobre los 135 ms, N135 (Figura e7.23). Figura e7.24. Procedimiento para PEV en niños. e-289 e-290 p a r t e 1 0 : C AP Í T U L O S E X T R A electrodos porque el niño no se está quieto, así como la falta de atención que también puede modificar las respuestas y la necesidad de emplear en algunos casos anestesia general para llevar a cabo la prueba; las anestesias realizadas con fluotano y clorhidrato de ketamina son las que menos influyen en los registros. A la hora de interpretar estos registros en los niños hay que tener en cuenta la existencia de un proceso de maduración en los PEV, es decir, que el número de ondas, la latencia y la amplitud de las deflexiones cambian desde el nacimiento, paralelamente a la maduración anatómica y fisiológica de las vías ópticas. Así, con la edad, el PEV se enriquece en componentes precoces y tardíos, los picos de las ondas son cada vez más agudos y sus latencias disminuyen, asemejándose a la del adulto. Esta maduración está en relación con el tipo de estimulación utilizada, alcanzando su morfología y valores de sus ondas los del adulto hacia los 6 años de edad. Los PEV estarían indicados, sobre todo, en niños con alguna anomalía visual, como ambliopía supuestamente funcional que no se recupera tras el tratamiento, nistagmo, sospecha de ceguera, o con alguna enfermedad general con una posible afectación de las vías visuales, pudiendo evaluar el estado funcional y emitir un pronóstico. También estaría indicado su empleo para diferenciar una ambliopía orgánica de una funcional y valorar las posibilidades de recuperación en esta última o para conocer la repercusión funcional ante una patología del fondo de ojo, así como para diagnosticar una lesión del nervio óptico en un niño en quien la opacidad de medios impide ver el fondo de ojo, como puede ocurrir en cataratas muy densas o en opacidades vítreas. Anomalías De Las Ondas. Semiología Patológica (Tabla e7.4) Potenciales Evocados Visuales Por Flash Hoy día los estímulos estructurados han reemplazado a la estimulación con flash, a excepción de los pacientes que no colaboran para la exploración (pacientes en coma, recién Tabla e7.4 Anomalías estudiadas en los potenciales evocados visuales Nervio y vía óptica Morfología Latencia Amplitud Neuropatía tóxica A N − Atrofia óptica A N/+ − Atrofia óptica de Leber A + − Drusas de nervio óptico A + − Edema de papila N/A N/+ N/− Glaucoma N N/− N/− Neuritis óptica N +++ A/N Neurotopatía óptica isquémica A + − Tumores vía óptica anterior A + − Ataxia de Friedreich A ++ − Ceguera cortical N N N/− Distrofia miotónica N + − Enfermedad de Alzheimer N N/+ N/− Esclerosis múltiple N/A +++ N/− Enfermedad de Charcot-MarieTooth N + − Enfermedad de Creutzfeldt-Jakob N/A ++ +/− Enfermedad de Parkinson N N/ + + N/− Albinismo N + − Afecciones renales N + − Déficit de vitaminas B12 y E N + N Hepatopatías N + − Migrañas N/A + N Enfermedades neurológicas y generales N: normal; A: anormal; +: incremento; −: disminución; (+): leve; (++): moderado; (++ + ): grave. E 7 | E l e c tro f i s iologí a oc ular nacidos), o con importante opacidad de medios (cataratas evolucionadas) en la que se puede predecir una mala recuperación cuando el PEV flash está muy alterado. Potenciales Visuales Evocados O Potenciales Evocados VISUALES Estructurados © Elsevier. Fotocopiar sin autorización es un delito. Como los ojos son estimulados monocularmente, pero cada uno de ellos proyecta a ambos lóbulos occipitales, cuando se utilizan los electrodos en la línea media puede pasar desapercibida una hemianopsia homónima completa, al ser normal la latencia de la onda P100. Ante su sospecha, en dichos casos se deberían utilizar electrodos laterales, con lo que se pondrán de manifiesto estas alteraciones (O1, O2, O3, O4). Si la estimulación es de campo total y encontramos una anomalía al estimular un ojo solo, la lesión estará localizada antes del quiasma. Debemos revisar la retina (degeneración, enfermedad desmielinizante, atrofia óptica, compresión del nervio, etc.), es por ello que la exploración de los PEV no debe ser aislada. Si las alteraciones son de los dos ojos anatómicamente no podemos localizar la lesión, ya que puede encontrarse en el trayecto que hay desde la retina a través del nervio óptico, quiasma, radiaciones o corteza visual. Existe una variabilidad de amplitud interocular normal, pero cualquier factor que afecte a la amplitud de los PEV puede estar relacionado con la agudeza visual (AV). Es pues preciso revisar procesos que produzcan cambios en la AV, como tamaño pupilar, defecto de refracción, opacidades de medios, enfermedades retinianas, neuritis o compresiones ópticas, así como mala fijación, parpadeo, etc. Sin embargo, el tiempo de latencia de la onda P100 se ve menos influido por estos factores, por lo que es la medida más fiable en los PPEV. Asimismo, posee un gran valor la diferencia entre ambos ojos, tomándose como límite unos 10 ms. Desde el punto de vista semiológico, es importante destacar que las enfermedades desmielinizantes producen defectos de conducción y, por tanto, un aumento de la latencia. Se ocasionan cambios en la amplitud y menos alteración de las latencias cuando hay suficiente número de axones sanos para producir un registro de velocidad de conducción normal. Las enfermedades compresivas producen pérdida axonal por una parte y desmielinización por la otra, por lo que se caracterizan tanto por un aumento de la latencia como por la disminución de la amplitud. Los PEV tienen clínicamente un gran interés, aunque no sean específicos para cada etiología y van a ser complementarios también de los exámenes neurológicos, que estudian el sustrato anatómico de las lesiones tomografía computarizada y resonancia magnética (TC, RM) aportando, además, su gran sensibilidad y objetividad. Conclusiones – La retina es parte del tejido nervioso central y la electrofisiología permite estudiar los cambios eléctricos del globo ocular. – Las técnicas electrofisiológicas permiten estudiar diferentes estructuras oculares. – Las técnicas empleadas son el electrooculograma, el electrorretinograma y electrorretinograma pattern y los potenciales evocados visuales. – Estas técnicas facilitan el diagnóstico de enfermedades retinianas y maculares y son de utilidad en la patología de la vía óptica. Incluso pueden emplearse en las en­ fermedades desmielinizantes. Bibliografía Benítez del Castillo JM, Pérez Salvador JL, Benítez del Castillo Sánchez J, PérezSalvador García E (eds.). Manual Básico de Electrofisiología Ocular: Sus aplicaciones en la práctica clínica. (1.a ed.) Madrid: Mac Line, 2002. Catalá J, Castany M. Pruebas electrofisiológicas: ¿qué, cómo, cuándo y por qué? (1.ª y 2.ª parte). Annals d’Oftalmologia 2005;13(1):8-29. Electrophysiologic Testing in disorders of the retina, optic nerve and visual pathway. En: (2nd ed.). Ophthalmology monograph 2. San Francisco, CA: The Foundation of the American Academy of Ophthalmology, 2001. International Society for Clinical Electrophysiology of Vision. Disponible en: http:// www.iscev.org. Sole P, Dalens H, Gentou C. Biophtalmologie. París: Masson, 1992. e-291 e-292 p a r t e 1 0 : C AP Í T U L O S E X T R A Autoevaluación E7 1. ¿En cuál de estas enfermedades el pico de iluminación del electrooculograma está habitualmente disminuido con un cociente de Arden patológico < 1,65, y el electrorretinograma de campo completo es normal? y que actualmente tiene enterocolitis necrosante y hemorragias cerebrales periventriculares para valorar si percibe o no la luz. ¿Qué prueba electrofisiológica sería la más adecuada en este caso? a. Distrofia macular de Stargardt. b. Enfermedad de Best. c. Distrofia «en patrón». d. Desprendimiento de retina. Correcta: b. En la enfermedad de Best suele existir una disociación entre el ERG de respuesta combinada, que es normal, frente al EOG, que está alterado, con un cociente de Arden patológico. a. ERG multifocal. b. ERG de conos. c.PEV con estímulo flash. d.PEV con estímulo estructurado. Correcta: c. En los PEV flash se recoge en localización occipital la señal al estimular con flash, por lo que ofrece información sobre si existe integridad de la vía óptica para al menos percibir un estímulo luminoso. Tanto el ERG multifocal como los pattern PEV utilizan estímulos estructurados. En el ERG de conos el electrodo es corneal, por lo que no objetiva la integridad de la vía óptica. 2. ¿Cuál de las siguientes afirmaciones acerca del PERG (pattern ERG) es cierta? a. El registro PERG está generado fundamentalmente en las células bipolares de la retina. b. El registro PERG está generado exclusivamente en las células ganglionares de la retina. c. El PERG es anormal siempre que el ERG de campo completo sea anormal. d. El registro PERG está generado fundamentalmente en las células ganglionares de la retina. Correcta: d. El PERG está generado fundamentalmente en las células ganglionares de la retina, pero no de forma exclusiva. El ERG de campo completo da una información global de la retina, por lo que puede ser normal en alteraciones sectoriales no muy extensas retinianas, como puede ser una afectación macular. 3.En los PEV de estímulo estructurado (pattern PEV) una onda P100 con tiempo de culminación alargado y una AV de la unidad implica generalmente: a. Neuritis óptica resuelta. b. Un error en el registro del PEV. c. Glaucoma. d. Miopía magna. Correcta: a. Habitualmente las neuropatías ópticas desmielinizantes presentan un tiempo de culminación para la onda P100 alargado incluso tiempo después tras resolverse el cuadro agudo, viéndose afectado el ojo contralateral en los registros con frecuencia, frente a las neuropatías ópticas isquémicas en las que predomina la reducción en la amplitud de la onda P100. Los PEV no detectan las alteraciones neuronales correspondientes al campo periférico que se ven afectados primero en el glaucoma. 4.El pediatra le remite a un niño prematuro que pesó 800 gramos al nacer y 31 semanas de edad gestacional 5. ¿Cuál de estas afirmaciones acerca de las técnicas electrofisiológicas oculares es falsa? a. Ciertas cegueras estacionarias nocturnas pueden ser detectadas mediante el adaptoelectrorretinograma (AERG), fundamentalmente aquellas con fondo de ojo normal. b. Los pattern PEV alterados monocularmente indican siempre una alteración en el nervio óptico ipsilateral. c. Las neuritis ópticas desmielinizantes suelen presentar un tiempo de culminación de la onda P100 alargado. d. En la distrofia de conos el ERG flicker y el ERG de conos suelen estar abolidos o por debajo de lo normal. Correcta: b. Dada la preponderancia de la representación de la región macular occipital, así como su localización retinotópica posterior más cercana al electrodo occipital, una afectación macular puede presentar unos pattern PEV alterados sin que necesariamente exista daño en el nervio óptico ipsilateral. 6. ¿Cuál de estas pruebas sería la de elección para confirmar el diagnóstico de una sospecha de hemeralopía? a.PEV a estímulos estructurados. b. ERG flicker. c. ERG de conos. d.Adaptoelectrorretinograma. Correcta: d. En el adaptoelectrorretinograma se realizan registros seriados según el paciente va siendo adaptado a la oscuridad, apareciendo si la función escotópica está preservada una onda b2 que alcanza la amplitud de la onda b1 (punto alfaadaptoelectrorretinográfico) antes de los 15 minutos de adaptación a la oscuridad. E 7 | E l e c tro f i s iologí a oc ular Caso clínico E7 Explicación del caso (historia) Paciente de 53 años, hombre, miope, que acude a una revisión oftalmológica de rutina. No refiere alergias conocidas. No tiene broncopatías ni cardiopatías. Presenta diabetes mellitus no insulinodependiente (DMNID) bien controlada sólo con dieta y antidiabéticos orales. Presenta hipertensión arterial en tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA) y buen control. No tiene antecedentes de litiasis renal. No refiere historia de jaquecas. No tiene una historia familiar oftalmológica de interés. © Elsevier. Fotocopiar sin autorización es un delito. Examen físico Examen de agudeza visual de lejos (Snellen): • Ojo derecho (OD): −4,00-0,50 × 130° = 1/1. • Ojo izquierdo (OI): −4,50-0,50 × 35° = 1/1. Estudio de biomicroscopia (lámpara de hendidura): • OD: polo anterior normal. • OI: polo anterior normal. Estudio de gonisocopia (ángulo camerular anterior) con lente de contacto: • OD: grado 3 Shaffer (abierto) sin depósitos ni anormalidades. • OI: grado 3 Shaffer (abierto) sin depósitos ni anormalidades. Tonometría de aplanación de Goldmann: • OD: 21 mmHg. • OI: 21 mmHg. Paquimetría ultrasónica (grosor corneal central): • OD: 500 mm. • OI: 500 mm. Oftalmoscopia OD (examen de fondo de ojo) con lente de biomicroscopia Volk 78D (con/sin luz aneritra) (Figura eCe7.1). • Nervio óptico. – Diámetro vertical papilar: 1,6 mm. – Relación excavación/disco vertical: 0,6. –Anillo neurorretiniano: ¿normalidad? –Atrofia alfa. – Estudio de capa de fibras nerviosas de la retina (luz aneritra): difícil de evaluar por carácter miópico de epitelio pigmentario de la retina. – Resto del examen del polo posterior, normal. Oftalmoscopia OI (examen de fondo de ojo) con lente de biomicroscopia Volk 78D (con/sin luz aneritra) (Figura eCe7.2). • Nervio óptico – Diámetro vertical papilar: 1,6 mm. – Relación excavación/disco vertical: 0,6. –Anillo neurorretiniano: ¿normalidad? –Atrofia alfa. – Estudio de capa de fibras nerviosas de la retina (luz aneritra): difícil de evaluar por carácter miópico de epitelio pigmentario de la retina. – Resto de examen del polo posterior, normal. Hallazgos de exploraciones complementarias Examen de campo visual mediante perimetría automática Humphrey (24-2 B/B SITA-estándar): Figura eCe7.1. Imagen de nervio óptico derecho. Figura eCe7.2. Imagen de nervio de ojo izquierdo. • OD: dentro de la normalidad (Figura eCe7.3). • OI: dentro de la normalidad (Figura eCe7.4). Examen de electrofisiología ocular: pattern electrorretinograma (PERG): • OD (Figura eCe7.5): – Valores de amplitud N1-P1 = 5,48 mV. – Valores amplitud P1-N2 = 8,03 mV. Nota: dentro de la normalidad. e-293 e-294 p a r t e 1 0 : C AP Í T U L O S E X T R A Figura eCe7.3. Campo visual ojo derecho. • OI (Figura eCe7.6): – Valores de amplitud N1-P1 = 3,31 mV. – Valores amplitud P1-N2 = 6,85 mV. Nota: dentro de la normalidad, pero valores más bajos que en OD. Polarimetría láser de barrido de capa de fibras nerviosas de la retina (GDx): • Estudio de ambos ojos (Figura eCe7.7). Nota: puede comprobarse en la figura del mapa de capa de fibras nerviosas de la retina (CFNR) que en el ojo izquierdo parecen faltar fibras (que se reflejarían en colores cálidos, amarillos y rojos) en la porción superior del nervio óptico (igual en el gráfico TSNIT: que compara la línea individual de grosor, medido en el círculo de cálculo de diámetro estándar, con el rango de la normalidad representado por la franja coloreada de violeta en el caso de dicho ojo izquierdo y de verde en el ojo derecho). En el mapa de probabilidad de cambio frente a la normalidad se marca el déficit en superpíxeles, coloreados sobre el fondo en blanco y negro, y se refleja y localiza la diferencia estadística con la normalidad. © Elsevier. Fotocopiar sin autorización es un delito. E 7 | E l e c tro f i s iologí a oc ular Figura eCe7.4. Campo visual ojo izquierdo. e-295 e-296 p a r t e 1 0 : C AP Í T U L O S E X T R A Figura eCe7.5. Examen de PERG ojo derecho. Figura eCe7.6. Examen de PERG ojo izquierdo. © Elsevier. Fotocopiar sin autorización es un delito. E 7 | E l e c tro f i s iologí a oc ular Figura eCe7.7. Estudio de GDx VCC (polarimetría láser de barrido de capa de fibras nerviosas de la retina con compensación corneal variable) en ambos ojos. e-297 e-298 p a r t e 1 0 : C AP Í T U L O S E X T R A 1.Con respecto al diagnóstico de este paciente, ¿qué afirmación sería cierta? a. No parece tener ninguna enfermedad porque toda la exploración es normal b. El aumento de los valores de amplitud en el PERG del OD indican una patología de células ganglionares en dicho ojo c. Se trataría de un glaucoma «preperimétrico» en el OI d. El grosor corneal central de este paciente podría falsear los valores de presión intraocular de forma que obtuviéramos en la medición valores más altos de los que realmente posea e. El déficit de fibras nerviosas que se encuentra en el OI no puede relacionarse en absoluto con la menor amplitud detectable en el PERG de ese mismo ojo Correcta: c. El deterioro detectable en la capa de fibras nerviosas es patológico aunque no se asocie aún con defectos evidenciables en el campo visual: se trata, pues, de un glaucoma en estado «preperimétrico». 2.Con respecto a la actitud terapéutica, ¿qué afirmación sería cierta? a. No se tratan las hipertensiones oculares b. Convendría tratar de bajar la presión intraocular en este paciente, al menos en el OI c. La cirugía es generalmente la primera opción hipotensora para el glaucoma por su bajo riesgo frente a otras opciones d. La trabeculoplastia láser es otra opción hipotensora, pero no ayuda al cumplimiento del régimen antiglaucomatoso e. El perfil de eficacia/seguridad de un fármaco no es im­ portante para escoger un fármaco hipotensor Correcta: b. La primera medida para evitar que la enfermedad del glaucoma se inicie o progrese es bajar la presión intraocular; desde luego parece recomendable hacerlo en este caso. Discusión-argumentación/resolución del caso La prevalencia del glaucoma en importante y creciente en la población general a partir de los 40 años y es más frecuente en los pacientes miopes. El glaucoma es una neuropatía óptica cuyo diagnóstico se basa en un defecto característico evidenciable en el campo visual y/o en una alteración detectable en el estudio del nervio óptico y/o en la capa de fibras nerviosas que lo componen. En general, esta enfermedad se asocia con una presión intraocular elevada. Actualmente la medición de la presión intraocular se realiza a través de la córnea. Consideraríamos normales valores por debajo de 20-22 mmHg. Sabemos, no obstante, que los valores que obtenemos se encontrarán interferidos por las propiedades biomecánicas de la córnea de cada paciente. De este modo, córneas especialmente gruesas (más allá de 550-560 micras de grosor) podrían causar artefactos en las medidas de presión, obteniéndose medidas más altas que las reales, y córneas más delgadas (menos de 510-500 micras de grosor) podrían ocasionar artefactos en las medidas de presión de manera contraria, obteniéndose medidas más bajas que las reales. Este último podría ser nuestro caso. No obstante, no sabemos bien cuánto, y se puede estimar un error de 1 mmHg, arriba o abajo, por cada 10 micras de desviación del grosor corneal medio (520-540 micras). Por otra parte, el daño del glaucoma en la estructura y en la función del nervio óptico, al menos con los medios diagnósticos convencionales actuales, no siempre se desarrolla en paralelo. Esta disociación estructura-función en esta enfermedad puede hacerse patente en sus primeros estadios de forma que primero se puede detectar un daño estructural y más adelante, meses y/o años después, se puede ver una afectación funcional en el campo visual. El déficit de fibras detectable en nuestro caso en el ojo izquierdo es definitivamente algo patológico y convierte a este caso en un glaucoma, si bien al no acompañarse de una alteración aún en el estudio de campo visual, diríamos que se trata de un «glaucoma preperimétrico». Si bien el examen de PERG se consideraría una prueba diagnóstica funcional no convencional en el glaucoma, en este caso podemos comprobar una disminución relativa de la amplitud en el PERG de dicho ojo izquierdo frente al contralateral; esto confirma la existencia de una alteración en la respuesta a la estimulación de la células ganglionares en el estudio electrofisiológico de dicho OI. La primera medida para evitar que la enfermedad del glaucoma comience o progrese es hacer descender la presión intraocular; desde luego parece recomendable hacerlo en este caso. Ante el buen estado funcional de campo visual optaríamos en principio por una terapia médica y/o trabeculoplastia láser y cambiaríamos o no de actitud según respuesta y/o evolución. Bibliografía Sommer A, Katz J, Quigley HA, et al. Clinically detectable nerve fiber atrophy precedes the onset of glaucomatous field loss. Arch Ophthalmol 1991;109:77-83. Trick GL. PERG abnormalities in glaucoma and ocular hypertension. Invest Oph­thalmol Vis Sci 1986;27:749. Weinstein GW, Arden GB, Hitchings RA, et al. The pattern electroretinogram (PERG) in ocular hypertension and glaucoma. Arch Ophthalmol 1988;106:923-8. E 7 | E l e c tro f i s iologí a oc ular Temas de trabajo E7 © Elsevier. Fotocopiar sin autorización es un delito. 1. Describir las características de los patrones de las enfermedades de nervio óptico. Indicar su utilidad y limitaciones. 2. Indicar en qué enfermedades retinianas y por qué la electrofisiología es una exploración complementaria que debe realizarse. e-299 Baja visión Objetivos de aprendizaje ● Conocer el significado de lo que es baja visión y ceguera y diferenciar entre ambos conceptos. ● Conocer la secuencia de examen de este tipo de pacientes. ● Conocer los dispositivos y ayudas que se prescriben para ayudarlos. e8 El concepto de ceguera también va a depender de la legislación propia de cada país, puesto que ser reconocido como ciego legal permitirá a la persona acceder a diferentes ayudas y prestaciones, por lo que existen diferencias importantes en función de los países (Tabla e8.2). Con la intención de aclarar estos conceptos el Consejo Internacional de la Oftalmología, en Sydney (2002), adoptó una resolución para tratar de clarificar este entramado de definiciones y clasificaciones, para lo que se estableció definir como: Ceguera Palabras clave/Key words Función visual Baja visión Ceguera Agudeza visual Refracción Telescopio Microscopio Aumento Visual function Low vision Blind Visual acuity Refraction Telescope Microscope Magnification Pérdida total de la visión y para situaciones en las que el sujeto tiene que confiar de forma predominante en habilidades sustitutivas de la visión. Baja Visión Pérdidas graves de la visión; los individuos pueden ser ayudados de forma significativa por mecanismos de mejora de la visión. Impedimento Visual Definición De La Baja Visión La confusión existente en torno a la definición de ceguera y baja visión ha impulsado a diferentes organismos y profesionales de la visión a intentar acotar mediante diferentes clasificaciones a estos pacientes. Sin embargo, definir quién es un paciente con baja visión y quién no lo es, limita las posibilidades de muchas personas afectadas, que pueden beneficiarse del aprovechamiento de los dispositivos y de las técnicas empleadas en baja visión. De todas estas clasificaciones, la más utilizada es la que recoge la Organización Mundial de la Salud (OMS) en 1993, que define a una «persona con baja visión como aquella que tiene un deterioro de su función visual incluso después de ser tratada o recibir corrección refractiva estándar, y cuya agudeza visual va desde menos de 6/18 a percepción de luz, o cuyo campo visual está restringido a menos de 10° desde el punto de fijación, pero que usa, o tiene la posibilidad de usar, la visión para la planificación o ejecución de una tarea» (Tabla e8.1). © 2012. Elsevier España, S.L. Reservados todos los derechos Se utilizará esta expresión cuando la condición de la pérdida de visión se caracteriza por una pérdida de funciones visuales (como agudeza visual o campo visual) en el órgano. Muchas de estas funciones pueden ser medidas cuantitativamente. Visión Funcional Se emplea para describir la capacidad de una persona para utilizar la visión en actividades de la vida diaria. Pérdida De Visión Se usa como expresión general que incluye tanto la pérdida total de visión como la pérdida parcial, caracterizada bien según un impedimento visual o bien según una pérdida de visión funcional. Para correlacionar los distintos grados de defectos visuales en relación con la agudeza visual se confeccionó la escala expuesta en la Tabla e8.3. No obstante, quizá para la práctica clínica sea más correcta la definición de baja visión de Faye: «paciente de e-300 E 8 | Baj a v i si ón TABLA e8.1 Clasificación de la Organización Mundial de la Salud (OMS) de baja visión y de ceguera (1993) Clasificación OMS Niveles de deterioro visual Visión casi normal Gama de visión normal AVL entre 2 y 0,8 Otros términos descriptivos Visión casi normal AVL entre 0,7 y 0,3 Baja visión Ceguera Deterioro visual moderado AVL entre 0,25 y 0,12 Baja visión moderada Deterioro visual grave AVL entre 0,1 y 0,06 Campo visual de 20° y menos Baja visión grave Deterioro visual profundo AVL entre 0,04 y 0,02 Campo visual de 10° o menos Baja visión profunda Deterioro visual casi total AVL de menos de 0,02; CD a 1 m o menos; MM a 5 m o menos; PPL Ceguera grave o casi total Deterioro visual total, no percibe luz Ceguera total o amaurosis AVL: agudeza visual lejana; CD: cuenta dedos; MM: movimiento de manos; PPL: percibe o proyecta luz. TABLA e8.2 Límites de la ceguera legal en función de la agudeza visual en algunos países Ceguera legal por países Agudeza visual Suecia 0,03 Alemania 0,04 Francia y Holanda 0,05 España, Italia, Gran Bretaña, Estados Unidos, Canadá 0,1 © Elsevier. Fotocopiar sin autorización es un delito. TABLA e8.3 Correlación entre la agudeza visual y el defecto visual aprobado por el Consejo Internacional de la Oftalmología, Sydney (2002) Defectos visuales Agudeza visual Visión normal Mayor o igual a 0,8 Pérdida suave de la visión Menor de 0,8 y mayor o igual de 0,3 Pérdida moderada de la visión Menor de 0,3 y mayor o igual a 0,125 Pérdida severa de la visión Menor de 0,125 y mayor o igual a 0,05 Pérdida profunda de la visión Menor de 0,05 y mayor o igual a 0,02 Pérdida cercano-total de la visión Menor de 0,02 y mayor o igual a no percibir luz Pérdida total de la visión Ceguera total baja visión es aquel que tiene implícita una disminución del nivel de rendimiento, siendo la baja visión más un estado funcional que una anotación matemática». Epidemiología y Causas De La Ceguera y La Baja Visión El 1% de la población son discapacitados visuales, de los cuales entre un 80 y un 90% mantienen un resto visual aprovechable. Se calcula que en los próximos 20 años se duplicará el número de personas ciegas en el mundo, aun con la disponibilidad de intervenciones altamente rentables (Figura e8.1). Cuatro de cada 5 personas perderán la visión innecesariamente. La necesidad de actuar contra este sombrío futuro llevó a la OMS y a la Agencia Internacional para la Prevención de la Ceguera a impulsar la iniciativa conjunta «Visión 2020: El Derecho a la Visión». Si la voluntad política y los recursos adecuados pudieran actuar Figura e8.1. Costes económicos de la ceguera sin intervención del programa 2020 y con intervención del programa 2020. e-301 e-302 par t e 1 0 : C A P Í T U L O S E X T R A Historia Del Caso Figura e8.2. Principales causas de ceguera en el mundo y porcentaje en 2002. Boletín de la Organización Mundial de la Salud, noviembre de 2004. conjuntamente, esta meta sería alcanzable. «Visión 2020» aspira a eliminar las causas principales de ceguera prevenible para el año 2020, uniendo a gobiernos, organizaciones no gubernamentales (ONG), profesionales de la salud ocular y todas aquellas organizaciones implicadas en la prevención de la ceguera. Diferentes enfermedades pueden ocasionar ceguera y baja visión. Según los datos de la OMS, la principal causa de ceguera en el mundo son las cataratas, seguida de las alteraciones retinianas (Figura e8.2). En un estudio presentado en 1998 por Dickinson en Inglaterra sobre las patologías oculares causantes de ceguera en relación con los grupos de edad, las degeneraciones maculares incrementaron su incidencia y pasaron del 37 al 49% en sólo 10 años. Para Bishop (1996), las patologías que producen baja visión se pueden agrupar de tres maneras: 1. Alteraciones que generan baja agudeza visual, por ejemplo, la degeneración macular asociada a la edad. 2. Alteraciones que conllevan restricción del campo visual, por ejemplo, el glaucoma. 3. Dificultades perceptivas, accidentes cerebrovasculares, por ejemplo, las ocasionadas por un ictus. Examen Funcional De La Visión Del Paciente Con Baja Visión Observación Del Paciente El examen del paciente de baja visión debería comenzar antes de que el paciente pase a la sala de examen. La observación del comportamiento del paciente en un ambiente no conocido puede aportar una información adicional sobre su estado visual y orientar sobre la estrategia de examen y de rehabilitación. Esto también permite conocer a otros miembros de la familia y la interacción del paciente con ellos. La observación debe centrarse en anomalías posturales como movimientos excesivos de cabeza y/o de ojos; movilidad general reducida, y anomalías visuales como la presencia de nistagmo, estrabismo o uso de gafas de sol en interiores. Estos signos pueden indicar anomalías en el campo visual, error refractivo sin corregir, fotofobia u otros que deben ser explorados durante el examen. La historia debe incluir información sobre la situación general del paciente, así como sobre el estado visual y médico del paciente. La historia en un paciente de baja visión debe incluir preguntas sobre su estilo de vida, si vive con otras personas y su relación de dependencia o independencia de ellas, necesidades visuales, objetivos y la motivación. La historia médica y visual debe incluir el diagnóstico, fecha de aparición, estabilidad, cirugías previas, tratamiento farmacológico de la o de las enfermedades que presenta el paciente, ya sean sistémicas o visuales, así como alergias e historia familiar. La historia del caso en el paciente de baja visión debe dirigirse hacia conocer cuáles son los objetivos del paciente, que en ocasiones pueden ser diferentes a los que tiene el profesional de la visión y, de esta forma, durante la evaluación, buscar el mejor tratamiento con el que el paciente pueda alcanzar esas metas. Exploración El examen de un paciente de baja visión no varía sustancialmente con respecto a otro tipo de pacientes; quizás lo que se debe tener en cuenta es la necesidad de ampliar los tiempos de las pruebas y ser muy rigurosos en la realización de alguna de ellas, como, por ejemplo, en la medida de la agudeza visual. Medida de la agudeza visual La medida de la agudeza visual es importante para poder valorar: 1. Cambios ocurridos con la enfermedad. 2. Los beneficios que se logran con la corrección óptica. 3. La mejora obtenida con una ayuda y tomar decisiones respecto a las ayudas. La medida de la agudeza visual de lejos no debe realizarse con el proyector de optotipos sino que, a ser posible, debe llevarse a cabo con un test de escala logarítmica. Las cartas de evaluación de la agudeza visual deber ser móviles, con iluminación variable, de alto contraste (incluso con diferente iluminación ambiente), y distintos rangos de tamaño. Se deben emplear cartas de tamaño mayor y menor de lo que puede leer el paciente, para así poder conocer los límites. Se debe empezar con el optotipo muy cerca (condición de facilidad) y si el paciente puede leer varias líneas hay que aumentar la distancia, buscando el tamaño umbral y supraumbral. Para tomar una buena medida clínica de la agudeza visual, la carta debe incluir tareas iguales para cada nivel y, además, las letras de la carta deben requerir el mismo número de letras para cada nivel de tamaño, espaciado entre letras y entre filas proporcional al tamaño de letra, letras equilibradas respecto a legibilidad y progresión logarítmica del tamaño (ratio constante). La carta de Bailey-Lovie (1976) presenta las siguientes ventajas respecto a las existentes: 1. Para un mismo aumento se consigue el mismo número de filas extra. E 8 | Baj a v i si ón actual carta ETDRS (Early Treatment of Diabetic Retinopathy) (Figura e8.3). Básicamente es el mismo diseño de Bailey y Lovie; sólo difiere en las letras utilizadas y en que se presenta a 4 o 2 m, realizando la conversión en función de la distancia de presentación. Existen numerosas formas de anotar la agudeza visual (Tabla e8.4). La anotación se debe realizar en la escala Snellen, lo que facilita bastante el cálculo del aumento; en cualquier caso, si se anota en la escala decimal no hay que olvidar que se tiene que anotar la distancia de presentación del test. Figura e8.3. Test para cuantificar la agudeza visual de lejos. ETDRS retroiluminado. 2. Cambios en la visión para un mismo número de letras, representa el mismo cambio fraccional en el mismo ángulo de resolución (MAR). 3. La notación de corrección parcial (−2, −1, +1, +2) tiene el mismo significado en todos los niveles de agudeza visual (20/200+2, 20/40+2). 4. El escalonamiento logarítmico asigna puntos por cada letra leída, esto otorga más exactitud y más sensibilidad a los cambios. En la escala logarítmica cada línea varía en 0,1 log units. Esto es igual a un exacto factor multiplicador de 1.2589. Cada letra se diferencia en 0,02. En la carta de Bailey y Lovie, 0,1 puntos se consiguen leyendo una fila completa de 5 letras; este resultado puede ser subdividido en 5 × 0,02 pasos por leer cada letra individual. Esta carta fue rediseñada en 1982 por Ferrys y Bailey, y es la 1. Notación de Snellen. Relación entre la distancia a la que se ve el optotipo y a la que debería verse. El numerador representa la distancia de presentación y el denominador la distancia a la cual una persona con agudeza unidad vería dicho optotipo. 2. Decimal: expresa la fracción de Snellen como decimal. 3. Notación M. Distancia a la que la letra subtiende a 5’. 4. MAR. Recíproco o inverso del decimal. 5. LogMAR. Logaritmo en base 10 del MAR en minutos de arco a la distancia de 6 m. 6. VAR (Visual Acuity Rating o porcentaje de agudeza visual) (100-50 [Log MAR]). La evaluación de la AV se debe realizar con cartas móviles, diseñadas en escala logarítmica y con una iluminación controlada. La anotación debe realizarse en escala Snellen. Medida de la agudeza visual de cerca En visión próxima no se utilizan unidades VAR porque resulta más útil conocer la altura de la letra, no el ángulo que subtiende. De cerca se recomienda el uso de unidades M y distancia de lectura (tamaño de letra). © Elsevier. Fotocopiar sin autorización es un delito. TABLA e8.4 Conversiones de agudeza visual en diferentes formas de anotación MAR Snellen 20/ Snellen 6/ Decimal LogMAR VAR 0,5 10 3 2 −0,3 115 0,63 12,5 3,8 1,6 −0,2 110 0,8 16 4,8 1,25 −0,1 105 1 20 6 1 0 100 1,25 25 7,5 0,8 0,1 95 1,6 32 9,5 0,63 0,2 90 2 40 12 0,5 0,3 85 Problemas para conducir 2,5 50 15 0,4 0,4 80 Problemas para leer 3,2 63 19 0,32 0,5 75 4 80 24 0,25 0,6 70 5 100 30 0.2 0.7 65 6.3 125 38 0.16 0.8 60 8 160 48 0.12 0.9 55 10 200 60 0.1 1 50 MAR: ángulo de resolución; VAR: Visual Acuity Rating. Funcionalidad visual Ayudas especiales en los estudios Ceguera legal en España e-303 e-304 par t e 1 0 : C A P Í T U L O S E X T R A La agudeza visual de lejos debe ser igual a la de cerca, si se cumplen las condiciones siguientes: el paciente tiene buen enfoque, la iluminación es equivalente, las pupilas son normales y el paciente no presenta opacidades en los medios. Se debe distinguir entre agudeza de lectura de un texto y agudeza evaluada con carta de letras sueltas. Los optotipos de lectura son más difíciles que los optotipos de visión lejana porque esta tarea es más compleja. Habitualmente las cartas de lectura miden la eficiencia visual, no la agudeza límite total. Para establecer la agudeza visual límite se debe tener impreso un valor más pequeño al del umbral del paciente (para esta distancia). La carta de lectura Ferrys-Bailey ETDRS (log MAR) pre­ senta un tamaño en progresión logarítmica (ratio 0,1 uni­ dades logarítmicas = 1.2589X o 5/4), rango de tamaños de 10 M a 0,25 M, tipo de texto Times Roman y palabras sin relación de 4, 7 o 10 letras. Para los 11 tamaños más pe­ queños, se utilizan 6 palabras (42 letras) por línea. En los 6 tamaños mayores se utilizan sólo 2 o 3 palabras. La carta de lectura MN utiliza texto con 60 caracteres incluidos espacios, en 3 líneas para cada nivel, tamaño en progresión logarítmica (ratio 0,1 unidades logarítmicas = 1.2589X o 5/4), texto en Times Roman y frases al nivel de tercer grado de primaria. En la anotación de agudeza visual de lejos y de cerca monocular y binocular también se debe anotar cuál es el ojo dominante. Cuando se mida la AV de lectura en visión próxima, se debe anotar el umbral de resolución y también el tamaño de texto que lee rápido o lento. Refracción Del Paciente De Baja Visión Posteriormente, y una vez comprobada la posibilidad de mejora con el agujero multiestenopeico, se pasa a realizar la refracción. En esta evaluación, al igual que en el resto de pacientes, se incluyen pruebas objetivas como retinoscopia y queratometría o topografía y la refracción subjetiva. La retinoscopia se realiza con la habitación a oscuras, para obtener el mayor diámetro pupilar posible y sin preocuparnos por la acomodación del paciente; ésta suele ser nula o estar muy disminuida. Si no somos capaces de observar el reflejo, el observador se debe acercar hasta lograrlo, utilizando la técnica de retinoscopia radical. La queratometría o topografía en estos pacientes es muy importante, puesto que muchas condiciones como el albinismo, queratocono, aniridia y nistagmo pendular congénito se acompañan de córneas muy tóricas. El procedimiento se realiza de igual forma que en otros pacientes con visión normal. La secuencia de refracción subjetiva se realiza con gafas de prueba y se permite al paciente que adopte la postura con la que se sienta más cómodo o en la que bloquee o minimice el nistagmo. Las variaciones de lentes deben ser de potencia elevada en función de su agudeza visual; en muchos textos se recomienda aplicar la MDA (mínima diferencia apreciable) que se puede obtener: MDA=denominador Snellen a 6 m/30 MDA=2/AV escala decimal a 6 m×10 Otros clínicos, como Bailey, recomiendan utilizar saltos grandes superiores a las 5 dioptrías y observar la reacción del paciente. En cualquier caso, se utilice uno u otro método, de lo que no cabe duda es de que los saltos dióptricos deberán ser lo suficientemente grandes como para que nuestro paciente aprecie la diferencia. Una posible secuencia refractiva si utilizamos la MDA sería la siguiente: 1. Ajustar la esfera: a) Sumar la mitad de la MDA a la esfera de partida y restando la mitad de la MDA a la esfera de partida y entre esos dos valores, ver cuál prefiere. Proseguir con este procedimiento de suma y resta hasta que se retorne a un punto anterior. En ese momento, comprobar sobre la mitad de la MDA. b) Si el paciente no prefiere ninguna, sumar +/− 1 D y repetir. 2. Ajustar el cilindro: a) Exageración de cilindro. Aumentar la potencia del cilindro de partida con la MDA. b) Girar 45° el eje e ir dirigiéndolo a la posición más nítida. c) Para afinar la potencia, utilizar la MDA como en la esfera. También se puede utilizar un cilindro cruzado de forma convencional, pero éste debe tener una potencia que sea superior al +/− 0,50 D. 3. Comprobación final con un telescopio con el fin de determinar el efecto del aumento. La visión binocular de lejos y de cerca debe evaluarse en un paciente de baja visión. La mayoría de pacientes de baja visión no presentan un buen nivel de estereopsis, pero sí estereopsis gruesa. En pacientes en quienes su agudeza visual monocular no difiere más de 1,5 se debe evaluar su visión binocular, y esto se realiza con los métodos convencionales de luces de Worth, Maddox y estereopsis. La refracción del paciente de baja visión se realiza igual que en otros pacientes pero con ligeras modificaciones: uso de gafa de prueba, cambios más altos en las lentes, dar más tiempo para responder, modificar su postura. Agudeza Visual De Cerca y Necesidades De Aumentos La medida de la agudeza visual del paciente en cerca permite calcular el aumento mediante el siguiente procedimiento: con la iluminación del gabinete encendida más una lámpara adicional y utilizando un texto de frases en escala M, se si­ túa a 25 cm del paciente al cual se añade 4 D sobre su refrac­ ción de lejos. A continuación el paciente lee hasta la frase más pequeña que pueda y este tamaño dividido por el obje­ tivo proporciona el aumento para 25 cm. Posteriormente se prueba la ayuda modificando la distancia de trabajo y se verifica si dicha ayuda puede llegar a ser eficaz. Salud Ocular y Campo Visual La evaluación de la salud ocular determina la naturaleza, la extensión y la estabilidad ocular de la patología ocular. Este examen debe comprender biomicroscopia para valorar el polo anterior, presión intraocular, fondo de ojo y valoración del color. E 8 | Baj a v i si ón El estado del campo visual central y periférico es un factor importante para determinar las ayudas que deben prescribirse. En la evaluación del paciente de baja visión se debe evaluar: 1. El campo visual central (10° centrales) mediante la rejilla de Amsler. Este test permite conocer si existen metamorfopsia y escotomas centrales. Deben anotarse en la hoja de registro, en caso de que existan, así como su localización. 2. El campo central-periférico mediante la pantalla tangente. 3. El campo visual periférico mediante el perímetro de arco en caso de que el paciente no pueda fijar, ya sea por presentar nistagmo o por la presencia de escotomas, lo que hace impracticable la campimetría computarizada. El Concepto De Aumento y Métodos Para Obtenerlo Dado que el paciente de baja visión no dispone de resolución suficiente para poder ver los objetos pequeños y los detalles, aunque su imagen esté correctamente enfocada en la retina, hay que proporcionarle una ayuda óptica para que, mediante el aumento de la imagen en la retina, el objeto supere el límite de resolución del paciente y así poder ser visto. Según Schapero et al (1968), el aumento puede definirse como el incremento del tamaño percibido o del tamaño real de un objeto o de su imagen con relación al objeto. Para los fines de la baja visión hay básicamente cuatro caminos para incrementar el tamaño de la imagen que se forma en la retina: 1. Aumento real del objeto que debe observarse. Es el que se obtiene al ampliar el tamaño del objeto en su posición original como, por ejemplo, cuando empleamos macrotipos. Para cuantificar el aumento relativo al tamaño se debe utilizar la misma distancia de fijación para ambos tamaños de objeto. Por ejemplo, si el paciente sólo puede resolver tamaños de letra de 20 mm y el tamaño de letra de texto es de 5 mm, el aumento que necesitaríamos es de: 4. Aumento por proyección (utilizado por los sistemas electrónicos como los circuitos cerrados de televisión, CCTV). Una forma sencilla para conocer el aumento que necesita el paciente es dividir la agudeza visual necesaria para observar el objeto por la que tiene el individuo. Por ejemplo, si el paciente tiene una agudeza visual de 0,1 y su objetivo es leer el periódico, su agudeza visual tendrá que ser por lo menos de 0,4: M = 0,4/0,1 = 4X Dispositivos y Ayudas Para Baja Visión Se pueden clasificar las ayudas para baja visión en tres grandes grupos: 1. Ayudas para lejos. 2. Ayudas para cerca. 3. Ayudas no ópticas. Ayudas Para Lejos La única opción de ayuda para poder ver los objetos lejanos son los telescopios. Éstos pueden ser de tipo Galileo o de Kepler. El telescopio Galileo está formado por dos lentes: una lente convergente como objetivo y una lente divergente como ocular (Figura e8.4). La imagen es derecha como señala la formula del aumento: M = −Poc/Pob El telescopio Kepler está formado por una lente convergente en el objetivo y una lente convergente en el ocular, por lo que la imagen será invertida. Por tanto, todos los telescopios keplerianos que se emplean como ayuda de baja visión han de incorporar un sistema inversor para obtener una imagen derecha. Los telescopios son la única ayuda para lejos y son útiles en los desplazamientos autónomos, pero tienen la © Elsevier. Fotocopiar sin autorización es un delito. M = 20/5 = 4X (la X es el símbolo de aumento) 2. Aumento angular (utilizado por los telescopios). 3. Aumento por reducción de la distancia del objeto al ojo. Al reducir la distancia de observación de un objeto, éste proyecta una imagen de mayor tamaño sobre la retina. El problema es que cuanto más cerca esté del objeto mayor debe ser la acomodación para poder verlo nítidamente; cuando la distancia se reduce de tal manera que supera la amplitud de acomodación del observador es necesario emplear lentes positivas que permitan mantenerlo enfocado en la retina. Por ejemplo, si se desplaza un objeto desde la distancia de lectura de 40 cm a 10 cm, el aumento por reducción de la distancia será: M = 40/10 = 4X. Para poder ver un objeto situado a 10 cm hay que acomodar 10 D o bien utilizar un sistema convergente para mantener enfocado el objeto. Figura e8.4. Telescopio tipo Galileo de 2 X montado en gafas de prueba. e-305 e-306 par t e 1 0 : C A P Í T U L O S E X T R A Figura e8.5. Microscopio de 4 X en el ojo izquierdo. desventaja de reducir el campo visual y sólo se pueden utilizar para tareas estáticas, excepto si se sitúan en posición superior en las gafas (posición bióptica). Ayudas Para Cerca Más del 95% de los pacientes de baja visión utilizan ayudas para cerca y éstas suponen el 80% de las ayudas que se prescriben. Existe mayor variedad de ayudas de cerca que de ayudas de lejos: 1. 2. 3. 4. Lentes positivas de alta potencia. Microscopios (Figura e8.5). Lupas manuales y con soporte (Figura e8.6). Telemicroscopios, formados por un telescopio más una lente convergente por delante del objetivo, o bien por un telescopio enfocado a una distancia cercana (Figu­ ra e8.7). 5. Ayudas electrónicas. Cada una de estas ayudas presenta ventajas e inconvenientes, y es función del profesional de la baja visión prescribirlas atendiendo a las necesidades de sus pacientes. Figura e8.7. Telemicroscopio de 16D, resultado de combinar una lente de +8 D con un telescopio de 2 X. Ayudas No Ópticas Favorecen la ejecución de las tareas mediante el control de la iluminación (lámparas especiales), la reducción del deslumbramiento y mejora del contraste (filtros solares), la mejora de la posición y postura corporal (atriles) y las ayudas a la movilidad, como la utilización de bastones. Conclusiones – El concepto de paciente de baja visión o el concepto de ceguera no son tan simples como algunas clasificaciones podrían presuponer; en cualquier caso suponen un reto para el profesional de la visión quien, mediante técnicas y dispositivos de ayuda, puede ayudarle a mejorar en sus actividades de la vida diaria. – Los pacientes de baja visión presentan condiciones oculares complicadas que requieren de una estrategia modificada de evaluación para lograr el diagnóstico y la prescripción de ayudas visuales que les permitan alcanzar sus objetivos. Bibliografía Figura e8.6. Lupas con soporte. Appel SD, Brilliant RL. The low vision examination. En: Brilliant RL, (ed.). Essentials of Low Vision Practice. Boston: Butterwoth Heinemann, 1999. p. 19-46. Boj Giménez PJ. Instrumentación óptica para baja visión. Alicante: Gamma, 1994. Cole RG. Visual Acuity and the predicted reading add. En: Rosenthal BP, Cole RG, (eds.). Functional assessment of low vision. St. Louis: Mosby Year Book, 1996. p. 27-44. Cummings RW, Muchnick, Whittaker SG. Specialized testing in low vision. En: Brilliant RL, (ed.). Essentials of Low Vision Practice. Boston: Butterworth Heinemann, 1999. p. 47-69. Dickinson C. Low vision. Principles and practice. Oxford: Butterworth Heinemann, 1998. p. 69–151. Faye E. Clínica de la baja visión. ONCE 1997;:3-27. Jackson AJ. Low vision assessment. En: Jackson AJ, Wolffsohn JS, (eds.). Low vision manual. Edinburgh: Butterworth Heinemann, 2007. p. 103-66. Macnaughton J. Fundamentos del ojo. En: Doshi S, Harvey W, (eds.). Evaluación en baja visión. Barcelona: Masson, 2006. E 8 | Baj a v i si ón Mehr EB, Freid AN. El cuidado de la baja visión. ONCE 1992. p. 242-51. Randall TJ. Undertanding low vision. New York: AFB, 1983. Rosenthal BP. The function-based low vision evaluation. En: Rosenthal BP, Cole RG, (eds.). Functional assessment of low vision. St. Louis: Mosby Year Book, 1996. p. 1-25. Páginas web recomendadas © Elsevier. Fotocopiar sin autorización es un delito. http://www.who.int/blindness/causes/en/ http://www.v2020la.org/Joomla/ http://www.islrr.org/ http://www.rpd.es/real_patronato.html http://www.lowvision.org/ http://www.nei.nih.gov/lowvision/ http://www.lighthouse.org/ http://www.aao.org/aao/index.cfm http://www.aoa.org/ http://www.once.es/new http://www.miopiamagna.org/ http://www.retina.es/ http://www.oftalmo.com/seo/ http://www.cnoo.es/index.php e-307 e-308 par t e 1 0 : C A P Í T U L O S E X T R A Autoevaluación E8 1. La medida de la agudeza visual en un paciente de baja visión: a. Cuantifica la potencia del error refractivo. b. Se realiza con el proyector de optotipos proyectados. c. Se realiza con un test de escala logarítmica, móvil y con iluminación variable. d. La anotación se realiza en escala decimal. Correcta: c. La medida de la agudeza visual permite valorar los cambios ocurridos con la patología, los beneficios que reporta la corrección óptica, la mejora obtenida con una ayuda y tomar decisiones respecto a las ayudas. La medida de la agudeza visual de lejos no debe realizarse con el proyector de optotipos sino que, a ser posible, debe hacerse con un test de escala logarítmica. Las cartas de evaluación de la agudeza visual deber ser móviles, con iluminación variable, de alto contraste (incluso con diferente iluminación ambiente), y diferentes rangos de tamaño. 2.El test de agudeza visual de escala logarítmica ETDRS: a. Cada línea varía en 0,1 unidades logarítmicas, asignando a cada letra un valor de 0,02. b. Se presenta a 6 metros. c. El escalonamiento logarítmico asigna puntos por cada letra leída, esto da menos exactitud y menos sensibilidad a los cambios. d. Cada línea de letras consta de un número distinto de letras. Correcta: a. En la escala logarítmica cada línea varía en 0,1 unidades logarítmicas, cada letra se diferencia en 0,02. En la carta ETDRS cada fila consta de 5 letras y se presenta a 4 o 2 m. Las ventajas de la escala logarítmica es que para un mismo aumen­ to se consigue el mismo número de filas extra, los cambios en la visión para un mismo número de letras; representa el mismo cambio fraccional en MAR, la notación de corrección parcial tiene el mismo significado en todos los niveles de agudeza visual y el escalonamiento logarítmico asigna puntos por cada letra leída, lo que da más exactitud y más sensibilidad a los cambios. 3. La refracción en el paciente de baja visión: a. La secuencia de refracción es distinta a cualquier otro paciente. b. Se realiza con foróptero porque los valores refractivos alcanzados son más fiables. c. Se realiza con gafas de prueba, realizando saltos de potencias más altos y permitiendo que el paciente modifique la postura en la que se encuentre más cómodo. d. No se suele realizar retinoscopia porque no es posible en estos pacientes. Correcta: c. En esta evaluación, al igual que en el resto de pacientes, se incluyen pruebas objetivas como retinoscopia y queratometría o topografía, y la refracción subjetiva. La refracción del paciente de baja visión se realiza igual que en otros pacientes, pero con ligeras modificaciones: uso de gafas de prueba, cambios más altos en las lentes, dar más tiempo para responder o modificar su postura. 4.Según el Consejo Internacional de Oftalmología las diferencias entre ceguera y baja visión son: a. En la ceguera el individuo tiene que confiar en habilidades sustitutivas de la visión y con la baja visión, sin embargo, puede ayudarse de mecanismos que refuercen el resto de visión. b. En la ceguera, la agudeza visual está por debajo de 0,1 en el mejor ojo y en la baja visión este límite se establece en 0,3. c. La ceguera es no percibir luz y el resto baja visión en alguno de sus diferentes grados hasta alcanzar la denominada visión casi normal, por encima de 0,3. d. La ceguera es sólo un término legal dependiente de la legislación de cada país, mientras que la baja visión es la de aquellos individuos con agudeza visual por debajo de 0,3 en cualquier ojo. Correcta: a. Para el Consejo Internacional de la Oftalmología, Sydney (2002), la ceguera puede definirse como pérdida total de la visión y aquellas situaciones en las que el sujeto tiene que confiar de forma predominante en habilidades sustitutivas de la visión, mientras que la baja visión es aquella condición que conlleva pérdidas graves de la visión, y los individuos pueden ser ayudados de forma significativa por mecanismos de mejora de la visión. 5.Si un paciente de baja visión necesita leer el periódico (tamaño de letra 1 M, agudeza visual de 0,4) y sólo es capaz de leer los titulares (tamaño 4 M, agudeza visual de 0,1) a 40 cm. ¿Qué aumento y distancia de trabajo tendrá que utilizar para poder leer el periódico con unas gafas? a. Aumento: 0,4/0,1 = 4X y la distancia de trabajo de 40 cm. b. Aumento: 4 M/0,4 = 10X y la distancia de trabajo de 10 cm. c. Aumento: 0,4/0,1 = 4X y la distancia de trabajo de 10 cm. d. Aumento: 4 M/0,1 = 40X y la distancia de trabajo de 4 cm. Correcta: b. El aumento se calcula en función de la agudeza visual de cerca dividiendo, en el caso de utilizar la notación decimal, la agudeza objetivo, 0,4, entre la que tiene el individuo, 0,1; por tanto, el aumento será de 4X. Para obtener este aumento de tamaño de imagen en retina, el paciente ha de reducir a la cuarta parte la distancia de lectura, pasando de 40 a 10 cm. Esta nueva distancia de trabajo obligará al paciente a acomodar 10 D para ver nítidamente, o bien, a utilizar unas gafas que permitan enfocar a esa distancia. E 8 | Baj a v i si ón Temas de trabajo E8 © Elsevier. Fotocopiar sin autorización es un delito. 1. Principios ópticos de las ayudas visuales empleadas en la corrección de la baja visión. 2. Indicar las enfermedades que pueden beneficiarse de las ayudas de baja visión y tipos de ayuda a la visión apropiadas. e-309 Repercusión oftalmológica de las enfermedades sistémicas Objetivos del aprendizaje ● Conocer las manifestaciones oftalmológicas más comunes de las enfermedades sistémicas. ● Establecer una orientación diagnóstica inicial ante las manifestaciones oftalmológicas más características de algunas enfermedades sistémicas. ● Transmitir la importancia de la colaboración multidisciplinaria en la evaluación integral del paciente con patología sistémica. Palabras clave/Key words Enfermedades sistémicas Manifestaciones oftalmológicas Vasculitis sistémicas Enfermedades infecciosas Signos oculares Systemic diseases Ophthalmic manifestations Systemic vasculitis Infectious diseases Ocular signs Enfermedades Reumáticas Artritis Reumatoide La artritis reumatoide (AR) es una enfermedad inflamatoria multisistémica crónica de origen desconocido, caracterizada por la presencia de una poliartropatía simétrica. Es la enfermedad reumática más frecuente. El diagnóstico de AR es clínico, de acuerdo con los criterios del American College of Rheumatology (ACR). Manifestaciones oftalmológicas La afectación oftalmológica más frecuente es la queratoconjuntivitis seca. Es más frecuente en mujeres (9:1). En la exploración se observan inestabilidad de la película lagrimal, detritos mucosos y filamentos corneales, así como un punteado epitelial fino y confluente en la mitad inferior de la córnea y en la conjuntiva bulbar, más evidente cuando © 2012. Elsevier España, S.L. Reservados todos los derechos E9 se instilan colorantes vitales como rosa de Bengala, fluoresceína o verde de lisamina (Figura e9.1). La epiescleritis es otra manifestación oftalmológica frecuente y a menudo autolimitada. Cursa con engrosamiento y edema del tejido epiescleral sin afectación de la esclera subyacente. La escleritis es un cuadro grave con edema e inflamación de la esclera, así como con congestión vascular (Figura e9.2). Se divide en anterior y posterior. Las escleritis anteriores son más frecuentes y se subdividen en difusas, nodulares, necrosantes con inflamación y necrosantes sin inflamación o escleromalacia perforante. Las formas más graves y destructivas se asocian con enfermedad sistémica evolucionada. En la córnea pueden aparecer queratitis ulcerativa periférica y cuadros de queratólisis central asociados con ojo seco grave. Entre las manifestaciones retinianas hay que destacar la aparición de exudados algodonosos, expresión de la vasculitis reumatoide, así como la posibilidad de desarrollar una retinopatía tóxica en aquellos pacientes con AR en tratamiento con antipalúdicos (cloroquina o hidroxicloroquina). Ambos fármacos poseen toxicidad ocular dependiente de la dosis, se acumulan en el epitelio pigmentario de la retina y dan lugar a una retinopatía pigmentaria «en ojo de buey». Los pacientes en tratamiento con estos antipalúdicos deben ser revisados periódicamente para intentar una detección precoz de la retinopatía y suspender el tratamiento, si ésta se produce. Artritis Idiopática Juvenil La expresión artritis idiopática juvenil (AIJ) hace referencia a una artritis de duración superior a 3 meses e inicio antes de los 16 años, una vez descartadas otras causas de inflamación articular. Manifestaciones oftalmológicas La manifestación característica es la uveítis anterior crónica. Se trata de una uveítis poco sintomática que suele cursar con importantes secuelas (sinequias, queratopatía «en banda», cataratas, glaucoma, edema macular, etc.) (Figura e9.3). Debido a su frecuencia y gravedad, se recomienda realizar revisiones oftalmológicas periódicas en todos los niños con el subgrupo de AIJ oligoarticular. e-310 E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as Figura e9.1. Queratoconjuntivitis seca. Puede apreciarse la existencia de un menisco lagrimal reducido, así como una tinción punteada superficial en la zona central e inferior de la córnea. Figura e9.4. Uveítis anterior aguda. Ojo rojo doloroso en el que destacan los fenómenos inflamatorios agudos como hiperemia ciliar o periquerática, células en cámara anterior, precipitados retroqueráticos y posible formación de sinequias. Espondiloartropatías Seronegativas Son un grupo de enfermedades articulares de naturaleza inflamatoria que comparten una serie de características clínicas (dolor lumbar inflamatorio) y genéticas (positividad del antígeno HLA-B27). En este grupo se incluyen espondilitis anquilosante (EA), artritis psoriásica, artritis reactiva, artritis asociada con enfermedad inflamatoria intestinal y espondiloartropatía indiferenciada. Manifestaciones oftalmológicas © Elsevier. Fotocopiar sin autorización es un delito. Figura e9.2. Escleritis anterior difusa. Se observa la existencia de un edema y congestión vascular profunda, así como una tonalidad violácea de la esclera. La afectación oftalmológica más frecuente en todas las enfermedades de este grupo es la iridociclitis aguda (Figura e9.4). Aproximadamente un tercio de los pacientes con EA desarrollan uno o más episodios de iritis en el curso de su enfermedad. Se trata de una iridociclitis no granulomatosa, unilateral, aguda y recurrente, aunque suele alternar entre ambos ojos en diferentes episodios. Cursa con dolor, enrojecimiento de predominio ciliar o periquerático, fotofobia y disminución variable de visión. Los precipitados endoteliales son finos y existen abundantes células en el humor acuoso (tyndall). La pupila está miótica y la tensión ocular suele estar disminuida por hipofunción del cuerpo ciliar. El vítreo permanece claro y la exploración del fondo de ojo es normal. Éstas y otras manifestaciones oftalmológicas que aparecen en el contexto de enfermedades reumáticas se exponen en la Tabla e9.1. Colagenosis O Enfermedades Del Tejido Conectivo Lupus Eritematoso Figura e9.3. Uveítis anterior crónica en un paciente con artritis idiopática juvenil. Existe un ojo con mínima hiperemia, depósitos cálcicos «en banda» interpalpebral, sinequias iridocristalinianas y cataratas. Se denomina lupus eritematoso sistémico (LES) a una enfermedad autoinmunitaria de origen desconocido, con manifestaciones cutáneas y multisistémicas, que puede afectar a los sistemas articular, renal, sanguíneo, pulmonar, cardiovascular y nervioso central (SNC). e-311 e-312 p a rte 1 0 : C A P Í T U L O S E X T R A Tabla e9.1 Manifestaciones oftalmológicas de las enfermedades reumáticas Tabla e9.2 Manifestaciones oftalmológicas de las conectivopatías Enfermedad reumática Manifestaciones oftalmológicas Enfermedad del tejido conectivo Manifestaciones oftalmológicas Artritis reumatoide Queratoconjuntivitis seca Escleritis, episcleritis Queratitis ulcerativa periférica Queratólisis central Vasculitis reumatoide Toxicidad retiniana por antipalúdicos Esclerodermia Esclerosis palpebral Queratoconjuntivitis seca Oclusiones venosas retinianas Retinopatía hipertensiva Paralisis oculomotoras Miositis Artritis idiopática juvenil (AIJ) Uveítis anterior crónica (formas de AIJ oligoarticular ANA+ en niños menores de 16 años) Iridociclitis anterior aguda en formas de artritis poliarticular HLA B27+ Granulomatosis de Wegener Espondiloartropatías seronegativas Iridociclitis anterior aguda unilateral recidivante Queratitis ulcerativa periférica Escleritis anterior y/o posterior Uveitis anteriores granulomatosas Vasculitis retinianas Neuritis óptica Infiltración orbitaria granulomatosa Lupus eritematoso Polimialgia reumática (en asociación con arteritis de células gigantes) Neuropatía óptica isquémica anterior Lesiones lúpicas discoides en párpados Síndrome de Sjögren secundario Escleritis Exudados algodonosos retinianos Oclusiones venosas y arteriales retinianas Parálisis de pares oculomotores Neuropatía óptica lúpica Alteraciones visuales de origen central Panarteritis nudosa (PAN) Conjuntivitis necrosante Queratitis ulcerativa periférica Escleritis necrosante Neuropatía óptica Parálisis de nervios oculomotores Vasculitis retiniana Retinopatía hipertensiva Coroidopatía isquémica multifocal Polimiositis/ Dermatomiositis Exantema heliotropo palpebral Edema periorbitario Quemosis conjuntival Epiescleritis Oftalmoplejia Vasculitis retiniana Síndrome de Sjögren Queratoconjuntivitis seca Infecciones frecuentes en superficie ocular y párpados Aumento de tamaño de las glándulas lagrimales Neuritis óptica Manifestaciones oftalmológicas La queratoconjuntivitis seca es la manifestación ocular más frecuente del LES, y aparece hasta en el 88% de los pacientes. Puede aparecer también escleritis, así como episodios de uveítis anterior. El hallazgo más característico es la existencia de una vasculitis retiniana, en cuya patogenia se ha implicado la presencia de anticuerpos antifosfolípido, que confieren a estos pacientes un riesgo aumentado de presentación de fenómenos trombóticos sistémicos. La presencia de una vasculitis retiniana se relaciona con la gravedad de la enfermedad. Otras manifestaciones menos frecuentes son la coroidopatía lúpica debida a alteraciones vasculares coroideas, la afectación neuroftalmológica con desarrollo de cuadros de neuropatía óptica y parálisis de los pares craneales, así como la afectación orbitaria (Tabla e9.2). Granulomatosis De Wegener La granulomatosis de Wegener (GW) es una vasculitis necrosante granulomatosa de vasos de pequeño calibre que afecta principalmente al aparato respiratorio, riñones y ojos, aunque puede afectar a numerosos órganos. Destaca la presencia de anticuerpos anticitoplasma de los neutrófilos (c-ANCA). Los ojos y sus anejos se ven afectados, según series, en el 28-87% de los pacientes con GW. La manifestación más frecuente es la queratitis ulcerativa periférica (14-28%). Otras manifestaciones frecuentes son conjuntivitis, escleritis anteriores y posteriores, a menudo necrosantes y con importante afectación estructural. También se han descrito neuritis ópticas isquémicas por vasculitis ciliar posterior o compresivas por afectación del ápex orbitario. Otras alteraciones son el síndrome de Horner, las parálisis oculomotoras y la trombosis del seno cavernoso. La órbita se ve afectada en el 20% de los casos, ya sea de forma primaria o como extensión de la enfermedad a partir de los senos paranasales o la nasofaringe. Síndrome De Sjögren El síndrome de Sjögren (SS) es una enfermedad autoinmunitaria de curso crónico con afectación multisistémica, en la que destaca la afectación de las glándulas exocrinas. Es más frecuente en mujeres de mediana edad. Puede aparecer de forma primaria (SS primario) o asociado con otras enfermedades autoinmunitarias como el LES o la AR (SS secundario). El diagnóstico se alcanza mediante la combinación de una serie de criterios clínicos, entre los que destacan la sequedad ocular y bucal, y de laboratorio (Tabla e9.3). E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as Tabla e9.3 Criterios diagnósticos del síndrome de Sjögren Tabla e9.4 Criterios diagnósticos de la enfermedad de Behçet (al menos un criterio mayor + 2 criterios menores) 1. Síntomas de ojo seco 2. Síntomas de boca seca 3. Signos oculares: Test de Schirmer < 5 mm a los 5 min y/o puntuación positiva del test de rosa de Bengala 4.Afectación salival comprobada por: Gammagrafía salival y/o Sialografía parotídea y/o Flujo salival 21,5 ml en 15 min 5. Biopsia de glándula salival menor positiva 6.Autoanticuerpos: Anti-Ro (SSA) o Anti-La (SSB) o Anticuerpos antinucleares o Factor reumatoide Criterios mayores: – Úlceras orales recidivantes (aftas menores, aftas mayores o úlceras herpetiformes observadas por el médico o el paciente, con un mínimo de tres episodios durante un período de 12 meses) Criterios menores (al menos dos de ellos): – Úlceras genitales recidivantes (úlceras o cicatrizaciones aftosas observadas por el médico o el paciente) – Lesiones oculares (uveítis anterior o posterior, o presencia de células en el vítreo en el examen con lámpara de hendidura, o bien vasculitis retiniana diagnosticada por un oftalmólogo) – Lesiones cutáneas (eritema nudoso observado por el médico o el paciente, seudofoliculitis, o lesiones papulopustulosas, o nódulos acneiformes observados por un médico en pacientes postadolescentes no tratados con corticoides) – Test de patergia positivo (evaluado por un médico a las 24-48 horas) Si se dan tres criterios: diagnóstico probable; más de cuatro criterios: diagnóstico definitivo. Enfermedad De Behçet Manifestaciones oftalmológicas La manifestación más frecuente es la queratoconjuntivitis seca (hasta en un 90% de los casos). Se trata de un ojo seco grave por hiposecreción lagrimal debido a la destrucción de la glándula por una infiltración linfocitaria de ésta. Se caracteriza por la existencia de un menisco lagrimal muy re­ ducido, un tiempo de rotura de la película lagrimal muy acortado, así como por una tinción confluente del epitelio corneal y conjuntival. Son también frecuentes las infecciones de superficie ocular, así como el agrandamiento indo­ loro de la glándula lagrimal (Tabla e9.2). Enfermedades Inflamatorias De Origen Desconocido Sarcoidosis © Elsevier. Fotocopiar sin autorización es un delito. La sarcoidosis es una enfermedad multisistémica de etiología desconocida que se caracteriza por la existencia de granulomas no caseificantes en diferentes órganos, especialmente pulmón, ganglios linfáticos, piel y ojos. Descrita inicialmente por H. Behçet como la tríada de úlceras orales, genitales y uveítis con hipopión. Es una enfermedad inflamatoria crónica multisistémica con un amplio espectro de manifestaciones clínicas. Es más frecuente en los países mediterráneos (Turquía, Grecia) y en el sudeste asiático. Su diagnóstico se basa en una serie de criterios clínicos (Tabla e9.4). Manifestaciones oftalmológicas La manifestación más habitual es la uveítis y es la principal causa de morbilidad en la enfermedad de Behçet. Suelen ser cuadros de panuveítis unilateral o bilateral de curso explosivo y recurrente, con importantes fenómenos inflamatorios. Lo más característico es la vasculitis retiniana, de tipo oclusivo, con células en la cavidad vítrea y edema retiniano, que va produciendo una atrofia retiniana progresiva y movilización pigmentaria debido a la pérdida del lecho vascular (Figura e9.5). Manifestaciones oftalmológicas Aparecen en un 25-60% de los pacientes con sarcoidosis sistémica. Pueden aparecer granulomas conjuntivales u orbitarios, aunque la manifestación más característica es la uveítis anterior, que suele ser de curso crónico, con precipitados retroqueráticos granulomatosos o «en grasa de carnero», sinequias iridocristalinianas y cataratas secundarias. La uveítis intermedia, con vasculitis retiniana y los característicos exudados «en gota de cera» alrededor de los vasos son otra manifestación frecuente. En el segmento posterior del ojo pueden encontrarse granulomas coroideos de gran tamaño, o lo que es más habitual, lesiones del tipo coroiditis multifocal. De forma más excepcional, puede producirse una neuropatía óptica por infiltración del nervio óptico. Figura e9.5. Vasculitis retinana oclusiva evolucionada en paciente con enfermedad de Behçet. Existen oclusión vascular, atrofia óptica, isquemia macular y movilización pigmentaria retiniana. e-313 e-314 p a rte 1 0 : C A P Í T U L O S E X T R A Enfermedades Dermatológicas Dermatitis Atópica Es una enfermedad inflamatoria crónica de la piel que cursa con eritema y prurito, y que se acompaña de alteraciones oculares. Suele existir una historia personal o familiar de asma o alergia. orzuelos y chalazión, conjuntivitis papilar, epiescleritis y sequedad ocular. Puede existir una pérdida visual debido a complicaciones corneales, especialmente la queratitis ulcerativa que empieza en forma de neovascularización en la hemicórnea inferior con opacidades subepiteliales, cicatrización y ulceración. Las manifestaciones oftalmológicas de otros procesos dermatológicos se exponen en la Tabla e9.5. Manifestaciones oftalmológicas En los párpados se produce una blefaritis crónica eccematosa. En el 40% de los pacientes se produce una queratoconjuntivitis bilateral. Suele ser una conjuntivitis papilar hipertrófica que, en casos avanzados, puede desarrollar un componente cicatricial en forma de simbléfaron, entropión y triquiasis. Entre otras manifestaciones corneales se incluyen pannus, opacidades estromales superficiales y raramente se presenta adelgazamiento corneal periférico con opacificación y vascularización. Existe una mayor incidencia de queratocono, probablemente debido al rascado crónico. También pueden aparecer cataratas corticales anteriores. Acné Rosácea Enfermedad caracterizada por la presencia de eritema y telangiectasias en áreas expuestas al sol de cara y tronco superior. Manifestaciones oftalmológicas La manifestación más frecuente es una blefaroconjuntivitis crónica con telangiectasias en el margen palpebral y disfunción de las glándulas de Meibomio. Pueden producirse Enfermedades Infecciosas Sistémicas Infecciones Por Micobacterias Tuberculosis La tuberculosis (TBC) es una infección crónica causada por Mycobacterium tuberculosis, que se caracteriza por la formación de granulomas en los tejidos infectados. Su incidencia ha aumentado debido a la infección por el virus de la inmunodeficiencia humana (VIH) y por la llegada de inmigrantes procedentes de zonas endémicas de TBC. El órgano más afectado es el pulmón. Manifestaciones oftalmológicas Ocurren en 1-2% de los pacientes con TBC. La manifestación más característica es la uveítis anterior granulomatosa (Figura e9.6). También pueden observarse lesiones coroideas granulomatosas (tuberculomas) y cuadros de vasculitis retiniana (sobre todo flebitis), con gran tendencia a desarrollar isquemia retiniana. También pueden aparecer conjuntivitis, flicténulas conjuntivales y escleroqueratitis. Tabla e9.5 Manifestaciones oftalmológicas de las enfermedades dermatológicas Enfermedad dermatológica Características principales Manifestaciones oftalmológicas Seudoxantoma elástico Hereditaria. Elastosis en la dermis y vasos sanguíneos Estrías angioides. Neovascularización subretiniana macular Síndrome de Ehler-Danlos Alteración del metabolismo del colágeno con fragilidad del tejido conectivo Escleróticas azules, estrabismo, miopía, queratocono, subluxación cristalino, córnea muy fina Psoriasis Enfermedad cutánea con maduración anormal de la epidermis. Placas eritematosas con descamación en cuero cabelludo y zonas de extensión Uveítis anterior aguda (asociada a artropatía psoriásica). Habituales lesiones cutáneas palpebrales Síndrome de Stevens-Johnson Forma severa de eritema multiforme. Reacción autoinmune generalizada con afectación de piel y mucosas, desencadenada por fármacos y/o infecciones. Depósitos de inmunoglobulinas y complemento en la membrana basal 70-90% casos: Conjuntivitis grave con gran exudación, descamación y formación de ampollas y costras. A largo plazo, cicatrización conjuntival, entropión, metaplasia epitelial, ojo seco grave y neovascularización corneal Penfigoide ocular cicatricial Enfermedad ampollosa autoinmunitaria con afectación de piel y mucosas, de curso crónico y recidivante 90% de los pacientes: Conjuntivitis crónica bilateral asimétrica, fibrosis subconjuntival, acortamiento de fondos de saco, simbléfaron y progresiva vascularización y opacificación corneal E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as endoftalmitis, con importante turbidez del vítreo y formación de agregados celulares a modo de collar de perlas. Infecciones Por Parásitos Acantamoeba La manifestación más frecuente es la queratitis, que afecta habitualmente a portadores de lentes de contacto con hábitos de higiene inadecuados. Es un cuadro muy doloroso, con afectación inicial del epitelio corneal, que adopta en ocasiones un patrón dendrítico, asociado con la afectación de los nervios corneales (queratoneuritis). Posteriormente, puede verse afectada la estroma, desarrollando infiltrados estromales multifocales o «en anillo». Figura e9.6. Uveítis anterior granulomatosa en paciente con tuberculosis pulmonar. Puede apreciarse la existencia de precipitados «en grasa de carnero» salpicados por todo el endotelio corneal, así como la existencia de sinequias y cataratas. Toxoplasmosis Infecciones Por Espiroquetas La toxoplasmosis es una zoonosis causada por el parásito intracelular obligado Toxoplasma gondii. La enfermedad puede ser congénita o adquirirse después del nacimiento, habitualmente por consumo de alimentos o agua contaminada. Sífilis Manifestaciones oftalmológicas La sífilis es una infección crónica generalizada causada por la espiroqueta Treponema pallidum que suele ser de transmisión sexual y en la que se alternan episodios de actividad y períodos de latencia. Manifestaciones oftalmológicas Es conocida como la «gran simuladora». Puede producir lesiones oculares en cualquier localización, desde la córnea hasta el nervio óptico. Puede verse afectada la córnea desarrollando un cuadro de queratitis intersticial. En la úvea puede existir cualquier patrón de uveítis. La forma anterior suele ser bilateral no granulomatosa. Pueden aparecer lesiones del tipo coriorretinitis multifocal o difusa. Otras manifestaciones son la pupila de Argyll-Robertson (pupila miótica, irregular, con disociación de la respuesta a la luz y a la acomodación), parálisis oculomotoras, etc. La retinopatía «en sal y pimienta» consiste en una importante movilización pigmentaria retiniana que suele acompañar a las formas de sífilis congénita. La manifestación más frecuente es una retinocoroiditis focal necrosante (Figura e9.7), que cursa a menudo con intensa vitritis y vasculitis retiniana en la vecindad del foco de retinitis. Puede también asociarse con uveítis anterior, a menudo con hipertensión ocular. La forma congénita suele ser más grave y afectar a ambos ojos, con desarrollo de lesiones maculares e incluso microftalmos. Infecciones Por Virus Infecciones por el virus del herpes simple Las infecciones por el virus del herpes simple (HSV) se encuentran entre las enfermedades más comunes que afectan a los seres humanos. Se dividen en dos cepas distintas: HSV-1, que causa herpes labial, estomatitis herpética y queratitis, y HVS-2, que suele producir herpes genital. © Elsevier. Fotocopiar sin autorización es un delito. Infecciones Por Hongos Candidiasis Es la infección fúngica sistémica y ocular más frecuente. Suele afectar a pacientes con alguno de los siguientes factores de riesgo: drogadicción intravenosa, tratamiento intravenoso prolongado, alimentación parenteral, traumatismo o cirugía reciente, catéteres, inmunosupresión y neoplasias. Los casos en individuos sanos son raros. Manifestaciones oftalmológicas Suele ser un cuadro bilateral. El germen accede a las estructuras oculares a través de la circulación coroidea, pasando luego a la retina y al vítreo, causando, en primer lugar, una coriorretinitis multifocal y posteriormente una verdadera Figura e9.7. Retinocoroiditis focal necrosante en un paciente con toxoplasmosis ocular. Se observa un foco de retinitis necrosante con vitritis asociada, adyacente a una cicatriz pigmentada característica. e-315 e-316 p a rte 1 0 : C A P Í T U L O S E X T R A Manifestaciones oftalmológicas Suele ser unilateral en un 90% de los casos. La mayoría de las infecciones primarias se producen en la infancia y la adolescencia y suelen ser subclínicas. Las recurrencias, sin embargo, pueden ser mucho más graves. La infección ocular recurrente por HVS se manifiesta de distintas formas: 1. Queratitis epitelial infecciosa: la queratitis dendrítica (Figura e9.8) es la manifestación más frecuente y habitual de la infección ocular por el HSV. Consiste en una úlcera lineal ramificada, cuyas terminaciones suelen ser prominentes. A menudo se asocia con hiposensibilidad corneal. 2. Queratitis epitelial no infecciosa o úlcera corneal metaherpética, con bordes sobreelevados. 3. Queratitis estromal. Puede deberse a replicación viral en la estroma corneal o a mecanismos inmunitarios. Suele presentarse tras varias recurrencias. 4. Endotelitis. En relación con mecanismos inmunitarios. Cursa como un área de edema corneal localizado, a menudo central, con precipitados retroqueráticos en el área del edema. 5. Uveítis anterior. Suele ser unilateral e hipertensiva, recidivando siempre en el mismo ojo. A menudo cursa con atrofia sectorial del iris por necrosis isquémica de éste. 6. Retinitis. La manifestación habitual es un cuadro de retinitis necrosante caracterizada por áreas amarillentas de necrosis de la retina que van confluyendo. Suele asociarse con una importante vasculitis oclusiva y celularidad vítrea. Infecciones por virus varicela zóster Hutchinson). Puede producir conjuntivitis, queratitis ­dendritiforme, uveítis granulomatosa con atrofia de la estroma iridiana, así como cuadros de necrosis retiniana aguda. Otras complicaciones son el desarrollo de glaucoma secundario, cataratas, isquemia del segmento anterior, midriasis paralítica, etc. El virus varicela zóster (VZV) es también el agente etiológico de la necrosis retiniana externa progresiva, retinitis más grave y rápidamente destructiva en pacientes con sida. Las manifestaciones oftalmológicas de otras enfermedades infecciosas relevantes se describen en la Tabla e9.6. Enfermedades Cardiovasculares Endocarditis Infecciosa Infección microbiana del endocardio que afecta principalmente a las válvulas cardíacas en las que se producen unas alteraciones habituales denominadas «vegetaciones». Manifestaciones oftalmológicas 1. Petequias palpebrales y conjuntivales. 2. Hemorragias retinianas superficiales. Son habituales, aunque no patognomónicas, las manchas de Roth (hemorragia redondeada con centro blanco constituido por linfocitos, plaquetas y fibrina) (Figura e9.9). 3. Embolias retinianas (procedentes del foco de endocarditis), ya sea de arteria central de la retina, de una rama o de arteriolas terminales. 4. Infecciones intraoculares por émbolos sépticos: coroiditis, retinitis o endoftalmitis. 5. Alteraciones neuroftalmológicas secundarias a la afectación del SNC por oclusiones vasculares, abscesos, etc. El herpes zóster oftálmico se caracteriza por un cuadro de erupción vesicular en el territorio de la rama oftálmica del V par. Es característica la afectación ocular cuando la erupción vesicular afecta a la punta de la nariz (signo de Figura e9.8. Queratitis epitelial dendrítica característica de la infección corneal por virus del herpes simple. Se aprecian una ulceración epitelial con morfología arboriforme y dilataciones terminales a modo de bulbos, que se tiñen con los colorantes vitales. Figura e9.9. Mancha de Roth. Hemorragia retiniana con centro blanquecino característica de la endocarditis infecciosa. E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as Tabla e9.6 Manifestaciones oftalmológicas de otras enfermedades infecciosas Enfermedad infecciosa Manifestaciones oftalmológicas Infecciones bacterianas Brucelosis Manifestación más habitual: uveítis (uveítis anterior, coroiditis, panuveítis con vitritis) Difteria Conjuntivitis con abundantes membranas y secreción mucopurulenta turbia. Puede producir necrosis y perforación corneal Endoftalmitis endógena Pacientes con factores de riesgo (drogadicción por vía parenteral, diabetes mellitus, traumatismo o cirugía reciente, valvulopatías, cáncer y tratamientos inmunosupresores). Cuadro de edema palpebral, edema corneal, uveítis anterior con hipopión, infiltración vítrea con pérdida del reflejo de fondo, focos de retinocoroiditis, etc. Infecciones por micobacterias Lepra Alopecia de la cola de la ceja, lagoftalmos paralítico, malposiciones palpebrales, etc. Hiposensibilidad corneal, queratitis avascular, sequedad ocular. Escleritis Uveítis anterior. Sinequias. Perlas de iris en el esfínter pupilar Infecciones por espiroquetas Enfermedad de Lyme En individuos procedentes de zonas endémicas o viajes recientes. Cuadro de eritema crónico migratorio, artritis y afectación neurológica y/o cardíaca Conjuntivitis aguda (manifestación más frecuente) Inflamación intraocular: uveítis anterior. Uveítis intermedia. Papiledema. Neuropatía óptica isquémica Infecciones por Chlamydia Tracoma Primera causa de ceguera prevenible en el mundo Conjuntivitis folicular crónica que produce cicatrización de córnea y conjuntiva Conjuntivitis de inclusión del adulto Enfermedad de transmisión sexual Cuadro subagudo de conjuntivitis folicular, con adenopatía preauricular y posible afectación corneal leve-moderada Síndrome de Reiter Artritis reactiva asociada a lesiones urogenitales, intestinal y oculares (conjuntivitis, uveítis anterior) Infecciones por Rickettsia Rickettsiosis Infecciones transmitidas por la picadura de artrópodos Cursan con exantema, fiebre y cefalea. En los ojos, conjuntivitis hemorrágica. Puede producir cuadros de vasculitis retiniana Infecciones por hongos Aspergilosis Cuadros de endoftalmitis endógena en pacientes inmunodeprimidos (similar al descrito). Riesgo de queratitis infecciosas en traumatismos de origen vegetal Mucormicosis En diabéticos mal controlados e inmunocomprometidos. Cuadro de mucormicosis rinoorbitocerebral. Celulitis orbitaria y parálisis de múltiples pares craneales. Extrema gravedad © Elsevier. Fotocopiar sin autorización es un delito. Infecciones por helmintos Toxocariasis Infección por Toxocara canis, huésped definitivo el perro (cachorros). Puede producir cuadros de endoftalmitis crónica, granuloma periférico o granuloma de polo posterior. Debe hacerse el diagnóstico diferencial con retinoblastoma y otras causas de leucocoria Oncocercosis Filariasis por Onchocerca volvulus. Conocida como «ceguera de los ríos». Produce nódulos subcutáneos, exantema, linfadenitis esclerosante y lesiones oculares (queratitis, uveítis anterior y coriorretinitis con gran movilización pigmentaria) Infecciones por virus Citomegalovirus (CMV) Infección intraocular más frecuente en pacientes con sida y primera causa de ceguera. Requiere inmunodepresión profunda. Cuadro de retinitis necrosante con abundantes hemorragias (imagen «en queso y tomate»). Vítreo sin infiltración celular. Frecuente vasculitis extensa. Mal pronóstico. Evolución hacia desprendimiento de retina con frecuencia Virus de la inmunodeficiencia humana (VIH) El 30-70% de los pacientes con sida desarrollan afectación ocular. – Párpados: sarcomas de Kaposi, linfoma no hodgkiniano (tumores oftalmológicos más frecuentes en el sida) – La microangiopatía retiniana es la alteración retiniana más frecuente en pacientes con sida. Se caracteriza por exudados algodonosos y hemorragias retinianas alrededor de las arcadas vasculares de la retina – Retinitis por CMV – Necrosis retiniana externa progresiva (virus varicela zóster) – Otras infecciones oportunistas: toxoplasmosis ocular, coroiditis tuberculosa, uveítis sifilítica, coroiditis por Pneumocystis, coroiditis criptocócica, etc. e-317 e-318 p a rte 1 0 : C A P Í T U L O S E X T R A Prolapso De La Válvula Mitral Manifestaciones oftalmológicas Enfermedad en la que durante la sístole se produce la pro­ trusión retrógrada de una o las dos valvas hacia la aurícula, auscultándose un chasquido o clic sistólico y un soplo sistólico tardío. Las principales manifestaciones oftalmológicas son dos: Manifestaciones oftalmológicas Entre un 30 y un 50% de los pacientes no tratados presentan una disminución importante de visión por neuropatía óptica isquémica o por obstrucción de la arteria central de la retina. Ante cualquiera de estos dos cuadros debe sospecharse la existencia de una arteritis de células gigantes en todo paciente de edad avanzada, en especial si presenta cefaleas, cansancio, malestar general y fiebre, y es más probable si existe hipersensibilidad en el área de la arteria temporal, polimialgia reumática o aumento de la velocidad de sedimentación globular (VSG). El diagnóstico se confirma con biopsia de arteria temporal. Constituye una urgencia terapéutica, y debe instaurarse tratamiento con megadosis de corticoides 3 días, seguido por corticoides por vía oral en pauta descendente y mantenimiento prolongado. Las manifestaciones oftalmológicas se deben al carácter embolígeno de la enfermedad, con oclusiones arteriales en retina y coroides; también pueden aparecer obstrucciones venosas retinianas y clínica neurooftalmológica secundaria a tromboembolismo cerebral. Insuficiencia Carotídea Se debe a la estenosis u oclusión de la luz arterial que produce la hipoperfusión de los tejidos irrigados por ella. La isquemia se produce por dos mecanismos: hipoperfusión (por la estenosis) y liberación de émbolos. Manifestaciones oftalmológicas Amaurosis fugax, aislada o asociada con manifestaciones neurológicas por la isquemia del hemisferio cerebral homolateral (paresias y parestesias contralaterales a la lesión). Isquemia aguda por embolización 1. Obstrucciones arteriales en distintas localizaciones (arteria oftálmica, central de la retina, ramas arteriales retinianas o arterias ciliares posteriores). Isquemia crónica por hipoperfusión 1. Síndrome isquémico del segmento posterior, por hipoperfusión retiniana y coroidea, con tortuosidad venosa, microaneurismas, hemorragias, exudados algodonosos, anastomosis arteriovenosas y neovasos. 2. Síndrome isquémico del segmento anterior, con edema corneal, cataratas, congestión de vasos epiesclerales, rubeosis y glaucoma neovascular (GNV). La presión intraocular (PIO) puede no estar muy elevada debido a la menor producción de humor acuoso por hipoperfusión del cuerpo ciliar. 1. Neuropatía óptica isquémica anterior aguda. 2. Obstrucción de la arteria central de la retina. Fístula Carótido-Cavernosa Es una comunicación arteriovenosa que se establece entre la arteria carótida o alguna de sus ramas y el seno cavernoso, así la sangre arterial accede al sistema venoso sin atravesar la red capilar. Manifestaciones oftalmológicas Las manifestaciones oftalmológicas serán diferentes según el tipo de fístula. Fístula directa La comunicación se establece a partir del propio tronco de la arteria carótida interna; son fístulas casi siempre de flujo alto, producidas por traumatismos craneoencefálicos importantes. Suponen un 75% del total. El cuadro clínico es muy aparatoso (Figura e9.10): Arteritis Del Células Gigantes, Arteritis De La Temporal, Enfermedad De Horton O Arteritis Craneal Panarteritis sistémica que afecta arterias de grueso y de mediano calibre. Se localiza principalmente en las ramas de la arteria carótida y es clínicamente significativa la afectación de la arteria temporal. Aparece en personas con edades superiores a los 55 años con predominio del sexo femenino y debe considerarse una enfermedad grave, ya que puede causar ceguera unilateral o bilateral y fallecimiento por accidente cerebrovascular o infarto de miocardio. Figura e9.10. Fístula carótido-cavernosa. Exoftalmos pulsátil y dilatación vascular «en cabeza de medusa». E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as 1. Exoftalmos unilateral pulsátil, generalmente acompañado de dolor orbitario. 2. Dilatación de venas conjuntivales y epiesclerales, «en cabeza de medusa», quemosis. 3. Edema palpebral, ptosis, dilatación y tortuosidad de venas palpebrales. 4. Oftalmoplejía, generalmente paresia del VI par craneal. 5. Hipertensión ocular, glaucoma. 6. Dilatación y tortuosidad de venas retinianas, oclusión de la vena central, edema papilar, desprendimiento coroideo, desprendimiento seroso de retina, etc. 7. Síndrome isquémico del segmento posterior y anterior. Fístula dural o indirecta La comunicación se establece con ramas de la arteria carótida interna o externa situadas en la duramadre del seno cavernoso, son de flujo bajo y producidas de modo espontáneo; están relacionadas con aterosclerosis, hipertensión arterial (HTA) o malformaciones congénitas, y suponen un 25% del total. Los síntomas son mucho menos espectaculares que en las fístulas directas. La tríada característica consiste en exoftalmia discreta que no suele ser pulsátil, dilatación de vasos epiesclerales y elevación de la PIO. Enfermedades Pulmonares Insuficiencia Respiratoria La insuficiencia respiratoria crónica produce un cuadro oftalmológico caracterizado por cianosis facial, edema palpebral bilateral, edema e hiperemia conjuntival con tortuosidad venosa y petequias. En el fondo de ojo puede observarse una coloración denominada «cianosis de la retina», dilatación y tortuosidad de las venas que en el área macular producen imagen de vénulas «en tirabuzón» o «en cabeza de medusa» y edema difuso del parénquima retiniano, hemorragias intrarretinianas o prerretinianas, y signos de trombosis o pretrombosis. © Elsevier. Fotocopiar sin autorización es un delito. Tabaquismo El tabaco y el alcohol se relacionan con un tipo específico de neuropatía óptica retrobulbar, progresiva e indolora, que suele ser bilateral. También se asocia con la degeneración macular asociada a la edad, considerándose el más importante y previsible factor de riesgo de esta entidad. Síndromes Paraneoplásicos Del Cáncer Broncopulmonar Retinopatía asociada a cáncer o síndrome CAR (cancer associated retinopathy) Está relacionada con distintas neoplasias (adenocarcinoma endometrial, ovario, ductal de mama, cervix, rabdomiosarcoma, cáncer de próstata), siendo el carcinoma broncopulmonar el más frecuente, y especialmente el oat cell pulmonar. El fondo de ojo puede ser aparentemente normal o presentar estenosis arteriolar e hiperpigmentación granulosa. El diagnóstico se establece por exclusión, siendo la presencia de la tríada de fotosensibilidad, escotoma anular e importante reducción del calibre de las arteriolas retinianas lo que nos ha de hacer sospechar este cuadro. Aproximadamente en la mitad de los casos, los síntomas del síndrome CAR preceden a la detección del tumor maligno. Metástasis ocular de cáncer broncopulmonar primario Entre el 10 y el 15% de las metástasis uveales en el hombre son de origen broncopulmonar (en mujeres más del 50% son mamarias) y en el 21% de los casos, multifocales. El cáncer broncopulmonar es, tras el cáncer de mama, la causa más frecuente de metástasis orbitarias. Manifestaciones Oculares De La Extensión Locorregional Del Cáncer Broncopulmonar Síndrome de la vena cava superior Se debe a la obstrucción o invasión de la vena cava superior por el tumor. Se caracteriza por cefalea, cianosis facial y retiniana, ingurgitación yugular, circulación colateral en la región esternocleidomastoidea, inflamación palpebral y congestión venosa conjuntival «en cabeza de medusa»; en las formas más obstructivas puede aparecer exoftalmos. Síndrome de Pancoast Se debe a un tumor pulmonar localizado en el ápex pulmonar que invade el plexo braquial, el ganglio estrellado y los dos primeros arcos costales. Se caracteriza por dolor escapular, dolor radicular desde C8 irradiado hasta el quinto dedo y síndrome de Claude-Bernard-Horner homolateral. Enfermedades Endocrinometabólicas En este apartado se describen las manifestaciones oftalmológicas de la enfermedad de Graves-Basedow en el grupo de las enfermedades endocrinológicas y de la amiloidosis en el de las metabólicas. Otras enfermedades aparecen descritas en las tablas correspondientes. La diabetes mellitus se describe con detalle en un capítulo aparte. Enfermedad De Graves-Basedow La enfermedad de Graves-Basedow (EGB) es un trastorno autoinmunitario en el que aparece, asociado con el síndrome clínico-bioquímico del hipertiroidismo, un bocio difuso hiperfuncionante, oftalmopatía tiroidea y, en ocasiones, dermopatía infiltrativa. La EGB suele afectar a mujeres entre 40 y 60 años de edad. Se producen anticuerpos estimulantes del receptor de la TSH (presentes en el 95% de los pacientes), así como una infiltración tiroidea linfocítica. Las manifestaciones clínicas no oftalmológicas de la EGB se resumen en la Tabla e9.7. e-319 e-320 p a rte 1 0 : C A P Í T U L O S E X T R A Tabla e9.7 Manifestaciones generales de la enfermedad de Graves-Basedow Tabla e9.8 Otras manifestaciones oftalmológicas de la oftalmopatía tiroidea Concepto Manifestaciones generales Signos y síntomas Causa Tirotoxicosis Nerviosismo, labilidad emocional, temblor, insomnio, irritabilidad, hipersudoración, intolerancia al calor, astenia, palpitaciones, taquicardia, pérdida de peso, etc. En pacientes jóvenes predominan el nerviosismo y la labilidad emocional, en los de mayor edad las manifestaciones cardiovasculares Ptosis bilateral y edema periorbitario Hinchazón secundaria a la acumulación de mucopolisacáridos Madarosis (caída de pestañas) Déficit nutricional Ojo seco Infiltración de glándulas lagrimales por tejido mixomatoso Nictalopía (mala visión nocturna) Déficit en síntesis de retinoides Nistagmo Miopatía restrictiva Glaucoma Depósitos de aminoglicanos en la malla trabecular Bocio difuso Aumento del tamaño de la glándula tiroidea (70% de los casos) Dermopatía infiltrativa Edema e induración del tejido subcutáneo. Piel con aspecto «en piel de naranja». Puede acompañarse de prurito e hiperpigmentación. Aparece en el 5-10% de los casos, en fases tardías de la enfermedad y casi siempre en pacientes con oftalmopatía Alteraciones bioquímicas TSH suprimida. Hormonas tiroideas elevadas (T3 > T4). TBG disminuida. Presencia de anticuerpos estimulantes del receptor TSH (marcador de eficacia del tratamiento) reflejo pupilar aferente, por compresión del nervio óptico en el ápex orbitario. En la Tabla e9.8 se resumen otras manifestaciones de la oftalmopatía tiroidea. Amiloidosis Oftalmopatía tiroidea La oftalmopatía tiroidea aparece clínicamente en el 50% de los pacientes con EGB, pero este porcentaje aumenta al 90% si se tienen en cuenta los datos aportados por las técnicas de imagen. Es la causa más frecuente de exoftalmos en el adulto. Entre las manifestaciones clínicas destaca la retracción palpebral, que es uno de los signos más característicos de la oftalmopatía tiroidea. La afectación de tejidos blandos produce exoftalmos, posiblemente la manifestación más frecuente (Figura e9.11). Se produce un desplazamiento anterior del globo ocular a causa del aumento de volumen de las estructuras orbitarias. Suele ser bilateral. El exoftalmos se puede cuantificar mediante un exoftalmómetro, considerándose normal un valor igual o inferior a 21 mm. El 10-15% de los pacientes con EGB desarrollan una oftalmoplejía, que se manifiesta en forma de diplopía, producida por disfunción de los músculos extraoculares, debida a infiltración celular, edema y fibrosis restrictiva. Los músculos más afectados son el recto medio y el recto inferior. El 3-5% de los pacientes con EGB presentan una neuropatía óptica compresiva, con presencia de discromatopsia, pérdida de visión y alteración del Esta enfermedad se produce por depósito intracelular y extracelular de material amiloide en distintos tejidos. La afectación ocular varía en las diferentes formas de amiloidosis. La amiloidosis primaria generalizada (idiopática y rápidamente letal) presenta manifestaciones oftalmológicas múltiples por infiltración de tejidos oculares, como los músculos (diplopía), conjuntiva (nódulos amarillentos), glándula lagrimal (ojo seco), tejidos orbitarios (proptosis), coroides, etc. Las manifestaciones oculares en la amiloidosis asociada a un mieloma múltiple son muy similares a las ya descritas, así como las propias de las amiloidosis secundarias generalizadas (que aparecen en el contexto de infecciones o inflamaciones crónicas, sobre todo tuberculosis, lepra, AR y ciertos síndromes nefróticos). Existen cuatro formas de amiloidosis heredofamiliares, de herencia autosómica dominante, cuyas manifestaciones oftalmológicas se resumen en la Tabla e9.9. Otras enfermedades metabólicas se resumen en la Tabla e9.10. Enfermedades Neurológicas Esclerosis Múltiple Figura e9.11. Exoftalmos tiroideo en un paciente con enfermedad de Graves-Basedow. Pueden observarse, además, la retracción del párpado superior y la exposición del área limbar superior. La esclerosis múltiple (EM) es el trastorno neurológico más frecuente en la población joven. Se trata de una enfermedad desmielinizante del SNC, que cursa presentando síntomas de alteración neurológica focal o multifocal con períodos de remisión y exacerbación. Es más frecuente en las mujeres y suele aparecer entre los 20 y los 40 años. La manifestación ocular más frecuente en los pacientes con EM es la neuritis óptica (NO), generalmente retrobulbar. La NO es la primera manifestación de la EM en un cuarto E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as Tabla e9.9 Amiloidosis heredofamiliares Amiloidosis Manifestación oftalmológica característica Otras manifestaciones oftalmológicas I (Portuguesa) II (Indiana) Amiloidosis vítrea (velos vítreos retrocristalinianos bilaterales) Glaucoma secundario, ojo seco (más en tipo I) III (Iowa) No manifestaciones oculares IV (Meretoja) Distrofia corneal reticular Afectación pares craneales Tabla e9.10 Otras enfermedades metabólicas Enfermedad metabólica Material depositado Manifestación oftalmológica característica Otras manifestaciones oftalmológicas Cistinosis Cistina (aa) Depósito corneal (90%) central y en todo el espesor, en forma de agujas doradas Depósito conjuntival (85%), depósito retiniano (raro) Homocistinemia Homocisteína (aa) Ectopia de cristalino (90%) Miopía, iris claro Galactosemia Galactosa (HC) Catarata bilateral precoz Hiperlipoproteinemias Lípidos Xantelasma Xantoma tuberoso, arco senil corneal Opacidades corneales centrales finas en estroma profundo Opacidad corneal severa extensa Retinosis pigmentaria Ptosis, ectropión Ptosis, exotropía, nistagmo, catarata Hipolipoproteinemia Enfermedad de Tangier Enfermedad de los ojos de pez Abetalipoproteinemia Enfermedad de Fabry Globotriosilceramida Córnea verticillata Enfermedad de Wilson Cobre Anillo corneal de Kayser-Fleischer Hemocromatosis Hierro Depósito férrico en tejidos oculares Catarata «en girasol» © Elsevier. Fotocopiar sin autorización es un delito. aa: aminoácidos; HC: hidratos de carbono de los casos, presentándose durante la evolución en el 70-75% de los pacientes afectados de EM. Se ha descrito la utilidad de la resonancia magnética (RM) en la predicción del desarrollo de EM tras un primer brote de NO, según el número de lesiones desmielinizantes presentes (deben tener al menos 3 mm de diámetro). Si no existe ninguna lesión, la probabilidad de desarrollar EM a los 15 años es del 25%, porcentaje que aumenta al 60% si existe una lesión y al 78% si aparecen tres o más lesiones. Los pacientes afectados de EM tienen mayor prevalencia de uveítis intermedia (UI), cifrándose esta prevalencia en torno al 30%. Ante una UI en un paciente joven, sobre todo si es mujer, debe descartarse la presencia de una EM, que será diagnosticada entre el 1 y el 16% de los casos. Pueden existir también otras manifestaciones de inflamación intraocular, como vasculitis retiniana periférica (fundamentalmente periflebitis), edema macular y nódulos iridianos. Hipertensión Intracraneal El aumento de la presión intracraneal (PIC) produce una serie de manifestaciones generales (cefalea, náuseas y vómitos, signos de focalidad neurológica, etc.) y una manifestación oftalmológica característica, el papiledema, definido como el edema de papila bilateral asociado con un incremento de la PIC (Figura e9.12). En todo paciente con papiledema se debe sospechar la existencia de una masa intracraneal hasta que se demuestre lo contrario. No obstante, no todos los pacientes con aumento de la PIC presentan papiledema, pues en algunas formas clínicas éste es más tardío o puede estar ausente por cicatrización glial de la cabeza del nervio óptico si han existido episodios previos. En las formas tempranas de papiledema no existe alteración campimétrica ni de la motilidad ocular, así como tampoco pérdida de agudeza visual. Sí pueden aparecer episodios transitorios de «oscurecimientos» visuales, en ocasiones desencadenados por cambios de posición, que no implican peor pronóstico visual. Los papiledemas de larga evolución se asocian con pérdida de agudeza visual y deterioro progresivo del campo visual, producido por la atrofia de las fibras nerviosas. Migraña, Cefaleas Y Algias Faciales La migraña es un trastorno que afecta al 10% de la población, en forma de episodios repetidos de cefalea pulsátil generalizada, en muchas ocasiones hemicraneal, que se suele acompañar de sonofobia, fotofobia, náuseas y vómitos. Alrededor del 30% de las migrañas presentan la denominada aura, un pródromo, generalmente visual, que e-321 e-322 p a rte 1 0 : C A P Í T U L O S E X T R A Figura e9.12. Papiledema en un paciente con tumor intracraneal. Borrosidad y elevación de los bordes del disco óptico. precede a la cefalea, que será más intensa y duradera que la de una migraña sin aura. Existen auras no visuales, como hemihipoestesias, anestesias peribucales o afasia, pero el aura habitual es el «espectro de fortificación», patognomónico de la migraña. Se define como un escotoma centelleante, que comienza en el punto de fijación y se extiende hacia la periferia. En los bordes del escotoma aparecen líneas luminosas en forma zigzag. Suele durar en torno a 20 minutos y desaparece cuando se inicia la cefalea. Existen raras formas de migraña complicada, definida por la presencia de fenómenos neurológicos más intensos y, en ocasiones, permanentes, entre los que se incluyen parálisis oculomotoras o vasculopatía retiniana. La cefalea «en racimos» es una cefalea episódica, de minutos u horas de duración, que asocia epífora ipsilateral, rubor facial y rinorrea. Se presenta en forma de ataques agrupados durante semanas o meses, generalmente a la misma hora del día. La cefalea es intensa y punzante, suele originarse en la región ocular y se propaga posteriormente. La neuralgia del trigémino se caracteriza por crisis de dolor lancinante muy intenso y breve (segundos de duración) en el territorio inervado por las ramas maxilar y mandibular del V par craneal. Aparece en pacientes ancianos, con más frecuencia en mujeres. Rara vez es bilateral. Enfermedades Genéticas Anomalías De Número Se incluyen aquellos síndromes en los que existe un número anómalo de cromosomas en las células, resultado de una deficiente disyunción de los gametos en la meiosis. La trisomía del 21 (síndrome de Down) es la anomalía cromosómica más común, así como la causa más frecuente de retraso mental. En torno al 65-70% de los pacientes presentan anomalías oculares. Las más frecuentes son la hendidura palpebral estrecha y los pliegues epicantales. Presentan mayor incidencia de blefaritis, miopía y estrabismo que la población general. El 10% de los pacientes presentan queratocono, posiblemente relacionado con el frotamiento ocular. La catarata es la anomalía cristaliniana más frecuente, generalmente precoz (pospuberal) y corticonuclear. La trisomía del 18 (síndrome de Edwards) es la segunda anomalía autosómica en frecuencia. Existen alteraciones oculares en el 50% de los casos, siendo las más frecuentes la estenosis de hendiduras interpalpebrales con hipertelorismo, el coloboma de iris, el microftalmos y la catarata (presente en menos del 10% de los casos). La trisomía del 13 (síndrome de Patau) es una de las anomalías cromosómicas que más frecuentemente causa alteraciones oculares, que incluso pueden ayudar al diagnóstico. Es la tercera trisomía en frecuencia. El 95% de los bebés afectados mueren antes del año de edad. Es constante la afectación ocular, generalmente bilateral. Pueden aparecer microftalmos, colobomas, persistencia hiperplásica de vítreo primario, cataratas, persistencia de arteria hialoidea, opacidades corneales, anomalía de Peters, hipoplasia de nervio óptico, etc. ANOMALÍAS DE ESTRUCTURA (Tabla E9.11) Anomalías De Los Cromosomas Sexuales El síndrome de Turner se da en individuos fenotípicamente femeninos pero cuyo genotipo corresponde a un solo cromosoma X (60% de los casos), un mosaico de 45X/46XX o un cromosoma X normal y una anomalía estructural del otro cromosoma X. Las manifestaciones oculares más frecuentes son ambliopía, estrabismo, hipermetropía, ptosis, hendiduras palpebrales antimongoloides y discromatopsia en el eje rojo-verde. El síndrome de Klinefelter afecta a hombres que poseen dos cromosomas X y uno Y (47XXY), aunque un 15% son mosaicos. Es la anomalía de diferenciación sexual más frecuente, y ocurre en uno de cada 500 hombres. Las manifestaciones oculares son infrecuentes e inespecíficas. Se incluyen anoftalmos bilateral, ametropías, colobomas uveales, retinosis pigmentaria, estrabismo, ptosis, heterocromía de Fuchs, queratocono posterior, etc. Es de destacar la posible existencia de discromatopsias ligadas al cromosoma X, como la protanopia o la deuteranopia. E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as Tabla e9.11 Anomalías cromosómicas de estructura (manifestaciones por orden decreciente de frecuencia; en negrita manifestación más importante o característica) Anomalía cromosómica Manifestaciones oculares Deleción del brazo corto del cromosoma 5 (síndrome del maullido de gato) Pliegues epicantales, estrabismo, ametropías, catarata congénita, hipoplasia del nervio óptico, ojo seco, anomalías pigmentación macular Deleción del brazo corto del cromosoma 4 (síndrome de Wolff-Hirschon) Hipertelorismo, nistagmo, estrabismo, ptosis, coloboma de iris, catarata, ectopia pupilar Deleción del brazo largo del cromosoma 13 Hipertelorismo, epicanto, ptosis palpebral, microftalmos, retinoblastoma Deleción del brazo corto del cromosoma 18 Ptosis, pliegues epicantales, estrabismo, hipertelorismo Deleción del brazo largo del cromosoma 18 Hipertelorismo, nistagmo, pliegues epicantales, estrabismo, ptosis, palidez del disco óptico Deleción 11p13 (región 13 del brazo corto del cromosoma 11) Aniridia, nistagmo, ambliopía, hipoplasia foveolar, glaucoma Enfermedades Digestivas Y Hepatopancreáticas Enfermedades Gástricas Úlcera duodenal Enfermedad frecuente favorecida por el estrés. Desencadenada por hiperclorhidria, infección por Helicobacter pylori, inhibición de prostaglandinas por tabaco y consumo de antiinflamatorios no esteroideos (AINE). Manifestaciones oftalmológicas Las manifestaciones oftalmológicas son poco frecuentes. Existe una posible asociación entre la infección gástrica por H. pylori y la coriorretinopatía serosa central, y aquélla puede considerarse como un posible factor de riesgo. Hemorragia digestiva La neuropatía óptica isquémica puede ocurrir en el contexto de una hemorragia gastroduodenal en relación con la hipoperfusión ocular producida por la hipovolemia. Cáncer de estómago © Elsevier. Fotocopiar sin autorización es un delito. Manifestaciones oftalmológicas La papilomatosis pigmentada proliferante en el borde palpebral obliga a descartar lesiones oncológicas en el tubo digestivo, ya que las metástasis en los párpados de estos tumores suponen un 10%. Pueden aparecer también metástasis coroideas u orbitarias, así como síndrome neuroftalmológico por carcinomatosis leptomeníngea secundaria. El síndrome MALT (mucosae associated lymphoid tissue) cursa con afectación quemótica asalmonada conjuntival. La quimioterapia puede producir lesiones en los párpados, la conjuntiva y la córnea. Enfermedades Intestinales Enfermedad inflamatoria intestinal Enfermedad de Crohn La enfermedad de Crohn (EC) es una enfermedad inflamatoria crónica de etiología desconocida que afecta a la totalidad de las capas de la pared intestinal; es segmentaria, por lo que alterna de forma parcheada zonas sanas y enfermas. Su localización más frecuente es ileocólica (40%). Manifestaciones oftalmológicas. Presentes en el 6-20% de los casos. Las más frecuentes son uveítis anterior aguda, en ocasiones con participación del segmento posterior, conjuntivitis, episcleritis, escleritis, infiltrados corneales y blefaritis ulcerativa. La incidencia de afectación ocular aumenta si hay artritis asociada y su curso sigue la evolución de la enfermedad, empeorando con los brotes, y suelen curar con la colectomía. Colitis ulcerosa Es un proceso inflamatorio con afectación de la mucosa rectocólica con distribución continua, a diferencia de la EC. La manifestaciones ocular más frecuente es la uveítis anterior no granulomatosa y recidivante. A veces se asocia con escleritis, vasculitis retiniana, oclusiones vasculares, coriorretinopatía central serosa, necrosis retiniana aguda y papilitis anterior. Poliposis adenomatosa familiar Esta entidad de carácter hereditario autosómico dominante es la principal representante de los síndromes familiares de poliposis gastrointestinal. Es responsable del 1% de los cánceres colorrectales. La manifestación clínica más importante es la existencia de pólipos adenomatosos, asintomáticos en estadios iniciales, dispersos en el intestino grueso y en el recto. El adenocarcinoma colorrectal representa la fase final de la poliposis adenomatosa familiar. Su incidencia es muy elevada (60-70%) y su edad de aparición, temprana (35-40 años). La manifestación ocular más característica es la hipertrofia del epitelio pigmentario de la retina (Figura e9.13). Estas lesiones, unidas al análisis molecular del gen APC (Adenomatous Polyposis Coli), complementan el diagnóstico de la poliposis. La hipertrofia congénita del epitelio pigmentario de la retina está admitida como un marcador clínico capaz de identificar a sujetos con riesgo de presentar una poliposis intestinal. Enfermedades Hepatopancreáticas Las manifestaciones oftalmológicas de las enfermedades hepáticas y pancreáticas se resumen en la Tabla e9.12. e-323 e-324 p a rte 1 0 : C A P Í T U L O S E X T R A Policitemia Se denomina policitemia, poliglobulia o eritrocitosis al aumento de la masa eritrocitaria circulante. Secundariamente se produce un aumento de la viscosidad de la sangre con enlentecimiento del flujo sanguíneo el cual es origen de signos y síntomas característicos. Manifestaciones oculares Figura e9.13. Hipertrofia del epitelio pigmentario de la retina con morfología «en huellas de oso» en un paciente con poliposis colónica familiar. Están relacionadas con el estado de hiperviscosidad de la sangre provocado por el aumento de eritrocitos circulantes. Las más importantes son las hemorragias retinianas y las oclusiones arteriales y venosas de la retina. También puede aparecer tumefacción papilar y síntomas neurooftalmológicos. Mieloma Múltiple Enfermedades Hematológicas Síndrome Anémico Engloba a un conjunto de manifestaciones comunes a todos los tipos de anemia, producidas por la disminución en el transporte de oxígeno e hipoxia tisular. Las más frecuentes son la anemia ferropénica, megaloblástica y aplásica. 1. La retinopatía anémica es la manifestación más frecuente, con hemorragias retinianas y exudados algodonosos. Es más frecuente en la anemia aplásica y con cifras de hemoglobina inferiores a 6 g/dl. Es asintomática. Cursa con alteraciones de la agudeza visual cuando las hemorragias afectan a la mácula. 2. Neuropatía óptica isquémica anterior asociada a la anemia aguda asociada a episodios hemorrágicos agudos y graves. La lesión esencial es la tumefacción pálida del disco óptico. Es una proliferación maligna de células plasmáticas en la médula ósea con producción anómala de inmunoglobulinas, que da lugar a manifestaciones patológicas a consecuencia de la expansión tumoral. Son frecuentes las fracturas óseas y una mayor susceptibilidad a presentar infecciones. Manifestaciones oftalmológicas Destacan los plasmocitomas orbitarios, papiledema por compresión, depósitos de cristales de inmunoglobulinas en conjuntiva, córnea, iris y cuerpo ciliar y cambios retinianos por el síndrome de hiperviscosidad secundario. Leucemias Neoplasias de la médula ósea caracterizadas por proliferación clonal de precursores mieloides o linfoides con diferentes grados de diferenciación celular según se trate de leucemias agudas o crónicas. Tabla e9.12 Manifestaciones oftalmológicas de enfermedades hepáticas y pancreáticas – Cirrosis hepática – Cirrosis biliar primaria (CBP) Ictericia Coloración amarillenta en la piel de párpados, conjuntiva y fluidos intraoculares, cápsula de Tenon Xeroftalmía Degeneración de las células caliciformes por falta de vitamina A Ceguera nocturna Alteración del metabolismo de la rodopsina en los segmentos externos de los bastones Xantelasmas Por aumento prolongado de la colesterolemia Queratoconjuntivitis seca Mecanismo autoinmunitario Malformaciones hepáticas Síndrome de Alagille (displasia arteriohepática) Disgenesia del segmento anterior (embriotoxon posterior, anomalía de Axenfeld). Retinopatía pigmentaria, pupila ectópica. Queratopatía «en banda» Enfermedad de Wilson (degeneración hepatolenticular) Anillo de Kayser-Fleischer Depósito de cobre de morfología anular y localización periférica en estroma corneal profundo y membrana de Descemet. Signo clave en el diagnóstico Catarata «en girasol» Color verdoso central que se extiende a periferia en forma de rayos Pancreatitis aguda Retinopatía de Purtscher Desarrollo de múltiples áreas de isquemia focal con aparición de exudados algodonosos, hemorragias retinianas superficiales y edema retiniano E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as Tabla e9.13 Manifestaciones oculares de las leucemias Tabla e9.14 Patología ocular secundaria a alteraciones plaquetarias y de coagulación a)Por infiltración directa de las estructuras oculares por células blásticas: 1. Infiltración leucémica de la órbita y anejos oculares 2. Infiltración leucémica de la conjuntiva, córnea, esclera, cámara anterior e iris 3. Infiltración leucémica del vítreo, retina, coroides y nervio óptico Trombocitopenias y trombocitopatías Hemorragias espontáneas, postraumáticas y quirúrgicas Desprendimientos serosos retinianos Alteraciones neuroftalmológicas b)Secundarias a las alteraciones hematológicas: 1. Retinopatía hiperleucocitaria aguda 2. Retinopatía isquémico-proliferante periférica de la leucemia crónica 3. Síndrome de isquemia del segmento anterior 4.Anormalidades vasculares conjuntivales Coagulación intravascular diseminada (CID) Desprendimientos exudativos de la retina (oclusión de la coriocapilar) Hemorragia intracraneal Síndrome de Terson Trombocitosis Oclusiones vasculares retinianas Manifestaciones neurooftalmológicas Macroglobulinemia de Waldensttröm Celulitis orbitaria Depósitos de cristales en conjuntiva y córnea Retinopatía por hiperviscosidad Enfermedad de injerto frente al huésped Secundaria al tratamiento Conjuntivitis, queratoconjuntivitis, cataratas, neuritis óptica Secundaria a infecciones oportunistas Queratitis bacteriana y herpética Retinitis por citomegalovirus y Toxoplasma Endoftalmitis endógena por Candida Inmunológicas Queratoconjuntivitis sicca Uveítis anterior y posterior Coroiditis c) Secundarias a complicaciones del tratamiento de la leucemia: 1. Infección ocular oportunista en pacientes neutropénicos 2. Toxicidad ocular directa de la quimioterapia y radioterapia antileucémica 3. Complicaciones oculares en los trasplantes de médula ósea (enfermedad del injerto frente al huésped) Manifestaciones oculares Son secundarias a: a) infiltración leucémica; b) alteraciones hematológicas, y c) al tratamiento de la propia leucemia (Tabla e9.13). Otras Alteraciones De Las Plaquetas Y De La Coagulación Las manifestaciones oculares de este grupo de enfermedades debidas a alteraciones de plaquetas y estados de coagulación se describen en la Tabla e9.14. Enfermedades Renales © Elsevier. Fotocopiar sin autorización es un delito. Insuficiencia Renal La insuficiencia renal aguda (IRA) se caracteriza por una situación de oliguria o anuria. La manifestación oftalmológica más frecuente es la retinopatía hipertensiva secundaria a insuficiencia renal. La insuficiencia renal crónica (IRC), o pérdida progresiva de la función renal, se manifiesta como un síndrome urémico, expresión de múltiples enfermedades sistémicas y renales, entre las que destaca la hipertensión arterial (HTA), que se comporta como causa y como consecuencia. La asociación insuficiencia renal-HTA conduce a una retinopatía hipertensiva mucho más grave que en el caso de la HTA aislada. Otras manifestaciones oftalmológicas son consecuencia de determinados eventos fisiopatológicos concomitantes, como el aumento del calcio sérico que puede producir depósitos córneo-conjuntivales. También pueden favorecer el desarrollo de cataratas. En el segmento posterior pueden desarrollarse cuadros obstructivos vasculares, así como desprendimientos exudativos de la retina. Trasplante Renal En los pacientes sometidos a trasplantes de riñón pueden aparecer manifestaciones oftalmológicas derivadas de la insuficiencia renal previa, así como las ocasionadas por los tratamientos para prevenir el rechazo. Manifestaciones oftalmológicas 1. Patología del segmento anterior. Tanto las cataratas, que se desarrollan en un alto porcentaje de pacientes (58%) como el glaucoma suelen ser secundarios al tratamiento corticoideo. 2. Patología del segmento posterior. La terapia inmunosupresora favorece la aparición de retinitis (generalmente por citomegalovirus [CMV]) y endoftalmitis bacterianas o fúngicas. También aparecen infecciones por Toxoplasma, herpes simple y Pneumocystis carinii. Otras Nefropatías En la Tabla e9.15 se resumen las manifestaciones oftalmológicas de otras nefropatías congénitas y adquiridas. e-325 e-326 p a rte 1 0 : C A P Í T U L O S E X T R A Tabla e9.15 Manifestaciones oftalmológicas de otras nefropatías Nefropatía Características principales Manifestaciones oftalmológicas Síndrome de Alport Nefropatía (proteinuria y hematuria) Insuficiencia renal Sordera neurosensorial 1. Corneales: arco senil, microcórnea y erosiones epiteliales recurrentes 2. Cristalino: lentícono anterior y posterior, cataratas y esferofaquia 3. Retinianas: manchas blanco-amarillentas perifoveolares, drusas del nervio óptico, retinosis pigmentaria, agujero macular y distrofia de conos Síndrome oculocerebrorenal (síndrome de Loewe) Retraso mental, hipotonía y alteración de la función de los túbulos renales Catarata congénita. Queloides corneales. Glaucoma congénito. Lentícono posterior. Anomalías angulares. Estrabismo y ambliopía Nefritis túbulointersticial y uveítis (síndrome TINU) Nefritis túbulo-intersticial aguda. Granulomas en la médula ósea y los ganglios linfáticos Uveítis anterior. Uveítis intermedia o posterior Enfermedades Neoplásicas Las manifestaciones oftalmológicas de las enfermedades neoplásicas pueden ser debidas a diferentes mecanismos fisiopatológicos: a la infiltración neoplásica directa o por compresión de los tejidos oculares, a la infiltración metastásica, a la enfermedad autoinmunitaria inducida por el cáncer, así como a la radioterapia y/o a los fármacos cito­ tóxicos empleados en su tratamiento. Tabla e9.16 Localización primaria de las metástasis coroideas Hombres Mujeres Pulmonar (40%) Mamaria (68%) Desconocida (29%) Pulmonar (12%) Gastrointestinal (9%) Desconocida (12%) Renal (6%) Otras (4%) Metástasis Oculares Prostática (6%) Gastrointestinal (2%) El 80% de las metástasis intraoculares se localizan en la coroides, 7% en el iris, 4% en el nervio óptico y 1% en el cuerpo ciliar. En un 7% de los casos afectan a varias estructuras y son bilaterales entre un 20 y un 25% de los casos. Tienen una clara predilección por el polo posterior y con frecuencia se sitúan en el área macular con tendencia a la multifocalidad (principalmente las de mama). Los tumores primarios que con mayor frecuencia producen metástasis en el globo ocular son el cáncer de pulmón y el cáncer de mama. Cutánea (4%) Cutánea (1%) Otras (4%) Renal (< 1%) Mamaria (1%) Metástasis coroideas Constituyen las metástasis oculares más frecuentes. La mayoría de tumores sólidos que originan metástasis en coroides son carcinomas. En la Tabla e9.16 se exponen los tumores primarios que con mayor frecuencia causan metástasis en la coroides, separados por sexos. Las manifestaciones clínicas dependen de la localización de la lesión. Hasta un 50% de las metástasis coroideas pueden cursar de forma asintomática y, en el resto, el síntoma más frecuente es la disminución de agudeza visual indolora o la aparición de un escotoma si se ve afectada la mácula. En algunos casos se asocian con un desprendimiento de retina exudativo. Las masas coroideas de origen metastásico suelen tener una coloración blanco-amarillenta y asentarse en el segmento posterior, probablemente por su mayor aporte sanguíneo (Figura e9.14). Una característica clínica importante que diferencia a las metástasis Figura e9.14. Metástasis coroidea de adenocarcinoma de mama. Neoformación amarillenta en polo posterior en una paciente con antecedentes de cáncer de mama. coroideas de los tumores intraoculares primarios es su tendencia a la bilateralidad, hasta en un 20-40% de los E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as casos. El diagnóstico diferencial debe apoyarse en técnicas de imagen (ecografía, angiografía fluoresceínica, verde de indocianina, etc.). Síndromes Paraneoplásicos Los síndromes paraneoplásicos se han descrito en el apartado «Enfermedades pulmonares». CONCLUSIONES © Elsevier. Fotocopiar sin autorización es un delito. – El ojo es una localización anatómica en la que se manifiestan con frecuencia múltiples enfermedades sistémicas. – En muchas de estas enfermedades, la afectación oftalmológica puede ser la manifestación inicial de la enfermedad. En otras, la repercusión oftalmológica puede ser la principal causa de morbilidad y secuelas de la enfermedad, como ocurre en la afectación ocular en la enfermedad de Behçet o en la neuropatía óptica isquémica en el contexto de una arteritis de la temporal. – El reconocimiento adecuado de las manifestaciones oftalmológicas de las enfermedades sistémicas puede suponer el diagnóstico precoz de una enfermedad potencialmente letal, como la granulomatosis de Wegener o el linfoma primario del sistema nervioso central. – La colaboración multidisciplinaria entre especialistas supone un avance importante en el abordaje integral del paciente con enfermedad sistémica. Bibliografía Bahn RS. Graves’ ophthalmopathy. N Engl J Med 2010;362:726-38. Bañares A, Hernández-García C. Eye involvement in the spondyloarthropathies. Rheum Dis Clin North Am 1998;24:771-84. Díaz-Valle D, Méndez R, Arriola P, Cuiña R, Ariño M. Enfermedades sistémicas no infecciosas y uveítis. An Sist Sanit Navar 2008;31(Supl. 3):97-110. Galiatsatos P, Foulkes WD. Familial adenomatous polyposis. Am J Gastroenterol 2006;101:385-98. Kanski JJ. Oftalmología Clínica. 6.ª ed. Madrid: Elsevier, 2009. Kasper DL, Fauci AS, Braunwald E, Longo DL, Jameson JL. Manual de Medicina Interna Harrison. (17th Edition). New York: McGraw-Hill, 2010. Lynn WA, Lightman S. The eye in systemic infection. Lancet 2004;364:1439-50. Menezo V, Lightman S. The eye in systemic vasculitis. Clin Med 2004;4:250-4. Pula JH, Reder AT. Multiple sclerosis. Part I: neuro-ophthalmic manifestations. Curr Opin Ophthalmol 2009;20:467-77. Sánchez Salorio M, Díaz-Llopis M, Benítez del Castillo JM, Rodríguez Ares T. Manifestaciones oftalmológicas de las enfermedades generales. 1.ª ed. Madrid: Mac Line, 2001. Taylor SR, McCluskey P, Lightman S. The ocular manifestations of inflammatory bowel disease. Curr Opin Ophthalmol 2006;17:538-44. e-327 e-328 p a rte 1 0 : C A P Í T U L O S E X T R A Autoevaluación E9 1. ¿En cuál de estas patologías sistémicas la queratoconjuntivitis seca es la manifestación oftalmológica más frecuente? a. En la artritis reumatoide (AR) b. En la espondilititis anquilosante (EA) HLA B-27+ c. En el lupus eritematoso sistémico (LES) d. En la granulomatosis de Wegener e. a y c son correctas Correcta: e. La manifestación ocular más frecuente en la granulomatosis de Wegener es la queratitis ulcerativa periférica (en el 14-28% de los casos), mientras que en las espondiloartropatías (como la EA), la alteración ocular más común es la iridociclitis aguda. 2. ¿Qué es falso sobre la enfermedad de Behçet? a. Es más frecuente en países mediterráneos b. La manifestación ocular más característica es la vasculitis retiniana de tipo oclusivo c. La vasculitis puede dar lugar a episodios de trombosis venosa retiniana d. Es necesario un tratamiento antibiótico para evitar las recidivas e. Es habitual la uveítis con hipopión Correcta: d. La etiología de la enfermedad de Behçet sigue siendo desconocida, y no se ha demostrado que ningún microorganismo bacteriano sea una causa nosológica. 3. ¿Cuál de estas manifestaciones oftalmológicas no son típicas de la infección ocular por el virus del herpes simple (VHS)? a. b. c. d. e. Hipopión Úlcera corneal metaherpética Queratitis dendrítica Queratitis estromal Uveítis anterior hipertensiva Correcta: a. Aunque en la afectación ocular por el herpes simple se puede presentar una uveítis anterior hipertensiva, ésta no suele acompañarse de hipopión. 4. ¿Qué patología oftalmológica no tiene una frecuencia aumentada en el síndrome de Down? a. Queratocono b. Glaucoma de ángulo estrecho c. Blefaritis d. Miopía e. Pliegues epicantales palpebrales Correcta: b. No se ha descrito una frecuencia aumentada en la incidencia de glaucomas de ángulo estrecho en sujetos con síndrome de Down. 5. ¿Qué es falso acerca de la arteritis de células gigantes o arteritis de Horton? a.Aparece en personas con edades superiores a los 55 años, predominantemente mujeres b. Es una panarterirtis sistémica que afecta a arterias de mediano y pequeño calibre c. Se observa un aumento de la velocidad de sedimentación globular (VSG) y el diagnóstico se confirma mediante biopsia d. Puede cursar con la obstrucción de la arteria central de la retina e. El tratamiento consiste en la administración de megadosis de corticoides intravenosos durante 3 días, seguidos de corticoterapia por vía oral Correcta: b. La arteritis de Horton es una panarterirtis sistémica que afecta a arterias de grueso y mediano calibre, y es característica la afectación de la arteria temporal. E 9 | R e pe rc u s i ó n o f ta l mo l ó gi c a d e l a s e n fe r me d a des si stémi c as Temas de trabajo E9 © Elsevier. Fotocopiar sin autorización es un delito. 1. El alumno deberá realizar una revisión de las principales causas de uveítis en nuestro medio, diferenciando las causas infecciosas y no infecciosas. 2. Realizar una revisión y descripción clínica de las manifestaciones oculares de la enfermedad herpética ocular. e-329 Genética de las enfermedades oculares Objetivos de aprendizaje ● ● ● ● ● Conocer las características más importantes del genoma humano. Reconocer los patrones de herencia monogénica y explicar los principales factores que pueden complicar su identificación. Definir el concepto y los tipos de heterogeneidad genética y saber aplicarlos a las enfermedades oftalmológicas. Diferenciar la herencia monogénica de la compleja. Conocer las bases genéticas y moleculares de las enfermedades oftalmológicas de herencia monogénica y compleja. Palabras clave/Key words Oftalmogenética Genoma humano Enfermedad compleja Herencia mendeliana Ophthalmogenetics Human genoma Complex disease Mendel heredity Genoma Humano El conocimiento actual sobre la estructura y función del genoma humano se lo debemos en gran medida al Proyecto Genoma Humano que concluyó en el año 2004. El princi­ pal objetivo de este proyecto fue determinar la secuencia de nucleótidos del material hereditario de la especie humana, debido a los beneficios potenciales de la aplicación de este conocimiento en medicina. Actualmente nos encontramos en la denominada era posgenómica. El conocimiento de la secuencia de nucleótidos del genoma humano ha permitido catalogar aproximadamente 10.000 caracteres monogénicos. De ellos más de 3.000 son patológicos y unos 500 están implicados en enfermedades oculares. Organización Del Genoma Humano El genoma puede ser definido como el conjunto del material hereditario de un organismo, se localiza en las © 2012. Elsevier España, S.L. Reservados todos los derechos E10 mitocondrias y en el núcleo. El genoma mitocondrial tiene un tamaño de unos 16.000 pares de bases y está constituido por ADN circular bicatenario. Contiene sólo 37 genes que codifican polipéptidos mitocondriales (complejos respi­ ratorios), ARNt y ARNr. El genoma nuclear humano está formado por 23 pares de cromosomas, cada uno de ellos constituido por una única molécula de ADN lineal, aso­ ciada a proteínas. Algunas características importantes del genoma nuclear son las siguientes: 1. Su tamaño es de unos 3.000 millones de pares de bases y contiene unos 20.000 genes. 2. El tamaño medio de un gen humano es de unos 28.000 pa­ res de bases. 3. Sólo el 1,5% del genoma corresponde a ADN codifi­ cante (existen secuencias que forman parte de los genes pero que no son codificantes, como los intrones, los promotores y las secuencias 5’ y 3’ no traducidas). 4. Más de la mitad del genoma está integrado por secuen­ cias que no forman parte de los genes y que en su inmensa mayoría están repetidas. Según la organización de las repeticiones podemos encontrar ADN repetido en tándem, y ADN repetido pero cuyas repeticiones están dispersas a lo largo de los cromosomas. 5. Las diferencias individuales del genoma son responsables de la susceptibilidad genética a las enfermedades. Estas diferencias pueden afectar a nucleótidos individuales (SNP), o al número de copias de determinados segmen­ tos cromosómicos (CNV) que puede afectar al número de copias de los genes localizados en ellos (v. «Glosario» al final del capítulo). Herencia Monogénica Los estudios de Mendel establecieron las leyes de la herencia de los caracteres biológicos, que pueden resumirse en los principios de segregación e independencia. Según el principio de segregación, los organismos con reproduc­ ción sexual poseen caracteres hereditarios determinados por parejas de genes, uno procedente del padre y otro de la madre. Sólo un miembro de la pareja de genes se trans­ mite a la descendencia debido a la separación (segregación) de los cromosomas durante la meiosis. Formulado de manera sencilla, el principio de transmisión independiente establece que dos caracteres determinados por genes dis­ tintos se transmiten de forma independiente. Para que se e-330 E 1 0 | G e n é ti c a d e l a s e n fe r me d ad es oc ulares cumpla este principio es necesario que los dos genes se localicen en cromosomas distintos, o bien en el mismo cromosoma, pero suficientemente alejados entre sí. Durante la reproducción, un progenitor transmitirá a su descendencia un alelo de cada uno de los dos genes, independientemente del otro. Historia Clínica Y Árboles Genealógicos La historia clínica recoge información sobre los anteceden­ tes familiares de la enfermedad. Esta información debe ser ordenada adecuadamente en forma de árbol genealógico para el estudio de las enfermedades genéticas. Un árbol genealógico es la representación ordenada de la información genética de una familia. Permite el análisis de un rasgo a través de varias generaciones y determinar su patrón de herencia. En los árboles genealógicos se usan una serie de símbolos estandarizados. Cada generación se identifica mediante un número romano y a los individuos de cada generación se les asigna un número arábigo, según su orden de naci­ miento. Los individuos se identifican indicando, en primer lugar, la generación a la que pertenecen, seguida de dos puntos y del número correspondiente a su posición en esa generación. Por ejemplo, el individuo I:2 de un árbol genealógico pertenece a la primera generación, en la que ocupa la segunda posición. Patrones De Herencia Monogénica Las características principales de los patrones básicos de herencia monogénica se exponen en la Tabla e10.1. Herencia autosómica recesiva La herencia recesiva generalmente se debe a mutaciones que producen una pérdida de la función (total o parcial) de una proteína que suele ser una enzima. Herencia autosómica dominante © Elsevier. Fotocopiar sin autorización es un delito. Los caracteres dominantes suelen ser producidos por mutaciones que originan una ganancia de función en pro­ teínas que en muchos casos son estructurales. Los individuos portadores heterocigotos de un alelo dominante muestran el fenotipo dominante. Sólo en casos raros se observan caracteres hereditarios dominantes en homocigosis. Herencia ligada al cromosoma X Las características diferenciales de este tipo de herencia dependen de la existencia de un solo cromosoma X en los hombres y de la inactivación al azar de uno de los dos cro­ mosomas X durante el desarrollo embrionario femenino (compensación de dosis). Así, si una mujer tiene una muta­ ción en heterocigosis en un gen localizado en este cromo­ soma, en promedio la mitad de sus células expresarán el alelo normal y la otra mitad el alelo mutante. Ello explica, por ejemplo, el mosaicismo clínico (fenotípico) que se observa en el fondo de ojo de mujeres portadoras (heterocigotas) de albinismo ocular ligado al cromosoma X. En las mujeres un carácter recesivo ligado al cromosoma X se comporta de Tabla e10.1 Características de los patrones de herencia monogénica Autosómica recesiva Los individuos enfermos suelen tener progenitores sanos que generalmente son portadores asintomáticos (heterocigotos) El riesgo de que nazca un hijo enfermo de progenitores heterocigotos es del 25% Dos individuos enfermos suelen tener toda la descendencia enferma Los individuos enfermos pueden ser homocigotos o heterocigotos compuestos. En este último caso presentan dos mutaciones distintas en el mismo gen, cada una de las cuales produce una pérdida de la función de la proteína Hay generaciones en las que no se observa el carácter (transmisión horizontal). En familias en las que no hay consanguinidad y los enfermos son heterocigotos compuestos es frecuente que haya solamente un individuo enfermo, por lo que el carácter puede aparentar ser esporádico En los árboles familiares suele existir algún grado de consanguinidad Los hombres y las mujeres se ven afectados por igual Autosómica dominante Los individuos enfermos tienen al menos un progenitor enfermo, por lo que el carácter debe estar presente en todas las generaciones (transmisión vertical) Un enfermo (heterocigoto) tiene un riesgo del 50% de transmitir la enfermedad a cada uno de sus hijos Dos individuos enfermos (heterocigotos) pueden tener hijos no afectados con una probabilidad del 25% Los hombres y las mujeres están afectados por el carácter por igual Recesiva ligada al cromosoma X La enfermedad es más frecuente en hombres que en mujeres. Las mujeres heterocigotas generalmente son normales, transmiten la enfermedad y los hombres la padecen Un hombre enfermo transmite el gen a todas sus hijas que serán portadoras (heterocigotas). Dominante ligada al cromosoma X Las mujeres portadoras presentan la enfermedad Los hombres están gravemente afectados En algunas enfermedades los fetos masculinos son inviables, dando lugar a abortos espontáneos o mueren poco después del nacimiento Ligada al cromosoma Y u holándrica Solamente afecta a los hombres Todos los hijos hombres de un hombre enfermo están enfermos Mitocondrial Toda la descendencia de una mujer enferma puede presentar la enfermedad, aunque puede existir expresión variable de la enfermedad debido a la heteroplasmia La descendencia de un hombre enfermo nunca presenta la enfermedad modo muy similar a un rasgo autosómico recesivo. Sin embargo, si un hombre hereda un gen patológico recesivo en el cromosoma X, estará afectado por la enfermedad. Herencia mitocondrial Todas las mitocondrias de un individuo proceden de su madre. Una célula puede contener cientos o miles de mitocondrias, dependiendo de su actividad metabólica. e-331 e-332 p a rte 1 0 : C A P Í T U L O S E X T R A Además, cada mitocondria contiene de 2 a 10 moléculas de ADN mitocondrial. Por ello una célula puede contener algunas moléculas de ADN mitocondrial con una mutación y el resto normales. Esta heterogeneidad de la composición del ADN se denomina heteroplasmia y puede originar una expresión variable de las enfermedades mitocondriales. La frecuencia de mutación del ADN mitocondrial es 10 veces superior a la del ADN nuclear, debido a la ausencia de mecanismos de reparación del ADN y, posiblemente también a la lesión causada por los radicales libres libera­ dos en la fosforilación oxidativa. Heterogeneidad genética La heterogeneidad genética es un fenómeno presente en muchas enfermedades hereditarias oftalmológicas, como la retinosis pigmentaria o el glaucoma. Existen dos tipos de heterogeneidad genética: de locus y alélica. El primer tipo se caracteriza porque mutaciones en distintos genes (loci) producen la enfermedad. En el segundo tipo, distintas mutaciones (alelos) del mismo gen producen una deter­ minada patología. Herencia Compleja Factores Que Complican La Interpretación De Los Patrones De Herencia Monogénica Cuando se analizan los árboles genealógicos de algunas enfermedades monogénicas puede observarse que presen­ tan características de herencia inesperadas. Ello puede deberse a la existencia de los fenómenos que se indican en la Tabla e10.2. Tabla e10.2 Fenómenos que complican la interpretación de los patrones de herencia monogénica básica Nueva mutación Las mutaciones pueden aparecer espontáneamente en los gametos de un progenitor sano o en un embrión formado a partir de gametos sanos. Así, puede nacer un niño con una enfermedad genética en una familia en la que no existen antecedentes de dicha enfermedad. El riesgo de que la enfermedad pueda ser transmitida por estos progenitores a un nuevo hijo es igual al de cualquier individuo normal. Si la nueva mutación es autosómica dominante y afecta a todas las células germinales de un individuo, éste transmitirá la enfermedad con una probabilidad del 50% Mosaicismo genético La mayoría de los caracteres humanos, incluyendo también numerosas enfermedades, son el resultado de una compleja interacción de múltiples factores genéticos y ambientales. Por ello se denominan caracteres complejos o multifactoriales. La herencia de estos caracteres no sigue los patrones monogénicos, aunque es importante tener presente que cada uno de los múltiples genes relacionados con el carácter se transmite de acuerdo con las leyes de Mendel. Las enfermedades complejas podrían estar determina­ das por la acumulación de pequeños efectos de múltiples factores genéticos y ambientales que contribuyen al riesgo total de presentar el trastorno. La enfermedad aparece cuando un individuo acumula un número suficiente de factores de riesgo (Figura e10.1). La identificación de genes implicados en enfermedades complejas puede realizarse mediante distintas estrategias, entre las que se encuentran los estudios de asociación. Su objetivo es determinar si en una población la frecuencia de una o más variantes génicas (alelos) es mayor en enfer­ mos que en individuos sanos. Los estudios de asociación suelen tener un diseño de casos y controles. La asocia­ ción entre un alelo y la enfermedad puede deberse a que éste contribuye directamente al desarrollo de la enferme­ dad, o a que se transmite junto con otra variante genética que es la realmente causante de aquélla. El resultado de los estudios de asociación puede estar sesgado si los grupos Un mosaico genético es un individuo que tiene dos o más tipos celulares genéticamente distintos en su cuerpo, como resultado de la aparición de una mutación durante el desarrollo embrionario. El mosaicismo genético está relacionado con el fenómeno de nueva mutación. En el mosaico adulto pueden estar afectadas solamente las células germinales. En este caso el individuo es normal, pero puede transmitir la enfermedad a múltiples descendientes, explicando casos en los que dos o más descendientes presentan una enfermedad autosómica dominante sin antecedentes familiares de ésta. Penetración y expresividad La penetración de un carácter hereditario es el porcentaje de individuos con un determinado genotipo que presentan el fenotipo esperado. Si la penetración es del 50%, el fenotipo esperado se encuentra sólo en la mitad de los casos. Es un fenómeno del tipo de todo o nada, es decir, un portador del genotipo patológico presenta el fenotipo patológico o no lo presenta. La expresividad es el grado de variación que existe en la expresión del fenotipo. Los portadores del genotipo patológico presentan el fenotipo patológico, pero con características que pueden ser diferentes entre los portadores. Ambos fenómenos son el resultado del efecto de factores ambientales y genéticos (genes modificadores) sobre el fenotipo. Figura e10.1. Comparación de las causas de las enfermedades monogénicas y complejas. Las enfermedades monogénicas se deben a la alteración de un único gen, o al menos de un gen principal o mayor. Simplificando el modelo, puede considerarse que la relación entre el genotipo y el fenotipo es directa (esquema superior). Las enfermedades complejas son el resultado de la acumulación de múltiples factores genéticos y ambientales. Los factores genéticos pueden ser mutaciones frecuentes (polimorfismos) o raras. Cada uno de los diferentes factores contribuye al riesgo total de presentar el trastorno. La enfermedad aparece cuando un individuo acumula un número suficiente de factores de riesgo. Las flechas dobles indican la existencia de interacciones entre los factores genéticos y ambientales. RG: riesgo genético; RA: riesgo ambiental. E 1 0 | G e n é ti c a d e l a s e n fe r me d ad es oc ulares no son homogéneos para variables que pueden influir en la enfermedad, como edad, sexo, raza, etc. Cuanto menor es el efecto de una variante genética sobre la enfermedad, mayor es el tamaño de la muestra necesario para detectar la asociación. Bases Genéticas De Enfermedades Oculares La identificación de mutaciones causantes de distintas enfermedades permite realizar el diagnóstico y asesoramiento genético, lo que contribuye a aliviar la angustia de las familias afectadas y es la base para realizar terapias génicas en el futuro. En este apartado se estudian algunas de las enfermedades oculares cuyas bases genéticas son conocidas. © Elsevier. Fotocopiar sin autorización es un delito. Distrofias Corneales De Herencia Autosómica Dominante Las distrofias corneales constituyen un grupo de enferme­ dades hereditarias bilaterales, clínica y genéticamente heterogéneo, producido por la formación de depósitos proteicos en distintas capas de la córnea. Estos depósitos originan una pérdida progresiva de la transparencia cor­ neal, que afecta a la agudeza visual. La mayor parte de las distrofias corneales son enfermedades monogénicas (autosómicas dominantes, recesivas o recesivas ligadas al cromosoma X), en las que hay variabilidad fenotípica y penetración variable. Se conocen más de 10 genes distintos implicados en los distintos tipos de distrofias corneales. Se han descrito cuatro tipos de distrofias corneales auto­ sómicas dominantes: granular tipo I (Groenow), reticular tipo I, combinada granular-reticular (de Avellino) y de Reis y Bücklers. Todas ellas son causadas por mutaciones en el gen QUERATOEPITELINA, también denominado TGFBI o BIGH3. Este gen codifica una proteína extracelular, muy abundante en el epitelio corneal y en los queratocitos y probablemente modula la adhesión celular. Las mutacio­ nes posiblemente alteran la estabilidad o la solubilidad de la proteína dando lugar a su lento depósito en la córnea. Hay dos puntos calientes de mutación, localizados en las argininas 124 y 555. Las mutaciones de cualquiera de los dos aminoácidos están presentes en aproximadamente la mitad de los pacientes, lo que facilita su análisis y el diagnóstico genético. Además, las mutaciones de estos dos aminoácidos muestran una buena correlación con el fenotipo, de forma que, por ejemplo, la sustitución de la arginina 124 por los aminoácidos cisteína, leucina o serina origina depósitos amiloides, granulares o mixtos, respec­ tivamente (Figura e10.2). Cataratas Las cataratas congénitas son las enfermedades genéticas del cristalino más importantes. Desde un punto de vista genético pueden establecerse cuatro tipos de cataratas: congénitas hereditarias aisladas; asociadas con otras alte­ raciones oculares; asociadas con síndromes autosómicos, y asociadas con enfermedades metabólicas. El primer grupo Figura e10.2. Fenotipos corneales producidos por dos mutaciones frecuentes del gen de la queratoepitelina (TGFBI o BIGH3). La mutación Arg124Cys origina distrofia corneal reticular de tipo I (A) y la mutación Arg555Trp da lugar a distrofia granular tipo I (B). Modificado de BlancoMarchite et al, 2007. representa aproximadamente el 25% de los casos y en general se heredan siguiendo un patrón autosómico dominante, aunque también hay casos de herencia auto­ sómica recesiva y ligada al cromosoma X. Se estima que existen al menos 40 genes implicados en su desarrollo, de los que se han identificado unos 26. Los genes conocidos están implicados en el mantenimiento de la transparencia o de la homeostasis del cristalino. Las proteínas que codifican se pueden agrupar en cinco categorías funciona­ les: cristalinas, factores de transcripción, transportadores de membrana (como las conexinas), de citoesqueleto y de función desconocida. Aproximadamente la mitad de los pacientes presentan mutaciones conocidas en los genes de las cristalinas y la cuarta parte en los genes de conexinas. Glaucoma El glaucoma es un conjunto de neuropatías ópticas que producen una pérdida de visión asociada con la muerte apoptótica de las células ganglionares de la retina. Pode­ mos distinguir dos grandes grupos de glaucoma según su tipo de herencia: monogénicos y de herencia compleja. Glaucomas monogénicos Los glaucomas monogénicos suelen ser de inicio temprano y presentan heterogeneidad fenotípica (clínica) y genética, tanto de locus como alélica. Hay al menos 20 genes impli­ cados, aunque se han identificado únicamente cinco de ellos, denominados MIOCILINA (MYOC), OPTINEURINA (OPTN), PROTEÍNA CON 36 REPETICIONES WD (WDR36), CITOCROMO P450 1B1 (CYP1B1) y LTBP2. Glaucoma juvenil autosómico dominante Se caracteriza por su inicio entre los 10 y los 35 años y por presiones intraoculares muy elevadas. Entre el 10 y el 30% de las familias con glaucoma juvenil presentan mutaciones en el gen MYOC. La función biológica de este gen se des­ conoce. Codifica una proteína extracelular presente, entre otros órganos y tejidos, en la malla trabecular, iris, humor acuoso, cuerpo ciliar, músculo esquelético y corazón. El mecanismo por el que las mutaciones del gen MYOC causan la enfermedad no se conoce, aunque la proteína mutante se acumula intracelularmente. También podrían e-333 e-334 p a rte 1 0 : C A P Í T U L O S E X T R A existir pequeñas cantidades de proteína mutante extrace­ lular, por ejemplo, en el humor acuoso. Los dos fenómenos pueden contribuir al desarrollo de la enfermedad. Algunas mutaciones se asocian con características clínicas impor­ tantes. Por ejemplo, la mutación Pro370Leu origina una forma agresiva de glaucoma juvenil que se caracteriza por elevadas presiones intraoculares y resistencia al tratamiento farmacológico. De igual manera, la mutación Asp380Ala, frecuente en pacientes españoles, se relaciona con un tipo de glaucoma de buena respuesta inicial al tratamiento farmacológico, pero que acaba desarrollando resistencia. Los portadores de ambas mutaciones son candidatos al tratamiento quirúrgico precoz (Figura e10.3A). Glaucoma adulto autosómico dominante Mutaciones de los genes OPTN y WDR36 son responsables de este tipo de glaucoma en determinadas familias. El gen OPTN se relaciona con casos de glaucoma normotensivo. Ambos genes podrían producir la enfermedad por inducir la apoptosis. Glaucoma congénito primario Puede aparecer desde el momento del nacimiento hasta los 3 años de edad. La herencia autosómica recesiva es frecuente (Figura e10.3B), aunque también se han descrito casos dominantes y esporádicos. Los estudios genéticos moleculares ayudan a identificar los casos recesivos. La enfermedad parece estar causada por malformaciones microscópicas en las estructuras de drenaje del humor acuoso que originan una elevación importante de la pre­ sión intraocular. Al menos 3 genes están implicados en el glaucoma congénito primario autosómico recesivo, de los que dos han sido identificados: CYP1B1 y LTBP2. El primero de ellos codifica una enzima de la superfamilia de los cito­ cromos P450 con actividad monooxigenasa. Se desconoce Figura e10.3. Herencia autosómica dominante en un glaucoma juvenil debido a una mutación del gen MYOC (A) y autosómica recesiva en un glaucoma congénito primario debido a mutaciones del gen CYP1B1 (B). Debajo de los símbolos se indica el genotipo de distintos miembros de las familias. En la familia con glaucoma juvenil todos los pacientes son heterocigotos para la mutación D380A (Asp380Ala) (A). En la quinta generación se han identificado dos portadores que debido a su corta edad no han desarrollado la enfermedad. La presencia de la mutación facilita el diagnóstico precoz (modificado a partir de Campos-Molló et al, 2007). En la familia B el paciente con glaucoma congénito primario es un heterocigoto compuesto. La mutación R355fsX69, que origina un codón de terminación prematuro, está presente en la rama materna, mientras que la mutación F261L se transmite por la rama paterna. En ambas ramas familiares hay individuos portadores heterocigotos que no presentan la enfermedad. +: alelo silvestre; rojo: glaucoma congénito primario; azul: glaucoma juvenil; amarillo: hipertensión ocular. El punto en el interior de los símbolos indica que el individuo es portador de la mutación (modificado a partir de Campos-Molló et al, 2009). E 1 0 | G e n é ti c a d e l a s e n fe r me d ad es oc ulares la función de esta enzima en el ojo y su relación con el glaucoma, aunque se ha propuesto que podría metabo­ lizar un compuesto implicado en el desarrollo del ángulo iridocorneal, de tal manera que una reducción de la actividad enzimática modificaría la concentración del morfógeno, originando la alteración estructural de la malla trabecular. Las mutaciones en el gen CYP1B1 son responsables del 20-80% de los casos de glaucoma congénito en distintas poblaciones. En población espa­ ñola se han detectado mutaciones en aproximadamente la tercera parte de los enfermos. Estas mutaciones produ­ cen una pérdida de la actividad enzimática que puede ser parcial (mutaciones hipomorfas) o completa (mutaciones nulas). Los pacientes portadores de dos mutaciones nulas en general presentan una forma grave de la enfermedad, caracterizada por estar presente en el momento del nacimiento o en los primeros días después de éste y por su bilateralidad. El gen LTBP2 codifica una proteína extracelular que parece regular el desarrollo de la cámara anterior del ojo. Sus mutaciones producen la enfermedad en un número reducido de familias pakistaníes. Glaucoma de herencia compleja A este grupo pertenecen las formas más frecuentes de glaucoma, como el crónico simple. © Elsevier. Fotocopiar sin autorización es un delito. Glaucoma crónico simple Este tipo de glaucoma suele aparecer en personas mayores de 40 años. La prevalencia del glaucoma crónico es mayor en parientes cercanos de glaucomatosos (3,5-19%), que en la población general (0,4-0,8%), lo que pone de manifiesto el componente genético de la enfermedad. Los genes implicados en el glaucoma crónico simple parecen actuar como factores de riesgo, contribuyendo con un pequeño efecto al fenotipo, de acuerdo con las caracterís­ ticas de la herencia compleja (v. Figura e10.1). Mediante análisis de asociación se han implicado al menos a 15 genes distintos en este tipo de glaucoma. Los resultados más consistentes se han obtenido con los genes MYOC y CYP1B1. Las mutaciones en el gen MYOC están presentes aproximadamente en el 2-4% de los pacientes y las del gen CYP1B1 en el 5-7%. Estas últimas representan el principal factor de riesgo genético conocido en glaucoma crónico. En conjunto, las mutaciones de estos 2 genes desempeñan un papel en el 7-11% de los casos de glaucoma crónico simple. Retinosis Pigmentaria La retinosis pigmentaria es un conjunto de distrofias hereditarias de la retina causadas por la pérdida apoptótica de los fotorreceptores y caracterizada por la presencia de depósitos retinianos de pigmento. Presenta una variabi­ lidad clínica y genética extrema, y es la forma más común de distrofias hereditarias de la retina. Las bases genéticas de la enfermedad son extremadamente complejas. Se puede heredar de manera autosómica dominante, autosómica recesiva, ligada al cromosoma X, digénica y compleja. Se conocen más de 40 genes implicados en la enfermedad, la mayor parte de los cuales se expresan de manera diferencial en la retina y muchos de ellos están implicados en la foto­ transducción. Entre estos genes se encuentran los de la rodposina, transducina, fosofodiesterasa, arrestina y recoverina, entre otros. El gen de la rodopsina fue el primer gen mayor identificado en la enfermedad. Otro grupo de genes codifica proteínas estructurales de los bastones, como RDS/periferina y ROM1. Genes que controlan el desarrollo como DRX, o que podrían proteger a las células de la apoptosis inducida por estrés oxidativo, como CERKL, también están implicados en la enfermedad. Se ha postu­ lado que la enfermedad es el resultado de alguno de los siguientes procesos: a) alteración del tráfico intracelular de proteínas, como consecuencia de alteraciones en el plegamiento de las proteínas; b) alteraciones del metabo­ lismo celular, y c) activación constitutiva de la transducción debida a mutaciones de la rodopsina. La enorme heterogeneidad genética de la patología complica su diagnóstico molecular, ya que el estudio en cada paciente de todos los genes posiblemente responsa­ bles de la enfermedad resulta muy costoso. Para solucionar este problema se están desarrollado chips genéticos que simplifican y reducen de manera considerable los costes del diagnóstico genético molecular. Degeneración Macular Asociada A La Edad Es la principal causa de ceguera entre la población de edad avanzada. Se han identificado variantes comunes (poli­ mórficas) de tres genes que codifican factores del com­ plemento (B, C2 y H), así como de los genes ARMS2 y HTRA1, que actúan como factores de riesgo genético importantes. Además, otros alelos de algunos de estos genes poseen un efecto protector. Como en otras enferme­ dades genéticas, se desconoce exactamente cómo los polimorfismos de estos genes contribuyen a la enfermedad, aunque parece claro que alteraciones en el funcionamiento del sistema del complemento producen respuestas infla­ matorias aberrantes que originan depósitos de material en la membrana de Bruch. El riesgo atribuible asociado con factores genéticos se calcula en el 50%, aunque estos fac­ tores genéticos pueden variar en distintas poblaciones. La variante Tyr402His del factor H del complemento es un factor de riesgo importante. El alelo de riesgo codifica el aminoácido histidina, y confiere mayor susceptibilidad a la enfermedad en homocigosis que en heterocigosis. Los factores B y C2 son activadores de las vías alternativa y clásica del complemento, respectivamente. La función del gen ARMS2 se desconoce, aunque se sabe que la proteína se localiza en la mitocondria. El gen HTRA1 codifica una proteasa de choque térmico que se localiza en la retina, interviniendo en la señalización de moléculas de la fami­ lia del factor de crecimiento transformante beta (TGF-beta). La combinación de factores de riesgo genético y/o ambien­ tal incrementa la susceptibilidad a la enfermedad. Así, se ha comprobado que el consumo de tabaco por parte de personas portadoras de variantes genéticas de riesgo, o la coincidencia en un mismo individuo de dos variantes genéticas de riesgo, incrementa de manera importante la susceptibilidad a la enfermedad. e-335 e-336 p a rte 1 0 : C A P Í T U L O S E X T R A Atrofia Óptica De Leber La atrofia óptica de Leber es la enfermedad de herencia mitocondrial más común. En más del 95% de las familias afectadas la causa es alguna de las tres mutaciones pun­ tuales que afectan a genes de subunidades del complejo I de la cadena respiratoria. Existe una gran variabilidad clínica debida al tipo de mutación presente en cada indi­ viduo y al fenómeno de heteroplasmia. En la mayoría de las familias afectadas la mutación que origina la enferme­ dad está presente en todas las moléculas de ADN de todas las mitocondrias (homoplasmia). Sin embargo, en un 10-15% de las familias sólo una fracción de las mitocon­ drias contiene el ADN mutante (heteroplasmia). El riesgo de ceguera es mínimo si la mutación está presente en menos del 60% de las moléculas de ADN. Conclusiones – El conocimiento de la estructura del genoma humano ha facilitado la identificación de numerosos genes implicados tanto en enfermedades monogénicas como complejas. – Este conocimiento permite realizar el diagnóstico y asesoramiento genético, especialmente en las enfer­ medades monogénicas. – La aplicación del análisis genético molecular no es fácil en las enfermedades complejas como el glaucoma crónico simple o la degeneración macular asociada a la edad. Glosario Gen unidad fundamental de la herencia. Desde el punto de vista molecular se puede definir como una secuencia de nucleótidos capaz de ser transcrita a ARN codificante (mensajero o ARNm) o no codificante (ribosómico o ARNr, transferente o ARNt, pequeño nuclear o ARNsn, micro ARN o miARN, etc.). Genotipo dotación genética específica de un organismo. También se puede definir como la constitución genética del individuo en un locus. Fenotipo manifestación observable de un genotipo. Puede resultar de la interacción del genotipo con el ambiente. Locus posición física ocupada por un gen en un cromo­ soma. El plural es loci. Alelo cada una de las variantes de un gen. Dos alelos pueden diferir sólo en un nucleótido. Alelos distintos de un mismo gen pueden originar efectos fenotípicos dife­ renciales. La mayor parte de los genes presentan múltiples alelos. Polimorfismo variante genética que presenta una frecuen­ cia en una población superior al 1%. Se suele utilizar como sinónimo de variante no patológica, aunque en algunos casos puede actuar como un factor de riesgo genético de una patología. La variación puede afectar a un solo nucleó­ tido y se denomina SNP (Single Nucleotide Polimophism, en plural SNP), o al número de copias de una región cromo­ sómica cuya longitud varía entre pocos miles o millones de nucleótidos. El segundo tipo de variación se denomina CNV (Copy Number Variation). Bibliografía Allingham RR, Liu Y, Rhee DJ. The genetics of primary open-angle glaucoma: A review. Exper Eye Res 2008;88:837-44. Blanco-Marchite C, Sánchez-Sánchez F, López-Sánchez E, Escribano J. R124C and R555W TGFBI mutations in Spanish families with autosomal-dominant corneal dystrophies. Mol Vision 2007;13:1390-6. Campos-Molló E, López-Garrido MP, Blanco-Marchite C, García-Feijoo J, Peralta J, Belmonte-Martínez J, et al. CYP1B1 gene mutations in Spanish patients with primary congenital glaucoma: phenotypic and functional variability. Mol Vision 2009;15:417-31. Campos-Molló E, Sánchez-Sánchez F, López-Garrido MP, López-Sanchez E, LópezMartínez F, Escribano J. MYOC gene mutations in Spanish patients with auto­ somal dominant primary open-angle glaucoma: a founder effect in southeast Spain. Mol Vision 2007;13:1666-73. Hartong DT, Berson EL, Dryja TP. Retinitis pigmentosa. Lancet 2006;368: 1795-809. Hejtmancik JF. Congenital cataracts and their molecular genetics. Semin Cell Develop Biol 2008;19:134-49. Kannabiran C. Genetics of corneal endothelial dystrophies. J Genet 2009;88: 487-94. Nussbaum RL. Thompson & Thompson. Genética en medicina. (7. ª ed.). Barcelona: Elsevier, 2008. Strachan T, Read AP. Genética Humana. (3 ª ed.). México: MacGraw-Hill Interame­ ricana, 2006. Swaroop A, Chew EY, Rickman CB, Abecasis GR. Unraveling a multifactorial lateonset disease: from genetic susceptibility to disease mechanisms for age-related macular degeneration. Ann Rev Gen Hum Gen 2009;10:19-43. Traboulsi EI. A Compendium of Inherited Disorders and the Eye. New York: Oxford University Press, 2006. Weiss JS. Molecular genetics and the classification of the corneal dystrophies: what is next? Am J Ophthal 2009;148:477-8. Yu-Wai-Man P, Griffiths PG, Hudson G, Chinnery PF. Inherited mitochondrial optic neuropathies. J Med Genet 2009;46:145-58. Recursos en Internet La base de datos OMIM (On line Mendelian Inheritance in Man; http://www.ncbi. nlm.nih.gov/omim) constituye una excelente fuente de información especiali­ zada. Contiene todos los caracteres hereditarios humanos tanto monogénicos como complejos y sus genes responsables. Creada por Victor McKusick, se actualiza muy frecuentemente. Cada carácter tiene asignado un número de 6 dígitos, que se emplea para identificarlo en la bibliografía científica. El primer número suele hacer referencia al patrón de herencia. Su mantenimiento depende del Centro Nacional para la Información en Biotecnología. (National Center for Biotechnology Information, NCBI), localizado en Bethesda, MD, EE.UU.). E 1 0 | G e n é ti c a d e l a s e n fe r me d ad es oc ulares Autoevaluación E10 1. ¿Cuál de las siguientes afirmaciones sobre el genoma humano es cierta? a. La mayor parte del genoma humano corresponde a secuencias codificantes. b. Las diferencias individuales del genoma son responsables de la susceptibilidad genética a ciertas enfermedades. c. El ADN repetido es poco abundante en los cromosomas humanos. d. Los genes son secuencias de ADN que no intervienen en la síntesis de moléculas de ARN. e. El tamaño del genoma nuclear y mitocondrial es similar. Correcta: b. Las variaciones de un solo nucleótido (SNP) en la secuencia del ADN y del número de copias (CNV) de determinados segmentos cromosómicos determinan, al menos en parte, la susceptibilidad a presentar algunas enfermedades complejas. 2. ¿Qué significa que una enfermedad tiene una penetración del 20%? a. Que los individuos que poseen el genotipo patológico manifiestan la enfermedad con una gravedad equivalente al 20% de la máxima. b. Que los individuos que poseen el genotipo patológico manifiestan la enfermedad con una gravedad equivalente al 80% de la máxima. c. Que el 20% de los individuos que poseen el genotipo patológico no manifiestan la enfermedad. d. Que el 20% de los individuos que poseen el genotipo patológico manifiestan la enfermedad. e. Que el 80% de los individuos que poseen el genotipo patológico manifiestan la enfermedad. Correcta: d. La penetración de un carácter es el porcentaje de individuos que teniendo un determinado genotipo manifiestan el fenotipo correspondiente. 3.Las enfermedades complejas se caracterizan por: © Elsevier. Fotocopiar sin autorización es un delito. a. Estar causadas por la alteración de un gen. b. Presentar patrones de herencia mendelianos típicos. c. La existencia de múltiples variantes genéticas que actúan como factores de riesgo, junto con factores ambientales. d. Estar producidas exclusivamente por la interacción entre múltiples factores ambientales. e. Depender exclusivamente de la acumulación de un número suficiente de factores de riesgo genético. Correcta: c. Las enfermedades complejas están determinadas por la acumulación de pequeños efectos, producidos por múltiples factores genéticos y ambientales, que contribuyen al riesgo total de presentar la enfermedad. 4. ¿Cuál de las siguientes enfermedades se caracteriza por su heterogeneidad genética, tanto alélica como de locus? a. Cataratas congénitas. b. Distrofias corneales. c. Glaucoma congénito primario. d. Retinosis pigmentaria. e. Todas las mencionadas anteriormente. Correcta: e. Todas las enfermedades anteriores están causadas por más de un gen (heterogeneidad de locus), y cada uno de los genes sufre distintos tipos de mutaciones que dan lugar a la enfermedad (heterogeneidad alélica). 5. ¿Cuál de las siguientes afirmaciones es correcta? a. Las mutaciones del gen CYP1B1 son responsables de aproximadamente un tercio de los casos de glaucoma congénito primario en pacientes españoles. b. El diagnóstico genético de la retinosis pigmentaria es muy sencillo de realizar. c. Ningún polimorfismo del gen del factor H del complemento es un factor de riesgo de degeneración macular asociada a la edad. d. El gen MYOC está implicado en el glaucoma juvenil autosómico dominante, pero no en el glaucoma crónico simple. e. Las mutaciones del gen de la queratoepitelina producen cataratas congénitas. Correcta: a. El porcentaje de casos de glaucoma congénito primario debido a mutaciones en el gen CYP1B1 varía en distintas poblaciones humanas. Las mutaciones que producen una disminución total o parcial de la actividad de la enzima CYP1B1 están presentes en aproximadamente el 33% de las familias españolas. e-337 e-338 p a rte 1 0 : C A P Í T U L O S E X T R A Temas de trabajo E10 1. Realizar una búsqueda en la base de datos OMIM de genes conocidos implicados en enfermedades genéticas oculares. El estudiante puede utilizar como guía las enfermedades estudiadas en este capítulo. Debido a la gran cantidad de información existente en esta base de datos, el alumno debe centrarse en los siguientes puntos: 1) describir el tipo de herencia de la enfermedad; 2) enumerar los genes conocidos indicando su función, cuando sea conocida; 3) indicar el número aproximado de mutaciones identificadas de cada uno de los genes, y 4) el mecanismo por el que las mutaciones causan la enfermedad, si éste se conoce. 2. Confeccionar un árbol genealógico a partir de la información que se presenta a continuación. Una pareja acude a la consulta del oftalmólogo debido a que han observado que el menor de sus hijos (probando), un niño de 2 años, presenta una alteración ocular. El padre tiene 33 años y la madre 32. La familia vive en un pueblo de 200 habitantes y los padres son primos hermanos. La pareja tiene otros 3 hijos, de los cuales dos son niñas (de 10 y 7 años) y el tercero, un niño (5 años). La mayor de las hijas presentó la misma alteración ocular al año de haber nacido. El padre tiene 2 hermanos hombres mayores que él y la madre una hermana de 50 años. Los abuelos paternos murieron hace unos años y los maternos viven. Según los padres del probando, ninguno de sus familiares tiene enfermedades oculares que pudieran estar relacionadas con la de sus hijos. Calidad de vida y enfermedades oculares Objetivos de aprendizaje ● Conocer los conceptos básicos sobre la calidad de vida y las herramientas para medirla en oftalmología. Reconocer su importancia para el tratamiento integral de los pacientes. ● Conocer la repercusión de las enfermedades oftalmológicas sobre la calidad de vida de los pacientes y sobre la sociedad en general. Palabras clave/Key words Calidad de vida Impacto de las enfermedades oculares Actividad social Quality of life Ocular diseases impact Social activities Introducción Muchas de las enfermedades oftalmológicas son crónicas como, por ejemplo, el glaucoma, la retinopatía diabética, la degeneración macular asociada a la edad o las uveítis. Los tratamientos a menudo consiguen prolongar la supervivencia de la función visual, pero no son curativos. Estas enfermedades visuales causan discapacidad visual, y a menudo su prevalencia aumenta con la edad. A medida que la función visual disminuye, se produce un deterioro tanto de la condición física como de la salud mental, que afectan a las actividades rutinarias de la vida diaria del paciente, incluyendo las actividades sociales (Tablas e11.1 y e11.2). Por ello, la patología ocular supone una carga considerable, no sólo para los pacientes, sino también para la sociedad en general, como consecuencia de los gastos de salud y de su repercusión en el bienestar social y en la atención médica. La pérdida de la visión puede ser devastadora para una persona con una visión normal, especialmente si afecta a ambos ojos. Desempeñar tareas rutinarias, como caminar, leer, conducir, realizar las tareas del hogar o reconocer a © 2012. Elsevier España, S.L. Reservados todos los derechos E11 las personas pueden convertirse en un grave problema al irse deteriorando la función visual. Incluso con la progresión de la enfermedad, los pacientes pueden llegar a disminuir sus actividades físicas habituales por miedo a las caídas o a los accidentes. Además, la pérdida visual puede conducir a cambios en las relaciones personales dentro del núcleo familiar (parejas e hijos), generando cambios en los roles y tareas familiares, responsabilidades, deberes, viajes, trabajo y forma de vida en general. Así, por ejemplo, si en una familia uno de los cónyuges era el encargado de las tareas que precisaban el empleo del coche, como llevar a los niños al colegio, su pérdida de visión va a modificar el equilibrio de roles en el que se basaba la convivencia familiar hasta ese momento. De esta manera y ante estas situaciones, ambos cónyuges están obligados a hacer ajustes inesperados en su estilo de comunicación y en sus expectativas sobre las habilidades de su compañero. Pacientes con alteraciones visuales graves o ciegos pueden decidir permanecer en casa y reducir la vida de relación social para minimizar la aceptación de su pérdida visual o incluso por la interiorización de una teórica estigmatización de los ciegos y el temor al rechazo. Además, la repercusión de la ceguera o de la pérdida grave de la visión en cada individuo dependerá de muchos otros factores como la sociedad en la que viva, los roles Tabla e11.1 Puntos de vista que deben tenerse en cuenta en los tratamientos Una enfermedad puede ser percibida de forma diferente por distintos individuos Por ejemplo, ante una paciente diagnosticada de hemorragia vítrea secundaria a retinopatía diabética 0. El oftalmólogo evalúa la severidad de la agudeza visual y decide si el paciente necesita cirugía inmediata, u observación a la espera de la reabsorción de la hemorragia 1. La paciente se pregunta si el tratamiento será doloroso y si tendrá posibilidades de recuperar de nuevo la visión 2. Su hija se pregunta si su madre podrá seguir viviendo sola 3. El administrador del hospital se preocupa por la frecuencia de las visitas de seguimiento y sobre el uso de recursos adicionales Estas diferencias deben ser consideradas o la disparidad entre las expectativas de cada uno de ellos frente al tratamiento provocará su falta de entendimiento e-339 e-340 pa r t e 1 0 : C A P Í T U L O S E X T R A Tabla e11.2 Aspectos de la pérdida de visión tomados de la «Guía para la evaluación de la discapacidad visual» El órgano La persona Aspectos Cambio estructural y anatómico Cambio funcional en los órganos Destrezas, habilidades de cada uno Consecuencias económicas y sociales Clasificación ICF Trastorno Deterioro Limitación de la actividad Restricción en la participación Aplicación a la visión Salud ocular «Función visual» (medida cuantitativamente) «Función visual» (descripción cualitativa) Calidad de vida en función de la visión Categorizados como rangos de «pérdida de visión» sociales «establecidos» en su comunidad, su trabajo, su edad, su desarrollo personal y el apoyo familiar y social (real y percibido). Esta potente mezcla de presiones sociales, expectativas individuales, temores, dificultades funcionales y ajustes en las relaciones personales puede conducir a la depresión e incluso al suicidio. Como el objetivo del tratamiento en las enfermedades oculares crónicas es prevenir la ceguera y mantener la calidad de vida de los pacientes, el modo tradicional de evaluar la evolución de la enfermedad y el resultado conseguido por el tratamiento se centra en los aspectos clínicos de la enfermedad, como, por ejemplo, la agudeza visual, la presión intraocular o la extensión de la pérdida del campo visual. Sin embargo, las medidas clínicas no reflejan los efectos de la enfermedad o de los tratamientos sobre la limitación de la actividad y la calidad de vida en general. La medida de las perspectivas de los pacientes y de la percepción subjetiva de los beneficios del tratamiento se realiza mediante el empleo de cuestionarios. Anteriormente, estos cuestionarios eran denominados, con frecuencia, medidas de calidad de vida. Sin embargo, como realmente la perspectiva procede de los pacientes, estos cuestionarios se denominan ahora «medidas de resultado realizados por los pacientes» (PROM, Patient Reported Outcome Measures). ¿Qué Es Calidad De Vida Y De Salud Relacionadas Con La Calidad De Vida? Calidad de vida incluye conceptos como bienestar, satisfacción, felicidad, esperanza o funcionalidad. No ­obstante, no existe una definición única que se haya convertido en la definición estándar de «calidad de vida». Además de la falta de definición estándar, los resultados de los estudios que emplean medidas de calidad de vida indican que los tratamientos pueden afectar a la percepción que tienen los pacientes de su salud, pero no a su calidad de vida. Una cuestión que se plantea es si estado de salud y calidad de vida tienen el mismo significado. De hecho, muchos investigadores utilizan estos términos indistintamente. La Organización Mundial de la Salud (OMS) define la salud como un «estado de completo bienestar físico, mental y social» y no sólo como la ausencia de afecciones o de enfermedades. Por lo tanto, calidad de vida es un término conceptualmente más amplio y probablemente incluye el estado de salud. Dado que la salud es el resultado en el que estamos interesados en el ámbito médico, el concepto de calidad de vida relacionada con la salud (HRQOL, Health Related Quality Of Life) se introdujo correctamente. Comprende el estado de salud, los niveles de deficiencia, discapacidad y minusvalía de un paciente y omite otros valores que no se consideran en general como «salud», como ingresos, estado espiritual o libertad. En otras palabras, lo que caracteriza a la calidad de vida relacionada con la salud es lo que el paciente experimenta como resultado de la atención médica. ¿Por Qué Es Importante Medir La Calidad De Vida Relacionada Con La Salud? El concepto de calidad de vida (QOL, Quality Of Life) es popular, pero es una entidad vaga y etérea. Es algo de lo que todo el mundo habla, pero nadie sabe muy bien qué es. Por ejemplo, algunas de las definiciones utilizadas son las siguientes: Son varios los beneficios potenciales de emplear esta medida en la práctica clínica y en la investigación. Puede ser utilizada para: 1. «La calidad de vida es una percepción subjetiva de la satisfacción o la felicidad en la vida en ámbitos de importancia para el individuo». 2. «Calidad de vida es la percepción de un individuo de su posición en la vida en el contexto de la cultura y el sistema de valores en que vive y en relación con sus objetivos, expectativas, estándares y preocupaciones». 1. La detección de problemas físicos o psicosociales que de otra manera podrían pasar inadvertidos. 2. El seguimiento de enfermedades y tratamiento. 3. El ajuste preciso de los tiempos en los planes terapéuticos. 4. La comunicación médico-paciente. 5. La mejora de la prestación de la atención. © Elsevier. Fotocopiar sin autorización es un delito. E 1 1 | Ca l i d a d d e v i d a y e n fe r me d ad es oc ulares ¿Cuáles Son Los Tipos De Medidas De La Calidad De Vida Relacionada Con La Salud? ¿Cuáles Son Los Retos De La Evaluación De La Calidad De Vida Relacionada Con La Salud? Existen dos tipos de herramientas disponibles para medir la calidad de vida relacionada con la salud: genéricos y específicos de la enfermedad. Las herramientas genéricas evalúan la calidad de vida en general y son aplicables en una amplia variedad de poblaciones. Incluyen perfiles de salud (p. ej., Sickness Impact Profile [SIP]) y las medidas de utilidad (p. ej., EuroQol EQ-5D [EQ-5D]). Estas herrramientas permiten la comparación de los efectos relativos de la enfermedad evaluada con personas sanas, con grupos de personas en países diferentes o distintos programas de atención de salud, independientemente de los problemas de salud subyacentes. Las herramientas genéricas no son sensibles a cambios en enfermedades o condiciones espe­ cíficas. Las herramientas específicas de la enfermedad se centran en los aspectos del estado de salud que son específicos del área de interés principal. Son más sensibles y se centran en los problemas que son relevantes para los pacientes estudiados. Además, se refieren a las áreas analizadas periódicamente por el médico. Pueden ser específicos para una enfermedad (p. ej., el glaucoma o la degeneración macular asociada a la edad), una población de pacientes (p. ej., pacientes con baja visión), una determinada función (p. ej., visión) o para un estado de­ terminado que puede ser causado por varias enfer­ medades de base (p. ej., dolor). Lógicamente, las herramientas específicas de una enfermedad no pueden ser utilizadas para comparar distintas enfermedades o estados. Ninguna herramienta puede emplearse por sí sola para evaluar todos los resultados y procesos ni abarca todas las áreas de la calidad de vida relacionada con la salud, enfermedades, población y tratamientos. El planteamiento común para medir la calidad de vida relacionada con la salud, y en particular en los ensayos clínicos, es el uso de ambas herramientas en combinación: es decir, herramientas genéricas y específicas de la enfermedad. Son complementarias, ya que las genéricas ofrecen información general sobre la calidad de vida relacionada con la salud y las específicas, información detallada de la enfermedad acerca de los problemas de salud específicos. La evaluación de la calidad de vida relacionada con la salud se refiere a las experiencias de los pacientes, los recursos, las creencias, las expectativas y las percepciones. Esto introduce errores en la medición, recopilación de datos, análisis e interpretación de los resultados, no sólo en los ensayos controlados aleatorios, sino también en la práctica clínica. Además, los médicos generalmente no están habituados a usar estas herramientas de medida. Por tanto, para muchos de ellos, la evaluación de la calidad de vida puede parecer más un arte que una ciencia. Algunos de los desafíos a los que se enfrentan los médicos son los siguientes: ¿Cuáles Son Las Medidas De Resultado Realizadas Por Los Pacientes Comúnmente Usadas En Los Trastornos Visuales? Se dispone para su uso de muchos sistemas de medida. Algunos de ellos se enumeran en la Tabla e11.3. La elección depende del objetivo del estudio, de la población objetivo y de la facilidad de empleo. 1. La elección de una herramienta adecuada para su práctica o de investigación. 2. La interpretación de los resultados y la relación con lo que es importante para ellos y sus pacientes. 3. La falta de tiempo, dinero y recursos necesarios para recoger los datos en su consulta. 4. El compromiso del paciente para cumplimentar los cuestionarios. 5. La dificultad para estandarizar los procedimientos en la investigación debido a las diferencias en la cultura y en el idioma. También puede ser un problema que el paciente cambie el estándar o la referencia a la que se refiere para evaluar su calidad de vida relacionada con la salud. Esto puede suceder por la adaptación, la supervivencia o la expectativa. Se hace difícil desentrañar si el verdadero cambio en el paciente se debe un cambio de actitud o de las normas, lo que causa problemas en el seguimiento de los pacientes con el tiempo y en la evaluación del impacto de la intervención. Conclusiones – La evaluación de la calidad de vida relacionada con la salud está ganando popularidad entre los médicos a medida que es más evidente que una evaluación formal de la calidad de vida relacionada con la salud mejora la calidad de la atención al paciente y afecta a la comunicación médico-paciente. También complementa la información acerca de la forma tradicional de medir el objetivo clínico y proporciona una imagen más clara de los resultados de la atención a los pacientes teniendo en cuenta sus puntos de vista. – Sin embargo, el éxito de la utilización de estas medidas en la práctica clínica diaria depende de la disponibilidad de un conjunto aceptable de medidas de resultados realizadas por los pacientes, la relevancia clínica de éstas para los pacientes y médicos, y la facilidad de uso para los usuarios de los servicios de salud (paciente, médico y personal sanitario). Son necesarias nuevas investigaciones sobre la definición metodológica y la interpretación de las medidas antes de que se conviertan en medidas de uso sistemático en la práctica clínica diaria. e-341 e-342 pa r t e 1 0 : C A P Í T U L O S E X T R A Tabla e11.3 Ejemplo de medidas usadas en los trastornos visuales Instrumentos Población objetivo N.° de ítems SF-36® Health Survey Adultos 36 Euroqol EQ-5D (EQ-5D) Adultos y niños mayores de 12 años 5 y 1 escala analógica visual Sickness Impact Profile (SIP) Adultos 136 Instrumentos genéricos Instrumentos específicos para la función visual Activities of Daily Vision Scale (ADVS) Adultos con cataratas 20 National Institute Visual Function Questionnaire (NEI-VFQ) Adultos con discapacidad visual 25 y 1 ítem general de salud Impact of Vision Impairment (IVI) Adultos con discapacidad visual 32 Low Vision Quality-of-Life Questionnaire (LVQOL) Niños, adolescentes y adultos con baja visión por enfermedad intratable 25 Ocular Surface Disease Questionnaire (OSD®) Adultos con alteraciones de la superficie ocular OSD-Qol®: 28; OSD-Sym®: 24; OSD-Med®: 24; OSD-Sat®: 4 Quality of Life and Vision Function Questionnaire (QOLVFQ) Adultos con discapacidad visual 17 Visual Function Index (VF-14) Adultos con cataratas 14 Comparison of Ophthalmic Medications for Tolerability Questionnaire (COMTol) Adultos con glaucoma 39 Glaucoma Quality of Life-15 (GQL-15) Adultos con glaucoma 15 Graves’ Ophthalmopathy Quality of Life Questionnaire (GO-QOL) Adultos con oftalmopatía de Graves 16 Miedziak's instrument Adultos con distrofia macular de Stargardt 54 Measure of Outcome in Ocular Disease (MOOD) Adultos con melanoma ocular 21 Refractive Status and Vision Profile (RSVP) Adultos con alteraciones refractivas 42 Turano's instrument Adultos con retinitis pigmentosa 46 Bibliografía Colenbrander A. Guide for the evaluation of visual impairment. In: International Society for Low Vision Research and Rehabilitation. San Francisco, CA: Pacific Vision Foundation, 1999. Garratt A. Patient reported outcome measures in trials. Br Med J (Clinical Research ed.) 2009; 338(12):a2597. Guyatt GH, Feeny DH, Patrick DL. Measuring health-related quality of life. Ann Intern Med 1993;118(8):622-9. Guyatt GH, Veldhuyzen Van Zanten SJ, Feeny DH, et al. Measuring quality of life in clinical trials: A taxonomy and review. Can Med Ass J 1989;140(12):1441-8. Hahn EA. Precision of health-related quality-of-life data compared with other ­clinical measures. Mayo Clin Proc 2007;82(10):1244-54. Revicki DA, Osoba D, Fairclough D, et al. Recommendations on health-related quality of life research to support labeling and promotional claims in the united states. Quality of Life Res 2000;9(8):887-900. Wu AW. Quality-of-life assessment in clinical research: Application in diverse populations. Med Care 2000;38(9 Suppl):130-5. E 1 1 | Ca l i d a d d e v i d a y e n fe r me d ad es oc ulares © Elsevier. Fotocopiar sin autorización es un delito. Autoevaluación E11 1. En oftalmología los cuestionarios denominados medidas de resultado realizados por los pacientes (PROM) incluyen los siguientes datos excepto: 3.Aproximaciones comunes para medir la calidad de vida relacionada con la salud en los ensayos clínicos en oftalmología son: a. Síntomas de las patologías visuales. b.Test de función visual. c. Preguntas sobre el cumplimiento del tratamiento. d. Satisfacción espiritual. Correcta: b. Los datos incluidos en los PROM se refieren a los efectos del tratamiento o su manejo por parte del paciente. Las áreas que cubren incluyen aspectos físicos (habilidad para desempeñar actividades de la vida diaria como el cuidado personal y la capacidad de caminar), psicológicos (bienestar emocional y mental) y desempeño social (relaciones con los demás y participación en actividades sociales), percepción del estado de salud (HRQOL), autopercepción del ser (espiritualidad y estigmas) y satisfacción con la vida. a. Emplear sólo herramientas genéricas. b. Utilizar únicamente herramientas específicas de problemas visuales. c. Emplear combinaciones de herramientas genéricas y específicas de problemas visuales. d. Utilizar las medidas de resultados visuales proporcionados por los médicos. Correcta: c. Como las herramientas genéricas dan información general sobre la calidad de vida relacionada con la salud y las específicas de enfermedad dan información sobre problemas de salud específicos, ambas herramientas son complementarias y pueden combinarse en los ensayos clínicos aleatorizados. 2.Sobre las herramientas genéricas sobre el estado de salud, es cierto que: 4.Las ventajas de emplear medidas de resultados realizados por los pacientes son: a. Las empleadas en la evaluación económica se denominan medidas «trade off». b. Son sensibles a los cambios producidos en la calidad de vida de los pacientes que presentan degeneración macular asociada a la edad. c. Pueden comparar el impacto sobre la calidad de vida en los pacientes que tienen degeneración macular frente a la población sana. d. Hacen hincapié sobre la degeneración macular asociada a la edad. Correcta: c. Las herramientas genéricas sobre el estado de salud miden la calidad de vida global. Pueden ser usadas para evaluar una gran variedad de patologías, programas de salud o intervenciones terapéuticas y preventivas sobre diferentes grupos demográficos y culturales. Sin embargo, estas herramientas no son sensibles a los cambios específicos debidos a enfermedades concretas. a. Son útiles para monitorizar el cumplimiento de los tratamientos tópicos por parte de los pacientes. b. Permiten conocer el cumplimiento del paciente con el tratamiento. c. Permiten detectar el deterioro visual o la progresión de las enfermedades oftalmológicas. d.Todo lo anterior. Respuesta: d. Las medidas de resultados realizados por los pacientes permiten a los médicos conseguir información específica sobre cómo afectan a los pacientes la enfermedad y el tratamiento. También les permite detectar problemas físicos o psicosociales que, de otro modo, podrían pasar desapercibidos, monitorizar la enfermedad y el tratamiento o el incumplimiento de los planes terapéuticos. Además, mejoran la comunicación médico-paciente y los cuidados proporcionados a los pacientes. e-343 e-344 pa r t e 1 0 : C A P Í T U L O S E X T R A Temas de trabajo E11 1. Enumerar y razonar cinco causas por las que un paciente con pérdida de agudeza visual empeora su calidad de vida y cuáles serían los mecanismos para mejorarla. 2. Realizar una búsqueda y exponer los resultados sobre las diferentes medidas de calidad de vida en la enfermedad ocular. Alteraciones de los reflejos pupilares Elena García Martín, Pilar Calvo Pérez E12 Objetivos de aprendizaje ● Aprender la metodología de la exploración de los reflejos pupilares y su interpretación. ● Conocer las principales alteraciones pupilares y su trascendencia. Palabras clave/Key words Reflejos pupilares Pupila de Argyll Robertson Pupila de Adie Síndrome de Horner Defecto pupilar aferente Pupila de Marcus-Gunn Pupillary reflexes Argyll Robertson pupil Adie pupil Horner Syndrome Afferent pupillary defect Marcus-Gunn pupil Anatomía aplicada La exploración de los reflejos pupilares permite valorar la función del sistema neurológico central y de la vía visual, revisando la integridad del II par craneal (oftálmico) y del III par craneal (motor ocular común). Se valoran ambos ojos por separado, pero de forma comparativa (Figura e12.1). En los reflejos pupilares luminosos, la respuesta esperada es la miosis (constricción pupilar) y se debe explorar tanto la presencia de respuesta como su intensidad. Las pupilas son sensores neurológicos cuya disfunción puede indicar una alteración en la vía óptica o aferente, o una alteración en el neurovegetativo cervical (simpático/ parasimpático) o vía eferente. Reflejo fotomotor Figura E12.1. Representación de la exploración de los reflejos pupilares: se valoran ambos ojos por separado, pero de forma comparativa. 2. La segunda neurona conecta el núcleo pretectal con ambos núcleos de Edinger-Westphal. 3. La tercera neurona conecta el núcleo de Edinger-Westphal con el ganglio ciliar. 4. La cuarta neurona va desde el ganglio ciliar al esfínter pupilar, donde las fibras parasimpáticas generan miosis. Reflejo de cerca Consiste en la sincinesia de acomodación, convergencia y miosis que se produce cuando la mirada cambia de un objeto distante a otro próximo. Las vías finales de este reflejo son las mismas que las del reflejo fotomotor, pero su centro está mal definido. Se debe a la acción de cuatro neuronas (Figura e12.2): Inervación simpática 1. La primera es la neurona sensorial que, si se inicia en la retina nasal, cruza el quiasma y llega al núcleo pretectal contralateral, mientras que si se localiza en la retina temporal no cruza el quiasma y, por tanto, llega al núcleo pretectal ipsilateral. Produce midriasis y consta de 3 neuronas (Figura e12.3): © 2012. Elsevier España, S.L. Reservados todos los derechos 1. La primera neurona, o central, parte del hipotálamo posterior y va al centro cilioespinal de Budge ipsilateral (localizado en la médula espinal entre C8 y T2). e-345 e-346 par t e 9 : C A P Í T U L O S E X T R A Reflejo fotomotor o directo a la luz Consiste en la constricción pupilar que se produce al esti­ mular la pupila con un haz de luz. Para explorar este reflejo se solicita al paciente que dirija su mirada al frente. El explorador se coloca frente al paciente, ilumina cada ojo por separado y observa la respuesta pupilar, comparando la intensidad de la respuesta entre ambos ojos (Figura e12.4). La luz debe dirigirse de abajo arriba para evitar reflejos corneales y la sombra nasal. Al proyectar la luz no sólo se contrae la pupila del ojo es­ timulado sino que también lo hace la pupila del otro ojo (reflejo consensual). Para observar con mayor facilidad la respuesta consensuada, se le puede pedir al paciente que coloque su mano entre los ojos, de forma que iluminaremos cada ojo por separado teniendo cuidado de no dirigir la luz hacia el otro ojo (que es este caso es el ojo a valorar). Reflejo a la visión cercana Figura E12.2. Vía anatómica del reflejo pupilar a la luz. Ocurre cuando el paciente pasa de estar viendo un objeto a distancia a ver otro situado a distancia más cercana (33 cm). Se produce una contracción pupilar por la inervación común del recto medio y del esfínter pupilar por la rama inferior del tercer par craneal. Para explorar este reflejo se coloca un objeto cercano al paciente, a la altura de sus ojos y entre ambos, y otro objeto lejano. El explorador se coloca lateralmente al paciente y observa de cerca sus ojos. Se le solicita que dirija la mirada al objeto cercano y posteriormente al lejano o viceversa; se valora la respuesta pupilar en ambos ojos a las distintas distancias (Figura e12.5). Cuando el paciente observa el objeto cercano la respuesta pupilar normal será la miosis y al observar el objeto lejano, la respuesta pupilar debe ser la midriasis. Figura E12.3. Vía anatómica de la inervación simpática. 2. La segunda neurona, o preganglionar, se dirige desde el centro cilioespinal de Budge hasta el ganglio cervical superior, localizado en el cuello. En su recorrido pasa cerca de la pleura apical, por lo que puede lesionarse durante la cirugía cervical o por un tumor de Pancoast (carcinoma broncogénico). 3. La tercera neurona, o posganglionar, camina pegada a la arteria carótida interna, entra en el seno cavernoso y se une a la división oftálmica del nervio trigémino (V par craneal) para alcanzar el cuerpo ciliar y el múscu­ lo dilatador de la pupila. Reflejos pupilares normales Son principalmente dos: el reflejo fotomotor y reflejo a la visión cercana. Figura E12.4. Representación del reflejo fotomotor directo y consensuado. Al proyectar la luz no sólo se contrae la pupila del ojo estimulado (reflejo directo), sino que también lo hace la pupila del otro ojo (reflejo consensual). E 1 2 | A l te ra c i o n e s d e l o s re f l ej os pupi lares Defecto pupilar aferente relativo o pupila de marcus-gunn Puede aparecer en lesiones del nervio óptico (unilaterales) o en lesiones retinianas extensas. Ambas pupilas son de tamaño similar en condiciones normales, pero al examinar las pupilas con luz ocurre lo siguiente: 1. Al iluminar el ojo sano, ambas pupilas se contraen (reflejo consensual). 2. Cuando se cambia rápidamente la luz del ojo sano al afectado, la pupila de éste empieza a dilatarse a pesar de tener estímulo luminoso, lo que se denomina «reacción paradójica de Marcus-Gunn». Se debe a que la reacción a la luz es más perezosa en el lado afectado. Figura E12.5. Representación del reflejo de la visión cercana. Cuando el paciente observa el objeto cercano, la pupila se contrae (miosis) y al obser­ var el objeto lejano, la pupila se dilata (midriasis). Defectos pupilares La mayoría de las anomalías pupilares se diagnostican por presentar una anisocoria (diferencia de tamaño entre ambas pupilas), por lo que debemos realizar un diagnóstico diferencial. Para ello es importante tener en cuenta las siguientes consideraciones: © Elsevier. Fotocopiar sin autorización es un delito. 1. En el caso de que exista duda en la intensidad de la respuesta fotomotora se puede reducir la iluminación de la habitación para acentuar la midriasis o, al contrario, si queremos explorar una pupila más grande de lo normal, puede resultar más aparente si aumentamos la iluminación ambiental. 2. En las opacidades de medios (como las cataratas o las anomalías corneales), el reflejo fotomotor se conserva. 3. Un ojo ciego no produce respuesta directa ni consensual; sin embargo, sí existirá respuesta pupilar fotomotora en el ojo sano y respuesta consensual en el ojo ciego. 4. Los ojos con iris muy oscuros pueden dificultar la valoración de la respuesta pupilar consensual y/o de acomodación. Defectos pupilares aferentes Defecto pupilar aferente absoluto o pupila amaurótica La pupila de un ojo ciego por enfermedad retiniana o del nervio óptico no se contrae cuando es estimulada por la luz. Al iluminar el ojo patológico, ambas pupilas son del mismo tamaño y ninguna reacciona a la luz (reflejo consensual abolido). Sin embargo, cuando se estimula el ojo sano, ambas pupilas se contraen, ya que los impulsos aferentes del ojo sano estimulan la inervación eferente intacta del ojo ciego (reacción consensual conservada). El reflejo de cerca es normal en ambos ojos. El defecto pupilar aferente relativo es de gran valor diagnóstico en pacientes que sufren una pérdida repentina de visión unilateral sin lesión retiniana evidente, especialmente importante para el diagnóstico de las neuritis ópticas. Disociación luz-cerca Es un grupo de alteraciones pupilares en las que el reflejo luminoso está ausente o es lento, mientras que la respuesta de cerca es normal. Las causas son numerosas (Tabla e12.1). Pupila de argyll robertson Es un signo clásico de neurosífilis, aunque puede aparecer en diabetes, alcoholismo, esclerosis múltiple, etc. Se caracteriza por una alteración pupilar bilateral y simétrica con: ● Pupilas mióticas, irregulares. Reflejo pupilar a la luz abolido. ● Reacción pupilar a convergencia y acomodación conservada. ● Pupila de Adie Aparece en pacientes jóvenes y sanos, preferentemente en mujeres. Se caracteriza por la presencia de una pupila dilatada que, en un principio, es unilateral. Tabla E12.1 Causas de disociación luz-cerca Causas unilaterales Defecto de la conducción aferente Pupila de Adie Herpes zóster oftálmico Regeneración aberrante del tercer par Causas bilaterales Neurosífilis Diabetes mellitus tipo 1 Distrofia miotónica Síndrome centroencefálico dorsal de Parinaud Amiloidosis familiar Encefalitis Alcoholismo crónico e-347 e-348 par t e 9 : C A P Í T U L O S E X T R A La lesión parece deberse a un problema de denervación parasimpática posganglionar del iris. La pupila dilatada reacciona lentamente a la luz y su tamaño es variable. Los pacientes suelen mostrar alteraciones en reflejos tendinosos profundos (rodilla, tobillo) y en algunos casos existe una historia reciente de infección respiratoria aguda. La instilación de acetilcolina al 2,5% o pilocarpina al 0,125% produce miosis en la pupila afectada (Figu­ ra e12.6). No existe tratamiento eficaz. Los colirios mióticos reducen la anisocoria, pero pueden inducir un espasmo del músculo ciliar, por lo que no se suelen prescribir. Parálisis oculosimpática o síndrome de horner Es el resultado de una parálisis de las fibras simpáticas de la vía pupilar, por diferentes causas (Tabla e12.2). Esta alteración puede ser el primer signo de un tumor de Pancoast, si bien también aparece en patología del cuello Tabla E12.2 Causas de la parálisis oculosimpática o síndrome de Horner Causas centrales: afectación de la primera neurona Enfermedades del tronco cerebral (tumor, patología vascular o desmielinizante) Siringomielia Síndrome de Wallenberg (afectación medular lateral) Tumores medulares Causas preganglionares: afectación de la segunda neurona Tumor de Pancoast (carcinoma broncogénico) Aneurismas y disección carotídea o aórtica Lesiones cervicales (amígdalas, traumatismo, posquirúrgicas, infecciosas) Causas posganglionares: afectación de la tercera neurona Cefaleas «en racimo» (neuralgia migrañosa) Disección de la arteria carótida interna Otitis media Masa del seno cavernoso Tumores nasofaríngeos y mediastino que provoque una interrupción del tronco simpático cervical. Se producen miosis, ptosis, déficit de sudoración (anhidrosis) y enoftalmos (Figura e12.7). Para su diagnóstico se utilizan colirios de cocaína al 4%, que provoca dilatación de la pupila normal pero no de la afectada. Pupila fija y dilatada Lo primero que hay que sospechar ante una pupila en midriasis que no responde a la luz es que inadvertida o intencionadamente el paciente haya tenido contacto con midriáticos, pero también puede reflejar la existencia de un proceso intracraneal grave (aneurisma de arterias cerebrales, tumores, etc.). Para diferenciar la pupila dilatada farmacológicamente de la pupila dilatada por lesión del tercer par craneal, instilaremos pilocarpina, que produce una miosis rápida en el caso de denervación simpática (lesión del tercer par), mientras que en el caso de midriasis farmacológica la pupila no se contraerá o lo hará débilmente. Figura E12.6. Ejemplo de un paciente con pupila de Adie (A), donde se observa que la pupila dilatada reacciona lentamente a la luz. Al instilar acetilcolina al 2,5% o pilocarpina al 0,125%, la pupila afectada se contrae (miosis) (B). Las pupilas en las intoxicaciones por drogas La marihuana no modifica la pupila. La cocaína produce midriasis. El LSD (familia de los alucinógenos) causa midriasis. La heroína provoca miosis. Interpretación de los reflejos pupilares en los comas Figura E12.7. Ejemplo de un paciente con parálisis oculosimpática o síndrome de Horner, en el que se observan miosis, ptosis, déficit de sudo­ ración (anhidrosis) y enoftalmos en el ojo derecho. En general, en el coma metabólico y por sobredosis de drogas, las pupilas son mióticas, pero reactivas a la luz. E 1 2 | A l te ra c i o n e s d e l o s re f l ej os pupi lares En la fase terminal (anóxica) de las encefalopatías metabólicas aparece midriasis como signo de pronóstico fatal. La dilatación pupilar en la isquemia cerebral se debe a una descarga adrenérgica masiva. Referencias Bibliográficas © Elsevier. Fotocopiar sin autorización es un delito. Kanski JJ. Oftalmología Clínica. Elsevier, 2009. Mojon SM, Odel JG. Neuro-Ophthalmology. In : Wisnicki, HJ. (ed.). Ophthalmology. McGraw-Hill ed.; 1997. Savino PJ, Sergott RC. Neuro-Ophthalmology. En: Rhee DJ, Pyfer MF, (eds.). The Wills Eye Manual. (4.ª ed.). Philadelphia: Lippincott Williams & Wilkins, 1999. Shirley HW. Neurooftalmología. campos visuales, nervio óptico y pupila. En: PavanLangston D, (ed.). Manual de diagnóstico y terapéutica oculares. (3.ª ed.). Barcelona: Masson-Salvat, 1993. Apoyo audiovisual y lecturas recomendadas Animaciones de los movimientos oculares y reflejos pupilares: http://cim.ucdavis. edu/eyes/version1/eyesim.htm. Simulador de alteraciones pupilares en Aula abierta de institutoalcon.com. Autor: Bernardo Sánchez Dalmau. Link: http://www.institutoalcon.com/?LNG=ESP&UID= 5555&TYPE=4. Web de la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP): Sección de libros. Capítulo XVI (Neuroftalmología). Autores: Juan J. Aliaga Gómez, Carmen Marcos Martín, Carlos Serrano Molina y Raquel Gato Morais. Link: http://www.sepeap.org/archivos/libros/OFTALMOLOGIA/ Ar_1_8_44_APR_3.pdf. e-349 e-350 par t e 9 : C A P Í T U L O S E X T R A Autoevaluación E12 1.Señale la respuesta falsa con respecto al reflejo fotomotor: a. Se debe explorar con el paciente colocado frente al observador. b. En un ojo normal, al proyectar la luz también se contrae la pupila del ojo no estimulado, lo que se denomina reflejo consensual. c. Se debe a la acción de 4 neuronas, la primera de las cuales se inicia en la retina. d. La luz debe dirigirse de arriba abajo para evitar reflejos corneales y la sombra nasal. e. Consiste en la constricción pupilar que se produce al estimular la pupila con un haz de luz. Correcta: d. El reflejo fotomotor o directo a la luz es la cons­ tricción pupilar que se produce al estimular la pupila con un haz de luz y se debe a la acción de 4 neuronas, la primera de las cuales es la neurona sensorial que, si se inicia en la retina nasal, cruza el quiasma y llega al núcleo pretectal contralateral, mientras que si se localiza en la retina temporal no cruza el quiasma y, por tanto, llega al núcleo pretectal ipsilateral. Para explorar este reflejo se solicita al paciente que dirija su mirada al frente. El explorador se coloca frente al paciente, ilumina cada ojo por separado y observa la respuesta pupilar, comparando la intensidad de la respuesta entre ambos ojos. La luz debe dirigirse de abajo arriba para evitar reflejos corneales y la sombra nasal. Al proyectar la luz no sólo se contrae la pupila del ojo estimulado sino que también lo hace la pupila del otro ojo (reflejo consensual). 2.Identifique el diagnóstico más probable para la siguiente situación (nota: la iluminación de la habitación en la que se encuentra el paciente es de intensidad leve): (anhidrosis) y enoftalmos, por lo que en este caso no se puede corresponder con afectación del ojo izquierdo (respuesta d), pero sí con la del derecho (respuesta c). La respuesta e es inco­ rrecta porque la pupila de Adie se caracteriza por la presencia de una pupila dilatada y en este caso la pupila derecha está contraída. 3. En la siguiente imagen, ¿cuál es el diagnóstico más probable? a. Pupila de Adie. b. Pupila de Argyll Robertson. c. Defecto pupilar aferente relativo. d. Pupila de Marcus-Gunn. e. Ninguna de las anteriores. Correcta: a. La pupila de Adie se caracteriza por una pupila dilatada que reacciona lentamente a la luz, como se observa en la imagen. La pupila de Argyll Robertson, sin embargo, se caracteriza por una alteración pupilar bilateral y simétrica con pupilas mióticas e irregulares. En el defecto pupilar aferente relativo o pupila de Marcus-Gunn, ambas pupilas son de tamaño similar en condiciones normales. 4.Señale la respuesta incorrecta: a. Pupila de Marcus-Gunn derecha. b. Pupila de Marcus-Gunn izquierda. c. Síndrome de Horner derecho. d. Síndrome de Horner izquierdo. e. Pupila de Adie derecha. Correcta: c. Las respuestas a y b son incorrectas porque en la pupila de Marcus-Gunn ambas pupilas son de tamaño similar en condiciones normales. En la parálisis oculosimpática o sín­ drome de Horner se producen miosis, ptosis, déficit de ­sudoración a. En el síndrome de Horner existe una parálisis de las fibras parasimpáticas de la vía pupilar. b. El síndrome de Horner puede deberse a un carcinoma broncogénico. c. El síndrome de Horner puede ser secundario a patología del cuello y mediastino que provoque una interrupción del tronco simpático cervical. d. En el síndrome de Horner se producen miosis, ptosis, déficit de sudoración (anhidrosis) y enoftalmos. e. En el síndrome de Horner, el colirio de cocaína al 4% puede ser útil para realizar el diagnóstico. Correcta: a. En el síndrome de Horner existe una parálisis de las fibras simpáticas de la vía pupilar. E 1 2 | A l te ra c i o n e s d e l o s re f l ej os pupi lares Caso clínico E12.1 Se presenta el caso clínico de una mujer de 37 años de edad, remitida por el servicio de pediatría para evaluación de aniso­ coria desde el nacimiento que se caracteriza por pupila derecha midriática, especialmente en condiciones de oscuridad. La paciente no presenta antecedentes de interés. En la exploración presenta anisocoria; sin ptosis asociada. La explora­ ción del fondo de ojo fue normal, así como la evaluación con tomografía axial computarizada (TC) cerebral. Se realiza el test de apraclonidina al 1%, instilando una gota en cada ojo. A los 30 minutos no se observan cambios en las pupilas, con lo que se descarta el síndrome de Horner derecho. En otra revisión se realiza el test de pilocarpina al 0,125%, que asocia miosis en el ojo derecho, como se observa en la imagen. © Elsevier. Fotocopiar sin autorización es un delito. Se realiza el diagnóstico de pupila tónica de Adie. e-351 e-352 par t e 9 : C A P Í T U L O S E X T R A Caso clínico E12.2 Niño de 4 meses remitido por ptosis y miosis en el ojo izquierdo. Entre los antecedentes personales, destaca parto por cesárea (nalgas) y comisura labial desviada al nacimiento (por posible alteración del nervio facial en el nacimiento). La exploración oftalmológica muestra ptosis, miosis, hipo­ cromía de iris y anisocoria que aumenta en la oscuridad, como se observa en la figura: El diagnóstico es compatible con síndrome de Horner izquierdo. Se realiza el test de apraclonidina al 1%, y a los 30 minutos se invierte la anisocoria, como se ve en la figura: Se confirma el diagnóstico de síndrome de Horner por posible lesión del plexo braquial en el parto. E 1 2 | A l te ra c i o n e s d e l o s re f l ej os pupi lares Temas de trabajo E12 Desarrolla cómo se ven afectados los reflejos pupilares ante la parálisis total de cada uno de los siguientes pares craneales: © Elsevier. Fotocopiar sin autorización es un delito. 1. Nervio oculomotor común (III par). 2. Nervio parético (IV par). 3. Nervio oculomotor externo (VI par). e-353