PRACTICA Nº 4a SÍNTESIS DE LA ASPIRINA Objetivos
Anuncio

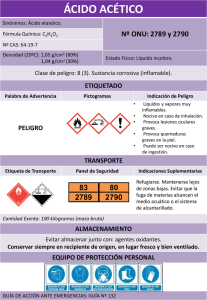
PRACTICA Nº 4a SÍNTESIS DE LA ASPIRINA Objetivos - Realizar un ejemplo de síntesis orgánica de interés industrial. - La reacción de obtención de la aspirina como ejemplo de reacción de sustitución del grupo acilo. - Caracterizar la pureza de un producto por determinación del punto de fusión y test químico de grupo funcional. - Comprobar su estructura mediante el uso de técnicas espectroscópicas (UV, IR y 1H-RMN). INTRODUCCIÓN. La aspirina (nombre comercial registrado por la casa Bayer para el ácido acetal salicílico) es uno de los compuestos que presentan una actividad fisiológica de gran interés, de ahí su importancia como fármaco debido a su capacidad para el dolor (analgésico), para reducir la temperatura corporal (antipirético), como antiinflamatorio, y más recientemente se ha comprobado su actividad como agente preservativo de enfermedades cardiovasculares. De hecho se puede decir que la aspirina es el medicamento de mayor consumo a nivel mundial. También con efectos medicinales se utilizan sus sales de litio o de calcio con la ventaja de que son solubles en agua (aspirina efervescente). Desde el punto de vista químico, al ácido acetilsalicílico es un éster del ácido acético donde la parte ácida proviene de este ácido mientras que la parte alcohólica lo hace del ácido salicílico (ácido o-hidroxibenzoico), obteniéndose por reacción del anhídrido acético con el grupo OH del ácido salicílico. La reacción que tiene lugar es: O C O O OH + H3C OH ác. salicílico (ác. o-hidroxibenzóico) C C O O C CH3 H+ O anhídrido acético OH C CH3 O ác. acetilsalicílico (aspirina) MATERIAL Y REACTIVOS. - Equipo de filtración a vacío (kitasato + embudo buchner). - 2 Erlenmeyer de 250 ml. - Probetas de 10 y 25 ml. - Placa eléctrica. - Pinzas metálicas. - Tubo de ensayo. - Papel de filtro. - Ácido salicílico. - Anhídrido acético. - Ácido sulfúrico concentrado. - Disolución de FeCl3. PROCEDIMIENTO EXPERIMENTAL. En un erlenmeyer de 250 ml se añaden, en este orden, 5 g de ácido salicílico, 10 ml de anhídrido acético y 1-2 ml de ácido sulfúrico concentrado y se agita de forma suave la mezcla para homogeneizarla. Al tratarse de una reacción exotérmica se puede percibir un aumento de la temperatura (calentamiento del matraz). Una vez que todo el ácido salicílico se ha disuelto se debe empezar a observar la aparición de un precipitado que correspondería al derivado acetilado. Hay que tener en cuenta que si la temperatura no sube lo suficiente no se logra la acetilación total. En el caso de suceder esto, calentar la mezcla en la placa eléctrica durante unos minutos. Se deja enfriar bien la mezcla de reacción con el fin de favorecer la precipitación del producto formado. Si no se observase la aparición de precipitado introducir el erlenmeyer en un baño de agua-hielo hasta que se observa la aparición de cristales. Una vez que la precipitación es total se procede a separar el sólido mediante filtración a vacío, lavando el producto y el erlenmeyer con un poco de agua fría hasta que el olor característico a ácido acético (olor intenso a vinagre) es apenas perceptible. Los líquidos de la filtración se pueden concentrar y, por enfriamiento, pueden dar lugar a cristales de producto. Finalizada la filtración se colocan los cristales sobre un papel de filtro previamente pesado y se deja secar. Cuando el producto esta completamente seco se pesa al objeto de calcular el rendimiento. También podemos comprobar la pureza de los cristales obtenidos mediante la obtención del punto de fusión (punto fusión de la aspirina pura: 130-135ºC) y también cogiendo unos pocos cristales, los cuales se colocan en un tubo de ensayo y se le añaden unas gotas de la disolución de FeCl3, observándose el color que adquiera la mezcla. NORMAS DE SEGURIDAD. Hay que evitar respirar los vapores del anhídrido acético y cualquier contacto con las manos debido a su carácter muy corrosivo e irritante, teniendo el cuidado de dejar bien cerrada la botella una vez que se ha utilizado. De igual forma evitar todo contacto directo con el ácido sulfúrico concentrado. Cualquier accidente que produzca un contacto con estos reactivos deberá tratarse mediante el secado con papel de la zona afectada, seguida de un lavado con abundante agua fría. CUESTIONES. 1. Calcular el rendimiento del proceso. 2. Al lavar el precipitado con agua fría, ¿cual sería el producto de reacción que arrastra el agua?. ¿Es soluble la aspirina en agua?. 3. Si en la prueba de pureza con la disolución de FeCl3 se observase una coloración violeta, ¿de que producto se trata?. 4. Escribir el mecanismo completo de la reacción de acetilación. Indica otras reacciones de acetilación que pueden tener lugar con otro producto que no sea el anhídrido acético. 5. Desde el punto de vista químico, explicar porque la aspirina no se altera en el estómago, y sin embargo, se hidroliza rápidamente en el intestino.