PRUEBA DE QUIMICA - Colegio Colsubsidio San Vicente IED
Anuncio

TALER PREICFES QUIMICA Realizar el taller en hojas de examen, justificando su respuesta con teoría, si utiliza internet asegúrese de registrar las páginas visitadas y si su consulta es de libros registre la bibliografía de los mismos incluyendo las paginas utilizadas RESPONDA LAS PREGUNTAS 1 Y 2 DE ACUERDO CON EL SIGUIENTE TEXTO. 1. Un catión se deposita en el cátodo porque A. es de carga positiva. B. es de carga negativa. C. tiene igual carga que el cátodo. D. es una especie química no polar. 2.Si un equivalente-gramo de plata tiene una masa de 108 gramos y se quieren depositar 10,8 gramos de plata sobre un electrodo, utilizando una corriente de 100 amperios; el tiempo que tardaría el procedimiento sería A. 9,65 segundos B. 96,5 segundos. C. 965 segundos. D. 9650 segundos. 3.La lixiviación es un método de separación que consiste en hacer pasar un solvente sobre una mezcla sólida, buscando que la solubilidad de alguno de los componentes del material tratado le permita pasar a la fase líquida. Un procedimiento cotidiano que se asemeja a la lixiviación es A. la preparación de un jugo en la licuadora. B. la preparación de tinto en una cafetera. C. la disolución del azúcar, cuando preparamos limonada. D. la preparación de agua de panela. 4.El agua por su polaridad hace que ciertas sustancias de carácter iónico se disocien al disolverse en ella, quedando en solución especies químicas formadas a partir de las moléculas disueltas. Si al agua se le agrega ácido sulfúrico (H2SO4), las especies químicas presentes en el agua, provenientes de esta molécula son: TALER PREICFES QUIMICA 5.La densidad es una propiedad que hace que un cuerpo más “pesado” se hunda en otro. En realidad no es el valor absoluto del peso lo que logra este propósito, sino su masa por unidad de volumen. Por ejemplo el aceite flota en el agua, por ser esta más densa. Sin embargo el alcohol siendo menos denso que el agua y no flota en ella; esto es debido a que A. el agua al contacto con el alcohol, cambia su densidad. B. las atracciones intermoleculares, mantienen unidas las moléculas de las dos sustancias evitando que se separen. C. la fuerza de gravedad hace que el alcohol se mantenga en medio del agua. D. en realidad sí se separan, pero por ser los dos líquidos incoloros, no se distinguen las dos fases. 6.El campo de estudio de la química es la materia, cuya estructura y propiedades nos permite clasificarla en sustancias puras y mezclas. Una sustancia pura se diferencia de una mezcla, en que las sustancias puras A. tienen composición fija y las mezclas composición variable. B. tienen solamente una clase de átomos. C. incluyen únicamente los elementos de la tabla periódica. D. no se mezclan con otras y por tanto no se pueden separar. RESPONDA LAS PREGUNTAS 7 Y 8 DE ACUERDO CON LA SIGUIENTE INFORMACION Las sustancias químicas pueden reaccionar entre sí, produciendo nuevas sustancias con propiedades que generalmente son muy diferentes a las propiedades de la materia original. Una reacción química es un proceso en el cual se producen nuevas sustancias. 7.En las reacciones químicas, las partículas de los átomos que interactúan para producir nuevas sustancias son A. los electrones que hay en el núcleo. B. los protones del último nivel de energía. C. los neutrones de los orbitales enlazados. D. los electrones de valencia. 8.La energía que nos suministra el sol proviene de una reacción nuclear, donde los átomos de Hidrógeno que tienen un protón se transforman en Helio, que tiene 2 protones; esta reacción es posible debido a A. la interacción de los electrones del último nivel. B. la fusión de los núcleos del hidrógeno. C. la fisión o ruptura de los núcleos del hidrógeno. D. que en el Sol, el hidrógeno no es una sustancia pura 9.Para la elaboración de la fórmula estructural de las parafinas, un profesor en su clase de química describe que los carbonos de la cadena deben estar completamente saturados con átomos de hidrógeno; lo cual implica que para obtener la fórmula estructural del propano, el alumno debe seleccionar y aplicar la expresión TALER PREICFES QUIMICA 10.El enlace químico conformado entre los elementos del grupo IA y grupos VIA y VIIA como en el caso del cloruro de sodio o sal de cocina empleada en la alimentación humana y animal, se forma porque los elementos del grupo IA presentan A. baja electronegatividad. B. alta electronegatividad. C. alto potencial de ionización. D. baja energía de enlace. 11.El oxígeno del aire interactúa con metales como el hierro. Esto se puede observar en las superficies como una capa de color café o marrón que caracteriza las estructuras metálicas expuestas a factores como aire y humedad, cuando no han sido recubiertas con anticorrosivos. De acuerdo con lo anterior, en la oxidación del hierro se A. forma una nueva sustancia. B. licúa el hierro C. forma una mezcla D. forman sustancias gaseosas. 12.La hibridación del carbono para la formación de los alcanos nos proporciona unos enlaces tales que la molécula del metano (CH4) resulta simétrica. De acuerdo con lo anterior la hibridación del carbono en los alcanos es A. lineal B. trigonal. C. tetragonal. D. pentagonal. RESPONDA LAS PREGUNTAS 13 A 16 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN CONVERSIÓN DE UNIDADES Cuando vamos a convertir unidades de un sistema a otro, se piensa normalmente en la regla de tres, pero este procedimiento se complica cuando las unidades son combinadas o compuestas. Como alternativa tenemos el método del factor unitario, mediante el cual una cantidad con su respectiva unidad de medida se multiplica por un factor cuyo numerador y denominador sean equivalentes (de ahí su nombre). Por ejemplo si quiero convertir 120 minutos a horas, procedo así: Vemos que al cancelar unidades y efectuar operaciones se convierte en 2 horas. Si las unidades son compuestas podemos ir multiplicando consecutivamente por factores unitarios adecuados, procurando siempre -como se ve en el ejemploque las unidades que quiero convertir se vayan eliminando con una adecuada selección (numerador/denominador). Así al convertir 20 m/s a Km/h puedo ir multiplicando y eliminando así: TALER PREICFES QUIMICA 13.La densidad es una propiedad de la materia que comúnmente se expresa en g/cm3, pero en el Sistema Internacional debe expresarse en kg/m3. Si la densidad del agua es 1 g/cm 3a 4ºC; entonces en el SI su valor será 14.Una unidad de concentración muy utilizada en química es la molaridad (moles/litro) que expresa la relación entre un soluto y la solución que lo contiene. Sabiendo que el peso molecular del NaOH es 40 gramos/mol; si quisiera expresar la concentración de una solución 0,4 molar de NaOH en gramos por cm3, procedería así 15.Para hallar las partículas existentes en cierta cantidad de materia puedo valerme del número de Avogadro (6 x 1023), el cual me indica el número de moléculas que hay en un mol de sustancia. Utilizando el método de los factores unitarios y sabiendo que un mol de agua tiene una masa de 18 gramos y que la densidad del agua es 1 gramo/ml, se puede afirmar que en 90 mililitros de agua habrá 16.Aunque la comunidad científica mundial se acogió al Sistema Internacional, el Sistema Inglés de unidades aún se sigue utilizando en muchos países. Algunas equivalencias del Sistema Inglés son: 1 pie = 12 pulgadas; 1 pulgada = 2,54 cm. Utilizando los factores unitarios y las equivalencias dadas, puedo determinar que si tengo 12 metros cúbicos de un líquido, el equivalente en pies cúbicos será RESPONDA LAS PREGUNTAS 17 A 20 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN 17.Los isómeros son compuestos que tienen igual fórmula molecular pero su estructura es diferente, es decir, TALER PREICFES QUIMICA AUNQUE LA MOLÉCULA TENGA LA MISMA CLASE Y CANTIDAD DE ÁTOMOS, ESTOS ESTÁN ORGANIZADOS DE FORMA DIFERENTE. La distribución de los átomos en la molécula implica que tengamos diferentes clases de isomería, por ejemplo, si la cadena principal se conserva y cambia la posición de los sustituyentes, se da la isomería de posición y si la distribución es tal que cambia el grupo funcional, tenemos la isomería funcional. Hay otros tipos de isomería tales como la geométrica (CIS-TRANS) y la óptica o estéreo-isomería Si dos compuestos son isómeros, pueden diferir en las siguientes propiedades, EXCEPTO, A. la polaridad. B. el peso molecular. C. la densidad. D. el punto de ebullición. 18.El alcohol butílico tiene fórmula molecular C4H10O. De las siguientes estructuras isoméricas (donde se omiten algunos hidrógenos), la que representa un isómero funcional del 1-butanol es 19.El pentano es un hidrocarburo cuya fórmula molecular es C5H12. El número de alcanos diferentes que se pueden representar con la misma fórmula molecular es A. 2 B. 3 C. 4 D. 5 20.El 2,2-dimetilbutano, es un hidrocarburo que tiene varios isómeros; ¿Cuál de las siguientes estructuras corresponde a un isómero del compuesto mencionado? 21.En una capsula de porcelana se calienta una mezcla de arena y yodo, para separar estas sustancias. Durante el proceso se producen vapores violáceos Esto ocurre por que A. La arena pasa del estado solido al estado liquido, es decir ocurre una fusión B. El yodo pasa por el estado solido al estado gaseoso directamente, es decir ocurre una sublimación C. La arena pasa del estado solido al estado gaseoso directamente, es decir ocurre una sublimación D. El yodo pasa del estado solido ala estado liquido, es decir ocurre una fusión TALER PREICFES QUIMICA La siguiente tabla de datos muestra la relación entre la temperatura y el volumen de un gas a presión constante 22.Teniendo en cuenta la información anterior podemos deducir que: A. El volumen de la masa fija de un gas, es directamente proporcional a la temperatura. B. El volumen de la masa fija de un gas, es inversamente proporcional a la temperatura . C. La cantidad de masa variable del gas es directamente proporcional a la temperatura. D. La cantidad de masa variable del gas es inversamente proporcional a la temperatura. Se tiene un frasco pequeño lleno hasta la mitad de agua con un tapón perforado y un tubo afilado se coloca sobre papel periódico mojado, se calienta el aire del frasco grande, durante unos 4 minutos y con este se tapa el frasco pequeño. 23. Teniendo en cuenta esta información podemos afirmar que A. Se genera un vacío y como el aire es incomprensible pero los líquidos no, el agua asciende B. Se genera un vacío y como el aire es comprensible pero los líquidos no, el agua asciende. C. Se genera un vacío y como el aire es incomprensible al igual que los líquidos, el agua desciende D. Se genera un vacío y como el aire es comprensible pero los líquidos no, el agua desciende 24. La solubilidad de una sustancia en diferentes solventes varia ampliamente. En general, las sustancias que tienen estructuras y fuerzas intermoleculares diferentes son solubles o insoluble, la tabla muestra las solubilidades de algunas sustancias SUSTANCIAS H20, POLAR C6H12, NO POLAR KNO3, iónico Soluble Insoluble NaCI, iónico Soluble Insoluble HBr, polar Soluble Insoluble C12H22O11, polar Soluble Insoluble Br, no polar Insoluble Soluble I2, no polar insoluble soluble Teniendo en cuenta la información anterior podemos deducir que: TALER PREICFES QUIMICA A. El agua es una molécula no polar y por lo tanto puede disolver solutos iónicos y polares. Las sustancias no polares se disuelven en solventes polares, pero tienden a disolverse en solventes polares B. El agua es una molécula altamente polar y por lo tanto puede disolver solutos iónicos y polares. Las sustancias no polares no se disuelven en solventes polares pero tienden a disolverse en solventes no polares C. El agua es una molécula altamente polar y por lo tanto puede disolver solutos iónicos y no polares. Las sustancias polares no se disuelven en solventes polares, pero tienden a disolverse en solventes no polares D. El agua es una molécula altamente polar y por lo tanto puede disolver solutos iónicos y polares. Las sustancias no polares no se disuelven en solventes no polares, pero tienden a disolverse en solventes polares




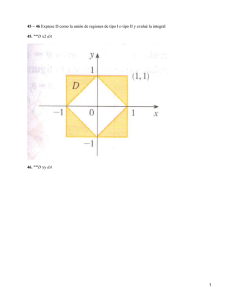



![Transforma la integral / (x2 " y2) dx ] dy a coordenadas polares y](http://s2.studylib.es/store/data/005336881_1-38107913b0406391f278007c215c7e11-300x300.png)