determinacion de la actividad de la acetilcolinesterasa en sangre
Anuncio

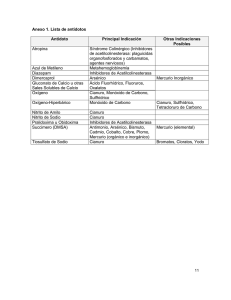
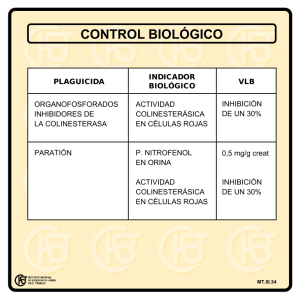
DETERMINACION DE LA ACTIVIDAD DE LA ACETILCOLINESTERASA EN SANGRE – METODO DE LIMPEROS Y RANTA MODIFICADO POR EDSON1 TECNICA ESTANDAR 1. Introducción Los agricultores, aplicadores y trabajadores en investigación usan insecticidas organofosforados, estos individuos pueden correr algún riesgo de absorción significativa de este tipo de tóxicos a pesar de la adopción de medidas protectoras. La sobre absorción y métodos de trabajo inseguros, son detectables por la disminución de la actividad normal de la enzima colinesterasa en sangre. Existen varios métodos para la medición exacta en el laboratorio de la actividad de la colinesterasa, pero un método rápido de “campo” es frecuentemente necesario para uso en emergencias o lejos del laboratorio. El método de Limperos y Ranta2 ha sido modificado por Edson1 para dar una combinación de rapidez, conveniencia y precisión razonable para emergencias o determinación de la actividad de la colinesterasa de rutina con un equipo sencillo3. Los plaguicidas organofosforados y carbamatos son compuestos altamente tóxicos con una acción fisiológica de inhibición de la actividad de la colinesterasa en humanos así como en insectos. Entre los principales síntomas que aparecen como resultado de sobre-exposición a estas sustancias son náuseas, vómito, diarrea y dolor de cabeza2. El método más práctico para detectar la verdadera causa de los síntomas es la determinación de los niveles de colinesterasa de la sangre, la cual refleja la actividad de la enzima en todas las partes del cuerpo y sirve como indicador de sobre-exposición2. La acetilcolinesterasa es una enzima, una forma de catalizador biológico, que actúa en los tejidos corporales manteniendo los músculos, glándulas y células nerviosas funcionando de manera organizada. Si el porcentaje de actividad de la acetilcolinesterasa en los tejidos se reduce rápidamente a niveles bajos se producen leves y grandes contracciones de las fibras musculares del cuerpo y excesiva secreción de lágrimas y saliva, con debilitamiento de la respiración y disminución de la frecuencia cardiaca. El equipo de medida Lovibond® utiliza dos técnicas básicas para medir en campo la colinesterasa en sangre en los humanos. • • Técnica estándar Técnica simplificada La técnica estándar es el método preferido, pero si se dispone de poco tiempo y han de realizarse muchas pruebas puede usarse la técnica simplificada siempre y cuando se cumplan exactamente las instrucciones de la prueba y de que la temperatura a la sombra no sea inferior a 10°C ni superior a 45°C. Además, si es probable que la temperatura a la sombra varíe en más de 2°C durante el período de la prueba debe usarse la técnica estándar. Algunos autores han establecido que es posible prescindir de una muestra “control” en tiempo y sustituir la relación tiempo/temperatura siempre y cuando el rango de temperatura involucrado no sea excesivo y las instrucciones con sus modificaciones sean seguidas exactamente3. 2. Principio del método Es un método colorimétrico visual en el cual ocurre un cambio de pH (∆pH). La sangre contiene una enzima, colinesterasa, la cual por hidrólisis libera ácido acético a partir de la acetilcolina produciendo cambio de pH. La actividad de la colinesterasa de las muestras de sangre total determinan el porcentaje de cambio de color en un sistema que comprende la solución indicadora (azul de 1 bromotimol soluble, verde-azul a pH 7.2 continuamente cambiante a naranja-café a pH 6.2), la enzima (muestra de sangre) y el sustrato (perclorato de acetilcolina), se deja actuar por un tiempo fijo. El cambio de pH durante este período de tiempo se mide comparando el color de la mezcla con un conjunto de patrones de vidrio coloreado contenidos en un disco. El cambio de nivel de pH en este tiempo es una medida de la actividad de la colinesterasa1,2,3. 3. Disco comparador estándar Lovibond® 5/30 El disco 5/30 del comparador del equipo Lovibond®, cubre un rango de 0% a 100% de actividad normal en divisiones estándares a intervalos sucesivos de 12,5% de actividad de colinesterasa, este comparador visual está calibrado para usarse con celdas ópticas Ref. W727 de 2,5 mm. El color a cero es verde y se hace progresivamente más amarillo al aumentar la escala hasta llegar al amarillo de 100% de actividad1,3. 4. Reactivos 4.1. Solución indicadora – Azul de bromotimol soluble en agua Disolver 0,112 g de sal sódica de azul de bromotimol soluble en agua en 250 mL de agua destilada desionizada libre de CO2 (hervida), quedando una concentración final de 0,0448%. La concentración es crítica, siendo el límite permisible ± 0.01 g (ver Nota 1). El agua destilada desionizada debe ser hervida para la eliminación del CO2 y dejarla enfriar para preparar la solución. Esta solución se prepara vaciando el contenido de un vial de azul de bromotimol (0,112 g) en un balón volumétrico aforado (suministrado por el equipo) y añadir agua destilada hervida fría hasta la mitad, tapar y mezclar suavemente, dejar en reposo por 1 hora aproximadamente, transcurrido este tiempo completar el volumen con agua destilada desionizada hervida hasta la marca de 250 mL, mezclar la solución por inversión 30 veces aproximadamente. Alicuotar en el frasco gotero destinado para el azul de bromotimol de uso diario. Ver figura 1. Esta solución es estable durante varios meses en condiciones adecuadas de almacenamiento (puede ser guardada en nevera bien tapada para prevenir la absorción de CO2). 4.2. Solución sustrato – Perclorato de acetilcolina Disolver 0,25 g de perclorato de acetilcolina en 50 mL de agua destilada desionizada libre de CO2 (hervida), medida con la probeta graduada, obteniendo una concentración final de 0,5%. La concentración no es crítica. Ver figura 1. Esta solución sustrato debe ser fresca por lo cual debe preparase cada día al momento de su uso. Si se presenta alguna turbidez puede ser ignorada. 5. Toma de muestra de sangre Emplear sangre superficial (punción en el dedo) o sangre venosa heparinizada, previa desinfección del área de punción. En caso de sangre superficial en lo posible cada paciente o trabajador debe lavarse las manos con abundante agua y jabón. Limpiar el área de punción (yema del dedo) con un algodón o gasa impregnada de alcohol y luego con un algodón seco. 2 Presionar y pinchar con una lanceta de sangrado nueva de tipo desechable en la yema del dedo tratando de obtener una buena gota. Para la toma de muestra de sangre con la pipeta de 10 µL, esta se debe mantener siempre en posición vertical, apriete el pulsador de la pipeta hasta el primer tope. Poner en contacto el extremo de la punta de la pipeta con la gota de sangre, deje que el pulsador vuelva hacia atrás lentamente, hasta tomar el volumen necesario para la prueba (10 µL). Limpiar la puntas de la pipeta con una toalla absorbente por los lados, teniendo cuidado de no pasarla por el extremo inferior, manteniendo siempre la pipeta en posición vertical. Para descargar la muestra de sangre, introduzca la punta de la pipeta por debajo de la superficie de la solución indicadora contenida en el tubo de reacción, apriete el pulsador hasta el segundo tope para vaciar completamente la punta, enjuagándola tres veces, evitando hacer burbujas, lo cual introduciría CO2 al tubo de reacción. 6. Técnica – Determinación de Colinesterasa en sangre de seres humanos 6.1. Prueba de reactivos: Mezclar 0,5 mL de solución indicadora, más 0,01 mL (10 µL) de sangre total (heparinizada punción venosa o por punción en el dedo) de un individuo normalmente sano “control” (no expuesto a plaguicidas organofosforados ni carbamatos) y 0,5 mL de solución sustrato. Mezclar bien el contenido del tubo y transferir la mezcla a una celda de 2,5 mm la cual se pone en el compartimiento derecho del comparador, (el compartimiento izquierdo debe estar vacío). Sostener el comparador contra una fuente de luz blanca uniforme, girar el disco hasta que coincida el color del disco con el color obtenido en la solución. El resultado no puede ser superior al color de 12,5% de actividad. Si la lectura da mayor de 12,5%, puede ser debido a que la solución indicadora es muy ácida, debido a la absorción de CO2, esta puede ser restaurada a la normalidad hirviéndola momentáneamente. Si este procedimiento no reduce la acidez de la solución a color de 12,5% de actividad, entonces la solución sustrato está fallando y esta debería ser descartada y preparar una solución fresca. La lectura debe dar entre 0% ó 12.5% (para poder realizar la prueba). Cuando se confirme que la prueba de reactivos está bien, se procede a realizar los análisis de la actividad de la acetilcolinesterasa. Descarte el contenido de la celda y registre el resultado (figura 2). 6.2. Hacer un “blanco” de sangre: Preparar este "blanco" de sangre, añadiendo 0,01 mL (10 μL) de sangre total heparinizada o superficial (punción en el dedo), de un individuo normalmente sano (no expuesto a plaguicidas organofosforados y/o carbamatos) a 1 mL de agua destilada desionizada (hervida). Transferir esta mezcla a una celda de 2,5 mm y colocarla en el compartimiento izquierdo del comparador. Este blanco debe permanecer hasta finalizar las lecturas de las pruebas de acetilcolinesterasa (figura 2). 6.3. Preparar un tubo de reacción: para el “control” y para cada paciente o trabajador, adicionando 0,5 mL de la solución indicadora en cada uno de los tubos. Se pueden realizar 15 a 20 pruebas al mismo tiempo. Tomar una muestra de sangre del individuo “control”, pipetear 0,01 mL (10 µL) de sangre, obtenida por punción en el dedo o sangre venosa heparinizada, dentro del tubo de reacción (tubo No. 1 o tubo “control”), enjuagando la punta de la micropipeta automática dos o tres veces con la solución indicadora del tubo, evitando hacer burbujas, agitar suavemente y tapar la mezcla. Seguidamente repita el procedimiento con cada paciente o trabajador, según orden establecido. 3 Adicionar 0,5 mL de solución sustrato en el tubo No. 1 (“control”), poner el cronómetro en marcha registrar el tiempo (“tiempo cero”), inmediatamente transferir la mezcla de reacción a una celda de 2,5 mm y registre el color obtenido en el comparador. El resultado no puede ser superior al color de 12,5% de actividad. Deje la celda con la muestra “control” en el comparador. Repetir el procedimiento con los tubos de cada paciente o trabajador a intervalos de 1 minuto a partir del tiempo cero, tapar y agitar suavemente cada tubo de reacción. 6.4. Lectura y registro de % de actividad de AChE: Comprobar periódicamente el color de la muestra “control” en el comparador y esperar a que el contenido de la celda de la muestra “control” reaccione hasta alcanzar un 100% de color de actividad (tarda 20-30 minutos, dependiendo principalmente de la temperatura). Tan pronto como se alcanza el color del 100%, descartar la muestra “control” y a intervalos de 1 minuto, agitar suavemente el tubo de reacción de cada trabajador y transferir el contenido de cada tubo por turno a una celda de 2,5 mm, colocándola en el compartimiento derecho del comparador, realizar la lectura girando el disco hasta hallar la coincidencia de color. Registrar el resultado en porcentaje (%) de actividad. El procedimiento de lectura se realiza con cada tubo de reacción a intervalos de 1 minuto, teniendo en cuenta la adición de la solución sustrato. El disco está graduado en porcentaje de actividad normal. 7. Interpretación de resultados2 • • Valores normales: De 75,0% a 100% de actividad de AChE Valores anormales: Menores de 75,0% de actividad de AChE - Probable sobre-exposición: 50,0% - 62,5% de actividad de AChE - Sobre-Exposición seria: 25,0% - 37,5% de actividad de AChE - Sobre-Exposición muy seria y peligrosa: 0,0% - 12,5% de actividad de AChE 7.1. Valores de actividad de la acetilcolinesterasa La actividad de la acetilcolinesterasa en sangre de un individuo bajo prueba, es expresada como un porcentaje de la actividad en sangre normal. Dependiendo del resultado obtenido, las siguientes acciones son recomendadas. • • • • 100 a 75 % de actividad: Valores de sangre de una persona normal. Ninguna acción, pero realizar otra prueba en tiempo futuro cercano. Menores de 75% a 50% de actividad: Sobre-exposición probable. Repetir la prueba: Si confirma el resultado, suspender al trabajador por dos (2) semanas para que no siga trabajando con plaguicidas organofosforados y/o carbamatos; entonces repetir la prueba de AChE para evaluar recuperación. Menores de 50% a 25% de actividad: Sobre-exposición seria. Repetir la prueba: Si confirma el resultado, suspender completamente al trabajador para que no siga trabajando con plaguicidas organofosforados y/o carbamatos. Si continúa indispuesto o enfermo, remitir a examen médico. Menores de 25% a 0% de actividad: Sobre exposición muy seria y peligrosa: Repetir la prueba: Si confirma el resultado, suspender completamente del trabajo y debe estar pendiente del examen médico. Registre la acción recomendada hecha a cada trabajador o persona sujeta a prueba. 7.2. Conducta a seguir según resultados de porcentaje de actividad de acetilcolinesterasa En caso de que el resultado de la actividad de la acetilcolinesterasa sea “anormal” (menor de 75% de actividad), se debe repetir la prueba por duplicado. 4 7.2.1. Resultados individuales • • • • 100 a 75% de actividad: Ninguna acción, pero repetir la prueba como seguimiento en tiempo futuro cercano. 62,5% de actividad: Averiguar con la persona, qué hace y cómo hace su trabajo. Repetir la prueba, si el porcentaje de la AChE sigue bajo se debe sugerir alejar al trabajador del factor de riesgo (exposición a plaguicidas organofosforados y/o carbamatos) por dos (2) semanas para que no siga trabajando con estos plaguicidas, hacer seguimiento y evaluar recuperación de los niveles de actividad de la acetilcolinesterasa repitiendo la prueba. 50% de actividad: Repetir la prueba, si el porcentaje de la AChE sigue bajo se debe suspender al trabajador del factor de riesgo (exposición a plaguicidas organofosforados y/o carbamatos) y remitir al médico si el paciente presenta sintomatología. Si está asintomático sugerir la rotación de trabajo y evitar el contacto con los plaguicidas organofosforados y/o carbamatos, la prueba debe repetirse cada semana hasta que el trabajador alcance niveles de actividad de acetilcolinesterasa normales. Igual o menor de 37,5% de actividad: Repetir la prueba, si el porcentaje de la AChE sigue bajo se debe suspender definitivamente al trabajador del factor de riesgo (exposición a plaguicidas organofosforados y/o carbamatos) y remitir al médico para valoración neurológica y atender las recomendaciones que éste establezca. 7.2.2. Resultados colectivos Si el 50% o más de los trabajadores presentan resultados “anormales” se programará y efectuará una visita de salud ocupacional e higiene y seguridad que permita calificar a toda la empresa y detectar los factores de riesgo a los que los trabajadores están expuestos y generando resultados de actividad de acetilcolinesterasa menores de 75% de actividad. Toda visita de salud ocupacional deberá producir un informe escrito con recomendaciones y sugerencias con respecto a las medidas de seguridad que deben ser tomadas en cuenta con los trabajadores. Se debe realizar seguimiento a los trabajadores hasta que presente porcentajes de actividad igual o mayores a 75%. Se debe ofrecer capacitación tanto a la empresa como al trabajador en particular por parte de la ETS 8. Notas 1. La concentración de la solución indicadora de azul de bromotimol es crítica, siendo el límite permisible de 102-122 mg / 250mL de agua destilada desionizada (libre de CO2). Si se sale de este límite los colores llegan a ser irreales y la prueba no es confiable. Cuando se están realizando estudios críticos, se recomienda que el pesaje del reactivo sea muy preciso. El pesaje cuidadoso es obviamente necesario cuando el indicador ha sido obtenido en grandes cantidades. 2. Siempre lave las celdas, tubos de ensayo y tapones de caucho con extrán neutro (detergente neutro biodegradable) al 2% y enjuáguelos con agua destilada para evitar que el material quede contaminado con ácido o álcali. No utilizar detergente alcalino que corroe la superficie del vidrio y es potente inhibidor de enzimas. 3. Las celdas, los tubos de reacción y tapones deben ser cuidadosamente lavados con agua destilada entre pruebas, ya que la prueba depende del cambio de pH, y no debe haber contaminación de ácido o álcali. 4. La solución de indicador no debe contener dióxido de carbono CO2,, por lo tanto el agua destilada debe hervirse primero para extraer el CO2, y debe dejarse enfriar antes de usarla. 5 5. No se deben hacer pipeteos con la boca para evitar producir acidez y falsos resultados debido a contaminación con CO2 de la respiración. Así mismo se ha de tener cuidado de no respirar sobre la solución indicador, recuerde poner el tapón a los frascos y tubos inmediatamente después de usarlos. 6. Si la solución de indicador (azul de bromotimol) es demasiado ácida (dando por resultado un color amarillo en la prueba) puede corregirse sometiéndola momentáneamente a ebullición en un vaso de precipitado en una plancha eléctrica o un mechero. Usar una varilla de vidrio para agitar periódicamente la solución. Tapar la solución y dejarla enfriar y envasar nuevamente en un frasco con cierre hermético. Realizar nuevamente la prueba de reactivos, si el resultado es superior a 12,5%, el sustrato es defectuoso y debe descartarse. Se debe preparar una nueva solución de sustrato y repetir la prueba de reactivos. 7. La contaminación por ácido, álcali o insecticida puede ser evitada por la limpieza cuidadosa de la piel antes de tomar la muestra de sangre, primero con jabón y agua, con gasa quirúrgica y secar el área con un algodón limpio. 8. La muestra de sangre “control” para la prueba de reactivos puede ser obtenida de una persona normalmente sana, quien no haya estado expuesta a plaguicidas organofosforados y/o carbamatos en los últimos tres (3) meses. Alternativamente, una muestra de sangre normal puede ser usada, pero únicamente la heparina es la adecuada para usarla como anticoagulante. Los citratos u oxalatos pueden interferir en cambios de pH por lo que no deben usarse como anticoagulantes. 9. Al enjuagar la punta de la pipeta en la solución de indicador/sangre, evitar producir burbujas, estas pueden introducir CO2. 10. La dilución de indicador + sangre es estable únicamente durante cuatro (4) horas en climas fríos y por dos (2) horas en climas cálidos. De esta manera se pueden tomar muestras de sangre 0,01 mL (10 µL) individuales de trabajadores aislados y mantener las muestras en tubos de reacción que contengan 0,5 ml de solución indicadora (azul de bromotimol) debidamente tapados, para posteriormente realizar los análisis de acetilcolinesterasa en serie, siempre y cuando se haga dentro de los tiempos indicados anteriormente. 11. Un cambio inmediato de color verde-azuloso a amarillo naranja, indica una contaminación por ácido. Repita la prueba después de lavar los tubos con suficiente agua destilada. 12. Si no se observa ningún cambio de color en el tubo de reacción en el tiempo indicado para el análisis de acetilcolinesterasa, puede ser debido a la completa ausencia de acetilcolinesterasa en la muestra de sangre debido a una sobre-exposición del trabajador a plaguicidas organofosforados y/o carbamatos, pero también puede ser por haber olvidado añadir la sangre o el sustrato al tubo de reacción, o a una contaminación alcalina. En cualquiera de los casos es necesario repetir el análisis, para su confirmación. 13. El 100% de los valore normales de acetilcolinesterasa del disco están basados en valores promedio para los hombres sanos en Europea. Los no-europeos de países tropicales pueden mostrar valores normales más bajos, en el rango de 75 a 87,5%. Las mujeres normalmente tienen ligeramente más baja la actividad de la acetilcolinesterasa que los hombres. 14. Puesto que existe una considerable variación personal de la actividad normal de acetilcolinesterasa en la sangre, es recomendable siempre que sea posible, determinar la 6 actividad normal de acetilcolinesterasa en los trabajadores, antes de tener su primer contacto con insecticidas organofosforados y/o carbamatos. 15. La acetilcolinesterasa interviene en el metabolismo del relajante muscular succinilcolina. La deficiencia de la enzima da lugar a la acción prolongada de este relajante que es de acción normalmente corta, lo que lleva a una apnea prolongada. Además de bajos niveles de las enzimas que a veces se producen después de una enfermedad hepática y la exposición a insecticidas organofosforados, se ha comprobado que existe un pequeño número de personas que tienen una deficiencia genéticamente determinada. El hallazgo de una apnea prolongada después de la administración de succinilcolina, debido a la deficiencia de la acetilcolinesterasa, es una clara indicación que se debe examinar a los restantes miembros de la familia del paciente para verificar la presencia de un defecto similar. 16. Se ha encontrado buena correlación con los resultados obtenidos por el método electrométrico de Michel4. 17. No se encontraron diferencias estadísticamente significativas entre la actividad de colinesterasa en sangre total, plasma y glóbulos rojos de varios grupos de personas estudiadas, entre hombres y mujeres ni por edad, resultados obtenidos el método de Limperos y Ranta y por el método electrométrico de Michel2. 18. En el estudio realizado por Lefkowitz LJ, et al., encontraron excelente correlación entre los valores de acetilcolinesterasa en glóbulos rojos determinados por el método de Michel, con los resultados de estudios anteriores (valores de 30 años: 1975-2005), en población normal realizados por los métodos de delta pH (Limperos y Ranta) 5. 9. Información sobre seguridad personal • • • • • • SIEMPRE use guantes de cirugía al realizar las pruebas. SIEMPRE utilice las torundas, lancetas y puntas de pipeta de forma que no ofrezcan peligro para su manejo. SIEMPRE hacer disposición final de los objetos cortopunzantes de forma segura. NUNCA vuelva a usar lancetas de sangrado ni torundas, todo debe ser desechable. NUNCA permita que los artículos de tipo desechable se dejen donde exista posibilidad de contacto o manipulación, por otras personas. NUNCA permita que la sangre de algún individuo entre en contacto con la piel no protegida. 10. Bibliografía 1. Edson EF, Fenwick ML. Measurement of cholinesterase Activity of whole blood. Brit Med J 1955;1:1218 2. Limperos G, Ranta KE. A rapid screening test for the determination of the approximate cholinesterase activity of human blood. Science 1953;117:453-455 3. The Tintometer Ltd. Lovibond®. The rapid field determination of cholinesterase. Cholinesterase 2005;3:1-4. 4. Michel HO, An electrometric method for the determination of red blood cell and plasma cholinesterase activity. J Lab Clin Med 1949;34:1564-8 5. Lefkowitz LJ, Kupina JM, Hirth NL, Henry RM, Noland GY, Barbee JY, et al. Intraindividual stability of human erythrocyte cholinesterase activity . Clinical Chemistry 2007;53:1358-1363. 7 EQUIPOS Y REACTIVOS EMPLEADOS EN LA DETERMINACION DE ACETILCOLINESTERASA EN SANGRE METODO DE LIMPEROS Y RANTA MODIFICADO POR EDSON1 Equipo de campo Lovibond® AF267 (412670) REACTIVOS 1. Azul de Bromotimol soluble en Agua Referencia: 460440 Lovibond R-132 Presentación: 1 vial por 0.112 g, pH: 6.0 – 7.6 (amarillo – azul) Esta presentación alcanza para preparar 250 mL de solución y para la determinación de 500 pruebas de AChE. 2. Acetylcholine Perchlorate Marca SIGMA Referencia: 460050, A2394-25 g, CAS [927-86-6], EC No. 213-166-6 Presentación: Frasco por 25 g Esta presentación alcanza para preparar 5000 mL de solución y para la Determinación de 10000 pruebas de AChE. ELEMENTOS DE LABORATORIO 1. Tubos con vacío para extracción de sangre (5 mL) Anticoagulante: heparina sódica 72 USP unidades Referencia: 366481 BD VACUTAINERTM Nota: En caso de no contar con los tubos, se puede emplear 15 µL de heparina sódica liquemine (líquida) de 5000 UI por 5 mL de sangre total ó 10 µL de heparina sódica liquemine (líquida) de 10000 UI por 5 mL de sangre total 2. 3. 4. 5. 6. Lancetas estériles Algodón Alcohol Termómetro Cronómetro o reloj El distribuidor exclusivo de equipos Lovibond® y de los reactivos es: Macroquímica Ltda. Calle 72A No. 20-15 Oficina 301 Tel.: 2178519 - 2126751 – 2127997 Fax: 2126554, Bogotá, D.C. macrolab@etb.net.co Para la compra de los tubos Vacutainer® con heparina se pueden cotizar en: Blamis Dotaciones Laboratorio Ltda. Calle 95 No. 28-08/12. PBX: 6111851. Teléfono: 6360593 Fax: 6360594. Bogotá, D.C. 8 LAVADO DE MATERIAL PARA LA DETERMINACION DE ACETILCOLINESTERASA EN SANGRE Inicio Desactivación y disposición de los residuos de muestras biológicas en el material usado en la determinación de AChE Restregar con churrusco Enjuagar el hipoclorito de sodio al 5% con abundante agua de la llave Lavar con extrán neutro al 2% Enjuagar con abundante agua de la llave Sumergir en agua destilada desionizada por dos (2) horas Escurrido y secado al ambiente o en un horno a 50°C Empacar el material rotulado con fecha y almacenarlo en gabinetes Fin Agradecimientos a los doctores Jaime Eduardo Ortiz Varón (q.e.p.d) y Hernán Acosta, químicos del Grupo Salud Ambiental-SRNL del Instituto Nacional de Salud, por el valioso aporte en la validación y adaptación de las metodologías para análisis de acetilcolinesterasa en sangre y residuos de plaguicidas OF y C en aguas. 9 Figura No. 1: Preparación de reactivos – Azul de bromotimol y perclorato de acetilcolina 10 Figura No. 2: Prueba de reactivos y blanco de sangre Elaboró: Omayda Cárdenas Bustamante Grupo Salud Ambiental Jaime Eduardo Ortiz Varón Subdirección Red Nacional de Laboratorios Instituto Nacional de Salud 11