PROGRAMA DE ASIGNATURA
Anuncio
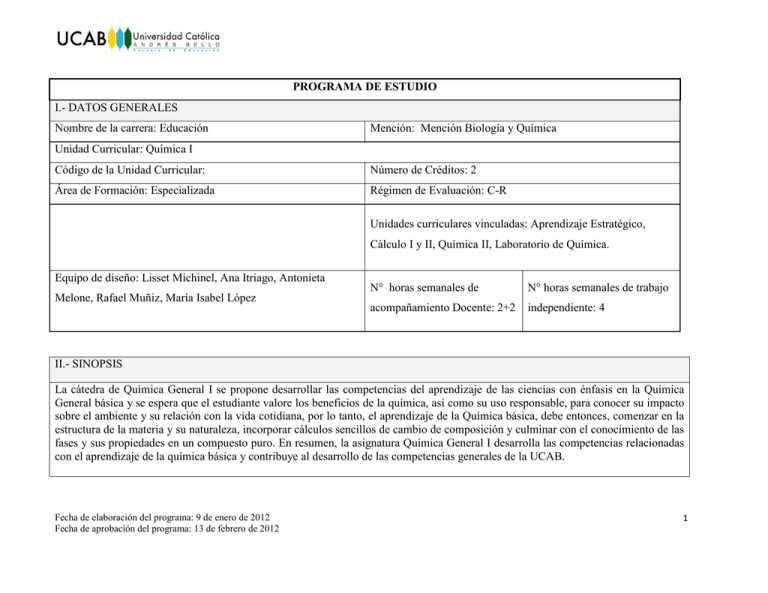
PROGRAMA DE ESTUDIO I.- DATOS GENERALES Nombre de la carrera: Educación Mención: Mención Biología y Química Unidad Curricular: Química I Código de la Unidad Curricular: Número de Créditos: 2 Área de Formación: Especializada Régimen de Evaluación: C-R Unidades curriculares vinculadas: Aprendizaje Estratégico, Cálculo I y II, Química II, Laboratorio de Química. Equipo de diseño: Lisset Michinel, Ana Itriago, Antonieta Melone, Rafael Muñiz, María Isabel López N° horas semanales de N° horas semanales de trabajo acompañamiento Docente: 2+2 independiente: 4 II.- SINOPSIS La cátedra de Química General I se propone desarrollar las competencias del aprendizaje de las ciencias con énfasis en la Química General básica y se espera que el estudiante valore los beneficios de la química, así como su uso responsable, para conocer su impacto sobre el ambiente y su relación con la vida cotidiana, por lo tanto, el aprendizaje de la Química básica, debe entonces, comenzar en la estructura de la materia y su naturaleza, incorporar cálculos sencillos de cambio de composición y culminar con el conocimiento de las fases y sus propiedades en un compuesto puro. En resumen, la asignatura Química General I desarrolla las competencias relacionadas con el aprendizaje de la química básica y contribuye al desarrollo de las competencias generales de la UCAB. Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 1 III.- JUSTIFICACION El hombre vive en un mundo de materiales sujetos a cambios de manera continua. Conocer la constitución de estos materiales y poder explicar la naturaleza de sus transformaciones, el uso de los mismos y las repercusiones sobre el medio ambiente ha sido el objetivo del estudio de la química, por lo tanto, en la enseñanza de la Química básica se debe proveer al estudiante de los principios químicos que rigen el estudio de esta ciencia, considerada por muchos, una ciencia central. Esta Unidad Curricular ofrece al estudiante dos aspectos importantes; primero, las bases fundamentales para el estudio de la Química y segundo, la aplicación de estrategia que faciliten el aprendizaje de esta ciencia. Paralelamente el estudiante se involucra con la didáctica de esta ciencia para establecer la relación entre el su conocimiento y su didáctica en el ejercicio de su rol docente. Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 2 IV.- COMPETENCIAS QUE DESARROLLA LA UNIDAD CURRICULAR Enunciado de la competencia General 1. Aprender a aprender con calidad Unidades de Competencia Criterios de desempeño Indicadores de logro 1.1.- Abstrae, analiza, y sintetiza información. 1.1.1.- Identifica elementos comunes en diferentes situaciones o contextos. 1.1.1.1 Identifica los elementos comunes entre los diferentes modelos atómicos. 1.1.2.-Descompone, identifica, clasifica y jerarquiza elementos comunes. 1.1.2.1 Identifica las relaciones entre los diferentes modelos de atómicos y como estos aportan conocimientos a la actual teoría atómica. 1.3.- Identifica, plantea y resuelve problemas. 1.3.1.- Reconoce diferencias entre una situación actual y la deseada. 1.1.2.1 Establece semejanzas y diferencias entre elementos, compuestos, sustancia, propiedades químicas y físicas de los elementos. 1.3.1.1 Identifica los elementos necesarios para la solución de un problema. 1.3.2.-Analiza el problema y obtiene la información requerida para solucionarlo. 1.3.1.2 Resuelve problemas identificando cada una de las etapas a partir de los datos dados. 1.3.2.1 Analiza el resultado teniendo en cuenta los datos, pasos y resultados. 1.7.- Realiza investigaciones. 1.7.1.- Realiza búsquedas de información, exhaustivas y sistemáticas, en fuentes impresas y digitales, Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 1.3.2.2 Analiza el resultado según la validez y factibilidad en el contexto planteado. 1.7.1.2 Busca información en las fuentes recomendadas por el profesor. 3 relacionadas con temas de investigación de su interés. 1.7.1.2 Reconoce la veracidad de la información encontrada en distintas fuentes. 1.9.- Busca y procesa información de 1.9.1.- Revisa periódicamente información 1.9.1.1 Incorpora aportes relacionados con diversas fuentes. actualizada sobre su disciplina. la nueva información publicada sobre la disciplina. Enunciado de la competencia General 3. 3.-Aprende a trabajar con el otro Unidades de Competencia Criterios de desempeño Indicadores de logro 3.1.- Participa y trabaja en equipo. 3.1.1.- Identifica roles y funciones de todos los miembros del equipo. 3.1.2.- Realiza tareas establecidas por el equipo. 3.1.1.1 Identifica los roles en los cuales puede desempeñarse en el momento de realizar trabajos en equipo. 3.1.1.2 Asume el rol asignado por el equipo. 3.1.2.1 Realiza la (s) tarea (s) asignadas por el equipo. 3.1.2.2 Reconoce el papel desempeñado por todos los miembros del equipo y como este contribuye al logro de una meta común. Enunciado de Competencia Profesional Básica 1.- Asume con autonomía su desarrollo personal Unidades de Competencia Criterios de desempeño Indicadores de logro 1.1.- Es un pensador critico. 1.1.3.- Desarrolla su pensamiento lógico. 1.1.3.1 Reconoce los preconceptos que posee sobre los diferentes temas relacionados al área de la Química. 1.1.5.- Sigue la ruta por la que la evidencia y la razón lo lleven y argumenta Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 4 a favor de lo que cree. 1.1.3.2 Compara sus preconceptos con los conceptos científicos discutidos en clase. 1.1.5.1 Argumenta sus opiniones con base a la experiencia y el conocimiento adquirido en el área de la Química. Enunciado de Competencia Específica 1.- Integra las disciplinas Biología y Química Unidades de Competencia Criterios de desempeño Indicadores de logro 1.1.- Incorpora el lenguaje científicotécnico de la biología y la química en diferentes contextos. 1.1.2 Comprende el lenguaje químico a través de su historia, símbolos, nomenclatura y formulación. 1.1.2.1 Identifica progresivamente nuevos conceptos relacionados con la Química. 1.1.3 Aplica los términos científicotécnicos propios de la ciencia al comunicar hechos, procesos y fenómenos propios de la química. 1.1.2.2 Aplica los términos científicotécnicos propios de la Química. 1.1.2.3 Representa elementos, compuestos y reacciones químicas de acuerdo con los criterios propios de la nomenclatura química. 1.1.3.1 Aplica apropiadamente los términos científico-técnicos propios de la Ciencia. 1.7.- Valora la química como la ciencia que estudia la materia, la energía y sus variaciones. 1.7.1 Identifica a la Química como una ciencia. 1.7.1.1 Identifica las características que hacen de la Química una ciencia. 1.7.4 Comprende los elementos químicos, su distribución en la naturaleza, su 1.7.3.1 Reconoce la distribución y Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 organización de los elementos químicos en la naturaleza. 5 organización (tabla periódica) y cómo está facilita la comprensión de las interacciones entre ellos. 1.7.3.2 Relaciona la organización de los elementos químicos con sus características 1.6.- Describe y comprende la teoría atómica 1.8.- Comprende la estequiometria. 1.6.1 Estudia los aportes de los diferentes científicos en el conocimiento de la teoría atómica. 1.7.3.2 Describe las características de los compuestos a partir de sus elementos constitutivos. 1.6.1.1 Reconoce los aportes científicos relacionados a la evolución del concepto átomo. 1.6.2 Comprende la materia está formada estructuralmente por átomos. 1.6.1.2 Reconoce el aporte brindado por la ciencia y la tecnología en la formulación de la teoría atómica y sucesivos modelos del átomo 1.8.1 Identifica la dinámica que se establece entre los elementos. 1.8.1.1 Reconoce la interacción de los elementos químicos como condición fundamental en la formación de compuestos. 1.8.2 Construye a partir de los elementos fórmulas químicas. 1.8.3 Representa las ecuaciones químicas. 1.8.2.1 Aplica los criterios establecidos en la formulación de compuestos químicos. 1.8.4 Reconoce que la fórmula química representa la composición elemental y no la estructural de un compuesto. 1.8.3.1 Aplica los criterios establecidos para la representación de reacciones químicas 1.8.5 Reconoce que la ecuación química es una representación del cambio de la composición de un sistema, con base en 1.8.4.1 Reconoce la diferencia entre la composición elementas y la estructural de un compuesto. Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 6 las leyes de la estequiometria. 1.8.6 Realiza cálculos estequiométricos. 1.8.5.1 Identifica que una ecuación química es la representación del cambio de composición de un sistema. 1.8.5.2 Identifica las leyes de la estequiometria en los cálculos realizados. 1.10.- Valora la química como herramienta para la vida. 1.10.3 Valora los beneficios del uso responsable de productos químicos, para evitar su impacto negativo en el ambiente. 1.10.3.1 Reconoce las ventajas de algunos productos químicos y el impacto de los mismos sobre el ambiente. 1.10.3.2 Propone diversas acciones para ejercer el uso responsable de algunos compuestos químicos. Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 7 V.- CONTENIDOS CONCEPTUALES I- La Química como ciencia Estudio de la Química. Clasificación de la materia. Propiedades de la materia. Unidades de medición. Incertidumbre de la medición. Análisis dimensional. PROCEDIMENTALES ACTITUDINALES Análisis de la Química como una ciencia que estudia la materia, sus propiedades y los cambios que experimenta. Reconocimiento de la Química como la ciencia que estudia la materia y sus cambios. Clasificación de la materia (estados de la materia, sustancias puras y mezclas elementos compuestos) Reconocimiento de las características de la materia así como sus cambios químicos. Establecimiento de las propiedades y cambios físicos y químicos de la materia. Manejo de las unidades del S.I y las unidades derivadas del S.I. Valoración de la medición como una forma de cuantificar algunas propiedades de la materia. Valoración del análisis dimensional como una herramienta para la solución de problemas. Incertidumbre en la medición (Precisión, exactitud y cifras significativas) Análisis dimensional. II- Teoría atómica de la materia Teoría atómica de Dalton y naturaleza eléctrica de la materia. Partículas subatómicas. Modelo de Thompson, Rutherford, Bohr y mecánico cuántico. Evaluación de la necesidad de conocer los modelos atómicos para interpretar la naturaleza eléctrica de la materia. Reconocimiento de la importancia del desarrollo de la teoría atómica para interpretar el comportamiento de la materia. Análisis de las partículas subatómicas (protones, neutrones y electrones) para Reconocimiento de la experimentación en interpretar la naturaleza de la materia y sus el desarrollo de la teoría atómica. Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 8 características más importantes. Análisis de los modelos de Thomson, Rutherford, Bohr y mecánico cuántico. Comparación de los modelos atómicos: aportes, evolución, fallas. Definición de orbital atómico y significado del número cuántico. III- Configuración electrónica y tabla periódica Configuración electrónica. Establecimiento de la configuración Tabla Periódica. electrónica de los elementos. Propiedades Periódicas de los elementos. Ubicación de los elementos en la Tabla Periódica de acuerdo a su configuración electrónica. Clasificación de los elementos de acuerdo a su configuración electrónica. Análisis de la variación de cada propiedad periódica a través de un Grupo y un Período. IV- Nomenclatura y formulación de compuestos inorgánicos Nomenclatura de: óxidos, ácidos, bases y Aplicación de las reglas de la I.U.P.A.C sales. para formular y nombrar compuestos. Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 Valoración de la tabla periódica como una estrategia de organización que facilita la identificación y agrupación de los elementos químicos. Valoración de la tabla periódica como una herramienta que permite predecir las propiedades de los elementos según su ubicación. Valoración de la tabla periódica como una herramienta para formular los compuestos que surgen por la unión de los diferentes tipos de elementos. Valoración de la nomenclatura como una estrategia universalmente aplicada para identificar los compuestos químicos. 9 Identificación de la correspondencia entre la nomenclatura y algunos compuestos utilizados en la vida diaria y su incidencia en el ambiente. V- Enlaces químicos Enlace iónico y covalente. Polaridad. Geometría molecular. Reconocimiento de la importancia correspondencia entre la nomenclatura y algunos compuestos utilizados en la vida diaria y su incidencia en el ambiente. Análisis de la formación del enlace iónico Reconocimiento de la importancia de los y sus propiedades. enlaces químicos en la constitución de las diferentes moléculas en los seres vivos Análisis de la formación del enlace covalente y sus propiedades. Valoración de la importancia de los enlaces químicos en la formación de Representación de los enlaces covalentes nuevos materiales y su impacto en la en la molécula. sociedad. Análisis de la polaridad de enlace. Reconocimiento de la importancia del efecto de la polaridad en la conductividad Determinación de la geometría molecular eléctrica de las sustancias. y de la polaridad de la molécula. Aplicación del orbital atómico para explicar orbitales híbridos (sp1, sp2 y sp3) y geometría molecular. VI- Reacciones químicas y estequiometría Reacciones químicas, tipos y balanceo por Determinación de la composición tanteo. centesimal de diversos compuestos. Concepto de mol, número de Avogradro. Masa molecular, composición porcentual, fórmula empírica y molecular. Determinación de la fórmula empírica y molecular a partir de la composición centesimal. Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 Reconocimiento de la importancia de la Ley de la Conservación de la Masa en las reacciones estequiométricas. Valoración del concepto de mol para realizar cálculos estequiométricos. 10 Estequiometría de reacciones químicas sencillas. Representación de una reacción química mediante una ecuación. Valoración del cálculo estequiométrico en la elaboración de diferentes compuestos utilizados por el hombre. Clasificación de las reacciones químicas simples. Valoración de la estequiometria como una herramienta que permite calcular los cambios de composición y su influencia Representación de las reacciones mediante en estudios ambientales. ecuaciones químicas. Establecimiento de relaciones en moles, unidades de masa y volumen. Resolución de problemas mediante cálculos estequiométricos (relaciones mol/mol, masa/masa, volumen/volumen, reactivo limitante y rendimiento) Identificación de los cambios en la composición de un sistema debido a una reacción química. VI- Estados de agregación de la materia Gases. Leyes de los gases ideales y ecuación de estado de los gases ideales. Estequiometría en reacciones gaseosas. Comparación los tres estados de agregación de la materia. Líquidos. Propiedades de los líquidos. Identificación de las propiedades de los Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 Valoración de la importancia del conocimiento de las diferentes propiedades de los sólidos, líquidos y gases para comprender sus características en diferentes condiciones de temperatura 11 Fuerzas intermoleculares. gases ideales. Sólidos. Propiedades y clasificación. Análisis las características de los gases y Diagrama de fase para un compuesto puro. su relación con las leyes de los gases Curvas de calentamiento. Equilibrio de ideales. fase. Resolución de problemas mediante cálculos estequiométricos sencillos para reacciones en fase gaseosa. y presión. Valoración de la importancia de la relación entre el estado de agregación de una sustancia y sus posibles aplicaciones. Reconocimiento de la capacidad para interpretar adecuadamente ecuaciones y gráficos. Identificación y análisis de las características de los líquidos con base en sus fuerzas intermoleculares. Identificación y clasificación de los tipos de sólidos. Representación gráfica sobre un diagrama presión-temperatura de las condiciones para que existan las fases y los equilibrios de fase de una sustancia pura. Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 12 VI.- ESTRATEGIAS DE ENSEÑANZA Y DE APRENDIZAJE SUGERIDAS Acompañamiento Docente a. Estrategias de codificación como las de enumerar y enunciar. b. Estrategias de elaboración verbal como: derivar Trabajo independiente del estudiante a. Estrategias de codificación como practicar y repetir b. Estrategias mnemotécnicas. c. Estrategias de elaboración verbal como: derivar significados de palabras desconocidas a partir del significados de palabras desconocidas a partir del contexto, parafrasear, identificación de ideas principales contexto, parafrasear, identificación de ideas principales y y secundarias, anticipar o predecir, activar el secundarias, anticipar o predecir, analogías, extraer conocimiento previo, analogías, extraer conclusiones, conclusiones, generar notas, hacer y responder preguntas, generar notas, hacer y responder preguntas, interpretar. interpretar. c. Estrategias de organización: tomar notas, responder d. Estrategias de organización: subrayar, repasar, responder preguntas anexas, elaboración de esquemas previo a la preguntas anexas, generar preguntas, mapas conceptuales lectura, mapas conceptuales y mentales. y mentales. d. Aplicación de las estrategias mencionadas en lecturas sobre el área de química y en presentaciones orales. e. Uso de estrategias metacognitivas en las actividades de clase como las horas de estudio independiente. f. Aplicación de las estrategias mencionadas en lecturas sobre el área de química. e. Búsqueda de información en enciclopedias, multimedios y usando motores de búsqueda. f. Utilización de grupos de socialización. Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 13 VII.- ESTRATEGIAS DE EVALUACION SUGERIDAS a. Elaboración de mapas mentales y conceptuales. b. Taller reflexivo. c. Exposiciones y trabajos escritos relacionados con las consultas realizadas en diferentes fuentes. d. Control de lectura sobre diferentes temas relacionados al área de la Química. e. Elaboración de un portafolio a partir de los exámenes, talleres, trabajos e investigaciones. f. Participación en foros virtuales o páginas cooperativas (google doc, o wikis) Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 14 VIII.-FUENTES DE CONSULTA Bibliográficas: Brown, T., LeMay, H., Bursten, B. y Burdge, J. (2009). Química. La ciencia central. Decimoprimera edición. México: Pearson Educación. Burns, R. (2003). Fundamentos de química. Cuarta edición. Pearson Educación: México. Chang, R. (2010) Química. Décima edición. McGrawHill: México. González, O.; Márquez, P.; Pérez, J. y Pérez, C. (2010) Estequiometría. CENAMEC. Ministerio del Poder Popular para la Educación. Venezuela. Hein, M., Arena, S. (2010). Química. Doceava edición. Cengage Learning Editores : México Umland, J. y Bellama, J. (2000) Química general. Tercera edición. International Thomson Editores: México. Whitten, K.; Davis, R. y Peck, M. (2008) Química General. Octava edición. McGrawHill: España. Electrónicas: Pinto, G. (2007). Cálculos de estequiometría aplicados a problemas de la realidad. Grupo de innovación educativa de didáctica de la química. Universidad Politécnica de Madrid. [Documento en línea], Disponible en: http://www.murciencia.com/UPLOAD/COMUNICACIONES/calculos_estequiometria_aplicados.pdf Fecha de elaboración del programa: 9 de enero de 2012 Fecha de aprobación del programa: 13 de febrero de 2012 15






