Potenciales termodinámicos
Anuncio

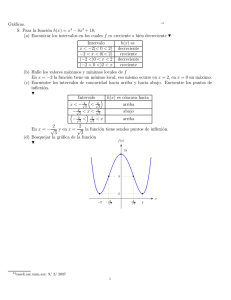
Capı́tulo 10 Potenciales termodinámicos Aunque la Ecuación Fundamental de un sistema contiene toda la información sobre el mismo, las variables extensivas entropı́a, energı́a interna, y volumen, son poco operativas cuando se llevan a cabo experiencias de laboratorio. Como los procesos naturales, y más bien los procesos de interés experimental, ocurren raramente en sistemas aislados, se han de encontrar criterios de espontaneidad y de equilibrio que puedan aplicarse cuando un sistema interaccione con su entorno, utilizando magnitudes que omitan toda referencia a cambios en el exterior del sistema termodinámico objeto de interés. Por esta razón es interesante poder obtener Ecuaciones Fundamentales, que conserven toda la información termodinámica sobre el sistema, pero expresadas en función de variables, como la temperatura o la presión, fácilmente medibles en el laboratorio. Matemáticamente, se trata de transformadas de Legendre de las Ecuaciones Fundamentales en la representación de la energı́a interna o de la entropı́a. Estas nuevas Ecuaciones Fundamentales, serán los denominados potenciales termodinámicos. A su vez, los potenciales termodinámicos son una consecuencia directa de la Ley de No Disminución de la Entropı́a [66]. Sin embargo, la aplicación del Principio de No Disminución de la Entropı́a o del Principio de No Aumento de la Energı́a Interna no es una forma habitual de introducir los potenciales termodinámicos. Este enfoque se ha elegido, precisamente, para enfatizar cómo la extensión natural del formalismo termodinámicos de sistemas aislados a otro tipo de sistemas conduce a los diversos potenciales termodinámicos. 183 184 Capı́tulo 10. Potenciales termodinámicos 10.1 Principio de Máxima Entropı́a Se ha demostrado, utilizando el Teorema de Clausius, que en un sistema aislado (donde la energı́a interna U , el volumen V y el número de moles N permanezcan constantes) la eliminación de alguna ligadura interna hace que aumente la entropı́a del sistema o bien que permanezca constante (Principio de No Disminución de la Entropı́a). Este principio de espontaneidad implica que, compatible con una cierta energı́a interna, un cierto volumen y una cierta masa, un sistema evolucionará espontáneamente cuando se elimine alguna ligadura hacia un estado de equilibrio de entropı́a máxima (Principio de Máxima Entropı́a). Supóngase que se tiene un sistema aislado formado por dos cuerpos A y B cuyos volúmenes y masas van a permanecer constantes. Se conocen sus capacidades calorı́ficas a volumen constante, CV A y CV B respectivamente. Si inicialmente se encuentran respectivamente a las temperaturas TA,i y TB,i , si la energı́a interna se conserva, se tendrá que, supuestas constantes, CV A y CV B , cualesquiera que sean las temperaturas finales, ∆U = CV A (TA − TA,i ) + CV B (TB − TB,i ) = 0 , lo que establece una relación entre TA y TB . variación de entropı́a en el proceso es igual a ∆S = CV A TA ln T A ,i Por otra parte, la + CV B (10.1) TB ln TB,i ≥ 0, (10.2) Imponiendo la condición de máximo para la entropı́a, con la condición de energı́a interna constante, se tiene ∂∆S ∂TA Pero, de (10.1) de donde U CV A CV B ∂TB = + TA TB ∂TA ∂∆S ∂TA ∂TB ∂TA = U =− U = 0. (10.3) U CV A CV B CV A CV A − = 0, TA TB (10.4) (10.5) 10.2. Principio de Mı́nima Energı́a Interna 185 por lo que en el equilibrio TA = TB . Sustituyendo este resultado en la condición de conservación de la energı́a interna (10.1), se tiene que TA = TB = CV A TA,i + CV B TB,i , CV A + CV B (10.6) que es una media aritmética ponderada de las temperaturas iniciales. 10.2 Principio de Mı́nima Energı́a Interna En un sistema en equilibrio, en el que puede haber ciertas ligaduras internas, la máxima entropı́a es compatible con la mı́nima energı́a interna. En otras palabras, dadas la energı́a interna, el volumen y el número de moles, si un sistema alcanza en el equilibrio la máxima entropı́a compatible con sus ligaduras, el sistema alcanza también para entropı́a, volumen y número de moles constante, la energı́a interna mı́nima compatible con dichas ligaduras. En la Sec. 6.4 se hizo una alusión a esa equivalencia entre los Principios de Energı́a Interna Mı́nima y de Entropı́a Máxima, que ahora se va a pormenorizar. Supóngase que en el sistema anterior, formado por los cuerpos A y B, para una cierta entropı́a (máxima) S0 , la energı́a interna U0 es tal que por algún procedimiento reversible (utilizando motores térmicos reversibles, por ejemplo) se logra extraer algo de trabajo, disminuyendo la energı́a interna del sistema hasta U0 − ∆U , con WN = −∆U . Los procesos reversibles garantizan que se conserva la entropı́a del sistema (universo). Ahora el trabajo obtenido, −∆U , se devuelve al sistema en forma de calor, con lo que la entropı́a del mismo aumentará. La energı́a interna final es la misma que la inicial pues se extrajo ∆U como trabajo, pero se devolvió como calor. Sin embargo, la entropı́a del sistema (universo) ha aumentado, contradiciendo la suposición inicial de que para esa energı́a interna, U0 , la entropı́a habı́a alcanzado un máximo 1 . Si, inicialmente, los dos cuerpos A y B se encuentran a las temperaturas TA,i y TB,i , cualesquiera que sean las temperaturas finales, TA∗ y TB∗ , se tiene que, si la entropı́a no varı́a, ∆S = CV A 1 TA∗ ln T A ,i + CV B TB∗ ln TB,i = 0, (10.7) El propio hecho de haberse podido obtener algo de trabajo del sistema indica que éste, en realidad, no se encontraba en equilibrio. 186 Capı́tulo 10. Potenciales termodinámicos lo que establece una relación entre las temperaturas TA∗ y TB∗ . Por otra parte, la variación de energı́a interna es ∆U = CV A (TA∗ − TA,i ) + CV B (TB∗ − TB,i ) ≤ 0 . (10.8) Imponiendo la condición de mı́nimo para la energı́a interna, con la restricción de que la entropı́a se mantenga constante, ∂∆U ∂TA∗ = CV A + CV B S ∂TB∗ ∂TA∗ = 0. (10.9) S Esta condición es conocida por Principio de Energı́a Interna Mı́nima. De la Ec. (10.7) TA,i CV A /CV B ∗ TB = TB,i (10.10) TA∗ y derivando ∂TB∗ ∂TA∗ de donde =− S CV A C /C TB,i TA,Vi A V B (TA∗ )−CV A /CV B −1 , CV B ∂U ∂TA∗ = CV A S T∗ 1 − B∗ TA (10.11) = 0, (10.12) Por tanto, en el equilibrio se debe cumplir que TA∗ = TB∗ . Sustituyendo en la condición (10.7) de conservación de la entropı́a, se tiene que TA∗ = TB∗ = TAC,Vi A TBC,iV B 1/CV A +CV B , (10.13) que es una media geométrica ponderada de las temperaturas iniciales. Nótese que estas temperaturas de equilibrio son diferentes de las temperaturas dadas por la Ec. (10.6). Es importante destacar que la diferencia entre la energı́a interna inicial y la energı́a interna final del sistema formado por los dos cuerpos se puede extraer en forma de trabajo (interpretación termodinámica de la entropı́a). Es decir 2 ∆U = Uf − Ui = −WN . Si los procesos son reversibles y se conserva la entropı́a, la disminución de la energı́a interna será la mayor posible y se obtendrá el máximo trabajo posible. 2 El signo menos indica que el trabajo es un trabajo positivo útil (trabajo neto) para un agente externo. 10.2. Principio de Mı́nima Energı́a Interna 187 Ası́, con los dos cuerpos A y B anteriores, el máximo trabajo neto que se puede obtener está relacionado con la temperatura final de equilibrio, TB∗ = TA∗ = T ∗ , determinada por la condición Ec. (10.13), y a partir de la Ec. (10.8), viene dado por WN = −Wmax = −∆U = − [CV A (T ∗ − TA,i ) + CV B (T ∗ − TB,i )] . (10.14) Por tanto, para un sistema a volumen constante y número de moles constante, si se encuentra en el equilibrio con una entropı́a S0 y una energı́a interna U0 , se tiene que : • Cualquier distribución de esta energı́a interna U0 , diferente de la distribución de equilibrio, entre los subsistemas hará que disminuya la entropı́a. Si la energı́a interna debe permanecer constante, pero se puede repartir entre los dos cuerpos A y B de tal manera que cada uno alcance una temperatura diferente, ∆U = CV A (TA − T ) + CV B (TB − T ) = 0 . entonces se tendrá que ∆S = CV A ln TA T + CV B ln TB T (10.15) < 0, (10.16) para cualesquiera temperaturas TA y TB 3 . • Cualquier distribución de esta entropı́a S0 entre los subsistemas, diferente de la distribución de equilibrio, hará que aumente la energı́a interna. Si la entropı́a se puede repartir entre los cuerpos A y B de tal forma que alcancen diferentes temperaturas, ∆S = CV A ln ∗ T A ∗ T B = 0, (10.17) ∆U = CV A (TA∗ − T ) + CV B (TB∗ − T ) > 0 , (10.18) T + CV B ln T se tiene independientemente de las temperaturas TA∗ y TB∗ 4 . En ambos casos se deben introducir ligaduras internas 5 (sistema complejo) para mantener la diferencia de temperaturas entre los subsistemas. Nótese que ahora TA = TB a diferencia de (10.6) De nuevo TA = TB a diferencia de (10.13) 5 De esta forma se evita hablar de la entropı́a de estados de no equilibrio, lo que no tendrı́a sentido termodinámico. 3 4 188 Capı́tulo 10. Potenciales termodinámicos Aunque estos dos Principios sean termodinámicamente equivalentes debe notarse que existe una evidente asimetrı́a entre ambos. El Principio de No Disminución de la Entropı́a es un principio de espontaneidad. Dado un sistema aislado de cualquier tipo, eliminada una ligadura interna y esperando tiempo suficiente, y sin intervención externa, el sistema alcanzará la máxima entropı́a compatible con las ligaduras que resten. El sistema alcanza entonces el equilibrio compatible con esas ligaduras. Por el contrario, el Principio de No Aumento de la Energı́a Interna es un principio de potencialidad. Dado un sistema aislado de cualquier tipo, eliminada una ligadura interna, se podrá ejecutar alguna clase de intervención externa, no espontánea, con tal de que la entropı́a del sistema permanezca constante. En concreto, se podrá extraer algo de trabajo (utilizando alguna clase de motor térmico) del sistema haciendo que disminuya su energı́a interna hasta que ésta alcance un valor mı́nimo compatible con las ligaduras (en concreto la entropı́a) que resten. En ese punto el sistema alcanza el equilibrio (que será distinto del equilibrio anterior). También se podrá realizar trabajo sobre el sistema (con ayuda de una máquina térmica) aumentando su energı́a interna. En este caso, el sistema se aparta del equilibrio. Aunque se apunta la posibilidad de que se realicen procesos no espontáneos que pueden tener lugar sin ir en contra de la Termodinámica, no hay nada en el formalismo que indique cómo se pueden llevar a cabo. Este Principio de Mı́nima Energı́a Interna permite hablar de Trabajo Máximo obtenible 6 a partir de una situación dada de no equilibrio, o de Trabajo Mı́nimo necesario para llevar a un sistema a una situación de no equilibrio. En ambos casos lo único que se exige es que se realicen procesos reversibles. 10.3 Principio de Mı́nima Entalpı́a Experimentalmente son importantes los procesos que tienen lugar en contacto con alguna fuente de trabajo. Supóngase que se tiene un sistema formado por dos cuerpos, A (a presión PA ) y B (a presión PB ), sobre los que ejerce una presión P0 una fuente de trabajo 7 (Fig. 10.1). En estas circunstancias se tiene que la condición de 6 7 Trabajo neto obtenido por un agente externo. Nótese que P0 no tiene que ser igual ni a PA ni a PB . 10.3. Principio de Mı́nima Entalpı́a 189 conservación de la energı́a interna se expresa ahora como ∆U = ∆UA + ∆UB + ∆UFT = 0 , (10.19) donde ∆UFT es la variación de energı́a interna de la fuente de trabajo. Si las temperaturas iniciales de cada sistema son TA,i y TB,i , en el equilibrio cada cuerpo puede alcanzar una temperatura TA y TB con tal de que se conserve la energı́a interna y que la entropı́a del sistema alcance un máximo. La fuente de presión interviene en el cálculo de la variaciones de la energı́a interna y las variaciones de entropı́a deben ser calculadas teniendo en cuenta la circunstancia de presión constante. δW P0 P0 TAi TBi P0 P0 δ Q1 TAf Tf (i) δ Q2 C (f) TBf Tf Figura 10.1: Sistema formado por los cuerpos A y B y una fuente de presión a presión P0 . (i) Situación inicial. Una ligadura adiabática impide el intercambio de calor entre los cuerpos. (f) Situación final (Tf ). Mientras se alcanza, una máquina térmica C está conectada entre ambos cuerpos. El trabajo puede abandonar la frontera adiabática del sistema. La variación de la energı́a interna es TA ∂UA TA,i ∂T dT + P TB ∂UB TB,i ∂T dT + ∆UFT = 0 . (10.20) P Pero la variación de la energı́a interna de la fuente de presión deberá ser calculada a través de las variaciones de los volúmenes de los sistemas A y B. Si sus volúmenes iniciales son VA,i y VB,i , ∆UFT = −P0 ∆VFT = P0 (VA − VA,i ) + P0 (VB − VB,i ) . (10.21) La variación de volumen de la fuente es simétrica de la variación de volumen de los cuerpos. Ası́, si VA < VA,i o VB < VB,i la fuente ha realizado un trabajo de expansión, por lo que su energı́a interna ha 190 Capı́tulo 10. Potenciales termodinámicos disminuı́do. Por el contrario si VA > VA,i o VB > VB,i se ha realizado un trabajo contra la fuente, por lo que su energı́a interna ha aumentado. Sustituyendo la Ec. (10.21) en la expresión (10.20), TA ∂UA TA,i TB ∂T ∂UB ∂T + TB,i dT + P0 P dT + P0 TA ∂VA ∂T TA,i TB ∂V dT P B P TB,i ∂T dT = 0 , (10.22) P de donde TA ∂UA TA,i TB + TB,i ∂T ∂UB ∂T + P0 P + P0 P ∂VA ∂T ∂VB ∂T dT P dT = 0 . (10.23) P Puesto que dUA = δQA − PA dVA y dUB = δQB − PB dVB , se tiene TA δQA TA,i TB + TB,i ∂T δQB ∂T + (P0 − PA ) P + (P0 − PB ) P ∂VA ∂T ∂VB ∂T dT P dT = 0 . (10.24) P Esta expresión establece una relación entre las temperaturas TA y TB . Por otra parte, se tiene que las variaciones de entropı́a del sistema total se pueden expresar como ∆S = ∆SA + ∆SB + ∆SFT . (10.25) Pero como la fuente no intercambia calor, ∆SFT = 0, y ∆S = TA ∂SA TA,i = CP A ∂T dT + P TA ln T A, i TB ∂SB TB,i + CP B ∂T TB ln TB,i dT P ≥ 0. (10.26) Pero debe notarse que en los intercambios de calor entre los cuerpos A y B, la condición (10.22) de conservación de la energı́a interna del sistema se cumple siempre 8 que PA = PB = P0 . Con esta 8 Esta es una condición suficiente, aunque no necesaria. El análisis del equilibrio que se puede alcanzar en condiciones de no igualdad de presiones entre cuerpos y fuente exigirı́a datos adicionales. 10.3. Principio de Mı́nima Entalpı́a 191 condición de igualdad de presiones ya se puede aplicar el Principio de Máxima Entropı́a al sistema y la expresión (10.24), puede ponerse como TA δQA dT TA,i dT + TB δQB TB,i P dT dT = 0 . (10.27) P Admitiendo que las capacidades calorı́ficas a presión constante CP A y CP B son constantes, se tiene que la condición de conservación de la energı́a interna del sistema (cuerpos más fuente) se puede expresar utilizando únicamente variables relativas a los cuerpos A y B como CP A (TA − TA,i ) + CP B (TB − TB,i ) = 0 , (10.28) que establece una relación simple entre las temperaturas TA y TB . En el equilibrio, la entropı́a ha de alcanzar un máximo. La condición de máximo de la entropı́a a energı́a interna constante se obtiene directamente de (10.26): ∂∆S ∂TA = U CP A CP B ∂TB + TA TB ∂TA = 0, (10.29) U de donde, calculando la derivada parcial a partir de la Ec. (10.28), CP A CP B CP A − = 0, TA TB CP B (10.30) y TA = TB . De nuevo se obtiene la igualdad de las temperaturas de los cuerpos A y B como condición de equilibrio. Sustituyendo la condición de equilibrio, TA = TB , en la Ec. (10.28), se tiene para las temperaturas finales TA = CP A TA,i + CP B TB,i = TB CP A + CP B (10.31) expresión análoga a (10.6). Por tanto, si la presión sobre los cuerpos A y B es en todo momento igual a la de la fuente de trabajo, PA = PB = P0 , se puede entonces definir para cada cuerpo la función de estado H ≡ U + PV , (10.32) denominada entalpı́a 9 , de tal manera que la condición de conservación de la energı́a interna total (cuerpos más fuente de presión), 9 Su etimologı́a proviene del griego νθαλπιν, calentar o sobrecalentamiento [24]. Este nombre fue inventado por Kammerlingh Onnes [266]. 192 Capı́tulo 10. Potenciales termodinámicos Ecs.(10.23) , se puede expresar como TA ∂HA dT + TB ∂HB dT = ∂T P ∂T P TB,i CP A (TA − TA,i ) + CP B (TB − TB,i ) = 0 . TA,i (10.33) Del mismo modo que en un sistema a volumen constante la variación de la energı́a interna es igual al calor intercambiado (siempre que no haya otras formas de trabajo distinto del de expansión), en un sistema a presión constante, e igual a la presión de foco, el calor intercambiado coincide con la variación de la entalpı́a del sistema (siempre que la única forma de trabajo sea el de expansión). Considerando ahora que se ha de conservar la entropı́a, ∆S = CP A TA∗ ln T A ,i + CP B TB∗ ln TB,i = 0. (10.34) La variación de H es entonces ∆H = ∆HA +∆HB = CP A (TA∗ −TA,i )+CP B (TB∗ −TB,i ) ≤ 0 . (10.35) En estas condiciones, esta desigualdad constituye el denominado Principio de Mı́nima Entalpı́a. A partir de la Ec. (10.34) se obtiene TA,i CP A /CP B ∗ (10.36) TB = TB,i TA∗ y en el equilibrio, en el mı́nimo de ∆H, ∂∆H ∂TA∗ = CP A 1 − S TB∗ TA∗ = 0, (10.37) de donde TB∗ = TA∗ . Sustituyendo en la condición de conservación de la entropı́a se obtiene 10 que TB∗ = TAC,Pi A TBC,iP B 1/CP A +CP B = TA∗ . (10.38) Para un sistema a la misma presión que la de la fuente, se puede obviar el tratar dicha fuente y estudiar sus variaciones de energı́a interna y entropı́a utilizando una nueva función de estado del sistema, la entalpı́a. Para un sistema a presión constante y número de moles constantes, si se encuentra en el equilibrio con una entropı́a S0 y una entalpı́a H0 , compatible con sus ligaduras internas, se tiene que : 10 Compárese esta expresión con la Ec. (10.13) 10.4. Principio de Mı́nima Energı́a Libre 193 • Cualquier distribución de la entalpı́a H0 entre los subsistemas diferente de la distribución de equilibrio implicará una disminución de la entropı́a. • Cualquier distribución de la entropı́a S0 entre los subsistemas diferente de la distribución de equilibrio implicará un aumento de la entalpı́a. Este Principio de Mı́nima Entalpı́a constituye un principio de equilibrio para sistemas en contacto con una fuente de presión. Al igual que en el caso del Principio de Mı́nima Energı́a Interna para sistemas a volumen constante, este no es un principio de espontaneidad, sino un principio de potencialidad, pues será preciso utilizar motores térmicos para poder obtener trabajo. Al igual que sucedı́a en los sistemas a volumen constante la diferencia entre la entalpı́a inicial y la entalpı́a final del sistema completo se puede extraer en forma de trabajo. Es decir ∆H = Hf − Hi = −WN 11 . Si los procesos son reversibles y se conserva la entropı́a, la disminución de la entalpı́a será la mayor posible y se obtendrá ası́ el máximo trabajo. Con los dos cuerpos anteriores, el máximo trabajo (trabajo neto) que se puede obtener a partir un estado inicial de no equilibrio está relacionado con la temperatura final de equilibrio, T ∗ , que viene determinada por la condición Ec. (10.34). Este trabajo 12 es ∆H = CP A (T ∗ − TA,i ) + CP B (T ∗ − TB,i ) = Wmax = −WN . (10.39) 10.4 Principio de Mı́nima Energı́a Libre Al igual que sucede con las fuentes de trabajo, experimentalmente son importantes los procesos que tienen lugar en contacto con algún foco de calor. Supóngase ahora que se dispone de un sistema formado por un cuerpo A, con capacidad calorı́fica a volumen constante CV A y cuyo volumen permanece constante, y un foco de calor a temperatura T0 . La conservación de la energı́a interna del conjunto, cuerpo más foco, se escribe ∆U = ∆UA + ∆UFC = 0 . (10.40) 11 De nuevo el signo menos se coloca para indicar que el trabajo es un trabajo positivo útil (neto) para un agente externo. 12 Wmax < 0 es el trabajo desde el punto de vista del sistema y el trabajo neto, WN = −Wmax , lo es desde el punto de vista del agente externo que realiza los procesos reversibles. 194 Capı́tulo 10. Potenciales termodinámicos Si se admite que la capacidad calorı́fica CV A es constante, se tiene que (10.41) ∆U = CV A (TA − TA,i ) − QA = 0 , donde se ha tenido en cuenta que el calor intercambiado por el foco es el intercambiado por el sistema cambiado de signo. Nótese que en la expresión anterior todas las magnitudes están referidas al cuerpo A. Aplicando el Principio de Máxima Entropı́a se tiene ∆S = ∆SA + ∆SFC = CV A TA ln T A,i QA ≥ 0. T0 − (10.42) Aquı́ intervienen tanto magnitudes del cuerpo A como la temperatura T0 del foco. La condición de máximo ∂S ∂TA U CV A 1 δQA = − TA T0 dTA = 0, (10.43) V (pues A intercambia calor a volumen constante), implica que CV A 1 − CV A = 0 , TA T0 (10.44) lo que indica que en el equilibrio la temperatura del cuerpo A debe ser la misma que la del foco. El mismo resultado se obtiene aplicando el Principo de Mı́nima Energı́a Interna, con ∆S = ∆SA + ∆SFC = CV A TA∗ ln T A ,i − QA =0 T0 (10.45) y ∆U = CV A (TA∗ − TA,i ) − QA = ∆UA − T0 ∆SA ≤ 0 . (10.46) donde ∆UA , y ∆SA se refieren al cuerpo A y T0 es la temperatura 13 del foco de calor. Hasta alcanzar el equilibrio, −∆U = Wmax , y éste es el trabajo máximo obtenible. 13 A diferencia de lo que sucede para sistemas formados por cuerpos finitos, en los que se podı́an obtener dos temperaturas diferentes (temperatura máxima mutua y temperatura mı́nima mutua), cuando interviene un foco de calor ambos principios llevan a la misma temperatura final de equilibrio para el cuerpo, la temperatura del foco. 10.4. Principio de Mı́nima Energı́a Libre 195 La función Λ = UA − T0 SA , relativa al cuerpo A y al foco T0 , se conoce como exergı́a 14 del sistema en contacto con un foco a temperatura T0 . Ası́, −∆Λ = Wmax y la disminución de la exergı́a es igual al máximo trabajo que se puede obtener del sistema A y el foco T0 . Pero si el cuerpo A se encuentra en todo momento a la misma temperatura que el foco, TA = T0 = T , la condición de mı́nimo (10.46) se puede expresar como ∆U = ∆UA − T ∆S A ≤ 0 . (10.47) Definiendo una nueva función F ≡ U − TS , (10.48) denominada energı́a libre o función de Helmholtz y, como U , T y S son funciones de estado, la magnitud F también lo es. La condición de equilibrio (10.47) se puede expresar como ∆UA − T ∆S A = (UA,f − T SA,f ) − (UA,i − T SA,i ) = FA,f − FA,i = ∆FA ≤ 0 . (10.49) La desigualdad d(U − T S) ≤ 0, es el criterio de evolución (irreversibilidad) para un sistema cuyo volumen permanece constante y en contacto con un foco a temperatura T . Se obtiene ası́ el Principio de No Aumento de la Energı́a Libre, que, en el equilibrio implica el Principio de Mı́nimo de la Energı́a Libre: Un sistema 15 cuyo volumen permanezca constante y en contacto con un foco de calor evolucionará disminuyendo su energı́a libre hasta alcanzar el mı́nimo de su función de Helmholtz, F , compatible con sus ligaduras 16 . 14 Este concepto fue introducido por Gibbs como energı́a obtenible del cuerpo y el entorno[129] [318] [191] [268]. 15 Nótese que el sistema puede ser simple o complejo, pues lo único que se exige es que su temperatura sea una magnitud bien definida e igual en todos sus subsistemas. 16 Es inmediato comprobar que a partir del Principio de Máxima Entropı́a, para un sistema en contacto con un foco a la temperatura T , y a V constante, se tiene para la variación de entropı́a del universo que ∆SU = ∆SA + ∆SFC = ∆SA − ∆UA /T ≥ 0 , Se puede definir una nueva función J = S − U/T denominada función de Massieu, tal que en el equilibrio esta función alcanza un máximo. Es 196 Capı́tulo 10. Potenciales termodinámicos En puridad, no es preciso que el sistema esté siempre en contacto con el foco a temperatura T . Basta que su temperatura inicial y final sea T y sólo intercambie calor con ese foco. Se tendrá entonces que el trabajo máximo obtenible (trabajo neto) a partir de un sistema a volumen constante en contacto con una fuente de calor 17 viene dado por la disminución de la energı́a libre del sistema. Ası́, ∆F = Wmax = −WN . (10.50) Este Principio de No Aumento de la Energı́a Libre 18 es un principio de espontaneidad, pero también de potencialidad. Un sistema en estas circunstancias puede evolucionar espontáneamente disminuyendo su energı́a libre cuando se elimine alguna ligadura interna 19 . Si ası́ lo hace, aumentará la entropı́a del universo y no se obtendrá trabajo neto. Pero este principio indica que existe la posibilidad de obtener trabajo neto si se llevan a cabo procesos reversibles. La disminución de la energı́a libre del cuerpo será la misma, pues F es función de estado, pero su disminución se habrá transformado en el trabajo máximo posible, WN = −∆F , y la entropı́a del universo no habrá variado. El conocimiento del estado inicial y del estado final del sistema no permite saber si los procesos han sido o no reversibles. Es al conocer el trabajo obtenido cuando esto se puede deducir: si no se ha obtenido trabajo, se han producido procesos irreversibles; si se ha obtenido el máximo trabajo, procesos reversibles 20 . Debe quedar pues muy claro que la disminución de la energı́a libre de un sistema a volumen constante en contacto con un foco de calor en un proceso espontáneo implica el aumento de la entropı́a del universo 21 [66]. decir, ∆SA − ∆UA /T = (SA,f − UA,f /T ) − (SA,i − UA,i /T ) = Jf − Ji = ∆JA ≥ 0 . Se puede enunciar ası́ el Principio de No Disminución de la Función de Massieu, que, en el equilibrio, lleva al Principio Máximo de la Función de Massieu. Para un sistema a volumen constante y en contacto con un foco de calor, los procesos espontáneos harán que aumente su función de Massieu hasta alcanzar un máximo compatible con las ligaduras. La equivalencia entre el Principio de Mı́nimo de F y de Máximo de J se ponen de manifiesto desde el momento en que F = −J/T . 17 Nótese que aunque el cuerpo A y el foco de calor se encuentran en equilibrio térmico, pueden no encontrarse en completo equilibrio termodinámico (Sec. 1.6 y Cap. 11). 18 No Disminución de la Función de Massieu 19 Por ejemplo, permitiendo que se mezclen gases a la misma temperatura. 20 Nótese que esta discusión recupera la interpretación termodinámica de la entropı́a. 21 A diferencia de la energı́a interna del universo, la energı́a libre del universo 10.5. Principio de Mı́nimo de la Función de Gibbs 10.5 197 Principio de Mı́nimo de la Función de Gibbs Una situación experimental muy general es aquella en la que el sistema termodinámico objeto de interés se encuentra en contacto con una fuente de trabajo y un foco de calor. Supóngase ahora que se dispone de un sistema formado por un cuerpo A en contacto con una fuente de trabajo a presión P0 y un foco de calor a la temperatura T0 . Recordando lo dicho en el caso de la entalpı́a, la conservación de la energı́a interna del sistema será ∆U = ∆UA + ∆UFC + ∆UFT = 0 . (10.51) Si la capacidad calorı́fica del cuerpo A es constante, se tiene que ∆U = CV A (TA − TA,i ) − QA + P0 (VA − VA,i ) = 0 , (10.52) donde se ha tenido en cuenta de nuevo que el calor intercambiado por el foco es el intercambiado por el cuerpo A cambiado de signo y que la variación de volumen de la fuente de trabajo es simétrica de la del cuerpo A. El Principio de Máxima entropı́a se aplica ahora: ∆S = ∆SA + ∆SFC = CP A TA ln T A ,i − QA ≥ 0. T0 (10.53) Aquı́ intervienen tanto magnitudes del cuerpo A como la temperatura T0 del foco. Nótese que ahora interviene CP A en vez de CV,A , una vez que la presión es constante Es inmediato comprobar que la condición de máximo ∂∆S ∂TA U CP A 1 ∂QA = − TA T0 ∂TA =0 (10.54) P implica CP A 1 − CP A = 0 . TA T0 (10.55) En el equilibrio la temperatura del cuerpo A debe ser la misma que la del foco. no es constante sino que disminuye en cada proceso irreversible, a semejanza de la entropı́a. 198 Capı́tulo 10. Potenciales termodinámicos Los mismos resultados se obtienen aplicando el Principo de Mı́nima Energı́a Interna, ∆S = ∆SA + ∆SFC = 0 (10.56) y, en general, ∆U = ∆UA + ∆UFT + ∆UFC = ∆UA − P0 ∆VFT + QFC = ∆UA + P0 ∆VA − T0 ∆SA ≤ 0 , (10.57) donde ∆UA , ∆VA , ∆SA se refieren al cuerpo A y P0 y T0 son la presión de la fuente de trabajo y la temperatura del foco de calor. Este es el trabajo máximo obtenible y la función ΛP = UA − T0 SA + P0 VA se conoce como exergı́a del sistema en contacto con un foco a temperatura T0 y una fuente de trabajo a presión P0 [191] [318]. Ası́, −∆ΛP = Wmax es el máximo trabajo que se puede obtener del sistema A y del foco T0 y la fuente 22 P0 . Pero si el cuerpo A se encuentra siempre a la misma temperatura que el foco, y a la misma presión que la fuente, la desigualdad Ec. (10.57) se puede poner como ∆U = ∆UA − T ∆S A + P ∆V A ≤ 0 . (10.58) Definiendo una nueva función G ≡ U − TS + PV , (10.59) denominada entalpı́a libre o función de Gibbs, se tiene que ahora la condición de evolución hacia el equilibrio se puede expresar como ∆UA − T ∆S A + P ∆V A = (UA,f − T SA,f + P VA,f ) − (UA,i − T SA,i + P VA,i ) = GA,f − GA,i = ∆G ≤ 0 , (10.60) 22 Las funciones exergı́a Λ y ΛP , son útiles cuando un cuerpo A alcanza un estado de equilibrio sin que la temperatura y/o la presión del cuerpo sean las mismas que las del foco de calor y/o de la fuente de trabajo. La disminución de la exergı́a representa la máxima cantidad de trabajo neto que puede obtenerse del sistema intercambiando calor y trabajo con foco y fuente (Principio de No Aumento de la Exergı́a) [318]. 10.5. Principio de Mı́nimo de la Función de Gibbs 199 donde todas las magnitudes se refieren al cuerpo A. Puesto que todas las magnitudes que intervienen en G son funciones de estado, también lo será G. Se obtiene ası́ el Principio de No Aumento de la Función de Gibbs, que en el equilibrio conduce al Principio de Mı́nimo de la Función de Gibbs: Un sistema 23 en contacto con una fuente de presión y en contacto con un foco de calor, a cuya temperatura se mantenga, evolucionará espontáneamente hacia el equilibrio disminuyendo su función de Gibbs 24 hasta alcanzar el mı́nimo de G compatible con sus ligaduras 25 . De acuerdo con la interpretación de la disminución de la función de Gibbs, se tendrá que el trabajo máximo (trabajo neto) obtenible a partir de un cuerpo a presión constante en contacto con una fuente de calor viene dado por la disminución de la función de Gibbs del cuerpo. Ası́, ∆G = Wmax = −WN . (10.61) La desigualdad d(U − T S + P V ) ≤ 0, es el criterio de evolución 26 (irreversibilidad) para un sistema cuya presión permanece constante e igual a la de una fuente de presión y en contacto con un foco a temperatura T . 23 De nuevo puede tratarse de un sistema simple o de un sistema complejo con todos sus subsistemas a la misma temperatura y presión. 24 Es inmediato comprobar que a partir del Principio de Máxima Entropı́a, para un cuerpo en contacto con un foco a la temperatura T y con una fuente de trabajo a presión P , para la entropı́a del universo, se tiene que ∆SU = ∆SA + ∆SFC = ∆SA − QA /T = ∆SA − 1/T ∆UA − P/T ∆VA = ∆SA − ∆HA /T ≥ 0 . Se puede definir una nueva función de estado Y = S − U/T − P V /T denominada función de Planck, tal que en el equilibrio esta función alcanza un máximo. Es decir, ∆SA − ∆UA /T − P/T ∆VA = (SA,f − UA,f /T − P VA,f /T ) − (SA,i − UA,i /T − P VA,i /T ) = Yf − Yi = ∆Y ≥ 0. Se puede enunciar ası́ el Principio de Máximo de la Función de Planck : para un cuerpo a presión constante y en contacto con un foco de calor, los procesos espontáneos harán que aumente su función de Planck hasta alcanzar un máximo compatible con las ligaduras. La equivalencia entre el Principio de Mı́nimo de G y de máximo de Y se ponen de manifiesto desde el momento en que G = −Y /T . [64]. 25 Nótese que aunque cuerpo y foco se encuentran en equilibrio térmico y cuerpo y fuente en equilibrio mecánico, pueden no encontrarse, por ejemplo, en equilibrio quı́mico (Sec. 1.6 y Cap. 11). 26 Debe quedar de nuevo muy claro que la disminución de la función de Gibbs de un sistema a presión constante y en contacto con un foco de calor en un proceso espontáneo implica el aumento de la entropı́a del universo. 200 Capı́tulo 10. Potenciales termodinámicos A semejanza del Principio de Mı́nima Energı́a Libre, este Principio de Mı́nima Función de Gibbs es un principio de espontaneidad y también de potencialidad. Un cuerpo en estas circunstancias puede evolucionar espontáneamente disminuyendo su función de Gibbs cuando se elimine alguna ligadura interna 27 . Si ası́ lo hace, aumentará la entropı́a del universo y no se obtendrá trabajo neto. Si se llevan a cabo procesos reversibles, la disminución de la función de Gibbs será la misma, pero se habrá obtenido el trabajo máximo posible, WN = −∆G, y la entropı́a del universo no habrá variado. Al igual que en el caso de la función de Helmholtz, el conocer el estado inicial y el estado final no permite saber si los procesos han sido o no reversibles. Es al conocer el trabajo obtenido cuando esto se puede saber. Diamante y grafito La variación de entropı́a que se produce al pasar de grafito a diamante a 25 ◦ C y 1, 01×105 Pa es de ∆sg→d = −3, 344 J·K−1 mol−1 (Tabla 9.1). La variación de entalpı́a en este mismo proceso es de ∆hg→d = 1, 88 kJ·mol−1 . Sus densidades son, ρd = 3, 513×106 g·m−3 para el diamante y ρg = 2, 260×106 g·m−3 , para el grafito. El peso atómico del carbono es 12. ¿En qué condiciones de presión y temperatura será posible transformar espontáneamente grafito en diamante 28 ? Si el carbón en forma de grafito pasa a diamante, su entropı́a disminuye y se debe aportar calor a un foco para que aumente su entropı́a y compense esta disminución. El calor cedido al foco a 25 ◦ C viene dado tanto por el trabajo de compresión, −P (vd − vg ), como por la disminución de la energı́a interna. A bajas presiones, la variación de entalpı́a del proceso es positiva y a la disminución de entropı́a del diamante (-3,344 J·K−1 ·mol−1 ) hay que añadirle la disminución de entropı́a del foco (∆hg→d /(273, 15 + 25) = −6, 31 J·K−1 ·mol−1 ). Como el resultado global es que la entropı́a del universo disminuirı́a en ese proceso, la Termodinámica prohibe que se produzca espontáneamente. El proceso inverso, pasar de diamante a grafito, sı́ es espontáneo en esas condiciones. Pero como ∆h = ∆u + P (vd − vg ), al ser vd < vg , aumentando la presión se puede lograr que ∆h se haga negativo, que la entropı́a del foco aumente y que se compense la disminución de la entropı́a del carbón en su paso de grafito a diamante, tal que el incremento de la 27 Por ejemplo, permitiendo que gases diferentes a la misma temperatura y presión reaccionen quı́micamente. 28 Una mezcla de grafito y diamante a la misma temperatura y presión es un sistema que no está en equilibrio quı́mico, por lo que puede obtenerse trabajo llevando el sistema al equilibrio. 10.5. Principio de Mı́nimo de la Función de Gibbs 201 entropı́a del universo se haga cero. Si se aumenta más la presión la entropı́a del universo aumenta, y ya puede producirse la transformación espontánea de grafito en diamante [66]. Pero la espontaneidad de estas transformaciones se describe mejor utilizando la función de Gibbs. A la temperatura constante de 25 ◦ C, el incremento de la función de Gibbs al pasar de grafito a diamante es de ∆gg→d = ∆hg→d − T ∆sg→d = 1, 88 − 298 · (2, 362 − 5, 706) · 10−3 = 2, 9 kJ · mol−1 . Como este incremento es positivo, significa que la transición de grafito a diamante a 25 ◦ C y 1, 01×105 Pa no será un proceso espontáneo. El inverso sı́, pues ∆gd→g = −2, 9 kJ·mol−1 . Al ir aumentando la presión, el incremento de entalpı́a del carbón en el proceso va a ir disminuyendo. A 105 Pa, el producto P0 (vd − vg ) es del orden de magnitud de 12 12 P0 (vd − vg ) = 1, 01×105 − 3, 513×106 2, 260×106 = −1, 91×10−1 J · mol−1 . Luego, la variación de energı́a interna del paso de grafito a diamante es de ∆ud→g = ∆h − P0 (vd − vg ) ≈ ∆h = 1, 88 kJ · mol−1 . P /MPa 10 5 Diamante Punto Triple 10 4 10 3 10 2 Líquido Grafito 10 Vapor 1 0 2000 4000 6000 T /K Figura 10.2: Diagrama de fases del carbono, con sus formas sólidas alotrópicas grafito y diamante. En el Punto Triple coexisten tres fases (Sec. 11.2.1), dos formas sólidas alotrópicas y la fase lı́quida. También es un punto triple el punto en que coexisten el sólido (grafito), el lı́quido y el vapor. Si se pone ahora ∆g = ∆u + P0 (vd − vg ) − T0 ∆s , donde P0 es una presión ejercida, y se impone la condición de transformación espontánea, ∆g = 0, se tiene que 12 12 3 ∆g = 1, 881×10 + P0 − 3, 513×106 2, 260×106 202 Capı́tulo 10. Potenciales termodinámicos −298 · (2, 362 − 5, 706) = 0 . A partir de esta igualdad se obtiene la presión P0 ≈ 15 193×105 Pa o P0 ≈ 1, 52×103 MPa, como presión a la que a temperatura normal se produce espontáneamente la transición grafito-diamante 29 . Compárese este resultado con la presión de equilibrio grafito-diamante a temperatura ambiente que se puede obtener a partir de la Fig. 10.2. 10.5.1 Potenciales termodinámicos en otros sistemas Los resultados anteriores se han obtenido para sistemas (P V T ), pero se generalizan sin ninguna dificultad para cualesquiera otros sistemas. Para un sistema magnético (HM T ), los Principios de Mı́nimo de la Energı́a Interna o de Mı́nimo de la Función de Helmholtz no se ven modificados, con F = U − T S. Sin embargo los potenciales termodinámicos que implican mantener constante la coordenada intensiva del trabajo de configuración, sı́ se ven modificadas. Se puede definir una entalpı́a magnética, H m , H m = U − µ0 HM , y una función de Gibbs magnética, Gm , Gm = U − µ0 HM − T S = Hm − T S . Para un cuerpo A sometido a un campo magnético constante, H, y en contacto con un foco de calor a temperatura T , la condición de equilibrio se puede expresar como ∆UA − T ∆S A − µ0 H∆M A = (UA,f − T SA,f − µ0 HMA,f ) − (UA,i − T SA,i − µ0 H MA,i ) m m ≤ 0, = Gm A,f − GA,i = ∆G donde todas las magnitudes se refieren al cuerpo A. Se obtendrı́a ası́ el Principio de No Aumento de la Función de Gibbs magnética: Un 29 Lo que la Termodinámica indica es que se puede esperar obtener diamantes de esa presión, pero no indica cómo se pueden obtener. Aunque la disminución de la entropı́a del carbón en el proceso favorece las bajas temperaturas para lograr la transformación de grafito en diamante, la experiencia indica que lo más práctico para lograr la transformación es aumentar la temperatura para hacer más plástico el grafito, a la vez que se aumenta la presión, para, posteriormente, disminuir la temperatura (un recorrido grafito-(lı́quido)-diamante en el diagrama de fases Fig. 10.2). A 1500 grados Celsius, se obtienen diamantes a presiones de entre 5-60 000×105 Pa [114]. 10.5. Principio de Mı́nimo de la Función de Gibbs 203 sistema en contacto con un campo magnético externo y en contacto con un foco de calor, a cuya temperatura se mantenga, evolucionará espontáneamente disminuyendo su función de Gibbs magnética, Gm , hasta alcanzar el mı́nimo de esa función, compatible con sus ligaduras (Principio de Mı́nimo de la Función de Gibbs magnética). Su relación con el trabajo máximo obtenible (trabajo neto) es también ∆Gm = Wmax = −WN . La generalización de estos principos a hilos elásticos, sistemas dieléctricos, etc., es inmediata. 10.5.2 Equilibrio quı́mico Como se vio en el Cap. 8 (Sec. 8.5), para sistemas quı́micamente reaccionantes se tiene que dU = T dS − P dV + µi νi dξ = T dS − P dV − Adξ , (10.62) i donde A es la afinidad quı́mica y ξ es el grado de avance de la reacción. Para una reacción quı́mica que se desarrolla en condiciones de presión y temperatura constantes, el potencial más adecuado para estudiar el equilibrio termodinámico es la función de Gibbs. La condición de equilibrio termodinámico exige que la función de Gibbs alcance un mı́nimo compatible con el foco de calor y la fuente de presión. El diferencial del potencial de Gibbs para un sistema reaccionante es dG = −SdT + V dP + µi νi dξ = −SdT + V dP − Adξ . (10.63) i Por tanto, una vez alcanzado el equilibrio a temperatura y presión constantes, la condición de mı́nimo de la función de Gibbs, exige que dG = µi νi dξ = −Adξ = 0 . (10.64) i Puesto que dξ es una variación arbitraria, para que siempre se verifique (10.64) es necesario que i µi νi = 0 , (10.65) 204 Capı́tulo 10. Potenciales termodinámicos que es la condición de equilibrio quı́mico buscada. Se explica ahora la elección del signo de A. La definición de A se hace de esta manera para que su signo indique el sentido de la reacción. Valores positivos de A indican que la reacción se producirá espontáneamente en el sentido elegido, con dξ > 0 y el potencial de Gibbs disminuyendo, dG < 0. Valores negativos de A indicarán que la reacción se produce en sentido inverso, dξ < 0, pero también con dG < 0. En ambos casos, esta disminución de la función de Gibbs del sistema se puede transformar en trabajo. En el equilibrio, A = 0 [70]. Un caso de estudio de equilibrio quı́mico particularmente sencillo es aquel en el que todas las especies quı́micas que intervienen son gases ideales. En este caso, el potencial quı́mico viene dado por la Ec. (8.32), µ = µ0 (T ) + RT ln P = µ (T ) + RT ln P , P (10.66) donde µ0 (T ) = µ es el potencial quı́mico de la sustancia a la temperatura T y bajo presión P = 1, 013×105 Pa, lo que se consideran condiciones de referencia. En el caso de una mezcla gaseosa, µi = µ i + RT ln Pi , Pi (10.67) donde µ i es el potencial quı́mico de la especie Ai a la temperatura T y bajo presión parcial Pi = 1, 013×105 Pa, y donde Pi es la presión parcial de dicha especie en la mezcla. En el equilibrio quı́mico a una determinada temperatura T , sustituyendo la Ec. (10.67) en la Ec. (10.65), se tiene que νi µ i i Pi + RT ln = 0 , Pi (10.68) y reordenando esta expresión, se tiene que i µ i νi = −RT ln i P(E)i Pi νi = ∆G , (10.69) donde el subı́ndice (E) significa que las presiones parciales se toman en el equilibrio. El primer término de esta igualdad sólo depende de la temperatura y, teniendo en cuenta los signos de los coeficientes 10.6. Resumen 205 estequiométricos, es igual a la diferencia en la función de Gibbs de los correspondientes números estequiométricos de moles de productos y de reactivos, tomada cada especie quı́mica en su estado de referencia. Esta diferencia de función de Gibbs se nota como ∆G y sólo depende de la temperatura [208] [209]. En una situación de no equilibrio, si la reacción avanza en dξ, dG varı́a como dG = µi νi dξ = ∆G + RT ln i i Pi Pi νi dξ ≤ 0 , (10.70) de acuerdo con el Principio de No Aumento de la Función de Gibbs. Si se define la constante de la reacción KP como µi νi i RT se tiene que KP = =− P(E)i Pi i ∆G = ln KP , RT νi ∆G = exp − RT (10.71) . (10.72) Esta igualdad caracteriza el equilibrio quı́mico del sistema a temperatura T . 10.6 Resumen Una forma simple de resumir los anteriores Principios es relacionarlos con la Desigualdad de Clausius. Considérese un sistema termodinámico complejo formado por los cuerpos A y B (Fig. 10.3(a)), donde el sistema sólo intercambia calor con un foco a la temperatura T y hay una fuente de trabajo caracterizado por X. En general, la temperatura del sistema (que puede no estar definida como en este caso en que A y B tienen diferentes temperaturas) es la misma que la del foco. Cuando en un sistema termodinámico se conectan dos estados de equilibrio, en cada intervalo de un proceso reversible que conecta ambos estados de equilibrio, se cumple la igualdad 30 dU − Xi dYi − δW ∗ = T dS , (10.73) i Nótese que, a diferencia de la Ec. (7.1), se consideran trabajos, δW ∗ , distintos de los trabajos de configuración. 30 206 Capı́tulo 10. Potenciales termodinámicos W* W* X0 (TA ,X0 ) A P0 (TB ,X 0 ) B (TA ,P0 ) Q A (TB ,P 0 ) B Q T0 T0 (a) (b) Figura 10.3: (a) Sistema termodinámico complejo genérico formado por los cuerpos A y B, en contacto con un foco de calor a temperatura T0 y con una fuente de trabajo de variable intensiva X0 . (b) Sistema P V T complejo, formado por los cuerpos A y B, en contacto con un foco de calor a temperatura T0 y una fuente de trabajo a presión P0 . La situación (b) es un caso particular de (a). Tanto en (a) como en (b) hay una máquina térmica que permite el intercambio de calor entre los cuerpos A y B. donde dU = dUA + dUB , dS = dSA + dSB , dY = dYA + dYB , y T es la temperatura del foco; Xi dYi son los trabajos de configuración y δW ∗ son todos los trabajos intercambiados distintos de los de configuración, y que se han representado en la Fig. 10.3, mediante una máquina térmica reversible con la que se puede intercambiar trabajo con el sistema. Este trabajo W ∗ se toma desde el punto de vista del sistema, por lo que es negativo cuando se cede al entorno. Si se elimina alguna ligadura interna de tal manera que el sistema evolucione, incluso interaccionando con el exterior, se tiene que, por el Primer Principio, dU − Xi dYi − δW ∗ = δQ , (10.74) i donde Xi son las variables intensivas de trabajo reversible. El Segundo Principio, a través de la Desigualdad de Clausius, asegura que sus variaciones de entropı́a deben ser tales que T dS > δQ , (10.75) Se obtiene entonces la desigualdad dU − i Xi dYi − δW ∗ − T dS < 0 . (10.76) 10.6. Resumen 207 Esta desigualdad, o su equivalente dS − δW ∗ dU Xi + dYi − > 0, T T T i (10.77) indican los cambios que pueden tener lugar en un sistema cuando éste evoluciona hacia el equilibrio. Estas desigualdades, que también se pueden resumir como δW ∗ ≤ −(dU − T dS − i Xi /T ), indican los cambios que se pueden producir espontáneamente o bien los procesos que se pueden utilizar para obtener trabajo del sistema. Si los procesos son tales que estas desigualdades no se cumplen, el sistema se está alejando del equilibrio. En esos casos, se tratará de procesos no espontáneos, en los que hay que proporcionar trabajo al sistema. En un proceso finito, W ∗ ≤ −(∆U − T ∆S − i Xi ∆Yi ), donde ∆U = ∆UA + ∆UB , ∆S = ∆SA + ∆SB , y ∆Y = ∆YA + ∆YB (∆V = ∆VA + ∆VB ), se refieren a variaciones de funciones de estado del sistema (A+B), y siendo T la temperatura del foco. En resumen, se está interesado en tres clases de procesos. Una primera clase son los procesos espontáneos, donde no hay ninguna intervención externa, con W ∗ = δW ∗ = −WN = 0, para los cuales la desigualdad anterior dará los criterios de evolución espontánea. Una segunda clase de procesos serán los reversibles con obtención de trabajo neto, para los cuales W ∗ = δW ∗ = Wmax = −WN , es el trabajo máximo obtenible. Estas condiciones proporcionarán otro criterio de equilibrio. Una tercera clase de procesos que serán reversibles con cesión de trabajo por parte de un agente externo, para los cuales el sistema se alejará del equilibrio y para los cuales W ∗ = −Wmin , o trabajo mı́nimo que habrá que realizar. Estos dos últimos procesos son equivalentes y simétricos. 10.6.1 Procesos adiabáticos a V constante El primer criterio, el de espontaneidad, W ∗ = 0, junto con la condición de sistema adiabático, Q = 0, indica que la energı́a interna U se conserva. En este caso, a partir de (10.77) se tiene directamente que dU = 0 y dV = 0, de donde el criterio de espontaneidad es dS > 0 . (10.78) Como no hay variación de energı́a interna, no se obtendrá trabajo. El segundo criterio, el de reversibilidad, exige que se realicen procesos reversibles, en cuyo caso S = Cte y dS = 0. Al realizarse 208 Capı́tulo 10. Potenciales termodinámicos procesos reversibles, dS = 0 y con dV = 0, a partir de (10.77) se obtiene −∆U = WN , (10.79) siendo WN el trabajo neto que puede ser obtenido. 10.6.2 Procesos adiabáticos con fuente de trabajo En este caso, la condición de adiabaticidad implica que dU + P dV = 0, con lo que se obtiene de nuevo que el criterio de espontaneidad vendrá dado por la Ec. (10.78). Como la presión de la fuente de presión coincide siempre con la presión del sistema, se puede escribir que d(U + P V ) = dH, conservándose la entalpı́a del sistema. Como no hay variación de entalpı́a, no se obtendrá nada de trabajo. Es decir, en un sistema a presión constante, si no se obtiene nada de trabajo distinto del de expansión, la entalpı́a del sistema permanece constante. Con el segundo criterio, se tiene que al realizarse procesos reversibles, dS = 0, y se obtiene el trabajo máximo, de donde el criterio de evolución hacia el equilibrio será ahora, a partir de (10.76), y dU + P dV − δW ∗ = 0 . (10.80) −∆H = W ∗ = WN , (10.81) con lo que la disminución de la entalpı́a se transforma en trabajo. 10.6.3 Procesos a V constante con foco de calor Si el sistema puede evolucionar sometido a la única restricción de intercambiar calor con un sólo foco a la temperatura T , se tiene que el criterio de espontaneidad es ahora dU − T dS < 0 . (10.82) Cuando la temperatura inicial y final del sistema coincida con la del foco se tendrá que dU − T dS = dF < 0 , (10.83) con lo que el criterio de espontaneidad es ahora el de la disminución de la función de Helmholtz, que alcanzará un mı́nimo compatible con las restricciones señaladas. 10.6. Resumen 209 Si se producen procesos reversibles y si la temperatura del sistema coincide al principio y al final con la temperatura del foco, a partir de (10.76), dU − T dS − δW ∗ = 0; ∆F = W ∗ = Wmax , (10.84) de donde −∆F = WN , indicando que la disminución de la energı́a libre o función de Helmholtz, se puede transformar en trabajo 31 . 10.6.4 Procesos con focos de calor y fuentes de trabajo El criterio de espontaneidad es ahora dU + P dV − T dS < 0 . (10.85) Si en todo momento las temperaturas inicial y final del sistema coinciden con la del foco de calor, entonces dU + P dV − T dS = dG < 0 , (10.86) con lo que el criterio de espontaneidad es ahora que la función de Gibbs disminuye hasta alcanzar un mı́nimo. El segundo criterio indica que en los procesos reversibles, dU + P dV − T dS − δW ∗ = 0; −∆G = WN . (10.87) y la disminución de la función de Gibbs, se puede transformar en trabajo 32 . En el caso de sistemas adiabáticos con V o P constantes, el universo coincide con el sistema a la hora de los cálculos de las variaciones de entropı́a. Eso significa que a partir de una situación inicial de no equilibrio se obtendrá un trabajo u otro y que en función del trabajo que se obtenga, el estado final de equilibrio será también uno u otro, aunque situado entre ciertos lı́mites. En el caso de sistemas en contacto con un foco de calor, el universo incluye dicho foco, lo que significa que a partir de una situación inicial 31 Del mismo modo se tiene que se debe cumplir dS + dSFC ≥ 0, lo que implica que el proceso puede tener lugar bien de forma completamente reversible, ∆SU = 0, obteniéndose todo el trabajo posible, bien de forma completamente irreversible, ∆SU > 0, sin obtenerse trabajo, o bien en cualquier forma intermedia, obteniéndose menos trabajo que el máximo. 32 De nuevo esta condición se complementa con la exigencia de que dS + dSFC ≥ 0, Si el proceso es reversible se obtendrá todo el trabajo posible o bien se obtendrá menos que el máximo si el proceso es irreversible. 210 Capı́tulo 10. Potenciales termodinámicos de no equilibrio se alcanzará siempre la misma situación de equilibrio, aunque el trabajo que se obtenga sea uno u otro. El calor recibido por el foco será diferente en cada caso. Los trabajos máximos se sustituyen por trabajos mı́nimos con sólo invertir el proceso. Evaporación del agua La entropı́a del agua a 100 ◦ C es sl = 1, 295 J·g−1 ·K−1 y la entropı́a del vapor de agua a la misma temperatura es de sv = 7, 357 J·g−1 ·K−1 . El volumen especı́fico del agua lı́quida a 100 ◦ C puede tomarse como igual a vl = 1 cm3 ·g−1 y el del vapor del agua igual a vv = 1700 cm3 ·g−1 . Todos los datos se dan a la presión de 101,3 kPa. Como sistema termodinámico se toma 1 g de agua. Puesto que en estas condiciones de temperatura y presión la evaporación del agua es un proceso reversible (lo que se confirmará posteriormente), el incremento de entalpı́a de la evaporación del agua (calor intercambiado) es igual al incremento de entropı́a, ∆s = sv − sl = 6, 062 J · g−1 · K−1 , multiplicado por la temperatura, ∆h = T ∆s = 2261, 3 J · g−1 . Esta variación de entalpı́a es igual a la energı́a que hay que proporcionar (por ejemplo, mediante una resistencia eléctrica) a 1 g de agua para que se evapore en estas condiciones. La variación de energı́a interna viene dada por ∆u = ∆h−P ∆v = 2261, 3−1, 01×105 [1700 − 1]·10−6 = 2090, 6 J · g−1 . Esta es la parte de la energı́a comunicada a 1 g de agua al evaporarse que no se transforma en trabajo de expansión. La variación de la función de Helmholtz en este proceso de evaporación es igual a vv ∆f = ∆u − T ∆s = − P dv = −P ∆v = −171, 0 J · g−1 . vl Este es el trabajo de expansión realizado por 1 g de agua al evaporarse en estas condiciones. La variación de la función de Gibbs viene dada por ∆g = gv − gl = ∆h − T ∆s = 0 . 10.7. Los potenciales como transformadas de Legendre 211 Este es el trabajo útil que puede obtenerse a partir de la evaporación de 1 g de agua en estas condiciones. Puesto que no hay variación de la función de Gibbs las fases lı́quida y gaseosa se encuentran en equilibrio es estas condiciones de temperatura y presión y aunque en su transformación hay implicado un trabajo de expansión, no puede obtenerse nada de trabajo útil. 10.7 Los potenciales como transformadas de Legendre Dada una cierta función, U = U (S, V, N ) en este caso, que contiene toda la información termodinámica sobre el sistema, se pueden obtener otras funciones, sus transformadas de Legendre (Ap. B), que contienen la misma información que ésta. 1. La función energı́a interna es U = U (S, V, N ) , (10.88) dU = T dS − P dV + µ dN + δW ∗ (10.89) siendo su diferencial donde δW ∗ son todos los trabajos distintos del de expansión. Para procesos adiabáticos en los que sólo hay trabajo de expansión, ∆U = Wad . Sus primeras derivadas son 33 T = T (S, V ) = ∂U ∂S ; P = P (S, V ) = − V ∂U ∂V . (10.90) S Eliminando S entre ambas, se obtiene la ecuación térmica de estado P = P (T, V ). Aplicando el Teorema de Schwartz se obtiene la Primera Relación de Maxwell, Tab. 7.1, ∂T ∂V =− S ∂P ∂S . (10.91) V Como todas sus variables son extensivas (S, V, N ), se tiene U = T S − P V + N µ, de acuerdo con el Teorema de Euler (Ap. B), 33 En esta sección, todas las derivadas parciales lo son también a N constante, pero no se explicita N para no sobrecargar la notación. 212 Capı́tulo 10. Potenciales termodinámicos 2. Si en vez de la entropı́a se toma su derivada, T , como la variable independiente, se tiene que la transformada de Legendre, U [T ], es de la forma U [T ] = F (T, V ) = U − T S = −P V + N µ , (10.92) que es la Función de Helmholtz. Diferenciando d F = dU − T dS − S dT (10.93) y, teniendo en cuenta la Ec. (10.89), dF = −S dT − P dV + µ dN + δW ∗ . (10.94) En un proceso isotermo reversible en el que sólo haya trabajo de expansión, ∆F = Wisot . Las primeras derivadas de F son ∂F P = P (V, T ) = − ∂V T ∂F ; S = S(V, T ) = − ∂T , V (10.95) que permite obtener directamente la ecuación térmica de estado. Se obtiene la Segunda Relación de Maxwell ∂P ∂T = V ∂S ∂V . (10.96) T Para F , sólo V y N son variables extensivas, luego, al aplicar el Teorema de Euler, hay que tener en cuenta que sólo se suma con respecto a las variables extensivas, es decir F = −P V + N µ. 3. Si en vez del volumen se toma su derivada, −P , como la variable independiente, se tiene que la transformada U [−P ] es U [−P ] = H(S, P ) = U + P V = T S + N µ (10.97) que es la entalpı́a, cuya diferencial es dH = T dS + V dP + µ dN + δW ∗ . (10.98) Sus derivadas primeras son T = T (S, P ) = ∂H ∂S ; V = V (S, P ) = P ∂H ∂P . S (10.99) 10.7. Los potenciales como transformadas de Legendre 213 Eliminando S entre ambas expresiones se puede obtener la ecuación térmica de estado. La capacidad calorı́fica CP se obtiene calculando ∂H , (10.100) CP = ∂T P expresión simétrica de U , V y CV . Se obtiene la Tercera Relación de Maxwell, ∂T ∂P = S ∂V ∂S . (10.101) P Como H es una función homogénea de S y N , se tiene que H = TS + Nµ . 4. Estas son transformadas parciales de Legendre. La transformada doble, U [T, −P ], donde la variable S se sustituye por la T y la V por −P , es U [T, −P ] = U − T S + P V = G(T, P ) = N µ , (10.102) que es la función de Gibbs, cuya diferencial es dG = −S dT + V dP + µ dN + δW ∗ . Se tiene entonces (10.103) ∂G S = S(P, T ) = − ; ∂T P ∂G , V = V (P, T ) = ∂P T (10.104) que son, respectivamente, las ecuaciones entrópica y térmica de estado del sistema. Se obtiene también la Cuarta Relación de Maxwell: ∂V ∂S =− . (10.105) ∂T P ∂P T Como la única variable extensiva de G es N , se verifica directamente que G = Nµ . (10.106) De esta ecuación, se deduce que µ = G/N = g. Esta es otra forma simple de calcular el potencial quı́mico de un sistema34 34 El hecho de que el potencial molar de Gibbs g no sólo sea una variable especı́fica, g = G/N , sino también la derivada del potencial G = N g(T, P ), a T y P constantes, hace que este potencial juegue un papel clave en el estudio del equilibrio termodinámico entre fases, Sec. 11.2. 214 Capı́tulo 10. Potenciales termodinámicos de un sistema sin necesidad de recurrir a la ecuación de GibbsDuhem (Sec. 8.4). Potencial Variación infinitesimal U = U (S, V ) dU = T dS − P dV Derivadas del Potencial P = H = H(S, P ) dH = T dS + V dP dF = −SdT − P dV T = dG = −SdT + V dP ∂H ∂S P ∂H ∂P S S=− P = G = G(T, P ) ∂U ∂S V ∂U − ∂V S V = F = F (S, V ) T = V = ∆US,V ≤ 0 ∆HS,P ≤ 0 ∂F ∂T V ∂F − ∂V T S=− Desigualdad ∆FT,V < 0 ∂G ∂T P ∂G ∂P T ∆GT,P < 0 Tabla 10.1: Potenciales termodinámicos expresados en función de sus variables naturales, variaciones infinitesimales en procesos reversibles, derivadas parciales de los potenciales y desigualdades en procesos espontáneos. Cada potencial termodinámico tiene sus propias variables naturales 35 . Puesto que, como ya se ha señalado (Secs. 3.8 y 7.1.1) cada función de dos variables tiene, en cada punto, tres 35 Aunque en los libros de Termodinámica es habitual calcular las derivadas parciales de cualquier función de dos variables, la existencia de los potenciales termodinámicos para un sistema, cada uno de ellos con un conjunto de variables naturales, lleva a reflexionar sobre la conveniencia de la notación utilizada. Ası́, para un sistema P V T , puesto que H = H(S, P ), una expresión del tipo (∂H/∂S)P serı́a una verdadera derivada parcial, pues una de las variables naturales de la función permanece constante. Pero una expresión del tipo (∂H/∂P )T deberı́a expresarse mejor como (dH/dP )T para indicar que lo que mide este coeficiente es, en realidad, una relación entre incrementos, es decir, el incremento de entalpı́a que tiene lugar cuando la presión del sistema varı́a a la vez que se mantiene constante la temperatura. Puesto que también la entropı́a del sistema varı́a en 10.7. Los potenciales como transformadas de Legendre 215 derivadas parciales segundas independientes, un conjunto de tres coeficientes termodiámicos convenientemente elegidos permite obtener cualquier otro coeficiente del sistema. Este conjunto básico debe 2 U/∂S 2 ∂ incluir: (i) un coeficiente térmico-térmico, del tipo V 2 2 o ∂ G/∂T ; (ii) un coeficiente mecánico-mecánico, del tipo 2 P 2 ∂ G/∂P2 T o ∂ 2 S/∂V U ; y (iii) un coeficiente térmico-mecánico, 2 del tipo ∂ G/∂T ∂P . Para sistemas P V T sesuelen elegir los co 2 G/∂T 2 2 G/∂P 2 eficientes C = −T ∂ , κ = −V ∂ y α = P T P T V ∂ 2 G/∂P ∂T como conjunto básico [320]. Puesto que todos los potenciales son transformadas de Legendre de una Ecuación Fundamental, expresadas en sus variables naturales, U = U (S, V ), H = H(S, P ), F = F (T, V ) y G = G(T, P ), todos ellos son Ecuaciones Fundamentales y contienen toda la información termodinámica sobre el sistema. Todas las ecuaciones de estado, coeficientes térmicos, coeficientes calorı́ficos, y cualesquiera otros coeficientes se pueden obtener a partir de cualquier potencial. En cada caso, la fı́sica del problema indicará cuál es el potencial más cómodo de utilizar para resolverlo. este proceso, ninguna de las variables naturales de H permanece constante en el proceso. Igualmente, sólo de deberı́an considerar derivadas parciales de funciones que tuvieran variables naturales, con lo que no se notarı́an como parciales las derivadas de T , V o P . Ver Ref. [320], donde se utiliza esta clase de notación.