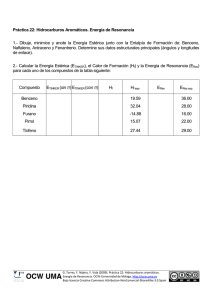
Tema 17- Hidrocarburos aromáticos Maturita Química TEMA 17: Hidrocarburos aromáticos Concepto: Æ Son compuestos cíclicos (anillos) con dobles enlaces caracterizados por tener una especial estabilidad y ser menos reactivos que los alquenos alifáticos –p.ej.: y casi no presentan reacciones de adición1)–. Æ A estas propiedades especiales es a lo que se conoce como la aromaticidad. Æ Se les denominó aromáticos porque los primeros que se descubrieron tenían olores muy intensos (y algunos agradables)2. Æ Son derivados del benceno o con estructuras parecidas (fue el primer compuesto aromático descubierto, y el más básico). Los hidrocarburos aromáticos contienen uno (como mínimo) o más de estos ciclos aromáticos Æ Esta estructura está presente en otros hidrocarburos aromáticos que podemos identificar siguiendo las reglas de Hückel: • Regla 1: Un sistema aromático debe ser cíclico y plano (sin carbonos sp3 en el ciclo) • Regla 2: Presentan dobles enlaces conjugados. • Regla 3: El número de electrones p del sistema aromático cumple la fórmula 4n+2, con n = 0, 1, 2, 3 ...... Además existen moléculas compuestas por más de uno ciclo benzenoico: Antraceno Fenantreno naftaleno Historia del benceno: En 1825, Faraday aisló un compuesto puro que presentaba un punto de ebullición de 80ºC. El resultado del análisis elemental realizado a dicho compuesto mostraba una proporción de carbono e hidrógeno de 1:1, lo cual resultaba ser inusualmente pequeña, ya que teóricamente corresponde a una fórmula empírica de CH. Posteriormente Mitscherlich sintetizó el mismo compuesto, calculo la densidad de vapor, lo que le permitió obtener el peso molecular que era aproximadamente 78, el cual corresponde a una fórmula molecular de C6H6. Como dicho compuesto se había obtenido a partir de la goma benjuí, se le denomino bencina y a partir de ahí derivó el nombre a benceno como actualmente se le conoce. Estructura de benceno: La fórmula C6H6 se conocía pero el problema era en que en conocer como se disponían los átomos en la estructura. En 1858 Kekulé propuso que los átomos de carbono se podían unir entre sí para formar cadenas. Posteriormente en 1865 propuso para poder resolver el problema del benceno, que estas cadenas carbonadas a veces se pueden cerrar formando anillos. En el benceno‐ es un hexágono con dobles enlaces conjugados (=alternados, lo que significa que hay un doble enlace luego simple y después otro doble). 1 El benceno no reacciona con halógenos (X2, siendo X Cl, Br o I) o con haluros de hidrógeno (HX) como lo haría un compuesto polialqueno. Además, la hidrogenación del benceno es mucho más lenta que la de los alquenos y requiere condiciones muy drásticas: alta presión de hidrógeno y empleo de catalizadores muy activos. 2 El término aromático se aplica en la actualidad a una serie de compuestos cuya estabilidad y reactividad es semejante a la del benceno, independientemente de su olor 1 Tema 17- Hidrocarburos aromáticos Maturita Química También propuso el concepto de resonancia: esto significa que los dobles enlaces se “mueven”, o sea, no están en un sitio fijo y la molécula se considera un híbrido de varias formas resonantes: Y por esto son más estables ( menos reactivos). Cuántas más formas resonantes hay tanto más estable es la molécula. Modelo “actual”: • Se comprobó que los enlaces entre los átomos de carbono son más largos que en dobles enlaces pero más cortos que en las de un enlace sencillo. • La densidad electrónica entre los carbonos es mayor que la del enlace simple, pero menor que de un enlace doble. • El benceno es un sistema cíclico de 6 electrones π deslocalizados. Está formado por 6 carbonos con hibridación sp2 cuyos orbitales p solapan formando una nube que permite la deslocalización de los electrones p y confiere al benceno una gran estabilidad. • Se considera que los enlaces entre los atomos de carbono no son ni “simples”(sin doble enlace) ni dobles. Cada carbono tiene un electrón de un orbital p deslocalizado, estos orbitales p se solapan lateralmente (pi) formando un orbital molécular en forma de anillo. Los “pi electrones” están extendidos (rozprostřené/rozložené) por todo el anillo. Importancia, aplicaciones y usos del benceno y los hidrocarburos aromáticos: En la industria química, el benceno puro es la base más importante para los productos aromáticos intermedios. En base al benceno se elaboran materiales plásticos, caucho sintético, colorantes, pinturas, materias primas para detergentes. Entre los hidrocarburos aromáticos más importantes se encuentran: • Las hormonas lípicas (esteroides) y las vitaminas lípidicas (A, D, E y K). • Algunos aminoácidos son aromáticos, también compuestos como la clorofila o la hemoglobina. • Muchos heterociclos3 también son aromáticos como por ejemplo las bases nitrogenadas que forman los ácidos nucleicos. • Muchos condimentos, perfumes y tintes orgánicos son aromáticos. Propiedades: Propiedades físicas: ‐ benceno, tolueno, xileno son líquidos (a temperatura ambiente) ‐ naftaleno, anthraceno y fenanthreno son sólidos a temperatura ambiente) ‐ olor característico ‐ menor densidad que el agua 3 Un compuesto heterocíclico (ver anexo) es una sustancia que contiene un anillo formado por más de un tipo de átomo (tienen al menos un átomo diferente al carbono). Ejemplos de heterociclos (no tienen porque ser aromáticos): monosacáridos (ciclados), bases nitrogenadas (ADN y ARN), clorofila, muchas drogas (alcaloides, nicotina) y vitaminas... 2 Tema 17- Hidrocarburos aromáticos Maturita Química Propiedades químicas ‐ no polares ‐ combustibles ‐ tóxicos, carcinógenos (=cancerígeno) ‐ no se disuelven en agua sino en los disolventes no polares‐ en disolventes orgánicos REACCIONES ‐ sustitucion electrofila en el ciclo ‐ se puede formar producto hasta di‐ o tri‐ sustituido (dobles o triples sustituciones..) ‐ la posicion de segundos y terceros sustituyente enlazado depende de los que ya están Sustituciones electrófilas: Halogenación (Cloración, bromación..): Un hidrógeno es sustituido por un halógeno, o sea, por floro o cloro o bromo o yodo (en el ejemplo Cloro). + Cl2 FeCl3 (ácido de Lewis) Cl + HCl Nitración: La nitración es una reacción en la que el hidrogeno es sustituido por un grupo nitro. Un ion nitronio ataca al anillo bencénico en medio ácido (ácido sulfúrico). El ácido sulfúrico es regenerado y por tanto funciona como catalizador. + HNO3 H2SO4 NO2 + H2O Alquilación: Implica la reacción entre un haluro de alquilo (R‐X) y una molécula de benceno en presencia de un ácido de Lewis como catalizador. Los productos son alquilbenceno y haluro de hidrógeno. + CH3Cl AlCl3 (ácido de Lewis) CH3 + HCl Sulfonación4: La reaccion del benceno con una disolución de trióxido de azufre en ácido sulfúrico produce ácidos bencenosulfónicos. Acilación: Un hidrogeno es sustituido por un grupo acilo. 4 La sulfonación es reversible, tiene utilidad sintética, debido a que el sustituyente ácido sulfónico puede utilizarse como grupo protector para dirigir la sustitución hacia una posición u otra. 3 Tema 17- Hidrocarburos aromáticos Maturita Química Dobles (o multiples) sustituciones: ¿En qué posición se va a unir el segundo o tercer grupo sustituyente? a) Grupos activantes (+M, +I): Ceden e‐ al anillo (por desplazam electrónicos) y aumentan su reactividad, (OH, Cl, CH3) Æ orientan al segundo sustituyente a posiciones orto y para. b) Grupos desactivantes (‐M): Atraen e‐ del anillo y disminuyen su reactividad (tiene dobles enlaces: NO2, COOH) Æ orientan el segundo sustituyente a posiciones meta ‐ p.ej.: SO3H, NO2, COOH Hidrogenación catalítica del benceno5 (con catalizador): La hidrogenación catalítica de benceno para dar ciclohexano (o un alqueno cíclico ‐ciclohexenos‐) se lleva a cabo a temperaturas y presiones elevadas. Algunos compuestos aromáticos: benceno ‐ C6H6 ‐ líquido, punto de ebullicion 80°C ‐ perjudica la salud ‐es combustible ‐ se puede obtener de petroleo ( dehidrogenacion catalítica de ciclohexano) uso: produccion de compuestos aromaticos p.ej.: estireno, es disolvente tolueno ‐ metilbenceno 5 La hidrogenación es un tipo de reacción química (redox) cuyo resultado final visible es la adición de hidrógeno (H2) a otro compuesto. En general, al añadir oxigeno el carbono de la molécula orgánica se oxida, al añadir hidrogeno o eliminar oxigeno el carbono se reduce. 4 Tema 17- Hidrocarburos aromáticos Maturita Química ‐ de petroleo ‐es un líquido parecido a benceno uso: se usa como disolvente o para la produccion de las sustancias orgánicas p.ej: para producir sacarina ( el azúcar artificial) estireno ‐ vinilbenceno ‐ Producción: de benceno, interpaso etilbenceno ‐ Polimeración: poliestireno Cumeno ‐ isopropilobenceno ‐ producción: reacción de benceno con propileno catalizada con acido uso: producción de fenol y acetona Xileno ‐ dimetilbenceno ‐ líquido uso: disolvente, producción de ácidos bencenodicarboxílicos Naftaleno ‐ C10H8 ‐ Sólido blanco (p.f.: 80°C) ‐ Se produce cuando se queman combustibles uso: producción de compuestos aromáticos (acido ftálico) Entre las moléculas que presentan aromaticidad están por ejemplo: Las bases nitrogenadas del ADN, algunos de los aminoácidos, y los compuestos clorofila y hemoglobina también (ver página 2). 5 Tema 17- Hidrocarburos aromáticos Maturita Química ANEXO: Nomenclatura: benceno CH3 CHO tolueno benzaldehido NH2 COOH ácido benzoico anilina Estructura Nº9 NO2 CH OH CH2 COOH CH3 OH HO nitrobenceno Sustituyente Hidroxi Amino Etenil fenol estireno Grupo funcional. ‐OH ‐NH2 ‐CH=CH2 CH3 para-xileno Nombre del compuesto. Hidroxibenceno Aminobenceno Etenilbenceno OH ácido gálico Nombre común Fenol Anilina Estireno Otros sustituyentes aromáticos bencenoides son: CH difenilmetil C trifenilmetil Heterociclos: Concepto y nomenclatura. (Ojo!! Ni todos los compuestos aromáticos son heterociclos, ni los heterociclos son todos aromáticos, son conceptos que no tienen nada que ver) Un compuesto heterocíclico es una sustancia que contiene un anillo formado por más de un tipo de átomo. Existen compuestos monocíclicos, bicíclicos y policíclicos, todos ellos con gran interés para los químicos y bioquímicos. Son compuestos muy abundantes en la naturaleza, se estima que más del 50% de los compuestos naturales son heterociclos: vitaminas, drogas, medicamentos, etc. Son heterociclos los carbohidratos, como también la clorofila y hemina, que dan el color verde a las hojas y rojo a la sangre. Los sitios reactivos de muchas enzimas y coenzimas son heterociclos. La herencia, por último, se almacena y transmite en la secuencia de unión específica de media docena de anillos heterocíclicos en largas cadenas de ácidos nucleicos. Nomenclatura: 6 Tema 17- Hidrocarburos aromáticos Maturita Química Muchos de los heterociclos tienen nombres comunes. Además, hay varias formas alternativas de nombrar a los heterociclos que requieren memorización, no son de aplicación universal y, a veces se prestan a confusión. Para compuestos monocíclicos sencillos se utiliza prefijos para indicar la presencia y la identidad del heteroátomo: aza‐ para nitrógeno, oxa‐ para oxígeno, tio‐ para azufre, fosfa‐ para fósforo y así sucesivamente. Oxaciclobutano Azaciclopentano Oxaciclohexano Tiociclohexano 3-etiloxaciclohexano Tipos. Pirrol Furano Tiofeno Imidazol Oxazol Tiazol Pirazol 3-Pirrolina Pirrolidina Piridina Pirimidina Purina 7