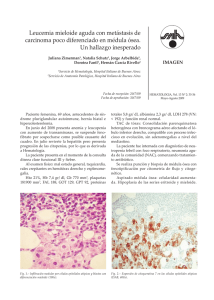
SÍNDROMES MIELOPROLIFERATIVOS CRÓNICOS. 1. Definición y clasificación de leucemias. Las leucemias son procesos patológicos en los que las células normales de la médula ósea, productoras de los distintos elementos celulares de la sangre, pierden su característica forma y función y se vuelven neoplásicas y no funcionales. A su vez estas células se desparraman a la circulación en donde pueden observarse en lugar de las células normales maduras. Los órganos principalmente afectados son el hígado, el bazo y principalmente la misma médula ósea. Una manifestación usual es la anemia, o falta de aporte de oxígeno a tejidos, y también leucosis, o elevación del número de glóbulos blancos de la sangre, aunque a veces hay leucopenia (reducción del número de leucocitos circulantes y/o en médula ósea). A partir de un célula madre pluripotencial, se van a diferenciar en primer lugar la línea que va a dar lugar a la producción de linfocitos y la que va a dar lugar a la formación de granulocitos y monocitos, plaquetas y hematíes. Tras distintas etapas de división y maduración se obtienen los elementos maduros de la sangre, que corresponden a linfocitos B y T, monocitos, granulocitos, plaquetas y hematíes. Puede haber alguna célula residual inmadura en el frotis sanguíneo que se ha encontrado por casualidad, o existe algún tipo de infección o reacción de fase aguda que requiere un mayor número de monocitos, linfocitos o granulocitos, es decir, mayor número de células sanguíneas maduras en la sangre junto a precursores inmaduros, siendo estos procesos patológicos usualmente limitados al tiempo en el que se produce la agresión al organismo. Tradicionalmente las leucemias se clasifican según la línea de células afectadas y según el grado de madurez de las células presentes en sangre. Según el tipo celular, pueden ser linfocíticas o mielocíticas. Las leucemias agudas suponen la desaparición de las células maduras y su sustitución por células inmaduras que ya no sufrirán posterior evolución o diferenciación funcional. Suponen un riesgo grave para la salud y en general la supervivencia del paciente es relativamente corta, incluso de meses, dando lugar a anemia, infecciones y hemorragias. Las leucemias crónicas, en cambio, pueden presentar mayor o menor número de células maduras, si bien el número de formas inmaduras es considerablemente elevado. Por esta razón, no suponen un riesgo de muerte inminente. La evolución y diferenciación de células sanguíneas aparece en el siguiente gráfico. Junto a cada célula aparece el tipo de leucemia a que da lugar según el estadio de desarrollo en el que se para la diferenciación celular o al estadio de desarrollo más afectado por el proceso patológico, y que corresponde frecuentemente al mayor número de células que aparece en la médula ósea y en la sangre o al estadio cuya transformación activará el desarrollo y transformación celular posterior (síndromes mieloproliferativos). Estas patologías aparecen en letras de color rojo (1). Redistribución de IgG Ig de superficie IgG citoplasmática Célula B temprana TdT + Células pre B Leucemia linfoblástica aguda de célula nula (ALL) Célula madre linfoide (Deoxinucleotidasa terminal, TdT) ?? Células B maduras Leucemia linfoblástica aguda de célula pre B Redistribución del receptor de células T (TCR) Secreción de Ig Célula B activada Célula plasmática Leucemia linfocítica crónica de células B y Linfoma linfocítico bien diferenciado (WDLL) Mieloma múltiple Linfoma no Hodkin de células B T3 + T8 + células citotóxicas T3 + Timocito temprano TdT + Célula madre hematopoyética pluripotente Timocito inmaduro T11+ TdT + T4 + células auxiliares Leucemia linfoblástica aguda de célula T y Linfoma linfobástico Síndrome mieloproliferativo crónico, posiblemente Células T posttímicas Monocito/ macrófago Granulocito/precursor de macrófagos Leucemia mielocítica aguda Plaqueta Célula madre mieloide multipotente Síndromes mielproliferativos crónicos Granulocito Precursor de megacariocitos Hematíe Precursor eritroide 2. Síndromes mieloproliferativos crónicos. Los procesos en los que se produce una maduración descontrolada de células procedentes de una célula madre hematopoyética pluripotente o principalmente, una célula madre mieloide multipotente corresponden a los síndromes mieloproliferativos crónicos. Según el tipo o de células afectadas, siempre de la línea mieloide, pueden existir cuatro condiciones patológicas principales: leucemia mieloide crónica (LMC), también llamada leucemia mielocítica crónica o leucemia granulocítica crónica; policitemia vera; trombocitemia esencial y mielofibrosis con metaplasia mieloide. Todas tienen en común que existe coexistencia de elementos inmaduros o blastos con elementos maduros, que según el tipo de elemento predominante se definirá el proceso (granulocitos, LMC; hematíes, policitemia vera; trombocitemia esencial; plaquetas); que puede haber una transformación de un proceso patológico a otro o a una producción exagerada de todos los elementos formes en la médula y en otros tejidos productores de células sanguíneas, como hígado o bazo (metaplasia mieloide); y que puede haber, de repente, un agotamiento de la médula ósea y una sustitución por células inmaduras, las “crisis blásticas” que suponen un agravamiento repentino del proceso patológico. Fue Dameshek en 1951 quién observó y describió estos procesos patológicos junto con la interconversión de uno en otro (2). Aunque cada trastorno mieloproliferativo crónico tiene signos distintivos propios, hay interconversiones y superposiciones entre los miembros del grupo de síndromes mieloproliferativos crónicos. Un sujeto puede presentarse inicialmente con policitemia vera, pero con el paso de los años se convierte en metaplasia mieloide con mielofibrosis. De los citados síndromes, la LMC es el síndrome leucémico, y los demás son no leucémicos. Parece ser que existe una proteína con actividad tirosina quinasa que estimula la producción de las células pluripotente en elementos celulares maduros. En el caso de LMC es el producto del gen bcr-abl. En la policitemia vera, mielofibrosis y trombocitemia esencial, es una mutación del gen JAK2, cuya traducción es la proteína con actividad proteína quinasa. 3. Leucemia mieloide crónica (LMC). En la LMC, la línea celular predominante es la de precursores granulocíticos. A diferencia de las leucemias agudas, no hay bloqueo en la maduración de las células madre leucemias. Hay un aumento de 15 a 20 veces la masa de precursores granulocíticos en médula ósea y bazo, que no se dividen más rápidamente que las células madre normales. La base del aumento de masa celular mieloide en la LMC parece provenir de la falta de regulación o freno de las señales fisiológicas que regulan su proliferación. El rasgo clínico que define a la LMC es la esplenomegalia. Una propiedad de tinción de leucocitos es su falta de fosfatasa alcalina leucocitaria o granulocítica. Un marcador genético de la LMC es el cromosoma Filadelfia (Ph1). La enfermedad es poco frecuente en la infancia, aparece a partir de los 50 años, ligero predominio en varones y tiene incidencia de 1 caso por cada 100.000 habitantes. 4. Clínica de la LMC. El comienzo de la LMC es lento, con síntomas inespecíficos, como debilidad, fatiga fácil y pérdida de peso. El primer síntoma es una tracción en el abdomen, a la consecuencia de la intensa esplenomegalia del trastorno. El curso es de progresión lenta, que incluso sin tratamiento hay supervivencia de 2 a 3 años. Después de un período variable, aproximadamente el 50% de los pacientes entra en una “fase acelerada”, durante la cual hay un fallo en el tratamiento, anemia, trombocitopenia en aumento, aparición de otras anormalidades citogenéticas y finalmente transformación en el cuadro que recuerda a la leucemia aguda (“crisis blástica”). En el 50% restante de casos, las crisis blásticas aparecen de forma abrupta, sin fase acelerada intermedia. En estos casos, los blastos tienen un marcador intracitoplasmático que es la enzima Transferasa terminal de deoxinucleótido (TdT), marcador primario de los linfoblastos, y estos linfoblastos son del tipo B, según aparece por la redistribución del gen de la inmunoglobulina. La transformación linfoblástica sugiere que, en estos casos, es la célula madre hematopoyética pluripotente la que está afectada inicialmente en la aparición de la LMC. 5. Frotis de sangre periférica y médula ósea en la LMC. En sangre periférica hay aumento del número de leucocitos, más de 100000 por mm3. Predominan los neutrófilos y metamielocitos, aunque puede haber mieloblastos. Un 50% de los enfermos presentan trombocitosis. Al comienzo suele haber un aumento del número de basófilos. Un signo característico es la ausencia de fosfatasa alcalina de los granulocitos, lo que sirve para distinguirlo de las reacciones leucemoides que también se acompañan de un notable aumento de granulocitos, en respuesta a inflamación crónica, infección, estrés y algunas neoplasias (3). La médula aparece hipercelular en todas las fases. Los precursores de eosinófilos y basófilos tienden a aumentar y los normoblastos tienden a disminuir. La aspiración de la médula puede ser difícil (en etapas avanzadas sobre todo) por la densidad del concentrado celular y por el mayor nivel de reticulina. En algunos casos, se observan macrófagos llenos de pigmento azul (histiocitos de color azul marino) o macrófagos similares a la células de Gaucher. La médula ósea no es esencialmente diagnóstica de la LMC. Se puede realizar sobre el mismo frotis la detección de la actividad de fosfatasa alcalina granulocítica por tinciones histoquímicas. La fosfatasa alcalina es una enzima hidrolítica que actúa hidrolizando ésteres del ácido fosfórico. Actúa a un pH de 9-9.5, y se pone de manifiesto cuando una sal diazódica se combina con un producto de la hidrólisis (alfanaftol-fosfato), produciendo un precipitado de color pardo. Esta enzima se encuentra en gránulos secundarios de los neutrófilos. Dependiendo de la cantidad de precipitado en su citoplasma se clasifican las células en seis grados diferentes. Se valora nada más en neutrófilos cayados y segmentados, presentes en sangre periférica. La valoración se establece teniendo en cuenta la aparición de precipitado pardo-marrón en el citoplasma. La fosfatasa alcalina de los neutrófilos disminuye mucho o no existe en pacientes con LMC, lo que ayuda a su distinción de la policitemia vera (en la que aumenta mucho), es normal, elevado o bajo en la mielofibrosis con metaplasia mieloide y normal o elevado en las reacciones leucemoides. Cuando hay remisión de la LMC puede normalizarse el valor de la fosfatasa alcalina de los neutrófilos en una tercera parte de casos. 6. Estudios citogenéticos de la LMC. Por técnicas de bandeo cromosómicos, se observa que el 90 – 95% de los pacientes tienen el cromosoma 22, acrocéntrico, anormalmente pequeño. Parte de su brazo largo queda translocado a otro cromosoma, normalmente el cromosoma 9. El pequeño cromosoma 22 anormal fue descrito inicialmente por Nowell y Hungerford en 1960 y se denominó cromosoma Filadelfia o Philadelphia (Ph1)(4): El cromosoma se halla presente en la sangre y células de médula ósea en recaída, y puede demostrarse su presencia en la médula ósea durante la remisión. Se halla en la célula madre mielógena pluripotencial, pero también puede estar en la célula hematopoyética pluripotencial. El cromosoma 9 se rompe por la banda 34 y el cromosoma 22, por la banda 11, lo que da lugar a una traslocación t(9;22) (q34;q11). En la parte quebrada y separada del cromosoma 9 está contenido el oncogen c-abl que va al brazo largo del cromosoma 22 en la banda 11. Se forma así un gen c-bcr/abl. Se une así el extremo 5’ del gen bcr con el extremo 3’ del gen abl. Inicialmente el gen c-abl codifica un RNA mensajero que da lugar a proteína de baja actividad tirosina quinasa. La asociación con bcr potencia la actividad tirosina quinasa, que por mecanismos todavía no completamente resueltos (si bien al respecto ha habido grandes avances) da lugar a la potenciación de la capacidad de desarrollo de la célula mielógena pluripotencial en células maduras (6). gen Bcr gen Bcr gen Abl gen Abl Cromosoma 22 Cromosoma Philadelphia Ph1 Cromosoma 9 Bcr: Breakingpoint cluster region Abl: gen Abelsson (adquirido por el cromosoma a partir del virus Abelson) Los pacientes sin Ph1 tienen las mismas características que los que lo manifiestan, como son esplenomegalia, edad de aparición, cuadro sanguíneo en sangre periférica y médula, y fosfatasa alcalina granulocitaria disminuida. En promedio, los pacientes con Ph1 negativo tienen recuentos de leucocitos menores, peor pronóstico y responden peor al traamiento, con menor supervivencia. En estos pacientes, puede haber un trastorno mieloproliferativo atípico, y a veces una leucemia mielomonocítica crónica (síndrome mielodisplásico). Estas variaciones en la manifestación de la enfermedad también pueden estar relacionadas con el punto de corte del gen brc. La sonda PCR seleccionada para diagnóstico también podrá o deberá ser diferente según el punto de corte. Principalmente, las escisiones en el cromosoma 22 se dan entre los exones 12 y 16, región denominada Major breakpoint cluster region (M-brc). Las proteínas que son la traducción de la fusión brc-abl tienen un peso molecular de 210 kd. Las proteínas codificadas por otros genes de fusión son menos comunes: las producidas por escisiones en el gen Brc entre los exones 1 y 2 se denomina minor breakpoint cluster region (m-brc), con peso molecular de 190 kd y las producidas por escisión entre los exones 19 y 20 dan lugar a proteínas de micro breakpoint cluster region (μ-Brc). La escisión en el gen Abl, cromosoma 9, tiene lugar en el exón 2. En cualquiera de las tres roturas y posterior translocación, en cultivos celulares in vitro, la expresión del gen fusionado Bcr-Abl sobre célula mieloide da lugar a su transformación en célula neoplásica, con crecimiento descontrolado. Los estudios in vivo confirman este hallazgo in Vitro (6). Puntos de corte en cromosomas Exones m-Bcr 1-2 M-Bcr 12- 16 µ-Bcr 19 - 20 Exon2 Cromosoma 22 Cromosoma 9 Entre las técnicas de reacción en cadena de la polimerasa tiene especial importancia la RT – PCR (Retro transcriptasa y Reacción en Cadena de la Polimerasa) que se basa en aislar el ARN leucocitario, hacer su retrotranscripción hacia ADN complementario y posterior amplificación. Se usa para la detección del cromosoma Ph1 y tambi+en usarse para aquellos casos que son cromosoma Ph1 negativos o hay translocación entre cromosomas 22 y 9, pero los puntos de corte no son los habituales. 7. Otros hallazgos de laboratorio. En frotis de sangre periférica puede haber aumento del número de basófilos. En plasma, hay aumento de proteína transportadora de vitamina B12, sobre todo transcobalamina I, y aumento de lisozima o muramidasa, se cree que por la gran cantidad de granulocitos producidos y almacenados en médula ósea. Por el metabolismo acelerado, puede encontrarse ácido úrico elevado en sangre, hiperpotasemia y LDH elevado (principalmente isoenzimas 3, 4). 8. Tratamiento de la fase crónica. El tratamiento habitual es por busulfán, hidroxiurea e interferón alfa. El paso a fase blástica se trata, en personas de menos de 55 años, por transplante de médula alogénico. Hay tratamiento complementario con alopurinol, alcalinización de la orina e hidratación para forzar la eliminación renal de ácido úrico. La hidroxiurea es inhibidor de la ribonucleótido reductasa, y reduce la expresión de todas las líneas celulares (megacariocitos, granulocitos, monocitos, linfocitos, eritrocitos), a la vez que favorece la expresión de los genes de hemoglobina F. No detiene la progresión a crisis blástica. Las dosis iniciales son de 30-50 mg/kg/día. Puede provocar macrocitosis y naúseas y estomatitis. Más del 80% de pacientes tienen remisión completa, pero no disminuye el porcentaje de Ph1. El busulfán está contraindicado en candidatos a recibir transplante de médula ósea. Se debe restringir a la fase acelerada, previa a la crisis blástica. El interferón alfa es la citoquina con mayor actividad antineoplásica. Activa la síntesis de muchas proteínas, como AgHLA, o reprime otras, como el producto del oncogen c-myc. Puede desestabilizar el complejo bcr-abl, y restaura la adhesión de las células de LMC al estroma por beta1 integrina y L-selectrina. La dosis es de 5 MU/m2/día por vía subcutánea, e induce remisión completa en el 70% de los pacientes con LMC de menos de un año de evolución y un 30-40% logran expresión de menos de un 35% de Ph1. Si hay remisión citogenética, con desaparición del cromosoma Ph1, la supervivencia a los 10 años es del 72%. Puede provocar cuadro pseudogripal, astenia, alopecia leve, mielosupresión, tiroiditis, hipertrigliceridemia, Coombs directo positivo y anticuerpos antinucleares positivos. El IFN-gamma pegilado tiene mayor vida media y puede darse solo una vez por semana. El tratamiento puede ser de por vida. 9. Tratamiento de la fase acelerada y crisis blástica. La fase acelerada tiene una serie de características, que según el IBMTR (“Center for International Blood and Marrow Transplant Research”, Centro para la Investigación Internacional del Transplante de Médula Ósea y Sangre) son las siguientes: Leucosis resistente a quimioterapia convencional, astenia o trombocitopenia refractaria a quimioterapia, esplenomegalia progresiva, más de 10% de blastos en sangre periférica o médula ósea, más del 20% de blastos más promielocitos en sangre periférica o médula ósea, más de 20% de blastos más eosinófilos en sangre periférico o médula ósea, trombocitosis persistente, clones adicionales y mielofibrosis progresiva (3). Un 70% de las crisis blásticas son mieloblásticas y un 20% son linfoblásticas. En este caso remedan la leucemia aguda linfoblástica, con CD10, TdT+, y además, heredado de LMC, con cromosoma Ph1 y reordenamiento bcr, con ARN b3a2 o b2a2 y proteína p210. Tanto el tratamiento de la fase acelerada y la crisis blásticas con fármacos por quimioterapia son decepcionantes. La supervivencia en fase acelerada es de 8-18 meses y en el caso de crisis blástica es de semanas. El tratamiento es el transplante de médula ósea, con supervivencia a los 5 años del 20%. En el caso de que el paciente esté en fase de transformación, hay que realizar tipaje de HLA lo antes posible y llevar a cabo el transplante de médula ósea en seguida se pueda. El paciente debe tener menos de 55 años, aunque no es límite rígido. En este caso se hace el tipaje de HLA clase I y II del enfermo y hermanos, si tiene. Si tiene menos de 35 años, se busca donante no emparentado. El efecto terapéutico del transplante proviene del acondicionamiento previo (ciclofosfamida 60 mg/kg/día durante 2 días e irradiación; o busulfán 4 mg/kg/día durante 4 días más ciclofosfamida 50mg/kd/día durante 2 días) y del posterior efecto de injerto contra huésped. En transplante entre hermanos, hay porcentaje de curación del 50-70% en pacientes con LMC en fase crónica y 10% de recaída a los 5 años. En el caso de donantes no emparentados, la probabilidad de supervivencia sin recaída hematológica es del 41% a los 3 años. Puede hacerse transplante autólogo con células madre propias Ph1 negativas tras quimioterapia intensa y tratamiento con factor estimulante de colonias de granulocitos. 10. Policitemia vera. La policitemia vera supone una expansión incontrolada de hematíes en sangre periférica. También aumentan los leucocitos y plaquetas, dando lugar a posibles infartos de órganos por oclusión de vasos sanguíneos y desórdenes de coagulación. Un dato de laboratorio significativo es la velocidad de sedimentación globular anormalmente baja. La eritropoyetina está normal o disminuida, lo que distingue a esta patología de la policitemia relativa, por estimulación de producción de glóbulos rojos debida a secreción de eritropoyetina, por ejemplo a elevadas alturas. A diferencia de la LMC, la fosfatasa alcalina granulocítica está aumentada. La enfermedad se produce a partir de los 60 años y es raro que tenga lugar a menos de 20 años, con predominio ligero para el género masculino (7). Los criterios de diagnóstico de la policitemia vera tradicionales son (8): a. Categoría A 1. Masa eritrocitaria aumentada (con hematíes marcados con 51Cr), en hombres más de 36 ml/kg y en mujeres más de 32 mg/kg 2. Saturación arterial de oxígeno normal 92% 3. Esplenomegalia b. Categoría B 1. Trombocitosis superior a 400.000/mm3 2. Leucocitosis superior a 12.000/mm3 3. Fosfatasa alcalina granulocítica elevada >200 en ausencia de fiebre o infección 4. Aumento de viamina B12 superior a 900 pg/ml o de la capacidad de fijación libre de vitamina B12, superior a 2200 pg/ml Para el diagnóstico de policitemia vera deben cumplirse los 3 criterios de categoría A o los dos primeros criterios categoria A y los cuatro criterios de categoría B. Los criterios modificados de diagnóstico de la policitemia vera son: a. Criterios mayores. i. Aumento de masa eritrocitaria, más del 25% sobre el valor esperado. ii. Ausencia de causa de policitemia secundaria. iii. Esplenomegalia palpable. iv. Marcador de clonalidad (por ejemplo, cariotipo medular anómalo). b. Criterios menores i. Trombocitosis más de 400.000/ml ii. Neutrofilia, más de 10000/mm3 iii. Esplenomegalia demostrada por técnicas radiológicas. iv. Crecimiento marcado de célula pluripotencial eritroide o reducción de la eritropoyetina sérica. Para el diagnóstico de la policitemia vera deben cumplirse los 2 primeros criterios mayores, y el tercero o el cuarto criterio mayor; o bien, los dos primeros criterios mayores y dos de los criterios menores. A su vez estos criterios han sido modificados por el descubrimiento de la mutación JAK2V617F o mutación JAK2 en el exon 12. La mutación JAK2V617F es positiva en el 96% de los pacientes con Policitemia Vera y la mutación JAK2 exón 12 en prácticamente el 4% de casos y constituye el criterio principal III de los nuevos criterios establecidos por la OMS en 2016(8). El diagnóstico suele establecerse en el laboratorio. El número de glóbulos rojos varía entre 6000000 y 10000000 por mm3, con los aumentos correspondientes de hemoglobina y valor hematocrito. El hematocrito es superior a 49% en hombres y 48% en mujeres, y la hemoglobina, superior a 16.5 g/dl en hombre y 16 g/dl en mujeres (criterio I de la OMS). En sangre periférica hay normocitos aunque puede haber hipocromía y microcitosis, sobre todo tras las distintas flebotomías. Los hematíes presentan anisocitosis, policromasia y punteado basófilo. La eritropoyetina está disminuida (criterio I secundario de la OMS). Hay hiperproliferación de precursores granulocíticos y megacariocitos en la médula ósea (criterio principal II de la OMS). Si los 3 criterios principales definidos por la OMS se cumplen (hematíes sangre periférica, médula ósea, marcador JAK2), la enfermedad es Policitemia Vera. No obstante, no es preciso realizar mielograma en caso de cumplimiento de criterios principales I y III, y criterio I secundario (eritropoyetina reducida). La médula ósea es normal, con predominio de la serie eritroide, e inversión de la relación mieloide/eritroide. El número de megacariocitos está elevado con forma madura. En la evolución de la policitemia vera se puede producir fibrosis colágena de la médula. En sangre periférica, el número de leucocitos puede ser hasta 80000 por mm3 y el de plaquetas muchas veces es mayor de 400000 por mm3. Es clásico que los valores de fosfatasa alcalina en los granulocitos sean superiores a los normales. Las plaquetas pueden presentar alteraciones en la morfología y función. Suele haber falta de agregación inducida por la epinefrina, y también con ADP y colágeno. La saturación arterial de oxígeno es normal. Los datos bioquímicos indican bajo hierro y ferritina, eritropoyetina disminuida o normal, vitamina B12 y capacidad de fijación libre aumentadas, hiperuricemia y LDH elevados por recambio celular elevado e hiperhistaminemia. Hasta el 2005 que se descubrió la mutación JAK2V617F, no se había descrito ningún marcador específico asociado con la policitemia vera. Se habían y se siguen encontrando trisomías 1, 8 y 9 y delecciones 5q, 13q y 20q. Se ha observado sensibilidad incrementada a la eritropoyetina y a interleukina 3, ambos precursores de hematíes. En definitiva, la mutación JAK2V617F y la eritropoyetina baja confirman el diagnóstico de Policitemia Vera (9). El conjunto de datos que puede dar falsos positivos surge de la combinación de tabaquismo muy intenso con consumo de gran cantidad de alcohol; lo primero lleva a policitemia secundaria y lo segundo, a enfermedad hepática con esplenomegalia, B12 elevada y en algún casos elevación de la fosfatasa alcalina granulocítica. La determinación de unidades formadoras de colonias, eritropoyetina baja y mutación JAK2 informan de policitemia vera . La enfermedad en su evolución pasa por diferentes etapas: 1. Fase asintomática. Solo se detecta una eritrocitosis aislada, o trombocitosis o esplenomegalia. 2. Fase policitémica. Los pacientes desarrollan los síntomas propios de la enfermedad. Estos síntomas son: a. Trombosis y hemorragia, con accidentes cerbrovasculares, infarto de miocardio, trombosis venosa profunda o tromboembolismo pulmonar. Otra complicación frecuente es la ertiromelalgia, que consiste en dolor en los dedos semejante a una quemadura, con calor y eritema local, siendo más frecuente en pies y piernas. Responde espectacularmente al ácido acetil salicílico. También se produce sangrado de encías y epistaxis. b. Prurito, que se manifiesta tras el baño y es resistente al tratamiento, probablemente por aumento de mastocitos en piel y elevación de histamina. c. Síntomas gastrointestinales, con dolor abdominal inespecífico en relación con la esplenomegalia. También sangrado gástrico o duodenal. d. Síntomas cardíacos, como infarto agudo de miocardio o insuficiencia cardíaca congestiva. e. Síntomas neurológicos, como dolor de cabeza, tinnitus y en algún caso, corea. f. Hiperuricemia, por recambio celular acelerado, con litiasis urinaria, artropatía y gota. 3. Fase inactiva al cabo de varios años, por propia tolerancia de síntomas. 4. Fase de agotamiento o metaplasia mieloide postpolicitémica. La metaplasia mieloide postpolicitémica tiene lugar a los 10 años, en aproximadamente el 10% de casos. Se produce aumento de esplenomegalia, cuadro leucoeritroblástico y poiquilocitos en sangre periférica, fibrosis medular difusa y normalización o disminución de la médula ósea. En esta fase final, o alguna vez tras la fase 1 o 2, puede producirse el paso a una leucemia aguda, que suele ser mieloide. La supervivencia, una vez realizada la transformación, es de menos de 3 años. Alrededor del 30% de los enfermos mueren de alguna complicación trombótica, que suele afectar cerebro o corazón. Otro 10 a 15% muere de alguna complicación hemorrágica. En personas sin tratamiento, la muerte resultante de estos episodios vasculares tiene lugar en el plazo de unos meses después de establecido el diagnóstico. Sin embargo, si mediante flebotomías la masa de glóbulos rojos puede conservarse en valores cercanos a los normales, cabe lograr una supervivencia media de 10 años. El tratamiento se realiza por la flebotomía para reducir la masa eritrocitaria, fármacos que suprimen la suprimen la médula ósea, y tratamiento antitrombótico, que puede restringirse al ácido acetilsalicílico para la eritromelalgia. La finalidad es reducir complicaciones trombóticas y retrasar la aparición de la mielofibrosis. Los fármacos supresores de la médula ósea son el 32P, la hidroxiurea, el alfa interferon (estos dos de forma similar a la LMC), pipobromán y anagrelide. El tratamiento con 32P es el habitual desde hace 80 años, con marcado efecto mielosupresor, que reduce el riesgo trombótico, pero es responsable de aumento de otro tipo de neoplasias. La hidroxiurea es el mielosupresión actual de elección, que puede ser sustituido por el pipobromán. El alfa interferon favorece la producción de fibroblastos lo que previene la mielofibrosis, y la anagrelida, imidazoquinazolina, es mielosupresores exclusivamente de megacariocitos, pero su administración no puede ser interrumpida por efecto rebote; además, la anagrelida es agente prometedor en pacientes jóvenes con enfermedad cardíaca. Las recomendaciones terapéuticas son: para menores de 50 años, exclusivamente flebotomía de forma que el hematocrito esté por debajo de 46; para mayores de 70 años, 32 P; y entre 50 y 70 años, tratamiento individualizado. Con ello se ha conseguido supervivencia de 10 años o incluso superior. 11. Trombocitemia esencial. La trombocitemia esencial es el proceso patológico en el que hay una producción incontrolada de plaquetas, en médula ósea, que se hace patente en sangre periférica. Da lugar a la aparición de fenómenos de sangrado y también trombóticos. Así las plaquetas tienen forma y función alterada, están multilobuladas y no se agregan de forma adecuada por epinefrina, ADP o colágeno. Tiene dos picos de incidencia, uno entre los 20-30 años, que afecta sobre todo a mujeres, y más de 60 años, que afecta por igual a ambos sexos (10). Los criterios de diagnóstico, según el grupo Trombocitemia Vera Study Group, son: a. Criterios obligatorios. i. Plaquetas más de 400000/mm3 sin causa conocida (ausencia de fiebre o infección, VSG y PCR normales). ii. Histología medular, plaquetas aumentadas en número y tamaño con núcleo hiperlobulado y formando cúmulos. b. Criterios de conformación. i. Fosfatasa alcalina leucocitaria elevada en ausencia de infección. ii. Médula ósea normo o hipercelular con eritropoyesis y mielopoyesis normales. Fibrosis reticulínica mínima o ausente. iii. Esplenomegalia ligera (clínica o radiológica) iv. Formación espontánea de colonias eritroides y/o megacariocíticas en cultivos celulares, c. Criterios de exclusión i. Exclusión de otros síndromes mieloproliferativos crónicos. 1. Ausencia del cromosoma Ph1 o reordenamiento bcr/abl 2. Ausencia de fibrosis colágena o reticulínica intensa. ii. Exclusión de síndromes mielodisplásicos (megacariocitos hipolobulados) y anomalías citogenéticas, como delección 5q Los datos de laboratorio reflejas más de 400000 plaquetas/mm3 en sangre periférica sin que exista causa reactiva o secundaria (no hay hemorragia aguda, neoplasia, inflamación aguda o crónica, esplenectomía, ejercicio, ferropenia, fármacos como vincristina o adrenalina o el síndrome POEMS, constituido por polineuropatía, organomegalias, endocrinopatías, mieloma osteosclerótico y pigmentación cutánea). Puede no haber síntomas, y si los hay (2/3 de casos), son por hemorragias, como sangrado de encías, o episodios trombóticos, como trombosis venosa profunda o tromboembolismo pulmonar, dolores abdominales, priapismo, acúfenos y cefaleas. Las hemorragias más graves tienen lugar en pacientes con cifras de plaquetas muy elevadas. Este hecho puede ser debido a la disminución de los multímeros de alto peso molecular del factor von Willebrand y a la fragilidad de los coágulos si tienen un excesivo número de plaquetas. La exploración física es normal en muchos casos, si bien un tercio de ellos presentan esplenomegalia y una tercera parte hepatomegalia. Puesto que la expectativa de vida es normal para los pacientes con trombocitemia esencial, no se realiza tratamiento o se individualiza éste a fin de reducir los efectos trombóticos o hemorrágicos. Para evitar la expansión clonal de megacariocitos son útiles los mismos medicamentos que para la policitemia, y en particular, la hidroxiurea y el alfa interferon. La anagrelida evita la proliferación de plaquetas. 12. Mielofibrosis con metaplasia mieloide. La mielofibrosis con metaplasia mieloide es el proceso patológico en el que las células de la médula ósea son sustituidas progresivamente por tejido fibroso y se desplaza la hematopoyesis a hígado y bazo. Puede ser de aparición repentina, metaplasia mieloide agnogénica (idiopática), lo que es raro, o por fase terminal de la policitemia vera. Por tanto, el diagnóstico se realiza tras la observación de la médula ósea. La esplenomegalia es común (10). La fibrosis medular es un proceso reactivo debido a la liberación desde los gránulos alfa de los megacariocitos clonales de distintos factores de crecimiento, como son el factor de transformación de crecimiento beta, el factor de crecimiento epidérmico, calmodulina y factor de crecimiento de plaquetas, que inducen la producción de colágeno tipo I, III y IV por parte de fibroblastos medulares adyacentes. El estudio citogenético puede mostrar distintas alteraciones aunque no son patognomónicas, como delección del cromosoma 13q, 20p y trisomía del cromosoma 1q. En sangre periférica, la mielofibrosis se presenta como anemia, diagnosticada como normocítica normocrómica, si bien los hematíes tienen formas variadas con presencia de poiquilocitos y dacriocitos. Puede producirse hemoglobinuria paroxística noctura. Hay cuadro leucoeritroblástico (presencia de células inmaduras mieloides y eritroides), plaquetas grandes y fragmentos de megacariocitos. Tiempo de hemorragia alargado y agregación reducida con adrenalina. Como en la mayoría de síndromes mieloproliferativos crónicos, hay marcadores de aumento de recambio celular, como aumentos de LDH, ácido úrico, potasio y vitamina B12; y aumentos de fosfatasa alcalina, transaminasas y bilirrubina por afectación hepática. Puede haber defectos de inmunocomplejos, hemólisis autoinmune, y defectos de hemostasia. La presencia de anemia con hemoglobina inferior a 10 g/dl, más de 1% de blastos en sangre periférica, anomalías citogenéticas y edad avanzada son signos de mal pronóstico. En médula ósea se han descrito tres patrones: a) Forma hiperplásica (fase inicial) con intensa hiperplasia de las tres series, abundantes megacariocitos y grado variable de displays con fibrosis reticulínica. b) Forma colágena (forma intermedia), caracterizada por fibrosis reticulínica y colágena. c) Forma osteosclerótica (fase final), con neoformación ósea y práctica ausencia de celularidad. El diagnóstico diferencial es complejo, ya que debe ser distinguido de otros procesos en los que queda afectada la médula ósea, como neoplasias hematológicas (leucemias agudas, mieloma múltiple, linfomas), neoplasias no hematológicas (cáncer mama, estómago, próstata y pulmón), infecciones (tuberculosis e histoplasmosis) y otros como osteodistrofia renal, lupus o enfermedad de Paget. Con todo, el diagnóstico más difícil es con LMC, ya que ambos cursan con esplenomegalia y leucocitosis. La médula ósea es la que, por su fibrosis, indica el diagnóstico de mielofibrosis. El tratamiento se realiza con los mismos fármacos de los demás síndromes mieloproliferativos, como hidroxiurea y alfa interferón.; andrógenos para la eritropoyesis ineficaz (danazol y oximetolona) y eritropoyetina recombinante. Ninguna de las opciones terapéuticas consigue prolongar la supervivencia y reducir la fibrosis, a excepción del transplante alogénico de médula ósea de donante histocompatible, con remisión a los 6 meses y supervivencia libre de enfermedad del 40% a los 5 años. 13. Otros síndromes mieloproliferativos crónicos. Otros síndromes mieloproliferativos crónicos que antiguamente fueron incluidos en la LMC son la leucemia neutrofílica crónica y la leucemia eosinofílica crónica., cuando el predominio es de neutrófilos o eosinófilos respectivamente (11) 14. Avances diagnósticos y terapéuticos de los síndromes mieloproliferativos. En los síndromes mieloproliferativos crónicos, se investiga la causa por la que la médula ósea se activa en la producción de elementos celulares sanguíneos hasta su fibrosis o agotamiento. Este hecho es más importante en la LMC ya que se conoce la anormalidad cromosómica, cromosoma Ph1, asociada a la patología y porque es el más grave de todos los síndromes mieloproliferativos por su evolución a fase acelerada y crisis blásticas. También es igualmente grave la mielofibrosis con metaplasia mieloide, que no tiene una anormalidad cromosómica clara. No obstante, la mayoría de casos de metaplasia mieloide son consecuencia de algún otro síndrome mieloproliferativo, de forma que si se corrige la patología inicial también se reduce la incidencia de mielofibrosis. En la LMC, se conoce la actividad tirosina quinasa del oncogen abl, que queda potenciado al unirse al oncogen bcr. Se han hecho ensayos para establecer los mecanismos por los que se activa el desarrollo y multiplicación de células pluripotenciales. A su vez, se han realizado ensayos con fármacos que pudieran reducir la transcripción del oncogen bcr-abl o inactivar la proteína codificada una vez formada, de forma que las células pluripotenciales no quedaran afectadas y se redujera la proliferación celular de células sanguíneas. En los últimos años se ha intentado dar respuesta a la forma en que las proteínas quiméricas Bcr-Abl desencadenan la transformación cancerosa de las células. La actividad tirosina quinasa de la proteína Abl normal está regulada por la presencia en el extremo N-terminal de los dominios SH2 y SH3. En particular, el dominio SH3 tiene efecto regulador negativo que bloquea la actividad tirosina quinasa de Abl, y cuando este bloqueo no se produce, la actividad tirosina quinasa es anormalmente elevada y proporciona la transformación neoplásica. En su extremo C terminal la proteína del gen Abl contiene el dominio DB que facilita la unión a las proteínas nucleares y ADN (6). PROTEINAQUINASA NH3+ DB SH2 SH3 -OOC Respecto a la proteína codificada por el gen Bcr normal, el extremo N-terminal contiene diversos dominios: OD (Dominio de Oligomerización), dominio serina – treonina – quinasa, y varios dominios de adaptación (como Grb2, SHC), de forma que el dominio Cterminal actúa como factor para el intercambio de GTP (Guanosin trifosfato) para la activación del gen Ras. -OOC Factor Intercambio GTP Ser - Tre Quinasa Factores Adaptación NH3+ En la proteína de fusion Bcr-Abl, los dominios N terminales de Bcr inducen la oligomerización de los dominios Abl- tirosina quinasa y además, y más importante, interfieren con la función reguladora del dominio SH3 de Abl, provocando un aumento desmesurado de la actividad tirosina quinasa de Abl. A su vez, se potencia la acción de otra proteína codificada por el oncogen Ras, cuya expresión proteica aumenta por sí misma la proliferación y diferenciación celular. Otro efecto de la proteína expresada por Bcr-Abl es la degradación proteosómica de los inhibidores de ciclo celular, como Cdk y proteína 27. El ciclo celular se vuelve muy rápido y la proliferación de células es masiva y descontrolada, liberándose las células leucémicas en sangre y facilitando su infiltración en otros tejidos. PROTEINAQUINASA + DB SH2 SH3 -OOC NH3+ Factor Intercambio GTP Ser - Tre Quinasa Factores Adaptación La comprensión de estos mecanismos ha permitido el desarrollo de fármacos que se unen a la proteína Bcr-Abl impidiendo que se una a sus receptores. El resultado ha sido el desarrollo del fármaco Imatinib (Glivec), que se une e inactiva a la proteína Bcr-Abl, actuando así como Inhibidor de la Tirosina Quinasa (ITK). Puesto que en algunos casos se desarrollan resistencias (12), se han introducido nuevos compuestos con la misma acción: Nilotinib (Tasigna)(13), Bosutinib (Bosufil)(14), Dasatinib (Sprycel)(15) y Ponatinib (Iclusig)(16). En 2005 fue descubierto el gen JAK2, responsable de actividad tirosina quinasa similar a la proteína Bcr-Abl, que fue hallada principalmente en Policitemia Vera y también en Trombocitemia Esencial y Metaplasia Mieloide. Se le denomina también Janus Kinasa 2, tirosina quinasa Jak2 o JTK10. El gen JAK2 proporciona instrucciones para codificar una proteína que promueve el crecimiento y la división (proliferación) de las células. Esta proteína es parte de una vía de señalización llamada vía JAK / STAT, que transmite señales químicas desde el exterior de la célula al núcleo de la célula. La proteína JAK2 es especialmente importante para controlar la producción de células sanguíneas a partir de células madre hematopoyéticas, convirtiéndose en glóbulos rojos, glóbulos blancos y plaquetas. La ubicación citogenética es 9p24.1, que es el brazo corto (p) del cromosoma 9 en la posición 24.1. La mutación más común (escrita como Val617Phe o V617F) reemplaza el aminoácido valina por fenilalanina en la posición 617 de la proteína. Esta mutación es la responsable de actividad tirosina quinasa aumentada y se encuentra en aproximadamente la mitad de las personas con trombocitemia esencial, mielofibrosis primaria y un 96% de casos de policitemia vera (17). Un pequeño número de individuos afectados tiene una mutación somática en otra parte del gen JAK2 conocido como exón 12. 15. Resumen. Las leucemias son procesos patológicos en los que las células sanguineas normales son reemplazadas por células inmaduras, no diferenciadas, que no cumplen su función, o se produce la proliferación selectiva o indiscriminada de células más allá de las propias necesidades del organismo. La primera anormalidad observada es la anemia y falta de distribución de oxígeno a tejidos, procesos hemorrágicos y tendencia a infecciones. En el caso de los síndromes mieloproliferativos, la causa principal es la proliferación y desarrollo de células maduras. Esta desregulación en exceso da lugar a una hipertrofia inicial de órganos relacionados con la síntesis y destrucción de células hemáticas, particularmente esplenomegalia. La proliferación en exceso de células sanguíneas afecta a la línea de células madre mieloides pluripotentes, de las que se derivan los granulocitos y monocitos, los hematíes y las plaquetas. Se podría decir que estas células han sido producidas hasta su punto final de maduración, pero se han fabricado sin el debido cuidado, no han sido “comprobadas” por el organismo (falta de apoptosis de células disfuncionales o defectuosas) y son poco fiables en su morfología y fisiología y en la realización de su función, y de ahí los síntomas de anemia, propensión a infecciones y trastornos en la hemostasia, ya sea por hipo o hipercoagulabilidad de la sangre. A modo de comparación, se podría decir que la médula ósea se convierte en una fábrica de coches que empieza una producción acelerada de éstos sin ninguna verificación ni control durante el proceso. Al final salen muchos coches, algunos sin estar acabados y la mayoría con defectos de fabricación. Los coches, en nuestra comparación las células maduras hemáticas, pueden no funcionar bien y estar mal acabados, pero aún así pasan a la circulación, es decir, al torrente sanguíneo. A su vez, puede llegar un momento que en la fábrica, es decir la médula ósea, se rompa el proceso de producción y aparecen así coches todos malos, lo que sería equivalente a una leucemia aguda o a una mielofibrosis. En el caso de que la línea celular más afectada sea la propia de granulocitos y monocitos, tiene lugar el síndrome mieloproliferativo crónico conocido como Leucemia Mieloide Crónica. (LMC), en la que suele haber más de 100000 leucocitos/mm3, principalmente leucocitos maduros, y con presencia de metamielocitos y mielocitos en sangre periférica. Tales leucocitos no protegen de la forma acostumbrada frente a infecciones, al carecer de fosfatasa alcalina granulocítica en su citoplasma. Los síntomas propios de esta enfermedad no están muy bien definidos, aunque la esplenomegalia es prácticamente siempre patente. El diagnóstico principal no se realiza por biopsia de médula ósea, aunque su observación da claves sobre éste, ya que el diagnóstico definitivo se realiza por la determinación del cromosoma Ph1 por PCR, o por técnicas de bandeo cromosómico. El cromosoma Ph1 es el cromosoma 22 tras haber quedado acortado por el intercambio de una parte grande de su brazo largo con un trozo corto del brazo largo del cromosoma 9. Esta mutación es somática, no heredada, que surge de forma idiopática o es causada por algún agente, por ejemplo, fármaco alquilante. La parte transferida del cromosoma 9 contiene el gen abl, con cierta actividad limitada de tirosina quinasa al producir proteínas que actúan con los receptores nucleares de las células, sobre todo hemáticas, para la proliferación y diferenciación celular. Al unirse con la parte que queda del cromosoma 22, en el extremo 5’ del gen bcr, se forma la quimera bcr-abl, que da lugar a expresión de una proteína que estimula enormemente la actividad tirosina quinasa, con la inducción de proliferación celular en la célula mielógena pluripotente o en la célula hematopoyética pluripotente, o con la activación de otros oncogenes como c-ras que igualmente inducen el desarrollo y diferenciación celular. El peligro principal de la LMC es su aceleración y transformación en crisis blástica, que suele tener lugar al cabo de 2 a 6 años del inicio. La estimulación de la médula ósea es tan alta que ésta ya no es capaz de sostener el proceso normal de desarrollo y maduración de las células pluripotentes, y éstas pasan a sangre periférica como blastos que sustituyen a las células maduras, incluyendo los hematíes. Al no tener oxígeno los tejidos, la muerte sobreviene a las pocas semanas. El resto de los síndromes mieloproliferativos crónicos tradicionales está constituido por policitemia vera, trombocitemia esencial y mielofibrosis con metaplasia mieloide agnogénica. En el caso de policitemia vera, las células principalmente afectadas son los hematíes, con masa eritrocitaria, hemoglobina y hematocrito muy elevado, pudiendo causar fenómenos de obstrucción de capilares, y también trombóticos (ya que también suelen estar muy elevado el número de plaquetas). En el caso de trombocitemia esencial es el número de plaquetas el que se halla realmente elevado. Son plaquetas maduras pero cuya función no ha sido verificada por el propio organismo, dando lugar tanto a fenómenos trombóticos como hemorrágicos. En el caso de la mielofibrosis, la médula se convierte en tejido fibrótico de colágeno y reticulina sin causa aparente, muchas veces con un período inicial de hiperproducción de todas las líneas de células hemáticas. Todos estos procesos pueden estar acompañados por anormalidades cromosómicas, como delecciones de brazos largos (5q en policitemia vera, por ejemplo) si bien no son patognomónicos de la enfermedad. Igualmente puede tener lugar la conversión de un proceso patológico en otro o en otro tipo de leucemia. Así la policitemia vera y la trombocitemia esencial pueden revertir una en otra, o convertirse en LMC, o dar lugar a un agotamiento de la médula ósea, con la consiguiente conversión en mielofibrosis. En los procesos descritos como síndromes mieloproliferativos distintos de LMC, al igual que en ésta, se ha descrito una mutación, que se halla en el gen JAK2. Este gen está localizado en el cromosoma 9 y tiene actividad tirosina quinasa limitada. La mutación V617F provoca un aumento muy importante en la actividad tirosina quinasa, con la estimulación de la célula mielógena pluripotente para producir los distintos tipos de células. Este hecho es principalmente observable en el incremento de producción de hematíes, puesto que esta mutación se halla presente en el 96% de todas las policitemia vera. También puede verse incrementada la producción de plaquetas o sustitución del tejido hemático por fibroso, puesto que esta mutación se halla también en el 60% de las trombocitemias esenciales o de las mielofibrosis . Salvo en el caso de la mielofibrosis con metaplasia mieloide, el mielograma tiene importancia diagnóstica relativa. El diagnóstico se realiza usualmente a partir de los elementos celulares del hemograma de la sangre periférica, según el tipo de elementos celulares incrementados en cantidad, el que lleva al diagnóstico: leucocitos (LMC), hematíes (Policitemia Vera) o plaquetas (Trombocitemia esencial). No obstante, en los tres casos suele haber anemia normocítica, normocrómica, con anisocitos, poiquilocitos, punteado basófilo y células en forma de lágrima. Las plaquetas aparecen grandes y multilobuladas. A diferencia de la LMC en donde la fosfatasa alcalina granulocítica está disminuida o inexistente, en los demás síndromes mieloproliferativos suele ser normal o elevada, sobre todo en la policitemia vera. En general, todos los síndromes mieloproliferavos cursan con cierto grado de esplenomegalia, si bien es mucho más notoria en la LMC. Los análisis de sangre rutinarios muestran el exceso de formación de células hemáticas. Están usualmente elevados LDH, ácido úrico, vitamina B12 y transcobalaminas. El hierro y ferritina suelen estar reducidos. Las plaquetas no se agregan bien con adrenalina. Se pueden presentar fenómenos hematológicos e inmunológicos, como test de Coombs directo y anticuerpos antinucleares positivo, y pueden estar elevados los enzimas y metabolitos hepáticos, sobre todo cuando hay hepatomegalia (fosfatasa alcalina, transaminasas, bilirrubina). El tratamiento va encaminado a tratar de controlar el número de células producidas en exceso y sobre todo intentar evitar la transformación a patología mucho más letal, como LMC a crisis blástica o policitemia vera a mielofibrosis o a LMC y después a leucemia aguda. Hay fármacos comunes para los síndromes mieloproliferativos que incluyen a busulfán, hidroxiurea, anagrelida y alfa interferón. En el caso de policitemia vera, muchas veces basta la simple flebotomía; un tratamiento clásico es con 32P, si bien ahora se reserva para personas de más de 70 años. Cuando hay transformación a crisis blástica, leucemia aguda o mielofibrosis, el tratamiento de elección es el transplante alogénico de médula ósea. En los últimos años se ha podido sintetizar la proteína codificada por el gen quimérico bcr-abl, y se han podido desarrollar medicamentos que se unen a esta proteína, inhibiendo su actividad tirosina quinasa. El primer fármaco que ha conseguido esta anulación de la proteína bcr-abl es el imatinib (Glivec) al que han seguido otros similares, que ya se han empleado por sí mismos o cuando se ha desarrollado resistencia a imatinib. BIBLIOGRAFIA. (1) (2) (3) (4) (5) Robbins, SL y Kumar V. “Capítulo 12: Sistemas Hematopoyético y Linfoide. Trastornos de glóbulos blancos”, pp. 375 – 401 en Robbins, SL y Kumar, V. “Patología Humana”, Interamericana – McGraw Hill, 4ª edición, México, 1990. ISBN. 9682513952. Dameshek, W. “Some speculations on the myeloproliferative síndromes”. Bllood, 1951; 6: 372 – 375. Steegmann Olmedillas, J.L y Martin Regueira, P. “Síndromes Mieloproliferativos. Leucemia Mieloide Crónica”.Medicine, 2001; 8: 2755 – 2763. Nowell P., Hungerford D. A minute chromosome in human chronic granulocytic leukemia [abstract]. Science. 1960; 132:1497. Davey, FR y Nelson DA. “Capítulo 27: Trastornos leucocitarios”, pp.699 – 738 en Henry, JB “Diagnóstico y Tratamientto Clínicos por el Laboratorio”, Masson – Salvat Medicina, 9ª edición, Barcelona, 1993, ISBN. 8445800469. (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) López Tricas, JM. “Iclusig: Nuevo Fármaco contra la Leucemia”. Disponible en http://www.info-farmacia.com/medico-farmaceuticos/informes-tecnicos/iclusigponatinib-nuevo-farmaco-contra-la-leucemia-mielogena De Miguel Llorente, D; García Suarez, J; López Rubio, M y Burgaleta Alonso de Ozalla, C. Síndromes Mieloproliferativos Crónicos No Leucémicos (I). Medicine, 2001; 8: 2764 – 2769. Nagalla V Polictemia Vera Workup. Approach Considerations. Disponible en https://emedicine.medscape.com/article/205114-workup#c1 (Requiere registro), 2019. Labardini Méndez, JR “Capítulo 14: Procedimientos Mieloproliferativos Crónicos y Mielofibrosis”, pp. 209 – 222 en Ruiz Argüelles, GJ. Fundamentos de Hematología, Editorial Médica Panamericana, 2ª edición, México, 1998. ISBN: 9687157925. García Suárez, J; de Miguel Llorente, D.; López Rubio, M, y Burgaleda Alonso de Ozalla, C. Síndromes Mieloproliferativos Crónicos No Leucémicos (II). Medicine, 2001; 8: 2770 – 2775. Gómez Almaguer, D “Capítulo 13: Leucemias Crónicas”, pp. 198 – 208, en Ruiz Argüelles, GJ. Fundamentos de Hematología, Editorial Médica Panamericana, 2ª edición, México, 1998. ISBN: 9687157925. Osborn M y Hughes T. Managing Imatinib Resistance in Chronic Myeloid Leukaemia, Curr Opin Hematol, 2010; 17: 97 – 103. Breccia, M; Alimena G. Nilotinib: a second – generation tyrosine kinase inhibitor for chronic myeloid leukemia. Leuk Res, 2010; 34: 129 -134. Cortes, JE et al. Bosutinib Versus Imatinib in Newly Diagnosed Chronic – Phase Chronic Myeloid Leukemia: Results from the BELA trial. J. Clin. Oncol, 2012; 30. 3486 – 92 Keam, SJ. Dasatinib: In Chronic Myeloid Leukemia and Philadelphia Chromosome – Positive Acute Lymphoblastic Leukemia. BioDrugs, 2008; 22: 59 – 69.. Cortés JE, Kim DW, Pinilla-Ibarz J, le Coutre P, Paquette R, Chuah C, et al; PACE Investigators. A phase 2 trial of ponatinib in Philadelphia chromosomepositive leukemias. N Engl J Med. 2013; 369(19): 1783-96. James C; Delhommeau F; Marzac C; Teyssandier I; Le Couédic J-P; Giraudier S; Roy L; Saulnier P; Lacroix L; Maury S; Tulliez M; Vainchenker W; Ugo V y Casadevall N. Detection of JAK2 V617F as a first intention diagnostic test for erythrocytosis. Leukemia 2006; 20: 350 – 353.