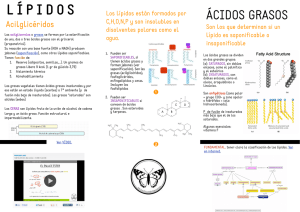
TEMA 4: LIPIDOS Los lípidos consisten de un grupo muy amplio de compuestos que son generalmente solubles en solventes orgánicos y escasamente solubles en agua. Ellos son componentes mayores de los tejidos adiposos, y junto con las proteínas y los carbohidratos, constituyen los componentes estructurales principales de todas las células vivientes. Los esteres del glicerol con los ácidos grasos componen hasta el 99% de los lípidos de plantas y de origen animal, y han sido denominados tradicionalmente grasas y aceites. Los lípidos de alimentos son consumidos bien sea en la forma de grasas “visibles”, los cuales han sido separados de su fuente vegetal o animal, tales como mantequilla, manteca o aceites para ensaladas, o como constituyentes de alimentos básicos, tales como leche, queso o carne. El mayor suministro de aceites vegetales vienen de semillas de soya, algodón y de maní, o de palma aceitera, de coco y de oliva. Los lípidos en los alimentos exhiben propiedades fisicas y químicas únicas. La composición, estructura cristalina, comportamiento de fusión y solidificación y asociación con el agua y otras moléculas no lipídicas son especialmente importantes en relación a las varias propiedades de textura que imparten, y a su funcionabilidad en productos confeccionarios y de panadería, y en muchos otros productos que son cocinados. Ellos sufren cambios químicos y reacciones complejas con otros constituyentes de los alimentos, produciendo numerosos compuestos tanto deseables como deletéreos a la cantidad del alimento. Los lípidos en la dieta juegan un papel importante en la nutrición. Ellos suministran calorías y ácidos grasos esenciales, actúan como portadores de vitaminas, e incrementan el gusto al paladar de los alimentos, pero por décadas han sido el centro de controversia con respecto a la toxicidad y enfermedad. Más del 99% de los ácidos grasos que se encuentran en las plantas y los animales están esterificados en glicerol. Los ácidos grasos libres no son comunes en los tejidos vivos porque son citotóxicos debido a su capacidad de alterar la organización de la membrana celular. Una vez que los ácidos grasos se esterifican en glicerol, su actividad superficial disminuye, al igual que su citotoxicidad. Los acilgliceroles pueden existir como mono, di y triésteres, conocidos como monoacilgliceroles, diacilgliceroles y triacilgliceroles, respectivamente. Los triacilgliceroles son los más comunes de los tres en los alimentos, aunque los mono y diésteres se utilizan a veces como aditivos alimentarios (por ejemplo, emulsionantes). El carbono central de un triacilglicerol presenta quiralidad si hay diferentes ácidos grasos en los carbonos terminales del glicerol. Por ello, los tres carbonos de la porción de glicerol del triacilglicerol pueden diferenciarse con una numeración estereoespecífica (sn). Si el triacilglicerol se muestra en una proyección plana de Fischer, los carbonos se numeran del 1 al 3 de arriba a abajo. Los acilgliceroles o glicéridos son ésteres de ácidos grasos con glicerol (propanotriol). Constituyen el contingente mayoritario de los lípidos de reserva energética, y son muy abundantes en el tejido adiposo animal y en las semillas y frutos de las plantas oleaginosas. El glicerol o propanotriol presenta tres grupos alcohólicos, y por tanto puede aparecer esterificado en una, dos o tres posiciones, dando lugar respectivamente, a monoacilgliceroles (monoglicéridos), diacilgliceroles (diglicéridos) y triacilgliceroles (triglicéridos). En su inmensa mayoría se presentan como triésteres, aunque los mono y diacilgliceroles aparecen esporádicamente como intermediarios en la biosíntesis o degradación de triglicéridos, o como segundos mensajeros hormonales. Los triglicéridos son moléculas muy hidrofóbicas, mientras que los mono y diacilgliceroles presentan carácter anfipático debido a los grupos OH no esterificados. La esterificación de Fischer convierte de manera directa a los ácidos carboxílicos y a los alcoholes en ésteres por medio de una sustitución nucleofílica sobre el grupo acilo catalizada por ácido. La reacción neta reemplaza al grupo -OH del ácido por el grupo -OR del alcohol. El carbono carboxílico no recibe letra. Se empieza a nombrar desde el carbono 2, al cual se le asigna la letra α; al carbono 3 se le otorga la letra β (de donde proviene el término β-oxidación, que es la ruta metabólica de degradación de los ácidos grasos en la matriz mitocondrial). CLASIFICACION En la tabla 1 se presenta una clasificación general de los lípidos en funcion de sus componentes estructurales. Tabla 1. Clasificación de los lípidos Mayores clases Lípidos simples Sub-clase Acil gliceroles ceras Lípidos compuestos Fosfoacilgliceroles (o glicerolfosfolípidos) Esfingomielinas Cerebrósidos Gangliósidos Lípidos derivados Materiales que cumplen con la definición de lípido, pero no son lípidos simples ni compuestos Descripción Glicerol + ácidos grasos Alcohol de cadena larga + ácido graso de cadena larga Glicerol + ácidos grasos + fosfato + otro grupo que contiene usualmente nitrógeno Esfingosina + ácido graso + fosfato + colina Esfingosina + ácido graso + azúcar simple Esfingosina + ácido graso + carbohidrato complejo que incluye ácido siálico Ejemplos carotenoides, esteroides, vitaminas solubles en grasa Los fosfolípidos o fosfoglicéridos son modificaciones de los triacilgliceroles donde los grupos fosfato se encuentran típicamente en la posición sn-3 (véase la figura 4.3 para las estructuras de los fosfolípidos). El fosfolípido más sencillo es el ácido fosfatídico (AF), en el que el grupo de sustitución del fosfato en sn-3 es un – OH. Otras modificaciones del grupo de sustitución del fosfato en sn-3 dan lugar a fosfatidilcolina (PC), fosfatidilserina (PS), fosfatidiletanolamina (PE) y fosfatidilinositol (PI). Los esfingolípidos son lípidos que comúnmente contienen una base de esfingosina. Los esfingolípidos más comunes incluyen la esfingomielina (un esfingofosfolípido; Figura 4.4), las ceramidas, los cerebrósidos y los gangliósidos. Estos lípidos se encuentran más comúnmente asociados a las membranas celulares, especialmente en el tejido nervioso. Por lo general, no son componentes principales de los lípidos alimentarios La esfingosina es un aminoalcohol formado por 18 carbonos, que forman una cadena hidrocarbonada insaturada. Al unirse a un ácido graso mediante un enlace amida por su grupo amino, forma las ceramidas, unidad estructural de los distintos tipos de esfingolípidos Dentro de los lípidos insaponificables hay un grupo que son los terpenos que son polímeros de la molécula de isopreno, por lo que también se llaman isoprenoides, y según el número de isoprenos que componen el terpeno se clasifican en monoterpenos, diterpenos, triterpenos, teraterpenos y politerpenos. Dentro de los tetraterpenos, que están formados por ocho moléculas de isopreno destacan un grupo denominado carotenoides. Los esteroides son lípidos insaponificables por no contener ácidos grasos. Se denominan lípidos insaponificables porque no contienen ácidos grasos en su composición; por ello no pueden realizar la reacción de saponificación, es decir, no pueden formar jabones. Las clase mas abundante de lípidos de alimentos son los acilgliceroles, los cuales dominan la composición de grasas y aceites animales o vegetales. Los acilgliceroles son tradicionalmente clasificados entre los siguientes subgrupos. A. Grasas de la leche: las grasas de este grupo se derivan de la leche de rumiantes, particularmente de vacas. Aunque los ácidos grasos predominantes de la leche son palmítico, oleico y esteárico, esta grasa es única entre las grasas animales ya que contiene cantidades apreciables de ácidos de cadenas más corta, de C4 a C12, y pequeñas cantidades de ácidos ramificados y de número impar de átomos de carbono. B. Grasas del ácido láurico: las grasas de este grupo se derivan de ciertas especies de palma, tal como la palma de coco. Estas grasas están caracterizadas por su alto contenido de ácido láurico (40-50%), cantidades moderadas de ácidos grasos C6, C8 y C10, un bajo contenido de ácidos grasos insaturados, y un punto de fusión relativamente bajo. C. Grasas vegetales: las grasas de este grupo se derivan de las semillas de varios arboles tropicales y se distinguen por un rango angosto de fusión, el cual es debido principalmente al arreglo de los ácidos grasos en sus moléculas de triacilglicerol. A pesar de una proporción grande de ácidos grasos saturados a insaturados, no contienen glicéridos trisaturados. Las grasas vegetales son usadas extensivamente en la manufactura de confecciones, siendo la manteca de cacao el miembro más importante de este grupo. D. Grasas de los ácidos oleico y linoléico: las grasas de este grupo son las más abundantes. Los aceites son todos de origen vegetal y contienen grandes cantidades de los ácidos oleico y linoléico, y menos del 20% de ácidos grasos saturados. Los miembros más importantes de este grupo son los aceites de semilla de algodón, maíz, maní, semilla de girasol, cártamo, oliva, palma y sésamo. E. Grasas del ácido linolénico: las grasas de este grupo contienen cantidades sustanciales de ácido linolénico. Ejemplos son los aceites de soya, germen de trigo y cañamón, siendo el de soya el más importante. La abundancia de ácido linolénico en estos aceites es responsable del desarrollo de un olor desagradable, un problema que se conoce como reversión de sabor. F. Grasas animales: este grupo consiste de grasas de depósito de animales terrestres domésticos (por ejemplo, manteca y cebo), todas conteniendo grandes cantidades de ácidos grasos C16 y c18, cantidades medianas de ácidos grasos insaturados, la mayoría oleico y linoléico, y pequeñas cantidades de ácidos con número impar de átomos de carbono. Estas grasas contienen también cantidades apreciables de triacilgliceroles completamente saturados y exhiben puntos de fusión relativamente elevados. G. Aceites marinos: estos aceites contienen típicamente grandes cantidades de ácidos grasos poliinsaturados de cadena larga, con hasta seis dobles enlaces, y son usualmente ricos en las vitaminas A y D. debido a su alto grado de insaturación, son menos resistentes a la oxidación que ocurre en los aceites insaturados, a diferencias de otros aceites animales o vegetales. REACCIONES QUIMICAS: A. Lipolisis: la hidrolisis de los enlaces de esteres en lípidos puede ocurrir por acción enzimática o por la acción del calor y la humedad, resultando en la liberación de ácidos grasos libres. Los ácidos grasos libres están virtualmente ausentes en la grasa del tejido de animales vivientes. Sin embargo, ellos se pueden formar por acción enzimática después del sacrificio del animal. Debido a que las grasas de animales comestibles no son usualmente refrigeradas para reducir su contenido de ácidos grasos libres, una pronta clasificación es de particular importancia. Las temperaturas comúnmente usadas en el proceso de clasificación son capaces de inactivar a las enzimas responsables de la hidrolisis. La liberación de ácidos grasos de cadena corta por hidrolisis es responsable del desarrollo de un sabor rancio (rancidez hidrolítica) en leche cruda. Por otra parte, ciertos sabores típicos en quesos son producidos por la adición deliberada de lipasas microbianas y lácteas. Las lipolisis controlada y selectiva es usada también en la fabricación de otros alimentos, tales como yogurts y pan. En contraste con las grasas animales, los aceites en semillas maduras pueden sufrir hidrolisis sustancial para el tiempo en que son cosechadas, dando lugar a cantidades significantes de ácidos grasos libres. La neutralización con álcalis es así requerida para la mayoría de los aceites vegetales después de ser extraídos. La lipolisis es una reacción mayor que ocurre durante la fritura, debido a las grandes cantidades de agua introducidas desde el alimento, y a las temperaturas relativamente altas a las cuales el aceite es mantenido. El desarrollo de altos niveles de ácidos grasos libres en el curso de la fritura es asociado usualmente con la disminución en el punto de humo y de la tensión superficial del aceite y en una reducción en la calidad del alimento frito. Es más, los ácidos grasos libres son más susceptibles a la oxidación que los ácidos grasos esterificados al glicerol. La lipolisis enzimática se usa extensivamente como una herramienta analítica en la investigación de lípidos B. Autooxidacion: la oxidación de lípidos es una de las mayores causas de descomposición de alimentos. Es de una gran importancia económica para la industria de alimentos debido a que conduce al desarrollo, en aceites comestibles y alimentos que contienen grasa de varios sabores y olores desagradables, generalmente denominados como rancio, los cuales dejan a estos alimentos inaceptables o reducen su tiempo de vida. Además, las reacciones oxidativas pueden disminuir la calidad nutricional del alimento, y ciertos productos de la oxidación son potencialmente tóxicos. Por otra parte, un grado limitado de oxidación de lípidos bajo ciertas condiciones, algunas veces es deseable, como en la producción de aromas a quesos típicos o alimentos fritos. Se está generalmente de acuerdo con que la “autooxidacion”, la cual es la reacción con oxígeno molecular, es la reacción principal involucrada en el deterioro oxidativo de lípidos, aunque pueden estar presentes reacciones fotoquímicas. En los alimentos, los lípidos pueden ser oxidados tanto por mecanismos enzimáticos como no enzimáticos. 1. Caracteristicas generales de la reacción de autooxidación: Hay mucha evidencia de que la autooxidacion de grasas procede a través de mecanismos de radicales libres como es caracterizado por: a) Inhibición marcada de la velocidad por especies químicas que se conocen que interfieren con otras reacciones de radicales libres bien establecidas. b) Catálisis por la luz y por sustancias que producen radicales libres c) Alta producción de hidroperóxidos, ROOH. d) Producción de cuantos que exceden la unidad cuando las reacciones de oxidación son iniciadas por la luz e) Un periodo de inducción relativamente largo observado cuando se comienza con el sustrato puro. En base a resultados experimentales, la mayoría con linoleato de etilo, la tasa de absorción de oxigeno se puede expresar como: 𝑡𝑎𝑠𝑎 = − 𝑑[𝑂2 ] 𝐾𝑎[𝑅𝐻][𝑅𝑂𝑂𝐻] = 𝑑𝑡 1 + 𝜆[𝑅𝐻]/𝑝 Dónde: RH=ácido graso que actúa como sustrato (H es un átomo de hidrogeno α-metilénico fácilmente removible debido a la influencia activante de dobles enlaces vecinos. ROOH = hidroperóxido formado. P = presión de oxigeno Λ y Ka = constantes empíricas. Para explicar los resultados experimentales se ha propuesto el siguiente mecanismo de radicales libres, simplificando en tres etapas: a) Mecanismo de autoxidación: se produce vía radicales libres. - Iniciación: - Propagación: - Terminación Con la oxidación de los radicales libres en combinación con otros ácidos grasos, se van formando hidroperóxidos y más radicales libres, que vuelven a entrar en la cadena de oxidación. Los hidroperóxidos por su parte, con la incidencia de la energía, forman grupos oxidrilo y la forma oxidada de los radicales libres, los cuales junto a otros ácidos grasos dan lugar a más hidroperóxidos y nuevos radicales libres. Por último, los grupos oxidrilo junto a otros ácidos grasos liberan agua y nuevos radicales libres expuestos a una nueva oxidación. Hay gran cantidad de compuestos reactivos e interaccionar entre ellos. La concentración de radicales peróxidos se reduce (empieza a estabilizarse la formación de productos deteriorados). Dada la estabilidad de los productos originados en las reacciones de terminación, se termina la actividad de oxidación. En la autooxidación de las grasas continúa interviniendo un radical libre y la acción de la temperatura y de la luz. La formación de nuevas cadenas favorecen la aceleración de la reacción global, además la capacidad de reacción se favorece en presencia de determinados metales como cobre y hierro. La figura 4.22 muestra los pasos de iniciación para la abstracción de hidrógeno del carbono interrumpido por el metileno del ácido linoleico con reordenamiento del doble enlace que produce dos isómeros. Cuando se abstrae el hidrógeno del ácido oleico, el radical alquilo puede existir en cuatro ubicaciones: La facilidad de formación de los radicales de los ácidos grasos aumenta con el incremento de la insaturación. La energía de disociación del enlace covalente carbono-hidrógeno en una cadena alifática es de 98 kcal mol-1. Si un átomo de carbono es adyacente a un doble enlace rico en electrones, el enlace covalente carbonohidrógeno se debilita y la energía de disociación del enlace disminuye a 89 kcal mol-1. En los ácidos grasos poliinsaturados los dobles enlaces están en una configuración de pentadieno con un carbono interrumpido por el metileno (figura 4.24) Como el enlace covalente carbono-hidrógeno del carbono interrumpido por el metileno está debilitado por dos dobles enlaces, su energía de disociación del enlace es aún más baja, 80 kcal mol-1. Mas suceptible a la autoxidacion Se ha estimado que el ácido linoleico (18:2) es de 10 a 40 veces más susceptible a la oxidación que el ácido oleico (18:1). Cuando se añaden dobles enlaces adicionales a los ácidos grasos poliinsaturados, se añade un carbono adicional interrumpido por el metileno que produce otro lugar para la abstracción de hidrógeno. Por ejemplo, el linoleico (18:2) tiene un carbono interrumpido por el metileno, mientras que el linolénico (18:3) tiene dos y el araquidónico (20:4) tiene tres (Figura 4.24). En la mayoría de los casos, las tasas de oxidación se duplican con la adición de un carbono interrumpido por el metileno. Así, el linolénico se oxida el doble de rápido que el linoleico y el araquidónico se oxida dos veces más rápido que el linolénico (cuatro veces más rápido que el linoleico). A una presión alta de oxígeno, λ[RH]/p es mucho menor que 1, y las reacciones (4( y (5) pueden ser despreciadas para dar: 1⁄ 2 𝑘1 𝑡𝑎𝑠𝑎 = 𝑘3 ( ) 𝑘6 [𝑅𝑂𝑂𝐻][𝑅𝐻] Así, la tasa de absorción de oxigeno es independiente de la presión de oxígeno. A una presión de oxigeno baja, λ[RH]/p es mayor que 1, y las reacciones (5) y (6) pueden ser despreciadas para dar: 1⁄ 2 𝑘1 𝑡𝑎𝑠𝑎 = 𝑘2 ( ) 𝑘4 [𝑅𝑂𝑂𝐻][𝑂2 ] Debido a que la reacciones 𝑅𝐻 + 𝑂2 → 𝑅𝑎𝑑𝑖𝑐𝑎𝑙𝑒𝑠 𝑙𝑖𝑏𝑟𝑒𝑠, es termodinámicamente difícil (Ea≅35 kcal/mol), la producción de los primeros pocos radicales necesarios para comenzar la reacción de propagación, normalmente debe ocurrir por algunos medios catalíticos. Se ha propuesto que la etapa de iniciación puede tomar lugar por medio de la descomposición de hidroperóxidos, por catálisis por metales, o por exposición a la luz. También se ha propuesto que el oxígeno singlote es la especie activa involucrada, con pigmentos de plantas y tejidos, tales como la clorofila o la mioglobina, actuando como sensitizadores. Una vez que se forman suficientes radicales libres, la cadena de reacción es propagada por la abstracción de átomos de hidrogeno en posiciones α a dobles enlaces (𝑅𝐻 → 𝑅 • +𝐻 •) Los hidroperóxidos, los productos iniciales primarios de la autooxidacion de lípidos, son relativamente inestables. Ellos entran en numerosos mecanismos complejos de ruptura e interacción responsables de la producción de una miríada de compuestos de diferentes pesos moleculares, sabores y significancia biológica. En la figura 1, se da un esquema general que resume el cuadro global de la autoxidacion de lípidos y algunos aspectos de la secuencia de reacciones. 2. Formación de hidroperóxidos: El análisis cualitativo y cuantitativo de los hidroperóxidos isoméricos que se derivan de oleato, linoleato y linolenato se han realizado a través del uso de herramientas analíticas modernas. En el caso del oleato, la abstracción de hidrogeno en los carbono 8 y 11 resulta en la formación de dos radicales alílicos intermedios. El ataque del oxígeno a los carbonos terminales de cada radical produce una mezcla isomérica de hidroperóxidos alílicos 8-, 9-, 10- y 11. Figura 1. Esquema generalizado de la autooxidacion de lípidos A continuación, se muestran los hidroperóxidos que se forman a partir del oleato. Las cantidades de los 8- y 11-hidroperoxidos formados son ligeramente mayor que los isómeros 9- y 10-. A 25 C, las cantidades de los 8y 11- hidroperóxidos cis y trans son similares, pero los isómeros 9- y 10- son principalmente trans. 3. Oxidación de sistemas biológicos: En sistemas biológicos, incluyendo alimentos, las moléculas de lípidos casi siempre existen en un estado altamente ordenado, están relativamente restringidos en términos de la distancia entre moléculas y movilidad, y están íntimamente asociados con material vecino no lipídico, tales como proteínas, carbohidratos, agua, enzimas, sales, vitaminas y pro- y antioxidantes. La composición de los lípidos, el grado de su orden molecular y su asociación con componentes no-lipídicos varia considerablemente dependiendo de la especie vegetal o animal y de la ubicación del lípido dentro del organismo individual. Obviamente, las consecuencias y mecanismos de las reacciones oxidativas en tales sistemas naturales pueden ser muy diferentes de aquellos que se producen en modelos puros en estado líquido. 4. Técnicas utilizadas para la medición de la oxidación de lípidos: Algunos de los métodos comúnmente usados son los siguientes: valor de peróxidos; ensayo del ácido tiobarbitúrico (TBA); compuestos carbonilos volátiles y totales; valor de Anisidina; ensayo de Kreis; espectro fotometría ultravioleta; ensayo del oxirano; valor de iodo; fluorescencia; métodos cromatográficos; evaluación organoléptica. También estas disponibles varios ensayos “acelerados” para medir la resistencia de un lípido a la oxidación bajo condiciones severas: ensayo del horno de Schaal; método del oxígeno activo (AOM); método de la bamba de oxigeno; absorción de oxígeno. Debido a que la oxidación de lípidos es un proceso muy complejo que involucra numerosas reacciones que dan lugar a una variedad de cambios físicos y químicos, un solo ensayo puede monitorear solamente uno o unos pocos cambios físicos que pueden proveer información importante para sistemas especificos y bajo condiciones específicas. Por lo tanto, se puede obtener una mayor confiabilidad cuando se emplea una combinación de varios ensayos. 5. Factores que afectan la tasa de oxidación de lípidos en alimentos: Las grasas de los alimentos contienen mezclas de ácidos grasos que difieren significantemente en susceptibilidad a la oxidación. Además, los alimentos contienen numerosos componentes no lipídicos que afectan la tasa de oxidación de lípidos. Por lo tanto, un análisis preciso de la cinética de oxidación en los alimentos es prácticamente imposible. Los factores involucrados son los siguientes. a. Composición de ácidos grasos: el número, posición y geometría de los dobles enlaces afectan la tasa de oxidación. Las tasas relativas de oxidación para los ácidos araquidónico, linolénico, linoléico y oleico son aproximadamente 40:20:10:1, respectivamente. Los ácidos cis se oxidan más fácilmente que sus isómeros trans, y los dobles enlaces conjugados son más reactivos que los no conjugados. La autooxidacion de ácidos grasos saturados es extremadamente lenta; a temperatura ambiente, ellos permanecen prácticamente sin cambio cuando la rancidez oxidativa de los insaturados es detectable. Sin embargo, a temperaturas elevadas, los ácidos saturados pueden sufrir cambios oxidativos significantes. b. Ácidos grasos libres en comparación a sus Acilgliceroles correspondientes: los ácidos grasos se oxidan a una tasa ligeramente mayor cuando están libres que cuando están esterificados al glicerol. La existencia en una grasa o aceite de una pequeña cantidad de ácidos grasos libres no tiene un efecto marcado sobre la estabilidad oxidativa. Sin embargo, en algunos aceites comerciales, la presencia de cantidades relativamente grandes de ácidos libres puede incrementar la incorporación de metales catalíticos en trazas desde el equipo o tanques de almacenamiento que incrementan la tasa de oxidación de lípidos. c. Concentración de oxigeno: si el suministro de oxígeno es ilimitado, la tasa de oxidación es independiente de la presión de oxígeno, pero a una presión de oxigeno muy baja, la tasa de oxidación es aproximadamente proporcional a la presión de oxígeno. Sin embargo, el efecto de la presión de oxigeno sobre la tasa de oxidación es influenciado por otros factores, tales como la temperatura y el área superficial. d. Temperatura: en general, la tasa de oxidación incrementa en la medida que incrementa la temperatura. La temperatura es importante también en términos del efecto de la presión parcial de oxigeno sobre la tasa de oxidación. En la medida que se incrementa la temperatura, el incremento en la tasa de oxidación con el incremento en la concentración de oxigeno se hace menos evidente, ya que el oxígeno se hace menos soluble en la medida que la temperatura es elevada. e. Área superficial: la tasa de oxidación incrementa en proporción al área superficial de un lípido expuesto al aire. Sin embargo, en la medida que aumenta la relación superficie-volumen, la reducción de la presión parcial de oxigeno se hace menos efectiva para disminuir la tasa de oxidación. En emulsiones aceite en agua la tasa de oxidación es gobernada por la tasa a la cual el oxígeno se difunde dentro de la fase de aceite. El aumento de la superficie de los lípidos puede incrementar las tasas de oxidación de los mismos, ya que esto puede aumentar la exposición al oxígeno y a los prooxidantes. f. Humedad: en estudios de sistemas modelos de lípidos y varios alimentos que contienen grasa, se ha demostrado que la tasa de oxidación depende fuertemente de la actividad del agua. En alimentos secos con contenidos de humedad muy bajos (aw<0.1), la oxidación procede muy rápidamente. Incrementando el contenido de agua a un aw de aproximadamente 0.3 retarda la oxidación de lípidos y casi siempre produce una tasa mínima. El efecto protectivo del agua se cree que ocurre por reducción de la actividad catalítica de metales, por el secuestro de radicales libres, por la promoción del oscurecimiento no enzimático, el cual produce compuestos con actividad antioxidante, y/o impidiendo el acceso del oxígeno al alimento. A actividades de agua algo mayores, aw= 0.55 – 0.85, la tasa de oxidación incremente otra vez, probablemente como un resultado de la movilización incrementada del catalizador presente. g. Pro-oxidantes: los metales de transición, particularmente aquellos que poseen dos o más estados de valencia con un potencial apropiado de oxidación-reducción entre ellos (por ejemplo, cobalto, cobre, hierro, manganeso y níquel) son pro-oxidantes mayores. Si estas presentes, aun a concentraciones tan bajas como 0.1 ppm, ellos pueden disminuir la longitud del periodo de inducción e incrementar la tasa de oxidación. Cantidades en trazas de metales pesados se encuentran en la mayoría de los aceites comestibles y ellos se originan del suelo donde la planta ha crecido, del animal, o del equipo metálico utilizado en el procesamiento o almacenamiento. Los metales en trazas son también componentes naturales de los tejidos de todos los alimentos y de todos los alimentos fluidos de origen biológico (huevos, leche y jugos de frutas), estando presentes tanto en forma libre como enlazada. 6. Antioxidantes: Los antioxidantes son sustancias que pueden retardar el comienzo o disminuir la tasa de oxidación de materiales autooxidable. Se han reportado cientos de compuestos, tanto naturales como sintéticos, que poseen literalmente propiedades antioxidantes. Sin embargo, su uso en alimentos está limitado por ciertos requerimientos obvios relacionados con la seguridad del alimento. Los principales antioxidantes usados corrientemente en alimentos son polifenoles con varias sustituciones en el anillo (ver figura 2). Para una máxima eficiencia, los antioxidantes primarios son utilizados en combinación con otros antioxidantes fenólicos o con varios agentes secuestrantes de metales (ver tabla 2). Aunque se conoce mucho en relación a los mecanismos mediantes los cuales muchos antioxidantes imparten estabilidad a aceites puros, se necesita mayor investigación para aclarar su funcion en alimentos complejos. Figura 2. Mayores antioxidantes usados en alimentos Tabla 2. Antioxidantes permitidos en alimentos Antioxidantes primarios Tocoferoles Goma Guaiac Galato de propilo Hidroxianisol butilado (BHA) Hidroxitolueno butilado (BHT) 2,4,5-trihidroxibutirofenona (THBP) 4-hidroximetil-2,6.ditercbutilfenol Tercbutilhidroquinona (TBHQ) Sinergistas Ácido cítrico y citrato de isopropil Ácido fosfórico Ácido tiodipropiónico y sus esteres de didodecilo, dilauliro y dioctadecilo Ácido ascórbico y palmitato de ascorbilo Acido tartárico, lecitina a. Efectividad y mecanismos de acción: una sustancia retarda la reacción de autooxidacion si inhibe la formación de radicales libres en la etapa de iniciación o si interrumpe la propagación de la cadena de radicales libres. La iniciación de radicales libres puede ser retardada por el uso de sustancias que descomponen a los peróxidos o agentes quelantes de metales o inhibidores del oxígeno singlete. Sin embargo, trazas de peróxidos y metales iniciadores no pueden ser eliminados completamente. Usando como modelo la autoxidacion del linoleato de etilo en presencias de hidroquinona como inhibidor (donador de hidrógenos o aceptor de electrones, AH), produce el siguiente mecanismo: 𝑅𝑂2 • +𝐴𝐻 → 𝑅𝑂𝑂𝐻 + 𝐴 • AH: es el antioxidante que dona su H. El radical A• es un radical mas estable Este mecanismo se puede representar en dos etapas: 𝑅𝑂𝑂 • +𝐴𝐻2 → 𝑅𝑂𝑂𝐻 + 𝐴𝐻 • 𝐴𝐻 • +𝐴𝐻 • → 𝐴 + 𝐴𝐻2 Otro mecanismo propuesto es el siguiente: 𝑅𝑂𝑂 • +𝐼𝑛ℎ → [𝑅𝑂𝑂 − 𝐼𝑛ℎ] [𝑅𝑂𝑂 − 𝐼𝑛ℎ] + 𝑅𝑂𝑂 • → 𝑝𝑟𝑜𝑑𝑢𝑐𝑡𝑜𝑠 𝑒𝑠𝑡𝑎𝑏𝑙𝑒𝑠 El mecanismo básico se puede visualizar como una competencia entre la “reacción del inhibidor”: 𝑅𝑂𝑂 • +𝐴𝐻 → 𝑅𝑂𝑂𝐻 + 𝐴 • Y la reacción de propagación de la cadena: 𝑅𝑂𝑂 • +𝑅𝐻 → 𝑅𝑂𝑂𝐻 + 𝑅 • La efectividad de un antioxidante está relacionada con muchos factores, incluyendo la energía de activación, las constantes de velocidad, el potencial de oxidación-reducción, de la facilidad de perdida de antioxidante o destrucción del mismo y de propiedades de solubilidad. b. Sinergismo: ocurre sinergismo cuando una mezcla de antioxidantes produce una actividad mas pronunciada que la suma de las actividades de los antioxidantes individuales cuando son usados por separado. Se reconocen dos categorías de sinergismo. Una involucra la acción de una mezcla de aceptores de electrones; la otra involucra la acción combinada de un aceptor de radicales libres y un agente quelante de metales. Sin embargo, casi siempre es el caso que el así llamado sinergista pueda jugar mas de un papel. Por ejemplo, el ácido ascórbico, puede funcionar como un donante de electrones, un quelante metálico, un secuestrador de oxígeno y un contribuyente a la formación de productos de pardeamiento con su actividad antioxidante. IMPORTANCIA DE LOS LIPIDOS Los ácidos grasos tienen numerosas funciones importantes en el cuerpo, incluido el almacenamiento de energía. Si el cuerpo no dispone de glucosa (un tipo de azúcar) cuando necesita energía, recurre a los ácidos grasos como combustible para las células. Los ácidos grasos son una familia de moléculas clasificadas dentro del grupo de los macronutrientes lipídicos. Uno de los roles que desempeñan los ácidos grasos en el metabolismo animal es la producción de energía, capturada en forma de adenosina trifosfato (ATP). Al ser comparado con otras clases de macronutrientes (carbohidratos y proteínas), los ácidos grasos producen la mayor cantidad de ATP en relación a su peso luego de ser completamente oxidados a CO2 y agua en la β-oxidación y el ciclo del ácido cítrico.2 Por este motivo los ácidos grasos (principalmente en la forma de triglicéridos) son la forma más eficiente de almacenaje de combustible en los animales, y en menor medida en las plantas. Adicionalmente, los ácidos grasos son importantes componentes de los fosfolípidos que forman las bicapas lipídicas, que es de lo que están formadas las membranas celulares de casi todas las células y las membranas que forman los organelos dentro de las células, tales como el núcleo, mitocondrias, retículo endoplasmático, y el aparato de Golgi.