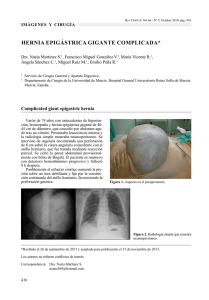
UNIVERSIDAD DE COSTA RICA SISTEMA DE ESTUDIOS DE POSTGRADO PROGRAMA DE ESPECIALIDADES MÉDICAS “MANEJO PREOPERATORIO DE HERNIAS INCISIONALES CON PÉRDIDA DE DOMINIO. MÉTODOS PARA LA EXPANSIÓN DE LA PARED ABDOMINAL” Tesis sometida para optar por el grado de Especialista en Cirugía General Dra. Fiorella Rodríguez Montero Ciudad Universitaria “Rodrigo Facio” Costa Rica 2018 DEDICATORIA A mi familia, porque no ha sido fácil ni para mi, ni para ustedes. Esto les pertenece, infinitamente agradecida con mi madre Nidia Montero por todo su apoyo, dedicación y esfuerzo. If the only prayer you ever say is “thank you” that will be enough Eckhart Tolle ii AGRADECIMIENTOS A mis profesores de postgrado, por todas sus enseñanzas. Al personal Médico y de Enfermería de los Hospitales San Juan de Dios, Carlos Luis Valverde Vega, San Vicente de Paúl, San Rafael de Alajuela y Raúl Blanco Cervantes y de las clínicas de Desamparados y Puriscal, por permitirme rotar en sus Servicios de Cirugía General y aprender cosas diferentes cada día. iii ACTA DE ACEPTACIÓN Esta tesis de Revisión Bibliográfica fue aceptada por la Comisión del Programa de Estudios de Postgrado en Ciencias Médica de la Universidad de Costa Rica, como requisito parcial para optar por el grado de Especialista en Cirugía General. ( Lec,fora Dr. Lector Coordinador Postgrado Cirugía General Dra. Fiorella Rodríguez Montero Sustentante iv TABLA DE CONTENIDO INTRODUCCIÓN……………………………………………………………………………...1 NEUMOPERITONEO PROGRESIVO PREOPERATORIO…………………………………5 HISTORIA……………………………………………………………………………..5 MECANISMO DE ACCIÓN…………………………………………………………..5 INDICACIONES……………………………………………………………………….6 TÉCNICA………………………………………………………………………………6 RESULTADOS………………………………………………………………………...7 COMPLICACIONES…………………………………………………………………..8 CONTRAINDICACIONES…………………………………………………………....9 ANÁLISIS……………………………………………………………………………...9 TOXINA BOTULÍNICA (BOTOX).........................................................................................10 MECANISMO DE ACCIÓN…………………………………………………………11 RESULTADOS……………………………………………………………………….11 TÉCNICA……………………………………………………………………………..14 COMPLICACIONES…………………………………………………………………15 CONTRAINDICACIONES…………………………………………………………..15 ANÁLISIS…………………………………………………………………………….16 EXPANSORES TISULARES………………………………………………………………...17 HISTORIA……………………………………………………………………………17 MECANISMO DE ACCIÓN…………………………………………………………17 RESULTADOS……………………………………………………………………….17 TÉCNICA……………………………………………………………………………..17 COMPLICACIONES…………………………………………………………………18 ANALISIS…………………………………………………………………………….18 CONSIDERACIONES PREVIAS A LOS PROCEDIMIENTOS……………………………19 v VALORACION PREOPERATORIA………………………………………………...19 OBESIDAD…………………………………………………………………………...19 SELECCIÓN DE CANDIDATOS……………………………………………………20 ADJUNTOS…………………………………………………………………………..20 TÉCNICAS QUIRÚRGICAS………………………………………………………………...21 CONCLUSIONES…………………………………………………………………………….23 BIBLIOGRAFÍA……………………………………………………………………………...25 vi RESUMEN El neumoperitoneo progresivo preoperatorio, la toxina botulínica y los expansores tisulares son métodos viables y seguros para la expansión de la cavidad abdominal, previos a una reparación de hernia incisional con pérdida de dominio. El uso de estos métodos puede facilitar el cierre primario de la fascia. Sin embargo, se necesitan estudios de alta calidad y larga data acerca de la efectividad de dichos tratamientos, así como una estandarización en las técnicas para su utilización. Esta revisión bibliográfica refleja la necesidad de estudios comparativos en el uso de métodos para la reparación de hernias incisionales complejas con pérdida de dominio. ABSTRACT The preoperative progressive pneumoperitoneum, Botilinum toxin A (Botox) and tissue expanders are feasible and safe methods to expand the abdominal cavity previous to a incisional hernia with loss of domain repair. The use of these methods can facilitate primary closure of fascia. However, it would be needed high quality studies and large data to prove the effectiveness of those treatments as well as the standardization of their techniques. This article review reflects the need of comparative studies regarding the use of these methods to repair highly complicated incisional hernias with loss of domain. vii LISTA DE TABLAS Tabla 1. Clasificación de hernias incisionales de acuerdo a la Sociedad Europea de Hernias (European Hernia Society) …………………………………………………………………....2 LISTA DE FIGURAS Figura 1. Localizaciones anatómicas para inyección de Toxina Botulínica A, según Smoot et al, 2011 ..................................................................................................................................................14 viii 1 1 INTRODUCCIÓN La función de la pared abdominal es contener y proteger las vísceras, ayudar a activar los movimientos del tronco, antagonizar los movimientos de sus músculos extensores y asistir con la micción y defecación. Es también importante para la regulación de los movimientos diafragmáticos, para una ventilación pulmonar adecuada. Una hernia incisional ocurre como una complicación de una cirugía previa. Estas hernias se pueden presentar posterior a cualquier tipo de cirugía abdominal, independientemente del tipo de incisión, con una incidencia de 10% o más de todas las operaciones abdominales (aproximadamente de un 9 a 20%) (1,2), la cual aumenta en pacientes sometidos a una cirugía de emergencia o en pacientes de alto riesgo (hasta un 35%) y puede resultar en una morbilidad sustancial (3). Las tasas reportadas de recurrencia a los 36 meses varían entre 15 a 21% para reparación abierta y entre 7 a 15,5% para reparación laparoscópica (4). A los 10 años las tasas de recurrencia pueden ser tan altas como 63% para reparación con sutura únicamente y 32% para reparación con malla. Las hernias incisionales surgen más frecuentemente luego de una laparotomía en la línea media o incisiones transversas, pero también se han documentado posteriores a incisiones paramedianas, aunque con una tasa menor (2,5%) (5). Cuando se realiza una incisión en la línea alba, las inserciones en la línea media de la fascia abdominal lateral se interrumpen. Una tensión excesiva e isquemia subsecuente en la línea alba predispone a la formación de hernia. El riesgo de hernia incisional aumenta en pacientes portadores de obesidad, diabetes mellitus, malignidad, antecedente de sepsis de herida quirúrgica, uso de agentes inmunosupresores y corticoesteroides, tabaquismo y laparotomías previas. Un defecto mayor a 10 cm define una hernia incisional grande (según la Sociedad Europea de Hernia) y uno de 5 a 10 cm define una hernia mediana, sin embargo, se ha recomendado clasificar de acuerdo al volumen tomográfico de la hernia incisional y al volumen de la cavidad abdominal para aceptar dicho contenido, independientemente del tamaño del defecto. 2 Tabla 1: Clasificación de hernias incisionales de acuerdo a la Sociedad Europea de Hernias (European Hernia Society) Una hernia incisional con pérdida de dominio es aquella en la que una gran parte de los contenidos intraabdominales se sitúa en el saco herniario, y en esta circunstancia el contenido herniario excede la capacidad de la cavidad abdominal para “recibir” estas vísceras. Cuando una hernia presenta pérdida de dominio ocurren cambios en el mesenterio, intestinos, tejido celular subcutáneo y piel. El retorno venoso y linfático de las asas intestinales que protruyen desde la cavidad se reduce debido a la compresión causada por el anillo fibrótico o el defecto herniario. Esto ocasiona un intestino y mesenterio edematosos, que dificultan la reducción de estos. Bajo presión el tejido celular subcutáneo se desvía lateralmente, llevando a una piel excesivamente distendida, con circulación alterada y tendencia a la atrofia. En casos avanzados esto puede llevar a zonas de ulceración. Las hernias con pérdida de dominio también causan contracciones progresivas y retracción de los músculos abdominales, debido a un desplazamiento de las vísceras intraabdominales hacia la hernia, lo que da como resultado una reducción de la presión y capacidad de la cavidad abdominal y ocasiona un descenso del hemidiafragma y alteración en el equilibrio ventilatorio, con depresión respiratoria. 3 En pacientes con una hernia incisional gigante con pérdida de dominio los órganos herniados no pueden regresar a la cavidad abdominal y por lo tanto se crea un “segundo abdomen”. La pérdida de dominio asociada a retracción músculo-aponeurótica lateral, relajación del diafragma y enfermedades cardíacas- respiratorias crónicas lleva al paciente a un estado de discapacidad biológica-social. Las consecuencias de no operar una hernia incisional incluyen: aumento progresivo de tamaño, alteraciones biomecánicas que afectan la postura, compromiso de actividades de la vida diaria (incluyendo levantar peso y la defecación), aspectos estéticos y posibilidad de incarceración/estrangulación. Se debe tener en cuenta que esta protrusión visceral masiva deriva en un reto terapéutico mayor, con el objetivo principal de retornar el contenido herniado al abdomen sin crear hipertensión intraabdominal, ya que esta conlleva a complicaciones pulmonares y/o síndrome compartimental intraabdominal con posibilidad de disfunción orgánica e isquemia intestinal. Posteriormente, si el paciente sobrevive presenta una alta tasa de recurrencia herniaria. Tanaka, en el 2010, fue el primer autor que introdujo un método objetivo acerca de la pérdida de dominio para ser aplicado basado en los hallazgos tomográficos, conocido como índice de Tanaka, el cual resulta ser el radio del volumen de la hernia incisional (VHI) entre el volumen de la cavidad abdominal (VCA), expresado en porcentaje. Un índice menor al 20% se asocia a un cierre fascial libre de tensión y menos complicaciones pulmonares. Cuando el radio es mayor al 20% solo en el 12,5% de los pacientes se logra un cierre primario libre de tensión (6). Por tanto, un radio de volumen de la hernia incisional/volumen de la cavidad abdominal mayor a 20% es indicativo de una hernia con pérdida de dominio y origina una reintroducción traumática a la cavidad abdominal (7). En la literatura se define pérdida de dominio cuando no se logra mantener la reducibilidad de la hernia en el examen físico, sin embargo, en la actualidad, es necesario obtener un TAC de pared abdominal sin medio de contraste (en reposo y con tomas funcionales) para evaluar la complejidad del defecto herniario. Los métodos de expansión de la cavidad abdominal para permitir la reparación de hernias incisionales con pérdida de dominio incluyen: neumoperitoneo progresivo preoperatorio, toxina botulínica y expansores tisulares. Se asocian con bajas tasas de morbi-mortalidad, altas tasas de cierre fascial primario y disminución de las tasas de 4 recurrencia herniaria (8). En combinación con las técnicas quirúrgicas existentes para la reparación pueden ayudar a obtener una movilidad extra crucial, requerida para lograr un cierre primario. Sin embargo, cabe destacar la necesidad de estudios prospectivos longitudinales de alta calidad para establecer su efectividad. En esta revisión bibliográfica se tratará cada uno de estos métodos por aparte (neumoperitoneo progresivo preoperatorio, toxina botulínica y expansores tisulares) haciendo hincapié en los estudios disponibles hasta el momento. 5 NEUMOPERITONEO PROGRESIVO PREOPERATORIO Historia Como herramienta terapéutica el neumoperitoneo fue usado por primera vez para producir colapso pulmonar indirecto en tuberculosis. El neumoperitoneo fue inducido accidentalmente por primera vez por Banyai en 1931 (9) y fue usado ampliamente a nivel mundial hasta la disposición de agentes farmacológicos adecuados. El neumoperitoneo progresivo preoperatorio es un método descrito por primera vez por Ian Goñi Moreno (cirujano argentino) en 1940 para el manejo de una hernia epigástrica incarcerada, la cual fue tratada exitosamente de manera preoperatoria usando inyecciones intraperitoneales de oxígeno durante varios días. En 1947 publicó por primera vez su experiencia usando neumoperitoneo inducido en el manejo de grandes hernias. A pesar del uso diseminado de la técnica en Suramérica luego de las publicaciones de Goñi Moreno el neumoperitoneo no fue reportado en los Estados Unidos hasta que Koontz y Graves lo describieron en 1954 (10). Mecanismo de acción El neumoperitoneo progresivo actúa de manera similar al embarazo o la ascitis en cuanto a expansión de los tejidos blandos de la cavidad abdominal (11). El neumoperitoneo involucra la inyección progresiva de aire en la cavidad peritoneal, que induce un incremento en el volumen de esta, mediante un aumento de la longitud de los músculos anterolaterales del abdomen, con un promedio reportado de hasta 83 mm (12), además realiza una lisis neumática de las adherencias intestinales y produce una elevación del diafragma (en pacientes con hernias de este tipo se encuentra debilitado y relajado) permitiendo una adaptación más fisiológica del paciente y de la cavidad abdominal al reintegro de las vísceras al abdomen. Este último es uno de los efectos de mayor importancia obtenidos con el neumoperitoneo, debido a que produce una mejoría en la función pulmonar del paciente (13). El neumoperitoneo preoperatorio puede mejorar la mecánica respiratoria en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) debido al reclutamiento progresivo de músculos respiratorios no usados previamente. 6 Hasta la fecha, sin embargo, las series encontradas en la literatura son relativamente pequeñas, haciendo que estos resultados sean difíciles de extrapolar a grandes poblaciones de pacientes. Indicaciones El neumoperitoneo está indicado cuando: a) No es posible realizar la reparación/cierre debido al tamaño de la hernia y pérdida de dominio. b) La reducción forzada de los contenidos herniarios puede resultar en síndrome compartimental abdominal. Tanaka et al (7, 15) sugiere que se realice neumoperitoneo progresivo preoperatorio en pacientes con un volumen de la hernia incisional del 25% del volumen de la cavidad abdominal, aunque el porcentaje aún no está definido. Técnica Se puede realizar con una punción percutánea con aguja de Palmer bajo anestesia local, con un catéter subcutáneo implantable quirúrgicamente, con un catéter implantado en la cavidad peritoneal con una aguja de Veress (catéter de pig-tail, cateter de doble luz), con un catéter de diálisis peritoneal (Tenckhoff) o bajo control radiológico con ultrasonido o TAC (catéter de drenaje radiológico multipropósito). Las ventajas de la colocación guiada por ultrasonido son: uso de anestesia local en lugar de general, disminución del riesgo de lesión intestinal y obviar la colocación de un puerto subcutáneo (con el riesgo de complicaciones locales como absceso) (16). Posterior a la colocación del catéter se realiza la insuflación de gas intraperitoneal (preferiblemente aire atmosférico). No se recomienda oxígeno o dióxido de carbono debido a su rápida absorción. No hay recomendaciones claras y consistentes acerca de la duración óptima, frecuencia y volumen insuflado, sin embargo, en la literatura consultada el procedimiento se realiza cada 2 a 3 días durante 15 a 21 días en pacientes con hernias ventrales y 7 a 10 días en pacientes con hernias inguinales, con un volumen inyectado de aire atmosférico que depende de la tolerancia del paciente (por ejemplo, de 500 a 1000 ml o hasta que el paciente aqueje dolor abdominal o escapular, disnea o náuseas). Muchos estudios utilizan 7 el abultamiento de los flancos como indicación de que ha ocurrido una distensión adecuada, mientras otros autores utilizan los signos clínicos mencionados previamente. Bueno-Lledó et al (7) recomienda un volumen insuflado de neumoperitoneo de tres veces el volumen herniario, debido a la reabsorción de aire por el peritoneo, con buenos resultados obtenidos en su estudio de 70 pacientes operados con neumoperitoneo y toxina botulínica preoperatorios. En otro estudio de Willis et al (17), luego de analizar la circunferencia abdominal y la función respiratoria de pacientes bajo neumoperitoneo preoperatorio se concluyó que no hay beneficio de su uso por más de 6 a 10 días de insuflación y se finalizaron las insuflaciones cuando la circunferencia abdominal se mantuvo constante por 2 días consecutivos. Existen protocolos en diferentes hospitales en cuanto a la administración de neumoperitoneo y posiblemente se necesiten más estudios para determinar el volumen correcto de insuflación del neumoperitoneo preoperatorio para predecir un cierre fascial libre de tensión. El sitio de inserción del catéter debe encontrarse lejos de la hernia o cicatrices en la piel y si es posible, el punto recomendado se localiza en el hipocondrio izquierdo, bajo el reborde costal. Durante el período de aplicación del neumoperitoneo se debe mantener fajado al paciente y realizar terapia respiratoria activa para tolerar la hipertensión intraabdominal progresiva, así como brindar profilaxis de trombosis venosa profunda. Se puede efectuar ambulatoriamente. La técnica quirúrgica de reparación abdominal con malla se escoge según criterio del cirujano y se puede realizar 2 días posterior al último procedimiento de neumoperitoneo. Resultados La eficacia del neumoperitoneo preoperatorio puede ser evaluada por un incremento en el volumen de la cavidad abdominal, el cual además es un predictor del éxito de la cirugía. En un estudio prospectivo de Renard et al (18) el volumen de la cavidad abdominal presentó un incremento promedio del 53%, con una media de 6138 ml de aire inyectado por paciente y en otro estudio de Lardiere et al (12) se demostró un incremento del 49% del volumen de la cavidad abdominal. En tanto que Bueno-Lledó et al (7) evidenció una reducción de 16.6% del radio volumen herniario/ volumen de la cavidad abdominal con el uso preoperatorio combinado de neumoperitoneo y toxina botulínica, en su estudio se inyectó un promedio de 8450 cc de aire (4500-13450 cc) 8 El neumoperitoneo progresivo preoperatorio incrementa el volumen de la cavidad abdominal en pacientes con hernias incisionales gigantes con pérdida de dominio, permitiendo una reducción completa y cierre primario de la fascia hasta en un 94% de los pacientes en un estudio, con una morbilidad promedio aceptable (18). También se puede utilizar para la reparación de hernias inguinales y umbilicales gigantes. Una ventaja significativa del neumoperitoneo incluye la capacidad de realizar adherenciolisis mecánica, la cual reduce la disección que debe ser realizada intraoperatoriamente (6). El neumoperitoneo además mejora la función diafragmática, reduce el edema crónico del mesenterio y desenmascara sitios de debilidad fascial o hernias e incluso puede llevar a una reducción herniaria espontánea en algunos pacientes. Astudillo et al (19) demostró una disminución del tiempo operatorio (50 versus 150 min), estancia hospitalaria (3,5 versus 12,5 días), íleo postoperatorio y menor requerimiento de opioides en los pacientes tratados preoperatoriamente con neumoperitoneo. La recurrencia posterior a una hernioplastía incisional, con uso de neumoperitoneo preoperatorio es de 2 a 6% durante el período de observación (20). En el estudio de Bueno-Lledó (21) se encontró una recurrencia de 4,4% durante el período de seguimiento. Según Elstner et al (6) el neumoperitoneo preoperatorio ayuda a localizar áreas libres de adherencias (en imágenes post-insuflación) y por tanto seguras para la entrada de puertos de laparoscopia al abdomen, evitando el riesgo de enterotomías en pacientes con cirugías previas. Complicaciones Las complicaciones del neumoperitoneo incluyen: -Dolor de hombro: complicación más frecuente y que usualmente ocurre debido a estiramiento del ligamento suspensorio del hígado (22). -Dolor abdominal. -Hematoma. -Migración intraperitoneal del catéter. 9 -Inyección de aire en el espacio subcutáneo (enfisema subcutáneo). -Insuficiencia pulmonar restrictiva principalmente en pacientes con comorbilidades respiratorias o cardiacas. -Infección en el sitio de colocación del catéter. -Perforación intestinal. -Neumotórax, neumomediastino, neumocardio -Embolismo aéreo. -Compresión de la vena cava: con administración de grandes volúmenes de aire e hipotensión secundaria (22). En un estudio de Bueno-Lledó et al (21) se encontró un 15,5% de complicaciones asociadas al procedimiento, la mayoría de ellas leves y tratadas con manejo conservador, las encontradas más frecuentemente fueron: dolor abdominal, enfisema subcutáneo y dolor de hombros. Contraindicaciones Como recomendación durante la cirugía definitiva, se enfatiza que los pacientes con neumoperitoneo se encuentran en riesgo de muerte/ complicaciones durante la inducción anestésica con óxido nitroso, debido a que este difunde en la cavidad peritoneal incrementando el volumen del neumoperitoneo, lo que puede ocasionar compromiso ventilatorio y del retorno venoso por elevación del diafragma y compresión de la vena cava, y por tanto esta sustancia se debe utilizar hasta que el abdomen esté abierto (22). Las contraindicaciones incluyen: -Insuficiencia cardiaca. -Insuficiencia respiratoria. -Sepsis intraabdominal. -Anillo herniario pequeño: debido al riesgo de estrangulación. -Hernias incarceradas o estranguladas. Análisis 10 El neumoperitoneo progresivo preoperatorio no ha sido generalizado en la mayoría de los hospitales, sin embargo, aquellos equipos que han incorporado esta técnica han reportado buenos resultados con un bajo riesgo asociado, además la tolerancia del paciente es adecuada. 11 TOXINA BOTULÍNICA (BOTOX) Mecanismo de acción La neurotoxina botulínica serotipo A (Botox) es producida por Clostridium botulinum tipo A, un bacilo anaerobio Gram positivo y se usa médicamente para una denervación química parcial y reversible del músculo. La neurotoxina botulínica actúa mediante bloqueo de la liberación de acetilcolina desde las terminales axonales excitatorias, por lo tanto, inhibe la contracción muscular mediante parálisis flácida. Se estima que dicha toxina disminuye la capacidad contráctil del músculo para generar fuerza a un 12% del porcentaje original. La US Food and Drug Administration (FDA) aprobó una presentación de esta neurotoxina llamada Botox en 1989 para el tratamiento de blefaroespasmo y estrabismo. En vista de sus efectos paralizantes, el Botox ha sido aplicado en numerosas patologías musculares, por ejemplo, distonías, hiperhidrosis, hiperreflexia del detrusor, acalasia esofágica, fisuras anales, síndromes de dolor muscular, medicina estética y otros. Resultados El primer estudio que reportó los beneficios de la toxina botulínica fue publicado por Cakmak et al en el 2006 (23). Este autor demostró que la toxina botulínica reduce la tensión de la pared abdominal, incrementa el volumen intraabdominal, disminuye la presión intraabdominal y ayuda al cierre del defecto fascial en ratas. La toxina botulínica resulta en una “separación química de componentes” causando una relajación de los músculos de la pared abdominal. La toxina botulínica ha sido usada exitosamente para reconstrucción tardía de la pared abdominal posterior a cirugía de control de daño, en manejo del abdomen abierto y el tratamiento de hernias incisionales con pérdida de dominio (7). El tratamiento con Botox en pacientes con herniación de la pared abdominal disminuye de forma significativa el diámetro transverso del defecto herniario (24) y permite medializar los músculos laterales de la pared abdominal (7), con lo que se puede llevar a cabo la reconstrucción quirúrgica, también mejora los índices de dolor postoperatorio y disminuye la necesidad de opioides. La mayor disminución del diámetro transverso del defecto herniario, más que del volumen del saco, permite que se pueda usar 12 en casos en donde el defecto herniario presente un gran diámetro transverso pero un volumen herniario moderado. Ibarra et al (25) en un estudio prospectivo de 12 pacientes del 2009, describe una relajación máxima (posterior a la aplicación de Botox preoperatorio) en la tercera semana y documenta una reducción promedio en el diámetro del defecto herniario de 5,25 cm. En 6 pacientes se logró un cierre fascial primario y los 6 restantes requirieron separación de componentes. En el seguimiento postoperatorio de 9 meses no se documentaron recurrencias. Ibarra y Chávez (26,27) observaron un descenso significativo en el grosor y un incremento en la longitud de los músculos laterales abdominales luego de la aplicación de toxina botulínica. Esta observación permitió la reconstrucción con aproximación fascial en la línea media en todos los pacientes, sin observar complicaciones asociadas a su administración. En conjunto con el neumoperitoneo preoperatorio se pueden lograr mayores volúmenes de insuflación mediante una relajación temporal de los músculos de la pared abdominal. Elstner et al (6) documentó que el uso combinado de neumoperitoneo preoperatorio y toxina botulínica promueve el cierre fascial en pacientes con hernias ventrales recurrentes y además una reducción significativa en el riesgo de síndrome compartimental intraabdominal. En un estudio de 32 pacientes de esta misma autora, en el 2016 (2) se documenta una reducción en el tamaño del defecto herniario de hasta 58%, con el mayor beneficio observado en pacientes con defectos en la línea media. En otro estudio de Elstner et al del 2016 (24) de 27 pacientes que recibieron toxina botulínica se encontró un aumento significativo en la longitud de la pared abdominal con un promedio de 4,2 cm a cada lado, lo que permitió que todas las hernias fueran quirúrgicamente reducidas y reparadas con malla, sin recurrencias tempranas y con 0% de mortalidad. En un estudio de Farroque et al (28) se encontró un aumento en la longitud de la pared abdominal lateral de 2,8 cm a cada lado, el cual es comparable al incremento dado por una cirugía de reparación de componentes, y como ventajas de este método se encuentran: mantenimiento de la integridad muscular, posibilidad de realizar procedimientos quirúrgicos abiertos y laparoscópicos y el uso de malla. 13 Zielinski et al (29) realizó una revisión retrospectiva de sus resultados con la utilización de 300 unidades de toxina botulínica inyectada bajo visión ultrasonográfica en pacientes con abdomen abierto luego de una cirugía de control de daños (aproximadamente 12 a 24 horas después de la primera laparotomía). Los autores recomiendan este procedimiento luego de que la estabilidad hemodinámica sea alcanzada, y mientras esto ocurre se sugiere el manejo temporal con presión negativa. La localización de las tres capas musculares laterales se realizó con guía ultrasonográfica. Se logró un 100% de cierre primario con la administración de toxina botulínica (usualmente a las 24 horas del procedimiento inicial). Este estudio es debatible ya que el mayor efecto del Botox se presenta a los 2 días de administración y los resultados se pueden asociar al manejo con presión negativa, sin embargo, la toxina botulínica si podría disminuir la tensión en la pared abdominal cerrada. En un estudio de 56 pacientes de Rodríguez et al (30) acerca de reparación de hernias incisionales recurrentes se encontró que no existen diferencias estadísticamente significativas entre el uso de Botox versus Botox más neumoperitoneo, ni tampoco entre el uso de 200 versus 300 unidades de toxina botulínica. La toxina botulínica impresiona ser el principal contribuyente de la elongación y adelgazamiento de la musculatura de la pared abdominal, mientras el neumoperitoneo preoperatorio impresiona facilitar la adherenciolisis e identifica áreas de adherencias a la pared abdominal anterior, demostrando áreas seguras para la colocación de los puertos en cirugía laparoscópica. Los efectos analgesicos del Botox fueron descritos por Zendejas et al (31), los cuales describen menor dolor postoperatorio y necesidad de uso de opioides, con un efecto en el alivio del dolor hasta por 3 meses. Aunque el mecanismo aún no es conocido, el Botox evita la liberación de las moléculas moduladoras de dolor (sustancia- P y péptido asociado a la calcitonina) de la terminación nerviosa presináptica. Finalmente, en un estudio de Chávez et al (27) de una serie de 14 pacientes a los que se les inyectó un total de 100 unidades de Botox no se encontró un cambio significativo en el tamaño del defecto herniario. Sin embargo, el cierre primario se logró en un 78% de estos casos. Se cree que el efecto prolongado del Botox protege la reparación quirúrgica debido a minimización de las fuerzas de tracción laterales, durante los tres meses críticos 14 iniciales, permitiendo un adecuado soporte perfusional, disminuyendo las tasas de dehiscencia de la herida y recurrencia herniaria (2). Técnica El efecto clínico del Botox se manifiesta luego de 2 días, alcanza su máximo a los 14 días y tiene un efecto que dura 6 meses aproximadamente (7,2). Para su uso como parte del manejo preoperatorio del paciente con hernia incisional con pérdida de dominio se recomienda su administración de 4 semanas a 7-14 días antes de la cirugía (30). Los protocolos de administración varían, sin embargo, para defectos en la línea media, se puede aplicar a lo largo de 5 puntos a cada lado de la pared abdominal: dos puntos en la línea axilar media entre el margen costal y la cresta ilíaca superior y tres puntos en la línea medioclavicular (músculo oblicuo externo) entre el margen costal y la cresta iliaca superior (21,25,26) Otro protocolo consiste en aplicar Botox a lo largo de tres puntos en la línea axilar anterior, entre el margen costal y la espina ilíaca antero-superior, el cual fue recomendado inicialmente por Smoot et al (2,24). Figura 1: Localizaciones anatómicas para inyección de Toxina Botulinica A, según Smoot et al, 2011 15 Para hernias que no se encuentren en la línea media (por ejemplo, subcostales) los sitios de inyección varían, de acuerdo al tamaño y localización del defecto, pero aún no se encuentran protocolos establecidos. Se recomienda una dilución de 250-500 unidades por paciente de toxina botulínica en 50-150 ml de solución salina al 0.9% (de 2 a 10 unidades/1ml) y se inyectan 5 ml (para la preparación de 10 unidades/ml) en cada uno de los 10 puntos anteriormente señalados (si se usa el primer protocolo nombrado), usando guía ultrasonográfica; sin embargo, la concentración y volumen a administrar aún no están definidos. La toxina botulínica se inyecta en cada una de las tres capas musculares laterales (transverso abdominal, oblicuo interno y oblicuo externo). Se escoge el punto que tenga mejor registro muscular en la electromiografía (idealmente). La electromiografía complementa la localización por ultrasonido, confirmando si el músculo está denervado o fibrótico, y permitiendo cambiar a otra área muscular en caso necesario, para asegurar su efectividad (21). Complicaciones Un efecto adverso comúnmente reportado posterior a la administración de toxina botulínica incluye sensación de distensión abdominal, asimismo, la flacidez de la pared abdominal puede resultar en tos o estornudos “débiles”. Estos síntomas son temporales y remiten posterior a la cirugía. Contraindicaciones El Botox está contraindicado en las siguientes condiciones: 1) Embarazo/lactancia. 2) Paresias preexistentes: a) Esclerosis lateral amiotrófica b) Miopatía c) Polineuropatía motora 3) Alteración en la transmisión neuromuscular a) Miastenia gravis b) Síndrome Lambert- Eaton 4) Uso concurrente o potencial de aminoglucósidos. 5) Necrosis de la pared abdominal. 16 6) Inestabilidad hemodinámica. 7) EPOC (debido a que el Botox disminuye la función de los músculos respiratorios accesorios): se requiere realizar más estudios al paciente para evaluar posibilidad de tratamiento. Análisis El Botox es un método seguro para la expansión de la pared abdominal previo a la hernioplastía, pero se necesitan más estudios prospectivos para determinar factores como: volumen ideal, concentración, sitios de inyección, modalidad radiológica de seguimiento y otros, debido a la falta de estandarización en la literatura. El uso combinado de neumoperitoneo y toxina botulínica podría brindar mejores resultados que la utilización de cada técnica por aparte, sin embargo, se requieren estudios de alta calidad para confirmar el beneficio de esta modalidad combinada. 17 EXPANSORES TISULARES Historia La expansión del tejido musculofascial mediante expansores tisulares temporales se remonta a la reconstrucción de la pared abdominal para defectos congénitos y, posteriormente, para defectos traumáticos y fue descrita por primera vez por Hobar, Byrd et al (32). Mecanismo de acción La expansión tisular quirúrgica es un procedimiento adoptado a partir de la observación de la reacción de los tejidos sometidos a un “estrés” mecánico. Algunos ejemplos de expansión tisular fisiológica son los observados en la piel normal del abdomen de una mujer embarazada o en pacientes obesos. La expansión gradual de la pared abdominal provee tejido autógeno, inervado y sano que permite la reaproximación de los bordes de tejido para el cierre del defecto herniario. Resultados En un reporte de caso de Van Geffen et al, en el 2005 (33) se logró realizar un cierre primario del defecto, y no se observó recurrencia a los 24 meses. Otra serie de Jacobsen et al, de 4 pacientes, reportó resultados similares y no se observaron recurrencias durante el período de observación (34). Paletta et al, en un reporte de 11 pacientes no reporta recurrencias durante un período de seguimiento de 2 a 5 años (35). En una revisión sistemática de Alam et al, del 2016 (8) se documenta una tasa de cierre fascial primario de 92,9% posterior al uso de expansores tisulares. Técnica El sitio recomendado para la colocación de un expansor tisular se encuentra entre el músculo oblicuo externo e interno. Otras localizaciones posibles incluyen: tejido subcutáneo, intramuscular (entre el músculo oblicuo interno y el transverso abdominal) e intraabdominal. Desde el punto de vista anatómico, la colocación intramuscular (entre el músculo transverso y el oblicuo interno) puede ser riesgosa debido a que esta área contiene el flujo arterial y la inervación para estos dos músculos y el recto abdominal. 18 El plano entre los músculos oblicuo interno y externo se caracteriza por tener poca inervación e irrigación y por lo tanto es el más recomendable para la colocación de un expansor tisular. Esta técnica requiere un procedimiento quirúrgico para colocar el expansor, el cual se realiza mediante incisiones separadas en un “bolsillo” creado mediante disección roma en un plano entre los músculos oblicuo externo e interno. Los expansores contienen puertos que permiten la inyección de solución salina de forma semanal/ bisemanal (de 40 a 120 ml), por algunas semanas (usualmente 3) o incluso meses, dependiendo del tamaño del defecto y permite un alargamiento de la musculatura que podría facilitar el cierre fascial primario. Los expansores se remueven durante la cirugía para el cierre del defecto. Complicaciones Principalmente se describen las complicaciones infecciosas en el sitio quirúrgico, que pueden ameritar la extracción del dispositivo en algunos casos (8). Análisis Hasta la fecha no existen estudios de calidad acerca del uso de los expansores para el cierre de defectos de la pared abdominal, únicamente se encuentran reportes de casos aislados, y con un período de seguimiento relativamente corto. Desde un punto de vista anatómico, el plano entre los músculos oblicuo externo e interno impresiona ser el más conveniente para su utilización. Este procedimiento requiere de tiempo, ya que la expansión ocurre a lo largo de varias semanas y es costoso. Existen dudas acerca de su efectividad debido a la aplicación de la ley de Laplace, ya que la expansión resulta en una compresión del volumen intraabdominal, resultando en un aumento limitado de las estructuras necesitadas, lo cual podría relacionarse con recurrencia del defecto herniario a corto/mediano plazo. 19 CONSIDERACIONES PREVIAS A LOS PROCEDIMIENTOS Valoración preoperatoria Se recomienda como parte de la valoración preoperatoria para métodos de expansión de la pared abdominal los siguientes: • Evaluación neumológica: incluye espirometría y gases arteriales. Debido a que el diafragma en pacientes con hernias incisionales se encuentra debilitado y relajado se produce un deterioro importante de la función respiratoria. En el caso del neumoperitoneo progresivo se espera que estas pruebas presenten una mejoría posterior a dicha técnica. Se sugiere monitorizar la función respiratoria antes y después del neumoperitoneo; y repetir antes de la cirugía definitiva en caso necesario. En el caso de la toxina botulínica se puede producir parálisis flácida de los músculos accesorios de la respiración, por lo que puede empeorar la condición de pacientes neumopatas, principalmente EPOC y se recomienda una valoración detallada, con compensación de su estado basal previo al procedimiento. • Evaluación cardiológica: el paciente debe estar compensado desde el punto de vista cardiológico, para la aplicación de cualquiera de las técnicas de expansión de la pared abdominal. Obesidad Se estima que un 75% a 88% de los pacientes portadores de hernias incisionales presentan sobrepeso u obesidad (6,36). La obesidad se asocia a un aumento en la morbilidad perioperatoria y mayores tasas de recurrencia herniaria, principalmente en pacientes obesos mórbidos (22). La obesidad no constituye una contraindicación absoluta para la reparación de la hernia, no obstante, se recomienda que el paciente baje de peso antes de considerarse candidato para algún procedimiento quirúrgico e inclusive se menciona una cirugía para el control de la obesidad (bypass gastrico, manga gastrica etc) previa a la hernioplastía; con el fin de disminuir la morbi/mortalidad perioperatoria y mejorar el pronóstico de la cirugía. 20 Selección de candidatos No son candidatos para las técnicas de expansión de la pared abdominal los siguientes pacientes: aquellos con un proceso séptico de la pared abdominal, descompensación cardiaca o respiratoria o presencia de complicaciones herniarias (estrangulación u obstrucción intestinal). En pacientes con un defecto herniario con anillo pequeño no se recomienda el neumoperitoneo preoperatorio debido a un aumento en el riesgo de estrangulación. En un artículo se menciona el cese del tabaquismo y la pérdida de peso (en obesos) como requisitos para incluir al paciente en el programa quirúrgico (2). Las contraindicaciones específicas para cada método de expansión se encuentran en las páginas previas. Adjuntos Durante la aplicación de neumoperitoneo progresivo preoperatorio y hasta el día de la cirugía se recomienda mantener fajado al paciente y además, terapia respiratoria activa que permita tolerar la hipertensión intraabdominal progresiva (18). Además, se recomienda la utilización de anticoagulación profiláctica desde el primer procedimiento, y adecuarla al peso (en caso de obesidad). Como consideración para todas las técnicas de expansión, en caso de un proceso dermatológico activo se debe brindar un tratamiento adecuado para prevenir complicaciones infecciosas. Se recomienda la utilización de anestesia general para el procedimiento quirúrgico definitivo y administración de antibiótico profiláctico (que se puede extender hasta 72 horas), además de medias elásticas durante las primeras 48 horas postoperatorias y profilaxis tromboembólica ajustada al peso del paciente (6). 21 TÉCNICAS QUIRÚRGICAS La técnica quirúrgica queda a elección del cirujano, de acuerdo a su experiencia y tipo de defecto herniario del paciente. Se describen varias opciones: El cierre primario consiste en aproximación de los bordes del defecto sin tensión, en estos casos se recomienda colocación de malla para evitar recurrencias. La técnica abierta retro muscular sublay (Rives- Stoppa) inicia con una resección de la cicatriz previa, entrada a la cavidad peritoneal y escisión del saco herniario. Se realiza una incisión en cada vaina del recto posterior para entrar al espacio retromuscular craneal a la línea arcuada. Estas estructuras se cierran para separar los contenidos intraabdominales de la malla sintética. Se coloca una malla de polipropileno en el espacio retromuscular con un traslape de al menos 5 cm con los bordes del defecto herniario y se fija con suturas de absorción lenta. La vaina del recto anterior se cierra con una sutura continua con un material de absorción lenta también. Se recomienda colocar dos drenos en el espacio retromuscular y dos en el espacio subcutáneo. Algunos autores describen que esta técnica tiene una baja tasa de recurrencia, de aproximadamente 3 a 7% y se considera por muchos como el Gold Standard (13, 18). La técnica de separación de componentes anterior (técnica de Ramírez) con el uso de malla en posición sublay/ onlay, fue descrita en 1990 y es un procedimiento usado por muchos cirujanos con buenos resultados. Esta cirugía involucra una liberación miofascial del oblicuo externo, mediante una disección del saco herniario y el defecto fascial, asociada a adherenciolisis (si es necesaria) y elevación de la piel y tejido subcutáneo de la fascia del recto abdominal y del oblicuo externo. Posterior a estos pasos se realiza una fasciotomía de la aponeurosis del oblicuo externo, seguida por disección del tejido areolar entre los músculos oblicuo interno y externo. La división de la fascia del oblicuo externo se realiza de 0,5 a 1 cm lateral al borde de la vaina de los rectos, extendiéndose cranealmente al margen costal y caudalmente al ligamento inguinal. Posteriormente se diseca entre los músculos oblicuo interno y externo, lo que usualmente permite aproximar los tejidos en la línea media. Una segunda parte del procedimiento, requerida en algunas ocasiones, implica la liberación de la vaina del recto posterior, que confiere 2 a 3 cm adicionales a cada lado para el avance medial. El paso final involucra una mioplastía fijando el colgajo del oblicuo externo a la malla. Con la separación de componentes se 22 produce una disrupción de la integridad musculofascial de la pared abdominal, y se asocia con una tasa de complicaciones de la herida del 26 a 42% y hasta un 30% de recurrencias, por lo que muchos autores no realizan este procedimiento quirúrgico. La técnica de separación de componentes posterior (transversis abdominis releaseTAR) , descrita desde el 2012 (21) implica una incisión en la vaina del recto posterior a 0,5- 1 cm de la línea alba, con el desarrollo de un plano retromuscular hacia la línea semilunar. Se realiza una incisión 1 a 2 cm medial a la línea semilunar, exponiendo el músculo transverso abdominal subyacente. El músculo transverso se divide a lo largo del borde medial usando electrocauterio. Este paso se inicia en el tercio superior del abdomen donde las fibras del transverso abdominal son fáciles de identificar, con esto se brinda acceso al espacio entre la fascia transversalis y el músculo transverso dividido. Este plano se puede extender de manera cefálica hasta el margen costal. Se puede usar una gran malla para cubrir el espacio retromuscular, incluso de forma lateral la malla se puede colocar contigua al borde lateral del músculo psoas. Este procedimiento preserva los nervios anterolaterales de la pared abdominal y evita la necesidad de realizar un colgajo cutáneo extenso, que interrumpe los vasos perforantes a la piel y puede considerarse una buena opción quirúrgica cuando no se logra reducir el contenido herniario durante la cirugía o en caso de hernias laterales (7). La técnica IPOM consiste en la reparación con malla intraperitoneal onlay, y se puede realizar de forma laparoscópica o laparoscópica- abierta- laparoscópica (LOL). En esta intervención los bordes de la fascia se aproximan laparoscópicamente con suturas transcutáneas no absorbibles a lo largo del defecto y se coloca una malla de forma intraperitoneal. En algunos casos donde no se logra reducción del contenido herniario se ha propuesto una resección intestinal (hemicolectomía derecha) y omentectomía supracólica, para facilitar alguna de las técnicas anteriores (18). En caso de que ocurra una contaminación de la cavidad abdominal (resección intestinal, necesidad de ostomía, presencia de pus en la cavidad abdominal) se sugiere el uso de malla absorbible de poliglactina (18). 23 CONCLUSIONES Las hernias incisionales con pérdida de dominio constituyen una patología bastante frecuente, y de manejo quirúrgico complejo, debido a la dificultad para lograr un cierre primario de los tejidos sin tensión excesiva. Además, presentan una elevada tasa de recurrencia, la cual aumenta con el número de reparaciones previas. Debido a ello se han estudiado diversas técnicas para lograr una adecuada expansión tisular de manera preoperatoria, tales como el neumoperitoneo progresivo preoperatorio, la aplicación de toxina botulínica y los expansores tisulares. El neumoperitoneo progresivo preoperatorio permite una adherenciolisis mecánica, mejoría de la función pulmonar de forma preoperatoria (debido a un incremento de la función diafragmática), identificación de áreas ocultas de debilidad en la fascia, posibilidad de reducción espontánea del defecto herniario y un aumento del volumen de la cavidad abdominal que puede permitir el cierre primario, con resultados adecuados en los estudios realizados hasta la fecha en cuanto a seguridad, facilidad de aplicación y recurrencia. Sin embargo, se debe destacar que en este momento no se cuenta con estudios comparativos de alta calidad que permitan respaldar los posibles beneficios de dicha técnica. La toxina botulínica impresiona ser una técnica bastante segura y de fácil aplicación, con resultados satisfactorios en cuanto a disminución del dolor postoperatorio y uso de opioides, posibilidad de cierre primario y reducción de recurrencias. Sin embargo, hasta el momento no se cuenta con un protocolo establecido en cuanto a dosis, sitios de inyección y dilución, ni tampoco estudios de alta calidad. Debido a los resultados promisorios se debe realizar una mayor investigación en dicha área. El uso combinado de toxina botulínica y neumoperitoneo progresivo preoperatorio es seguro, presenta baja tasa de complicaciones y mayores resultados que los obtenidos de forma individual, y se puede considerar su utilización en casos que cumplan los criterios, sin embargo, como se mencionó previamente, se requieren más estudios para poder establecer sus beneficios reales. Los expansores tisulares podrían resultar útiles en el tratamiento de hernias incisionales con pérdida de dominio, sin embargo, requieren varias semanas para lograr una expansión adecuada y son costosos. Su efectividad se ha puesto en duda por la 24 probable compresión de los contenidos intraabdominales, lo que podría disminuir su eficacia y aumentar la posibilidad de recurrencia. Estas técnicas de expansión de la pared abdominal evidencian resultados quirúrgicos satisfactorios en los estudios realizados, lo cual permitiaría mejorar sustancialmente la calidad de vida del paciente con hernia incisional. Es por esto que son necesarios estudios de alta calidad, para poder predecir sus alcances y ampliar la utilización. 25 BIBLIOGRAFÍA 1. Diener M, Voss S, Jensen K, Buchler M & Seiler C (2010). Elective mid- line laparotomy closure: the INLINE systematic review and meta- analysis. Ann Surg 251: 843- 856. 2. Elstner K, Read J, Rodríguez O, Cosman P, Dardano A, Jacombs A, Edye M, Zea A, Boesel T, Mikami D & Ibrahim N (2017). Preoperative chemical component relaxation using Botulinum toxin A: enabling laparoscopic repair of complex ventral hernia. Surg Endosc 31: 761- 768. 3. Lien SC, Hu Y, Wollstein A, Franz M, Patel S, Kuson W & Urbanchek M (2015). Contraction of abdominal wall muscles influences size and ocurrence of incisional hernia. Surgery. http://dx.doi.org/10.1016/jsurg.2015.01.023 4. Farooque F, Jacombs A, Roussos E, Read J, Dardano A, Edye M & Ibrahim N (2016). Preoperative abdominal muscle elongation with botulinum toxin A for complex incisional ventral hernia repair. ANZ J Surg 86: 79- 83. 5. Mulholland M, Lillemoe K, Doherty G, Maier R, Simeone D, Upchurch G. Greenfield´s Surgery Scientific Principles & Practice. Wolters Kluwer Health/ Lippincott Williams & Wilkins. Edición #5. 6. Elstner K, Read J, Rodríguez O, Ho-Shon K, Magnussen J, Ibrahim N (2016). Preoperative progressive pneumoperitoneum complementing chemical component relaxation in complex ventral hernia repair. Surg Endosc. DOI 10.1006/s00464-0165194-1 7. Bueno J, Torregrosa A, Jiménez R & García P (2018). Preoperative combination of progressive pneumoperitoneum and botulinum toxin type A in patients with loss of domain hernia. Surgical Endoscopy http://doi.org/10.1007/s00464-018-6089-0 8. Alam N, Narang S, Pathak S, Daniels I & Smart N (2016). Methods of abdominal wall expansion for repair of incisional herniae: a systematic review. Hernia. DOI 10.1007/s10029-016-1463-0. 9. Banyai A. Pneumoperitoneum treatment. St. Luois, CV. Mosby Co., 1946, pag 376. 10. Koontz A, Graves J (1954). Preoperative pneumoperitoneum as an aid in the handling of gigantic hernias. Ann Surg 140: 759- 762. 11. Cady B, Brooke G (1976). Repair of Massive Abdominal Wall Defects. Combined use of pneumoperitoneum and marlex mesh. Surgical Clinics of North America 56 (3): 559- 570. 26 12. Dumont F, Fuks D, Verhaeghe P, Brehant O, Sabbagh C & Riboulot M (2009). Progressive pneumoperitoneum increases the lenght of abdominal muscles. Hernia 13: 183-187. 13. Oprea V, Matei O, Gheorghescu D, Leuca D, Buia F, Rosianu M & Dinca M (2014). Progressive Preoperative Pneumoperitoneum (PPP) as an Adjunct for Surgery of Hernias with Loss of Domain. Chirurgia 109: 664-669. 14. Tanaka E, Yoo J, Rodrigues A, Utivama E, Birolini D & Rasslan S (2010). A computarized tomography scan method for calculating the hernia sac and abdominal cavity volume in complex large incisional hernia with loss of domain. Hernia 14: 63- 69. 15. Van Geffen H, Simmermacher R (2005). Incisional hernia repair: abdominoplasty, tissue expansion, and methods of augmentation. World J Surg 29: 1080-1085. 16. Alyami M, Passot G, Voiglio E, Lundberg PW, Valette PJ, Muller A & Caillot JL (2015). Feasibility of catheter placement under ultrasound guidance for progressive preoperative pneumoperitoneum for large incisional hernia with loss of domain. World J Surg. DOI 10.1007/s00268-015-3206-2. 17. Willis S, Conze J & Muller S (1996) . Progressive pneumoperitoneum in treatment of inguinal and scar hernias. Results of animal experiments and clinical applications. Langenbecks Arch Chir 381: 132-137. 18. Renard Y, Lardiere S, de Mestier L, Appere F, Colosio A, Kianmanesh R & Palot J (2016). Management of large incisional hernias with loss of domain: A prospective series of patients prepared by progressive preoperative pneumoperitoneum. J.Surg http://dx.doi.org/10.1016/j.surg2016.03.033 19. Astudillo R, Merrell R, Sánchez J & Olmedo S (1986). Ventral herniorrhaphy aided by neumoperitoneum. Arch Surg 121: 935- 936. 20. Mcadory R, Cobb W & Carbonell A (2009). Progressive preoperative pneumoperitoneum for hernias with loss of domain. Am Surg 75: 504- 508. 21. Bueno J, Torregrosa A, Ballester N, Carreño O, Carbonell F, Pastor PG, Pamies J, Cortes V, Bonafé S & Iserte J (2017). Preoperative progressive pneumoperitoneum and botulinum toxin type A in patients with large incisional hernia. Hernia. DOI 10.1007/s10029-017-1582-2. 22. Murr M, Mason E & Scott D (1994). The use of pneumoperitoneum in the repair of giant hernias. Obesity Surgery 4: 323-327. 27 23. Cakmak M, Caglayan F, Somuncu S, Leventoglu A, Ulusoy S & Akman H (2006). Effect of paralysis of the abdominal wall muscles by botulinum A toxin to intraabdominal pressure: an experimental study. J Pediatr Surg 41: 821- 825. 24. Elstner K, Jacombs A, Read J, Rodríguez O, Edye M, Cosman PH, Dardano AN, Zea A, Boesel T, Mikami DJ, Craft C & Ibrahim N (2016). Laparoscopic repair of complex ventral hernia facilitated by pre-operative chemical component relaxation using Botulinum Toxin A. Hernia 20: 209-219. 25. Ibarra T, Nuño C, Echeagaray JE, Robles E & González J (2009). Use of Botulinum toxin type A before abdominal wall hernia reconstruction. World J Surg 33: 2553- 2556. 26. Ibarra T, Nuño C, Miranda A, Troyo R, Navarro R, Bravo L (2014) Effect of botulinum toxin type A in lateral abdominal wall muscles thickness and length of patients with midline incisional hernia secondary to open abdomen management. Hernia 18: 647652. 27. Chávez K, Cárdenas L, Pérez H (2014). Resultado de la aplicación preoperatoria de toxina botulínica A en el tratamiento de hernias incisionales gigantes. Rev Hispanoam Hernia 2: 145-151. 28. Oliveira L, Futema F, Antunes G, Jardim J, Ryuchi L, Yuji F, Ramos D, Nii F, Reis D, Meyer A, Andraus W & Carneiro L (2017). Component separation of abdominal wall with intraoperative botulinum A presents satisfactory outcomes in large incisional hernias: a case report. International Journal of Surgery Case Reports 41: 99-104. 29. Zielinski M, Goussous N, Schiller H & Jenkins D (2013). Chemical components separation with botulinum toxin A: a novel technique to improve primary fascial closure rates of the open abdomen. Hernia 17: 101- 107. 30. Rodríguez O, Elstner K, Jacombs A, Read J, Tomazini R, Arduini F, Wehrhahm M, Craft C, Cosman P, Dardano A & Ibrahim N (2017). Preoperative Botulinum toxin A enabling defect closure and laparoscopic repair of complex ventral hernia. Surg Endosc http://doi.org/10.1007/s00464-017-5750-3. 31. Zendejas B, Khasawneh M & Srvantstyan B (2013). Outcomes of chemical paralysis using botulinum toxin for incisional hernia repairs. World J Surg 37: 2830-2837. 32. Hobar P, Rohrich R, Byrd H. Abdominal- wall reconstruction with expanded musculofascial tissue in a posttraumatic defect (1994). Plast Reconstr Surg 94: 379-383. 33. Jacobsen W, Petty P & Bite U. Massive abdominal- wall hernia reconstruction with expanded external/internal oblique and transversalis musculofascia (1997). Plast Reconstr Surg 100: 326- 335. 28 34. Paletta C, Huang D & Dehgan K (1999). The use of tissue expanders in staged abdominal wall reconstruction. Ann Plast Surg 42: 259- 265. 35. Weissler J, Lanni M, Tecce M, Carney M, Shubinets V & Fischer J (2017). Chemical component separation: a systematic review and meta- analysis of botulinum toxin for management of ventral hernia. Journal of Plastic Surgery and Hand Surgery. http://dx.doi.org/10.1080/2000656X.2017.1285783 36. Mayagoitia JC, Suárez D, Arenas JC & Díaz V (2006). Preoperative progressive pneumoperitoneum in patients with abdominal-wall hernias. Hernia 10: 213-217. 37. López M, Robres J, López M, Barri J, Lozoya R, López S, Vasco M, Buqueras M, Subirana H & Jorba R (2013). Neumoperitoneo preoperatorio progresivo en pacientes con hernias gigantes de la pared abdominal. Cir Esp 91 (7): 444-449.