Las proteínas que se ingieren en la dieta no puede ser absorbidas por el organismo
Anuncio

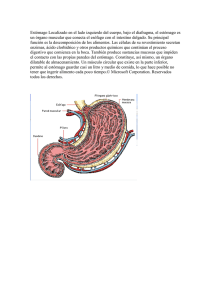
Las proteínas que se ingieren en la dieta no puede ser absorbidas por el organismo , razón por la cual deben de ser digeridos hast aminoácidos libres o pequeños péptidos, los cuales pueden ser absorbidos en el intestino y poder llegar a la sangre, y en el proceso se cuenta con la participación de diferentes peptidasas, donde algunas de ellas actúan como endopeptidas, hidrolizando enlaces peptídicos internos y generando fragmentos peptídicos grandes, y otras de estas enzimas como exopeptidasas, hidrolizando los péptidos desde su extremo carboxiterminal (carboxipeptidasas) o desde el amino-termi- nal (aminopeptidasas). La gran mayoría de estas enzimas se producen como zimógenos y han de ser activadas hidrolíticamente antes de ejercer su acción. La digestión de las proteínas comienza en el estómago, donde el jugo gástrico genera un pH inferior a 1 debido a la presencia de HCl. El com- ponente más conocido de jugo gástrico es el ácido clorhídrico, el pro- ducto de secreción de las células parietales u oxínticas. La capacidad del estómago para secretar HCl es directamente proporcional al número de células parietales. Cuando estas células son estimuladas secretan HCl a una concentración de, aproximadamente, 160 mM (equivalente a un pH de 0,8); que mediante grandes canalículos, invaginaciones profundas de la membrana plasmática, llega al lumen del estómago. La capacidad de la célula parietal para secretar ácido depende de un transporte activo, cuya clave es una H+/K+ ATPasa localizada en la membrana de los cana- lículos y que actúa como “bomba de protones”. El epitelio del estómago es intrínsecamente resistente a los efectos dañinos del ácido clorhídrico. Sin embargo, la secreción excesiva de ácido gástrico es un problema im- portante, dando lugar a gastritis y úlceras gástricas. El HCl desnaturaliza las proteínas de la dieta, desestabilizando su estructura terciaria y hacién- dolas, de esta forma, más accesibles a los ataques enzimáticos. La pepsina A es la principal proteasa del estomago, es activa a pH acido y se inactiva a pH neutro. Es una endopeptidasa que hidroliza los enlaces peptídicos en los que el aminoácido que aporta el grupo carboxilo al enlace es Phe, Tyr o Leu. Esta enzima es una aspartato proteasa que contiene dos residuos de aspartato en su centro catalítico, los grupos carboxílicos de ambos son decisivos en el mecanismo catalítico. La pepsina A se produce en el estómago en forma de zimógeno, el pep- sinógeno, que tiene un péptido adicional de 44 residuos en el extre- mo amino-terminal, que se elimina espontáneamente a pH ácido por hidrólisis del enlace entre Leu e Ile, generándose pepsina (figura 13.1); la pepsina a su vez puede activar otras moléculas de pepsinógeno por autocatálisis.