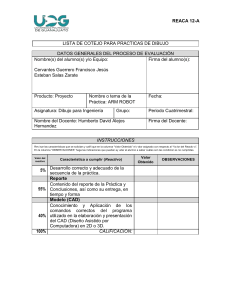
4.- la reacción de un aldehído con reactivo de grignard es una adición nucleofílica al doble enlace carbono oxígeno: Los reactivos de Grignard son compuestos organometálicos de fórmula general R-Mg-X, donde R es un resto orgánico (alquílico o arílico) y X un halógeno. Los reactivos de Grignard son unos de los más importantes y versátiles en química orgánica debido a su rápida reacción con electrófilos, como por ejemplo el grupo carbonilo. Son importantes para la formación de enlaces de carbono-carbono, carbono-fósforo, carbono-estaño, carbonosilicio, carbono-boro y otros enlaces carbono-heteroátomo.12 Por el descubrimiento de estos reactivos y sus reacciones, Victor Grignard recibió el premio Nobel de Química en 1912. a) Cual es el nucleofilo Mecánicamente la reacción de Grignard es una adición nucleófila en la que se añade el átomo de carbono polarizado negativamente (carbanión) del reactivo de Grignard al átomo de carbono de un grupo carbonilo. Por lo tanto, se forma un nuevo enlace carbono-carbono. Se cree que en el estado de transición de la reacción están involucradas dos moléculas del compuesto de Grignard, resultando un estado de transición de seis miembros cíclico. 4 El átomo de oxígeno del carbonilo del metal toma la forma de un alcóxido de metal. En el siguiente paso este átomo de oxígeno se protona por un ácido acuoso diluido y después se hidroliza por el ataque nucleófilo de una molécula de agua. Por desprotonación se produce el alcohol correspondiente.5 b) El magnesio en el reactivo de grignard que función tiene Los reactivos de Grignard se sintetizan a partir de un halogenuro de alquilo o arilo al reaccionar con magnesio en presencia de un éter anhidro (seco): Para que esta reacción tenga éxito, tanto los reactivos como el material utilizado deben estar completamente secos, y trabajar en atmósfera inerte. Sobre un matraz se coloca magnesio en forma de virutas o limaduras y se cubre con unos pocos mililitros del disolvente (dietil éter o tetrahidrofurano, generalmente; otra alternativa es el 2-Metiltetrahidrofurano más benigno con el medio ambiente). Se añade una pequeña cantidad de activante (usualmente dibromoetano o yodo) y, una vez activada la superficie del magnesio mediante la aplicación de calor, se comienza a adicionar la disolución del compuesto halogenado correspondiente previamente disuelto. Suele ser necesario calentar hasta que la reacción finaliza. Por último sólo es necesario filtrar la disolución (siempre bajo atmósfera inerte). Para que tenga cierta estabilidad el reactivo de Grignard debe encontrarse solvatado. Esta reacción se lleva a cabo en disolventes nucleófilos que no tienen hidrógeno activo, como el éter dietílico anhidro o éteres superiores (dibutil éter, anisol, tetrahidrofurano...), como se ha comentado anteriormente. Llevan cada uno dos pares de electrones libres, que complejan al magnesio y proporcionan la estabilidad necesaria cumpliendo la regla del octeto.3 Por ejemplo, el tetrahidrofurano formaría el siguiente complejo de bromuro de alquilmagnesio: c)Que producto se forma al reaccionar agua La misma reactividad que hace tan útil al reactivo de Grignard limita estrictamente las posibilidades de su empleo. Cuando planificamos als condiciones experimentales de una síntesis, debemos tener presente esta reactividad para seleccionar el halogenuro que ha de convertirse en el reactivo de Grignard, y elegir el compuesto con el que ha de reaccionar. En nuestro primer encuentro con el reactivo de Grignard, reaccionó con agua para formar un alcano; el agua, que es el ácido más fuerte, desplaza de su sal al ácido extremadamente débil, el alcano. Del mismo modo, todo compuesto que tiene hidrógeno unido a un elemento electronegativo oxígeno, nitrógeno, azufre e, incluso, carbono con enlace triple es suficientemente ácido como para descomponer al reactivo de Grignard, que también reacciona velozmente con oxígeno y dióxido de carbono, y con casi todos los compuestos orgánicos con enlaces múltiples carbono-oxígeno o carbono-nitrógeno. ¿Cómo afecta todo esto a nuestra reacción entre un reactivo de Grignard y un aldehído? En primer lugar, el halogenuro de alquilo, el aldehído y el éter empleado como disolvente, deben ser secados escrupulosamente y liberados del alcohol, del cual probablemente derivan las materias primas: un reactivo de Grignard ni siguiera se formará en presencia de agua. Nuestro equipo debe estar completamente seco antes de comenzar. Debemos proteger todo el sistema del vapor de agua, oxígeno y dióxido de carbono atmosféricos: el primero puede mantenerse fuera del equipo, empleando tubos con cloruro de calcio, y los otros dos pueden sacarse por arrastre con nitrógeno seco. Una vez hecho esto, podemos abrigar la esperanza de obtener un buen rendimiento en producto, siempre que la elección del halogenuro y del aldehído haya sido adecuada. No podemos preparar un reactivo de Grignard con un compuesto (por ejemplo, HOCH2CH2Br) que, además del halógeno, contenga algún grupo (por ejemplo, -OH) que Grignard reaccionaría con el grupo activo (-OH) de otra molécula para generar un producto no deseado (HOCH2CH2-H). Debemos ser particularmente precavidos en la preparación de un halogenuro de arilmagnesio, en vista de la amplia variedad de sustituyentes que pueden encontrarse en el anillo bencénico. Carboxilo (-COOH), hidroxilo (-OH), amino (-NH2) y -SO3H contienen hidrógeno unido a un oxígeno o nitrógeno, por lo que son tan ácidos que descompondrían un reactivo de Grignard. Acabamos de ver que estos reactivos se adicionan al grupo carbonilo (C=O) y, en forma similar, también se agregan a los grupos -COOR y -C=N; en cambio, el grupo nitro (-NO2), los oxida. Son relativamente pocos los grupos que pueden estar presentes en la molécula de halogenuro que se emplea para preparar un reactivo de Grignard, entre ellos están -R, -Ar, -OR y -CI (de un cloruro de arilo).Por motivos similares, el aldehído (u otro compuesto) con que ha de reaccionar un reactivo de Grignard no debe contener otros grupos sensibles a él. Por ejmplo, un reactivo de Grignard se descompondría antes de poder añadirse al grupo carbonilo de: 4.- A partir del ACETALDEHIDO escribe el mecanismo de una reacción al para obtener 2- metil -3- hidroxibutanal Se elige como cadena principal la que contiene las dos funciones, CHO y OH. El nombre del compuesto propuesto es 2-Metil-3-hidroxibutanal. CH3COOCH2CH3 La reacción entre un ácido carboxílico y un alcohol es una reacción de esterificación y los productos resultantes de la misma son un éster y agua. De las sustancias propuestas la correcta es CH3COOCH2CH3, acetato de etilo, que se obtiene mediante la siguiente reacción: CH3COOH(l) + CH3CH2OH(l)---) CH3COOCH2CH3(l) + H2O(l) 5.- Describa los productos obtenidos de la reacción del propanal con: A)NaBH4 en NaOH acuoso Se trata de convertir el nitrilo en una amina, dejando intacto el grupo carbonilo. Es una reducción que puede hacerse empleando hidruro de litio y aluminio; sin embargo, el H4AlLi también reducirá la cetona, convirtiéndola en un alcohol secundario. La estrategia a seguir es muy simple: primero se protege el grupo carbonilo en forma de acetal, a continuación se lleva a cabo la reducción y, finalmente, se regenera el grupo carbonilo hidrolizando el acetal: B) LiAlH4 y Agua El borohidruro sódico (NaBH4) es menos reactivo que el H4AlLi y, por consiguiente, más selectivo. En condiciones ordinarias no reacciona con ésteres, amidas, nitrilos y nitrocompuestos: 6.-explica la reacción de oxidación Qué diferencia a los aldehídos de las cetonas reacción del(reacción de haloformo y el ensayo de tollens) La prueba de Tollens. El reactivo de Tollens, el agente de oxidación suave usado en esta prueba, es una solución alcalina de nitrato de plata, es transparente e incolora. Para evitar la precipitación de iones de plata como oxido de plata a un pH alto, se agregan unas gotas de una solución de amoniaco, que forma con los iones plata un complejo soluble en agua: Al oxidar un aldehído con el reactivo de Tollens, se produce el correspondiente ácido carboxílico y los iones plata se reducen simultáneamente a plata metálica. Por ejemplo, el acetaldehído produce ácido acético, la plata suele depositarse formando un espejo en la superficie interna del recipiente de reacción. La aparición de un espejo de plata es una prueba positiva de un aldehído. Si se trata el acetaldehído con el reactivo de Tollens, la reacción es la siguiente: La reacción del haloformo es una reacción orgánica en la que se produce un haloformo por halogenación exhaustiva de una metilcetona en presencia de una base. R puede ser hidrógeno, un radical alquilo o un radical arilo. La reacción puede ser utilizada para producir CHCl₃, CHBr₃ o CHI₃. Las cetonas metílicas(1) reaccionan con halógenos en medios básicos generando carboxilatos(2) y haloformo(3). El mecanismo consiste en halogenar completamente el metilo, sustituyendo en una etapa posterior el grupo -CX3 formado por -OH. El grupo CI3- es muy básico y desprotona el ácido carboxílico formándose yodoformo y el carboxilato. Esta reacción (con yodo) puede emplearse como ensayo analítico para identificar cetonas metílicas aprovechando que el yodoformo precipita de color amarillo.