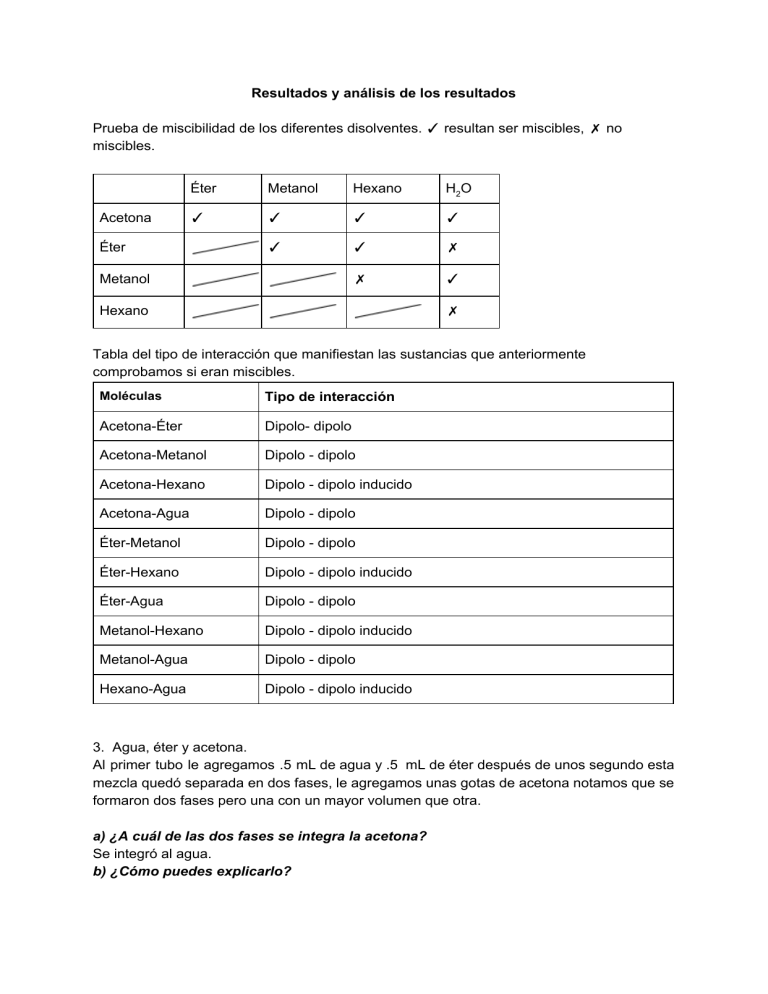
Resultados y análisis de los resultados Prueba de miscibilidad de los diferentes disolventes. ✓ resultan ser miscibles, ✗ no miscibles. Acetona Éter Metanol Hexano H2O ✓ ✓ ✓ ✓ ✓ ✓ ✗ ✗ ✓ Éter Metanol Hexano ✗ Tabla del tipo de interacción que manifiestan las sustancias que anteriormente comprobamos si eran miscibles. Moléculas Tipo de interacción Acetona-Éter Dipolo- dipolo Acetona-Metanol Dipolo - dipolo Acetona-Hexano Dipolo - dipolo inducido Acetona-Agua Dipolo - dipolo Éter-Metanol Dipolo - dipolo Éter-Hexano Dipolo - dipolo inducido Éter-Agua Dipolo - dipolo Metanol-Hexano Dipolo - dipolo inducido Metanol-Agua Dipolo - dipolo Hexano-Agua Dipolo - dipolo inducido 3. Agua, éter y acetona. Al primer tubo le agregamos .5 mL de agua y .5 mL de éter después de unos segundo esta mezcla quedó separada en dos fases, le agregamos unas gotas de acetona notamos que se formaron dos fases pero una con un mayor volumen que otra. a) ¿A cuál de las dos fases se integra la acetona? Se integró al agua. b) ¿Cómo puedes explicarlo? Porque las interacciones entre el agua y la acetona son de tipo dipolo-dipolo, y aunque las interacciones entre el acetona y éter son dipolo- dipolo son más débiles a causa de la no polaridad del éter. 4. Adición de más acetona. Seguimos agregando acetona hasta los dos mililitros y agitando muy bien la mezcla ésta se disolvió por completo. a) ¿Qué pasó? Se disolvió la muestra b) ¿Por qué? Porque había un exceso de acetona entonces aunque las interacciones entre el éter y la acetona fueran débiles podían llevarse a cabo por dicho exceso. 5. Yodo, acetona y hexano. -En el segundo tubo colocamos un cristal de yodo con un mL de acetona, esta disolución se volvió de un tono marrón. ¿Qué tipo de interacción intermolecular se manifiesta entre el yodo y la acetona? Dipolo-dipolo inducido, debido a que el yodo es no polar. ¿Qué tipo de interacción intermolecular se presenta entre el yodo y el hexano? Dipolo instantáneo-dipolo inducido debido a que ambas moléculas son no polares. - En el tercer tubo colocamos, de igual manera, un cristal de yodo y un mL de hexano y esta se tornó de un color rosa claro, continuamos agregando acetona hasta los tres mililitros y paso de rosa claro a marrón. ¿Cuál de las dos posibles interacciones predomina y qué explicación sugieren para esta observación? Dipolo-dipolo inducido porque el color que observamos fue el mismo que cuando agregamos yodo y acetona, y en realidad esta fuerza es mayor que la dispersión de London que se presenta con el hexano. Después de realizado este experimento, ¿qué opinión tienes acerca de la conocida regla empírica “lo similar disuelve a lo similar”? Que dicha regla tiene sus excepciones como el caso anterior, porque aunque el hexano y el yodo eran similares en cuanto a su polaridad lo que en realidad influyeron fueron las fuerzas intermoleculares. 6. Yodo, agua, hexano. -Al cuarto tubo le agregamos un cristal de yodo y un mL de agua, el cristal se disolvió por completo en el agua teniendo un color amarillo, pasamos esta mezcla a otro tubo y le añadimos 1 mL de hexano y esto se separó en dos fases, una de color rosa muy claro y otra transparente. ¿Por qué? Al principio el yodo y el agua no se disolvieron por completo porque son interacciones diferentes, y al agregar hexano se crearon las dos fases donde en la parte superior se encontraba el agua que anteriormente no se había disuelto ni con el yodo ni con el hexano, y en la fase de color rosa se encontraba el hexano y el yodo porque ambos tienen el mismo tipo de interacción. -En otro tubo se disolvió un cristal de yodo en un mL de agua siendo esta disolución de color amarilla y le añadimos la disolución de KI cambiando a un color rojizo. ¿Qué tipo de interacción es la que da origen a la especie I 3 ? Ion- dipolo inducido -En el último tubo agregamos una pequeña cantidad de KI con agua siendo de un color rojo, después de agitarlo se volvió un rojo más fuerte. a) Describe lo que observaste y explica lo que sucedió en función de fuerzas intermoleculares: Cuando agregamos una cantidad mayor cantidad de KI, las interacciones de tipo ion-dipolo inducido aumentaron y dichas interacción son muy fuertes, entonces al encontrarse interacciones de más fuerza, la solubilidad aumenta.. 10. Torito En un tubo de ensaye agregamos un mililitro de agua y un poco de acetilacetonato de hierro(III) siendo esta disolución de color rojo calor, después, añadimos 1 mL de éter etílico y se formaron dos fases una de color rojo y otra otra turbia, finalmente, agregamos NaCl y agitamos y quedaron dos fases de color rojo y anaranjado. Considerando las interacciones intermoleculares, ¿cómo podrías explicar lo que observaste? Cuando agregamos el agua al acetilacetonato de hierro(III) había una interacción de tipo ion-dipolo y cuando agregamos éter etílico no se disolvió porque no hubo un cambio de color de color en nuestra mezcla heterogénea y esto nos dice que la interacción ion- dipolo es de una fuerza superior. Cuando agregamos el NaCl, se disolvió por los cambios que notamos en nuestra disolución, esto se debe a que la interacción que proporcionó el NaCl fueron del tipo ion-dipolo. Para pensar... 11.- Si las interacciones ion-ion son mucho más fuertes que las interacciones ion-dipolo, ¿por qué muchos compuestos iónicos son solubles en agua? Porque el disolvente minimiza la energía de red cristalina y como consecuencia se generan interacciones intermoleculares de tipo ion-dipolo. ¿Qué aprendí? Los resultados están basados en la solubilidad de las sustancias, las fuerzas intermoleculares determinan si una sustancia es miscible en otra, hay sustancias que al mezclarlas no son miscibles entre sí pero si se agrega otra sustancia si se logra disolver, así como hay otras que al mezclarse forman 2 o más fases, observamos los colores que se obtenían así como la capacidad que tenían de disolverse y también se mencionaron los nombres de esas fuerzas que se llevan a cabo en los disolventes y son las que le dan la característica física de disolver y que depende que sean polares para disolver algo polar o lo contrario es decir lo similar disuelve lo similar. Conclusión Logramos el objetivo de saber cómo tienen que ver las fuerzas intermoleculares con la solubilidad así pudimos observar que esto es lo que cambia las propiedades físicas y así saber qué sustancias pueden disolverse en otras y cuáles no, porque es cierto lo similar disuelve lo similar. Las fuerzas intermoleculares también ayudan a poder predecir si una sustancia es miscible en otra y en esta práctica fue fácil de entender y de ver. Referencias Quimica la ciencia central - Theodore L Brown, Editorial Pearson pag 409-414 9na edicion Modelos vs. dibujos: el caso de la enseñanza de las fuerzas intermoleculares Revista Electrónica de Enseñanza de las Ciencias Vol.8 Nº1 (2009) https://goo.gl/25DDse