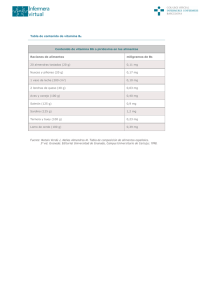
DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASCÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO CRISTINA ÁLVAREZ GARCÍA 2ºº BACHILLERATO CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO ÍNDICE RESUMEN .......................................................................................................... 1 INTRODUCCIÓN ................................................................................................ 2 1. Antecedentes generales .............................................................................. 2 1.1. La vitamina C (ácido ascórbico) ............................................................... 2 1.1.1. Historia ............................................................................................ 2 1.1.2. Estructura química .......................................................................... 3 1.2. Funciones de la vitamina C ...................................................................... 4 1.3. Fuentes de vitamina C .............................................................................. 5 1.3.1. Naranja (Citrus aurantium), limón (Citrus arantifolia), mandarina (Citrus reticulada) ............................................................................... 5 1.4. Métodos de cuantificación REDOX .......................................................... 6 1.4.1.. Volumetría REDOX ......................................................................... 7 Concepto tradicional de REDOX..................................................... 7 Concepto electrónico de oxidación-reducción ................................ 8 MATERIALES Y MÉTODOS ............................................................................... 9 2. Parte experimental ....................................................................................... 9 2.1. Emisión de una o más hipótesis .............................................................. 9 2.2. Reactivos utilizados ................................................................................. 9 2.3. Materiales de laboratorio utilizados ......................................................... 10 2.4. Diseño del experimento ........................................................................... 10 2.5. Desarrollo del experimento ...................................................................... 10 2.5.1. 1ª Experiencia ................................................................................. 10 2.5.2. 2ª Experiencia ................................................................................ 11 2.6. Explicación del proceso REDOX (reacción del yodo con el ácido ascórbico) ................................................................................................. 12 RESULTADOS ..................................................................................................... 14 3. Resultados y observaciones ........................................................................ 14 3.1. Recogida de datos................................................................................... 14 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO 3.2. Observaciones......................................................................................... 18 CONCLUSIONES ................................................................................................. 19 4. Conclusiones y recomendaciones ............................................................... 19 4.1. Conclusión ................................................................................................ 19 BIBLIOGRAFÍA .................................................................................................... 21 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO SUMMARY Vitamins are organic substances that keep metabolic functioning, that are not synthesized in the organism and therefore must be obtained from external sources. Vitamins are sensitive to different physical and chemical agents, the most sensitive is vitamin C that is easily degraded by changes in temperature, exposure to sunlight and oxygen concentration. Vitamin C is a water-soluble vitamin that is found naturally in various fruits and vegetables. Because of vitamin C is thermolabile, it is possible to have a variation in the concentration with the passage of time, for this reason, it is important to establish the mechanisms that affect its stability and that influence in its lifespan. Because of its instability, a sensitive and rapid technique was used that allowed its concentration to be evaluated. For this study, three citrus fruits, considered of higher consumption, were taken as variable: orange (Citrus aurantium), lemon (Citrus aurantifolia) and tangerine (Citrus reticulata). The problem or curiosity that appears is to know the quantity of vitamin C, so necessary for the human being, which is ingested when we take a fruit juice. The objective of this work was to apply an analytical method for the extraction, identification and quantification of vitamin C in orange (Citrus aurantium), lemon (Citrus aurantifolia) and mandarin (Citrus reticulata), considering the instability of this vitamin over time. In addition, the comparison between the concentration of vitamin C present in the fruits mentioned above. Finally, taking into account the questions we ask ourselves from the beginning, how much vitamin C does each juice contain? What juice contains more vitamin C? What happens to the vitamin over time? 1 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO INTRODUCCIÓN 1. ANTECEDENTES GENERALES 1.1. LA VITAMINA C Los zumos nos aportan vitaminas, azúcares y energía para seguir adelante día a día. Uno de los componentes fundamentales en casi todos ellos es el ácido ascórbico. Este, usualmente llamado vitamina C es un nutriente esencial para el metabolismo. 1.1.1. HISTORIA La vitamina C fue denominada la “vitamina antiescorbútica”, ya que previene y cura el escorbuto, de ahí su nombre ácido ascórbico. Dicha enfermedad causaba desde la debilidad de encías hasta hemorragias diseminadas por todo el organismo. Aunque esta había sido descubierta mucho antes, (en el siglo XIII estaba descrita en diversos textos) tuvo una gran importancia histórica debido a sus incidencias en las flotas de los siglos XVI al XVIII, causaba bastantes más bajas que las propias batallas navales. En 1749 James Lind, médico escocés de una marina, se dio cuenta del espectacular efecto beneficioso que tenía el consumo de cítricos sobre las afecciones del escorbuto. Fue el responsable de su apelativo “factor antiescorbútico”. Al principio, se suponía que las propiedades ácidas eran las responsables de estos beneficios, sin embargo, pronto se hizo evidente al ver como otros ácidos como el vinagre no tenían el mismo efecto. En 1907, dos médicos noruegos informaron de un compuesto esencial en los alimentos para prevenir la enfermedad y finalmente unos años más tarde demostraron que era la vitamina C. 2 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO 1.1.2. ESTRUCTURA QUÍMICA La vitamina C es muy soluble en agua, medianamente en alcohol e insoluble en componentes orgánicos; poco estable en medio alcalino y termolábil pero resistente a la congelación. Todas estas propiedades se deben a su estructura. La fórmula de la vitamina C6H8O6 y tiene un peso molecular de 176,13 g/mol. Posee 4 formas estructurales, el ácido D-ascórbico, L-ascórbico, D-isoascórbico y el ácido L-isoascórbico; pero de todos ellos únicamente el ácido L-ascórbico posee actividad antiescorbútica. Podemos apreciar la estructura del ácido L-ascórbico en la figura 1.1 Figura 1.1 Estructura del Ácido L-ascórbico La vitamina C interconvertibles: puede presentarse ácido ascórbico en dos (forma formas reducida) químicas y ácido dehidroascórbico (forma oxidada), siendo ambas formas funcionales biológicamente. Estas serán las tratadas en este trabajo. Figura 1.2 Formas biológicamente activas de la vitamina C OH HO 5 O 4 3 HO 1 O HO OH 5 O 4 2 3 OH O 1 2 O Ácido dehidroascórbico 3 O CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO 1.2. FUNCIONES DE LA VITAMINA C Las funciones metabólicas y biológicas de la vitamina C, están basadas en sus propiedades de oxido-reducción. Su papel biológico principal parece ser el de actuar como cofactor en diversas reacciones enzimáticas que tienen lugar en el organismo. El ácido ascórbico actúa como coenzima de las hidroxilasas de prolina y lisina, encargadas de hidroxilar éstas en el protocolágeno, modificación necesaria para que éste pueda formar las fibrillas de colágeno. En este sentido, la vitamina C es importante para el mantenimiento del tejido conjuntivo normal, para la curación de heridas y para la formación del hueso, ya que el tejido óseo contiene una matriz orgánica con colágeno. Esta termina siendo su función principal. En su condición de agente reductor, el ácido ascórbico posee otras propiedades importantes, que parecen ser no enzimáticas. Por ejemplo, ayuda a la absorción del hierro al reducirlo a su estado ferroso en el estómago; protege la vitamina A, vitamina E y algunas vitaminas B de la oxidación; también favorece la utilización del ácido fólico… Finalmente, la vitamina C es un gran antioxidante, ya que es capaz de unirse a radicales libres, unas sustancias muy reactivas que introducen oxígeno en las células provocando la oxidación de alguna de sus partes o cambios diversos que influyen en el envejecimiento del cuerpo. De esta forma, evita la proliferación de tumores cancerígenos y además evita las enfermedades cardíacas. La mayor parte de síntomas de la carencia de vitamina C se puede relacionar directamente con sus papeles metabólicos. Entre los síntomas de carencias leves de vitamina C se encuentran la facilidad para producir heridas, debido al incremento de la fragilidad de los capilares. El escorbuto está asociado con una disminución en la capacidad de curar heridas, osteoporosis, hemorragias y anemia. 4 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO 1.3. FUENTES DE VITAMINA C Al ser una vitamina que se destruye fácilmente por oxidación, y más aún en presencia de álcalis y calor; su contenido en los alimentos disminuye. Los alimentos de origen animal no contienen vitamina C, pero la gran mayoría de frutas y verduras si, siendo los pimientos, los cítricos, las coles, la coliflor, las espinacas y las frutas como el plátano, los mangos, la manzana, la naranja, el limón, la mandarina, el kiwi, la piña y el melón los que mayores concentraciones tienen de ésta. Debajo se mostrará una tabla donde se podrá apreciar una lista con algunos de los alimentos más ricos en vitamina C. Tabla 1.1 Alimentos ricos en vitamina C Kiwi 500 Guayaba 480 Pimiento rojo 204 Grosella negra 200 Perejil 150 Caqui 130 Col de Bruselas 100 Naranja 80 Coliflor 70 Espinaca 60 *Cantidades expresadas en mg/100g. La cantidad recomendada por día es de 50-60 mg 1.3.1. CÍTRICOS El limón (Citrus aurantifolia), la naranja (Citrus aurantium) y la mandarina (Citrus reticulata) son alimentos ricos en vitamina C que tiene estupendas propiedades antiescorbúticas y mineralizantes. Poseen nutrientes importantes entre ellos: azúcares, aminoácidos y sales minerales; entre las vitaminas, se analizará sobre la que tratamos en este estudio La vitamina C, que en la naranja se conoce que posee 5 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO un aporte de 60 mg por cada 100g, en el limón 50 mg y en la mandarina que posee 35 mg. Además, contienen unas importantes cantidades de potasio y calcio. A continuación, se presenta una tabla donde se detalla la composición química de los tres frutos en estudio. Imagen 1.1 Naranja (Citrus aurantium), limón (Citrus aurantifolia), y mandarina (Citrus reticulata) T a b Tabla 1.2. Composición química de la naranja, limón y mandarina Agua Calorías Proteína Grasa Vitamina Mg (%) Naranja (cal) (g) (g) C (mg) K (mg) (mg) 88 35-50 0.8-1 0.1 60 15 200 Limón 82.8 29 0.8-1 0.1 50 8 137 Mandarina 83.2 37 0.8-1 0.1 35 11 185 1.4. MÉTODOS DE CUANTIFICACIÓN, REDOX Existen varios métodos para poder cuantificar el contenido de vitamina C de un alimento. De ellos se conocen la cromatografía y la titulación volumétrica de óxido-reducción. La cromatografía líquida de alta presión (HPLC) es el método más utilizado por ofrecer una gran precisión de los resultados. Es utilizada para separar los componentes de una mezcla basándose en diferentes tipos de interacciones químicas. Sin embargo, la técnica de HPLC resulta bastante cara, por ello en esta práctica se determinará el contenido de vitamina C 6 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO presente en la fruta, en bebidas preparadas mediante una titulación volumétrica de óxido reducción. 1.4.1. VOLUMETRÍA REDOX La volumetría oxidación reducción (REDOX) es una técnica o método analítico muy usado, que permite conocer en una disolución la concentración de una sustancia que pueda actuar como oxidante o reductor. En ella se mide el volumen de una disolución de concentración conocida (disolución patrón o titulante patrón) necesario para reaccionar completamente con un compuesto en disolución de concentración desconocida. Para determinar cuándo se ha llegado al final de la titulación, en la disolución problema se agrega un indicador que sufre un cambio físico apreciable, como por ejemplo cambio de color, en el punto final de la reacción. Es un tipo de valoración basada en una reacción redox entre la sustancia cuya concentración queremos conocer y la sustancia valorante. CONCEPTO TRADICIONAL DE REDOX Los términos de oxidación y reducción fueron utilizados originalmente en Química para referirse a la combinación de cualquier sustancia química con oxígeno. Según esta primera acepción, oxidación es la combinación de una sustancia con oxígeno y reducción, el proceso inverso, es decir, la pérdida de oxígeno de una sustancia. Pero pronto la Química puso en manifiesto que esa interpretación resultaba insuficiente, pues se producían reacciones en las que los átomos experimentaban cambios análogos a los que tenían lugar en los procesos de oxidación-reducción, pero sin intervención del oxígeno. Para que estos procesos pudieran considerarse procesos de oxidación-reducción (procesos redox) se hizo necesario desarrollar el concepto electrónico de este proceso, vigente en la actualidad. 7 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO CONCEPTO ELECTRÓNICO DE OXIDACIÓN-REDUCCIÓN Se considera que un proceso es de oxidación-reducción cuando en él se producen transferencias o intercambios de electrones de unas especies químicas a otras; una especie química cede electrones y otra los capta. Cuando una especie química gana electrones se dice que se reduce (reducción) Cuando una especie química pierde electrones se dice que se oxida (oxidación) Asociados a estos conceptos de oxidación y de reducción se encuentran los de especies químicas oxidantes y reductoras. Para que una especie química se reduzca debe haber otra que se oxide. Por eso, la especie química que se reduce (que gana electrones) se dice que es el agente oxidante, ya que favorece que otra se oxide (pierda electrones). La especie química que se oxida (que pierde electrones) se dice que es el agente reductor, porque favorece que la otra se reduzca (gane electrones). 8 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO MATERIALES Y MÉTODOS 2. PARTE EXPERIMENTAL 2.1. REACTIVOS UTILIZADOS Normalmente se suele utilizar un reactivo de laboratorio cuyo nombre es Lugol (disolución de yodo al 5% y yoduro de potasio al 10%, en agua). Pero debido a la disponibilidad de este reactivo se decidió desarrollar esta técnica a partir de productos yodados que se utilizan habitualmente para tratar las heridas. Así se utiliza tintura de yodo (disolución de yodo en alcohol) que en España este producto se comercializa con el nombre de Betadine. Este reactivo funcionará como el agente oxidante de la vitamina C. Fécula o almidón de maíz, (comercialmente conocido como maicena) que ejercerá el papel de indicador para concluir el final de la titulación. Zumos o bebidas de frutas naturales, (de las frutas mencionadas anteriormente) los cuales contendrán lo fundamental de este estudio, la vitamina C que funcionará como el agente reductor hasta que termine de oxidarse completamente por la acción del yodo. Agua 2.2. MATERIALES DE LABORATORIO UTILIZADOS Tubos de ensayo Gradilla Vaso de precipitado Cuentagotas Colador Pipeta Placa calefactora Exprimidor 9 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO 2.3. EMISIÓN DE UNA O MÁS HIPÓTESIS El ácido ascórbico como ya se sabe es una molécula orgánica muy inestable frente a fuentes de calor, al contacto con el oxígeno o a la luz, por lo que se descompone formando ácido dehidroascórbico. Por esta razón, los zumos se envasan al vacío y en recipientes opacos. Conociendo estos datos, sería lógico formular la hipótesis de que en la muestra de los zumos recién exprimidos se obtendrá mayor cantidad de vitamina C que en las que van a ser apartados y dejados a la exposición del aire. 2.4. DISEÑO DEL EXPERIMENTO Este trabajo se ha de fundamentar en la organización, antes de empezar con el proceso experimental, lo primordial será revisar el material de laboratorio, vaso de precipitado, bureta, tubos de ensayo… En segundo lugar, se realizará la disolución necesaria con el agua y almidón. Por último, se procederá a exprimir las frutas necesarias en diferentes lapsos de tiempo para preparar las diferentes condiciones en las que se encontrarán los zumos en el momento de la valoración. 2.5. DESARROLLO DEL EXPERIMENTO Una vez revisado el material del laboratorio se empieza el proceso experimental. Como se ha mencionado se quiere saber la cantidad de vitamina C que contiene cada zumo de fruta y su respectiva comparación, y por último la variación que encontramos en sus respectivas cantidades con el paso del tiempo. Por lo que habrá que diferenciar dos experiencias distintas: 2.5.1. 1ª EXPERIENCIA: Cantidad de vitamina C de cada zumo de fruta El proceso será el siguiente: En primer lugar, se cogen seis tubos de ensayos para tener seis muestras, se limpian bien y se colocan en una gradilla. Seguidamente, se pone a calentar un vaso de precipitado con agua destilada hasta que 10 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO alcance su grado de ebullición (100ºC) y a continuación se le añaden unas cucharadas de almidón. Deberemos revolver hasta que éste se disuelva. Mientras se espera a que se disuelva, se empezará a cortar la fruta para posteriormente ser exprimida con el exprimidor. Cuando esté listo, con la ayuda de un colador, se evitará el paso de otras sustancias (como la pulpa). De esta forma se tendrá el zumo listo. Una vez tengamos el zumo de la fruta que vayamos a utilizar, se extraerán 5 ml con la ayuda de la pipeta y se irán depositando en cada uno de los tubos de ensayo. A continuación, con la ayuda del cuentagotas añadiremos 3 gotas de la disolución de agua destilada y almidón a cada uno de los tubos, la cual debe de estar caliente. Ahora se comenzará a añadir gotas de Betadine a la primera muestra y se irá agitando hasta que el color del zumo cambie de color a un tono oscuro (marrón), de esta forma se podrá saber cuándo la vitamina C ha sido completamente oxidada. Dependiendo de las gotas de Betadine que se usen se cuantificará la cantidad de vitamina C que tiene el zumo, por lo que se tendrá que anotar el número de gotas. Todo este proceso se realizará con cada fruta y se anotarán sus respectivos resultados. Con esto realizado, ya se podría cuantificar y comparar las cantidades de vitamina C que hay en cada zumo de fruta. 2.5.2. 2ª EXPERIENCIA: Variación de la vitamina C con el paso del tiempo Para saber su variación con el paso del tiempo se realizará todo lo anteriormente explicado en la experiencia anterior y se continuará con lo siguiente: 11 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO A partir de este momento, se irán añadiendo gotas de Betadine en las demás muestras, pero a determinadas horas. Si las gotas de Betadine que se echaron en la primera muestra fueron a las 12 am., las siguientes gotas las echaremos en el segundo tubo a las 2 pm., pasadas otras dos horas echaremos en el tercer tubo otras gotas de Betadine y así sucesivamente hasta completar las 12 horas. Además, mientras vaya pasando el tiempo se observará también el estado del zumo. Todo este proceso se realizará con cada fruta y se anotarán sus respectivos resultados. 2.6. EXPLICACIÓN DEL PROCESO REDOX (REACCIÓN DEL YODO CON EL ÁCIDO ASCÓRBICO) En este trabajo se ha determinado el contenido de vitamina C mediante una volumetría de óxido-reducción. La vitamina C tiene carácter reductor y se utiliza una disolución de yodo como agente oxidante que constituye el titulante patrón. Como se ha mencionado antes, para que una sustancia se oxide es necesario que otra se reduzca y al revés, por lo tanto, cuando al ácido ascórbico le añadimos yodo, este se reducirá a yoduro a costa de que el ácido ascórbico se oxide. El almidón se utiliza como indicador para el yodo, debido a que forma un complejo de color azul intenso con el mismo. Cuando añadimos yodo sobre vitamina C reducida desaparecerá pues pasará a yoduro (la vitamina C se oxidará en el proceso). Cuando ya no quede vitamina C reducida el yodo no desaparecerá, se unirá al almidón y aparecerá el color azul indicando el fin de la titulación. Sin embargo, hay que tener en cuenta que el color amarillo del zumo puede enmascarar en parte el color azul por lo que hay que tener cuidado para 12 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO observar el cambio de color, que en vez de ser azul virará a un color marrón oscuro. Las titulaciones en las que interviene el yodo como agente oxidante se denominan yodimetrías. Dado que la reacción entre el yodo y el ácido ascórbico presenta una estequiometría 1:1, en el punto final de la titulación el número de moles de yodo reducido es equivalente a los moles de ácido ascórbico oxidado. Pero es importante señalar que con este método se determina la capacidad reductora total de la disolución, por ello, si alguna de las disoluciones contiene otras sustancias además del ácido ascórbico o yodo, el volumen de la disolución oxidante (yodo) consumida puede estar aumentada o disminuida (como es este caso al utilizar Betadine), y, por tanto, el contenido de ácido ascórbico se puede ver afectado. Además, en lo que se refiere a la primera experiencia, hay que tener en cuenta que la vitamina C es oxidada fácilmente por el aire, por tanto, las disoluciones que contienen vitamina C deben ser preparadas inmediatamente antes de ser tituladas, con el fin de obtener resultados fiables. 13 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO RESULTADOS 3. RESULTADOS Y OBSERVACIONES 3.1. RECOGIDA DE DATOS 1ª EXPERIENCIA: Cantidad de vitamina C de cada zumo de fruta Tabla comparativa sobre la cantidad de vitamina C en cada una de las frutas escogidas FRUTA CONDICIÓN VOLUMEN A CANTIDAD DE VALORAR VITAMINA C (en función de las gotas de Betadine usadas) Naranja Recién exprimido 5 ml 53 Limón Recién exprimido 5 ml 42 Mandarina Recién exprimido 5 ml 35 2ª EXPERIENCIA: Variación de la vitamina C con el paso del tiempo Naranja (Citrus aurantium) Tabla sobre la variación de la vitamina C de la naranja al cabo de 12 horas Muestras VOLUMEN A CANTIDAD DE VITAMINA C VALORAR (en función de las gotas de Betadine usadas) Muestra 1 (11:00) 5 ml 57 Muestra 2 (13:00) 5 ml 55 Muestra 3 (15:00) 5 ml 48 Muestra 4 (17:00) 5 ml 35 Muestra 5 (19:00) 5 ml 22 Muestra 6 (21:00) 5 ml 14 Muestra 7 (23:00) 5 ml 12 14 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO Gráfico sobre la variación de vitamina C de la naranja al cabo de 12 horas 60 57 55 48 Nº de gotas 50 40 35 30 22 20 Nº gotas 14 12 10 0 11 h 13 h 15 h 17 h 19 h 21 h 23 h Tiempo (horas) Limón (Citrus aurantifolia) Tabla sobre la variación de la vitamina C del limón al cabo de 12 horas Muestras VOLUMEN A CANTIDAD DE VITAMINA C VALORAR (en función de las gotas de Betadine usadas) Muestra 1 (11:00) 5 ml 45 Muestra 2 (13:00) 5 ml 41 Muestra 3 (15:00) 5 ml 37 Muestra 4 (17:00) 5 ml 25 Muestra 5 (19:00) 5 ml 18 Muestra 6 (21:00) 5 ml 11 Muestra 7 (23:00) 5 ml 6 15 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO Gráfico sobre la variación de vitamina C del limón al cabo de 12 horas 50 45 45 41 37 Nº de gotas 40 35 30 25 25 18 20 15 Nº gotas 11 10 6 5 0 11 h 13 h 15 h 17 h 19 h 21 h 23 h Tiempo (horas) Mandarina (Citrus reticulata) Tabla sobre la variación de la vitamina C de la mandarina al cabo de 12 horas Muestras VOLUMEN A CANTIDAD DE VITAMINA C VALORAR (en función de las gotas de Betadine usadas) Muestra 1 (11:00) 5 ml 36 Muestra 2 (13:00) 5 ml 33 Muestra 3 (15:00) 5 ml 26 Muestra 4 (17:00) 5 ml 20 Muestra 5 (19:00) 5 ml 15 Muestra 6 (21:00) 5 ml 7 Muestra 7 (23:00) 5 ml 3 16 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO Gráfico sobre la variación de vitamina C de la mandarina al cabo de 12 horas 40 36 33 35 Nº de gotas 30 26 25 20 20 15 Nº gotas 15 7 10 3 5 0 11 h 13 h 15 h 17 h 19 h 21 h 23 h Tiempo (horas) General Gráfico comparativo sobre la variación de vitamina C en las 3 frutas al cabo de 12 horas 57 60 55 48 50 45 41 Nº de gotas 40 30 35 37 36 Naranja 33 20 22 25 26 Limón 18 20 15 10 0 13 h 15 h 17 h 19 h Tiempo (horas) 17 12 11 7 11 h Mandarina 14 21 h 6 3 23 h CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO 3.2. OBSERVACIONES Antes de realizar la segunda experiencia, se intentó realizar una primera “toma de contacto” con la vitamina C. Para ello se analizó el cambio que sufre la vitamina C al quedar expuesta al aire libre durante un tiempo prolongado, cosa que se tenía prevista en el experimento. De esta forma podríamos notar los aspectos físicos en los que el zumo cambiaría y poder corroborarlos a la hora de realizar el experimento real. Lo único que se hizo fue exprimir un zumo de naranja y verterlo en un vaso para posteriormente probarlo y analizar su sabor y color. Recién exprimido tenía un cierto punto de acidez, pero tampoco llegaba a ser exagerado y su color era el típico naranja intenso. Foto de los zumos recién exprimidos Una vez probado y analizado se dejó a exposición del aire para ver los cambios que sufriría a la mañana siguiente. Durante toda la noche el zumo de naranja había estado en contacto con el aire lo que había propiciado que, poco a poco, la vitamina C fuera oxidándose. Se observaron dos cambios directos dentro de las características del zumo; adquiere un sabor más ácido y se torna a un color más pálido y amarillento en vez de mantener el naranja vibrante característico. Foto de los zumos expuestos al aire durante 24 horas En el caso de la mandarina ocurría lo mismo, se notaba un cambio en color y en el sabor de su zumo. Pero a diferencia de los dos anteriormente mencionados, en el zumo de limón no se notó una gran diferencia en el color. Se llega a suponer que no se nota un gran cambio debido a que el zumo recién exprimido tiene un color bastante claro por lo que a la hora de notar si se torna a otro más pálido es complicado. 18 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO CONCLUSIÓN 4. CONCLUSIÓN Y RECOMENDACIONES 4.1. CONCLUSIÓN Una vez calculados los resultados que se requerían desde un primer momento es posible dar respuestas a las inquietudes que se planteaban al comienzo de la investigación, así como a otras observaciones que se han planteado durante la misma. En primer lugar, para la naranja se han necesitado 53 gotas de Betadine, para el limón 42 y por último para la mandarina 35. De esta forma al realizar la comparativa, se puede concluir que el zumo de la naranja es el que contiene mayor cantidad de ácido ascórbico de las tres frutas valoradas y que el que menos tiene es el zumo de mandarina. En segundo lugar, como era de esperar, al realizar la valoración el contenido del zumo recién exprimido resultante es mayor que cuando se deja expuesto al aire libre durante las 12 horas. Si nos damos cuenta, el contenido va disminuyendo notablemente cada 2 horas, aproximadamente unas 10 gotas. Pero esto no ocurre en las primeras dos horas en las que casi no se nota el cambio. Esto es así porque el tiempo de interacción con el medio en el caso del zumo recién exprimido es demasiado breve como para conseguir una oxidación notable del ácido ascórbico. Por lo que se puede concluir que la vitamina C empieza a oxidarse a partir de las 2 horas de haber estado expuesto al medio. Además, si nos fijamos a las 12 horas el contenido de vitamina C en cada zumo es insignificante no llega a las 10 gotas (excepto el zumo de naranja que llega a las 12 gotas). De esta observación también se deduce que el contenido de ácido ascórbico en un zumo de fruta, desaparece a las 12 horas de haber estado expuesto. Con esta experimentación se corrobora y se asegura la identificación de esta vitamina en los zumos de las frutas valoradas y la inestabilidad que 19 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO tiene con el paso del tiempo. La acción del oxígeno hace mella en la concentración de vitamina C. Por lo tanto, cuanto más tiempo pase expuesta al aire libre, menor número de gotas serán necesarias para que ésta se oxide y finalmente desaparezca. 20 CRISTINA ÁLVAREZ GARCÍA 2ºA BACHILLERATO 1ºA BACHILLERATO DETERMINACIÓN, CUANTIFICACIÓN Y COMPARACIÓN DE VITAMINA C (ÁCIDO ASÓRBICO) DEPENDIENDO DE LA FRUTA Y EL TIEMPO TRANSCURRIDO BIBLIOGRAFÍA http://milksci.unizar.es/bioquimica/temas/vitamins/ascorbico.html (historia) http://www.iqb.es/nutricion/vitaminac/vitaminac.htm (historia) https://www.acidoascorbico.com/ (ácido ascórbico) https://orlandodanpadrob.wixsite.com/exp-vitaminac (ácido ascórbico) https://www.acidoascorbico.com/qumica_del_cido_ascrbico (química del ácido ascórbico) https://medlineplus.gov/spanish/ency/esp_imagepages/18109.htm (fuentes de vitamina C) https://vitaminas.org.es/vitamina-c-alimentos (fuentes de vitamina C) https://www.zonadiet.com/nutricion/vit-c.htm (funciones de la vitamina C) https://quimica.laguia2000.com/reacciones-quimicas/valoraciones-redox (métodos de cuantificación REDOX) https://es.slideshare.net/luisangelchicomarojas/determinacin-de-la-vitaminac-por-iodometriaquimica-analitica (métodos de cuantificación REDOX) http://www.hablandodeciencia.com/articulos/2011/11/28/bebete-el-zumoque-se-le-va-la-vitamina/ (oxidación de la vitamina C) https://www.consumer.es/alimentacion/el-zumo-de-naranja-pierde-vitaminac-si-no-se-bebe-enseguida.html (oxidación de la vitamina C) https://orlandodanpadrob.wixsite.com/exp-vitaminac/experimentos (método experimental) Química 2º Bachillerato Mc Graw Hill Education ABC de las Vitaminas (2005) 21