
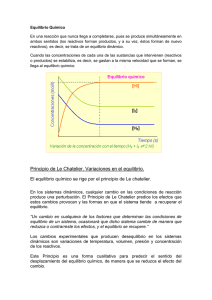
Equilibrio Químico y Principio de Le Chatelier A. Equilibrio Químico: Existen reacciones reversibles en donde los productos se juntan y forman los reactivos. Una reacción reversible consiste en una reacción directa hacia formación de productos y una reacción inversa hacia formación de reactivos. Cuando la velocidad de la reacción directa es igual a la velocidad de la reacción inversa se estable el equilibrio químico y las concentraciones de reactivos y productos permanece constante aA + bB cC + dD Se establece así la expresión de la constante de equilibrio: Ke = [C]c[D]d [A]a[B]b en donde a, b, c, d son los coeficientes del balanceo Existen equilibrios homogéneos en donde todas las sustancias se encuentran en solo estado físico. En los equilibrios heterogéneos hay más de un estado, pero sólo influyen en el equilibrio los gases; los líquidos y sólidos no influyen. Si Ke es pequeña el equilibrio favorece la formación de reactivos y si Ke es grande el equilibrio favorece la formación de productos. Práctica 1. Escriba la expresión de la constante de equilibrio: a) H2(g) + Cl2(g) <---------> 2HCl(g) Ke = [HCl]2_ [H2][Cl2] b) 2H2O(l) <---------> 2 H2(g) + O2(g) Ke = [H2]2[O2] c) C3H7OH(l) d) MgO(s) e) Si(s) + + + O2(g) CO2(g) Cl2(g) <---------> <---------> <---------> CO2(g) + MgCO3(s) SiCl4(g) H2O(g) 2. Dada la reacción de descomposición N2O4(g) <---------> NO2(g) La mezcla en el equilibrio contiene [N2O4] = 0,45 M y [NO2] = 0,31M calcule Ke y explique el equilibrio. 3. Para la siguiente reacción NH3(g) <---------> N2(g) + H2(g) Cuál es el valor de Ke y qué indica si en el equilibrio se encuentran [NH3] 0,040M [N2] = 0,20M y [H2] = 0,60 M 4. La Ke es 0,030 para la reacción CO(g) + H2(g) <---------> CH4(g) + H2O(g) Si el sistema en equilibrio contiene [H2] = 0,30M, [CO] = 0,51M, [H2O] =2,0M y Ke 260, cual es [CH4] B. Principio de Le Chatelier: Según este principio cuando hay un cambio que altere la reacción en equilibrio, el equilibrio se desplaza en la dirección que disminuya la perturbación o alteración. 1. Concentración: si aumenta la concentración de una de las sustancias el equilibrio se desplaza hacia el lado contrario y si disminuye una sustancia el equilibrio se desplaza ahí mismo donde esté la sustancia. 2. Temperatura: si aumenta la temperatura el equilibrio se desplaza hacia el lado contrario donde esté la energía y si disminuye la temperatura el equilibrio se desplaza ahí mismo donde esté la energía. 3. Presión: Si aumenta la presión el equilibrio se desplaza hacia el lado que tenga menos volumen (moles del balanceo) y si disminuye la presión el equilibrio se desplaza hacia el lado con más moles. Si la cantidad de moles en reactivos y productos es la misma un aumento o disminución de la presión no afecta el equilibrio 4. Catalizador: Si se agrega un catalizar no se afecta el equilibrio químico. Práctica 1. Considere la reacción: 2CO(g) + O2(g) Hacia donde se desplaza el equilibrio si: a) Aumenta concentración O2: productos b) disminuye concentración CO: reactivos c) aumenta concentración de CO2: reactivos d) disminuye temperatura: productos e) aumenta temperatura: reactivos e) aumenta presión: productos <---------> 2. Dada la reacción C6H12(g) + 206 kJ <---------> Hacia donde se desplaza el equilibrio si: a) disminuye concentración de C6H6 _____________ b) aumenta concentración C6H12 ____________ c) aumenta presión ___________ d) disminuye presión _____________ e) aumenta temperatura ____________ 2CO2(g) C6H6(g) + 135 kcal + H2(g)



![Material Complementario- PRÁCTICO 6 Kc = [C]c [D]d … [A]a [B]b](http://s2.studylib.es/store/data/005642464_1-49307596d309ea8acaa86e7521a6bd97-300x300.png)



