2013_Loayza_Química orgánica- Práctica 4- Alcoholes y fenoles.pdf
Anuncio

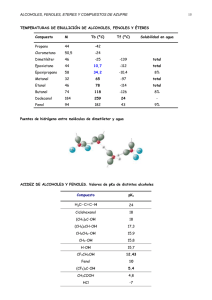
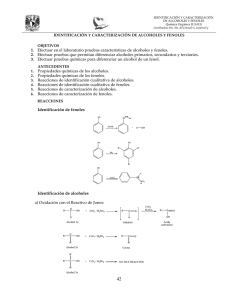
FACULTAD DE INGENIERIA CARRERAS INGENIERÍA AGROINDUSTRIAL Y AGRONEGOCIOS INGENIERÍA DE INDUSTRIAS ALIMENTARIAS CURSO: QUIMICA ORGANICA PROFESORA: LILLYAN LOAYZA G. COORDINADORA: LILLYAN LOAYZA G PRÁCTICA No 4 ALCOHOLES Y FENOLES I. OBJETIVOS a. Identificación del grupo funcional hidroxilo. b. Identificar propiedades físicas (pH) del grupo funcional hidroxilo. c. Diferenciar por reacciones químicas, alcoholes de fenoles. d. Identificar los tipos de alcoholes. II. MATERIALES Y REACTIVOS Muestras: etanol, 2-propanol, ter-butanol Sodio metálico Fenol Bicromato de potasio Tubos de prueba Acido sulfúrico concentrado Tiras de pH Reactivo de Lucas Pinza Cloruro férrico al 5% Pipetas de 1 ml Equipo de seguridad: lentes protectores III. PROCEDIMIENTO 1. MEDIDA DE pH Introducir con la ayuda de una pinza, la tira reactiva de pH en el gotero con la muestra indicada. Anotar el valor de pH. Se trabajará con las muestras de pH menor a 7. 16 2. IDENTIFICACIÓN DEL GRUPO FUNCIONAL HIDROXILO: PRUEBA CON SODIO METÁLICO (NaO) Muestras Con las indicaciones brindadas por Observaciones el profesor, agregarle a cada 1 ml (o 20 gotas) Observar el burbujeo que se desprende, de cada muestra muestra y una por una, un pequeño calcule tiempo que transcurre en trozo de sodio metálico. ácida. desaparecer el trozo (velocidad de reacción). Al término de la reacción, medir pH. Sólo las muestras positivas presentan el grupo funcional hidroxilo. 3. REACCIONES DE DIFERENCIACIÓN ENTRE ALCOHOLES Y FENOLES Muestras 1 ml (o 20 gotas) de muestra con el grupo hidroxilo. Agregar 1 gota de Cloruro férrico. Mezclar. Observaciones Observar cambio de color (amarillo a morado). Sólo los fenoles dan positiva esta prueba. 4. IDENTIFICACIÓN DEL TIPO DE ALCOHOL: PRUEBA DE LUCAS Muestras 1 ml de muestra (sólo alcoholes) Agregar a c/u de ellos 3 ml de Reactivo de Lucas. Agitar enérgicamente. Observaciones Observar la formación de un precipitado lechoso, de no aparecer al instante, calentar en b.m por 5 min. Anotar el tiempo de formación y determinar el tipo de alcohol. 5. REACCIONES DE OXIDACIÓN DE ALCOHOLES Muestra 0.5 ml de alcohol primario 0.5 ml de alcohol secundario 0.5 ml de alcohol terciario Adicionar a c/u 0.5 ml de una solución de observaciones bicromato de potasio y 1 gota de ácido Observar cambio de color sulfúrico, mezclar. (amarillo a verde) y tiempo de oxidación. Los alcoholes terciarios no se oxidan. 6. REACCIÓN DE DESHIDRATACIÓN Colocar 2 ml. de etanol en un tubo de ensayo y añadir 5 gotas de ácido sulfúrico concentrado, por las paredes. Agitar. Para comprobar si el experimento ha sido positivo, añadir 7 gotas de una solución de KMNO4, la solución se tornará de un color marrón, indicando que se sintetizó el alqueno. 17 IV. RESULTADOS PRUEBA A Resultado Obs. B Resultado Obs. C Resultado Obs. pH Sodio Cloruro Férrico Lucas Oxidación V. DISCUSIONES Con respecto a los resultados, identifique las muestras A, B y C y proponga las ecuaciones químicas de cada reacción producida en la práctica. VI. CUESTIONARIO 1. ¿Por qué los alcoholes tienen pruebas negativas con Cloruro Férrico y Bromo y positivas con el reactivo de Lucas?. 2. ¿Por qué cambia el pH de los alcoholes en la reacción con Sodio metálico?. 3. Explique la diferencia de los valores de pH entre los tipos de alcoholes. 4. Explique el comportamiento de los alcoholes con el reactivo de Lucas. 18