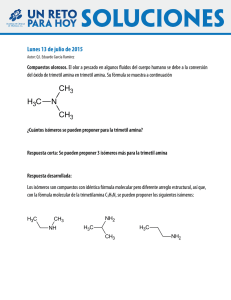
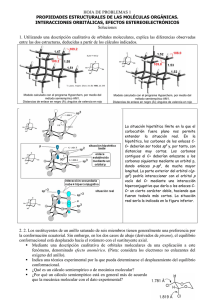
Fundamentos químicos
Anuncio

FUNDAMENTOS QUÍMICOS DE LA INGENIERÍA 1ºITI UNIVERSIDAD DE CANTABRIA 2−DICIEMBRE−2000 1º− Explicar: a) Cómo se originan los espectros atómicos de emisión. b) Cómo interpretó Avogadro la ley de Gay−Lussac. c) Cómo se determinan las masas atómicas. d) En que consiste la estequiometría y en qué ley se basa. e) Cómo se interpretaron los hechos experimentales que confirmaron la naturaleza corpuscular de la radiación. 2º− ¿Qué es un orbital atómico?, ¿Cuáles son las características de un orbital s y de un orbital p? ¿Qué significa diamagnético y paramagnético?. Escribir las configuraciones electrónicas de los átomos de los elementos A(Z=8), B(Z=49) y C(Z=73), cuáles son paramagnéticos y dar un conjunto de cuatro números cuánticos para el electrón diferenciador de cada uno de ellos. 3º− Cuál es la geometría de las siguientes moléculas o iones: CHCL3, CO3 2−, SH2, Al Cl3, AsF5 e interpretar sus enlaces según la teoría del enlace de valencia. ¿Qué moléculas serán polares? Con la teoría de orbitales moleculares comparar las estabilidades del Be2, O2, O2+, y F2. Números atómicos: Be=4, C=6, O=8, F=9, Al=13, S=16, y As=33. 4º− Calcular la energía reticular del cloruro de calcio dados: el calor de sublimación del calcio 121 Kj/mol, el calor de formación del cloruro de calcio −794 Kj/mol, la energía de disociación del cloro 242 Kj/mol, la 1ª y 2ª energías de ionización del calcio 589.8 y 1145 Kj/mol y la afinidad electrónica del cloro −347 Kj/mol. Suponiendo que este tipo de compuesto cristaliza en el mismo tipo de red que el óxido de calcio ¿cuál de los dos compuestos tendrá mayor energía de red? 5º− Cuántas toneladas de ácido sulfúrico del 98% de riqueza se pueden preparar a partir de una tonelada de pirita de hierro, suponiendo que el proceso transcurre según las reacciones: FeS2 + O2 Fe2O3 + SO2 SO2 + O2 SO3 SO3 + H2O H2SO4 Y que el rendimiento global es del 85%. ¿Qué cantidad de aire (20% en peso de O2) se habrá gastado en la oxidación a 20ºC y 1 atmósfera? Pesos atómicos: H=1, O=16, S=32, Fe=55.85 1