2.06 Compresibilidad
Anuncio

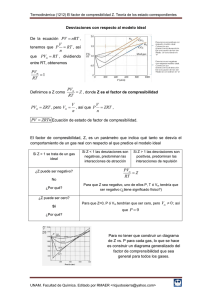
Curso de Física en CD-R Notas de Clase Ing. Alfonso Cuervo Cantón. Capacidad de la materia de unir al máximo sus mas ínfimas partículas. El factor de compresibilidad es uno de los parámetros que, con mayor precisión diferencia el comportamiento de los fluidos en estado líquido del estado gaseoso. Define el comportamiento de los gases a determinadas condiciones de presión y temperatura y se vuelve elemento fundamental para todos los diseños e instalaciones que trabajan con fluidos compresibles. La compresibilidad del agua. En los libros de texto escolares se subraya con tanta tenacidad la incompresibilidad de los líquidos que se inculca la idea de que realmente lo son, al menos en un grado menor que los sólidos. Pero de hecho el término «incompresibilidad» aplicado a los líquidos no es sino una expresión figurada para definir su insignificante reducción de volumen al ser presionados, además, éstos se comparan sólo con los gases. Si comparamos los líquidos y los sólidos en cuanto a la compresibilidad, resultará que los primeros son muchas veces más compresibles que los segundos. El metal más compresible -e1 plomo- expuesto a la acción de una carga omnilateral, disminuye su volumen en 0,000006 del inicial bajo la presión de 1 at. El agua, en cambio, es unas ocho veces más compresible: su volumen disminuye en 0,00005 al aplicar la misma presión. Pero en comparación con el acero, este líquido se estrecha unas 70 veces más 1. El ácido nítrico se distingue entre los líquidos por su elevada capacidad de compresión reduciendo su volumen inicial en 0,00034 a la presión de 1 at, es decir, al ser presionado reduce su volumen unas 500 veces más que el acero. Sin embargo, la compresibilidad de los líquidos es decenas de veces menor que la de los gases. Compresibilidad Las experiencias de Boyle y de otros físicos de la época pusieron claramente de manifiesto que los gases podían comprimirse y expandirse. Pero, ¿cómo explicar estas propiedades que los diferenciaban claramente de los líquidos y los sólidos? Las ideas de los atomistas griegos influyeron en Boyle de tal manera que propuso dos explicaciones alternativas para el comportamiento de los gases basadas ambas en la hipótesis de que la materia estaba compuesta de partículas indivisibles o átomos. La primera partía del supuesto de que los átomos estaban en reposo y en contacto mutuo, y explicaba la compresibilidad como consecuencia de una cierta elasticidad de los átomos que podrían comportarse como una especie de muelles blandos. Este modelo estático, sin embargo, no podía explicar la expansibilidad ilimitada de los gases. En cambio, si los átomos no estuvieran ni en reposo ni en contacto mutuo entonces podrían desplazarse rápidamente de un lado a otro en el interior del recipiente, llenando así todo el espacio. Dentro de la clasificación de fluidos, los líquidos y gases presentan propiedades diferentes. Ambos tipos de fluidos, tienen la propiedad de no tener forma propia y que estos fluyen al aplicarles fuerzas externas. La diferencia está en la llamada compresibilidad. Para el caso de los gases estos pueden ser comprimidos reduciendo su volumen. El coeficiente de compresibilidad describe la variación del volumen que ocupa una determinada cantidad de fluido al aplicarle presión a una temperatura dada. La compresibilidad es la calidad de compresible, es decir, que se puede comprimir o reducir a menor volumen. El factor de compresibilidad Z representa la fracción adicional en la cual un gas se reduce en determinadas condiciones de presión y temperatura, con respecto al comportamiento ideal. Recuerda que estas notas son complemento de tu clase y no sustituyen a las que en clase debas tomar. 1 Curso de Física en CD-R Notas de Clase Ing. Alfonso Cuervo Cantón. El factor Z es el factor de compresibilidad, es el parámetro con el cual se corrige el comportamiento de los gases para ajustarlo a las condiciones reales o actuales. Que expresa la manera como realmente se comportan los fluidos compresibles. Recuerda que estas notas son complemento de tu clase y no sustituyen a las que en clase debas tomar. 2