Electrones Elemento totales Diagrama orbital Configuración
Anuncio
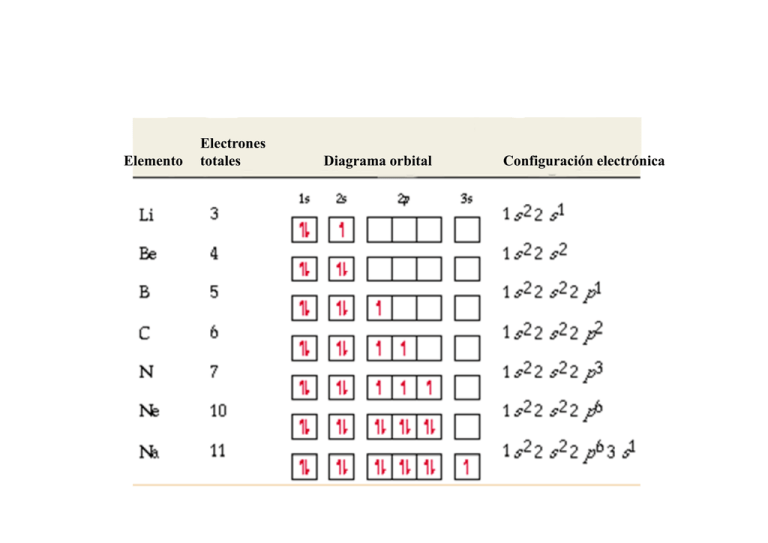
Elemento Electrones totales Diagrama orbital Configuración electrónica Modelo de Bohr Modelo cuántico •La energía del electrón depende sólo de n. •La energía del electrón depende de n, l, m. •Órbitas definidas. •Órbitales (regiones del espacio donde es más probable encontrar al electrón) Nube electrónica Estado fundamental Estado excitado Estado fundamental Distancia promedio desde el protón al electrón Estado excitado (Cargas positivas y negativas) (El núcleo) (Niveles de energía) (Modelo de la nube electrónica) Configuración electrónica y Tabla Periódica Número de e- en el último nivel ocupado Último nivel ocupado P i d d P Propiedades Periódicas: iódi •Radio atómico •Potencial Potencial de ionización •Electroafinidad •Electronegatividad Radio atómico. Ra adio atóm mico Perríodo Grupo Radio atómico Carga nuclear efectiva: Repulsión Electrones externos Atracción Núcleo Potencial de ionización o energía de ionización. Energía requerida para arrancar un electrón de un átomo neutro t o de d un ión ió aislado i l d A(g) Æ A+(g) + e- (energía de 1º ionización) A+ (g) Æ A2+ (g) + e- (energía de 2º ionización) Afinidad electrónica o electroafinidad. Energía requerida liberada cuando se agrega un electrón a un átomo át neutro t A(g) + e- Æ A-(g) Afinidad elecctrónica (KJ/m A mol) 400 300 200 100 0 -100 -200 0 5 10 Número atómico 15 20 Pérdida de electrones Período Períoddo Ganancia de electrones Grupo Grupo Electronegatividad. Tendencia de un átomo a atraer un par de electrones en un enlace químico. 4.5 Electronegatividad 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0 10 20 30 40 50 60 Número atómico 70 80 90











