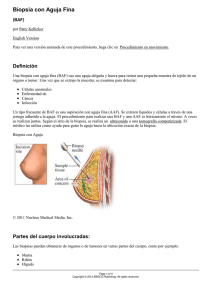
El examen clínico debe realizarse valorando el estado de salud
Anuncio

El examen clínico debe realizarse valorando el estado de salud general, comportamiento y estado corporal del animal. Un examen visual del caballo con buena luz determina la extensión de la lesión (generalizada o localizada), lo que ayuda a estrechar el diagnóstico presuntivo ya que, algunas patologías raramente son localizadas y otras pocas veces son generales. Los problemas clínicos de la piel pueden ser clasificados en cinco grandes grupos: • • • • • Prurito: picor e irritación de la piel que conlleva cambios en la conducta tales como autolesión. Alopecia y alteraciones de la cantidad y calidad del pelo. Ésta puede ser una calvicie total o parcial, o bien, únicamente una alteración en la densidad del pelo. Nódulos: Engrosamiento circunscrito de la piel de grosor variable. Dermatosis seca: Aparición de costras y descamación excesiva de la piel o acumulo de exudado seco sobre la superficie de la piel. Dermatosis húmeda: Aparición de exudado sobre la superficie de la piel proveniente de una lesión, inflamación u otra patología cutánea. PRUEBAS DIAGNOSTICAS • • • Raspado cutáneo: Todos los caballos que sufran de prurito deben ser sometidos a este sencillo y eficaz test. Especialmente indicado para detectar la presencia de ectoparásitos tales como Chorioptes equi. Se frota la zona afectada con un cepillo rígido o de cerdas duras, depositando las descamaciones y residuos cutáneos en una placa de Petri. Ésta puede se puede enviar al laboratorio para su examen, o bien observarla directamente al microscopio. Los ectoparásitos más grandes (piojos principalmente) pueden ser identificados macroscópicamente. La observación al microscopio puede ser verdaderamente útil para la detección de parásitos a partir de sus huevos. • Recogida de muestras de pelo: Especialmente indicado cuando existen problemas de crecimiento y pelo quebradizo o bien, presencia de zonas alopécicas. • Esta técnica esta indicada en caballos de los que se sospeche que presentan una infección por Dermatophylus. • • • Se recogen pelos y escamas de las zonas marginales de lesiones recientes y se depositan en un tubo de vidrio estéril y convenientemente identificado. Si se va a realizar un cultivo, el bote no debe cerrarse herméticamente ya que esto puede potenciar un sobrecrecimiento del hongo. Examen directo: se deposita la muestra de pelo sobre un portaobjetos y se aplican unas gotas de disolución limpiadora (hidróxido potásico al 10% o cloranfenicol). Al observarla al microscopio con pocos aumentos (4X), los pelos infectados aparecen pálidos y engrosados. A mayores aumentos (40X), se pueden apreciar las hifas y artrosporas del hongo. Cultivos: A partir de estas muestras de pelos podemos realizar cultivos de hongos o bacterias, para establecer un diagnóstico específico: Cultivo bacteriano: Se realiza una siembra en un medio adecuado. Se incuba a 37ºC durante 24-48 horas, tiempo en el cual se puede apreciar el crecimiento de las colonias bacterianas (Clostridium, Staphylococus, Dermatophy-lus...) Cultivo fúngico: se realiza una siembra en medio Sabouraud e se incuba durante 14 días. Trichophyton y Microsporum son las principales familias de hongos que causan problemas dermatológicos en caballos. • Biopsias: Empleadas para establecer un diagnóstico específico, como diagnóstico diferencial, para seguir el curso de una enfermedad o para confirmar la adecuada escisión de un tumor. Existen distintos tipos de biopsias: “Shave”biopsia:particularmente indicada para las lesiones de tipo vesiculomatoso como las producidas por Pemphigus vulgaris o p. Foliaceus. Método: Se corta la epidermis en capas de forma paralela a la superficie de la piel. Debe usarse una hoja de bisturí estéril y, en ningún caso, tijeras para obtener la muestra. Biopsia por punción: Se extrae una columna de tejido mediante la utilización de punzones desechables específicos para este tipo de biopsia. Método: extraer una muestra de tejido anormal (contiene epidermis, dermis, subcutáneo y tejido paniculado).Generalmente se usan punzones de 6-9 cm de diámetro para la piel del caballo. Sedación sistémica y analgesia es todo lo que se necesita para la realización de esta práctica. Como norma general no se requiere sutura de la zona tras la obtención de la muestra. Biopsia de región marginal: Una muestra con una pequeña porción de tejido sano, puede ser muy útil; la región sana permite al patólogo realizar comparaciones con el tejido dañado. Biopsia por escisión: Usada cuando se requiere la existencia en la muestra de tejido sano y tejido dañado o cuando la lesión es tan pequeña que la obtención de una porción es muy difícil. Aspiración por aguja fina: Usada para obtener muestras celulares o de fluidos provenientes de la lesión. Método: se emplea una jeringuilla grande (20 cc) y una aguja hipodérmica de 19-20 G. Se introduce la aguja en el centro de la lesión y se aspira repetidas veces manteniendo un intervalo de varios segundos entre aspiraciones. Tras la última aspiración se retira la aguja. Citología por impresión: tiene una utilidad bastante limitada, aunque pueden se puede emplear para identificar Dermatophylus, algunos tumores o nódulos subcutáneos que, en algunos casos, hay que incidir antes de realizar esta prueba. Método: La muestra se obtiene realizando presión directa sobre la lesión con un porta-objetos estéril, tras haber retirado, previamente, las descamaciones o exudados. Posteriormente se fija la muestra de forma inmediata con alcohol o mediante la aplicación directa de calor. Tras la realización de las biopsias se deben administrar antibióticos sistémicos o antisépticos locales. MANIPULACION DE LAS MUESTRAS Para obtener los mejores resultados del examen de la biopsia, se deben tener en cuenta las siguientes medidas: • No comprimir la piel durante la biopsia ya que aparecerían alteraciones tanto a nivel macroscópico como microscópico. • Usar bisturí, nunca tijeras. Esto elimina la aparición de artefactos a lo largo de la línea de incisión. • Tratar de evitar una excesiva manipulación de la muestra y usar unas pinzas planas muy suavemente o, preferiblemente, una aguja hipodérmica para hacerlo. • Tratar de reducir el tamaño de la muestra a menos de 1 cm, para permitir una rápida y apropiada fijación. • • • Las muestras grandes deben ser fileteadas o separadas en pequeñas muestras menores de 1 cm, acompañadas de un diagrama que oriente al patólogo. Evitar las muestras demasiado pequeñas. Las muestras menores de 4-6 mm de diámetro son susceptibles de sufrir distorsiones por compresión y su manipulación, una vez fijadas, es muy compleja. Evitar los botes de boca estrecha; Su utilización supone que la muestra sea tratada con dureza para ser extraída. TÉCNICAS ESPECIALES · TEST DE PRIVACION/PROVOCACIÓN: En casos en los que se sospecha de una reacción alérgica por algún alimento, este test puede ser muy útil para determinar la causa. El animal debe ser alimentado con una dieta básica (de un único componente) durante unas 4-6 semanas. Una vez que la dieta inicial es tolerada, se añaden de manera individual el resto de los componentes que constituían la dieta original en intervalos de 2 semanas (incluyendo el componente que se sospecha como causante del problema). El ambiente y otros factores deben ser considerados y, aún así, la complejidad del problema es difícil de resolver. · TEST DE ALERGIA (TEST INTRADÉRMICO): Este test se ha empleado de forma muy limitada en caballos. Requiere la posibilidad de disponer de alérgenos específicos y de experiencia en leer e interpretar los resultados. Suelen aparecer falsos negativos y positivos e, incluso, algunos caballos dan positivo a la muestra blanco. Para la realización de este test el paciente no debe haber sido tratado con fármacos tales como corticoesteroides, antihistamínicos, tranquilizantes y anestésicos o AINES debiendo existir al menos un tiempo de supresión de entre 6 y10 días. Los animales pueden ser sedados de una forma segura y eficaz con agonistas alfa-adrenérgicos como xilacina o detomidina. Las fenotiacinas (como la acepromacina) pueden tener un significativo efecto supresor sobre el test. Muchas sustancias como césped, polen, polvo y hojas pueden ser causantes de alergias por inhalación que cursan con prurito atópico, y que pueden ser detectadas con un test intradérmico. Método • Dos días antes del test, el pelo de las tablas del cuello debe ser convenientemente trasquilado y lavado (evitando áreas con evidentes signos de lesión). El tamaño depende del número de agentes que se deseen testar; cada antígeno necesita un área de 3-4 cm de radio para evitar posibles reacciones cruzadas. • • • • Un día antes de la realización del test, se inyectan intradermicamente 0.05 ml de una solución 1:100 000 de histamina fosfato, en una región fuera del área de test. Normalmente, aparece una reacción de 1-2 cm de diámetro en 30 minutos. Si esto no ocurriese, el test debe posponerse hasta que se desarrolle la reacción. En el caso de que apareciese una reacción anómala, el test debe ser suspendido. Se debe preparar un botiquín de urgencia incluyendo adrenalina. Afortunadamente, las reacciones adversas en caballos son poco usuales. Los lugares de inyección deben ser marcados o numerados, bien sobre el animal o en un “mapa” del área de test; ya que todas las variaciones en el grosor de la piel de las zonas inyectadas deben ser cuidadosamente anotadas. Se inyectan pequeñas cantidades (normalmente 0.05 ml) de distintos alérgenos, usando una aguja de 25-26 G y una jeringuilla de insulina (1 ml). Como controles se emplean la histamina (positivo) y solución salina (negativo). La extensión de las reacciones en cada una de las regiones marcadas, es medida y anotada a los 15, 30 minutos y a las 4 horas tras la administración. Interpretación Un resultado positivo se manifiesta como una inflamación de la zona de inyección. Se considera que una reacción es significativa, cuando la inflamación es mayor o igual a dos veces la diferencia de incremento entre el control positivo y el negativo. Una respuesta positiva no se corresponde, necesariamente, con una alergia patológica. Además, la extensión de una reacción positiva no es directamente proporcional con la severidad de la alergia. Autor: Pablo Adrados/Alvaro Vázquez EQUISAN veterinaria Equina Integral