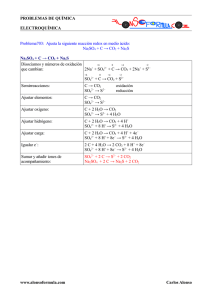
+ H2O (l) CO(g) + 1/2 O2(g) + 4 H2O (l) + 1/2 O2(g) V1 0,5 V1 V1 V2
Anuncio

45.- Se tienen 100 mL de una mezcla formada por monóxido de carbono, hidrógeno y propano, y se hace combustionar con 75 mL de oxígeno. Después de reaccionar nos queda una mezcla de gases formados por CO2 y O2 en exceso, ya que el H2O formado se ha condensado. Sabiendo que el volumen total de los gases de la mezcla es de 50 L y que el 80% de la misma es CO2, calcula la composición de la mezcla inicial. Reacción que se produce: CO(g) + H2 (g) + C3H8 (g) + O2(g) V = 100 mL O2 (en exceso) + CO2 (g) + H2O (l) 80 % CO2 V = 75 mL V = 50 mL Semirreacciones que se producen CO(g) + 1/2 O2(g) V1 V2 5V2 H2 (g) + 1/2 O2(g) V3 CO2 (g) V1 0,5 V1 C3H8 (g) + 5 O2(g) 0,5V3 Volumen de CO2 obtenido 20 % O2 3 CO2 (g) + 4 H2O (l) 3V2 H2O (l) V3 Volumen de O2 que reacciona V de O2 sobrante = 10 mL V de O2 reacciona= 75 -10 = 65 mL Como tenemos 3 incógnitas planteamos 3 ecuaciones: Ec. al volumen inicial de la mezcla: V1 + V2 + V3 = 100 mL (1) Ec. al volumen de oxígeno: 0,5 V1 + 5 V2 + 0,5 V3= 65 mL Ec. al volumen de CO2: V1 + 3 V2= 40 mL (3) (2) Calculamos el volumen de Propano (V2) Eliminamos V1 y V3; Multiplicamos por 2 la ec. (2) y restamos la ec. (1) 0,5 V1 + 5 V2 + 0,5 V3= 65 mL ·2 V1 + 10 V2+ V3= 130 mL - V1 - V2 - V3 = -100 mL (1) 9 V2 = 30 mL V2 Calculamos el volumen de CO (V1), para ello sustituimos en la ec. 3 Como V2= 3,3 mL ; V1 + 3 V2= 40 mL Calculamos el volumen de hidrógeno (V3) sustituyendo en la ecuación (1) V1 + V2 + V3 = 100 mL; V3 = 100 – V1 – V2; V3 = 100 – 30 – 10/3 = 66,7 mL de hidrógeno (H2)