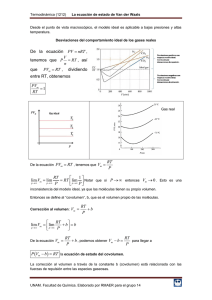
De la ecuación PV nRT = , tenemos que V P RT n = , así que PV RT
Anuncio

Termodinámica (1212) La ecuación de estado de van der Waals Desde el punto de vista macroscópico, el modelo ideal es aplicable a bajas presiones y altas temperatura. Desviaciones del comportamiento ideal de los gases reales De la ecuación PV nRT , V RT , así n PVm RT , dividiendo tenemos que P que entre RT, obtenemos PVm 1 RT De la ecuación PVm RT , tenemos que Vm RT P RT 1 RT lim Notar que si P entonces Vm 0 . Esto es una p P p P lim Vm lim p inconsistencia del modelo ideal, ya que las moléculas tienen su propio volumen. Entonces se define al “covolumen”, b, que es el volumen propio de las moléculas. Corrección al volumen: Vm RT b P RT lim Vm lim b b p p P De la ecuación Vm RT RT b , podemos obtener Vm b para llegar a P P P Vm b RT la ecuación de estado del covolumen. La corrección al volumen a través de la constante b (covolumen) está relacionada con las fuerzas de repulsión entre las especies gaseosas. UNAM. Facultad de Química. Elaborado por Q. Ricardo Manuel A. Estrada Ramírez Termodinámica (1212) La ecuación de estado de van der Waals Algunos arreglos posibles Vm P Vm b RT V n V P b RT n Vm Multiplicando por n RT b P Multiplicando por V Pn b nRT n P RT PVm bP 1 RT RT P V nb nRT Corrección por las fuerzas de atracción Asumiendo que las moléculas son esféricas, tenemos que 4 Vm r 3 elevando al cuadrado 3 Vm 2 r6 Fatracción k 1 9Vm 2 2 16 k 16 2 6 r despejando r6 9 9Vm 2 1 recordar que Fatracción k 6 2 r 16 16 2 dividiendo entre el área 9Vm 2 Fatracción 16 2 a 16 2 k a k y hacemos que con lo cual obtenemos Patracción 2 A 9A 9 AVm Vm 2 Recordar que ya habíamos obtenido P Vm b RT , que también se puede expresar como P RT a introduciendo obtenemos Vm 2 Vm b P RT a 2 Ecuación de estado de van der Waals para gases reales. Vm b Vm Las constantes a y b se llaman los coeficientes de van der Waals y tienen valores característicos para cada gas. Bibliografía recomendada: Atkins, P.W., Fisicoquímica, 3ª ed. U.S.A., Addison-Wesley Iberoamericana, 1991. UNAM. Facultad de Química. Elaborado por Q. Ricardo Manuel A. Estrada Ramírez