GASES REALES. Problemas Propuestos. 1) ¿Por qué razón se
Anuncio

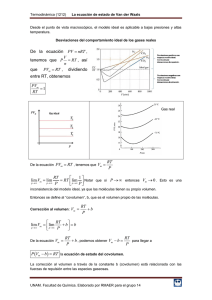
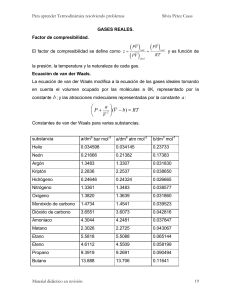
GASES REALES. Problemas Propuestos. 1) ¿Por qué razón se incrementa la constante a de van der Waals cuando la presión y la temperatura críticas se incrementan? 2) Cierto gas obedece la ecuación de estado P (V − nb ) = nRT donde b y R 3) 4) 5) 6) 7) son constantes. Si la presión y la temperatura son tales que V = 10b , ¿cuál es el valor numérico del factor de compresibilidad? Cierto gas obedece la ecuación de van der Waals con a = 0.50 m6 Pa mol-2. Su volumen es de 5.00 x 10-4 m3 mol-1 a 325K. A partir de esta información, calcular la constante b de van der Waals. Determinar el factor de compresibilidad a esta temperatura y presión. Usar la ecuación de van der Waals para calcular el valor de la presión de un mol de etano a 400 K que se encuentran confinados en un recipiente de 83.26 cm3. Comparar el resultado con el obtenido con el modelo del gas ideal y con el valor experimental que es de 400 bar. La temperatura y la presión críticas del naftaleno son 474.8 K y 40.6 atm respectivamente. Calcular las constantes a y b de van der Waals para el naftaleno. Calcular el volumen molar del CO a 200 K y 1000 bar usando la ecuación de van der Waals. Comparar el resultado con el obtenido con el modelo del gas ideal y con el valor experimental, que es 0.04009 L mol-1. Usar los datos siguientes del etano y del argón a Tr = 1.64 para ilustrar la ley de los estados correspondientes mediante la elaboración de una gráfica de Z versus V r Etano (T=500 K) P/bar 0.500 2.00 10.00 20.00 40.00 60.00 80.00 100.0 120.0 160.0 200.0 240.0 300.0 350.0 400.0 450.0 500.0 600.0 700.0 V / L mol 83.076 20.723 4.105 2.028 0.9907 0.6461 0.4750 0.3734 0.3068 0.2265 0.1819 0.1548 0.1303 0.1175 0.1085 0.1019 0.09676 0.08937 0.08421 −1 Argón (T=247 K) P/bar 0.500 2.00 10.00 20.00 40.00 60.00 80.00 100.0 120.0 160.0 200.0 240.0 300.0 350.0 400.0 450.0 500.0 600.0 700.0 V / L mol −1 40.506 10.106 1.999 0.9857 0.4795 0.3114 0.2279 0.1785 0.1462 0.1076 0.08630 0.07348 0.06208 0.05626 0.05219 0.04919 0.04687 0.04348 0.04108 8) Usar los datos del problema anterior para ilustrar la ley de los estados correspondientes haciendo la gráfica de Z versus Pr. 9) Dos moles de pentano se encuentran a 563.7 K y 132.8 atm. Calcular el volumen que ocupan a) utilizando la ecuación de los gases ideales, b) utilizando la gráfica del factor de compresibilidad generalizado. 10) Encontrar la relación entre las constantes a y b de Berthelot y las constantes críticas.