LA REACCIÓN DE DIELS ALDER EN DETALLE Otto Diels y Kurt
Anuncio

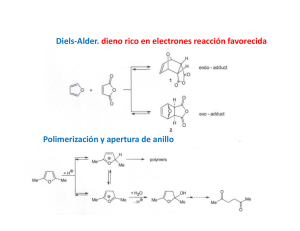
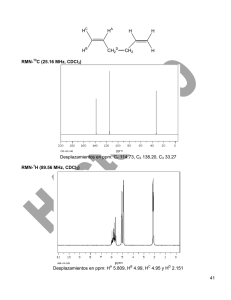
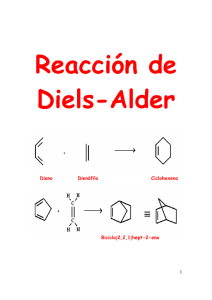
LA REACCIÓN DE DIELS ALDER EN DETALLE Otto Diels y Kurt Alder recibieron en 1950 el premio Nobel en química por el descubrimiento de la reacción entre un dieno conjugado y un alqueno. El 1,3-butadieno (dieno) [1] se adiciona al eteno (dienófilo) [2] para formar ciclohexeno [3]. Diels-Alder forma ciclos de seis miembros, por ello es conocida como una reacción de cicloadición. El estado de transición de la reacción es cíclico, perteneciendo a la familia de las reacciones pericíclicas. La reacción de Diels-Alder se favorece cuando uno de los componentes tiene grupos que le ceden carga y el otro grupos que le roban. El producto de Diels-Alder siempre tiene un ciclo más que los reactivos de partida Diels-Alder es una reacción estereoespecífica, produce un único diastereoisómero. Para dibujar el estereoisómero formado en una Diels-Alder se siguen tres reglas: 1. Diels-Alder conserva la estereoquímica del dienófilo. Si el alqueno es cis los sustituyentes quedan cis en el producto final. 2. La reacción de Diels-Alder conserva la estereoquímica del dieno. Si los sustituyentes están situados al exterior del dieno, quedan cis en el aducto final. Si un sustituyente está al interior y el otro al exterior, quedarán trans en el producto. 3. Diels-Alder es una reacción ENDO. Los sustituyentes del alqueno que se aproximan endo, quedan cis con respecto a los sustituyentes del dieno que van orientados al exterior. El producto endo es cinético y se obtiene a temperatura moderada. El producto exo por su mayor estabilidad es termodinámico y se obtiene a temperatura más elevada. En el caso de emplear dienos cíclicos se obtenen biciclos. En la aproximación endo, los sustituyentes del alqueno quedan colocados endo en el biciclo (al lado opuesto del puente). Los grupos que se aproximan exo, quedan exo en el biciclo (orientados hacia el puente). Los alquinos pueden actuar como dienófilos en al reacción de Diels-Alder. La reacción entre dieno y alquino forma un 1,4-ciclohexadieno. El 1,3-butadieno [1] reacciona con butinodioato de dietilo [2] para formar ciclohexa-1,4-dieno-1,2-dicarboxilato de dietilo. Se denomina retro-Diels-Alder a la reacción inversa a Diels-Alder. Los aductos de Diels-Alder descomponen bajocalentamiento en el dieno y dienófilo que los formaron. Los enlaces formados por la Diels-Alder (rojo) rompen, dejando libres dieno y dienófilo. En el caso de aductos formados a partir de alquinos, es posible romper la molécula de dos formas diferentes, eligiéndose aquella que deja los sustituyentes atractores sobre el dienófilo. FUENTE: www.químicaorgánica.org