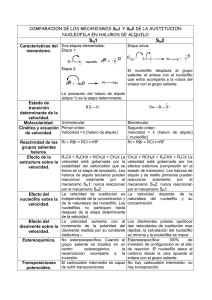
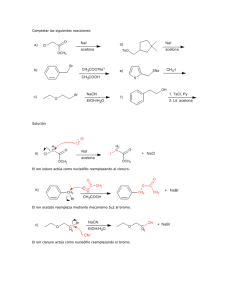
Diapositiva 1 - Campus Virtual FFyB
Anuncio

DERIVADOS HALOGENADOS PARTE I REACCIONES SN1 Y SN2 DRA. ALEJANDRA SALERNO CATEDRA DE QUIMICA ORGANICA 1 CURSO 2015 ESTRUCTURA Y CLASIFICACION R X halogenuro (grupo funcional) alquilo/ arilo H R C X H R R C X H R R C X R primario secundario terciario H H2C=HC C X H alílico primario R H2C=HC C X H alílico secundario CH2=C X H vinílico X nuclear R H2C=HC C X R alílico terciario CH2X bencílico primario REACTIVIDAD sustitución eliminación unión polar sustitución R CH2 CH2 Nu R CH2 CH2 X + NuR CH CH2 grupo saliente reactivo nucleofílico Eliminación Sustitución vs eliminación Depende de: - estructura del derivado halogenado - poder nucleofílico del reactivo - solvente SUSTITUCIONES NUCLEOFÍLICAS ALIFÁTICAS Dos mecanismos altenativos 1- el nucleófilo es atraído por el centro deficiente de e- mientras se forma el enlace Nu-C se rompe el enlace C-X (heterolítico) Producto de sustitución nucleófilo Un paso 2- el enlace C-X se rompe en forma heterolítica y se forma un carbocatión el que reacciona con el nucleófilo Producto de sustitución Dos pasos Dos mecanismos probables SN1 SN2 dos pasos un paso (concertada) El mecanismo que predomina depende de: Estructura del derivado halogenado Reactividad del nucleofilo Concentracion del nucleofilo Disolvente utilizado Competitivamente a las reacciones de sustitución se dan reacciones de eliminación SN2 Sustitución nucleofílica bimolecular bromometano metanol buen Nu- reacción de segundo orden v = k [RX] [Nu] sustitución SN2 bimolecular : en el paso limitante de la velocidad intervienen dos moléculas nucleofílica Evidencias experimentales del mecanismo de reacción: 1- La velocidad depende de la concentración del RX y del reactivo nuclefílico 2- A medida que el RX es más sustituído la velocidad disminuye 3- Si el halógeno está unido a un carbono asimétrico la configuración del centro estereogénico se invierte respecto a la del RX Mecanismo propuesto: estado de transición -Las dos especies intervienen en el estado de transición, la velocidad depende de la concentración de ambas (primera evidencia) -El nucleófilo se acerca al carbono por el lado opuesto al que se encuentra el halógeno, al aumentar la sustutución del derivado halogenado impide el acercamiento por impedimento estérico (segunda evidencia) Reactividad relativa de los RX en reacciones SN2: halogenuro de > metilo primarios > secundarios > terciarios > vinílicos y nucleares Velocidad relativa de reacción para varios halogenuros de alquilo Halogenuro de alquilo Tipo de halogenuro de alquilo Velocidad relativa metilico primario primario secundario terciario Muy lenta para medir el impedimento estérico aumenta la energía del ET y disminuye la velocidad no impedido energía libre energía libre Impedimento estérico progreso de la reacción progreso de la reacción Inversión de la configuración (tercera evidencia). Inversión de Walden tres uniones en el mismo plano ET carbono pentacoordinado La configuración del producto se encuentra invertida respecto a la del sustrato (R) 2-butano (S) 2-butanol FACTORES QUE INFLUYEN EN LA SN2 -Grupo saliente -Nucleófilo (poder nucleofílico y efectos estéricos) -Solvente Grupo saliente: son especies con carga negativa, será mejor grupo saliente el que pueda estabilizar mejor la carga. Relación inversa con la basicidad. Las bases débiles son más estables que las bases fuertes y mejores grupos salientes rapidez relativa de reacción F- Cl- Br- I- peor grupo saliente mejor grupo saliente Grupo VII diferencia de tamaño A mayor tamaño mayor estabilidad de la base, la carga se distribuye en un mayor volumen Reactividad relativa según el halógeno (grupo saliente): RI > RBr > RCl > RF Reactividad relativa según la fuerza del enlace C-X Longitudes y fuerzas de los enlaces C-H Interacción de orbitales 2sp3 -2sp3 2sp3 -3sp3 2sp3 -4sp3 2sp3 -5sp3 Longitud de enlace Fuerza de enlace Nucleófilos Nucleofilicidad: es la medida de la facilidad con la que el compuesto puede atacar un centro deficiente de electrones. Se mide como velocidad. Basicidad: es la medida en que el compuesto comparte un par de electrones con un H+. Se mide como equilibrio (acido-base) En general la basicidad y la nucleofilicidad son paralelas. Una especie con carga negativa es más básica y también mejor nucleófilo Nucleófilos más reactivos- buenos nucleófilos- nucleófilos fuertes: - CH3S metanotiolato CH3O- metóxido SH- hidrosulfuro - OH hidróxido Cl cloruro HC C acetiluro HC N- cianuro NH3 amoníaco H- hidruro CH3 C O- acetato O Nucleófilos menos reactivos- malos nucleófilos- nucleófilos débiles: H2O ROH alcoholes Efectos estéricos y nucleofilicidad Mejor nucleófilo Base más débil (el etanol es más ácido que el terc-butanol) Ion etóxido Base más fuerte Peor nucleófilo por impedimento estérico de aproximación al sustrato Ion terc-butóxido Solvente Para las reacciones SN2 los peores solventes son los polares próticos ya que solvatan al nucleófilo (anión) disminuyendo la capacidad nucleofílica anión solvatado …. Nu- …. Para las reacciones SN2 los mejores solventes son los polares apróticos ya que no forman puentes de hidrógeno y no solvatan aniones sinó cationes La d+ no está muy accesible N,N-dimetilformamida DMF Dimetilsulfóxido DMSO DMSO puede solvatar cationes mas que aniones RESUMEN DE SN2 SUSTRATO RX 1° > GRUPO SALIENTE I NUCLEOFILOS buenos nucleófilos, fuertes ESTEREOQUÍMICA inversión de configuracion SOLVENTE polar aprótico CINETICA v = [Nu] [RX] MECANISMO 1 paso CONCERTADO (ET) > 2° > Br > Cl 3° > 2° orden > vinílicos, nucleares F bimolecular UTILIDAD SINTETICA DE LA REACCION SN2 alcohol tiol éter tioéter amina primaria alquino nitrilo SN1 Sustitución nucleofílica unimolecular CH3 CH3 H3C C X + H3C C OH H2O + HX CH3 CH3 2-bromo-2-metilpropano 2-metil-2-propanol Rapidez relativa de reacciones SN1 para varios bromuros de alquilo (solvente agua, nucleófilo agua) Bromuro de alquilo Tipo de bromuro de alquilo terciario secundario primario primario rapidez relativa v = k [RX] sustitución Reacción de primer orden SN1 unimolecular : en el paso limitante de la velocidad interviene una sola especie nucleofílica Evidencias experimentales del mecanismo de reacción: 1- La velocidad depende solamente de la concentración del RX 2- A medida que el RX es más sustituido la velocidad aumenta 3- Si el halógeno está unido a un carbono asimétrico se obtienen productos con retención e inversión de la configuración Mecanismo propuesto ataque nucleofílico al carbocatión rápido lento ruptura de la unión C-Br carbocatión intemediario energía libre paso determinante de la velocidad progreso de la reacción rápido transferencia del protón - El derivado halogenado es el único que participa en el etapa lenta de la reacción (primera evidencia) -El mecanismo plantea la formación de un carbocatión intermediario según la estabilidad del intermediario la velocidad aumenta con la mayor sustitución del mismo (segunda evidencia) Reactividad relativa de los RX en reacciones SN1: RX 3° > Becílicos 2° Alílicos 2° RX 2° > bencílicos 1° alílicos 1° RX 1° > RX vinilicos, nucleares ( no reaccionan) Carbocationes bencílicos y alílicos se estabilizan por resonancia: Deriv. halog. alilico primario Se obtienen dos isómeros estructurales +CH2 CH2Cl + H2O CH2 CH2 CH2 CH2OH + + + Deriv. halog. bencílico primario alcohol bencílico Tercera evidencia: estereoquímica de la reacción: Inversion de configuración (S) 2-bromobutano (R) 2-butanol Retención de configuración (S) 2-butanol Configuración invertida respecto al sustrato Igual configuración que el sustrato Se obtiene un pequeño exceso del producto de inversión de configuración Es una recemización parcial: racemización + inversión por formación de un par iónico solvente par ionico iones disociados FACTORES QUE INFLUYEN EN LA SN1: - Grupo saliente - Nucleófilo y solvente - Reordenamientos Grupo saliente: igual que en la SN2 Reactividad relativa según el halógeno: RI > RBr > RCl > RF Nucleófilo y solvente: En general en las SN1 el nucleófilo es también el solvente: solvólisis Nucleófilos débiles, malos nucleófilos (H 2O, alcoholes) Solventes polares para favorecer la disociación del RX Reordenamientos: como el intermediario de la reacción es un carbocatión pueden ocurrir reordenamientos igual que en AE de alquenos C+ secundario C+ secundario 2-bromo3-metilbutano 3-metil-2-butanol 2-metil-2-butanol RESUMEN DE SN1 SUSTRATO RX 3° > GRUPO SALIENTE I NUCLEOFILOS malos nucleófilos, débiles ESTEREOQUÍMICA inversión de configuracion y retención de la configuración racemización parcial SOLVENTE polar CINETICA v = [RX] MECANISMO 2 pasos > Br 2° > > Cl 1° orden 1° > > vinílicos, nucleares F unimolecular Derivados halogenados bencílicos, alílicos, vinílicos y nucleares Derivados halogenados bencílicos y alilicos primarios dan reacciones S N1 y SN2 condiciones SN2 Cloruro de bencilo Bencilmetileter condiciones SN1 1-bromo-2-buteno 2-butenen-1-ol Derivados helogenados bencílicos y alílicos terciarios no dan S N2 por impedimento estérico Derivados halogenados vinílicos y nucleares no dan SN1 ni SN2: Condiciones de SN2: El nucleófilo es repelido por la nube electrónica nucleófilo nucleófilo Condiciones SN1: carbocatión vinílico inestable carbocation arilico inestable Derivados halogenados nucleares dan SUSTITUCION NUCLEOFILICA AROMATICA Si el haluro de arilo presenta grupos fuertemente atractores de electrones por resonancia en posicion es orto y para respecto al halógeno puede dar reacciones de sustitución nucleofílica. (El halógeno se encuentra activado para la Sustitución Nucleofílica Aromática Reactivos Nu-fuertes Mecanismo lento rapido Regioselectividad NO2 NO2 + Cl Cl NaOH Cl OH RESUMEN GENERAL RX 1° mal Nu- - RX 2° RX3° buen Nu- mal Nu- SN2+E2 SN1 + E1 buen Nu- mal Nu- RX alílicos, bencílicos 1° buen Nu- E2