Compración entre SN y E
Anuncio

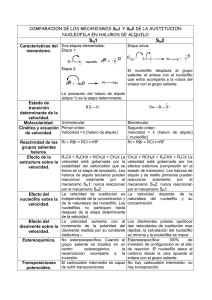
Q. CÉSAR ALEJANDRO B. NAVA ORTIZ. COMPARACIÓN DE ELIMINACIÓN Y SUSTITUCIÓN. Ahora que ya hemos estudiado varias formas en que reaccionan los halogenuros de alquilo con nucleófilos y bases, la pregunta lógica es: ¿Cómo se predice cuál de esas posibles reacciones se llevará a cabo en un caso determinado? Si se mezcla un halogenuro de alquilo con un nucleófilo determinado en un disolvente adecuado, ¿se llevará a cabo la reacción SN2 o E2? O bien, ¿predominará la reacción SN1 o la E1? No siempre se puede contestar esta pregunta. Con frecuencia, no podemos predecir el curso de la reacción. Sin embargo, en la mayor parte de los casos, podemos eliminar algunas posibilidades y hacer buenas predicciones. A continuación se presentan algunas directrices: 1. La fuerza de la base o del nucleófilo determina el orden de la reacción. Si un nucleófilo 2. 3. (o base fuerte) está presente, probablemente forzará a una cinética de segundo orden: ya sea SN2 o E2. Un nucleófilo fuerte tiene suficiente reactividad para atacar al átomo de carbono electrofílico o sustraer un protón con más rapidez de lo que una molécula pueda ionizarse lo necesario para las reacciones de primer orden. Si una base o nucleófilo fuerte no esta presente, la reacción más rápida probablemente será una de primer orden, ya sea SN1 o E1. Si agregamos sales de plata a la reacción, podemos forzar que ocurra una ionización Los halogenuros primarios participan en la reacción SN2, y a veces en la reacción E2. La mayor parte de los halogenuros primarios no pueden participar en las reacciones de primer orden, porque bajo condiciones normales no se forman carbocationes primarios. Con buenos nucleófilos, generalmente se observa la sustitución SN2. Si una base muy fuerte está presente, también se observará la eliminación E2, aunque esta reacción no es tan común como la SN2 para los halogenuros primarios. Si el grupo alquilo de un halogenuro primario es muy voluminoso, la reacción SN2 se frenará lo suficiente para que se pueda ver más eliminación. Si el halogenuro de alquilo primario se puede rearreglar fácilmente para dar un carbocatión más estable, también se podrán observar los productos rearreglos de SN1 y E1. Los halogenuros terciarios generalmente participan en la reacción E2 (base fuerte) o una mezcla de E1 y SN1 (base débil). Los halogenuros terciarios no pueden participar en la reacción SN2. Una base fuerte fuerza a una cinética de segundo orden, lo que resulta en la eliminación por el mecanismo E2. En ausencia de una base fuerte, los halogenuros terciarios reaccionan siguiendo procesos de primer orden, por lo general una mezcla de SN1 y de E1. Las condiciones específicas de reacción determinan la relación de sustitución a eliminación. Las altas temperaturas favorecen a la eliminación. Las reacciones de los halogenuros secundarios son las más difíciles de predecir. Con una base fuerte, son posibles tanto las reacción SN2 como la E2. Con una base débil y un buen disolvente ionizante, son posibles tanto la reacción SN1 como la E1. Las mezclas de productos son comunes. Las altas temperaturas favorecen la eliminación.