2. glúcidos - IES Juan Gris
Anuncio

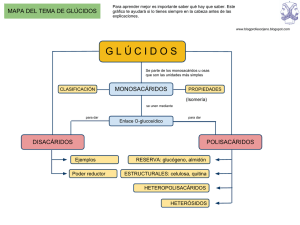
2. GLÚCIDOS 1. CARACTERÍSTICAS DE GLÚCIDOS Y CLASIFICACIÓN. 2. MONOSACÁRIDOS: CARACTERÍSTICAS GENERALES Y MONOSACÁRIDOS MÁS IMPORTANTES. ISOMERÍAS DE LOS MONOSACÁRIDOS. ENLACES DE LOS MONOSACÁRIDOS. DERIVADOS MÁS IMPORTANTES DE LOS MONOSACÁRIDOS. 3. OLIGOSACÁRIDOS SARAROSA. MALTOSA. LACTOSA. CELOBIOSA. 4. POLISACÁRIDOS. CARACTERÍSTICAS. TIPOS. 5. HETERÓSIDOS. 1. CARACTERÍSTICAS DE LOS GLÚCIDOS Y CLASIFICACIÓN. Los glúcidos están formados por los bioelementos, C, H, O, y en mucha menor cantidad, P, S y N. Podemos definirlos como aldehídos y cetonas polihidroxilados; cada átomo de C está unido a una función alcohol, salvo uno que está unido a una función aldehído o cetona. Su fórmula empírica es CnH2nOn. Los glúcidos están formados por la unión de unas unidades básicas, denominadas monosacáridos, moléculas no hidrolizables, el resto de los glúcidos que se forman a partir de ellos, sí son hidrolizables. Según presenten un grupo funcional u otro podemos clasificarlos en aldosas o cetosas, según tengan aldehído o cetona respectivamente, y según el número de átomos de carbono que tengan se denominan triosas, tetrosas, pentosas... según tengan 3, 4, 5 o más átomos de carbono. MONOSACÁRIDOS U OSAS: azúcares formados por la unión de entre 3 y 7 átomos de carbono. OLIGOSACÁRIDOS: de 2 a 15 monosacáridos ÓSIDOS Formados por la unión de varios monosacáridos HOMOPOLISACÁRIDOS: un único tipo de HOLÓSIDOS monosacáridos formados POLISACÁRIDOS únicamente por Más de 15 monosacáridos monosacáridos HETEROPOLISACÁRIDOS: más de un tipo de monosacáridos HETERÓSIDOS: formados por la unión de monosacáridos y otras sustancias no glucídicas Desde el punto de vista funcional los glúcidos son sustancias energéticas, tienen papel de fuente de energía para los seres vivos y con este fin se almacenan en forma de polisacáridos, tienen papel estructural, como la celulosa y las pentosas que forman parte de la pared celular y los ácidos nucleicos, y también función de señalizador celular. 2. MONOSACÁRIDOS. CARACTERÍSTICAS GENERALES Y MONOSACÁRIDOS MÁS IMPORTANTES Son glúcidos sencillos que no se pueden descomponer en otros más simples, por lo que se dice no son hidrolizables. 14 Tienen sabor dulce, son blancos, son solubles en agua y poseen poder reductor, es decir que pueden reducir a otra sustancia oxidándose1 ellos, (debido a la presencia del grupo aldehído o cetona). La reacción de Fehling mide esta propiedad y la estudiaremos en una práctica, más adelante Los monosacáridos más importantes con su formula desarrollada son los siguientes (en proyección de Fischer: El gliceraldehído es producto intermedio importante de muchas reacciones biológicas; La ribosa y la desoxirribosa forman parte de los ácidos nucleicos; la ribulosa participa de forma fundamental en la fotosíntesis; la glucosa se encuentra libre en el citoplasma y en el plasma, así como en uvas o dátiles; la galactosa forma parte de la lactosa, el azúcar de la leche de los mamíferos; La fructosa se encuentra libre en algunos frutos, en el semen y forma parte de la sacarosa ISOMERIAS DE LOS MONOSACÁRIDOS Dos moléculas son isómeras, cuando presentan la misma fórmula molecular y distinta fórmula estructurales o desarrolladas, los isómeros tienen diferentes propiedades ya sean físicas o químicas. Todos los monosacáridos excepto la dihidroxiacetona presentan carbonos asimétricos o quirales, estos carbonos se caracterizan por estar unidos a cuatro radicales químicos distintos. El gliceraldehído, por ejemplo, presenta dos isómeros, que solo difieren en la posición en el espacio de su –OH. Ello da lugar a la existencia de dos isómeros espaciales o estereoisómeros: el D- gliceraldehído y el L- gliceraldehído. Actividad1: De las siguientes moléculas ¿cuáles tendrán estereoisómeros? a) CH3 – CH2 OH b) HN= CH - CHCl – CHO c) CH3 – CHOH – CH3 1 Oxidar: perder electrones; Reducir: ganar electrones. 15 El isómero con la estructura L, es la imagen especular (en un espejo) y no superponible del isómero con la estructura D, por lo que ambos reciben el nombre de enantiómeros o enentiomorfos. Cuando tenemos en la molécula más de un carbono asimétrico, se establece por convenio que miremos al carbono asimétrico que ocupa la última posición en la cadena, si está a la derecha será de la serie D y si está a la izquierda será de la serie L. La presencia de uno o más carbonos asimétricos permite a las moléculas que los presentan hacer girar un cierto ángulo un haz de luz polarizada2, cuando éste atraviese una solución que contenga dichas moléculas. Si el plano gira hacia la derecha, la molécula es dextrógira (+) y si lo hace hacia la izquierda, la molécula es levógira (-), estas dos moléculas son iguales excepto en la forma de desviar la luz polarizada y se denominan isómeros ópticos. Se mide con un polarímetro y el ángulo es característico de cada monosacárido. Es muy importante señalar que: NO TIENE NADA QUE VER QUE UN MONOSACÁRIDO SEA DE LA SERIE “D” PARA QUE SEA DEXTRÓGITO O LEVÓGIOS. Así, la glucosa puede ser D- glucosa y ser dextrógira o levógira. Debemos nombrar aquí también otro tipo de isomería, en este caso de posición, en la que se modifica la posición de un grupo funcional de un carbono (o más de uno siempre que no produzca una imagen especular), en este caso, una función alcohol, se trata de los epímeros, en los que la posición del –OH del último carbono asimétrico no se modifica. 2 Luz polarizada: aquella que sus partículas vibran en un solo plano. 16 Actividad 2: ¿Cuántos esterioisómeros hay en las aldotetrosas? ¿y en las cetotetrosas? ¿Por qué existen menos en las cetosas que en las aldosas? Actividad3: La dihidroxiacetona presente en los seres vivos ¿es un isómero D o L? Las estructuras que hemos estudiado hasta ahora (proyecciones de Fischer), se corresponden con los monosacáridos en estado sólido, pero cuando están en disolución presentan una estructura cerrada, con una fórmula cíclica. La estructura cíclica de la Glucosa, por ejemplo, se origina al reaccionar el grupo hidroxilo del carbono 5, con el grupo aldehído del carbono 1, dando lugar a un hemiacetal intramolecular. El anillo que resulte se llama piranosa (ya que es semejante al pirano). Del mismo modo en la Fructosa, el grupo cetona del carbono 2 reacciona con el grupo hidroxilo del carbono 5, para formar el hemiacetal, este anillo de cinco componentes se denomina furanosa (ya que es semejante al furano). 17 Hawoth, propuso unas fórmulas planas, en las que los anillos se ven en perspectiva. En ésta representación se sitúan hacia abajo todos los grupos situados a la derecha de la fórmula lineal, y hacia arriba los situados a la izquierda, exceptuando el –OH implicado en la formación del puente de oxígeno que sufre una rotación, para poder reaccionar más fácilmente con la función aldehído o cetona de la molécula. Esta estructura permite la existencia de dos nuevos estereoisómeros, que se denominan anómeros, consecuencia de la aparición de un nuevo carbono asimétrico en posición 1 ó 2 (dependiendo de sí era un aldehído o cetona), y de que su función –OH, ahora se puede colocar por encima o por debajo del plano de la molécula. Cuando este nuevo –OH se encuentra por encima del plano se denomina de la serie β, y sí él –OH se encuentra hacia abajo se denomina de la serie α. A su vez, el anillo piranosa no es plano, sino que puede adoptar dos conformaciones en el espacio: lasilla y la nave. Nomenclatura: ahora que los monosacáridos están ciclados, se les denomina de una manera que nos indica varias características de la molécula; tenemos que poner en primer lugar, el tipo de isomería espacial, el tipo de anomeria y finalmente, el sufijo piranosa o furanosa dependiendo de la forma que han adquirido al ciclarse. 18 Por ejemplo: la D- glucosa una vez que se ha ciclado con su –OH del C 1 por debajo del plano, ahora se llama α- D- glucopiranosa. Si fuera la D- fructosa la que se hubiera ciclado con su –OH hacia arriba del plano, ahora se llama β- Dfructofuranosa. Actividad 4: ¿Por qué no es posible la ciclación de las tetrosas o de las cetofuranosas? Actividad 5: El carbono anomérico de una hexosa ciclada es siempre el carbono 1? ¿por qué? Así, podemos resumir las isomerías de los monosacáridos en: ISOMERIA ESPACIAL O ESTEREOISOMERÍA: • Enantiómería- serie D o L. • Anomería- serie α o β. ISOMERÍA ÓPTICA- dextrógiro o levógiro. ISOMERÍA DE POSICIÓN- epímeros. ENLACES DE LOS MONOSACÁRIDOS. La unión de los monosacáridos entre sí se lleva a cabo mediante enlaces O- GLUCOSÍDICOS. Dicho enlace consiste en la formación de un acetal entre el –OH hemiaetálico del Carbono Carbonílico3 de un monosacárido y uno de los carbonos alcohólicos del siguiente monosacárido con la liberación de una molécula de agua. Este enlace puede ser α o β- glucosídico, dependiendo del lugar que ocupe él –OH del primer monosacárido. La unión que se produce puede ser de dos tipos: 1. Enlace monocarbonílico: si se establece entre un carbono anomérico del primer monosacárido y un carbono no anomérico del siguiente. Como el carbono anomérico (recuerda: el que llevaba la función aldehído o cetona). Este enlace mantiene el poder reductor, ya que tiene un –OH hemiacetálico libre, el del segundo monosacárido y puede reaccionar con otras moléculas. 2. Enlace dicarbonílico: en el que participan los dos carbonos anoméricos de ambos monosacáridos, perdiéndose el poder reducto al no tener ningún –OH hemiacetálico libre con el que poder reaccionar con otras moléculas.r. 3 Carbono carbonílico: es aquel que lleva o llevaba la función aldehído o cetona. En las hexosas, el C 1 o el C 2, si son respectivamente Aldosas o pentosas. Después de la ciclación lleva el –OH hemiacetálico. 19 Además del enlace O- glucosídico que es el más frecuente, también pueden formarse enlaces mediante otros átomos diferentes del oxígeno, como por ejemplo a través del Nitrógeno y del Azufre de una función –NH o – SH, en cuyo caso los enlaces se denominan: N- glucosídico o S- glucosídico. DERIVADOS DE LOS MONOSACÁRIDOS • Polialcoholes: se obtienen por la reducción del grupo aldehído alcohol. Los más interesantes son: el Sorbitol, que deriva de la glucosa; y, el Glicerol, que deriva del gliceraldehído. • Glucoácidos: se producen por la oxidación del grupo aldehído a ácido. Los más interesantes son: ac. D- glucurónico, que deriva de la glucosa; y, el ac. Ascorbico. • Aminoazúcares: se obtienen por la sustitución de un grupo alcohol de la molécula por una función amino en el carbono 2. Quizás el más importante sea la D- glucosamina, que deriva de la glucosa y la N- acetil- glucosamina que es un derivado de la anterior, también vamos a nombrar la galactosamina. 3- OLIGOSACÁRIDOS. Los oligosacáridos son azucares cuya hidrólisis completa da lugar a la aparición de entre 2→ 15 monosacáridos, son de sabor dulce, cristalizables, solubles, y la mayoría mantienen su poder reductor. ♦ Sacarosa: se forma por la unión de una α- D- glucopiranosa y una β- D- fructofuranosa, mediante un enlace (1→2). Recibe el nombre de: α- D- glucopiranosil (1→2) β- D- fructofuranosido. Se encuentra en la caña de azúcar y remolacha azucarera y es el azúcar de consumo habitual. ♦ Lactosa: se forma por la unión de una molécula de β- D- galactopiranosa con una molécula de α- Dglucopiranosa, con enlace (1→4). Se encuentra en la leche de los mamíferos, siendo ésta su única fuente natural. ♦ Maltosa: se forma por la unión de 2 moléculas de α- D glucopiranosa, mediante un enlace (1→4). Se denomina pues, α- D- glucopiranosil (1→4) α- D- glucopiranosa. Se obtiene por la hidrólisis del almidón y del glucógeno. ♦ Celobiosa: se forma por la unión de dos moléculas de β- D- glucopiranosa, con enlace (1→4). Se obtiene de la hidrólisis de la celulosa. Actividad 6: Una solución de sacarosa ¿cambiará el color del reactivo (de azul a rojo ladrillo) al someterlo a la prueba de Fehling? ¿Y si previamente se ha hervido la solución de sacarosa con HCl durante 3 minutos? 20 Los oligosacáridos formados a partir de 3 monosacáridos tienen una propiedad fundamental, la capacidad de almacenar información, debido a la secuencia en la que se unen los distintos monosacáridos que los forman. Se encuentran en la superficie de la membrana, unidos a proteínas o lípidos, formando glucoproteínas o glucolípidos, que cumplen un papel fundamental en la identificación y señalización celular, como veremos en temas posteriores. 4. POLISACÁRIDOS. Se forman por la unión de más de 10 monosacáridos que puede llegar a alcanzar varios miles. El tipo de enlace que se forma es el de los disacáridos. Por tanto, en el proceso de unión de n moléculas se producirán (n-1) moléculas de agua. No suelen ser solubles en agua o en todo caso forman dispersiones coloidales (debido a su elevado peso molecular), no cristalizan, no tienen sabor dulce y no tienen poder reductor, como vemos han perdido las características de los monosacáridos. Los seres vivos los utilizan como elementos estructurales y de reserva. Actividad 7: ¿Cuántas moléculas de agua se liberan al formarse un polisacárido constituido por 1000 moléculas de glucosa? HOMOPOLISACÁRIDOS: Tienen un solo tipo de monosacárido y unidos mediante enlace O- glucosídico. Los estructurales presentan todos un enlace β- glucosídico, debido a que esta configuración de enlace protege más a la molécula del ataque de enzimas, ideal para realizar la función que tienen que es normalmente de sostén, además este enlace es el ideal para construir cadenas que se puedan superponer unas con otras. Los de reserva presentan un enlace α- glucosídico, que es más asequible al ataque de las enzimas, necesario para cumplir la función de reserva energética que tienen, es decir, guardar unidades de glucosa, pero poder disponer de ellas fácilmente cuando el organismo las necesite, siendo liberadas rompiendo el enlace O- glucosídico. ALMIDÓN: Constituye la principal reserva alimentaria de los vegetales, se acumula en forma de gránulos en el interior de los amiloplastos, siendo especialmente abundante en tubérculos, semillas... Con el agua caliente se forma una solución coloidal denominada “engrudo de almidón” que se colorea de azul por las soluciones de Yodo. Por hidrólisis, el almidón se descompone en los siguientes productos: 21 Almidón → dextrina → maltosa→ glucosa. Actuando en los dos primeros pasos la enzima, amilasa y en el último la maltasa. Esta formado por la unión de muchas moléculas de α- D- glucopiranosa mediante enlaces α- (1→4) y α(1→6) y estas uniones dan lugar a dos polímeros distintos: • La amilosa: la amilosa es un polímero de la maltosa, que forma una cadena lineal, que se dispone en el espacio como una hélice, dando una vuelta cada 6 moléculas de glucosa. Su peso molecular no es muy elevado, por lo que todavía es soluble en agua. Cuando se le añade yodo, se tiñe de azul violáceo. • La amilopectina: este es ya un polímero ramificado, apareciendo las ramificaciones cada 12 moléculas de glucosa, y con uniones α- (1→6). Como consecuencia tenemos ya, una molécula más grande y por lo tanto más insoluble en agua, adquiere también en el espacio una disposición helicoidal. Cuando se le añade yodo se tiñe de color rojo violáceo. Por la asociación de estos dos polímeros se forma la macromolécula de almidón. Amilosa, glucosas unidas por enlace a(1→4) Amilopectina, glucosas unidas por enlaces a(1→4) y (1→6) GLUCÓGENO: Es el polisacárido de reserva de los animales, se localiza en el hígado y en el músculo. Su estructura es semejante a la amilopectina, pero mucho más grande, ya que es también un polímero ramificado, pero en este caso sus ramificaciones aparecen cada 8 ó 10 moléculas, por lo demás se forma por la unión de unidades de glucosa, y con los mismos tipos de enlaces. ¿En qué son semejantes almidón y glucógeno, y en que se diferencian?. Son semejantes (además de su composición y tipo de enlace), en que ambos son polímeros ramificados, esta estructura molecular es la más ventajosa para liberar rápidamente unidades de glucosa, ya que las enzimas específicas actúan liberando glucosa, únicamente en los extremos reductores libres podrán actuar a diferentes niveles al mismo tiempo y liberar mayor cantidad de moléculas de glucosa. Se diferencian en que el glucógeno es más ramificado, esto es debido a que los animales requieren más energía para sus procesos vitales y por tanto cuantas más ramificaciones tengan las moléculas, más rápidamente se pueden liberar moléculas de glucosa. 22 Glucógeno Celulosa Actividad 8: Mastica una miga de pan y mantenla en la boca unos minutos ¿Qué sensación experimentas? ¿Sabrías explicar a qué se debe? Actividad 9: ¿Por qué las moléculas de reserva glucídica son polisacáridos y no monosacáridos? ¿Por qué crees que el glucógeno es una molécula más ramificada que el almidón? QUITINA: La quitina se forma de una manera semejante a la celulosa, es decir, por asociación de unidades cada vez más complejas, pero en este caso a partir de otra molécula, de la β- N- Acetil- glucosamina en enlace (1→4). Este polisacárido es una gran reserva en la naturaleza de nitrógeno, ya que la quitina forma parte del exoesqueleto de los artrópodos, y dado lo numerosos que son estos animales y la cantidad de nitrógeno que necesitamos para construir estas estructuras nos damos cuenta de la cantidad de este átomo que está acumulado en estos animales. CELULOSA: Es el componente fundamental de las paredes celulares de los vegetales. Está formado por la unión de unidades de celobiosa, en cadenas no ramificadas, estas cadenas se asocian mediante puentes de hidrógeno para formar microfibrillas, estas se asocian nuevamente para dar lugar a fibrillas y por último estas se reúnen para dar lugar a fibras de celulosa, (como ocurre en el algodón), estas se dispondrán entrelazadas, para dar lugar a capas de celulosa. Esta estructura de asociación de unidades cada vez más complejas y perfectamente empaquetadas hace que sean muy rígidas e insolubles en agua, lo que explica su función de sostén y protección, es decir, estructural. 23 5. HETEROPOLISACÁRIDOS: Los heteropolisacáridos están formados por varios tipos de polisacáridos distintos. Para estudiarlos vamos a separarlos en dos grupos: Los de origen vegetal: son componentes estructurales de la pared o membrana de secreción: • • • Hemicelulosa: es un polímero de la xilosa, arabinosa y de otros azúcares. Es componente de la matriz de la pared celular. Gomas: se les atribuye una función defensiva frente a traumas externos o internos y salen al exterior como exudados vegetales en forma de lágrimas, perlas o masas rugosas. Presentan interés económico la goma arábiga (se extrae de la acacia), la goma de cerezo... Mucílagos: estos no fluyen al exterior, pues parece que tienen función de defensa interna. Su propiedad más característica es la de hincharse al contacto con el agua, lo que les convierte en sustancias apropiadas para lubricar las heces y evitar el estreñimiento, son muy abundantes en las semillas de lino, y las algas. Destacamos el Agar- Agar: es un polímero de la D y L- galactosa, algunas de las cuales forman ésteres con el ácido sulfúrico. Se encuentra en las algas rojas, y cuando se hierve en agua y se deja enfriar, se transforma en una especie de gelatina, muy utilizada en microbiología para fabricar medios de cultivo, en la industria alimentaria como espesante en la elaboración de helados, flanes… De origen animal- MUCOPOLISACÁRIDOS: Tienen carácter ácido debido a que en su composición intervienen aminoazúcares, y ácidos urónicos, que aveces forman ésteres con el ácido sulfúrico. Cuando se unen a proteínas forman lo que se denomina mucoproteínas. • Ácido hialurónico: se encuentra como sustancia cementante en el liquido tisular del tejido conjuntivo, cartilaginoso y óseo y como lubrificante en el líquido sinovial; también aparece en el humor vítreo del ojo y en la cubierta de los ovocitos. • Condroitina: es junto con el anterior componente de la sustancia intercelular del cartílago, los huesos y la córnea, donde actúa como sustancia cementante. • Heparina: además de localizarse en el líquido tisular de varios tejidos(pulmón e hígado), tiene un importante papel como anticoagulante de la sangre, por lo que se utiliza como fármaco para prevenir la trombosis. 5. HETERÓSIDOS. Son sustancias que están formadas por una parte glucídica y otra no glucídica llamada aglucón, que puede ser de naturaleza diversa (alcoholes, fenoles, esteroides...). Si el aglucón es naturaleza lipídica, se denominan glucolípidos, y si es una proteína, glucoproteína. • Muchos heterósidos forman parte de los principios activos de numerosas plantas medicinales, que en dosis adecuadas, se utilizan como fármacos, pero pueden llegar a causar intoxicaciones 24 graves, e incluso mortales. Entre ellos cabe citar a los heterósidos cardiotónicos, presentes en las hojas de Digitalis purpúrea; los heterósidos cianogenéticos, presentes en las almendras amargas, cuya ingestión libera ácido cianhídrico, que puede ser mortal; o la glicirrina, existente en la raíz del regaliz, que posee acción espectorante y antiinflamatoria. • Los ácidos nucléicos también pueden ser considerados heterósidos, resultado de la unón de Ribosa o desoxirribosa con bases nitrogenadas. • Glucolípidos: como los gangliósidos o los cerebrósidos. • Glucoproteínas: son muy variadas y cumplen funciones importantes: • Los peptidoglicanos: son constituyentes de la pared bacteriana y están formados por un armazón de naturaleza polisacárida, resultado de la formación de largas cadenas producidas de la sucesión de dos monosacáridos: N- acetil- glucosamina y N- acetil- murámico, estas largas cadenas se unen entre sí, mediante otras pequeñas cadenas de aminoácidos, siendo el enlace que los une, el enlace peptídico. • Mucoproteínas o mucinas: las mucinas son segregadas en el tracto respiratorio (mucus), digestivo (lubrifican el bolo alimentario) y urogenital (taponan el cuello del útero para impedir la invasión bacteriana y lubrifican la vagina durante el coito y el parto). • Glucoproteínas estructurales de la membrana celular, esta es una función muy importante que describiremos detenidamente cuando estudiemos las membranas. Actividad 10: Explica el significado de los siguientes símbolos: a) D y L; b) (+) y (-); c) α y β. Actividad 11: Completa la siguiente tabla: glúcido maltosa tipo polisacárido localización cebada Exoesqueleto artrópodos función anticoagulante Caña azúcar polisacáridos Músculos e hígado lactosa Actividad 12: Semejanzas y diferencias entre glucógeno, almidón y celulosa. Actividad 13: 25 Teniendo en cuenta las fórmulas de la D- glucosa, D-manosa y D- galactosa, escribe las fórmulas de la Lglucosa, L-manosa, y L- galactosa e indica alguna propiedad física en las que difieran los isómeros D y L de dichos azúcares. Actividad14: ¿Cuáles son los glúcidos de almacenamiento en los vegetales y en los animales? Actividad 15: La gráfica muestra las cantidades relativas de glúcidos en hojas y tubérculos de una planta de patata. Interprétala indicando los cambios bioquímicos que se producen y esquematiza las correspondientes reacciones. Actividad16: La miel contiene una mezcla equimolecular de glucosa y fructosa. Esta mezcla es el resultado de un proceso conocido como “inversión de la sacarosa”, el azúcar más abundante en el néctar de las flores. En la saliva de las abejas existe una enzima, la sacarosa, que desdobla la sacarasa en sus dos monosacáridos: la glucosa que es dextrógira y la fructosa que es levógira y su acción de giro de la luz polarizada es mayor que el de la glucosa, por lo que el efecto resultante de la mezcla es una actividad levógira; de ahí el nombre de “inversión” con el que se conoce la hidrólisis de la sacarosa. Teniendo en cuenta esta información responde: a) ¿qué diferencia, en cuanto a composición química, hay entre la miel y una solución de sacarosa? b) Si realizamos la prueba de Fehling a la miel, ¿dará positiva o negativa? c) ¿con que proceso físico resolverías si un producto es miel o una solución de sacarosa? 26