utilidad clínica de la pth intraoperatoria
Anuncio

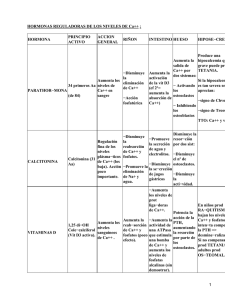
UTILIDAD CLÍNICA DE LA PTH INTRAOPERATORIA CURSO DE FORMACIÓN CONTINUADA A DISTANCIA 2010-2011 TALLER DEL LABORATORIO CLÍNICO Nº 1 I.S.S.N.- 1988-7469 Título: Taller del Laboratorio Clínico Editor: Asociación Española de Biopatología Médica Maquetación: AEBM Fecha de Distribución: noviembre de 2010 Utilidad clínica de la PTH intraoperatoria Gema Mª Varo Sánchez.- QIR de Análisis Clínicos. Carolina Andrés Fernández.- Facultativo Especialista de Área de Análisis Clínicos. Servicio de Análisis Clínicos del Complejo Hospitalario Universitario de Albacete. 1. Introducción. 2. Secreción y metabolismo de la hormona paratiroidea o PTH. 2.1 Péptidos circulantes paratiroideos. 2.2 Principales receptores de la PTH. 2.3 Acciones fisiológicas principales de la PTH. 3. Hiperparatiroidismo primario. 3.1. Etiopatogenia y clasificación anatomopatológica de HPP. 3.2. Fisiopatología. 3.3. Manifestaciones clínicas. 3.4. Tratamiento quirúrgico. 4. Hiperparatiroidismo secundario y terciario. 4.1. Fisiopatología. 4.2. Manifestaciones clínicas. 4.3. Tratamiento. 5. Métodos de determinación de la PTH. 5.1. Ensayos de primera generación. 5.2. Ensayos de segunda generación. 5.3. Ensayos de tercera generación. 6. Principales consideraciones en el abordaje del Hiperparatiroidismo asintómatico según the Third International Workshop of Hyperparathyroidism in 2008. 7. Protocolo de monitorización de la PTH intraoperatoria. 8. Utilidad clínica de la PTH intraoperatoria. 9. Conclusiones. 10. Referencias bibliográficas. 403 1. Introducción La PTH o parathormona es la hormona fundamental en la regulación del metabolismo fosfo-cálcico, cuya determinación en suero o plasma es primordial para el diagnóstico diferencial de hipercalcemia e hipocalcemia, así como para el tratamiento de la función paratiroidea en trastornos del metabolismo óseo y fallo renal. En la última década, los avances en los ensayos de determinación de PTH han hecho posible la monitorización de los niveles de PTH intraoperatoria en la cirugía del hiperparatiroidismo. El hiperparatiroidismo (HP) ocasiona una alteración en el metabolismo del calcio, fósforo y tejido óseo por hiperfunción de las glándulas paratiroides. Debido a que la PTH tiene una vida media de 2-4 minutos, la disminución significativa de la concentración intraoperatoria permite evaluar la resección completa y la extracción total del tejido paratiroide hiperfuncionante (1) . 2. Secreción y metabolismo de la hormona paratiroidea o PTH. La PTH es sintetizada en los ribosomas de las células principales de las glándulas paratiroideas como una pre-prohormona de 115 aminoácidos y un peso molecular de 13 kilodaltons (kDa), cuyo fragmento señal de 25 aminoácidos se escinde al entrar en la luz del retículo endoplasmático dando lugar a la prohormona (90 aminoácidos y 10 kDa). En el aparato de Golgi, el propéptido se hidroliza y pierde un fragmento de 6 aminoácidos, que da lugar a la hormona biológicamente activa o PTH intacta (84 aminoácidos y 9,3 kDa) (2) . 2.1 Péptidos circulantes paratiroideos.La función renal es fundamental en el metabolismo de la PTH, pequeñas alteraciones en el aclaramiento renal suponen incrementos en los niveles circulantes de hormona y de sus fragmentos. 404 La biosíntesis de PTH intacta tiene una duración aproximada de una hora, y entre las formas circulantes se encuentran: Fragmentos carboxi-terminales o C-terminales: son esenciales en el proceso de exocitosis de la PTH, tienen un tiempo de vida media de 5 a 10 veces superior a la PTH intacta y les faltan largos segmentos del extremo aminoterminal. Representan aproximadamente un 80% de las formas de PTH circulantes en individuos sanos y hasta un 95% en enfermos renales crónicos. Fragmentos amino-terminales o N-terminales: son ricos en aminoácidos hidrófobos, los cuales son fundamentales para su transporte al retículo endoplasmático durante la biosíntesis de la PTH. Estos fragmentos presentan una fosforilación del aminoácido en la posición 17. En individuos con función renal normal, constituyen de un 4 a 8 % de las formas circulantes de la PTH, y hasta un 15% en pacientes con fallo renal. Fragmentos no PTH 1-84: son fragmentos grandes C-terminales con ausencia de algunos aminoácidos en el fragmento N-terminal. En individuos sanos representan un 10% de todos los C-terminales. La isoforma predominante es PTH 7-84, que tiene propiedades opuestas a la PTH, es decir, posee propiedades hipocalcemiantes. PTH intacta o PTH 1-84: hormona activa de 84 aminoácidos con una zona amino-terminal de 34 aminoácidos. Representa de un 5 a 30 % de todas las formas circulantes de la PTH (3) . Cabe destacar la proteína PTHrp (PTH related protein) que fue identificada en 1987, y es miembro de la familia de la PTH, con función análoga a la parathormona. Aunque 405 la PTHrp está presente en tejidos normales de adulto y feto, sus niveles sanguíneos son bajos y suele estar asociada a hipercalcemia tumoral. 2.2 Principales receptores de la PTH La PTH lleva a cabo sus funciones mediante la unión del extremo amino-terminal al receptor específico clásico PTH/PTHrp, o también denominado PTHR1, proteína de membrana de las celulas paratiroideas de la familia de receptores ligados a proteínas G, codificado por el gen PTHR1. PTH y PTHrp se unen a PTHR1 con gran afinidad e inducen la activación de la fosfolipasa C y adenociclasa, que inhiben la producción del segundo mensajero AMPc. Dicha señal celular estimula la resorción ósea y la reabsorción renal tubular de calcio. El PTHR1 se expresa mayoritariamente en hueso y riñón, pero también está presente en páncreas, mama, testículos, etc. Otro receptor identificado es el PTHR2 que actúa como inhibidor de la PTH al unirse al PTHR1 impidiendo su activación. Es selectivo para la PTH pero no para PTH rp. Este receptor se expresa en el sistema nervioso central, testículos, páncreas y placenta (4) . Existen evidencias de la existencia de más receptores de la PTH, como el PTHR3 que es específico para PTHrp, PTHR4 que se une a los fragmento C-terminales de la PTH o CPTHR que está muy expresado en osteocitos y es específico para PTH 7-84. El receptor más estudiado hasta ahora ha sido el PTHR1, de hecho, posibles polimorfismos en el gen PTHR1 pueden determinar la sensibilidad renal y ósea a la PTH (5) . 2.3 Acciones fisiológicas principales de la PTH. 406 Tabla 1. Acciones fisiológicas de la parathormona REGIÓN Hueso Riñón (6) . EFECTO Aumenta la liberación de calcio y fósforo al torrente sanguíneo por resorción osteoclástica. Aumenta la reabsorción tubular de calcio e inhibe la de fósforo. Estimula la actividad del enzima 1-hidroxilasa, favoreciendo la síntesis renal de 1,25 dihidroxivitamina D. Intestino Aumento de la absorción digestiva de calcio y fósforo por activación renal de la vitamina D. 3. Hiperparatiroidismo primario. El hiperparatiroidismo primario (HPP) se caracteriza por un aumento en la secreción paratiroidea de PTH, ocasionando una alteración en el metabolismo fosfo-cálcico y óseo (7) . 3.1 Etiopatogenia y clasificación anatomopatológica del HPP. El HPP es una enfermedad de etiología múltiple. Mayoritariamente, el HPP está causado por un adenoma benigno monoclonal de alguna de las glándulas paratiroideas (80-85%), mientras que es menos frecuente por hiperplasia paratiroidea (12-15%) y solamente en un 1-4% de los casos se trata de carcinoma paratiroideo. De un 3 a un 5% de los casos son de origen hereditario, como por ejemplo la neoplasia endocrina múltiple tipo 1 y 2, la hipercalcemia hipocalciúrica familiar, etc. El HPP es una alteración endocrina más frecuente en mujeres que en hombres, en una relación 2:1, y en pacientes mayores de 50 años, siendo muy rara encontrarla en niños (8) . 407 3.2 Fisiopatología. La manifestación más común de HPP es la hipercalcemia causada por el exceso de PTH, que se explica por: Aumento de la masa total de tejido paratiroideo, es decir, mayor número de células secretoras. Aumento del umbral de los niveles de calcemia a los que se suprime la PTH. 3.3 Manifestaciones clínicas. Los síntomas más frecuentes son consecuencia de la hipercalcemia, dando lugar a una gran variedad de manifestaciones patológicas (Tabla 2). Tabla 2. Manifestaciones clínicas más frecuentes por hipercalcemia (6). HIPERCALCEMIA Arritmia cardíaca Hipertensión arterial Reducción intervalo QT en el electrocardiograma Fatiga Mialgias Depresión Mareos Artritis Osteoporosis Dolor generalizado Diarrea Vómitos GASTROINTESTINAL/ Anorexia RENAL Deshidratación Poliuria Litiasis renal Tetania neonatal Retraso crecimiento intrauterino CARDIOVASCULAR NEUROMUSCULAR ESQUELÉTICO EMBARAZO 408 Durante los últimos años, la petición rutinaria de calcio en suero ha supuesto un aumento en la incidencia y prevalencia de HPP en los países desarrollados. Y ha tenido como consecuencia la detección de los comienzos de enfermedad, con valores de calcemia ligeramente por encima al límite superior del intervalo de referencia y con escasa sintomatología, lo que se denomina hiperparatiroidismo asintomático. El HPP asintomático se caracteriza por la carencia de manifestaciones clínicas de hipercalcemia. El abordaje del HPP asintom ático ha sido muy estudiado, llegando a nuevas conclusiones en la última reunión de 2008 por el grupo de expertos, que serán comentadas más adelante. 3.4 Tratamiento quirúrgico Ante un HPP sintomático, el tratamiento quirúrgico se encuentra indicado pues es la única vía de curación de la enfermedad, y además la terapia médica disponible no tiene una respuesta compensadora tan completa cómo la extirpación de la glándula hiperfuncionante. Por otro lado, el porcentaje de éxito de la intervención es de un 95% con baja mortalidad y escasa recurrencia de la enfermedad (1) . Las complicaciones de la intervención no son muy graves, entre ellas destacan: Hemorragias no muy severas. Lesión del nervio recurrente. Hipocalcemia postquirúrgica Otras complicaciones propias de una intervención bajo anestesia. Sin embargo, la opción de la paratiroidectomía ante el HPP asintomático ha sido muy controvertida, por ello se han ido modificando los criterios de indicación quirúrgica en los últimos años por el comité de expertos, con el fin de definir mejor la barrera entre intervención o tratamiento médico para este tipo de pacientes (9) . 409 4. Hiperparatiroidismo secundario y terciario. El hiperparatiroidismo secundario (HPS) se caracteriza por el aumento en la secreción de la PTH como respuesta compensadora ante una hipocalcemia, estimulando la proliferación e hiperplasia de las células paratiroideas. En la regulación de los niveles de PTH intervienen: calcitriol, fósforo y calcio. Se considera hiperparatiroidismo terciario (HPT) cuando el HPS se cronifica y se llega a una situación de hipercalcemia persistente, induciendo al tejido paratiroideo a funcionar de forma autónoma e irreversible, de forma que libera PTH sin control. El HPT es altamente prevalente en pacientes con insuficiencia renal crónica (10) . 4.1 Fisiopatología Las causas principales de HPS son: Hiperplasia de las glándulas paratiroideas. Insuficiencia renal crónica (IRC). Déficit de aporte de vitamina D y calcio (dieta, síndrome de malabsorción, raquitismo, etc.). Osteodistrofia renal. Pancreatitis. Otros (rabdomiolisis, fármacos, hiperfosfatemia, etc.). La causa principal de HPT es la hiperplasia nodular o adenomas múltiples en el HPS. 4.2 Manifestaciones clínicas Las manifestaciones más frecuentes son deformidades óseas, fracturas, inflamación articular, debilidad, crecimiento deficiente, osteoporosis, etc. Todas ellas relacionadas con la causa subyacente de HPS. 410 4.3 Tratamiento En pacientes con HPS en estadios tempranos de insuficiencia renal el tratamiento médico a seguir suele ser: Restricción de fósforo en la dieta y empleo de quelantes de fósforo. Administración de sales de calcio. Administración de vitamina D. Empleo de calcimiméticos. El tratamiento quirúrgico en HPS está peor definido que para el HPP, a pesar de ello, en pacientes que no responden al tratamiento médico y con niveles altos de PTH se opta por la intervención, como por ejemplo, en grados severos de IRC (11) . La KDOQI (Kidney Disease Outcomes Quality Initiative) en sus guías recomienda el uso de PTH intacta para el diagnóstico y monitorización de enfermedad ósea renal en pacientes con HPS (12) . Promueve el empleo de rangos de valores de la PTH para establecer el estadío de la enfermedad, junto con otras pruebas bioquímicas como calcio, fósforo y tasa de filtración glomerular. 5. Métodos de determinación de PTH (13) . 5.1 Ensayos de primera generación. En 1963 se presentó el primer radioinmunoensayo (RIA) para la determinación de PTH. El RIA emplea diferentes anticuerpos policlonales dirigidos a los epítopos más antigénicos, que corresponden a la región media y C-terminal de la molécula de PTH, y por lo tanto, mide fragmentos de PTH biológicamente inactiva que carecen de efectos calcémicos. Estos ensayos mostraron limitaciones en la utilidad clínica, pues no discriminaba entre pacientes sanos y aquellos con HPP o hipercalcemia tumoral, y 411 sobre todo, en pacientes con HPS a insuficiencia renal con elevadas concentraciones de fragmentos C-terminales que carecen del extremo amino-terminal de unión a PTHR1. 5.2 Ensayos de segunda generación. A finales de la década de los 80 se introducen los ensayos inmunométricos (IMA) o sandwich que emplean dos anticuerpos, uno dirigido a la porción C-terminal de la molécula de PTH y el otro a la porción N-terminal, así se detecta directamente la PTH intacta. Los anticuerpos se marcan con isótopos radiactivos (IRMA), como 125 I, o mediante el marcaje de sonda o enzima por quimioluminiscencia (ICMA). Estos ensayos presentan mayor especificidad y sensibilidad que los RIA, por lo tanto, se consigue una mejor discriminación entre individuos sanos y pacientes afectos de hiperparatiroidismo y se obtienen resultados reproducibles en pacientes en proceso de diálisis. En 1996, D´Amour detecta formas no PTH 1-84 en los IMAs, concretamente el fragmento PTH 7-84, que en su gran mayoría suelen ser biológicamente inactivos y tener propiedades hipocalcemiantes. Esto suponía la sobreestimación de la PTH, sobre todo en pacientes con fallo renal (14) . 5.3 Ensayos de tercera generación. Estos inmunoensayos, denominados ensayos de PTH biointacta, emplean una captura similar a los ensayos de PTH intacta, pero utiliza la detección de anticuerpos directamente contra epítopos específicos del extremo N-terminal final, en concreto, epítopos 1-4 de la molécula de PTH. Por lo tanto, sólo se detecta PTH biológicamente activa y no presenta reacción cruzada con fragmentos no PTH 1-84. 412 Actualmente, multitud de estudios demuestran resultados comparables y con una excelente correlación de la PTH entre los ensayos de segunda generación y los de tercera (15) . Sin embargo, en pacientes con IRC o en proceso de diálisis se observan unos valores de PTH de un 50% inferior para PTH biointacta frente PTH intacta, esto es debido a que el ensayo de segunda generación detecta fragmentos grandes Cterminales, que suelen acumular los pacientes con IRC (16) . Los ensayos de PTH intacta y biointacta se emplean indistintamente para el diagnóstico del hiperparatiroidismo. En la determinación de PTH intraoperatoria durante una paratiroidectomía, es más conveniente el empleo de ensayos de tercera generación, pues no se detectan fragmentos de PTH 7-84, sin embargo, en la mayoría de los laboratorios se emplea la determinación de PTH intacta. Para el diagnóstico y monitorización de enfermedades óseas asociadas a fallo renal es frecuente emplear ensayos de PTH intacta, no encontrándose ventajas frente a ensayos de tercera generación. Actualmente, se disponen de una gran variedad de inmunoanálisis para la determinación de PTH intraoperatoria, pero los más utilizados se nombran en la tabla 3. Estos inmunoensayos presentan buenos rangos de medida y resultados comparables entre sí. La mejora en el tiempo de respuesta introdujo el empleo de dispositivos portátiles para la monitorización de PTH (PTH intacta de Nichols® o de Future Diagnostics®), de fácil manejo y gran utilidad como prueba a la cabecera del paciente (POCT-PTH). Muchos laboratorios emplean el equipo de rutina para la determinación de la PTH intraoperatoria, ya que los tiempos de respuesta de los ensayos son adecuados para 413 la monitorización (como por ejemplo Elecsys de Roche®), se amortizan gastos y se obtienen resultados de PTH sin diferencias metodológicas con los de seguimiento del paciente. Tabla 3. Inmunoensayos de 2ª y 3ª generación. Ensayo/ Fabricante Forma de PTH Equipo Automático Tiempo de respuesta Quick-Intraoperative Intact PTH Nichols Institute Diagnostics® Intacta No 15 minutos STAT-IO-I PTH Future Diagnostics® Intacta No 10 minutos Turbo Intact PTH Diagnostic Products Corporation® Intacta Sí 15 minutos Elecsys Roche Diagnostics® Intacta Sí 12-20 minutos (E1010-E20210) Quick-Intraoperative Biointact PTH Nichols Institute Diagnostics® Biointacta Sí 12 minutos 6. Principales consideraciones en el abordaje del Hiperparatiroidismo asintomático según the Third International Workshop of Hyperparathyroidism in 2008. El National Institute of Health (NIH) Workshop en la reunión de 1990 determinó que muchos pacientes con hiperparatiroidismo primario (HPP) asintomático podían ser monitorizados sin la necesidad de la cirugía. Por otro lado, en el 2008, en la tercera reunión internacional de expertos de HPP asintomático (9) se aprobaron nuevos criterios de indicación quirúrgica, modificando los consensuados en el 2002 y considerando la intervención si se cumple uno de los siguientes criterios: Edad < 50 años. Reducción del aclaramiento de creatinina a menos de 60mL/min. Calcio sérico mayor de 1mg/dL del límite superior del intervalo de referencia. Densitometría ósea con T-score< -2.5. 414 Por otro lado, la terapia médica del HPP asintomático está indicada en: Pacientes asintomáticos con enfermedad recurrente o persistente después de la cirugía y que reúnen los criterios para una nueva cirugía de paratiroides. Pacientes con un alto riesgo quirúrgico. Pacientes que rechazan la cirugía de paratiroides o en quienes la cirugía está contraindicada. Como terapia adjunta a la paratiroidectomía en pacientes con carcinoma de paratiroides. El grupo de expertos sugirió que la monitorización clínica recomendada en caso de no intervención es: calcio y creatinina sérica anual y densitometría ósea cada 1-2 años. 7. Protocolo de monitorización de la PTH intraoperatoria. Las recomendaciones de la Academia Nacional de Bioquímica Clínica de Estados Unidos (NACB) (17) Obtención para la determinación de PTH intraoperatoria son las siguientes: de muestras basales preoperatorias (PTH1), previas o inmediatamente posteriores a la extirpación (PTH 2). Debe obtenerse nueva muestra pasados 5-10 minutos de la resección (PTH 3). Si la reducción de los niveles de PTH 3 respecto del nivel basal más alto (PTH 1 o PTH 2) supera el 50%, la intervención quirúrgica se considera exitosa. El análisis de muestras adicionales (PTH 4) aumenta la sensibilidad de los hallazgos, ya que ésta aumenta pasado más tiempo. 415 Si los valores de PTH no se reducen por debajo de los niveles recomendados, esto indica que: a) Sigue existiendo tejido hiperfuncionante residual (por ejemplo, pacientes con quinta glándula paratiroides ectópica), b) Los niveles de PTH alcanzaron valores pico al movilizar el adenoma. Figura 1. Protocolo de monitorización de PTH intraoperatoria. Las muestras deben extraerse en tubo malva de EDTAK3, para una determinación en plasma en el menor tiempo posible. La mejora en el tiempo de respuesta de los inmunoensayos de PTH ha sido fundamental en la determinación intraoperatoria, abarcando tiempos de 10 a 20 minutos. Si la determinación de PTH intraoperatoria se realiza en el laboratorio de rutina, resulta primordial una ágil comunicación de los resultados de las pruebas con el quirófano para ayudar al cirujano en el éxito de la intervención. Por el contrario, los equipos portátiles de POCT-PTH permiten el uso en el quirófano, con una información más rápida de los resultados, pero son equipos más caros que necesitan una dedicación mayor para la calibración y el mantenimiento de los mismos. 416 8. Utilidad clínica de la PTH intraoperatoria. La determinación intraoperatoria de PTH permite una evaluación rápida y fiable de la extracción del tejido paratiroide hiperfuncionante en el procedimiento quirúrgico, consiguiendo cirugías menos invasivas (18) . Esto es posible porque la PTH tiene un tiempo de vida medio de 2-4 minutos, por tanto, tras la resección exitosa existirá una disminución significativa de los niveles sanguíneos de la hormona, que revelará la efectividad de la intervención. La posibilidad de determinación de la PTH durante la paratiroidectomía logra reducir las complicaciones postoperatorias, y por tanto las molestias del paciente ante una nueva intervención por recurrencia de la enfermedad. También se consigue una disminución de los costes socio-sanitarios, pues permite el alta hospitalaria en menor tiempo. Frente a la controversia existente ante la cirugía del HPP asintomático, en los últimos años, las reuniones del comité de expertos han facilitado enormemente los criterios decisivos de intervención o terapia médica, y en ambos casos el valor de la paratirina o parathormona es fundamental. 9. Conclusiones. El futuro desarrollo de nuevos ensayos que nos permitan distinguir entre los diferentes fragmentos circulantes de PTH, mejorará la utilidad diagnóstica y permitirá conocer mejor las contribuciones de la parathormona y sus fragmentos en el metabolismo óseo. La monitorización de la PTH intraoperatoria en la cirugía del HPP es fácil de realizar y tiene un gran valor clínico pues es capaz de predecir el éxito de la paratiroidectomía. 417 Permite el uso de técnicas menos invasivas, disminuyendo el tiempo de intervención y la estancia hospitalaria, lo que repercute favorablemente en los costes del proceso. 418 10. Referencias bibliográficas. (1) Lori J, Sokoll PhD. Measurement of parathyroid hormone and application of parathyroid hormone in intraoperative monitoring. Clin Lab Med 2004; 24:199216. (2) Cole D, Webb S, Chan P. Update on parathyroid hormone: New tests and new challenges for external quality assessment. Clin Biochem 2007; 40: 585–590. (3) Murray TM, Rao LG, Divieti P, Bringhurst FR. Parathyroid hormone secretion and action: evidence for discrete receptors for the carboxyl-terminal region and related biological actions of carboxyl- terminal ligands. Endocr Rev 2005; 26-78. (4) Potts JT. Parathyroid hormone: past and present. J Endocrinol 2005; 187:311– 25. (5) Heishi M, Tazawa H, Matsuo T, Saruta T, Hanaoka M, Tsukamoto Y: A novel Van91 I polymorphism in the 1st intron of the parathyroid hormone (PTH)/PTHrelated peptide (PTHrP) receptor gene and its effect on the urinary cAMP response to PTH. Biological and Pharmaceutical Bulletin 2000; 23:386-389. (6) Becker K, Bilezikian J, Bremner W, Hung W, Kahn C et al. Principles and Practice of Endocrinology and Metabolism. 3ª edición. Philadelphia: Lippincott Williams & Wilkins Publishers; 2002. (7) Silverberg, SJ, Bilezikian, JP. Evaluation and management of primary hyperparathyroidism. J Clin Endocrinol Metab 1996; 81:2036. (8) Larsen P, Kronenberg H, Melmed S, Polonsky K. Williams Textbook of Endocrinology. 10ª edition. Philadelphia: W.B. Saunders Company, 2003. (9) John P. Bilezikian, Aliya A. Khan, and John T. Potts, Jr. Guidelines for the Management of Asymptomatic Primary Hyperparathyroidism: Summary Statement from the Third International Workshop. J Clin Endocrinol Metab 2009; 94: 335– 339. (10) Rodríguez M. Etiopatogenia del hiperparatiroidismo secundario: factores que afectan a la secreción de PTH. Nefrología 1995; 25: 25-30. (11) Santamaría I, Cannata J. Etiopatogenia del hiperparatiroidismo primario, secundario y terciario: implicaciones de los cambios moleculares en el fracaso terapéutico. Nefrología 2002; 22: 213-218. (12) National Kidney Foundation. K/DOQI clinical practice guidelines for bone metabolism and disease. Am J Kidney Dis 2003;42(3):1–200. 419 (13) Goodman WG. The evolution of assays for parathyroid hormone. Semin Dial 2005;18:296–301. (14) Brossard JH, Cloutier M, Roy L, Lepage R, Gascon-Barre M, D’Amour P. Accumulation of a non-(1–84) molecular form of parathyroid hormone (PTH) detected by intact PTH assay in renal failure: importance in the interpretation of PTH values. J Clin Endocrinol Metab 1996;81:3923–9. (15) Yamashita, H, Gao, P, Cantor, T, et al. Comparison of parathyroid hormone levels from the intact and whole parathyroid hormone assays after parathyroidectomy for primary and secondary hyperparathyroidism. Surgery 2004; 135:149. (16) D’Amour P, Brossard JH, Rousseau L, Nguyen-Yamamoto L, Nassif E, Lazure C et al. Structure of non-(1-84) PTH fragments secreted by parathyroid glands in primary and secondary hyperparathyroidism. Kidney Int 2005; 68: 998–1007. (17) Sokoll LJ, Remaley AT, Sena SF, Wians FH Jr, Wu J, Libutti SK, Udelsman R. Intraoperative parathyroid hormone. Laboratory medicine practice guidelines: evidence-based practice for point-of-care testing. Washington (DC): National Academy of Clinical Biochemistry (NACB); 2006. p. 105-19. [99 references]. (18) Sharma J, Milas M, Berber E, Mazzaglia P, Siperstein A, Weber CJ. Value of intraoperative parathyroid hormone monitoring. Ann Surg Oncol 2008; 15(2):493–498. 420