Tema 4 Carbohidratos
Anuncio

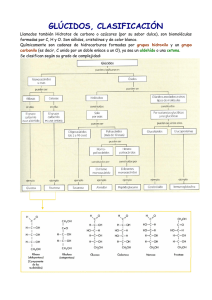
Carbohidratos: Son biopolímeros o biomoléculas que se encuentran distribuidas ampliamente en la naturaleza Existen dos tipos de carbohidratos: simples y complejos, los primeros son compuestos de una o dos moléculas y saben más dulces ya que por su tamaño pueden empezarse a digerir desde la saliva, estos se encuentran en alimentos como azúcar de mesa, mieles, jaleas, chocolate y mermeladas así como en frutas y verduras. (monosacáridos) Los carbohidratos de tipo complejo, son cadenas más largas de moléculas, debido a esto su sabor no es dulce ya que se no se digieren desde la boca, estos se encuentran en alimentos como pan, arroz, papa, elote, camote, pasta, tortillas y todos los derivados de los granos (polisacáridos) Los monosacáridos son sustancias blancas, con sabor dulce, cristalizables y solubles en agua. Se oxidan fácilmente, transformándose en ácidos, por lo que se dice que poseen poder reductor (cuando ellos se oxidan, reducen a otra molécula). LOS MONOSACÁRIDOS Los monosacáridos son moléculas sencillas que responden a la fórmula general (CH2O)n. Están formados por 3, 4, 5, 6 ó 7 átomos de carbono. Químicamente son polialcoholes, es decir, cadenas de carbono con un grupo -OH cada carbono, en los que un carbono forma un grupo aldehído o un grupo cetona. Se clasifican atendiendo al grupo funcional (aldehído o cetona) en aldosas, con grupo aldehído, y cetosas, con grupo cetónico. Cuando aparecen carbonos asimétricos, presentan distintos tipos de isomería. Algunos de ellos pueden presentar su estructura ciclada. Clasificación de los monosacáridos Monosacáridos Aldosas (polihidroxialdehídos) grupo aldehído en el carbono # 1 CHO H OH n CH2OH cetosas (polihidroxicetonas) grupo ceto en carbono # 2 n = 1, 2, 3, 4, etc. n = 1, 2, 3, etc. Número de carbonos quirales Número de carbonos quirales aldosa Número total de carbonos 1 2 3 4 aldotriosa aldotetrosa aldopentosa aldohexosa 1+2=3 2+2=4 3+2=5 4+2=6 O OH H n CH2OH 2 carbonos no quirales n CH2OH 3 carbonos no quirales n cetosa 1 2 3 cetotetrosa cetopentosa cetohexosa Número total de carbonos 1+3=4 2+3=5 3+3=6 Los monosacáridos se nombran atendiendo al número de carbonos que presenta la molécula: Triosas: tres carbonos Tetrosas: cuatro carbonos Pentosas: cinco carbonos Hexosas: seis carbonos Heptosas: siete carbonos Configuraciones D y L en monosacáridos (Enantiómeros) Enantiómeros: imágenes especulares no superponibles L-(-)-Glucosa D-(+)-Glucosa 2R Enantiómeros (Imágenes especulares) 1 CHO H CHO OH HO 3S 1 HO H H OH HO H H OH HO H último OH de carbono quiral a la izquierda 1 CHO 1 CHO HO C 3R CH2OH último OH de carbono quiral a la derecha H H OH H CH2OH 2S 2 2 2 C 2 CH 3 R OH 4 C C 1 HO 1 3 3 4 CH 3 R R S espejo Carbono quiral: cuatro sustituyentes diferentes H OH Los isómeros especulares, llamados también enantiómeros, o enantiomorfos, o isómeros quirales, son moléculas que tienen los grupos -OH de todos los carbonos asimétricos, en posición opuesta, reflejo de la otra molécula isómera. CHO HO H HO H CH2OH L - Eritrosa Configuración de las D-aldosas Aldotriosa CHO H OH CH2OH D-(+)-Gliceraldehído D-(-)-Eritrosa Aldotetrosas D-(-)-treosa CHO H CHO OH H H HO OH H OH CH2OH CHO CH2OH Aldopentosas H OH H OH H OH Aldopentosas CHO CHO H HO H H OH H HO OH H CHO H OH HO OH H H OH H OH H CH2OH D-(+)-Alosa H CHO H OH HO H OH H OH H H OH H OH H H CH2OH CH2OH D-(+)-Altrosa D-(+)-Glucosa HO H H H H OH HO OH H CH2OH D-(+)-Manosa H HO H H OH HO H OH H OH CH2OH OH CH2OH D-(-)-Lixosa CHO CHO CHO OH HO H D-(+)-Xilosa Aldohexosas CHO HO CH2OH D-(-)-Arabinosa D-(-)-Ribosa OH OH CH2OH CH2OH CHO H OH HO H H OH CH2OH CHO CHO H HO HO H OH HO H HO H HO H H OH CH2OH H H OH CH2OH D-(-)-Gulosa D-(-)-Idosa D-(+)-Galactosa D-(+)-Talosa Epímeros Un par de aldosas diasterómeras que solo difieren en configuración al carbono 2 Epímeros: difieren únicamente en la estereoquímica de un solo carbono, los demas carbonos quirales tienen la misma configuración CHO H HO 2R 2S OH H H OH H OH CH2OH D-(+)-Glucosa Diastereómero I Epímeros en el carbono 2 CHO HO H HO H H OH H OH CH2OH D-(+)-Manosa Diastereómero II diasterómeros: son estereoisómeos que no son imágenes especulares Isomería óptica Cuando se hace incidir un plano de luz polarizada sobre una disolución de monosacáridos que poseen carbonos asimétricos el plano de luz se desvía. Si la desviación se produce hacia la derecha se dice que el isómero es dextrógiro y se representa con el signo (+). Si la desviación es hacia la izquierda se dice que el isómero es levógiro y se representa con el signo ( - ). Esta cualidad es independiente de su pertenencia a la serie D o L Las formas isómeras de la glucosa difieren en muchas de sus propiedades, y en particular en su capacidad en desviar el plano de giro de la luz polarizada, dado que tienen distinta configuración en un carbono asimétrico Enantiómeros CHO CHO H OH HO HO H OH H H OH HO H H OH HO H CH2-OH H CH2-OH D - (+) - Glucosa L - (-) - Glucosa Dextrógira Levógira Configuración de las D-cetosas CH2OH O D-(+)-Eritrulosa H cetotetrosa OH CH2OH cetopentosas CH2OH CH2OH D-(+)-Ribulosa O O H OH H OH HO H CH2OH CH2OH O OH HO H OH H OH H OH H OH D-(+)-Psicosa H CH2OH D-(-)-Fructosa CH2OH CH2OH O H CH2OH OH CH2OH CH2OH cetohexosas D-(-)-Xilulosa H O O H HO H OH H OH CH2OH D-(+)-Sorbosa HO HO H H H OH CH2OH D-(-)-Tagatosa Ciclación En disolución, los monosacáridos pequeños se encuentran en forma lineal, mientras que las moléculas más grandes ciclan su estructura. La estructura lineal recibe el nombre de Proyección de Fischer; la estructura ciclada de Proyección de Haworth. En la representación de Haworth la cadena carbonada se cicla situada sobre un plano. Los radicales de la cadena se encuentran por encima o por debajo de ese plano. La estructura ciclada se consigue en aldopentosas y hexosas. El enlace de ciclación se genera entre el carbono que posee el grupo funcional y el carbono asimétrico más alejado del grupo funcional. Cuando el carbono tiene un grupo aldehído, como grupo funcional, el enlace recibe el nombre de hemiacetálico. Cuando el carbono tiene un grupo cetona, como grupo funcional, el enlace recibe el nombre de hemicetálico. Ciclización de una D-aldohexosa a una piranosa (proyecciones de Haworth y de silla) D-(+)-Glucosa en forma de hemiacetal 1 CHO 2 H OH 3 HO H OH = 5 H 6 CH2OH H 5 OH 4 OH C 2 1 O HO 3 OH H 4 6 CH2OH H OH 4 OH C 2 1 O HO 3 OH + 6 OH 5 H+ H CH2OH 6 6 6 CH2OH 4 5 O HO HO 3 2 HO CH2OH 5 O OH 1 = H Conformación de silla los -OH de los carbonos 2, 3, 4 y el carbono 6 estan en posición ecuatorial 4 HO OH 2 3 OH 1 - H+ H OH Proyección de Haworth todos los OH de los carbonos 2, 3, y 4 y el carbono 6 son verticales alfa o beta D-(+)-glucopiranosa 5 4 HO CH2OH O + OH 2 3 OH H OH 1 H CHO H D-Glucosa HO OH H H OH H OH CH2OH -D-glucopiranosa Ciclación de la glucosa (forma piranosa) Ciclación de la fructosa (forma furanosa) Ciclización de una D-cetohexosa a una furanosa (proyecciones de Haworth y de silla). D-(-)-Fructosa en forma de un hemicetal 1 CH OH 2 2 3 HO 4 H 5 H O 1 CH OH 2 6 H = OH HOH2C OH 5 HO H O 4 OH C + 2 HOH2C OH HO 5 4 3 OH 1 CH OH 2 6 2 C O + 3 OH H 6 CH2OH H 5 HO 6 HO O 1 OH H 4 OH 3 H 2 CH2OH H 6 HO-CH2 O 5 OH HO 4 HO Conformación de silla de una D-cetohexosa los OH de los carbonos 3 y 4 estan en posición axial, el carbono 6 no tiene OH 3 2 - H+ HOH2C 6 CH2OH 1 Proyección de Haworth los OH estan en posición vertical alfa o beta D-(-)-Fructofuranosa 5 4 HO 3 + O HO OH 2 CH2OH 1 La molécula ciclada puede adquirir el aspecto de un pentágono o de un hexágono. Los monosacáridos ciclados con aspecto de pentágono reciben el nombre de Furanosas. Los monosacáridos ciclados con aspecto de hexágono reciben el nombre de Piranosas Al no ser plano el anillo de piranosa, puede adoptar dos conformaciones en el espacio. La forma "cis" o de nave (bote) y la "trans" o de silla Mutarrotación: anómeros α y β (Diastereómeros) D-(+)-Glucosa en solución acuosa contiene una mezcla en equilibrio de los anómeros alfa y beta a través de la forma intermedia de cadena abierta CHO Anómero alfa menos estable HOH2C HO HO H HO O H HO OH alfa D-(+)-glucopiranosa (36%) Rotación óptica = +112.0o Anómero beta más estable OH H H OH H OH HOH2C HO HO OH HO CH2OH H O H + beta D-(+)-Glucopiranosa (64%) Rotación óptica = +18.7o CH2OH H OH OH C O HO OH Mezcla en equilibrio (alfa + beta) Rotación óptica = + 52.7o Rotación específica α-glucosa β -glucosa Equilibrio 112,0 18,7 52,7 Ciclización de las proyecciones de Fischer a hemiacetales cíclicos de Fischer O H C OH +H HO O + H C H nuevo carbono quiral HO C OH + OH HO HO OH O OH H H CH2OH CH2OH reacción entre el OH del C-5 y el carbonilo protonado del aldehído D-glucosa HO OH + O H O CH2OH C H OH anómero HO beta H O H C anómero alfa OH OH + hemiacetal cíclico O - H+ HO OH OH CH2OH CH2OH La beta-D-Glucosa y la alfa D-glucosa cíclicas son isómeros llamados Anómeros puesto que son diastereómeros que difieren en la configuración del carbono 1 Derivados de los monosacáridos al reaccionar con fenilhidrazina, por oxidación, reducción y con enzimas NH-NH2 Reactivo en exceso y H+ H C=N-NH-C6H5 Br2 / H2O HNO3 NaBH4 enzimas COOH COOH CH2OH CHO CH2OH COOH CH2OH COOH N-NH-C6H5 CH2OH osazona ácido aldónico ácido aldárico alditol ácido urónico Disacáridos: Son oligosacáridos formados por dos monosacáridos. Son solubles en agua, dulces y cristalizables. Pueden hidrolizarse y ser reductores cuando el carbono anomérico de alguno de sus componentes no está implicado en el enlace entre los dos monosacáridos. La capacidad reductora de los glúcidos se debe a que el grupo aldehído o cetona puede oxidarse dando un ácido. Maltosa.- Es el azúcar de malta. Grano germinado de cebada que se utiliza en la elaboración de la cerveza. Se obtiene por hidrólisis de almidón y glucógeno. Posee dos moléculas de glucosa unidas por enlace tipo alfa (1-4). Isomaltosa.- Se obtiene por hidrólisis de la amilopectina y glucógeno. Se unen dos moléculas de glucosa por enlace tipo alfa (1-6) Celobiosa.- No se encuentra libre en la naturaleza. Se obtiene por hidrólisis de la celulosa. y está formado por dos moléculas de glucosa unidas por enlace beta (1-4). Lactosa.- Es el azúcar de la leche de los mamíferos. Así, por ejemplo, la leche de vaca contiene del 4 al 5% de lactosa. Se encuentra formada por la unión beta (1-4) de la beta -D-galactopiranosa (galactosa) y la alfa-D-glucopiranosa (glucosa) Formación del enlace glucosídico entre una molécula de galactosa y una de glucosa Sacarosa.- Es el azúcar de consumo habitual, se obtiene de la caña de azúcar y remolacha azucarera. Es el único disacárido no reductor, ya que los dos carbonos anoméricos de la glucosa y fructosa están implicados en el enlace Glucosídico (1-alfa,2-beta ) Enlaces glucosidicos en la formación de disacaridos Resumen del tema 4: carbohidratos Estructura y Nomenclatura Isomería Ciclización (mutarrotación) Propiedades químicas: derivados Proyecciones: Fischer, Haworth, silla Disacáridos