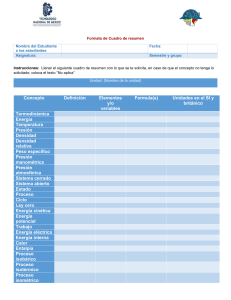
Archivo 6 PRIMERA LEY DE LA TERMODINAMICA.
Anuncio

Primera Ley de la Termodinámica La termodinámica es el estudio de la relación entre energía y trabajo, la energía se ha considerado en forma de calor. Cada vez que conducimos un automóvil, que encendemos un aire acondicionado o cocinamos algún alimento, recibimos sin darnos cuenta los beneficios prácticos de la termodinámica; o sea el estudio de las relaciones en las que intervienen: el calor, el trabajo mecánico y otros aspectos de la energía y de su transferencia. Si tomamos como ejemplo lo que sucede en el motor de un automóvil, se genera calor por la reacción química entre el oxígeno y la gasolina vaporizada en los cilindros del motor. Cuando el gas se calienta, este empuja los pistones de los cilindros, efectuando así un trabajo mecánico que se utiliza para lograr que el vehículo de ponga en movimiento y pueda desplazarse. Este es un muy buen ejemplo de lo que es un proceso termodinámico. La primera ley de la termodinámica, es fundamental para entender tales procesos, es al mismo tiempo una extensión del principio de conservación de la energía. Aquí se amplía entonces este principio para incluir el intercambio de energía tanto por intercambio de calor como por el trabajo mecánico que se efectúa y se introduce un concepto nuevo llamado energía interna. La conservación de la energía desempeña un papel muy importante en todas las áreas de la física y la primera ley tiene una utilidad muy amplia. Tenemos entonces que entender un concepto bien importante y es el de sistema termodinámico y ver el calor y el trabajo como dos formas de introducir o extraer energía de ese sistema. Debemos considerar la relación dl sistema con el entorno, al realizar un trabajo, de manera que cuando se gana o se pierde calor, la energía en el sistema se modifica por el trabajo realizado ya sea sobre el sistema o por si sistema. Cuando un sistema realiza trabajo sobre su entorno (alrededor), genera un gasto de energía, por lo que su contenido de energía disminuye. Cuando en un sistema, el entorno (alrededor) realiza un trabajo, el contenido de energía del sistema aumentará. La Primera Ley de la Termodinámica se relaciona totalmente con una ley de la conservación de la energía: Primera Ley de la Termodinámica: La energía no se crea ni se destruye, solo se transfiere de un cuerpo a otro y se modifica de una forma a otra. La energía del universo es constante. Esta Ley establece que al variar la energía interna en un sistema cerrado, se produce calor y trabajo, es decir, la energía no se pierde sino que se transforma. Esta Ley la pudimos comprobar en el experimento que realizamos en el laboratorio con la fabricación de nuestra máquina de vapor, la energía que le aplicábamos a nuestro sistema se convirtió en trabajo que en este caso lo detectábamos por el movimiento del rehilete. La Primera Ley de la Termodinámica se aplica a todo proceso de la naturaleza que parte de un estado de equilibrio (presión, volumen, temperatura, etc.) y termina en otro. El cambio de energía (AE) en un sistema queda expresado por la cantidad de calor (q) que se transfiere entre el sistema y sus alrededores, y el el trabajo realizado de los alrededores al sistema (W). La siguiente expresión matemática representa la primera Ley de la Termodinámica ∆U=Q-W Q = ∆U+ W AU = Cambio en el contenido de energía cinética Q = Calor transferido al o desde el sistema W = Trabajo transferido al o desde el sistema La energía interna de un sistema químico es la suma de la energía cinética y potencial de los átomos y moléculas que lo forman, La energía potencial se relaciona con las fuerzas de atracción, repulsión, energía almacenada en los enlaces químicos y las fuerzas intermoleculares de los sólidos y líquidos. La energía cinética se relaciona con el movimiento de los átomos y moléculas de un sistema. El valor total de la energía interna de los sistemas es difícil poder calcularlo, la variación de ésta (AH), es una cantidad medible cuando se determina el calor y trabajo transferible. El trabajo se asocia con cambios de volumen a presión constante. W = (P.AV) W = trabajo P = Presión constante AV = Variación del volumen Los valores de q y W son indicativos para predecir si la energía del sistema aumenta o disminuye. La siguiente tabla relaciona a q y W, y la energía interna del sistema Número Q, W AE 1 q, mayor que 0 (+) Aumenta 2 Q, menor que 0 (-) Disminuye 3 W mayor que 0 (+) Aumenta 4 W menor que 0 (-) Disminuye Interpretación: De la tabla anterior ¿Cómo se transfiere el calor? ¿Cómo se realiza el trabajo? Número Cambio 1 Calor transferido del entorno al sistema 2 Calor transferido del sistema al entorno 3 Trabajo realizado sobre el sistema para el entorno 4 Trabajo realizado por el sistema sobre el entorno Funciones de estado El calor y el trabajo en forma individual no son funciones de estado, pero sumados como AU si lo son. La entalpia y energía interna son funciones de estado porque sus valores no dependen de la forma en que se ejecuta un proceso de cambio. Sólo dependen del estado inicial y final del sistema. Existen tres tipos de sistema Sistema adiabático: No hay entrada ni salida de calor por lo tanto el calor es igual a cero: Q=0 W = -n (Cp-R)(AT) n = número de moles R = es la constante universal de los gases y vale 8.3145 J/molºK Cp = capacidad calorífica a presión constante AT = la diferencia de la temperatura Proceso isocórico: Se trabaja a volumen constante, el trabajo efectuado en este sistema es igual a cero: W=0 Proceso Isobárico: Se trabaja a presión constante, el trabajo es: W = nRAT Podemos resumir en la siguiente tabla SISTEMA FUNCION DE ESTADO FORMULA Adiabático No entra ni sale calor W = -n (Cp-R)(AT) Isocorico Volumen constante W=0 isobárico Presión constante W = nRAT Es importante que copien esta tabla y la tengan en la mano para realizar los ejercicios en clase.